天蚕素C蛋白和/或天蚕素C基因的应用以及抗病毒药物的制作方法
本发明属于生物医药技术领域,具体涉及一种天蚕素c蛋白和/或天蚕素c基因的应用以及抗病毒药物。
背景技术:
天蚕素c(cecropinsc)是一种抗菌肽,是对革兰氏阳性菌和革兰氏阴性菌均有活性的约31-37个氨基酸残基的小蛋白,最早从hyalophoracecropia的血淋巴中分离出来。抗菌肽构成了昆虫无细胞免疫的主要部分,而天蚕素既能裂解细菌细胞膜,也抑制脯氨酸摄取并引起渗膜漏。
水疱性口炎病毒(vesicularstomatitisvirus,vsv)在感染脊椎动物细胞后,可以很快引起明显的细胞病变,而感染昆虫细胞(如果蝇细胞)则引起持续性感染,无细胞病变。登革病毒(denguevirus,denv)主要通过埃及伊蚊和白纹伊蚊等媒介昆虫传播,引起登革热以及发病率和死亡率很高的登革出血热和登革休克综合征。据世界卫生组织统计,目前已有100多个国家及地区出现登革病毒感染流行,大约有25亿人生活在受登革病毒感染威胁的区域,每年约有1-3亿人被登革病毒初次感染或重复感染。虽然登革感染可以引起人类烈性疾病,但是蚊子却可以终身携带,对其生命周期没有影响。昆虫缺乏获得性免疫系统,只能依靠天然免疫系统消灭病原微生物,抗菌肽作为天然免疫系统的一部分可能扮演了重要的角色。
另外,越来越多的细菌逐渐产生抗生素耐药性,这已经成了对抗细菌感染的一大挑战,寻找新型抗生素就成为了一个迫在眉睫的问题。抗菌肽由于活性高,抗菌谱广,来源多样,而且由于其通过电荷吸附作用于病原微生物的膜上这一特殊机制,使得靶菌株不容易发生突变,因而在医药工业上认为有广阔的应用前景。昆虫只有天然免疫系统的保护,抗菌肽的作用是其免疫功能的重要部分,因此从昆虫分离得到的抗菌肽可能具有更强的抗病原微生物作用。
抗病毒感染的途径很多,如直接抑制或杀灭病毒、干扰病毒吸附、阻止病毒穿入细胞、抑制病毒生物合成、抑制病毒释放或增强宿主抗病毒能力等。抗病毒药物的作用主要是通过影响病毒复制周期的某个环节而实现的。
技术实现要素:
本发明的目的在于提供一种天蚕素c蛋白和/或天蚕素c基因的应用以及抗病毒药物,旨在解决为现有抗病毒药物提供更多选择的技术问题。
为实现上述发明目的,本发明采用的技术方案如下:
本发明一方面提供一种天蚕素c蛋白和/或天蚕素c基因在制备抗病毒药物中的应用;其中,所述天蚕素c蛋白的氨基酸序列如seqidno.1所示,所述天蚕素c基因的核酸序列如seqidno.2所示。
本发明另一方面提供一种抗病毒药物,所述抗病毒药物含有如seqidno:1所示的氨基酸序列,或所述抗病毒药物含有如seqidno:1所示的氨基酸序列经缺失、插入或替换所获得的具有相同功能的氨基酸序列;和/或
所述抗病毒药物含有如seqidno:2所示的核苷酸序列,或所述抗病毒药物含有如seqidno:2所示的核苷酸经缺失、插入或替换所获得的具有相同功能的核苷酸序列。
本发明提供的天蚕素c蛋白(或天蚕素c基因)是一种来自果蝇的分泌型功能蛋白,在本发明中通过试验验证,其具有显著抑制多种病毒复制的功能。因此,该天蚕素c蛋白和/或天蚕素c基因可以用于制备抗病毒药物,具有广泛的应用前景。
附图说明
图1为本发明实施例1中水泡性口炎病毒复制的结果图;
图2为本发明实施例2中重组质粒pmt-dmcecc-v5-hisa的转染结果图;
图3为本发明实施例2中登革2型病毒复制的结果图。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
一方面,本发明实施例提供了一种天蚕素c蛋白和/或天蚕素c基因在制备抗病毒药物中的应用;其中,所述天蚕素c蛋白的氨基酸序列如seqidno.1所示,所述天蚕素c基因的核酸序列如seqidno.2所示。
本发明提供的天蚕素c蛋白(或天蚕素c基因)是一种来自果蝇的分泌型功能蛋白,在本发明中通过试验验证,其具有显著抑制多种病毒复制的功能。因此,该天蚕素c蛋白和/或天蚕素c基因可以用于制备抗病毒药物,具有广泛的应用前景。
本发明实施例的天蚕素c蛋白、天蚕素c基因的orf(开放阅读框)的具体序列如下:
天蚕素c蛋白序列(seqidno.1):
mnfykifvfvalilaisigqseagwlkklgkrierigqhtrdatiqglgiaqqaanvaatarg;下划线部分为信号肽。
天蚕素c基因序列(seqidno.2):
atgaacttctacaagatcttcgttttcgtcgccctcatcctggccatcagcattggacaatcggaagccggttggctgaagaaacttggcaagagaatcgagcgcattggccagcacacccgggatgcaaccattcaaggactgggaattgcgcaacaggccgccaatgtggcagccaccgccagaggatga;下划线部分为表达信号肽的序列。
进一步地,在本发明实施例中,通过试验验证了,该天蚕素c蛋白和/或天蚕素c基因可以抑制水泡性口炎病毒(vesicularstomatitisvirus,vsv)、登革2型病毒(denguevirustype-2,denv-2)的复制。因此,该天蚕素c蛋白和/或天蚕素c基因用于制备的抗病毒药物可以包括抗水泡性口炎病毒药物、抗登革2型病毒药物中的至少一种。
进一步地,在本发明实施例中,该抗病毒药物可以是蛋白类药物,具体地,该抗病毒药物含有如seqidno:1所示的氨基酸序列,或如seqidno:1所示的氨基酸序列经缺失、插入或替换所获得的具有相同功能的氨基酸序列,如缺失上述信号肽的部分氨基酸序列。或者,该抗病毒药物可以是核酸类药物,具体地,所述抗病毒药物含有如seqidno:2所示的核苷酸序列,或如seqidno:2所示的核苷酸经缺失、插入或替换所获得的具有相同功能的核苷酸序列,如缺失上述表达信号肽的部分核苷酸序列。
进一步地,在本发明实施例中,所述天蚕素c蛋白的制备方法包括:
s01:构建含有seqidno.2所示序列的重组质粒;
s02:将所述重组质粒转入宿主细胞中进行表达,得到所述天蚕素c蛋白。
在本发明实施例中,在验证天蚕素c蛋白的功能时,构建seqidno.2中不存在表达信号肽的部分核苷酸序列的重组质粒就可以实现功能验证,具体步骤包括:
合成单链dna分子甲(seqidno.12)和单链dna分子乙(seqidno.13),两条单链混合退火后得到双链dna分子即含有seqidno.2中非信号肽部分的核苷酸序列;然后将该双链dna分子与骨架质粒载体连接,得到所述重组质粒。
另一方面,本发明实施例还提供一种抗病毒药物,所述抗病毒药物含有如seqidno:1所示的氨基酸序列,或所述抗病毒药物含有如seqidno:1所示的氨基酸序列经缺失、插入或替换所获得的具有相同功能的氨基酸序列;和/或
所述抗病毒药物含有如seqidno:2所示的核苷酸序列,或所述抗病毒药物含有如seqidno:2所示的核苷酸经缺失、插入或替换所获得的具有相同功能的核苷酸序列。
优选地,所述抗病毒药物包括抗水泡性口炎病毒药物、抗登革2型病毒药物中的至少一种。具体地,在本发明实施例中,该抗病毒药物还包括与药学上可接受的载体和/或辅料,具体包括稀释剂、粘合剂、吸收剂、崩解剂、分散剂、湿润剂、助溶剂、缓冲剂、表面活化剂。优选地,该抗病毒药物还可包括现有已知的抗病毒药物,即用天蚕素c蛋白和/或天蚕素c基因的序列与现有已知的抗病毒药物联合使用。更优选地,该抗病毒药物可以为注射剂,此情况下,剂型发挥最好药效功能。
本发明先后进行过多次试验,现举一部分试验结果作为参考对发明进行进一步详细描述,下面结合具体实施例进行详细说明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例中所使用的水泡性口炎病毒为indianaserotype,sanjuan,mudd-summersstrains;参考文献:pattnaikak,hwangl,lit,englundn,mathurm,dast,banerjeeak.phosphorylationwithintheamino-terminalacidicdomainiofthephosphoproteinofvesicularstomatitisvirusisrequiredfortranscriptionbutnotforreplication[j].jvirol.1997,71(11):8167-8175。
实施例中所用的登革2型病毒均为登革2型病毒newguineac株;参考文献:chaoyc,huangcs,leecn,etal.higherinfectionofdenguevirusserotype2inhumanmonocytesofpatientswithg6pddeficiency[j].plosone,2008,3(2):e1557。
实施例中所用的质粒pmt/bip/v5-hisa来自invitrogen公司,产品目录号v4130-20;s2细胞(即为果蝇s2细胞)来自invitation公司,产品目录号r690-07。vero细胞(即非洲绿猴肾细胞):
实施例中所述的dmcecc基因或dmcecc蛋白,dmcecc即指drosophilamelanogastercecropinc,即分别代表黑腹果蝇天蚕素c基因或黑腹果蝇天蚕素c蛋白。
术语moi(multiplicityofinfection)即感染复数;moi是一个比值,没有单位。moi被普遍用于病毒感染细胞的研究中,含义是感染时病毒与细胞数量的比值。
实施例1抑制dmcecc基因表达的dsrna促进水泡性口炎病毒复制验证
一、制备dsrna
1、设计用于制备抑制dmcecc基因表达的dsrna的编码dna的引物如下:
dmcecc-f(seqidno.3):
5’-
dmcecc-r(seqidno.4):
5’-
上述引物中,方框标注的区域为t7启动子序列。
2、提取s2细胞的总rna并反转录为cdna,以cdna为模板,用dmcecc-f和dmcecc-r组成的引物对进行pcr扩增,得到pcr扩增产物。
3、取步骤2得到的pcr扩增产物,采用ambionmegascriptt7highyieldtranscriptionkit(产品目录号为am1334)并按试剂盒说明书进行体外转录,由于dmcecc-f和dmcecc-r都具有t7启动子,体外转录形成两条反向互补的单链rna分子,该两条反向互补的单链rna分子自发形成双链rna分子(dsrna-1)。
4、设计用于制备抑制gfp基因表达的dsrna的编码dna的引物如下:
gfp-f(seqidno.5):
5’-
gfp-r(seqidno.6):
5’-
上述引物中,方框标注的区域为t7启动子序列。
5、合成gfp基因序列(seqidno.7)的双链dna分子,以合成的双链dna分子为模板,用gfp-f和gfp-r组成的引物对进行pcr扩增,得到pcr扩增产物。
gfp基因序列(seqidno.7):
atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggacggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctacggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttcttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctggtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgccgaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccactacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaagctc。
6、取步骤5得到的pcr扩增产物,采用ambionmegascriptt7highyieldtranscriptionkit(产品目录号为am1334)并按试剂盒说明书进行体外转录,由于gfp-f和gfp-r都具有t7启动子,体外转录形成两条反向互补的单链rna分子,该两条反向互补的单链rna分子自发形成双链rna分子(dsrna-2)。
二、抑制dmcecc基因表达的物质即dsrna-1在促进水泡性口炎病毒复制中的验证
1、将s2细胞分成实验组和对照组两组,借助转染试剂(effectenetransfectionreagent,购自qiagen,产品目录号为301425)并按说明书进行操作,将dsrna(实验组:dsrna-1,对照组:dsrna-2)转入s2细胞,转染72h后,感染水泡性口炎病毒,感染复数为0.001。
2、完成步骤1的感染24天后,提取s2细胞的总rna并反转录为cdna,利用sybr-green方法检测s2细胞内的水泡性口炎病毒量(采用dmactin基因为内参)。
用于检测水泡性口炎病毒的引物对如下:
上游引物(seqidno.8):5’-aatgacgatgagactatgcaatc-3’;
下游引物(seqidno.9):5’-cacaagtcactcgtgaccatct-3’。
用于检测dmactin基因的引物对如下:
上游引物(seqidno.10):5’-cccaaggccaaccgtgagaa-3’;
下游引物(seqidno.11):5’-cggaggcgtacagcgagagc-3’。
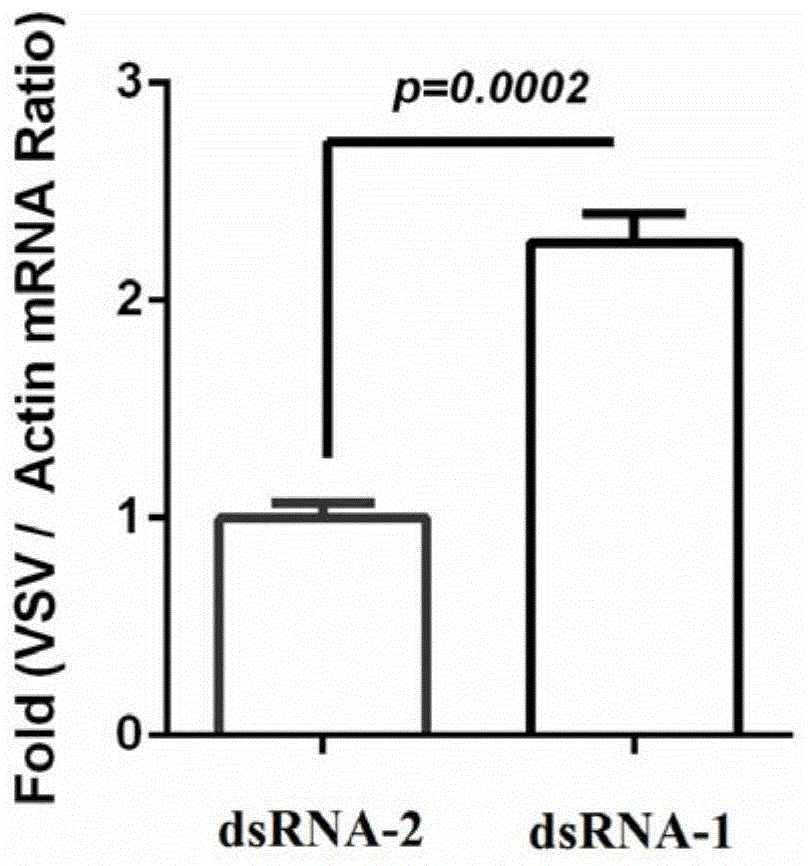
s2细胞内的水泡性口炎病毒量见图1。
结果表明,导入用于抑制dmcecc基因表达的dsrna-1后,s2细胞内的水泡性口炎病毒量出现明显上升,即抑制dmcecc基因表达可以促进水泡性口炎病毒在s2细胞内的复制,因此,dmcecc基因可以抑制水泡性口炎病毒在s2细胞内的复制。
实施例2dmcecc蛋白在抑制登革病毒复制中的验证
一、重组质粒pmt-dmcecc-v5-hisa的构建
1、分别合成单链dna分子甲和单链dna分子乙,退火后得到双链dna分子(单链dna分子甲和单链dna分子乙中,下划线标注限制性内切酶的识别序列中的部分,得到的双链dna分子中,上游具有限制性内切酶ecori的粘性末端,下游具有限制性内切酶xbai的粘性末端)。
单链dna分子甲(seqidno.12):
5’-aattctggttggctgaagaaacttggcaagagaatcgagcgcattggccagcacacccgggatgcaaccattcaaggactgggaattgcgcaacaggccgccaatgtggcagccaccgccagaggat-3’;
单链dna分子乙(seqidno.13):
5’-ctagatcctctggcggtggctgccacattggcggcctgttgcgcaattcccagtccttgaatggttgcatcccgggtgtgctggccaatgcgctcgattctcttgccaagtttcttcagccaaccg-3’;
2、用限制性内切酶ecori和xbai双酶切质粒pmt/bip/v5-hisa,回收约5000bp的载体骨架。
3、将步骤1得到的双链dna分子和步骤2得到的载体骨架连接,得到重组质粒pmt-dmcecc-v5-hisa。
4、借助转染试剂(effectenetransfectionreagent,购自qiagen,产品目录号为301425)并按说明书进行操作,将重组质粒pmt-dmcecc-v5-hisa转入s2细胞,转染24h后用500mm浓度的cu2+(以cuso4的形式加入)诱导48h(即28℃静置培养),收集上清液并采用anti-v5鼠单克隆抗体(anti-v5-tagmab,购自mbl公司,产品目录号为m167-3)作为一抗进行westernblot,图谱见图2,可以观察到检测到特异的阳性条带。
二、dmcecc蛋白在抑制登革病毒复制中的验证
1、实验组的处理
(1)借助转染试剂(effectenetransfectionreagent,购自qiagen,产品目录号为301425)并按说明书进行操作,将重组质粒pmt-dmcecc-v5-hisa转入s2细胞,转染24h后用500mm浓度的cu2+(以cuso4的形式加入)诱导48h(即28℃静置培养),收集上清液。
(2)在步骤(1)得到的上清液中加入登革2型病毒的病毒液,使登革2型病毒的浓度为104pfu/ml,28℃静置孵育2h。
(3)将2×106个细胞/ml的vero细胞的细胞液铺6孔板,每孔2ml。
(4)将步骤(2)得到的溶液加入步骤(3)得到的6孔板,每孔1ml,37℃静置培养3h,然后更换dmem完全培养基(购自lifetechnology,产品目录号为11965-084)培养24h。
(5)完成步骤(4)后,吸弃上清,用ph7.4的pbs缓冲液清洗细胞一次,然后采用rna抽提试剂盒(axyprep总rna小量制备试剂盒,购自axygen,产品目录号为ap-mn-ms-rna-250)提取总rna,然后采用逆转录试剂盒(iscriptcdnasynthesiskit,购自bio-rad,产品目录号为170-8890)进行逆转录得到cdna,以cdna为模板,利用taqmanrt-qpcr检测vero细胞中登革2型病毒的病毒量(采用gadph基因为内参)。
用于检测登革2型病毒的引物对如下:
上游引物(seqidno.14):5’-cattccaagtgagaatctctttgtca-3’;
下游引物(seqidno.15):5’-cagatctctgatgaataaccaacg-3’。
用于检测登革2型病毒的探针(seqidno.16)如下:
5’-fam-atgctgaaacgcgagagaaaccgc-trama-3’。
用于检测gadph基因的引物对如下:
上游引物(seqidno.17):5’-gaaggtgaaggtcggagt-3’;
下游引物(seqidno.18):5’-gaagatggtgatgggatttc-3’。
用于检测gadph基因的探针如下(seqidno.19):
5’-fam-ccgactcttgcccttcgaac-trama-3’。
2、对照组的处理
用质粒pmt/bip/v5-hisa代替重组质粒pmt-dmcecc-v5-hisa,其它同步骤1。
3、结果分析
实验组(重组pmt-dmcecc-v5-hisa)和对照组(pmt/bip/v5-hisa)中,vero细胞中登革2型病毒的病毒量见图3(进行三次重复实验,每次重复实验中设置5个重复处理,结果取平均值)。结果表明,加入dmcecc蛋白后,vero细胞内的登革2型病毒的病毒量出现明显下降,即dmcecc蛋白可以抑制登革2型病毒在vero细胞中的复制。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>深圳市疾病预防控制中心
<120>天蚕素c蛋白和/或天蚕素c基因的应用以及抗病毒药物
<160>19
<170>siposequencelisting1.0
<210>1
<211>63
<212>prt
<213>drosophilamelanogaster
<400>1
metasnphetyrlysilephevalphevalalaleuileleualaile
151015
serileglyglnserglualaglytrpleulyslysleuglylysarg
202530
ilegluargileglyglnhisthrargaspalathrileglnglyleu
354045
glyilealaglnglnalaalaasnvalalaalathralaarggly
505560
<210>2
<211>192
<212>dna
<213>drosophilamelanogaster
<400>2
atgaacttctacaagatcttcgttttcgtcgccctcatcctggccatcagcattggacaa60
tcggaagccggttggctgaagaaacttggcaagagaatcgagcgcattggccagcacacc120
cgggatgcaaccattcaaggactgggaattgcgcaacaggccgccaatgtggcagccacc180
gccagaggatga192
<210>3
<211>42
<212>dna
<213>人工序列(artificialsequence)
<400>3
taatacgactcactatagggatcagtcgctcagtttccacag42
<210>4
<211>42
<212>dna
<213>人工序列(artificialsequence)
<400>4
taatacgactcactataggggcgttatcctggtagagtcctt42
<210>5
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>5
taatacgactcactataggggtgagcaagggcgaggag38
<210>6
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>6
taatacgactcactatagggcatgatatagacgttgtggctgtt44
<210>7
<211>720
<212>dna
<213>人工序列(artificialsequence)
<400>7
atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggac60
ggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctac120
ggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccacc180
ctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaag240
cagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttc300
ttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctg360
gtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcac420
aagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaac480
ggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgcc540
gaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccac600
tacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtc660
ctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaagctc720
<210>8
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>8
aatgacgatgagactatgcaatc23
<210>9
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>9
cacaagtcactcgtgaccatct22
<210>10
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>10
cccaaggccaaccgtgagaa20
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
cggaggcgtacagcgagagc20
<210>12
<211>127
<212>dna
<213>人工序列(artificialsequence)
<400>12
aattctggttggctgaagaaacttggcaagagaatcgagcgcattggccagcacacccgg60
gatgcaaccattcaaggactgggaattgcgcaacaggccgccaatgtggcagccaccgcc120
agaggat127
<210>13
<211>126
<212>dna
<213>人工序列(artificialsequence)
<400>13
ctagatcctctggcggtggctgccacattggcggcctgttgcgcaattcccagtccttga60
atggttgcatcccgggtgtgctggccaatgcgctcgattctcttgccaagtttcttcagc120
caaccg126
<210>14
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>14
cattccaagtgagaatctctttgtca26
<210>15
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>15
cagatctctgatgaataaccaacg24
<210>16
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>16
atgctgaaacgcgagagaaaccgc24
<210>17
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>17
gaaggtgaaggtcggagt18
<210>18
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>18
gaagatggtgatgggatttc20
<210>19
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>19
ccgactcttgcccttcgaac20
- 还没有人留言评论。精彩留言会获得点赞!