一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法与流程
本发明属于材料技术领域,具体涉及一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法。
背景技术:
海藻酸钠是天然多糖,天然多糖具有较好的生物相容性和生物降解性,同时价廉易得,利用磷钙纳米材料与高分子进行复合,制备新型磷酸钙复合材料,在物理,化学和生物学性质上具有优良的表现,可以有效的负载细胞,药物等,并可以控制药物的释放。海藻酸钠分子中含有-coo-基团,当向海藻酸钠的水溶液中添加二价阳离子时,g单元中的na+会与这些二价阳离子发生交换,使海藻酸钠溶液向凝胶转变。当海藻酸钠水凝胶作为药物的释放载体时常选用ca2+作为交联剂[化学进展,2013,25,1012]。制备海藻酸钠微球,可以选用磷钙材料为支架模板,将海藻酸盐固定在磷钙材料微球的多孔结构中[rscadvances,2016,24,20447]。双相磷酸钙是由羟基磷灰石和β-磷酸三钙组成,是一种无毒、有较高比表面积的磷钙材料,降解性能可以通过羟基磷灰石和β-磷酸三钙的比例进行调控,此外,双相磷酸钙生物相容性好、生物活性较高以及化学性质稳定,常用于制备新型磷钙类生物材料。为了使复合体系具有较好的抗菌性能,需要引入抗菌纳米颗粒。硝酸银作为较好的抗微生物性能被研究和使用,多种纳米结构的含银磷酸钙复合材料已经被制备出来,通过一些方法合成了银掺杂磷酸钙微球,通过细菌共培养实验结果表明该材料具备抗原核细胞的效果[陈峰.纳米结构磷酸钙的可控制备及药物缓释应用研究[d].上海交通大学,2014]。但是仍在毒性较大等问题,并限制其应用。
本发明针对以上问题,制备了一种以双相磷灰石为核芯的藻酸银水凝胶微球,本发明实验方法简单易行,原料方便易得。而且双相磷酸钙和海藻酸钠均具有良好的生物相容性和可降解性,二者交联不仅可以制备出用于药物控释的微球,而且该药物载体具有较好的吸附作用,此外银离子的加入使得该药物载体具有抗菌效力。
技术实现要素:
本发明的目的在于提供一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法。
基于上述目的,本发明采取如下技术方案:
一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法,包括以下步骤:
(1)将双相磷酸钙粉末溶于藻酸钠溶液中,高速搅拌5~10分钟后离心去除上清液,洗涤沉淀;
(2)在所得沉淀物中加入硝酸银溶液,高速搅拌1~5分钟,将所得混合液离心收集沉淀,洗涤沉淀,获得以双相磷灰石为核芯的藻酸银水凝胶微球,可保存在纯水中。
步骤(1)中,所述海藻酸钠溶液的质量浓度为(1~3%),双相磷酸钙与海藻酸钠溶液的用量比例:1g:(60~120)ml。
步骤(2)中,硝酸银的摩尔浓度为(0.005m~1m),硝酸银溶液和海藻酸钠溶液的用量体积比:3:(1~3)。
步骤(1)和(2)中所述的高速搅拌的转速为8000~20000rpm,离心转速为3000~5000rpm。
本发明采用模板法制备多功能微球,以双相磷酸钙和海藻酸钠为微球模板,将银纳米颗粒原位装载在微球内,制备出的复合微球可以用于药物装载和释放等生物医用领域。与现有技术相比,本发明的技术优势在于:
(1)可以获得稳定的装载银纳米颗粒复合微球,可以储存在水溶液中;
(2)采用本方法制备的装载银纳米颗粒复合微球具有良好的细胞相容性,可降解性,无毒副作用;
(3)采用本方法制备的装载银纳米颗粒复合微球具有良好的吸附作用,可有效的提高载药率;
(4)复合微球中的银纳米颗粒是通过原位方式获得,在复合微球内部分布更加均匀,抗菌效果明显。
(5)本发明制备方法未见文献报道,制备过程可操作性强,有利于本发明在生物医用领域的推广。
附图说明
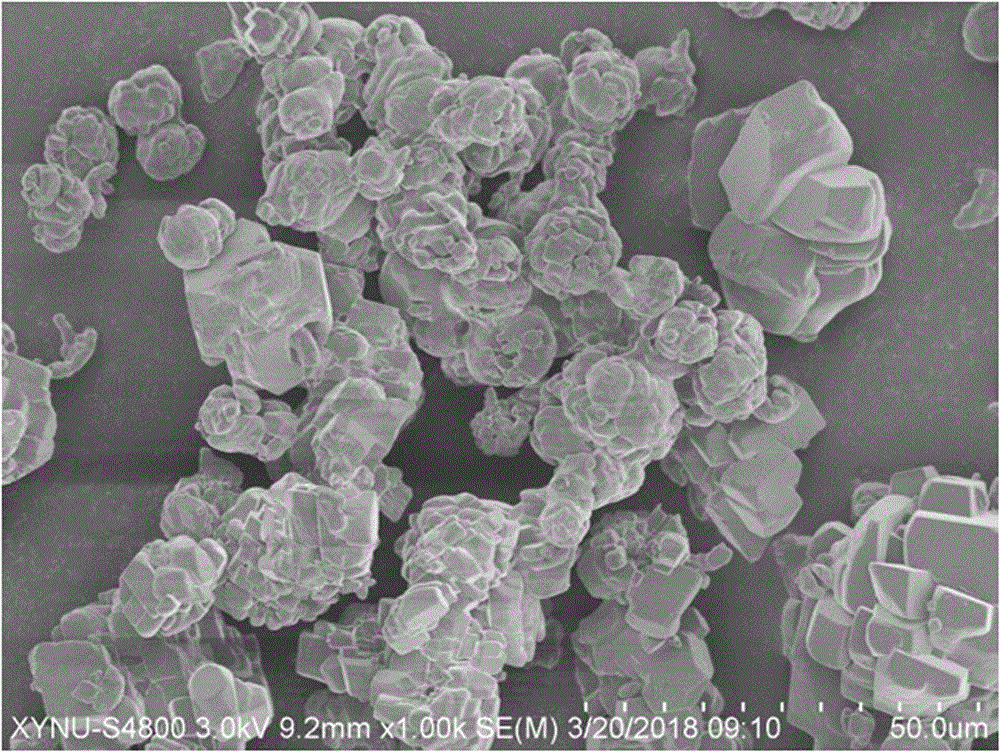
图1为实施例1制得的藻酸银水凝胶微球扫描电镜sem图;
图2为实施例1制得的藻酸银水凝胶微球透射电镜照片tem图;
图3为实施例1制得的藻酸银水凝胶微球装载阿霉素(dox)的释放曲线;
图4为实施例1制得的藻酸银水凝胶微球与293t细胞培养不同时间的光学显微镜照片;
图5为实施例1到实施例5制得的藻酸银水凝胶微球与293t细胞培养2天后的细胞活性测试(cck-8);
图6为实施例1到实施例3制得的装载纳米银复合微球与革兰氏阳性细菌(gram-positives.aureusatcc6538)培养12小时后的抗菌圈照片。
具体实施方式
下面结合具体实施例对本发明做进一步描述。实施例中所用到原料,除双相磷灰石是我们实验室制得,其他原料均可在市场购得。
本发明中所述室温是指25~30℃。
本发明中,海藻酸钠的分子量为198.11,硝酸银的分子量为169.87,计算时,取小数点后两位,四舍五入。
实施例1
一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法,包括以下步骤:
(1)将海藻酸钠在室温下溶解于超纯水中,制得质量浓度为1%的海藻酸钠溶液备用。将硝酸银在避光情况下配制成摩尔浓度为0.005m的硝酸银溶液备用;将0.15g双相磷酸钙粉末置于50ml离心管中,加入12ml的海藻酸钠溶液,在室温下8000rpm高速搅拌10分钟,然后在室温下3000rpm离心3min,用超纯水洗涤3次。
(2)向步骤(1)所得的沉淀中加入硝酸银溶液,硝酸银溶液和海藻酸钠溶液的用量体积比3:1。混合溶液在室温8000rpm下高速搅拌5分钟,然后3000rpm离心3min,超纯水洗涤3次。沉淀即为目标产物。
实施例2
一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法,包括以下步骤:
(1)将海藻酸钠在室温下溶解于超纯水中,制得质量浓度为1.5%的海藻酸钠溶液备用。将硝酸银在避光情况下配制成摩尔浓度为0.01m的硝酸银溶液备用;将0.15g双相磷酸钙粉末置于50ml离心管中,加入12ml的海藻酸钠溶液,在室温下15000rpm高速搅拌8分钟,然后在室温下3500rpm离心5min,用超纯水洗涤3次。
(2)向步骤(1)所得的沉淀中加入硝酸银溶液,硝酸银溶液和海藻酸钠溶液的用量体积比3:2,混合溶液在室温下15000rpm高速搅拌3分钟,然后3500rpm离心5min,超纯水洗涤3次。沉淀即为目标产物。
实施例3
一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法,包括以下步骤:
(1)将海藻酸钠在室温下溶解于超纯水中,制得质量浓度为1.5%的海藻酸钠溶液备用。将硝酸银在避光情况下配制成摩尔浓度为0.05m的硝酸银溶液备用;将0.20g双相磷酸钙粉末置于50ml离心管中,加入12ml的海藻酸钠溶液,在室温下10000rpm高速搅拌8分钟,然后在室温下5000rpm离心5min,用超纯水洗涤3次;
(2)向步骤(1)所得的沉淀中加入硝酸银溶液,硝酸银溶液和海藻酸钠溶液的用量体积比3:1,混合溶液在室温下20000rpm高速搅拌3分钟,然后5000rpm离心5min,超纯水洗涤3次。沉淀即为目标产物。
实施例4
一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法,包括以下步骤:
(1)将海藻酸钠在室温下溶解于超纯水中,制得质量浓度为1.5%的海藻酸钠溶液备用。将硝酸银在避光情况下配制成摩尔浓度为0.1m的硝酸银溶液备;将0.15g双相磷酸钙粉末置于50ml离心管中,加入12ml的海藻酸钠溶液,在室温下10000rpm高速搅拌8分钟,然后在室温下5000rpm离心5min,用超纯水洗涤3次;
(2)向步骤(1)所得的沉淀中加入硝酸银溶液,硝酸银溶液和海藻酸钠溶液的用量体积比:3:1,混合溶液在室温下10000rpm高速搅拌3分钟,然后5000rpm离心5min,超纯水洗涤3次。沉淀即为目标产物。
实施例5
一种以双相磷灰石为核芯的藻酸银水凝胶微球的制备方法,包括以下步骤:
(1)将海藻酸钠在室温下溶解于超纯水中,制得质量浓度为1.5%的海藻酸钠溶液备用。将硝酸银在避光情况下配制成摩尔浓度为0.01m的硝酸银溶液备用。将0.12g双相磷酸钙粉末置于50ml离心管中,加入14.4ml的海藻酸钠溶液,在室温下20000rpm高速搅拌8分钟,然后在室温下5000rpm离心5min,用超纯水洗涤3次;
(2)向步骤(1)所得的沉淀中加入硝酸银溶液,硝酸银溶液和海藻酸钠溶液的用量体积比:1:1,混合溶液在室温下20000rpm高速搅拌3分钟,然后5000rpm离心5min,超纯水洗涤3次。沉淀即为目标产物。
性能测试
为表明本发明效果,以实施例1为例,分别对其制得的微球进行扫描电镜和透射电镜观察,载药试验和细胞相容试验,结果如图1-4所示,其中,图1为实施例1制得的微球扫描电镜(sem)照片;图2为实施例1制得的微球透射电镜(tem)照片;图3为实施例1制得的微球装载阿霉素(dox)的释放曲线;图4为实施例1制得的微球与293t细胞培养的光学显微镜照片;图5为实施例1到实施例5制得的藻酸银水凝胶微球与293t细胞培养2天后的细胞活性测试(cck-8);图6为实施例1到实施例3制得的装载纳米银复合微球与革兰氏阳性细菌(gram-positives.aureusatcc6538)培养12小时后的抗菌圈照片。从试验得到的结果可知,针对所有制备的微球均得到了一致的结论。
从图1可以看出实施例1制得的藻酸银水凝胶微球在15~30微米之间,大部分呈球状,少数球在制备样品过程中团聚在一起。通过透射电镜照片tem图观察实施例1制得的藻酸银水凝胶微球,可以看出纳米双相磷灰石分散在海藻酸网络中,并形成球形。图3可知,采用本发明实施例1制得的微球装载阿霉素(dox)的释放曲线,可以看到dox总释放量随着时间的增加而增加。将实施例1制得的微球与293t细胞培养60h的光学显微镜照片,如图4所示,可以看到293t细胞在60h和120h都呈现了良好的细胞形态,在120h的细胞数量要比60h的细胞数量多。将实施例1到实施例5制得的藻酸银水凝胶微球与293t细胞培养2天后的细胞活性测试(cck-8),结果如图5所示,相对于对照组,细胞活性有所降低,但实施例1得到的复合微球的细胞活性最好。图6为实施例1到实施例3制得的装载纳米银复合微球与革兰氏阳性细菌(gram-positives.aureusatcc6538)培养12小时后的抗菌圈照片,从图中可以看出,实施例3的抗菌圈最大,抗菌效果最好,但是所有样品均具有抗菌性能。
- 还没有人留言评论。精彩留言会获得点赞!