C3G在制备抗类风湿性关节炎药物中的应用的制作方法
本发明涉及抗类风湿性关节炎药物领域,具体涉及矢车菊素-3-o-葡萄糖苷(cyanidin-3-o-glucosidechloride,c3g)在制备抗类风湿性关节炎药物中的应用。
背景技术:
类风湿性关节炎(rheumatoidarthritis,ra)是一种常见自身免疫性疾病,其病理特征主要表现为关节滑膜炎症、炎性细胞浸润、滑膜成纤维状细胞(rasynovialfibroblast-likecell,rasf)异常增殖、血管翳形成以及关节软骨和骨组织损伤等。由于目前对ra病理机制尚不完全清楚,所以治疗该病的药物有限,主要是通过非甾体抗炎药物如阿司匹林和吲哚美辛、抗风湿药物(disease-modifyinganti-rheumaticdrug,dmard)如甲氨蝶呤(methotrexate,mtx)和生物制剂如英夫利昔单(infliximab)和利妥昔单抗(rituximab)来抑制该病炎症和自我免疫。
cd38是细胞膜上的一种糖蛋白,发挥环腺苷二磷酸核糖水解酶(cyclicadpribosehydrolase,cadprh)(简称为环状adp核糖水解酶)作用,可通过把烟酰胺腺嘌呤二核苷酸(nicotinamideadeninedinucleotide,辅酶ⅰ,nad+)催化成环腺苷二磷酸核糖(cyclicadpribose,cadpr)来调节钙离子(ca2+)内平衡。本申请前期通过转录组学发现cd38在ra滑膜组织中与骨关节炎滑膜和强直性脊柱炎滑膜相比特异性高表达,还首先发现cd38(+)cd56(+)细胞在ra外周血中比例显著提高。有人利用cd38敲除小鼠制备牛ⅱ型胶原诱导性关节炎(collagen-inducedarthritic,cia)模型,发现cd38敲除后可以明显缓解cia的发生和发展。cd56是nk细胞重要的标志物。研究表明,nk细胞既可以通过调节骨代谢,介导骨侵蚀,又可以通过影响分泌tnf-α、ifn-γ等细胞因子调节b、t细胞、巨噬细胞等免疫细胞和成纤维细胞功能参与ra的进程。这些结果建议cd38及cd38(+)nk细胞对ra的重要作用和成为治疗靶点的可能性。
矢车菊素-3-o-葡萄糖苷通常为氯化矢车菊素-3-o-葡萄糖苷(kuromaninchloride,cyanidin-3-o-glucosidechloride,1-benzopyrylium,5,7–dihydroxy-2-(3,4-dihydroxyphenyl)-3-(β--d-glucopyranosyloxy)-chloride),简称c3g,其分子式为c21h21clo11,结构母核为2-苯基苯并吡喃阳离子,属于类黄酮化合物。据报道,c3g具有抗肿瘤、抗炎和抗氧化药物作用。研究发现,c3g也是cd38的抑制剂,可通过与cd38活性部位结合,竞争性抑制cd38的功能。
sirt6属于sirtuin蛋白家族成员,可以通过抗氧化作用降低骨侵蚀缓解cia小鼠的炎症反应。有研究报道,sirt6可以治疗cia,并且c3g可以促进sirt6活化。
c3g对ra是否具有治疗作用尚不明确,专利cn101250206a中公开了一种从黑豆皮中提取富含矢车菊素-3-o-葡萄糖苷有效部位的方法,经实验证明,该有效部位具有良好的抗佐剂性类风湿性关节炎的作用。该专利中提供的是一种混合物形式,且佐剂性类风湿关节炎与人类类风湿关节炎具有一定的差距,并不能很好的证明矢车菊素-3-o-葡萄糖苷对ra具有治疗效果。
现有技术中针对c3g能否治疗ra尚不明确,提供c3g治疗ra的机制、为c3g成为潜在的ra治疗药物提供依据,对于ra的治疗具有重要的意义。
技术实现要素:
针对上述现有技术中的缺陷,本申请以牛ⅱ型胶原诱导性关节炎(cia)大鼠、体外培养的ra滑膜成纤维细胞(rasf)、ra滑液和健康人外周血来源的单个核细胞(mnc)为模型,探索c3g对ra潜在的治疗作用及作用机制。c3g注射后大鼠cia明显缓解、外周血和关节滑液中炎性因子il-6和ifn-r浓度降低、抑炎因子il-10水平升高,启示c3g对ra和cia有治疗作用。本申请进一步研究c3g对mnc的影响,用c3g培养mnc后,mnc中cd38(+)nk细胞比例降低、treg细胞及il-10(+)treg细胞比例升高,而且cd38(+)nk细胞的比例与il-10(+)treg细胞的比例呈负相关。证明c3g对人类类风湿性关节炎切实具有治疗效果。进一步,本申请通过分子药理学实验对c3g抑制cd38细胞、提升treg细胞及il-10(+)treg细胞比例的机制做了进一步研究,为c3g成为类风湿性关节炎药物提供了依据。
为了实现上述技术目的,本申请提供以下技术方案:
本申请第一方面,提供矢车菊素-3-o-葡萄糖苷(c3g)在制备抗类风湿性关节炎药物中的应用。
现有技术启示矢车菊素-3-o-葡萄糖苷(c3g)对于佐剂性类风湿关节炎具有一定的治疗效果。本领域公知,类风湿关节炎的发病机制并不明确,佐剂性类风湿关节炎是采用弗氏试剂制作的一种动物模型,其症状与人类类风湿性关节炎相似,但仍然具有一定的差距。本申请采用牛ii型胶原与完全弗氏佐剂共同进行免疫刺激制备cia大鼠模型,同时还通过体外培养的ra滑膜成纤维细胞(rasf)、ra滑液和健康人外周血来源的单个核细胞(mnc)为模型确认了c3g对ra的治疗作用。
优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)作为一种cd38抑制剂,应用于制备抗类风湿性关节炎药物。
estherkellenberger等的研究表明c3g能够抑制cd38,具有抗炎作用。但是类风湿关节炎是一种免疫系统疾病,与一般意义的炎症不同。本申请通过流式细胞术分析了mnc中各细胞亚型在总淋巴细胞中所占的比例,证实了c3g能够通过抑制cd38治疗类风湿性关节炎。
优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)作为一种treg细胞及il-10(+)treg细胞激动剂,应用于制备抗类风湿性关节炎药物。
进一步优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)同时作为cd38抑制剂和treg细胞及il-10(+)treg细胞激动剂,应用于制备抗类风湿性关节炎药物。
本申请研究表明,c3g注射后cia大鼠外周血和滑液中treg细胞比例升高、cd38(+)nk细胞比例下降,而且c3g治疗后的cd38(+)nk细胞比例/c3g治疗前cd38(+)nk细胞比例的比值与treg细胞比例呈负相关。用c3g培养mnc后,mnc中cd38(+)nk细胞比例降低、treg细胞及il-10(+)treg细胞比例升高,而且cd38(+)nk细胞的比例与il-10(+)treg细胞的比例呈负相关。
优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)作为一种sirt6激动剂,应用于制备抗类风湿性关节炎药物。
本研究将去除cd38(+)nk的mnc与anti-sirt6sirna转染后的cd38(+)nk细胞共培养,发现无论c3g处理cd38(+)nk细胞与否mnc中treg及il-10(+)treg细胞比例无明显变化;当mnc与anti-sirt6sirna和c3g合并处理的cd38(+)nk细胞共培养后,mnc中treg细胞及il-10(+)treg细胞比例比与只用c3g处理的cd38(+)nk细胞共培养的对照组相比明显下降。表明c3g通过活化cd38细胞来调节treg细胞及il-10(+)treg细胞比例。
优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)作为一种nkg2d抑制剂,应用于制备抗类风湿性关节炎药物。
进一步优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)同时作为sirt6激动剂和nkg2d抑制剂,应用于制备抗类风湿性关节炎药物。
c3g处理提升cd38(+)nk细胞中sirt6表达同时也降低nk活化受体nkg2d的表达;用anti-sirt6sirna和c3g合并处理cd38(+)nk细胞时nkg2d表达水平与只用sirna处理的对照组相比无明显差异。这些结果提示,c3g通过提升cd38(+)nk细胞中sirt6表达继而抑制nkg2d的表达来刺激mnc分化更多的il-10(+)treg细胞。
优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)作为一种tnf-α激动剂和ifn-r抑制剂,应用于制备抗类风湿性关节炎药物。
进一步优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)同时作为sirt6激动剂和tnf-α激动剂和ifn-r抑制剂,应用于制备抗类风湿性关节炎药物。
本研究还发现cg3处理后cd38(+)nk培养液中tnf-α的浓度升高,ifn-γ的浓度降低。mnc与c3g合并tnf-α处理的cd38(+)nk细胞共培养后il-10(+)treg细胞的比例明显上升,与c3g和ifn-γ合并处理的cd38(+)nk细胞共培养后il-10(+)treg细胞的比例降低;mnc与c3g和anti-tnf-α抗体合并处理的cd38(+)nk细胞共培养后il-10(+)treg细胞比例显著下降,与c3g和anti-ifn-γ抗体合并处理后的cd38(+)nk细胞共培养后il-10(+)treg细胞比例明显上升。这些结果提示,tnf-α促进c3g处理的cd38(+)nk细胞提升mnc中il-10(+)treg细胞比例,ifn-γ抑制该过程。c3g通过促进cd38(+)nk细胞分泌tnf-α和降低ifn-r分泌来升高mnc中il-10(+)treg细胞的比例。
与只用c3g处理的对照组相比,anti-sirt6sirna和c3g合并出来的cd38(+)nk细胞培养中tnf-α的分泌水平陡然下降、ifn-γ的浓度明显上升,建议cd38(+)nk细胞通过sirt6基因表达调控tnf-a和ifn-r分泌。c3g通过提升sirt6基因的表达来促进tnf-α分泌和抑制ifn-γ分泌来刺激mnc分化il-10(+)treg细胞。
优选的,上述应用中,矢车菊素-3-o-葡萄糖苷(c3g)作为一种ra滑膜成纤维细胞(rasf)促凋亡剂,应用于制备抗类风湿性关节炎药物。
通过c3g体外培养患者滑膜成纤维细胞(rasf),通过mtt检测细胞增殖。流式细胞术检测细胞凋亡及细胞周期,结果表明c3g能够抑制rasf的增殖、促进rasf凋亡,从而对类风湿关节炎具有一定的治疗效果。
本发明的有益效果
1.本领域研究认为c3g能够用于治疗佐剂性类风湿性关节炎,而佐剂性类风湿性关节炎与人类类风湿性关节炎具有一定的差距,本申请以牛ⅱ型胶原诱导性关节炎(cia)大鼠、体外培养的ra滑膜成纤维细胞(rasf)、ra滑液和健康人外周血来源的单个核细胞(mnc)为模型,证实了c3g对ra的治疗作用,为ra的治疗提供了潜在药物。
2.本申请针对c3g治疗ra的机制展开了研究,研究结果表明c3g通过降低cd38(+)nk细胞比例来提升mnc中treg细胞比例及il-10分泌,结果导致il-6和ifn-r水降低平,继而发挥治疗作用。针对c3g抑制cd38提升treg细胞比例及il-10分泌的机制进一步研究,证明了c3g通过活化sirt6表达继而抑制nkg2d的表达来刺激mnc分化更多的il-10(+)treg细胞,还包括途径c3g通过提升sirt6基因的表达来促进tnf-α分泌和抑制ifn-γ分泌来刺激mnc分化il-10(+)treg细胞。
3.上述机制的研究,为c3g作为抗类风湿关节炎药物提供了充分的依据,并且为类风湿关节炎靶点药物的开发提供了丰富的研究启示。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
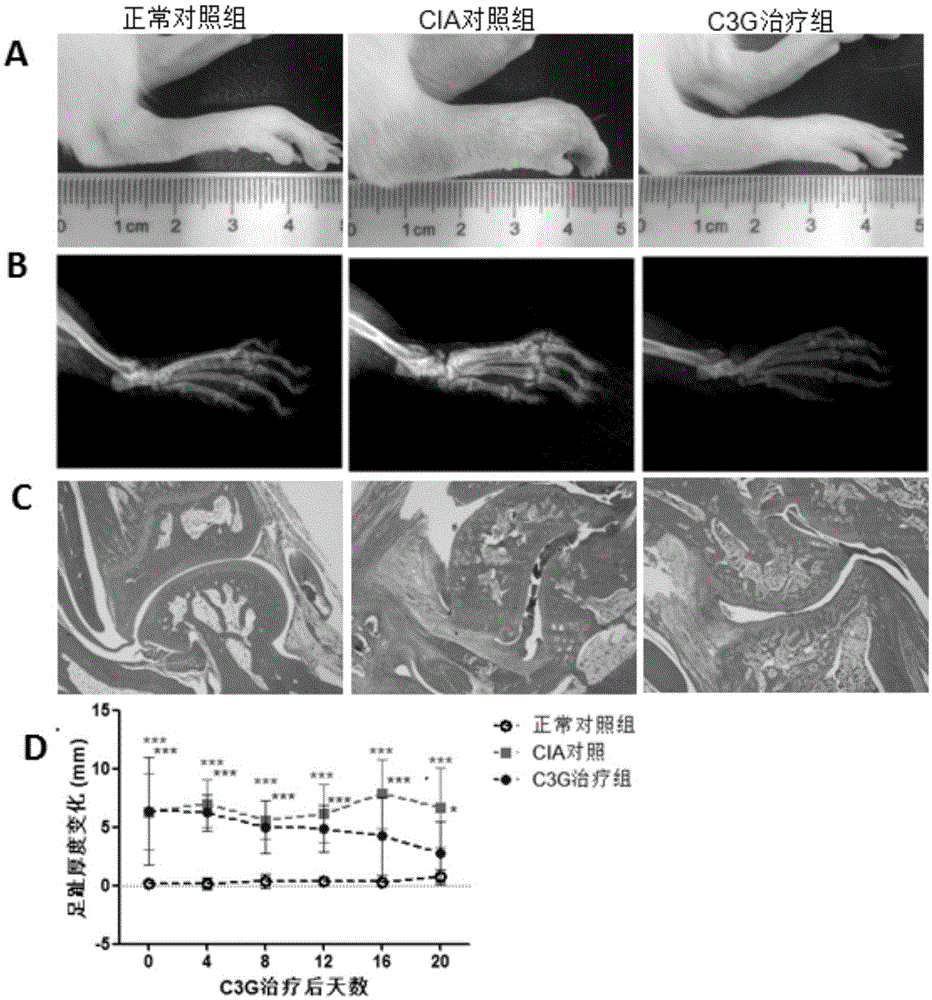
图1为c3g治疗cia大鼠的结果图;
图1a表示c3g治疗21天后各组大鼠关节肿胀度的一般观察;
图1b表示c3g治疗21天后踝关节脚趾关节的x-ray观察;
图1c各组大鼠踝关节he染色结果。
图1d为根据足趾肿胀绘制的炎症曲线。
图2为c3g对cia大鼠的免疫学影响图;
图2a为流式检测各组外周血中各淋巴细胞亚型比例;
图2b为流式检测各组外周血中cd38(+)nk细胞的变化及统计学分析;
图2c为流式分析了成模后的c3g组外周血中treg细胞、nk细胞、cd38(+)nk细胞c3g治疗前与治疗后的比例比值变化,统计分析了treg细胞比值分别与nk细胞和cd38(+)nk细胞的线性关系。
图2d为流式检测各组血清中各细胞因子的浓度。
图2e为流式检测cia对照组和c3g治疗组滑液中treg细胞、nk细胞、cd38(+)nk细胞在淋巴细胞中的比例变化。统计分析了c3g治疗组中treg细胞比例分别与nk细胞和cd38(+)nk细胞的线性关系。
图2f为流式检测滑液中cia对照组和c3g治疗组中各细胞因子的浓度。
图3为c3g对rasf纤维细胞增殖、凋亡和细胞因子分泌的作用图;
图3a为mtt方法检测rasf的增殖及统计学分析;
图3b为流式细胞术检测rasf细胞周期及统计学分析;
图3c为annexinv-fitc/pi流式细胞术检测rasf凋亡及统计学分析;
图3d为流式细胞术检测各细胞因子及统计学分析。
图4为c3g对ra滑液和外周血单个核细胞中各淋巴细胞亚型和细胞因子的影响图;
图4a为流式细胞术检测c3g处理外周血mnc中各淋巴细胞亚型的变化;
图4b为流式细胞术检测外周血mnc中c3g组与pbs组il-10(+)treg细胞、nk细胞、cd38(+)nk细胞比值变化;
图4c为统计分析外周血mnc中c3g组与pbs组il-10(+)treg细胞比值分别与nk细胞和cd38(+)nk细胞比值的线性关系;
图4d为流式细胞术检测c3g处理外周血mnc培养液中各淋巴细胞因子的浓度;
图4e为流式细胞术检测c3g处理滑液mnc中各淋巴细胞亚型;
图4f为流式细胞术检测滑液mnc中c3g组与pbs组il-10(+)treg细胞、nk细胞、cd38(+)nk细胞比值变化;
图4g为统计分析c3g组与pbs组il-10(+)treg细胞比值分别与nk细胞和cd38(+)nk细胞比值的线性关系;
图4h为流式细胞术检测c3g处理滑液中mnc培养液中各细胞因子浓度变化及统计学分析。
图5为c3g对nk和mnc中treg细胞比例的作用图;
图5a为c3g对体外treg细胞功能的影响;
图5b为c3g对与nk细胞共培养mnc中treg细胞比例的影响;
图5c为c3g对nk细胞cd38mrna表达的影响;
图5d为c3g对nk细胞cd38蛋白表达的影响;
图5e为c3g对nk细胞中cadpr浓度和ca2+浓度的影响。
图6为c3g对cd38(+)nk细胞和mnc共培养的影响图;
图6a为流式检测去除cd38(+)nk的mnc与c3g处理后cd38(+)nk细胞共培养后treg细胞的占淋巴细胞的比例变化;
图6b为流式检测去除cd38(+)nk的mnc与c3g处理后cd38(+)nk细胞共培养后各细胞因子的变化;
图6c分别用tnf-α、ifn-γ、anti-tnf-α抗体、anti-ifn-γ抗体和c3g合并处理cd38(+)nk细胞与mnc共培养,流式检测il-10(+)treg细胞的变化。
图7为sirt6小分子rna和c3g对cd38(+)nk细胞功能的影响图。
图7a为westernblotting检测不同浓度c3g刺激后cd38(+)nk细胞中sirt6蛋白的表达水平。
图7b为real-timepcr检测c3g处理后cd38(+)nk细胞中sirt6和nkg2dmrna表达。
图7c为real-timepcr和westernblotting检测cd38(+)nk细胞转染sirt6sirna后sirt6mrna和蛋白的表达。
图7d为cd38(+)nk细胞中转染sirt6sirna后再用50μmc3g刺激cd38(+)nk细胞。real-timepcr检测细胞中nkg2dmrna表达。
图7e为cd38(+)nk细胞中转染sirt6sirna后再用50μmc3g刺激cd38(+)nk细胞。流式检测细胞培养上清液中ifn-γ和tnf-α的浓度。
图7fcd38(+)nk细胞被转染sirt6sirna后,用c3g刺激cd38(+)nk细胞,再与去除cd38nk细胞mnc共培养。流式检测mnc中treg和il-10(+)treg细胞比例的变化。
图8为sirt6抑制剂对c3g治疗cia的影响图;
图8a为c3g联合sirt6抑制剂处理后cia大鼠炎症曲线;
图8b为流式细胞技术检测cia大鼠外周血中cd38(+)nk细胞和treg细胞比例的变化;
图8c为流式细胞技术检测cia大鼠关节滑液中cd38(+)nk细胞和treg细胞比例的变化;
图9为c3g治疗ra的机制模式图;
c3g通过抑制nk细胞cd38分子来促进sirt6的表达,既可以通过抑制nkg2d降低ifn-r,又可以直接促进tnf-α的转录提高tnf-α,升高ra微环境中treg细胞比例及其il-10分泌,最终实现对cia和ra治疗。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,目前针对类风湿关节炎的发病原因尚不完全明确,针对类风湿关节炎的治疗药物有限。相关研究表明矢车菊素-3-o-葡萄糖苷针对佐剂性类风湿性关节炎具有治疗效果,但佐剂性类风湿关节炎是通过弗氏试剂制作的动物模型,与人类的类风湿性关节炎有一定的差距。本申请研究确认了矢车菊素-3-o-葡萄糖苷对类风湿性关节炎的治疗作用,并进一步提供了矢车菊素-3-o-葡萄糖苷对类风湿的治疗机制,为类风湿关节炎的治疗提供了新的药物和用药依据。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例与对比例详细说明本申请的技术方案。
材料与方法
一、材料
1.临床资料
本研究收集健康志愿者和ra患者血液标本各30例,收集ra患者滑液标本各30例,收集ra患者滑膜标本20例。标本按2010年美国风湿病学会(americancollegeofrheumatology,acr)修订的ra分类标准筛选,并除外其它自身免疫性疾病、感染、肿瘤等疾病。上述样本来源于山东省千佛山医院骨外科、风湿科和体检中心。病例收集和研究方案经山东省千佛山医院伦理委员会批准【批准号:20160901】并由患者签署知情同意书。
2.实验动物
6周龄spraguedawley(sd)雄性大鼠购自济南朋悦实验动物繁育有限公司[许可证号:scxk(鲁)20140007]。饲养温度为18~29℃,日温差≤3℃,相对湿度40%~70%,新鲜空气换气次数10次/h。实验动物饲养和操作按赫尔辛基动物保护公约和中华人民共和国实验动物管理条例进行。
二、方法
1.牛ⅱ型胶原诱导性关节炎大鼠模型的构建
大鼠适应性饲养1周,将72只大鼠随机分为2组,正常对照组(normalcontrol,nc,n=24),cia(collagen-inducedarthritic,胶原诱导性关节炎)模型组(n=48)。cia模型组大鼠每只以0.2ml/只的剂量在大鼠尾根部皮内注射牛ii型胶原(美国chondrex公司,lotno.:150479)和完全弗氏佐剂(美国sigma公司,lotno.slbr1681v)等量混合的乳化剂,进行初次免疫。一周后,同样的方法注射牛ii型胶原和不完全弗氏佐剂(美国sigma公司,lotno.slbn5308v)等量混合的乳化剂,进行加强免疫。隔天观察毛色、精神状态、活动状态,用游标卡尺测量足趾厚度变化,用电子称测量体重。给药结束后,根据足趾变化,绘制炎症曲线。与正常对照组比较足趾明显肿胀,包括变形和僵直,活动障碍则认为cia建模成功。用最小显著性差异法(leastsignificantdifference,lsd)比较炎症曲线有显著性差异(p<0.05),用流式检测外周血血清中各细胞因子的浓度。
2.c3g药物对大鼠cia处理及疗效评价
以上建模成功的大鼠,二次免疫3天后随机分为cia模型对照组(n=24)和c3g治疗组(n=24)。氯化矢车菊素-3-o-葡萄糖苷粉末(中国solarbio,lotno.sc8740)用生理盐水避光溶解,对大鼠尾静脉注射(25mg/kg)。每周2次,连续给药6次。此时,模型组和对照组大鼠注射同剂量生理盐水。
2.1组织病理学观察
给药结束后,即第一次c3g注射后第21天处死大鼠。取右脚踝关节,除去多余组织后于4%多聚甲醛中固定。按常规edta脱钙、石蜡包切片并进行苏木素伊红(hemetoxylin-eosin,he)(中国solarbio,lotno.:g1120)染色,10x光镜下观察组织病理学变化。
2.2x-ray观察
给药结束后,即第一次c3g注射后第21天,腹腔注射10%水合氯醛(3-4ml/kg)将大鼠麻醉后,x-ray拍摄踝关节和膝关节,观察骨侵蚀和软骨破坏情况。
2.3大鼠血清和关节腔灌洗液细胞因子的检测
给药结束后,即第一次c3g注射后第21天处死大鼠,在下腔静脉用1ml注射器吸取大鼠外周血1ml置普通的1.5mlep管中。血液室温凝固30min后,在4℃下1000gx10min离心,取上清,于-80℃保存待用。同时,用医用眼科手术剪刀打开大鼠踝关节,用1ml注射器吸取0.5ml生理盐水冲洗关节腔,收集200ul关节腔灌洗液于1.5mlp管,于-80℃保存待用。用th1/th2大鼠试剂盒(美国biolegend,lotno.740286)检测大鼠血液和关节滑液铬细胞因子变化水平。在检测板中,每孔加入25ul混合磁珠、25ulassaybuffer、25ul标准品或检测样品、25ul抗体,室温避光,在转速为250xg的摇床中孵育3h。加入pe25ul,孵育0.5h。再加入200ul1xwashbuffer,250xg下离心5min。吸弃上清,加入100ul1xwashbuffer重悬,用流式细胞仪(美国aceabio,novocyted2040r)上机检测。用legend_plex_v8.0软件分析gm-csf、ifn-γ、il-2、il-4、il-5、il-10、il-6、il-13和tnf-α在大鼠血清和关节灌洗液中的浓度变化。
2.4大鼠外周血和关节灌洗液中淋巴细胞亚型的检测
处死大鼠,在下腔静脉用edta采血管采集外周血1-2ml,250xg离心5min离心,吸弃血浆,用红细胞裂解液冰上裂解10-30min。加入1mlpbs(phosphatebufferedsolution,磷酸盐缓冲液)液,250xg离心5min。吸弃上清,加入1mlpbs重悬细胞,于4℃待用。获得关节腔灌洗液后,加入1mlpbs,250xg下离心5min。洗涤后,吸弃上清,加入100ulpbs重悬,于4℃待用。取以上待测样本100ul加入流式抗体,4℃避光孵育30min,加入500ulpbs250xg离心5min。吸弃上清,加入100ulpbs重悬,用流式细胞仪上机检测各细胞亚型。用apcanti-ratcd3抗体(美国biolegend,lotno.201413)检测cd3(+)t细胞,用apcanti-ratcd3抗体、fitcanti-ratcd4抗体(美国biolegend,lotno.203305)检测cd3(+)cd4(+)t细胞,用apcanti-ratcd3抗体、percpanti-ratcd8a(美国biolegend,lotno.201712)抗体检测cd3(+)cd8(+)t细胞,用fitcanti-ratcd4抗体、feanti-ratcd25抗体(美国biolegend,lotno.202105)检测cd4(+)cd25(+)treg细胞,用apcanti-ratcd3抗体、fitcanti-ratcd45ra抗体(美国biolegend,lotno.202305)检测cd3(-)cd45ra(+)b细胞,用apcanti-ratcd3抗体、peanti-ratcd38抗体(美国biolegend,lotno.b210722)、fitcanti-ratcd161抗体(美国biolegend,lotno.b238452)检测cd38(+)cd3(-)cd161(+)nk、cd38(+)cd3(+)cd161(+)nkt细胞。
3.人滑膜成纤维细胞的原代培养
收集滑膜组织,用手术剪刀在无菌的平皿中剪碎,加入3ml含4%ii型胶原酶(中国solarbio,货号:c8150)(1mg/ml)dmem(dulbecco'smodifiedeaglemedium)混匀,于37℃、5%co2细胞培养箱(日本panasonic)中消化4-6h(期间每隔1h混匀一次),直至细胞分散成细胞悬液。用70-100um孔径大小的细胞滤网过滤,然后250xg下离心5min,弃上清。加入胰蛋白酶(trypsin/edtasolution,gibco公司,r001100)消化0.5h,250xg下离心5min,弃上清。再加入含10%胎牛血清(foetalbovineserun,fbs)的dmem重悬,移入培养瓶,于5%co2培养箱37℃培养,传至3-8代进行后续实验。
4.c3g刺激人滑膜成纤维细胞
取对数生长期rasf细胞,以2x10^5细胞/ml的密度种板至96孔平底板(corning
5.mtt检测成人纤维细胞增殖
取孵育后rasf细胞,去除培养液,用pbs小心洗2-3遍。每孔加入20μlmtt溶液(中国solarbio,lotno.m1020)(5mg/ml),继续培养4h。终止反应,小心吸弃培养液,每孔加入150μl二甲基亚砜(dmso),摇床80-120rpm下震荡10min,使结晶充分溶解。用分光光度计在490nm下检测吸光值。
6.annexinv-fitc/pi流式细胞术检测人rasf凋亡
将rasf细胞用25μm、50μm、100μmc3g或等体积生理盐水处理48h后,加入胰蛋白酶,收集rasf细胞制成单细胞悬液。取5×10^5个细胞,加入pbs,250xg下离心5min,弃上清,加入100ulbindingbuffer重悬,加入抗体annexinv-fitc5ul、pi10ul,(美国biolegend,lotno.640919)混匀后室温避光孵育15min。加入pbs,1000rpm下离心5min。离心洗涤3次,每管加入500ulbindingbuffer重悬,用流式细胞仪上机检测。
7.流式细胞术检测人rasf细胞周期
将rasf用25μm、50μm、100μmc3g或等体积生理盐水处理48h后,加入胰蛋白酶收集rasf细胞制成单细胞悬液。取5×10^5个细胞,加入预冷70%乙醇1ml,4℃固定30min,再加入1mlpbs,250xg下离心5min洗涤3次。加入500ulrnasea(20ug/ml)(中国solarbio,lotno.ca1510),37℃孵育30min,加入1mlpbs,250xg下离心5min离心洗涤1次,再加入500ulpi(50ug/ml)(中国solarbio,lotno.ca1510),室温避光孵育30min。过300目筛网后,用流式细胞仪上机检测。增殖指数(pi)=(s+g2)/(g0/1+s+g2m)。
8.流式细胞术检测人细胞因子
用人th1/th2亚群检测试剂盒(杭州cellgene,lotno.20171001)检测人体液中各细胞因子。将rasf用25μm、50μm、100μmc3g或等体积生理盐水和不含fbs的dmem培养48h后,收集上清,于-80℃待测。在检测板上,每孔加入捕获微球混合液25ul、荧光试剂25ul、待测样品25ul,室温避光孵育2.5h。加入200ulpbs,250xg下离心5min。洗涤2次,吸弃上清,加入100ulpbs重悬,最后流式细胞仪上机检测。用fcap_array_v3软件(bdbiosciences)分析il-2、il-4、il-6、il-10、tnf-α和ifn-γ的浓度变化。
9.滑液单个核细胞(synovialfluidmononuclearcell,sfmc)的分离
收集获得的ra滑液标本,用透明质酸酶(hyaluronidase,10u/ml)(中国solarbio,lotno.h8030)在37℃预处理30min。用淋巴细胞分离液(天津灏洋华科生物,lotno.lts1077)-密度梯度离心法分离滑液单个核细胞(mononuclearcell,mnc)白膜层细胞,加入3倍体积的pbs,200xg离心5min,洗3次后获得滑液单个核细胞。用含10%胎牛血清(foetalbovineserun,fbs)的rpm1640培养基(rpm1640medium)重悬,移入培养瓶,于5%co2培养箱37℃培养待用。
10.外周血单个核细胞(peripheralbloodmononuclearcell,pbmc)的分离取肝素钠(中国solarbio,货号:h8060)抗凝ra患者外周血(n=18)20ml,500xg离心10min后,吸其血清,加入等体积的pbs稀释混匀。取50mlep管加入25ml的淋巴细胞分离液。将细胞悬液沿壁缓缓加入至分离液中,缓升缓降800xg离心20min。吸取白色环状mnc层,pbs清洗、重悬细胞2次,再加入含10%fbs的rpm1640重悬,移入培养瓶,于5%co2培养箱37℃培养待用。分别加入50μm、100μmc3g或等体积生理盐水,37℃和5%co2细胞培养箱中避光孵育24-48h。
11.c3g刺激滑液单个核细胞或外周血单个核细胞
取sfmc或pbmc换无血清培养基,以2x10^5细胞/ml的密度种板至96孔u型底板(康宁
收集各孔培养细胞悬液1200rpm下离心5-10min,收集上清。在检测板上,每孔加入捕获微球混合液25ul、荧光试剂25ul、待测样品25ul,室温避光孵育2.5h。加入200ulpbs,250xg下离心5min。洗涤2次,吸弃上清,加入100ulpbs重悬。用流式细胞仪上机检测。用fcap_array_v3软件分析il-2、il-4、il-6、il-10、tnf-α和ifn-γ的浓度变化。
12.流式检测人各淋巴细胞亚型
收集各孔培养细胞悬液250xg下离心5-10min,收集细胞。pbs重悬,250xg下离心5-10min,洗涤2-3次。取待测样本100ul加入流式抗体,4℃避光孵育30min。加入500ulpbs250xg下离心5min,吸弃上清,加入100ulpbs重悬。用cd3/cd8/cd45/cd4检测试剂盒(流式细胞仪法-fitc/pe/percp/apc)(aceabioscienceslotno.8920008)检测cd45(+)淋巴细胞、cd3(+)t细胞、cd3(+)cd4(+)t细胞、cd3(+)cd8(+)t细胞,用cd3/cd16+cd56/cd45/cd19检测试剂盒(流式细胞仪法-fitc/pe/percp/apc)(aceabioscienceslotno.8920009)检测cd3(+)cd56+cd16(+)nk细胞、cd3(-)cd56+cd16(+)nkt细胞、cd3(-)cd19(+)b细胞,用anti-human-cd25-fitc(美国biolegend,lotno.302603)、anti-human-cd4-percp/cy5.5(美国biolegend,lotno.357413)检测cd4(+)cd25(+)treg细胞,用anti-cd38-fe(美国biolegend,lotno.356603)、anti-cd3-fitc(美国biolegend,lotno.300305)、anti-cd56-apc(美国biolegend,lotno.318303)抗体检测cd38(+)cd3(-)cd56(+)nk细胞和cd38(+)cd3(+)cd56(+)nkt细胞。
13.调节性细胞(regulatorytcells,treg细胞)细胞的诱导扩增
无菌操作取健康人外周抗凝血50ml,密度梯度离心分离人外周血总淋巴细胞。在预先用5ug/mlanti-human-cd3(天津sungene,lotno.ac305)抗体包被的细胞培养瓶中,用含tgf-β(5ng/ml)(美国peprotech,lotno.1217209)、重组人il-2(2000iu/ml)(北京同立海源,lotno.tl-104)、anti-human-cd28(100ng/ml)(天津sungene,lotno.h10281-14f)和10%胎牛血清(gibco,lotno.10100139)的1640培养基(gibco,lotno.61870-036)诱导外周血总淋巴细胞中treg细胞分化、扩增。两天换液一次,6天后第一轮扩增完成。将细胞转移到无抗体包被的培养瓶中,加入不含tgf-β和cd28、仅含重组人il-2和10%胎牛血清的1640培养基培养2天,再将细胞转移至anti-cd3抗体包被过夜的培养瓶中按第一轮扩增方法进行第二轮扩增。培养扩增2周。此方法为treg细胞常见制备方法。
14.流式分选treg细胞
取扩增前人外周血总淋巴细胞及扩增14天后的treg细胞悬液各500ul,加入anti-human-cd25-fitc(biolegend,lotno.302603)、anti-human-cd4-percp/cy5.5(biolegend,lotno.357413)、anti-human-cd127-fe(biolegend,lotno.351303)抗体,4℃避光孵育30min。500ulpbs洗涤2次,最后加100ulpbs重悬上机分选,获得纯度>99%的treg细胞。此方法为常见treg分选方法。
15.c3g刺激treg细胞和流式检测il-10(+)treg细胞
取分选后treg细胞,以2x106细胞/ml的密度种板至96孔u型板,每孔100μl体积。各孔中分别加入25μm、50μm、100μmc3g或等体积生理盐水。37℃下5%co2细胞培养箱中避光孵育24-48h。收集treg细胞,250xg离心5min,pbs重悬细胞。加入anti-human-cd25-fitc、anti-human-cd4-percp抗体,4℃孵育30min。用fixationbuffer(biolegend,lotno.420801)固定细胞,每管0.5ml固定液,室温避光孵育固定20min。350xg下离心5min,弃上清。用cellstainingbuffer洗一遍细胞,350xg,离心5min,弃上清。用permeabilizationwashbuffer(biolegend,lotno.421002)重悬固定的细胞,350xg下离心5-10min,弃上清。用100ulpermeabilizationwashbuffer重悬固定破膜后的细胞,加入特定的荧光标记抗体或者阴性对照,室温避光20min。用2mlpermeabilizationwashbuffer把细胞洗两遍。350xg离心5min,弃上清。用0.5mlpbs(bi,lotno.0010218)重悬固定染色后的细胞,流式细胞仪检测分析。
16.nk细胞的扩增、质控和分选
取健康志愿外周血50-100ml,淋巴细胞分离液密度梯度离心法进一步纯化单个核细胞(pbmc),无血清培养液洗涤2次,获得纯度在90%以上的pbmc。将从外周血分离得到的pbmc用培养液重悬后,接种培养瓶中,同时添加il-2和il-21因子进行刺激培养。第二天换kbm581培养基(含10%的自体血浆,200u/ml的il-2,80u/ml的庆大霉素)(浙江中赢方舟生物,lotno.2017101302)培养4天后,将细胞转移到透气的细胞培养袋或大培养瓶中继续扩大培养。持续扩大培养至第21天,收获细胞,完成nk细胞的制备。台盼蓝染色检测:活细胞应在80%以上;细胞杀伤实验:以nk细胞为效应细胞,以k562为靶细胞,将效应细胞与靶细胞按10:1(数目比)的比例加入96孔u型板中,每孔含靶细胞1x10^4个,终体积为200ml,设3个复孔。培养4h,然后取培养上清,用乳酸脱氢酶(ldh)试剂盒(中国solarbio,lotno.bc0685)检测效应细胞对靶细胞的杀伤率。收获细胞前,取少量培养物进行细菌、真菌培养,并检测支原体、衣原体,及内毒素(标准:病原学检测阴性,内毒素<5eu)。流式细胞仪检测cd3(-)cd56(+)细胞的比例在50-80%。加入anti-cd3-fitc(美国biolegend,lotno.300305)、anti-cd56-apc(美国biolegend,lotno.318303)抗体各10ul,4℃孵育30min。加入pbs后,200xg离心10min收集细胞,pbs重悬待用。建立cd3(-)cd56(+)阳性门及阴性门。分选的nk细胞。(纯度>99%)。
17.c3g刺激nk细胞和实时定量pcr检测cd38mrna的表达
用25μm、50μm、100μmc3g或等体积生理盐水刺激分选nk细胞。c3g处理nk细胞24-48h后,按常规提取细胞rna,再按toyobo逆转录试剂盒操作说明书将rna逆转录为cdna。实时荧光定量pcr检测cd38mrna水平的表达。总反应体系10ul,包括5ulsybrgreen、2ulddh2o、1ul上游引物、1ul下游引物和1ulcdna。反应条件为95℃预变性10min,(95℃15s,60℃34s,72℃30s)×40cycle,72℃延伸3min。cd38pcr引物序列如下:
forwardprimers:5‘agtttcttcagtgtgtgaaaaatcc3’,
reverseprimers:5‘caaaatcttcagctctgcacc3’。
gapdh引物如下:
forwardprimers:5‘caccatcttccaggagcgag3’,
reverseprimers:5‘gcaggaattgctgat3。
另外,sirt6引物序列如下:
forwardprimers:5‘tggcagtcttccagtgtggtgt3’,
reverseprimers:5‘cgctctcaaaggtggtgtcgaa3’。
nkg2d引物序列如下:
forwardprimers:5‘actgtggcccatgtcctaaa3’,
reverseprimers:5‘ggttgggtgagagaatggag3’
18.分光光度法检测钙离子(ca2+)和c-adp-ribose(cadpr)的含量。
用ca2+检测试剂盒(南京建成生物,lotno.c004-2)检测nk细胞培养液中ca2+浓度。具体方法如下:取去离子水、1mmol钙标准液、血清或培养上清各10ul,分别加入钙荧光探针250ul,混匀。静置5min后,用酶标仪在波长610nm下检测各孔od值。
分光光度法检测cadpr的含量的方法如下:1×10^5cells/mlnk细胞和20μm底物ε-nad(1,n^6-ethenonad,1,n^6-ethenonicotinamideadeninedinucleotide)(sigma公司,lotno.38806-38-1)用10mm磷酸盐缓冲液(postassiumphosphatebuffer,ph7.4)重悬后,加入50μmc3g或等体积pbs,在37℃和5%co2的湿润环境中共培养,激发波长410nm,发射波长310nm检测capdr的含量。
19.nk细胞与去除nk细胞的mnc共培养
取1x106nk细胞加入50μmc3g、37℃无菌避光孵育24h。250xg下离心5min,去除培养上清。无血清rpm160重悬细胞,然后移至0.4μmtranswell小室中(分离共培养细胞、0.4μm、(corning
20.流式分选cd38(+)nk细胞
取健康志愿者外周血或ra患者滑液,分离mnc,200xg下离心5min,吸弃上清,再加入500ulpbs重悬。加入anti-cd3-fitc、anti-cd56-apc、anti-cd38-percp抗体各10ul,4℃孵育30min。加入pbs后,200xg离心10min收集细胞,pbs重悬待用。建立cd38(+)cd3(-)cd56(+)阳性门及阴性门,阴性门中细胞群即为去除cd38(+)nk细胞的mnc细胞。取ra患者外周血扩增后的nk细胞500μl,加入anti-cd38-fe(美国biolegend,lotno.356603)、anti-cd3-fitc(美国biolegend,lotno.300305)、anti-cd56-apc(美国biolegend,lotno.318303)抗体抗体各10ul,4℃孵育30min。加入pbs后,200xg离心10min收集细胞,pbs重悬待用。120℃高压鞘液30min,75%乙醇处理鞘液桶和液面感受器1h后,双蒸水洗涤。流式细胞仪检测细胞中cd38(+)nk细胞的比例,建立阳性门及阴性门。分选后,对样本进行分选纯度的检测,分选cd38(+)nk细胞和去除cd38(+)nk细胞mnc供后续使用。用50μmc3g处理cd38(+)nk24h后,收集上清,流式检测细胞因子的变化。
21.cd38(+)nk细胞与去除cd38(+)nk细胞的mnc共培养
取1x106cd38(+)nk细胞,加入50μmc3g或等体积pbs,37℃无菌避光孵育24h。250xg下离心5min去除培养上清。无血清rpm160重悬细胞,然后移至0.4μmtranswell小室中。加入tnf-α(10ng/ml)(sigma,cat.no.t0157)或ifn-γ(5ng/ml)(sigma,lotno.srp3058)或anti-tnf-α抗体(10ng/ml)(cellsignaling,lotno.7321)或anti-ifn-γ抗体(5ng/ml)(cellsignaling,lotno.8455)等体积溶剂。下室种5x106去除cd38(+)nk细胞的mnc。直接用50μmc3g或等量生理盐水刺激去除cd38(+)nk细胞的mnc细胞做对照组。37℃、5%co2的湿润环境中共培养24-48h。流式细胞术分析il-10(+)treg细胞的比例。
22.c3g刺激cd38(+)nk和sirt6(sirtuin6)和nkg2d(natural-killergroup2,memberd)表达的检测
用不同浓度的c3g刺激cd38(+)nk细胞24-48h后,收集细胞。按常规提取rna(foregene,lotno.re-0301t),将其逆转录为cdna(hiscripiiqrtsupermixforqpcr,vazyme,lotno.r223-01)。real-timepcr检测sirt6和nkg2dmrna水平的表达。
sirt6引物序列如下:
forwardprimers5‘tggcagtcttccagtgtggtgt3’,
reverseprimers5‘cgctctcaaaggtggtgtcgaa3’;
nkg2d引物序列如下:
forwardprimers5‘actgtggcccatgtcctaaa3’,
reverseprimers5‘ggttgggtgagagaatggag3’。
23.sirt6sirna对cd38(+)nk细胞的处理
提前0.5-1h将cd38(+)nk细胞换成不含fbs的培养基。将5xpepmutebuffer使用无菌水稀释至1xbuffer混匀。加入3-6μlsirt6小干扰rna(sirt6sirna)或阴性对照(allstarssirna)和4ulpepmute转染试剂。吹打50次或震荡仪缓慢涡旋2min,无菌室温孵育15-20min后加入至培养孔。37℃,5%co2细胞培养箱中孵育24h待用。sirt6sirna序列设计参考tennen的设计。具体序列如下:5‘ccggctctgcaccgtggctaa3’。从培养细胞中按常规提取总rna和总蛋白,然后用real-timepcr和westernblotting检测sirt6sirna干扰效率。与对照组相比,干扰效率约70%-80%时可继续进行。
收集转染sirt6sirna24h后的cd38(+)nk细胞,加入50μm的c3g刺激48h。收集细胞,250xg下离心5min。收集细胞培养上清,流式检测细胞因子的变化。同时收集细胞,提取mrna,将其逆转录为cdna,用real-timepcr检测nkg2dmrna水平的表达。
24.westernblotting
收集细胞,在4℃条件下500g离心5min,用手指把细胞用力弹散。按每106个细胞中加入100μl裂解液(上海beyotime,lotno.p10013b)的比例加入适量的裂解液,4℃持续震荡30min。4℃10000g离心20min,轻轻吸取上清并转移至新预冷的微量离心管中,置于冰上,即为蛋白样品。bicinchoninicacid(bca)法(上海beyotime,lotno.p0009)测定蛋白质浓度。使用含十二烷基硫酸钠(sds)的上样缓冲液(上海beyotime,lotno.p0015l),95-100℃煮沸5min。凝胶(上海beyotime,lotno.p0012ac)上样前将上样孔中气泡赶尽,使用特定的凝胶上样吸头在样品池中加入样品。上层胶80v电压,下层胶120v电压跑胶至溴酚蓝指示剂即将跑出胶时结束。280ma湿转60min将凝胶中的蛋白转移到pvdf膜上(中国boster,lotno.13g26c36)。用5%的脱脂奶粉室温孵育1.5-2h后,抗sirt6抗体(abcam,lotno.ab88494),cd38抗体(santacruz,lotno.sc-374650)或gapdh(abcam,lotno.ab8245),4℃过夜孵育,结束后用tbst摇动洗膜5次,每次5min。加入稀释后的二抗37℃孵育1h。结束后用tbst摇动洗膜5次,每次5min。用增强化学发光法(ecl)显色(上海beyotime,lotno.p0018s)。
25.用sirt6抑制剂处理cia大鼠
用sirt6抑制剂oss_128167(selleck公司,lotno.s862701)处理cia大叔。首先按上述方法构建cia大鼠,将其随机分为cia模型对照组(n=9),c3g治疗组(n=9)和c3g联合sirt6抑制剂处理组(n=9)。sirt6抑制剂用2%dmso、40%peg300、2%吐温80和h2o溶解,溶解度为12mg/ml。用10%水合氯醛按300mg/kg进行腹腔注射麻醉后,c3g治疗组尾静脉注射c3g(25mg/kg),c3g联合sirt6抑制剂治疗组尾静脉注射c3g同时尾静脉注射sirt6抑制剂(100mg/kg)。每周2次,连续给药6次。隔天观察并测量足趾厚度,绘制炎症曲线。在给药后3周后,水合氯醛麻醉后,分别取外周血和关节腔灌洗液,流式检测treg细胞、cd38(+)nk细胞及细胞因子tnf-α、ifn-γ、il-6和il-10的浓度。
26.统计学处理
采用spss17.0软件(biomedicalcomputerprograms)进行正态和方差齐性的检验。对于符合检验标准的数据以x±s表示。采用单因素方差分析进行多组间显著性检验,两两比较采用lsd法,相关性分析采用pearson相关分析,|r|≥0.8两变量高度相关;0.8>|r|≥0.5两变量中度相关;0.5>|r|≥0.3两变量低度相关;0.3>|r|两变量无相关;检验标准α=0.05,p,<0.05为差异有统计学。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
sequencelisting
<110>常晓天
<120>c3g在制备抗类风湿性关节炎药物中的应用
<130>2010
<160>13
<170>patentinversion3.3
<210>1
<211>25
<212>dna
<213>人工序列
<400>1
agtttcttcagtgtgtgaaaaatcc25
<210>2
<211>21
<212>dna
<213>人工序列
<400>2
caaaatcttcagctctgcacc21
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
caccatcttccaggagcgag20
<210>4
<211>15
<212>dna
<213>人工序列
<400>4
gcaggaattgctgat15
<210>5
<211>22
<212>dna
<213>人工序列
<400>5
tggcagtcttccagtgtggtgt22
<210>6
<211>22
<212>dna
<213>人工序列
<400>6
cgctctcaaaggtggtgtcgaa22
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
actgtggcccatgtcctaaa20
<210>8
<211>20
<212>dna
<213>人工序列
<400>8
ggttgggtgagagaatggag20
<210>9
<211>22
<212>dna
<213>人工序列
<400>9
tggcagtcttccagtgtggtgt22
<210>10
<211>22
<212>dna
<213>人工序列
<400>10
cgctctcaaaggtggtgtcgaa22
<210>11
<211>20
<212>dna
<213>人工序列
<400>11
actgtggcccatgtcctaaa20
<210>12
<211>20
<212>dna
<213>人工序列
<400>12
ggttgggtgagagaatggag20
<210>13
<211>21
<212>dna
<213>人工序列
<400>13
ccggctctgcaccgtggctaa21
- 还没有人留言评论。精彩留言会获得点赞!