抗菌生物医学植入物以及相关的材料、装置和方法与流程
本公开总体上涉及抗菌生物医学植入物,并且具体地涉及用于改善椎间脊柱植入物的抗菌特性的材料、装置和方法。
背景技术:
聚合物材料在骨整合和微生物抗性方面都很差。先前克服这种问题的工作涉及将抗微生物或成骨材料包含在聚合物材料上或聚合物材料中。在这些情况下,羟基磷灰石通常被用作改善骨传导的材料,而抗微生物化合物通常是银或抗生素。然而,需要使用一种材料来改善聚合物材料的成骨和抗感染性质。
考虑到这些观察,除其他事项之外,构思和发展了本公开的各个方面。
技术实现要素:
需要具有抗菌性质的改善的生物医学植入物。因此,本公开的一个实施方案可包括用于改善生物医学植入物的抗菌特性的方法。所述方法可包括以下步骤:提供生物医学植入物;以及向生物医学植入物加载约10%至约20%的粉末,其中所述粉末包含氮化硅材料。所述方法还可包括将生物医学植入物的至少一部分的表面粗糙度增加至具有至少约500nmra的算术平均值的粗糙度轮廓以改善生物医学植入物的抗菌特性,所述表面粗糙度的增加是通过微机械加工、研磨、抛光、激光蚀刻、激光纹理化、喷砂或其他喷磨、化学蚀刻、热蚀刻和等离子蚀刻中的至少一种完成。氮化硅材料可选自由以下组成的组:α-si3n4、β-si3n4、β-siyalon及其组合。生物医学植入物可以是椎间脊柱植入物。生物医学植入物可包含聚醚醚酮(peek)、钛、peek和β-si3n4粉末或peek和β-siyalon粉末。
在其他实施方案中,所述方法还可包括将氮化硅涂层施加到生物医学植入物。增加生物医学植入物的至少一部分的表面粗糙度的步骤可以在将涂层施加到生物医学植入物的步骤之后进行,并且增加生物医学植入物的至少一部分的表面粗糙度的步骤可包括增加涂层的至少一部分的表面粗糙度。将生物医学植入物的至少一部分的表面粗糙度增加至具有至少约1,250nmra或在约2,000nmra与约5,000nmra之间的算术平均值的粗糙度轮廓的步骤。
本公开的另一种实施方式可以采用具有改善的抗菌特性的生物医学植入物的形式。生物医学植入物可包含聚合物或金属基底材料;和约10%至约20%的粉末,其中所述粉末包含氮化硅材料。植入物的至少一部分可具有算术平均值为至少约500nmra的增加的表面粗糙度轮廓,所述增加的表面粗糙度轮廓是通过微机械加工、研磨、抛光、激光蚀刻、激光纹理化、喷砂或其他喷磨、化学蚀刻、热蚀刻和等离子蚀刻中的至少一种产生的。氮化硅材料可选自由以下组成的组:α-si3n4、β-si3n4、β-siyalon及其组合。基底材料可包括聚醚醚酮(peek)、钛、peekβ-si3n4粉末或peek和15%β-siyalon粉末。生物医学植入物可以是椎间脊柱植入物、髋植入物或骨螺钉。生物医学植入物可包括髋植入物,其中在髋植入物的股骨柄上具有氮化硅涂层。生物医学植入物还可包括生物医学植入物上的氮化硅涂层。
附图说明
本文的书面公开描述了非限制性且非穷举性的说明性实施方案。参考附图中描绘的某些此类说明性实施方案,在附图中:
根据本公开的一个方面,图1a是脊柱植入物的一个实施方案的透视图;图1b是在对植入物施加表面粗糙化处理之后图1a的脊柱植入物的透视图;并且图1c是图1b的脊柱植入物的透视图,所述脊柱植入物具有用于使植入物迁移最小化的表面特征部;
根据本公开的一个方面,图2a是其上施加有涂层的脊柱植入物的另一个实施方案的透视图;并且图2b是在对植入物的涂层施加表面粗糙化处理之后图2a的实施方案的透视图;
根据本公开的一个方面,图3a是髋柄植入物的实施方案的透视图,所述髋柄植入物具有施加到植入物的一部分的涂层;并且图3b是在对植入物的涂层施加表面粗糙化处理之后图3a的实施方案的透视图;
图4a是沿图3a中的线4a-4a截取的剖视图;并且图4b是沿图3b中的线4b-4b截取的剖视图;
根据本公开的一个方面,图5a是骨螺钉植入物的实施方案的透视图;并且图5b是在对植入物施加表面粗糙化处理之后图5a的实施方案的透视图;
根据本公开的一个方面,图6a示出了单片peek上的saos-2细胞的荧光光谱图像;图6b示出了具有15%α-si3n4的peek上的saos-2细胞的荧光光谱图像;图6c示出了具有15%β-si3n4的peek上的saos-2细胞的荧光光谱图像;并且图6d示出了具有15%β-siyalon的peek上的saos-2细胞的荧光光谱图像;
根据本公开的一个方面,图7是基于荧光显微镜检查的细胞计数结果的图;
根据本公开的一个方面,图8a示出了在暴露于saos-2细胞之前和之后的单片peek的sem图像;图8b示出了在暴露于saos-2细胞之前和之后的具有15%α-si3n4的peek的sem图像;图8c示出了在暴露于saos-2细胞之前和之后的具有15%β-si3n4的peek的sem图像;并且图8d示出了在暴露于saos-2细胞之前和之后的具有15%β-siyalon的peek的sem图像;
根据本公开的一个方面,图9是基底材料的3d激光显微镜检查结果的图,其示出了骨磷灰石体积;
根据本公开的一个方面,图10a是在暴露于saos-2细胞7天之后β-siyalon填充的peek的拉曼微探针光谱图像;并且图10b是在暴露于saos-2细胞7天之后β-siyalon填充的peek的拉曼强度的图;
根据本公开的一个方面,图11a示出了单片peek上的表皮葡萄球菌(s.epidermis)的dapi/cfda染色的荧光显微图像;图11b示出了具有15%α-si3n4的peek上的表皮葡萄球菌的dapi/cfda染色的荧光显微图像;图11c示出了具有15%β-si3n4的peek上的表皮葡萄球菌的dapi/cfda染色的荧光显微图像;并且图11d示出了具有15%β-siyalon的peek上的表皮葡萄球菌的dapi/cfda染色的荧光显微图像。
根据本公开的一个方面,根据本公开的一个方面,图12是各种基底上的cfda/dapi染色阳性细胞的结果图
根据本公开的一个方面,图13是每种基底的wst测定结果(450nm处的吸光度)的图。
具体实施方式
参考附图将最佳地理解本文所述的实施方案,其中相同部分始终由相同标号表示。将易于理解的是,如总体上在本文附图中所描述和说明的,本公开的部件可被布置和设计成很多种不同的配置。因此,以下对装置的实施方案的更详细描述并不意图限制本公开的范围,而仅是表现出本公开可能的实施方案。在一些情况下,并未详细示出或描述众所周知的结构、材料或操作。
本文公开了装置、方法和系统的各种实施方案,其涉及具有抗菌特性的生物医学植入物以及用于改善此类植入物的抗菌功能和/或特性的材料和方法。在优选的实施方案中,提供了氮化硅陶瓷植入物,在一些实施方案中,可以处理所述植入物以改善它们的抗菌特性和/或其他希望的特性。例如,本文公开的实施方案和实施方式可导致改善细菌吸附和生物膜形成的抑制、改善蛋白质吸附和/或增强骨传导和骨整合特性。此类实施方案可包括氮化硅陶瓷或掺杂的氮化硅陶瓷基底。另选地,此类实施方案可包括在不同材料的基底上的氮化硅或掺杂的氮化硅涂层。在其他实施方案中,植入物和涂层可以由氮化硅材料组成。在再其他实施方案中,植入物的一个或多个部分或区域可包含氮化硅材料和/或氮化硅涂层,而其他部分或区域可包含其他生物医学材料。
作为另一种替代性方案,可以将氮化硅或其他类似的陶瓷材料掺入用于形成生物医学植入物的其他材料中。例如,氮化硅可用作填料或以其他方式掺入聚合物或可生物降解的聚合物中,所述聚合物诸如聚醚醚酮(peek)、聚(甲基丙烯酸甲酯)、聚(对苯二甲酸乙二酯)、聚(二甲基硅氧烷)、聚(四氟乙烯)、聚丙烯酸、聚乳酸、聚碳酸酯、聚乙烯和/或聚氨酯,呈它们的多孔支架或块状结构形式。在一些实施方案中,氮化硅填料可以是β-氮化硅,并且可以以约1重量%至约99重量%范围内的量存在于生物医学植入物中。例如,β-硅粉末可以以约10重量%至约20重量%的量掺入peek生物医学植入物中。氮化硅也可以用作填料,以其他方式掺入用于形成其他生物医学植入物的其他材料中,诸如金属,包括例如,钛、银、镍钛诺、铂、铜、钴/铬和相关合金。作为再一替代性方案,氮化硅可以用作填料或以其他方式掺入其他材料中,诸如陶瓷和金属陶瓷。
在包括一个或多个涂层的实施方案中,涂层可以通过许多方法施加,所述方法诸如化学气相沉积(cvd)、物理气相沉积(pvd)、等离子体喷涂、电沉积或电泳沉积、浆料涂覆和高温扩散或本领域技术人员已知的任何其他施加方法。在一些实施方案中,涂层厚度可以在约5纳米至约5毫米之间的范围内。在一些此类实施方案中,涂层厚度可以在约1微米与约125微米之间。涂层可附着到植入物的表面,但不一定是密封的。
氮化硅陶瓷具有极大的弯曲强度和断裂韧度。在一些实施方案中,已发现此类陶瓷具有大于约700兆帕斯卡(mpa)的弯曲强度。实际上,在一些实施方案中,已测量这种陶瓷的弯曲强度大于约800mpa、大于约900mpa或约1,000mpa。在一些实施方案中,氮化硅陶瓷的断裂韧度超过约7兆帕斯卡平方根米(mpa·m1/2)。实际上,在一些实施方案中,此类材料的断裂韧度约为7-10mpa·m1/2。
合适的氮化硅材料的实例描述于例如标题为“metal-ceramiccompositearticulation”的美国专利号6,881,229中,所述专利以引用的方式并入本文。在一些实施方案中,可以处理掺杂剂(诸如氧化铝(al2o3)、氧化钇(y2o3)、氧化镁(mgo)和氧化锶(sro))以形成掺杂的氮化硅组合物。在包括掺杂的氮化硅或另一种类似的陶瓷材料的实施方案中,可以优化掺杂剂的量以实现最高密度、机械性质和/或抗菌性质。在另外的实施方案中,生物相容性陶瓷可具有大于约900mpa的弯曲强度和大于约9mpa·m1/2的韧度。根据美国金属测试协会(astm)协议方法c-1161,可以在标准3点弯曲样本上测量弯曲强度,并且根据astm协议方法e399,可以使用单边缺口梁样本测量断裂韧度。在一些实施方案中,氮化硅粉末可单独使用或与上文提及的一种或多种掺杂剂组合使用,以形成陶瓷植入物。
合适的氮化硅材料的其他实例描述于标题为“ceramic-ceramicarticulationsurfaceimplants”的美国专利号7,666,229中,所述专利以引用的方式并入本文。合适的氮化硅材料的再其他实例描述于标题为“hipprosthesiswithmonoblockceramicacetabularcup”的美国专利号7,695,521中,所述专利也以引用的方式并入本文。
已发现氮化硅具有意料不到的抗菌性质和增加骨形成的性质。实际上,如下文更详细讨论的,最近已证明,相对于其他常见的脊柱植入物材料(诸如钛和聚醚醚酮(peek)),细菌在氮化硅材料上的粘附和生长大幅减少。如下文更详细讨论的,与医用级钛和peek相比,氮化硅显著抑制体外和体内的细菌定植和生物膜形成。在研究期间,氮化硅还表现出低得多的活菌计数和活菌死菌比。
还已经表明,氮化硅材料提供比钛和peek显著更大的玻连蛋白和纤连蛋白的吸附,所述蛋白已知能够降低细菌功能。人们认为,通过显著降低感染的可能性,这些性质在所有类型的生物医学植入物中都将非常有用。这可以通过例如防止或破坏植入物上/中的细菌形成和/或杀死已经转移到植入物的细菌来实现。
不受理论的限制,人们认为,表征氮化硅的更高的蛋白质吸附,可有利于抑制细菌生长并促进干细胞分化为成骨细胞。这种优先吸附可能是氮化硅降低细菌功能的原因。同样,不受理论的限制,氮化硅的增强的抗菌特性的机制可以是其特征部的组合。例如,它的亲水表面可以导致蛋白质的优先吸附,这是造成细菌功能降低的原因。可以通过增加基于氮化硅的植入物或由不同材料组成的植入物上的基于氮化硅的涂层的表面纹理或粗糙度来增强这种效果。由于这些特性,当与单独的钛或peek相比时,氮化硅还表现出增强的体内骨传导和骨整合。
如上文所讨论的,在一些实施方案和实施方式中,可以使用在植入物表面的一个或多个区域上使用氮化硅涂层或填料来抑制细菌粘附,同时增加/促进愈合和骨重建所必需的蛋白质吸附。在其他实施方案中,使用单片氮化硅作为植入物可以实现这种相同的效果。
在此类实施方案中,陶瓷植入物的表面可以被工程化成能够提供增加程度的微粗糙度和表面纹理以增强这些希望的性质。例如,在一些实施方案中,微粗糙度—即典型地通过ra值测量的峰与谷之间的表面纹理—也可以或者另选地通过合适的纹理化来增加。在一些实施方式中,植入物和/或涂层的微粗糙度可通过微机械加工、研磨、抛光、激光蚀刻或纹理化、喷砂或其他喷磨、化学蚀刻、热蚀刻或等离子蚀刻等来增加。可以通过使用轮廓曲线仪上的截止限制测量表面微凸体的高度来测量微粗糙度。这种方法可用于选择性地评估峰与谷之间的表面的粗糙度。另选地或除此之外,可以测量偏度和/或峰度。这些测量值考虑了所述表面与可能出现表面粗糙度的正常高斯分布的表面之间的偏差。这种表面工程化也可以在氮化硅涂层上进行,而不是在单片氮化硅或氮化硅复合植入物上进行。
在一些实施方案中,氮化硅材料或掺杂的氮化硅材料的密度可以在整个植入物上变化,或者在整个由氮化硅组成的植入物的部分上变化。例如,在脊柱植入物实施方案中,最外层或最外层的一部分可以比植入物的核芯或中心更多孔或更松散。这可以允许骨生长到植入物的较松散部分中或以其他方式与植入物的较松散部分融合,并且植入物的较致密部分可以是耐磨的,并且例如可具有更高的强度和/或韧度。
在某些实施方案中,植入物的一个或多个内部部分可具有相对低的孔隙率或者是无孔陶瓷的,并因此表现出高密度和高结构完整性,这通常与天然密质骨一致并且通常模仿天然密质骨的特性。并且,相比之下,在植入物的外表面处形成的一个或多个表面涂层、层或衬里可以表现出相对更大或更高的孔隙率,这通常与天然松质骨一致并且通常模仿天然松质骨的特性。结果,较高孔隙率的表面区域、涂层或衬里可以提供有效的骨向内生长表面,用于实现植入物的陶瓷部分(在一些中实施方案中,其包括整个植入物)在患者的椎骨之间或人体内的另一个合适的位置的牢固且稳定的骨向内生长附连。
在一些实施方案中,可以通过施加氮化硅作为附着涂层来改善其他植入物材料(诸如聚合物、金属或陶瓷)的抗菌行为。在一些实施方案中,这种涂层可以被粗糙化或纹理化以提供增加的氮化硅材料/涂层的表面积。在其他实施方案中,可以提供单片氮化硅可植入设备,其可以经受类似的表面工程化。
可以使用粗糙度轮廓(ra)的算术平均值来计算本文公开的表面粗糙度值。抛光的氮化硅表面可具有20nmra或更小的粗糙度。然而,如下文更详细讨论的,与直觉相反,可以通过粗糙化(而不是抛光)氮化硅陶瓷或其他类似陶瓷植入物的表面的全部或者一个或多个部分来改善某些实施方案的抗菌性质。在一些实施方案中,可以作为产生材料的过程的一部分(诸如在烧制阶段期间)产生相对粗糙的表面,而无需进一步粗糙化或其他表面工程化。然而,在其他实施方案中,如下文更详细讨论的,可以使表面粗糙化以使粗糙度进一步增加超过单独的标准烧制/固化所产生的粗糙度。因此,在一些实施方案中,表面粗糙度可以大于约1,250nmra。在一些此类实施方案中,表面粗糙度可以大于约1,500nmra。在一些此类实施方案中,表面粗糙度可以大于约2,000nmra。在一些此类实施方案中,表面粗糙度可以大于约3,000nmra。在其他实施方案中,表面粗糙度可以在约500nmra与约5,000nmra之间。在一些此类实施方案中,表面粗糙度可以在约1,500nmra与约5,000nmra之间。在一些此类实施方案中,表面粗糙度可以在约2,000nmra与约5,000nmra之间。在一些此类实施方案中,表面粗糙度可以在约3,000nmra与约5,000nmra之间。
在某些实施方案中,金属、聚合物或陶瓷植入物基底可填充有氮化硅粉末。填料氮化硅粉末的非限制性实例包括α-si3n4、β-si3n4和β-siyalon粉末。可填充有氮化硅粉末的金属或聚合物生物医学植入物基底的非限制性实例包括聚醚醚酮(peek)、聚(甲基丙烯酸甲酯)、聚(对苯二甲酸乙二酯)、聚(二甲基硅氧烷)、聚(四氟乙烯)、聚丙烯酸、聚乳酸、聚碳酸酯、聚乙烯、聚氨酯、钛、银、镍钛诺、铂、铜和/或相关合金。在各种实施方案中,peek植入物可填充有β-si3n4或β-siyalon研磨粉末。植入物中研磨的氮化硅粉末的百分比可以在约1重量%至约99重量%的范围内。在各个方面,植入物中的氮化硅可以在以下范围内:约1重量%至约5重量%、约5重量%至约15重量%、约10重量%至约20重量%、约15重量%至约25重量%、约20重量%至约30重量%、约25重量%至约35重量%、约30重量%至约50重量%、约40重量%至约60重量%、约50重量%至约70重量%、约60重量%至约80重量%、约70重量%至约90重量%和约80重量%至约99重量%。在一个实施方案中,peek植入物可包括高达约15%的β-si3n4或β-siyalon。
在一个实施方案中,siyalon和β-si3n4材料可以添加氧化铝和氧化钇。不受特定理论的限制,可以通过添加这些氧化物掺杂剂来增强植入物的功能性表面化学。
在一些实施方案中,与不含氮化硅填料的植入物相比,填充有氮化硅粉末的聚合物植入物可以改善植入物的骨传导性和抗菌活性。例如,与单片peek植入物相比,填充有β-si3n4或β-siyalon的peek植入物可以改善植入物的骨传导性和抗菌特性。在一个实施方案中,填充有氮化硅粉末的植入物的表面可以进一步修改表面粗糙度,并且还可以包括或不包括氮化硅涂层。因此,本文公开的一些方法可以提供氮化硅陶瓷填充的植入物的表面粗糙度的工程化,以便改善它们的抗菌性能。
不受特定理论的限制,添加相对低比例的β-si3n4或β-siyalon或其合适的混合物可以增强peek的体外骨传导性和抗菌性。氮化硅填充的peek植入物比不含氮化硅填料的其他基底具有明显更好的结果。意料不到的是,填充有α-si3n4的peek植入物表现出增加的骨传导性和降低的抗菌性,而β-si3n4或β-siyalon具有增加的骨传导性和抗菌性。
在一些实施方案中,金属、聚合物或陶瓷基底可以预先工程化成具有可以向其施加氮化硅涂层的表面纹理。这种纹理的平均表面粗糙度(ra)可以在低至约5纳米高至约5,000纳米或更高的范围内。另选地,作为另一个实施方案,除了基底的表面粗糙度之外,还可以增加氮化硅涂层本身的表面纹理,以获得类似的ra范围和所得的抗菌效果。因此,本文公开的一些方法可以提供单片氮化硅陶瓷植入物的表面粗糙度的工程化以便改善它们的抗菌性能,并且本文公开的其他方法可以提供施加到基底上的层或涂层的表面粗糙度的工程化,所述基底由可用于生物医学植入物的任何其他合适材料组成。当然,在一些实施方式中,表面工程化可以应用于基底和涂层二者。
增加陶瓷或陶瓷填充的植入物的表面粗糙度可以使用本领域技术人员已知的许多方法来实现,所述方法包括微机械加工、研磨、抛光、激光蚀刻或纹理化、喷砂或其他喷磨、化学蚀刻、热蚀刻、等离子蚀刻等。
本文公开的本发明技术,包括但不限于氮化硅涂层和粗糙化表面光洁度,可以应用于任何数量和类型的生物医学部件,其包括但不限于脊柱笼,矫形螺钉,板、线和其他固定设备,脊柱、髋部、膝部、肩部、踝部和趾骨、导管、人造血管和分流器中的关节设备,用于面部或其他重建整形手术的植入物,中耳植入物,牙科设备等。
如下文示出的实施例所示,与钛和聚醚醚酮(peek)相比,氮化硅显著抑制体外和体内的生物膜形成和细菌定植,并表现出低得多的细菌的活菌/死菌比,所述细菌包括但不限于表皮葡萄球菌(staphylococcusepidermidis(staph.epi.))、金黄色葡萄球菌(staphylococcusaureus(staph.aureus))、肠球菌(enterococcus)、铜绿假单胞菌(pseudomonasaeruginosa(pseudo.aeruginosa))和大肠杆菌(escherichiacoli(e.coli))。氮化硅还表现出显著更高的三种蛋白质(纤连蛋白、玻连蛋白和层粘连蛋白)的体外吸附,这三种蛋白质可以取代或抑制细菌生长并促进干细胞分化为成骨细胞。
在临床环境中,细菌是永远存在的威胁,特别是在涉及手术治疗和将外来物质引入人体(诸如矫形、心脏或牙齿内假体)时。在手术期间引入的微生物倾向于最初填充在植入物的无菌表面。细菌对生物材料表面的粘附是感染发生的必要步骤。如果植入物被细菌过度定植,则会触发人体的防御机制。当细菌菌落达到临界尺寸并克服局部宿主防御时,就会出现慢性感染。当这种情况发生时,身体倾向于包裹感染并拒绝植入物。因此,患者通常必须进行再次手术,移除植入物、治疗感染并更换植入物。与常见矫形手术相关的深度伤口感染可高达4%,并且用于矫正治疗的成本高达100,000美元或更多。生活质量的降低和治疗感染的相关成本是当今医疗护理的重大负担。
因此,本文公开的各种实施方案和实施方式将提供抵抗细菌粘附、定植和生长的材料和方法,如上文所讨论的,所述细菌粘附、定植和生长经常导致慢性感染。与其他常见植入物(诸如仅由钛和peek组成的植入物)相比,本文公开的实施方案和实施方式还可以提供增强的体内骨整合和增加的骨生长。
影响细菌对生物材料表面的粘附的因素可包括化学组成、表面电荷、疏水性以及植入物表面和/或涂层的表面粗糙度或物理特性。金属、聚合物和陶瓷植入物的表面化学存在显著的差异。金属通常在其表面上具有薄的保护性氧化物层(通常厚度小于约25nm)。聚合物也可具有氧化物表面,但所述氧化物通常是较长链羧基或羟基的一部分。金属和聚合物表面二者都通常硬度较低,并因此容易磨损并且对化学侵蚀和溶解高度敏感。陶瓷,诸如氮化硅陶瓷,也可具有氧化物表面。然而,与它们的金属对应物不同,它们对化学和研磨作用具有高度抗性。
金属和聚合物设备通常也是疏水的。因此,细菌不必取代水性体液以便附着到植入物表面。相反,已知陶瓷,并且特别是氮化硅,是亲水的。例如,固着水滴研究表明,氮化硅具有比医用级钛或peek更高的可润湿性。这种较高的可润湿性被认为直接归因于基于氮化硅的陶瓷的亲水表面。
为了使细菌附着到亲水表面,必须取代表面上存在的水。因此,亲水表面通常比疏水表面更有效地抑制细菌粘附。还示出,植入物表面光洁度和纹理在细菌定植和生长中起重要作用。典型的聚合物或金属植入物的表面上的不规则部分倾向于促进细菌粘附,而光滑表面倾向于抑制附着和生物膜形成。这是正确的,因为粗糙表面具有更大的表面积并且包括提供有利的定植位点的凹陷。
然而,与直觉相反,已经证明某些陶瓷材料,包括特别是基于氮化硅的陶瓷材料,不仅提供希望的抗菌性质,而且还被证明提供进一步增强的抗菌性质,以及增加的而不是降低的表面粗糙度。换句话讲,较高粗糙度的氮化硅表面似乎比光滑表面更耐细菌粘附。这与许多其他植入材料(诸如钛和peek)所观察到的完全相反。如上文所提及的并且如下文更详细讨论的,与医用级钛和peek相比,氮化硅已经表现出显著抑制体外细菌定植和生物膜形成,并且在研究期间表现出低得多的活菌计数和活菌死菌比。然而,在不同类型的氮化硅之间的研究中,粗糙的氮化硅表面已经表现出比抛光的氮化硅更有效地抑制细菌定植(而不是像最常见的植入物材料那样不太有效)(尽管两者都比钛或peek在这方面更有效)。
通过以下实施例将进一步理解各种实施方案和实施方式:
实施例1
在第一个工作实施例中,测试了生物医学植入物材料抑制细菌定植的能力。所述研究包括氮化硅材料、生物医学4级钛和peek。研究中包括四种类型的细菌:表皮葡萄球菌、金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌和肠球菌。
在研究中,将植入物样品通过uv光暴露灭菌24小时,并使用扫描电子显微镜检查表征表面粗糙度。然后将细菌接种在样品表面上并孵育4、24、48和72小时。
在每个时间段结束时使用两种方法确定细菌功能:(1)结晶紫染色;和(2)活菌/死菌测定。还使用具有图像分析软件的荧光显微镜在视觉上计数细菌。实验一式三份完成并重复三次。然后使用studentt检验完成适当的统计分析。
对于所有细菌和所有孵育时间,与医用级钛和peek相比时,氮化硅样品表现出较低的生物膜形成、较少的活细菌和较小的活菌死菌比。粗糙氮化硅表面在抑制细菌定植方面甚至比抛光表面更有效。此外,具有抛光表面或粗糙表面的氮化硅植入物在抑制细菌定植方面都显著优于钛或peek。
钛和peek的生物膜形成也比氮化硅高得多。例如,钛上的金黄色葡萄球菌的生物膜形成,在孵育72小时之后,是抛光氮化硅的三倍,并且在孵育72小时之后,是peek的八倍多。并且使用表面粗糙度为约1250nmra的相对粗糙的氮化硅,结果甚至更好。在72小时之后,在这种较粗糙的氮化硅上的金黄色葡萄球菌的生物膜形成小于抛光氮化硅上的金黄色葡萄球菌的生物膜形成的一半。
活细菌计数遵循类似的模式。当与氮化硅相比时,孵育72小时之后,钛和peek的活细菌计数在1.5倍与30倍之间。并且,同样,粗糙氮化硅优于抛光氮化硅。例如,对于铜绿假单胞菌,72小时之后,粗糙氮化硅(同样,约1250nmra)的活细菌计数为抛光氮化硅的活细菌计数的约五分之一。
氮化硅的活/死细菌比同样最低,并且粗糙氮化硅通常比抛光氮化硅更低。例如,在抛光氮化硅上孵育大肠杆菌72小时之后,活菌/死菌比是钛的三倍以上并且是peek的约两倍。对于粗糙氮化硅,活菌/死菌比是钛的约六倍,并且是peek的近三倍。
实施例2
在本研究中,测试了生物医学植入物材料吸附常见的骨形成蛋白的能力。与实施例1一样,测试粗糙氮化硅、抛光氮化硅、医用级钛和peek。测试的蛋白质为纤连蛋白、玻连蛋白和层粘连蛋白。进行酶联免疫吸附测定(elisa)20分钟、1小时和4小时。纤连蛋白、玻连蛋白或层粘连蛋白分别与第一兔抗牛纤连蛋白、抗玻连蛋白和抗层粘连蛋白直接连接。用abts底物试剂盒测量吸附到表面的每种蛋白质的量。用计算机软件分析分光光度计在405nm处的吸光度。elisa一式两份进行,并且每种基底重复三次不同的时间。
对于所有孵育时间,当与钛和peek相比时,氮化硅都表现出显著更大的纤连蛋白和玻连蛋白吸附。在孵育1小时和4小时时,与钛和peek相比,氮化硅也表现出更大的层粘连蛋白吸附。与抛光氮化硅表面相比,粗糙氮化硅表面(大约1250nmra)在蛋白质的吸附方面更有效。然而,两种氮化硅表面通常都优于钛或peek,特别是对于纤连蛋白和玻连蛋白。不受理论的限制,认为这些蛋白质优选吸附在氮化硅上是其改善的抗菌性的可能原因。
实施例3
在本研究中,使用wistar大鼠颅盖模型研究了体内骨形成、炎症和各种植入物材料的感染。所述研究考虑了这些材料的骨附着强度。在研究中使用粗糙氮化硅、医用级钛和peek。
所述研究通过使用标准技术将灭菌样品植入两岁wistar大鼠的颅盖中来进行。另一组样品先验地用表皮葡萄球菌接种,并植入第二组相似的wistar大鼠中。
在3天、7天、14天和90天处死动物。对每种植入物材料周围的巨噬细胞、细菌和生物膜蛋白的数量进行组织学定量。此外,进行推出测试以确定骨附着结果和性能。
使用未接种的样品3天之后,钛和peek植入物不稳定,并因此无法进行组织学检查。3天之后,如使用显微镜线性分析所测量的,氮化硅植入物(表面粗糙度为大约1250nmra)表现出约3%-5%的骨-植入物界面,并且如使用显微镜区域分析所测量的,在手术区域中表现出约16%-19%的新骨生长。
使用未接种的样品7天之后,钛和peek植入物不稳定,并因此无法进行组织学检查。相反,7天之后,氮化硅植入物在手术区域中表现出约19%-21%的骨-植入物界面和约28%-32%的新骨生长。
使用未接种的样品14天之后,钛植入物在手术区域中表现出约7%的骨-植入物界面和约11%的新骨生长。peek植入物在手术区域中表现出约2%的骨-植入物界面和约14%的新骨生长。相反,14天之后,氮化硅植入物在手术区域中表现出约23%-38%的骨-植入物界面和约49%-51%的新骨生长。
在没有接种的情况下90天之后,钛和peek植入物分别表现出约19%和8%的骨-植入物界面,并且分别表现约36%和24%的新骨生长。氮化硅植入物同样表现得更好。这些植入物表现出约52%-65%的骨-植入物界面和约66%-71%的新骨生长。
对于接种的样品,所有植入物都太不稳定,不能在第3天和第7天进行组织学检查。14天之后,钛植入物仅表现出约1%的骨-植入物界面、75%的细菌-植入物界面(使用显微线性分析测量)、在手术区域中的约9%的新骨生长以及在手术区域中的约45%的细菌生长。peek表现出基本上没有的骨-植入物界面、约2%的新骨生长和约25%的细菌生长。peek的细菌-植入物界面是不清楚的。接种的氮化硅植入物在14天之后表现出约3%-13%的骨-植入物界面。氮化硅植入物的新骨生长为约25%-28%,并且细菌生长为约11%-15%。
90天之后,接种的钛植入物表现出约9%的骨-植入物界面、约67%的细菌-植入物界面、约26%的新骨生长和约21%的细菌生长。peek植入物表现出约5%的骨-植入物界面、约95%的细菌-植入物界面、约21%的新骨生长和约88%的细菌生长。接种的氮化硅植入物在90天之后表现出约21%-25%的骨-植入物界面。氮化硅植入物的新骨生长为约为39%-42%,并且在90天之后没有可测量的细菌-植入物界面或细菌生长。事实上,90天之后在氮化硅植入物上没有检测到细菌。
在测量所有植入时间之后,无论是否接种,氮化硅植入物的推出强度都明显优于钛或peek植入物。在没有接种的情况下植入90天之后,氮化硅植入物的推出强度是钛的2倍多,并且是peek的2.5倍多。在接种的情况下,与钛和peek相比,氮化硅推出强度对于所有植入时间都甚至更好。氮化硅推出强度是钛或peek的推出强度的五倍多。这些结果表明,当与钛和peek相比时,氮化硅具有明显的骨附着。
通过获取颅盖的切片部分(包括植入物)并将颅盖固定到支撑板上的木块来测量推出强度。然后向植入物施加负载,并测量将植入物从颅盖移除所需的力。
组织学结果进一步证实了测试的推出强度。如上文所讨论的,在所有植入时间和所有接种条件下,当与钛和peek相比时,在氮化硅的颅盖缺陷区域中观察到显著更大的新骨生长。
实施例4
在本研究中,使用saos-2细胞系研究了各种植入物材料的骨传导性的体外评估。所述研究考虑了这些材料上的saos-2细胞增殖。在研究中使用氮化硅填充的peek(即,填充有15%α-si3n4、β-si3n4和β-siyalon粉末的peek)和单片peek基底材料。
通过使用标准技术将saos-2细胞接种到每种基底材料的方块(5x105个细胞/ml)上来进行所述研究。24小时之后,将细胞用bluehoechst33342进行染色,并通过荧光光谱法计数。7天之后完成细胞接种。通过荧光光谱法对细胞进行评估并计数,并且使用激光显微镜检查、拉曼光谱和扫描电子显微镜检查(sem)评估基底材料。
图6a-6d示出了各种基底上saos-2细胞的荧光光谱图像。图7是基于荧光显微镜检查的细胞计数结果的图。与单片peek相比,所有复合物均表现出快600%以上的saos-2细胞体外增殖。具有15%β-siyalon的peek表现出最大的增殖速率,其中比单片peek增加约770%。
图8a-8d示出了暴露于saos-2细胞之前和之后的基底材料的sem图像。图9是基底材料的3d激光显微镜检查结果的图,其示出了骨磷灰石体积。所有复合物的表现都优于单片peek。与具有saos-2细胞的单片peek相比,具有15%si3n4的peek表现出增加约100%的体外骨传导性。图10a和10b示出了暴露于saos-2细胞7天之后的β-siyalon填充的peek上的拉曼微探针光谱的结果。在所有复合物样品上证实了,暴露于saos-2细胞7天之后的表面凸起是骨羟基磷灰石。
与单片peek相比,所有负载有15%si3n4(α-或β)或β-siyalon的peek复合物都表现出大幅改善的saos-2细胞增殖。与单片peek相比,所有负载有15%si3n4(α-或β)或β-siyalon的peek复合物都表现出显著改善的saos-2细胞系的骨传导性。上述结果通过若干种不同的分析工具得到证实并经过统计学验证。
实施例5
在本研究中,使用表皮葡萄球菌研究了各种植入物材料的抗菌活性的体外评估。表皮葡萄球菌(s.epidermis)是重要的机会致病菌,定植于人皮肤上,导致矫形设备在插入过程中污染的可能性很高。仅在美国,由表皮葡萄球菌引起的与血管导管相关的血流感染相关的成本每年为约20亿美元。抗生素治疗由于其免疫逃避能力以及高风险的慢性疾病而变得复杂。
所述研究考虑了表皮葡萄球菌在这些材料上的活力。在研究中使用氮化硅填充的peek(即,填充有15%α-si3n4、β-si3n4和β-siyalon粉末的peek)和单片peek基底材料。培养表皮葡萄球菌(1x107cfu/ml),并且然后置于bhi琼脂中的基底材料样品中(1x108/ml)。24小时之后,通过微生物活力测定(wst)和荧光光谱法,通过添加dapi和cfda,并通过在450nm处的吸光度测量浓度,来评估细菌和样品。
图11a-11d示出了表皮葡萄球菌在各种基底上的dapi(细胞核)和cfda(活菌)染色的荧光显微图像。图12是各种基底上cfda/dapi染色阳性的细胞的结果的图。与单片peek相比,具有15%β-si3n4的peek对表皮葡萄球菌的体外抗菌性表现出约1个数量级的增加。图13是每种基底的wst测定结果(450nm处的吸光度)的图。与单片peek相比,具有15%β-si3n4的peek对表皮葡萄球菌的体外抗菌性表现出约100%的增加。
与单片peek相比,负载有15%β-si3n4或β-siyalon的peek复合物表现出大幅改善的抗菌性。具有15%α-si3n4的peek复合物不表现出与其他peek复合物相同程度的抗菌行为。上述结果显然超出了简单的混合定律改善,并示出了,相对低比例的β-si3n4相如何能够至少导致与单片peek相比100%改善的抗菌性。
上文讨论的每个实施例中的结果表明,在所有培养期间,与医用级钛和peek相比,氮化硅导致明显更好的对体外细菌定植和生物膜形成的抑制,并且导致所有研究细菌的低得多的活菌死菌比。氮化硅还表现出显著更高的三种蛋白质的体外吸附,这三种蛋白质可抑制细菌生长并促进干细胞分化为成骨细胞。这种优先吸附与氮化硅降低细菌功能的能力相关,并且可能是其中的致病因素。与单片钛和peek相比,氮化硅还表现出增强的体内骨生成和骨整合,并且表现出显著的抗菌性。
实施例中讨论的研究也倾向于表明粗糙氮化硅植入物在抗菌功能和/或骨生长和整合方面通常优于抛光氮化硅。这些结果表明,不仅单片氮化硅植入物和/或其他类似的陶瓷植入物可以进行表面粗糙化以便改善抗菌功能,而且也可以向其他植入物(氮化硅和非氮化硅二者,诸如金属、聚合物和/或其他陶瓷)施加氮化硅涂层。如上文所讨论的,此类涂层可进行表面粗糙化,以进一步改善抗菌功能并提供其他希望的特性。初步研究还倾向于表明,将表面粗糙度增加到超过实施例中所使用的水平—即约1250nmra—可进一步增加材料的抗菌功能。例如,在一些此类实施方案中,表面粗糙度可以大于约1,500nmra。在一些此类实施方案中,表面粗糙度可以大于约2,000nmra。在一些此类实施方案中,表面粗糙度可以大于约3,000nmra。在其他实施方案中,表面粗糙度可以在约500nmra与约5,000nmra之间。在一些此类实施方案中,表面粗糙度可以在约1,500nmra与约5,000nmra之间。在一些此类实施方案中,表面粗糙度可以在约2,000nmra与约5,000nmra之间。在一些此类实施方案中,表面粗糙度可以在约3,000nmra与约5,000nmra之间。
一些替代性陶瓷材料,例如像氧化铝和氧化锆(zro2),具有与氮化硅的性质类似的某些性质。因此,认为这些陶瓷材料或其他类似材料可表现出类似的抗菌效果和成骨效果。认为本领域普通技术人员在获得本公开的益处之后,能够识别此类替代性材料。还认为这些陶瓷材料或其他类似材料可表现出改善的抗菌功能和增加的表面粗糙度,与氮化硅陶瓷的情况一样。
通过以下附图将进一步理解另外的实施方案和实施方式。
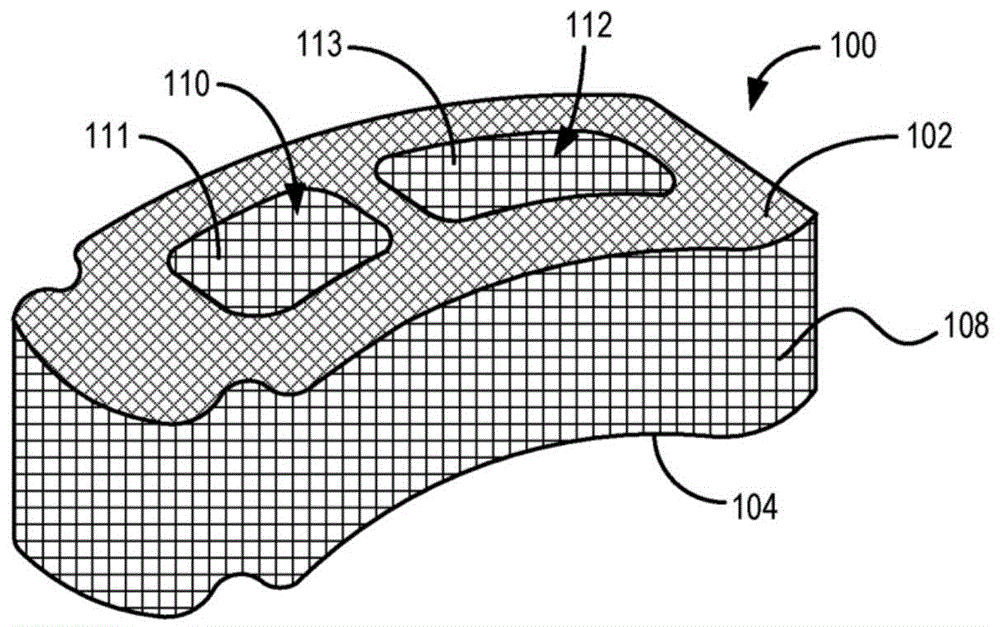
图1a描绘了脊柱植入物100。脊柱植入物100具有相对光滑的顶表面、底表面和侧表面(分别为102、104和108)。脊柱植入物100可包含氮化硅陶瓷材料或其他类似的陶瓷材料。脊柱植入物100还包括延伸穿过植入物的顶表面和底表面的两个开口110和112。在一些实施方案中,脊柱植入物100可包含掺杂的氮化硅材料,如上文更详细描述的。脊柱植入物100的一个或多个表面可以被粗糙化或纹理化,以提供氮化硅材料组成的表面的增加的表面积。例如,脊柱植入物100的一个或多个表面可以通过微机械加工、研磨、激光蚀刻或纹理化、喷砂或其他喷磨、化学蚀刻、热蚀刻、等离子蚀刻等进行粗糙化或纹理化。
图1b描绘了外表面102、104(在图中不可见的表面)和108中的每一个都已被粗糙化之后的脊柱植入物100。如上文所解释的,这种表面粗糙化改善了植入物的抗菌功能和特性。还可以使一个或多个内表面粗糙化。例如,分别限定开口110和112的内表面111和113也可以被粗糙化。根据需要,与外表面102、104和108的粗糙化相比,内表面粗糙化的程度可以相同、更大或更小。
图1c描绘了脊柱植入物100,其在顶表面和底表面上具有多个表面特征部或齿114。一旦定位在患者的椎间空间内,表面特征部114可以帮助防止或至少最小化植入物的迁移。表面特征部114可以在表面粗糙化发生之前或之后由植入物100形成。类似地,表面特征部114可另选地包含同样在表面粗糙化之前或之后附接到植入物100的另一种材料。
图2a描绘了脊柱植入物200的替代性实施方案。脊柱植入物200可包含任何合适的材料,诸如金属、聚合物和/或陶瓷。脊柱植入物200还包括涂层220。涂层220优选地包含氮化硅或掺杂的氮化硅陶瓷材料,但是设想具有与氮化硅类似的某些性质的其他陶瓷材料也可以另选地用作涂层。涂层220可以施加到任何暴露于或可能暴露于生物材料或活性的表面。例如,在所描绘的实施方案中,涂层220被施加到顶表面202、底表面204、侧表面208以及分别限定开口210和212的内表面211和213。可以施加涂层220以利用本文其他地方讨论的氮化硅的独特抗菌性质和特性。在一些实施方案中,涂层厚度可以在约5纳米至约5毫米之间的范围内。在一些优选的实施方案中,涂层厚度可以在约1微米与约125微米之间。
例如,因为在脊柱植入物中非常常见的peek在细菌环境中表现非常差,所以可以将氮化硅陶瓷涂层或层(或另一种类似材料)施加到peek脊柱植入物,以改善植入物的抗菌功能和/或提供如上文更详细讨论的其他优点。涂层可以通过本领域普通技术人员已知的任何合适的方法施加,所述方法诸如化学气相沉积(cvd)、物理气相沉积(pvd)、等离子体喷涂、电沉积或电泳沉积、浆料涂覆和/或高温扩散。
为了进一步增强植入物的抗菌特性,涂层220或涂层220的一个或多个部分,可以进行表面粗糙化,如图2b所示。涂层表面粗糙化可以应用于植入物的任何部分和所有部分,所述部分暴露于或可暴露于生物活性或材料。例如,在图2b所示的实施方案中,表面202、204、208、211和213中的每一个都已如上所述进行粗糙化或纹理化。在一些实施方案中,植入物的表面可以在涂覆之前被粗糙化或纹理化,代替涂层上的表面粗糙化或纹理化,或者除了表面粗糙化或纹理化之外。
本文所述的原理、材料和方法也可以应用于其他生物医学植入物。例如,图3a-3b和4a-4b示出了髋植入物300,其包括股骨柄330,所述股骨柄330被构造成能够被接纳在患者的股骨内;颈340和模块化髋臼头350,所述模块化髋臼头350构造成能够接纳球窝关节(未示出),其最终定位在髋臼杯内或患者的天然髋臼内。
可以将一个或多个涂层320施加到髋植入物300的股骨柄330,如图3a所示。在优选的实施方案中,涂层320包含氮化硅陶瓷材料。在替代性实施方案中,植入物的其他部分也可以涂覆有氮化硅陶瓷或另一种类似的材料。例如,根据需要,涂层320也可以施加到股骨柄330、颈340和/或模块化髋臼头350。
为了进一步增强植入物300的抗菌性质,植入物300的一个或多个表面/部分可以进行粗糙化和/或纹理化。例如,如图3b所示,包括涂层320的股骨柄330可以在已施加涂层320之后进行粗糙化和/或纹理化。另选地,在施加涂层320之前,可以使股骨柄330和/或植入物300(或本文所讨论的任何其他植入物)的任何其他所需区域进行粗糙化和/或纹理化。作为又一替代性方案,植入物的一个或多个表面可以在已施加抗菌涂层之前和之后进行纹理化和/或粗糙化。
图4a是沿着图3a中的线4a-4a截取的剖视图。如此图所示,涂层320仅沿着植入物300的股骨柄330部分延伸。然而,如上文所讨论的,在替代性实施方案中,涂层320也可以施加到植入物的其他部分(在一些实施方案中,涂层可以施加到整个植入物)。
图4b是沿着图3b中的线4b-4b截取的剖视图。此图示出了在粗糙化/纹理化处理已完成之后植入物300的股骨柄330的表面。
图5a和5b描绘了再其他替代性实施方案。这些图示出了骨螺钉500。例如,骨螺钉500可包括椎弓根螺钉。骨螺钉500包括球形头510和螺纹轴520。骨螺钉500,或者骨螺钉500的一个或多个部分,可包含氮化硅陶瓷材料。骨螺钉500的一个或多个部分或表面也可进行粗糙化或纹理化以改善植入物的抗菌特性或其他特性。例如,如图5b所示,螺纹轴520已进行粗糙化。螺钉500的头510可保持光滑或可抛光光滑,以在脊柱固定系统连接器内提供所需的关节。然而,对于其他实施方案,也可能希望使头510的表面进行粗糙化。这不仅可以提供本文所讨论的改善的抗菌特性,而且还可以提供希望的与脊柱固定系统的另一个部件的摩擦界面。
在其他实施方案中,骨螺钉500或本文公开的任何其他实施方案可包含另一种合适的材料,诸如钛。在此类实施方案中,可以将氮化硅涂层施加到植入物,而不是由氮化硅材料形成整个植入物。如上文所讨论的,涂层和/或涂层的下表面(即,原始植入物本身的表面)可以进行粗糙化或纹理化,以进一步改善抗菌特性和其他特性。
在再其他实施方案中,骨螺钉500或本文公开的任何其他实施方案可包含生物医学材料(诸如金属、陶瓷或聚合物),所述生物医学材料包括氮化硅填料,或者所述生物医学材料以其他方式将氮化硅材料掺入用于形成植入物的材料中。例如,氮化硅可以用作填料或以其他方式掺入聚合物中,诸如聚醚醚酮(peek)、聚(甲基丙烯酸甲酯)、聚(对苯二甲酸乙二酯)、聚(二甲基硅氧烷)、聚(四氟乙烯)、聚乙烯和/或聚氨酯。氮化硅也可以用作填料,以其他方式掺入用于形成其他生物医学植入物的其他材料中,诸如金属,包括例如,钛、银、镍钛诺、铂、铜和相关合金。作为再一替代性方案,氮化硅可以用作填料或以其他方式掺入其他材料中,诸如陶瓷和金属陶瓷中。通过将氮化硅掺入其他材料中,预期可以实现本文所述的一些抗菌优点和/或其他有利性质。氮化硅也可以掺入用作本文所述的一种或多种涂层的一部分的另一种材料中,以增加抗菌功能。
本领域的技术人员将理解,可在不背离本文所述的潜在原则的情况下,对上述实施方案的细节进行变化。例如,设想各种实施方案或其特征部的任何合适的组合。
本文所公开的任何方法包括用于进行所描述方法的一个或多个步骤或动作。方法步骤和/或动作可以彼此互换。换句话讲,除非实施方案的适当操作需要步骤或动作的特定顺序,否则可修改特定步骤和/或动作的顺序和/或使用。
贯穿本说明书,“一个实施方案(oneembodiment)”、“实施方案(anembodiment)”或“实施方案(theembodiment)”的任何提及意指关于所述实施方案所描述的特定特征部、结构或特性包括在至少一个实施方案中。因此,在整个说明书中引用的引证短语或其变型不一定都指代相同的实施方案。
类似地,应当理解,在上文实施方案的描述中,出于简化本公开的目的,有时将各种特征部组合在单个实施方案、附图或其描述中。然而,本公开的方法不应当被解释为反映任何权利要求需要比所述权利要求中明确叙述的特征部更多的特征部的意图。相反,本发明的方面在于少于任何单个前述公开实施方案的所有特征部的组合。本领域的技术人员将显而易见的是,可在不背离本文所述的潜在原则的情况下,对上述实施方案的细节进行变化。因此,本发明的范围只应由以下权利要求来决定。
- 还没有人留言评论。精彩留言会获得点赞!