包含(E)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-N-叔丁基苯甲酰胺的药物组合物和药物剂型,其制备方法、治疗方法及用途与流程
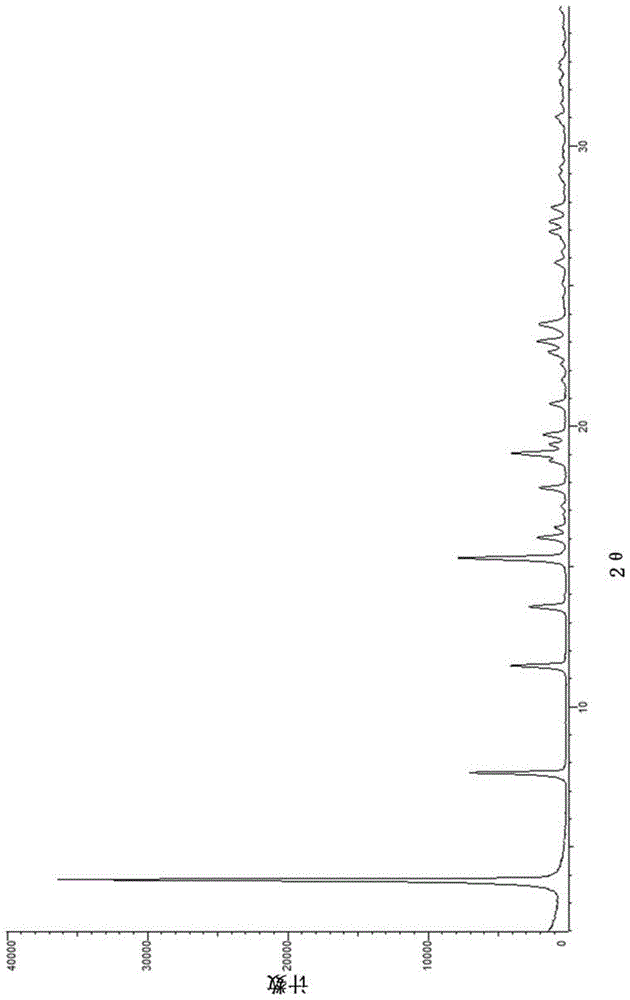
本发明涉及包含具有以下化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药学成分的药物组合物,特别涉及包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐以及一种或多种稳定剂的药物组合物。此外,本发明涉及包含此类药物组合物的药物剂型。此外,本发明涉及用于制备此类药物剂型的方法。此外,本发明涉及一种用于在有此需要的患者中预防纤维化疾病、代谢性疾病、炎性疾病、眼病、神经炎性疾病或癌症中的一种或多种,或减缓一种或多种所述疾病的进展,或延迟或治疗所述一种或多种疾病的方法,其特征在于将所述药物组合物或药物剂型向所述患者给药。此外,本发明涉及所述药物组合物或剂型在用于预防、延迟或治疗一种或多种上文或下文所述的疾病或减缓其进展的方法中的用途。另外,本发明涉及用于治疗非酒精性脂肪肝病(nafld)、非酒精性脂肪性肝炎(nash)或糖尿病性视网膜病变的方法。发明背景(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺是一种含铜胺氧化酶3(aoc3)的抑制剂,由wo2013/163675中已知(化合物23)。该国际申请中也描述了其合成及其用途。作为在上述疾病和病况的治疗中广泛使用(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺及其药学上可接受的盐的前提,需要提供包含满足通常标准的所述活性成分的药物组合物和/或药物剂型。药物组合物的通常标准包括:所述活性成分具有良好且可再现的生物利用度、可接受的形式和尺寸、可接受的保质期和良好的储存稳定性,即该活性成分随时间的降解度较低。例如,降解的接受标准之一是在36个月的储存后总降解不超过3.0%,优选地,在36个月的储存后总降解不超过1.5%或更低。当前,对于在纤维化疾病、代谢性疾病和眼病(例如非酒精性脂肪肝(nafl)疾病、非酒精性脂肪性肝炎(nash)或糖尿病性视网膜病变)方面具有良好功效并且同时符合药物组合物和剂型的标准化标准的方法、药物和药物组合物的医学需求尚未得到满足。发明目的本发明的目的为提供包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物,特别是涉及包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物,其具有可接受的储存稳定性。本发明的另一目的为提供包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物,特别是涉及包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物,所述药物组合物在储存过程中,显示出经时降解产物的形成减少和/或所述活性成分的经时降解率降低。本发明的另一目的为提供包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物,特别是包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物,其具有更长保质期。本发明的另一目的为提供包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物,特别是包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物,其避免或减少了对特殊储存条件(比如冷却)的需求。本发明的另一目的为提供包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物剂型,特别是包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物剂型,其具有短的崩解时间、具有良好的溶出特性和/或能够提高所述患者体内所述活性成分的生物利用度。本发明的另一目的为提供包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物,特别是包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物,其具有高含量均一性和/或允许在时间和成本方面有效生产含有所述药物组合物的药物剂型。本发明的另一目的为提供药物组合物和药物剂型,其各自包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐,特别是涉及包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物和药物剂型,其用于预防纤维化疾病、代谢性疾病、炎性疾病、眼病、神经炎性疾病或癌症中的一种或多种,或减缓一种或多种所述疾病的进展,或延迟或治疗所述一种或多种疾病的方法中。本发明的进一步的目的为提供用于在有此需要的患者中预防纤维化疾病、代谢性疾病、炎性疾病、眼病、神经炎性疾病或癌症中的一种或多种,或减缓一种或多种所述疾病的进展,或延迟或治疗所述一种或多种疾病的方法。本发明的另一目的为提供药物组合物和药物剂型,其各自包含具有上述化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐,特别是涉及包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物和药物剂型,其在用于预防纤维化疾病、代谢性疾病、炎性疾病、眼病、神经炎性疾病或癌症中的一种或多种,或减缓一种或多种所述疾病的进展,或延迟或治疗所述一种或多种疾病中有高药效,具有良好或非常好的药理学和/或药代动力学和/或理化性质。本发明的另一目的为提供用于制备根据本发明所述的药物组合物和药物剂型的方法,其在在成本和/或时间上有效。本发明的进一步的目的对于本领域技术人员而言,通过上文和下文的描述以及实施例将变得明显。技术实现要素:首先,制备包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐作为所述活性成分、甘露醇和硬脂酸镁为填充剂和润滑剂的常规药物组合物。然而,事实证明这些药物组合物的稳定性不令人满意,因此它们需要在8℃以下储存,即在冰箱中,以获得具有超过12个月的令人满意的保质期(参见实施例a中的表)。令人惊讶的是,后来发现包含具有以下化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药学成分的药物组合物,特别是包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物以及额外包含一种或多种、优选一种稳定剂,具有显著改善的在储存过程中的所述活性成分抗降解稳定性。因此,即使在室温(即,没有冷藏),也可获得令人满意的保质期。在一个方面,本发明提供包含具有以下化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药物成分,以及一种或多种稳定剂的药物组合物。在其它方面,本发明提供药物剂型,优选地固体药物剂型,例如片剂,其包含根据本发明所述的药物组合物。在一个实施方案中,根据本发明的所述药物组合物和药物剂型不包括泡腾制剂(包括例如泡腾颗粒或粉末)。在另一实施方案中,本发明不包括另外包含二氧化碳源(例如,碳酸氢钠或碳酸钠)的药物组合物和药物剂型。在另一方面,本发明提供用于在有此需要的患者中预防纤维化疾病、代谢性疾病、炎性疾病、眼病、神经炎性疾病或癌症中的一种或多种,或减缓一种或多种所述疾病的进展,或延迟或治疗所述一种或多种疾病的方法,其特征在于将如上文和下文所述的药物组合物或药物剂型向所述患者给药。在另一方面,本发明提供用于治疗非酒精性脂肪肝病(nafld)、非酒精性脂肪性肝炎(nash)或糖尿病性视网膜病变的方法,其特征在于将包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药物成分(api)的药物组合物或药物剂型,特别是如上文和下文所述的药物组合物或药物剂型向所述患者给药。在其它方面,本发明提供包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药物成分(api)的药物组合物或药物剂型的用途,特别是如上文和下文所述的药物组合物或药物剂型用于如上文和下文所述的方法中。在另一方面,本发明提供包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药物成分(api)的药物组合物或药物剂型,特别是如上文和下文所述的药物组合物或药物剂型用于如上文和下文所述的方法中的用途。在其它方面,本发明提供包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药物成分(api)的药物组合物或药物剂型的用途,特别是如上文和下文所述的药物组合物或药物剂型用于制备用于如上文和下文所述的方法中的用途的药物。在其它方面,本发明提供用于制备如上文和下文所述的药物组合物的方法,例如通过干法造粒或通过直接压片。在另一方面,通过用于制备如上文和下文所述的方法,可获得或获得本发明提供药物组合物。本发的其它方面对于本领域技术人员而言,通过上文和下文的描述以及实施例将变得明显。定义根据本发明所述的药物组合物的术语“活性成分”意指具有以下化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐,特别(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。优选地,使用所述活性成分的结晶形式比如“型i”,特别地如下文定义的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的结晶形式。“活性成分”在本文中有时也称为“活性物质”或“活性药物成分”或“api”。例如,在以下专利申请中描述了(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺及其盐及其合成方法:wo2013/163675(化合物23)。术语“治疗”和“治疗的”包含对已经发展出所述病症、特别是明显形式的患者的治疗性治疗。治疗性治疗可为对症治疗,以减轻特定适应症的症状,或对因治疗,以逆转或部分逆转适应症的病况,或停止或减缓疾病的进展。因此,例如,本发明所述的组合物和方法可用作一段时间内的治疗以及用于慢性治疗。术语“预防性治疗”、“预防性治疗的”和“预防”可互换使用,并且包含对有患上述病况风险的患者的治疗,从而降低了所述风险。术语“片剂”包含没有包衣的片剂和具有一种或多种包衣的片剂。此外,“术语”片剂包含具有一层、两层、三层或甚至更多层的片剂和压制-包衣片剂,其中每种前述类型的片剂可不具有或具有一种或多种的包衣。术语“片剂”还包括微型、熔融、可咀嚼和口腔崩解的片剂。术语“药典”是指标准药典,例如“usp31–nf26throughsecondsupplement”(美国药典)或“europeanpharmacopoeia6.3”(欧洲药品和卫生质量总局,2000-2009)。附图简述图1:(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i的xrpd谱图。图2:(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i的dsc曲线。图3:给药(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(api)或给药地塞米松或不给药(对照)的氧致视网膜病变小鼠模型中的新血管簇形成。图4:在对照组以及给药和没有给药(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(api)的高血糖stz-诱导的糖尿病大鼠中测量的标准化光敏度(s/s对照)。发明详述根据本发明的方面,特别地,所述药物组合物、方法以及用途,是指具有以下化学结构的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为活性药学成分,特别指(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。根据本发明的实施方案,所述药物组合物或所述药物剂型仅包含一种活性药物成分,其为所述化合物(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐。根据本发明应当理解的是,该化合物的定义也包括其水合物、溶剂合物和其多晶型形式,以及其前药。化合物(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的优选固体形式为“型i”,即结晶、高熔点、稳定形式的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐,其不易发生多晶型转化。发现型i包含水:(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐相对于h2o的摩尔比率为3:1至5:1,更具体为4:1;因此,可认为型i是四水合物。型i的x射线粉末衍射(xrpd)峰在实施例和实验数据部分给出。因此,特别地,型i的特征在于xrpd谱图包含在3.82、7.63、13.55和15.29度2θ处的峰,具体地包含在3.82、7.63、13.55、15.29、16.03和17.80度2θ处的峰,更具体地包括在3.82、7.63、11.46、13.55、15.29、16.03、17.80和19.02度2θ处的峰(对于上述所有峰:使用cukα辐射,±0.2度2θ)。型i的特征还在于约181℃±5℃的熔点(其通过差示扫描量热法(dsc)测定;评估为起始温度;加热速率10℃/min)。型i的dsc曲线如图2所示。(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i可通过根据本领域已知的方法合成的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的重结晶获得。(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐可有利地从溶剂体系中进行重结晶,该体系选自水/乙醇/乙酸乙酯、水/异丙醇/乙酸乙酯、异丙醇/乙酸乙酯/mtbe、甲醇/乙酸乙酯、水/乙酸异丙酯/丙酮和水/异丙醇/庚烷,其优选地选自水/乙醇/乙酸乙酯、水/异丙醇/乙酸乙酯和异丙醇/乙酸乙酯/mtbe;更优选地,该溶剂体系为异丙醇/乙酸乙酯/mtbe,其中异丙醇和乙酸乙酯的体积比率的范围为约1:1至约1:0.75,且其中异丙醇和mtbe的体积比率的范围为约1:0.9至约1:0.65,例如,三者的体积比率为9:8:7。通过本领域技术人员已知的方法从溶液中分离(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i,所述方法包括但不限于进行离心和过滤。特别地,通过包括过滤、洗涤滤饼并在真空下干燥的方法分离(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。优选用溶剂或溶剂混合物洗涤所获得的晶体,其中该溶剂优选选自mtbe和庚烷/异丙醇的3:1(v/v)混合物,随后为庚烷。最优选的溶剂是mtbe。优选地,在真空中的干燥步骤中,例如在约60℃、约5至12小时,有利地从该晶体中除去残留的溶剂。可选择该干燥步骤的温度、压力和持续时间,以便将一种或多种的残余溶剂的含量降低到给定值以下。根据本发明所述的药物组合物或药物剂型优选地包含以其型i存在的如上文和下文所定义的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在一个实施方案中,所述活性成分占所述药物组合物的重量的25%或更低。优选地,所述活性成分占所述药物组合物的重量的0.5%至25%。更优选地,所述活性成分占所述药物组合物的重量的1.0%至15%。甚至更优选地,所述活性成分占所述药物组合物的重量的3.5%至10%。根据另一实施方案,所述活性成分占所述药物组合物的重量的1.5%至10%。根据本发明所述的药物组合物包含一种或多种的稳定剂。所述稳定剂优选地为酸性稳定剂,特别是酸。优选地所述稳定剂是有机酸,更优选地是二质子酸,特别是二羧基的有机酸,例如包含3-10个、特别是4-8个或4-6个c原子,其可包含一个或多个的羟基,例如α-羟基。有机酸可以是氨基酸,特别是氨基酸盐酸盐。更优选地,所述稳定剂选自l-谷氨酸盐酸盐、富马酸和酒石酸。优选的所述稳定剂的实例为l-谷氨酸盐酸盐以及酒石酸。在一个实施方案中,l-谷氨酸盐酸盐用作稳定剂。在另一实施方案中,酒石酸用作稳定剂。在另一实施方案中,富马酸用作稳定剂。在一个实施方案中,所述稳定剂占所述药物组合物的重量的20%或更低。在一个实施方案中,所述稳定剂占所述药物组合物的重量的0.5%或更高。优选地,所述稳定剂占所述药物组合物的重量的1%至15%。更优选地,所述稳定剂占所述药物组合物的重量的1%至10%。根据本发明的实施方案,所述稳定剂占所述药物组合物的重量的1%至5%。根据另一本发明的实施方案,所述稳定剂占所述药物组合物的重量的2%至5%。在一个实施方案中,所述稳定剂与所述活性成分的摩尔比率为约30:1或更低,特别地约10:1或更低,例如约5:1或更低。在一个实施方案中,所述稳定剂比所述活性成分的摩尔比率为约1:5或更高,特别地约1:4或更高,例如约1:3或更高,或例如约1:2或更高。根据此实施方案的一个方面,所述稳定剂比所述活性成分的摩尔比率的范围为约1:3至约20:1。根据此实施方案的另一个方面,所述稳定剂比所述活性成分的摩尔比率的范围为约1:3至约10:1或约1:2至约5:1。在一个方面,本发明提供包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物,特别是包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐作为活性药学成分,以及一种或多种、优选地一种如上文所定义的稳定剂以及一种或多种赋形剂的药物组合物。下面详述在根据本发明所述的药物组合物中适合的赋形剂。优选地,根据本发明所述的药物组合物额外包含一种或多种稀释剂。例如,根据本发明的适合的稀释剂(也称为填充剂)为乳糖,特别地乳糖一水合物、纤维素及其衍生物,比如粉末状纤维素、微晶或硅化微晶纤维素、纤维素乙酸盐、淀粉及其衍生物,例如预胶化淀粉、玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、可灭菌玉米、氯化钠、碳酸钙、磷酸钙、尤其是二元磷酸钙、硫酸钙、磷酸二钙或磷酸三钙、碳酸镁、氧化镁、糖及其衍生物,比如蜜饯糖、果糖、蔗糖、右旋糖(dextrate)、糊精、d-山梨糖醇磺基丁基醚β-环糊精、右旋糖、聚右旋糖、海藻糖、麦芽糖、麦芽糖醇、甘露醇、麦芽糖糊精、山梨糖醇、菊糖、木糖醇、赤藓糖醇、异麦芽酮糖醇(isomalt)、高岭土和乳糖醇。根据本发明的实施方案,所述稀释剂为甘露醇。根据本发明所述的药物组合物也可包含一种或多种润滑剂。适合的根据本发明的润滑剂为硬脂酸及其盐,特别是其碱金属盐和碱土金属盐,包括硬脂酸钠、硬脂酸钙、硬脂酸锌、硬脂酸镁、硬脂富马酸钠和单硬脂酸甘油酯。优选的润滑剂为硬脂酸镁。在所述药物组合物或药物剂型中,此类润滑剂的浓度为0.25-5%,优选0.5-2%。任选地,根据本发明所述的药物组合物进一步包含一种或多种的粘合剂。通常,在药物组合物中使用的任何粘合剂均可用于本发明的上下文中。例如,粘合剂为天然存在的或部分或全部合成的聚合物,其选自阿拉伯树胶、琼脂、海藻酸、卡波姆、羧甲基纤维素钠、角叉菜胶、纤维素乙酸邻苯二甲酸酯、长角豆胶(ceratonia)、壳聚糖、蜜饯糖、共聚维酮、聚维酮、棉籽油、右旋糖、糊精、右旋糖、聚葡萄糖、麦芽糖糊精、麦芽糖、纤维素及其衍生物,例如微晶纤维素、甲基纤维素、葡萄糖、麦芽糖、麦芽糖、纤维素及其衍生物。甲基纤维素、乙基纤维素、羟基乙基纤维素、羟基乙基甲基纤维素、羟基丙基纤维素、羧基甲基纤维素、羟丙甲纤维素(纤维素羟基丙基甲基醚)、淀粉及其衍生物,如预胶化淀粉、羟基丙基淀粉、玉米淀粉、明胶、山嵛酸甘油酯(glycerylbehenate)、黄蓍胶、瓜尔豆胶、氢化植物油、菊粉、泊洛沙姆、聚卡波非、聚环氧乙烷、聚乙烯吡咯烷酮、n-乙烯基吡咯烷酮和乙酸乙烯基酯的共聚物、聚甲基丙烯酸酯、聚乙二醇,海藻酸盐(例如海藻酸钠),明胶、蔗糖、葵花籽油、玉米蛋白及其衍生物和混合物。任选地,根据本发明所述的药物组合物进一步包含一种或多种的崩解剂。例如,根据本发明的适合的崩解剂为粉末状的纤维素、交聚维酮、交联羧甲基纤维素钠、多库酯钠、低取代的羟基丙基纤维素、硅酸镁铝、微晶纤维素、波拉克林钾(polacrilinpotassium)、淀粉羟乙酸钠、淀粉,特别是预胶化淀粉和玉米淀粉。最后,可使用任选的额外的添加剂,例如着色剂或调味剂。在一个实施方案中,所述药物组合物或药物剂型(例如片剂)包含:在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分1.0–15一种或多种稳定剂1.0-10一种或多种稀释剂70–98任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分1.5–10一种或多种稳定剂1-5一种或多种稀释剂85–95任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分3.5–10一种或多种稳定剂1-5一种或多种稀释剂85–95任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分0.5–25一种或多种稳定剂0.5–10一种或多种稀释剂60–99润滑剂0.25–5.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在一个实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分0.5–25l-谷氨酸盐酸盐1.0-10甘露醇63–98硬脂酸镁0.5–2.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分3.5–10l-谷氨酸盐酸盐1.0-5.0甘露醇83–94硬脂酸镁0.5–2.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分0.5–25酒石酸1.0-10甘露醇63–98硬脂酸镁0.5–2.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分3.5–10酒石酸1.0-5.0甘露醇83–94硬脂酸镁0.5–2.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分1.5–10酒石酸1.0-5.0甘露醇83–94硬脂酸镁0.5–2.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在另一实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分0.5–25富马酸1.0–10甘露醇63–98硬脂酸镁0.5–2.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。在一个实施方案中,所述药物组合物或药物剂型(例如片剂)包含:量(%以重量计)活性成分3.5–10富马酸1.0–5.0甘露醇78–91硬脂酸镁0.5–2.0任选的额外添加剂加至100%在一个方面,所述活性成分为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。所述药物组合物可被配制成片剂、颗粒剂、细颗粒剂、粉末、胶囊、囊片、软胶囊、丸剂、可咀嚼片剂、糖锭、速溶片剂、口服速分散片剂等形式。优选地,根据本发明所述的药物组合物为速释制剂。在一个方面,根据本发明所述的药物组合物为固体药物组合物,例如用于口服给药固体药物组合物。根据本发明的剂型可为片剂。所述片剂可任选地被薄膜包衣。通常,薄膜衣占总组合物总重量的2-5%,并且优选包含成膜剂、增塑剂、防粘连剂和任选地一种或多种颜料。示例性的包衣组合物可包含羟丙基甲基纤维素(hpmc)、聚乙二醇(peg)、滑石粉、二氧化钛和任选的氧化铁,包括氧化铁红和/或氧化铁黄。例如,根据本发明的薄膜包衣包含48%羟丙甲纤维素、14%聚乙二醇、18%氧化钛、18%滑石粉以及2%氧化铁红(red02f250006int)。在一个方面,根据本发明的薄膜包衣包含量(%以重量计)成膜剂30-70一种或多种的增塑剂1-20一种或多种防粘连剂5-30一种或多种着色剂0-30任选的额外添加剂加至100%为了平衡根据本发明所述的药物组合物和药物剂型的稳定性和可制造性,可通过本领域技术人员公知的方法来优化成分、特别是稳定剂和润滑剂的确切范围。在另一方面,本发明提供直接压片法,用于制备药物组合物,其中所述方法包含下述步骤:(1)在搅拌器中预混合所述活性成分和所述赋形剂的主要部分以及稳定剂,以获得预混合物;(2)任选地通过筛子干筛所述预混合物,从而分离粘结性粒子以及提高含量的均匀性;(3)在搅拌器中将步骤(1)或(2)的所述预混合物混合,任选地通过添加剩余的赋形剂至所述混合物中,并持续搅拌;(4)通过在适合的压片机上压制所述步骤(3)的最终混合物而将其制片,以生产片芯;(5)任选地将步骤(4)的所述片芯用薄膜衣进行薄膜包衣。在另一方面,本发明提供可经上述方法获得的药物组合物。在另一方面,本发明提供干法造粒方法,用于制备药物组合物,其中所述方法包含下述步骤:(1)在搅拌器中,将所述活性成分与全部或部分的所述赋形剂和稳定剂混合;(2)在适合的辊式压实机上将所述步骤(1)的混合物压实;(3)通过适当的研磨或过筛步骤将在步骤(2)中获得的带状物还原为颗粒,优选小颗粒;(4)任选地在搅拌器中将步骤(3)的所述颗粒与剩余的赋形剂混合,以获得所述最终混合物;(5)通过在适合的压片机上压制所述步骤(3)的颗粒或所述步骤(4)的最终混合物而将其制片,以生产片芯;(6)任选地对步骤(5)的所述片芯用薄膜衣进行薄膜包衣。在另一方面,本发明提供可经上述方法获得的药物组合物。除上述方法外,本发明所述的药物组合物和药物剂型还可通过本领域技术人员已知的其它方法来制备,例如通过湿法制粒法。根据本发明所述的药物组合物在室温(例如,20℃),可储存超过12个月,优选最多36个月。在这些储存条件下,未观察到所述活性成分的不利降解。因此,不需要在低于8℃的温度储存根据本发明所述的药物组合物。就药物剂型(比如片剂和胶囊)的时间和成本而言,根据本发明所述的药物组合物允许较高的含量均一性和有效的生产。此外,在一个实施方案中,这些药物剂型特别地为片剂。因此,在另一方面,本发明提供包含根据本发明所述的药物组合物的药物剂型。在一个方面,根据本发明所述的药物剂型为固体药物剂型,例如用于口服给药的固体药物剂型。在另一方面,本发明提供用于制备根据本发明所述的药物剂型的方法,其包括一种或多种造粒方法,其中将所述活性药物成分与一种或多种赋形剂一同造粒。在另一方面,本发明提供用于制备根据本发明所述的药物剂型的方法,其包括一种或多种直接压片法。可发现的是,包括(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物或药物剂型,特别是包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的药物组合物或药物剂型,可有利地用于预防、延迟或治疗患者中一种或多种如上文和下文所述的疾病或减缓其进展。根据一个方面,本发明涉及用于在有此需要的患者中预防纤维化疾病、代谢性疾病、炎性疾病、眼病、神经炎性疾病或癌症中的一种或多种,或减缓一种或多种所述疾病的进展,或延迟或治疗所述一种或多种疾病的方法,其特征在于向所述患者给药如上文和下文所定义的药物组合物或药物剂型。根据此方面的实施方案,本发明涉及用于在有此需要的患者中预防、延迟或治疗纤维化疾病的方法或减缓所述纤维化疾病进展的方法,该疾病选自囊性纤维化、间质性肺疾病,包括特发性肺纤维化,包括非酒精性脂肪性肝炎(nash)、酒精引起的脂肪肝、酒精引起的肝纤维化在内的肝纤维化,中毒性肝炎和肝硬化、肾脏纤维化、硬皮病(scleroderma)、放射引起的纤维化和其它过度纤维化导致疾病病理的疾病,所述方法的特征在于向所述患者给药如上文和下文所定义的药物组合物或药物剂型。根据此方面的实施方案,本发明涉及用于在有此需要的患者中预防、延迟或治疗代谢性疾病的方法或减缓所述代谢性疾病进展的方法,该疾病选自前期糖尿病、1型糖尿病、2型糖尿病、与糖尿病相关的并发症、超重、肥胖、受损的葡萄糖耐量(igt)、空腹血糖异常(ifg)、高血糖、餐后高血糖、胰岛素抵抗、脂肪肝(包括非酒精性脂肪肝病(nafld))、超重、肥胖、代谢综合征,其特征在于向所述患者给药如上文和下文所定义的药物组合物或药物剂型。与糖尿病有关的并发症包括白内障、微血管和大血管疾病,比如糖尿病性肾病、肾小球硬化症、糖尿病性视网膜病变、脉络膜新生血管形成、非酒非酒精性脂肪肝(nafl)病、非酒精性脂肪性肝炎(nash)、糖尿病性神经病、糖尿病性疼痛、组织贫血、糖尿病足、糖尿病性溃疡、动脉硬化、心肌梗塞、急性冠状动脉综合征、不稳定型心绞痛、稳定型心绞痛、中风、外周动脉闭塞性疾病、心肌病、心力衰竭、心血管死亡、心律失常和血管再狭窄。根据此方面的另一实施方案,本发明涉及在有此需要的患者中用于预防选自以下的炎性疾病、减缓选自以下的炎性疾病的进展、或者延迟或治疗选自以下的炎性疾病的方法:关节炎(包括青少年类风湿性关节炎)、克罗恩氏病、溃疡性结肠炎、炎性肠病(例如肠易激症)、银屑病、哮喘(例如嗜酸性粒细胞性哮喘、重度哮喘、病毒性加重性哮喘)、肺炎炎症、慢性肺阻塞性疾病(copd)、支气管扩张、皮肤炎症、眼病、接触性皮炎、肝脏炎症、肝脏自身免疫性疾病、自身免疫性肝炎、原发性胆汁性肝硬化、硬化性胆管炎、自身免疫性胆管炎、酒精性肝病、动脉硬化、慢性心力衰竭、充血性心力衰竭、缺血性疾病、中风及其并发症、心肌梗塞及其并发症、中风后炎性细胞破坏、滑膜炎、全身性炎性脓毒症、糖尿病引起的炎症、与囊性纤维化有关的肺部炎症、其它细菌引起的肺部疾病(比如脓毒症)、急性呼吸性窘迫综合征(ards)、急性肺损伤(ali)、输血诱导的肺损伤(trali),其特征在于向所述患者给药如上文和下文所定义的药物组合物或药物剂型。根据此方面的另一实施方案,本发明涉及在有此需要的患者中用于预防、延迟或治疗眼病或减缓所述眼病进展的方法,该眼病包括黄斑变性(包括糖尿病性黄斑水肿)、葡萄膜炎和视网膜病变(包括糖尿病性视网膜病变),其特征在于向所述患者给药如上文和下文所定义的药物组合物或药物剂型。根据此方面的另一实施方案,本发明涉及用于在有此需要的患者中预防、延迟或治疗神经炎性疾病的方法或减缓所述神经炎性疾病进展的方法,该疾病选自中风、帕金森氏病、阿尔茨海默氏病、血管性痴呆、多发性硬化症、慢性多发性硬化症,其特征在于向所述患者给药如上文和下文所定义的药物组合物或药物剂型。根据此方面的另一实施方案,本发明涉及在有此需要的患者中用于预防、延迟或治疗癌症的方法或减缓所述癌症进展的方法,该癌症选自肺癌、乳腺癌、大肠癌、肛门癌、胰腺癌、前列腺癌、卵巢癌、肝胆管癌、食道癌瘤、非霍奇金淋巴瘤、膀胱癌瘤、子宫癌瘤、神经胶质瘤、成胶质细胞瘤、成神经管细胞瘤和其它脑肿瘤、肾癌、头颈癌、胃癌、多发性骨髓瘤、睾丸癌、生殖细胞瘤、神经内分泌肿瘤、宫颈癌、胃肠道、乳腺癌和其它器官的类癌;印戒细胞癌瘤、间充质瘤,包括肉瘤、纤维肉瘤、血管瘤(haemangioma)、血管瘤病(angiomatosis)、血管外皮细胞瘤、假血管瘤性间质增生、成肌纤维细胞瘤、纤维瘤病、炎性肌纤维母细胞瘤、脂肪瘤、血管脂肪瘤、颗粒细胞瘤、神经纤维瘤、神经鞘瘤、血管肉瘤、脂肪肉瘤、横纹肌肉瘤、骨肉瘤、平滑肌瘤或平滑肌肉瘤,其特征在于向所述患者给药如上文和下文所定义的药物组合物或药物剂型。根据另一方面,本发明涉及在有此需要的患者中用于治疗非酒精性脂肪肝病(nafld)或非酒精性脂肪性肝炎(nash)的方法,特别是伴有肝纤维化的nash,例如伴有第二和第三阶段肝纤维化的nash,其特征在于向所述患者给药包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物作为活性药物成分(api),优选地根据本发明所述的药物组合物。例如,所述患者为有nas(nafld活性评分)大于或等于4的患者。优选的所述api用于每天一次口服给药的剂量为关于(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的1mg、2mg、2.5mg、3mg、4mg、5mg、6mg、7mg、7.5mg、8mg、9mg、10mg、12.5mg、15mg、20mg或25mg,特别地3mg、5mg、6mg或10mg。根据本发明的此方面的实施方案,所述药物组合物包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为唯一一种活性药物成分。给具有nafld、nash和/或肝纤维化的患者给药所述药物组合物的效果可通过肝脏炎症和/或肝功能的相关生物标志物的变化、特别是降低而被观察到,所述生物标志物例如为alt(丙氨酸氨基转移酶)、ast(天冬氨酸氨基转移酶)、ap(碱性磷酸酶)、γ-gt(γ-谷氨酰胺转移酶)、ck-18(细胞角蛋白18)片段或hvpg(肝静脉压力梯度)。此外,可以通过改善例如脂肪变性、纤维化、肝僵硬或健康相关的生活质量的程度或阶段来观察向患有nafld、nash和/或肝纤维化的患者给药所述药物组合物的效果。观察到的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺在眼病内模型中的作用表明神经元功能的改善和病理性新血管生成的预防,因此主张预防视力丧失和新血管形成。实验部分中描述的数据支持该活性成分在治疗患有糖尿病性视网膜病变,包括非增殖性和增殖性糖尿病性视网膜病变的患者的方法中的用途,并防止其发展为增殖性糖尿病性视网膜病变。根据进一步的方面,本发明涉及在有此需要的患者中用于治疗糖尿病性视网膜病变的方法,其特征在于向所述患者特别是所述没有糖尿病性黄斑水肿的患者给药包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物作为活性药物成分(api)的、优选如本发明所述的药物组合物。优选的所述api用于口服给药的剂量为每天一次或每天1至25mg、更优选地2.5至15mg或5至12.5mg,最优选地2.5至10mg或5至10mg,特别地2.5mg、3mg、5mg、6mg、7.5mg、10mg或12.5mg,例如5mg、7.5mg或10mg,所有量为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺游离碱的量。所述api用于每天一次口服给药的剂量优选为1mg、2mg、2.5mg、3mg、4mg、5mg、6mg、7mg、7.5mg、8mg、9mg、10mg、12.5mg、15mg、20mg或25mg,特别是3mg、5mg、6mg或10mg,例如10mg的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺。根据本发明的此方面的实施方案,所述药物组合物包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为唯一一种活性药物成分。根据此方面的实施方案,所述患者具有糖尿病,例如1型或2型糖尿病。根据此方面的实施方案,所述糖尿病性视网膜病变为非增殖性糖尿病性视网膜病变(npdr),其中所述患者不具有糖尿病性黄斑水肿(dme),特别地,所述患者不具有中心性糖尿病性黄斑水肿(ci-dme)。例如,所述患者具有中度或严重nprd而没有ci-dme,或所述患者具有npdr而没有ci-dme,以及nprd水平47或53,如通过使用所述糖尿病性视网膜病变严重程度(drss)所测量的。优选的和示例的剂量已在上文关于用于治疗糖尿病性视网膜病变的方法中描述。根据此方面的另一实施方案,本发明涉及在糖尿病性视网膜病变的患者中用于改善视网膜病变的方法,特别是在患有非增殖性糖尿病性视网膜病变(npdr)的患者中,其中所述患者不具有糖尿病性黄斑水肿(dme),特别地其中所述患者不具有中心性糖尿病性黄斑水肿(ci-dme),其特征在于向所述患者给药包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的药物组合物作为活性药物成分(api),优选地根据本发明所述的药物组合物。例如,所述患者具有中度或严重nprd而没有ci-dme,或所述患者具有npdr而没有ci-dme,以及nprd水平47或53,如通过使用所述糖尿病性视网膜病变严重程度(drss)所测量的。例如,所述糖尿病性视网膜病变、特别是视网膜病变的改善可通过使用所述糖尿病性视网膜病变严重程度(drss)来测定。或者,可根据最佳矫正视力(bcva)来确定眼睛的改善情况。优选的和示例的剂量已在上文关于用于治疗糖尿病性视网膜病变的方法中描述。根据此实施方案,所述药物组合物可包含(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐作为唯一一种活性药物成分。根据此方面的另一实施方案,所述糖尿病性视网膜病变为非增殖性糖尿病性视网膜病变,其中所述患者具有糖尿病性黄斑水肿(dme)。根据此方面的实施方案,所述糖尿病性视网膜病变为增殖性糖尿病性视网膜病变,其中所述患者不具有糖尿病性黄斑水肿(dme)。根据此方面的另一实施方案,所述糖尿病性视网膜病变为增殖性糖尿病性视网膜病变,其中所述患者具有糖尿病性黄斑水肿(dme)。根据本发明的此方面的实施方案,所述方法包括预防、逆转、延迟、减缓或停止所述患者中非增殖性糖尿病性视网膜病变(npdr)至增殖性糖尿病性视网膜病变的进展,特别是在没有糖尿病性黄斑水肿(dme)的患者中,特别地,其中所述患者不具有中心性糖尿病性黄斑水肿(ci-dme)。例如,所述患者具有中度或严重nprd而没有ci-dme,或所述患者具有npdr而没有ci-dme,以及nprd水平47或53,如通过使用所述糖尿病性视网膜病变严重程度(drss)所测量的。优选的和示例的剂量已在上文关于用于治疗糖尿病性视网膜病变的方法中描述。根据本发明的此方面的实施方案,所述方法包括预防、逆转、延迟、减缓或停止非增殖性糖尿病性视网膜病变(npdr)或增殖性糖尿病性视网膜病变(pdr)至糖尿病性黄斑水肿(dme)的进展,特别是所述患者的中心性糖尿病性黄斑水肿,特别地在没有糖尿病性黄斑水肿的患者中。优选的和示例的剂量已在上文关于用于治疗糖尿病性视网膜病变的方法中描述。根据本发明的此方面的实施方案,所述方法包括预防、逆转、延迟、减缓或停止患者、特别是没有糖尿病性黄斑水肿的患者的新血管形成。根据此实施方案的一个实施例,所述患者具有糖尿病性视网膜病变,特别是非增殖性糖尿病性视网膜病变。优选的和示例的剂量已在上文关于用于治疗糖尿病性视网膜病变的方法中描述。通过向患者给药api,可观察到视网膜氧化应激、低氧、炎症、血管生成、晚期糖基化终产物的减少,从而导致糖尿病性视网膜病变的稳定和/或治愈。所述药物组合物对患有糖尿病性视网膜病变患者给药的效果(该糖尿病性视网膜病变例如非增殖性或增殖性糖尿病性视网膜病变)可由糖尿病性视网膜病变严重程度(drss)中的bcva(最佳矫正视力)、与健康相关的生活质量或对急救治疗的需求的改善来观察到,所述急救治疗例如prp(全视网膜光凝,panretinalphotocoagulation)、抗vegf和/或对糖尿病性视网膜病变的并发症的治疗,该并发症例如青光眼、玻璃体出血和视网膜脱落。根据本发明所述的药物组合物和方法在治疗和预防如上文所述的疾病和病况时显示出有利的作用。例如,可关于药效、剂量强度、剂量频率、药效学特性、药代动力学特性、减少不良反应、便利性、依从性等观察到有利的作用。当本发明提及需要治疗或预防的患者时,它主要涉及人类的治疗和预防,但该药物组合物也可以相应地用于哺乳动物的兽医学中。在本发明的范围内,成年患者优选是18周岁以上的人。以下描述了在根据本发明所述的药物组合物、药物剂型或方法中使用的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐的量的优选范围。这些范围是指每天对成年患者、特别是对人的每日给药量,例如大约70kg体重的人,并且针对其它给药途径以及患者年龄,可相应地调整为给药2次、3次、4次或更多次。对所述活性成分(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺计算剂量和量的范围。优选的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(其作为其药学上可接受的盐、特别地作为(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐来使用)的量的范围为0.5至25mg(其为碱化合物即(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的量),优选地为1至20mg,甚至更优选地为1至10mg,例如3至10mg。优选的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的剂量为例如1mg、2mg、2.5mg、3mg、4mg、5mg、6mg、7mg、7.5mg、8mg、9mg、10mg、12.5mg、15mg、20mg或25mg,特别是2.5mg、3mg、5mg、6mg或10mg。所有的量以mg计,其优选涉及所述碱性化合物(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺、即作为游离碱的所述api的量。根据实施方案,根据本发明所述的药物组合物包含:(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐、特别是(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐作为活性药学成分;以及一种或多种稳定剂、特别是一种稳定剂,所述稳定剂选自l-谷氨酸盐酸盐和酒石酸,特别是酒石酸,其中所述活性成分的量的范围为所述药物组合物重量的0.5至25%,且其中所述稳定剂与所述活性成分的摩尔比率的范围为约1:3至约20:1,特别是约1:2至约10:1;以及一种或多种赋形剂,例如一种或多种稀释剂。优选的一种或多种稀释剂的量为所述药物组合物的量的70至98%。此外,所述药物组合物可包含额外的添加剂,例如一种或多种润滑剂。根据实施方案,根据本发明所述的药物剂型为固体药物剂型,其包含根据上文所述的实施方案的所述药物组合物,其中所述活性药物成分的量按碱化合物(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(即作为游离碱的所述活性成分)计为1至10mg,例如1、2.5、3、5、6或10mg。根据此实施方案的一个方面,所述固体药物剂型为片剂,例如薄膜衣片剂。所述药物组合物或剂型的给药一天最多可发生3次,优选地一天1次或2次,最优选地一天1次。在本发明的范围内,所述药物组合物优选口服给药。根据本发明的药物组合物可包括在片剂、胶囊或薄膜衣片剂内。在一个实施方案中,根据本发明所述的药物剂型具有溶出性质,使得所述药学上的活性成分的重量在45分钟时至少75%,优选地至少80%,优选地至少90%被溶出。在另一实施方案中,在30分钟后,所述药学上的活性成分的重量的至少75%,优选地至少80%,优选地至少90%被溶出。在另一实施方案中,在15分钟后,所述药学上的活性成分的重量的至少65%,优选地至少75%,优选地至少80%,优选地至少90%被溶出。该溶出性质可在标准溶出测试中测定,例如在药典中描述的,比如usp31-nf26s2第711章(溶出)。在一个实施方案中,根据本发明所述的药物剂型具有崩解性,使该药物剂型在30分钟内,或者在20分钟内,优选在15分钟内,更优选在10分钟内,甚至更优选在5分钟内崩解。该崩解性可在标准崩解试验中确定,例如在药典中描述的,例如usp31-nf26s2的第701章(崩解)所描述的。在一个实施方案中,根据本发明所述的药物剂型具有高含量均一性,优选相对于所述药物成分的重量比为85-115%,更优选90-110%,甚至更优选95-105%。例如,可使用药典中所述的例如随机选择的10种药物剂型在标准测试中确定含量均一性。根据本发明所述的剂型,比如片剂、胶囊或薄膜衣片剂可通过本领域技术人员熟知的方法制备。制备片剂的适合方法包括压制粉末形式的所述药物组合物,即直接压片;或对颗粒形式的药物组合物压片,以及若需要的话与其它赋形剂一起压片。可通过本领域技术人员熟知的方法来制备根据本发明所述的药物组合物的颗粒。用于将活性成分与赋形剂一起造粒的优选方法包括干法造粒,也称为辊压。在一个实施方案中,根据本发明所述的颗粒的尺寸在25至800μm的范围内,例如在40μm至500μm的范围内。可通过筛分分析,例如使用超声筛分来测量颗粒的尺寸。在一个实施方案中,按重量计至少80%、至少90%或至少95%的颗粒在给定范围内。本发明所述的药物组合物和剂型可使用pvc泡罩、pvdc泡罩、pvc/pvdc泡罩或防潮包装材料如铝箔泡罩包装、alu/alu泡罩、带有小袋的透明或不透明聚合物泡罩、聚丙烯管、玻璃瓶、pp瓶和hdpe瓶,任选地带有防止儿童触及或具有防拆印迹的功能。主要的包装材料可包含干燥剂,例如分子筛或硅胶,以提高所述活性药物成分的化学稳定性。不透明的包装,例如有色泡罩材料、试管、棕色玻璃瓶等可用于通过减少光降解来延长活性药物成分i的保质期。所述药物组合物和剂型优选地包含一种或多种药学上可接受的赋形剂,该赋形剂在与制剂的其它成分相容且对接受者无害的意义上必须是“可接受的”。药学上可接受的赋形剂的实例是本领域技术人员已知的。(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺及其盐的制备方法是本领域技术人员已知的。有利地,根据本发明所述的化合物可使用文献中所述的合成方法来制备,包括上文中引用的专利申请。所述活性成分可以药学上可接受的盐的形式存在。短语“药学上可接受的盐”是指适于在药物应用中使用的任何盐制剂。药学上可接受的盐是指在合理的医学判断范围内适合与人和低等动物的组织接触而没有过度的毒性、刺激性、过敏反应等的盐,并且与合理的收益/风险比率相当。药学上可接受的盐是本领域众所周知的,并包括酸加成盐和碱式盐。还可形成酸和碱的半盐。药学上可接受的盐包括无机酸的胺盐(例如,盐酸盐、氢溴酸盐、硫酸盐等);以及有机酸的胺盐(例如,甲酸盐、乙酸盐、乳酸盐、苹果酸盐、酒石酸盐、柠檬酸盐、抗坏血酸盐、琥珀酸盐、马来酸盐、丁酸盐、戊酸盐、富马酸盐等)。对于具有碱性位点的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺,适合的药学上可接受的盐可为酸加成盐。例如,适合的(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的药学上可接受的盐可通过将药学上可接受的酸比如盐酸、硫酸、甲磺酸、琥珀酸、富马酸、马来酸、苯甲酸、磷酸、乙酸、草酸、碳酸、酒石酸或柠檬酸与(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺混合来制备。在j.pharmaceuticalsciences,1977,66:1-19中,s.m.bergeetal.详述了药学上可接受的盐。可在所述活性成分的最终分离和纯化过程中原位制备该盐,或通过使游离碱官能团与适合的有机酸反应来分别制备该盐。代表性的酸加成盐包括乙酸盐、己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、二葡糖酸盐、环戊烷丙酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳糖醛酸盐、乳酸盐、月桂酸酯、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、思波酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、十一酸盐、戊酸盐等。实施例与实验数据上文和下文中使用以下缩写:ac乙酰基et乙基dsc差示扫描量热法h小时hplc高效液相色谱mtbe甲基叔丁基醚r.h.相对湿度ssnmr固态核磁共振xrpdx射线粉末衍射除非另有说明,百分比(%)值是重量/重量百分比(%)值。通过重结晶制备(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i将(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐(20g,63.1mmol)悬浮在异丙醇(90ml)中,加热至82℃。在回流条件下将乙酸乙酯(etoac)(80ml)加入溶液中。在75-80℃的温度添加晶种后,将混合物搅拌5分钟。在1小时内将所得的悬浮液冷却至56℃。在>50℃的温度,5分钟内添加甲基叔丁基醚(mtbe)(70ml)。将产物悬浮液冷却至0-5℃,搅拌30分钟并过滤。滤饼用mtbe(40ml)洗涤,产物在真空中于75℃干燥约12小时。得到(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i,其为灰白色结晶固体(18.8g,有机纯度hplc:99.7面积%,产率:93.9%)。xrpd实验收集xrpd数据x射线粉末衍射曲线是使用brukerd8advance衍射仪以反射模式获得的,该衍射仪配备有使用cukα辐射的位置敏感检测器。为此,(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的样品的特征在于,通过hplc测得的纯度应高于99%,优选纯度高于99.5%,甚至更优选高于99.7%,最优选高于99.8%。为了允许实验误差,应当认为本文所述的2θ值精确到±0.2度2θ,特别是±0.1度2θ,甚至更具体地±0.05度2θ。也就是说,当评估给定的((e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐晶体的样品是否为晶型i时,若实验观察的2θ值落在特征值的±0.2度2θ内,特别是在±0.1度2θ内,甚至更特别地在±0.05度2θ内,则应认为该实验观察的2θ值与本文所述的特征值相同。下表总结了(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i的xrpd峰。相应的xrpd谱图如图1所示。峰2θ[°]13.8227.63311.46413.55515.29616.03716.38817.15917.801018.731119.021219.351319.691420.801521.651622.201722.641823.031923.632024.582125.112225.832326.212426.932527.302627.792728.932829.242931.033031.523132.283232.943333.603434.27dsc实验通过dsc确定(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐的型i的熔点为181℃±5℃作为起始温度。使用tainstrumentsq2000dsc从25℃至225℃以10℃/min的加热速率获取dsc数据。相应的dsc曲线如图2所示。保质期稳定性测试的实施例以下实施例显示,根据本发明药物组合物的保质期增加。实施例a:储存压力测试在制备不同的药物组合物后,立即对活性成分即(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的含量进行了测试(“起始”值),以及测试药物组合物在60℃的温度保存在密闭的可旋转玻璃瓶中1个月和2个月后的量。具有和不具有(参考实施例)稳定剂的不同药物组合物的成分的确切清单在下面给出。在以下给出的条件下,通过反相高效液相色谱测定所述活性成分的含量。活性成分含量(标称含量的%,即每片以1mg游离碱计)实施例b:酒石酸对稳定性的效果在制备不同的药物组合物后,立即对所述活性成分即(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的含量进行了测试(“起始”值),以及测试在不同条件下将该药物组合物在密闭的可旋转玻璃瓶中储存1个月和3个月之后的量。下面给出了具有不同量的所述稳定剂酒石酸的不同药物组合物的成分的确切清单。所述活性成分的含量通过反相高效液相色谱在以下给出的条件下测定。活性成分含量(标称含量的%,即每片以1mg游离碱计)此外,通过使用具有2%酒石酸的药物组合物显示出酒石酸的作用。在制备不同的药物组合物后,立即测试了所述活性成分即(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的含量及其降解产物的量(“起始”值),以及测试了在不同条件下将该药物组合物在密闭的可旋转玻璃瓶或铝泡罩中储存3个月和6个月之后的量。下面给出了具有2%酒石酸的不同药物组合物的成分的确切清单。所述活性成分和降解产物的含量通过反相高效液相色谱在以下给出的条件下测定。活性成分含量(标称含量的%,上部)和降解产物的总量(%,下部)实施例c:l-谷氨酸盐酸盐对稳定性的效果在制备不同的药物组合物后,立即对所述药活性成分即(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的含量(“起始”值)以及在不同条件下将该药物组合物在密闭的可旋转玻璃瓶中储存1个月和3个月之后的含量进行了测试。下面给出了具有不同量的稳定剂l-谷氨酸盐酸盐的不同药物组合物成分的确切清单。所述活性成分的含量通过反相高效液相色谱法在下述条件下测定。活性成分含量(标称含量的%,即1mg(以游离碱计)/片剂)*)储存3个月后,上述活性成分含量的明显增加可能归因于样品不均匀性和/或hplc方法的变化。制剂实施例可以与本领域已知的方法类似地获得的以下制剂实施例,用于更全面地说明本发明,而不将其限于这些实施例的内容。术语“活性物质”或“活性成分”表示(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺或其药学上可接受的盐之一,尤其是(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐。参考实施例:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)、不含稳定剂的片剂组合物:制备:将(1)和(2)在适合的混合机中混合。该粉末混合物用适当的过筛机中过筛。部分经过筛的粉末与(3)预混合(比率=1:1),然后添加剩余的经过筛的粉末并一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例1:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和酒石酸的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例2:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和富马酸的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末并一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例3:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和l-谷氨酸盐酸盐的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例4:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和酒石酸的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例5:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)以及酒石酸的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例6:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)以及酒石酸的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例7:含有2.5mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)以及酒石酸的片剂组合物:*)所述薄膜衣预混料red02f250006int由48%羟基丙基甲基纤维素(hpmc)、14%聚乙二醇(peg)、18%氧化钛、18%滑石粉以及2%氧化铁红构成。制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物通过辊式压实机压制并研磨成颗粒。部分所述颗粒与(5)预混合(比率=1:1),然后添加剩余的所述颗粒,一同混合。此最终的掺合物被压制成6mm的带有斜边的圆形双凸片剂。为了制备该包衣悬浮液,将纯净水转移至适合的混合容器中,并在搅拌下添加(6)。通过喷涂该包衣悬浮液,该片芯在盘式包衣机中被薄膜包衣。实施例8:含有2.5mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和酒石酸的片剂组合物:*)所述薄膜衣预混料red02f250006int由48%羟基丙基甲基纤维素(hpmc)、14%聚乙二醇(peg)、18%氧化钛、18%滑石粉以及2%氧化铁红构成。制备:在适当的混合机中混合(1)和预筛选的(2)和(3)。该粉末混合物用适当的过筛机中过筛。部分经过筛的粉末与(4)预混合,然后添加剩余的经过筛的粉末,一同混合。此混合物通过辊式压实机压制并研磨成颗粒。部分所述颗粒与(5)预混合,然后添加剩余的所述颗粒,一同混合。此最终的掺合物被压制成5.5mm的带有斜边的圆形双凸片剂。为了制备该包衣悬浮液,将纯净水转移至适合的混合容器中,并在搅拌下添加(6)。通过喷涂该包衣悬浮液,该片芯在盘式包衣机中被薄膜包衣。实施例9:含有5.0mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和酒石酸的片剂组合物:*)所述薄膜衣预混料red02f250006int由48%羟基丙基甲基纤维素(hpmc)、14%聚乙二醇(peg)、18%氧化钛、18%滑石粉以及2%氧化铁红构成。制备:在适当的混合机中混合(1)和预筛选的(2)和(3)。该粉末混合物用适当的过筛机中过筛。部分经过筛的粉末与(4)预混合,然后添加剩余的经过筛的粉末,一同混合。此混合物通过辊式压实机压制并研磨成颗粒。部分所述颗粒与(5)预混合,然后添加剩余的所述颗粒,一同混合。此最终的掺合物被压制成7mm的带有斜边的圆形双凸片剂。为了制备该包衣悬浮液,将纯净水转移至适合的混合容器中,并在搅拌下添加(6)。通过喷涂该包衣悬浮液,该片芯在盘式包衣机中被薄膜包衣。实施例10:含有1.0mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和酒石酸的片剂组合物:制备:在适当的混合机中混合(1)和预筛选的(2)和(3)。该粉末混合物用适当的过筛机中过筛。部分经过筛的粉末与(4)预混合,然后添加剩余的经过筛的粉末,一同混合。此混合物通过辊式压实机压制并研磨成颗粒。部分所述颗粒与(5)预混合,然后添加剩余的所述颗粒,一同混合。此最终的掺合物被压制成3mm的带有斜边的圆形双凸片剂。实施例11:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和l-谷氨酸盐酸盐的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例12:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和l-谷氨酸盐酸盐的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例13:含有1mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和l-谷氨酸盐酸盐的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物被压制成6mm的带有斜边的圆形双凸片剂。实施例14:含有5.0mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(以游离碱计)和酒石酸的片剂组合物:制备:将(1)与少量的(3)(活性成分:甘露醇=1:4)预混合。该预混料与(2)和剩余的(3)混合并过筛。部分经过筛的粉末与(4)预混合(比率=1:1),然后添加剩余的经过筛的粉末,一同混合。此混合物通过辊式压实机压制并研磨成颗粒。部分所述颗粒与(5)预混合(比率=1:1),然后添加剩余的所述颗粒,一同混合。此最终的掺合物被压制成5.5mm的带有斜边的圆形双凸片剂。用于测量活性成分含量的反相高效液相色谱的测试条件用于测量活性成分和降解产物含量的反相高效液相色谱的测试条件制备方法:通过干法造粒的制备方法步骤1.1:混合1将(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐与预混合的部分甘露醇预混合和预过筛。将该预过筛的粉末与剩余的甘露醇和稳定剂转移至在适合的混合机中,并混合。步骤1.2过筛1该粉末混合物用适当的过筛机中过筛。步骤1.3:混合2预混合硬脂酸镁的颗粒内部分和来自步骤1,2部分经过筛的粉末;用适合的筛子过筛所得预混物。添加来自步骤1.2的剩余的筛过的粉末,然后用适合的混合机将整个混合物掺合。步骤2.1:干法造粒和研磨在适合的辊式压实机中,将步骤1.3制备的混合物造粒并研磨。步骤3.1:最终掺合预混合硬脂酸镁的颗粒外部分和来自步骤2.1部分经研磨的颗粒;用适合的筛子过筛所得预混物。添加来自步骤2.1剩余的经研磨的颗粒,然后用适合的混合机将整个混合物掺合。步骤4.1:压片最终的掺合物用旋转压片机被压制成片剂。步骤5.1:制备薄膜包衣通过搅拌将薄膜包衣剂分散在净化的水中,从而制备薄膜衣悬浮液。步骤5.2:薄膜包衣在鼓式涂布机中,所述片剂被薄膜衣悬浮液包衣。通过直接压片的制备方法步骤1.1:混合1预混合和预过筛(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺盐酸盐与预先混合的部分甘露醇。将该预过筛的粉末与剩余的甘露醇和稳定剂转移至在适合的混合机中,并混合。步骤1.2过筛1该粉末混合物用适当的过筛机中过筛.步骤1.3:最终掺合预混合硬脂酸镁和来自步骤1.2的部分经过筛的粉末;用适合的筛子过筛所得预混物。添加来自步骤1.2的剩余的筛过的粉末,然后用适合的混合机将整个混合物掺合。步骤2.1:压片最终的掺合物用旋转压片机被压制成片剂。步骤3.1:制备薄膜包衣通过搅拌将薄膜包衣剂分散在净化的水中,从而制备所述薄膜衣悬浮液。步骤3.2:薄膜包衣在鼓式涂布机中,所述片剂被薄膜衣悬浮液包衣。治疗的实施例实施例1:减少病理性新血管生成在进行全身注射后,在氧气诱导的视网膜病变(oir)小鼠模型中,测试了api(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的体内作用。由于在同一模型中已显示皮质类固醇地塞米松可降低oir的严重程度,因此它已被列为技术对照和抗炎参考化合物。在本研究中,api的剂量为1.8mg/kg(以游离碱计),api以其盐酸盐的形式使用。将api和地塞米松溶解在0.9%nacl中。api和地塞米松通过皮下注射给药。给药量为10ml/kg。对照动物仅接受媒剂。从出生后第7天和第12天起,新生小鼠及其母亲就暴露于75%的o2中,并在p12时回到室温。在这种情况下,p意指产后的天数。在该模型中,从p7-p12暴露于75%o2引起中心无血管视网膜区域的发展,当小鼠在p12时进入室内空气时,它将变成局部缺血。从p12开始,无血管区域开始重新血管化,同时新血管簇向玻璃体突出。在p16和p17时,异常的病理性新血管形成峰和血管再生仍不完全。摘除小鼠眼睛,在4%pfa中固定至少24小时,然后包埋在石蜡中。连续切片(厚度为6μm)的每第3张玻片均取自视神经周围区域。检查pas染色的切片中是否存在从视网膜内部限制膜伸入玻璃体的新生血管簇。新血管评分定义为每只眼睛在十个切片(视神经的每一侧五个)中发现的每个切片的平均新血管细胞核数。从计数中区分出与视神经相邻的簇(每侧最大90μm)。数据表示为单向anova测试的10张载玻片±sem计数的簇细胞的平均值,且p<0.05被认为是显著的。在p12和p14时,用1.8mg/kgapi连续两次皮下注射治疗新生小鼠,在第4天局部缺血期(p16)结束时,视网膜簇形成显著减少49%(p<0.05),见图3。效果大小与技术对照地塞米松(1.8mg/kg,皮下,簇数减少了57%(p<0.01))相当。在图3中,数据代表n=12-15眼的平均簇数±sem,*p<0.05,**p<0.01(anova)。根据前哨肺组织匀浆中aoc3活性的88%抑制,api实现了完全的靶标结合,而地塞米松未显示出明显的作用。与相应的媒剂对照相比,在局部缺血期间用api治疗的动物显示出明显减少的新生血管簇核。这表明api降低了病理性新血管形成,从而预防或减少了增殖性视网膜病变以及从npdr到pdr的进展。实施例2:保护视网膜功能在stz-诱导的糖尿病大鼠模型中,研究了api(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺对视网膜功能的保护作用,该模型的特征在于,视网膜中的进行性高血糖依赖性神经元功能障碍。从charlesriver(德国)获得雄性brownnorway大鼠(bn大鼠)。高血糖是由腹腔注射stz(65mg/kg体重)引起的。每天两次通过口服媒剂(natrosol)或api(1.8mg/kg体重(以游离碱计))向动物给药,持续5周,足以实现完全的靶标结合,即几乎完全在眼睛和血浆中抑制aoc3活性。api以其盐酸盐的形式使用。视网膜功能通过视网膜电图(erg)记录进行评估。erg为非侵入性电生理技术,其用于评估不同视网膜神经元的光诱导电活动,并可量化视网膜功能的不同方面,例如暗光或彩色视觉。经腹膜应用stz(第1天)诱发糖尿病后,将糖尿病(高血糖)动物随机分为相似的血糖浓度(第5天>20mm)组。诱导糖尿病后第5周,进行erg记录以量化视网膜中神经元功能障碍的程度。1个糖尿病组(第3组;n=10只动物)接受api口服治疗;非糖尿病对照组(第1组;n=10只动物)和糖尿病对照组(第2组;n=10只动物)接受口服赋形剂治疗。将杆驱动(rod-driven)的ergb-波响应的光敏感性用于衡量参与杆驱动的视网膜途径的神经元数量(特别是感光细胞和下游双极细胞),以及它们对光刺激的敏感性以产生去极化光响应。将光敏度s(定义为饱和b波响应幅度与半饱和闪光强度的比率)标准化为非糖尿病对照大鼠(s对照)的平均光敏度,并绘制在图4中(数据为均值+sem,每组调查的眼睛:n=19(第1组),n=19(第2组),n=20(第3组);ns,不显著;*,p<0.05;**,p<0.01;***,p<0.001单向方anova与tukey的多重比较测试)。与对照组大鼠(第1组)相比,stz诱导的高血糖动物(图4中的第2组)的标准化光敏度降低了约40-50%。用api进行治疗可显著防止光敏度降低,从而使光敏度提高约30%(第3组与图4中的第2组相比)。因此,如在糖尿病对照组中观察到的那样,用api进行的治疗使糖尿病动物免受杆驱动的视网膜途径的光敏度损失。总之,这项研究的结果为api在视网膜高血糖应激条件下的神经保护作用提供了证据,从而表明了该api在治疗糖尿病性视网膜病变中的治疗潜力。实施例3:糖尿病性视网膜病变的治疗如以下所述,研究api(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺(例如以盐酸盐的形式)对于患者中的非增殖性糖尿病性视网膜病变(npdr)、尤其是视网膜病变的改善中的影响。npdr患者,特别是中度或重度npdr患者(例如drss(糖尿病性视网膜病变严重程度)47级或drss53级)在一段时间内(例如,对每位患者约12周)接受以其盐酸盐形式的api(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺治疗,并与接受安慰剂治疗的患者进行比较。所述患者是成年人类,优选年龄为18岁或更大。每天一次口服所述api(例如,相当于10mg(e)-4-(2-(氨基甲基)-3-氟烯丙基氧基)-n-叔丁基苯甲酰胺的用量)。例如,将两片5mg片剂(根据制剂实施例部分的实施例11的药物组合物)每天一次向患者口服给药。所述患者优选不表现出糖尿病性黄斑水肿、特别是中心性糖尿病性黄斑水肿(ci-dme),尤其是这些患者不表现出超过300微米的中心子区域厚度,例如通过光学相干断层扫描(oct)测得的。被诊断出患有糖尿病(1型或2型)的患者包括在本研究内,优选hba1c等于或低于10%,例如由ada或who标准记录,并用适合的抗糖尿病药物治疗的患者。在定义的时间(例如第4周和第8周)以及其结尾(例如第12周)以及随访期间,对接受api治疗的患者(例如,每天一次10mg)和接受安慰剂的患者进行以下参数研究:-视网膜病变的改善,-发生任何眼部不良事件(根据不良事件的通用术语标准(ctcae))的患者比例-在drss的研究眼中,至少改善了2个步骤的患者比例,-在drss的研究眼中,改善了1个步骤的患者比例,-改善研究眼中drss水平的各个组成部分(视网膜出血、静脉串珠样改变、视网膜内微血管异常(irma)),-通过drss水平升高评估的疾病进展患者比例,-在drss的患者水平上至少改善了3个步骤的患者比例,-通过宽视野荧光素血管造影测量的非灌注面积相对于基线的变化[%],-最佳矫正视力(bcva)相对于基线的平均变化,-对比敏感度相对于基线的平均变化[字母数],-通过光学相干断层扫描血管造影(oct-a)测量的非灌注面积变化。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1