术中放射治疗中的实时X射线剂量测定的制作方法
相关申请的交叉引用
本申请要求于2017年7月18日提交的美国专利临时申请no.62/534,010的优先权,其全部内容通过引用合并于此。
本发明的布置涉及放射治疗,并且更具体地涉及用于术中放射治疗的系统和方法。
背景技术:
癌症外科手术可以包括切除癌性肿瘤和围绕肿瘤的一些正常组织。例如,保乳手术(breastconservingsurgery,bcs)是一种癌症手术,其中在手术过程中切除了癌性肿块和周围乳房组织的一部分(相对于整个乳房)。手术后通常进行中等剂量的放射治疗,目的是从肿瘤床根除任何癌组织痕迹(围绕癌性肿瘤的血管和基质组织)。放射治疗技术可以涉及到外部递送的放射剂量,使用称为体外放射治疗(ebrt)的技术。但是传统的ebrt可能会增加错过预期目标体积的风险。为了解决这个问题,有时使用术中放射治疗(intraoperativeradiotherapy,iort)。iort涉及对肿瘤床施加治疗级别的放射,同时该区域在切除手术期间暴露且可接近。iort的好处在于,它可以将高剂量的放射精确地传递到目标区域,而对周围组织的放射照射极少。iort还避免了通常的延迟,该延迟与手术切除癌组织时和ebrt之间的时间有关。
在iort合适时,外科医生将切除癌性肿瘤,然后放射肿瘤学家将放射线施加器或治疗放置在患者先前肿瘤所在的区域内。这样的治疗头可以在去除了癌性肿瘤的肿瘤腔内产生低能x射线。
技术实现要素:
本文件涉及一种用于实时x射线剂量测定的方法和系统。该方法包括:将x射线治疗头放置在可扩张的球囊内。使球囊扩张,然后使用x射线治疗头将x射线能量施加到球囊外部的治疗表面。该方法还包括:检测由治疗头递送到治疗表面的一部分的x射线剂量。该结果通过使用附接到形成球囊的壁的至少一个感测元件来得到。
根据一个方面,本文所述的检测步骤可以包括:检测从治疗头递送到与治疗表面的不同部分相关联的多个位置的x射线剂量。这是通过使用附接到球囊上的多个不同位置的多个感测元件来完成的。在一些场景下,多个位置可以与多个正交轴(比如以x射线治疗头为中心)在球囊扩张时与球囊表面相交的位置对齐。在其他场景下,多个不同的位置可以在球囊的表面上限定卵形或球形栅格图案(在球囊扩张时)。
在本文呈现的解决方案中,将来自一个或更多个感测元件的感测数据从至少一个感测元件传送至电子控制系统。根据一个方面,通过使用导电导线、光纤和/或无线数据收发器有助于感测数据从至少一个感测元件至电子控制系统的通信。
在一些场景下,设置在球囊中的一个或更多个感测元件可以包括:半导体材料,硅漂移检测器(sdd)和/或pin二极管类型的x射线检测器。在其他场景下,感测元件被选择为使得当暴露于x射线能量时发出荧光或改变颜色。在感测元件被配置为发荧光或改变颜色的情况下,可基于至少一个感测元件呈现的荧光的强度或颜色变化来确定至少一个感测元件指示或检测的x射线剂量。例如,至少一个感测元件检测的x射线剂量可通过使用设置在球囊内的图像捕获装置来确定。在这种场景下的图像捕获装置可以检测至少一个感测元件的荧光或颜色变化中的至少一个。
该解决方案还涉及一种用于实时x射线剂量测定的系统。该系统包括:可扩张的球囊,被配置为在其内部容纳能够从其发出x射线的x射线治疗头。至少一个感测元件附接到形成所述球囊的表面的壁上。该感测元件响应于x射线能量,且被配置为传送关于感测元件检测的x射线剂量的信息。更具体地,该感测元件可以传送感测位置处检测的x射线剂量信息,其中在该感测位置处,至少一个感测元件被附接到壁。
根据一个方面,多个感测元件附接到球囊上的多个不同的感测位置。例如,多个不同的感测位置可与以球囊的近似中心为原点的多个正交轴在球囊扩张时与球囊表面相交的位置对齐。在其他场景下,当球囊扩张时,多个不同的感测位置在球囊的表面上限定卵形或球形栅格图案。
包括在系统中的所述至少一个感测元件有利地选自以下组成的组:半导体材料形成的传感器,硅漂移检测器(sdd),pin二极管检测器。系统还包括至少一个信息通信组件,所述至少一个信息通信组件被配置为有助于传感器信息从所述至少一个感测元件到电子控制系统的通信。在一些场景下,信息通信组件可以是导电导线、光纤和/或无线数据收发器。
在其他场景下,所述至少一个感测元件被配置成当暴露于x射线能量时发出荧光或改变颜色。在这样的情况下,图像捕获装置可布置在球囊内。进一步,图像捕获装置被配置为有助于获取图像信息,所述图像信息指示所述至少一个感测元件的荧光或颜色变化中的至少一个。图像捕获装置可通信地耦接至电子控制系统。电子控制系统被配置为评估荧光或颜色变化,作为确定在所述至少一个感测元件处接收到的x射线剂量的基础。
本文公开的解决方案还包括x射线剂量测定感测系统,其中可扩张的球囊包括多个感测元件,所述多个感测元件布置在形成球囊表面的壁上分布开的位置处,其中所述多个感测元件中的每个响应于x射线能量。在该解决方案中的感测元件各自都被配置成传送感测元件在感测位置所检测的x射线剂量有关的信息,在上述感测位置处,感测元件附接到壁。
附图说明
本文的公开将参考以下附图,其中,在所有图中相同的标号表示相同的项目,并且其中:
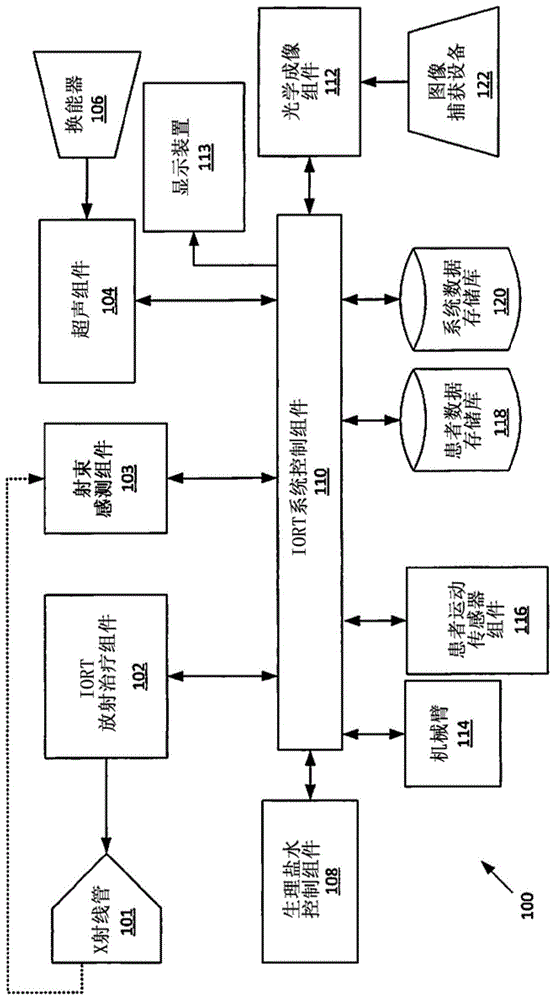
图1是用于理解机器人iort系统的框图。
图2是用于理解使用机械臂和治疗头的机器人iort的实现的图。
图3是示出布置在图2中的机械臂上的处理头的更详细视图的图。
图4是用于理解用于机器人iort的处理的图。
图5是用于理解治疗头的替代实施方式的图,该治疗头可用于使用机械臂的机器人iort。
图6是用于理解控制系统的框图,该控制系统可用于有助于实施如本文所述的机器人iort。
图7是用于理解x射线剂量测定感测系统和方法的图。
图8是用于理解x射线剂量测定传感器的布置的图。
图9是用于理解x射线传感器的图,该x射线传感器集成在构成球囊的材料或材料层内。
图10是用于理解替代实施方式的x射线感测元件的图。
具体实施方式
应理解,本文中描述的以及附图中示出的系统和方法的组成元素可以以多种不同的配置来布置和设计。因此,如附图中所示的以下更详细的描述并非旨在限制本公开的范围,而仅表示对理解本公开有用的某些示例性场景。尽管在附图中呈现了各个方面,但是除非特别指出,否则附图不是一定按比例绘制的。
一种类型的低能x射线iort施加器包括具有球囊头部的导管状装置。切除肿瘤后,将导管插入先前肿瘤所位于的腔中,然后将微型放射治疗源插入球囊内从而插入腔中,以在内部将放射递送到肿瘤床,且以生理盐水使球囊扩张从而扩张的球囊紧密贴合在腔内。球囊和生理盐水溶液用于帮助确保对肿瘤床的所有部分均施加均匀的放射剂量。生理盐水用于使球囊扩张并减少放射衰减,这通常是x射线在空气中传播时发生的。生理盐水溶液也不断在球囊内循环,以便在治疗过程中为x射线微型源提供多余的冷却剂介质。在一段时间(例如15分钟)之后,将放射源和球囊从腔中移除,并且外科医生闭合切口。
与微型x射线源相关的费用和较短的使用寿命可以通过更大、更常规的x射线源轻松克服。然而,这些源在执行iort时提出了不同的问题。当执行iort时,重要的是将肿瘤床的所有组织保持在距放射源的预定距离处。这确保了对整个肿瘤床均匀的放射照射。更大更常规的x射线源通常必须支撑在铰接臂上。铰接臂将x射线源保持在固定位置。相反,患者的呼吸功能意味着胸腔内和胸腔周围的组织将不停活动。因此,源与形成肿瘤床的腔壁之间的相对运动使得几乎不可能确保将均匀的放射剂量施加到构成肿瘤床的所有组织上。
针对该问题的解决方案是其中x射线源被布置在机械臂上的机器人iort。机械臂的运动与患者的呼吸动作同步,因此x射线源始终与包括肿瘤床的组织具有相同的相对位置。机械臂支撑x射线源,并提供所有必要的实用通道以支持iort功能和操作。例如,机械臂可以提供用于操作x射线源的主要电力。机械臂还可以包括一个或更多个流体管道,以有助于将生理盐水递送到可扩张的球囊并从球囊中排出生理盐水。
通过前述布置,可以代替微型x射线源针对iort使用更常规或更大尺寸的x射线源。常规的x射线源可以提供微型x射线源的所有优点,但是没有与微型x射线源相关的额外成本。对患者的功能结果与置于柔性导管中的微型x射线源相同,但是较大的常规x射线源的耐用性和较低的成本将大大降低iort治疗的总成本。如本文所述的较大类型的x射线源还可以包括布置在x射线治疗头上方的球囊,其被插入肿瘤腔中。可以通过控制生理盐水向球囊内部腔的流动来对球囊进行扩张或收缩。
如上所述,设置在治疗头中的x射线放射源周围的可扩张球囊可以帮助确保将均匀的放射剂量施加到肿瘤床的所有部分。球囊概念的一方面是,当适当地扩张时,其促使包括肿瘤床的所有组织符合由扩张的球囊限定的大致球形形状。因此,布置在球囊中心的放射源将与限定肿瘤床的所有组织表面大致等距。如果放射源具有近似球形或各向同性的放射图,那么结果是:基本上均匀的放射剂量被施加到肿瘤床的所有部分。
该方法仍然存在一些问题,这些问题可能导致施加到肿瘤床各个部分的x射线放射量出现不希望的变化。例如,放射源由于其设计或由于故障而可能不会产生预期的x射线放射图。或者,球囊可能无法真正在肿瘤床内实现预期的球形。每种情况都可能导致肿瘤床的不同部分接收到不同级别的或级别不一致的x射线放射。
此外,用于iort的x射线治疗头的最新发展具有有助于肿瘤腔内x射线射束转向的潜力。但是,目前没有很好的方法来验证射束转向操作是否已正确发生和/或是否向肿瘤床的特定部分递送了所需量的x射线放射。
因此,本解决方案涉及一种在iort背景下实时监视x射线剂量测定的系统。该解决方案涉及多个x射线放射传感器元件(x-rayradiationsensorelement,xrse),其布置在球囊的表面上或与球囊集成。在某些情况下,传感器布置在球囊的内部。在其他情况下,传感器布置在球囊的外部。在其他情况下,传感器可以与形成球囊的材料集成。
xrse布置在多个预定位置。在某些情况下,这些位置可以与限定x、y和z坐标系的多个正交轴中的每一个对齐,并且x射线放射源在轴相交的原点处对齐。在其他情况下,多个xrse可以与限定球面网格的多个点对准。如本文中所使用的术语球面网格可以是一组点,这些点均匀地(或半均匀地)设置在由球囊限定的近似球形的表面上。
本文公开的传感器可以设置在球囊的表面上或嵌入在球囊中。这样,球囊可以包括专门的设计,并且可以包括独特的制造过程,以有助于形成用于放射治疗的独特且新颖的组织管理球囊。球囊可与嵌入式x射线传感器完全集成,以用于实时剂量测定反馈和控制。
xrse将其感测活动的结果传送到控制系统,该控制系统监视由每个传感器检测到的x射线放射剂量。每个xrse在球囊表面上都有已知位置,并且控制系统将知道该位置。因此,控制系统可以确定沿与每个xrse对齐的径向方向施加的x射线的确切剂量。这些结果可以在计算机显示器上显示给治疗专家。治疗专家由此可以实时地监视由x射线源施加到肿瘤床的x射线放射的实际量,并且可以关于相对于x射线源限定的各种径向方向进行监视。治疗专家还可以使用从每个xrse中检测到的放射级别来帮助定位x射线治疗头。例如,在某些情况下,治疗专家可以调整包含x射线源的治疗头的位置,以便在肿瘤腔内实现x射线强度更高的均匀性。如下面进一步详细解释的,这些调节可以手动地或借助于机械臂来执行。
应当理解,当围绕x射线源的球囊以不同程度扩张时,对于生理盐水的不同的扩张体积/压力,xrse的位置将必然改变。但是,可以预先知道x射线源与每个xrse之间的实际位置和距离。通过仔细控制泵入球囊中的生理盐水量和/或球囊中的生理盐水压力,并测量从xrse到x射线源的结果距离,可以确定在各种条件下到源的xrse位置距离。或者,可以使用计算机软件对球囊的特性进行建模,从而在不同条件下知道扩张球囊的半径。该额外的信息对于将治疗信息准确地呈现给技术人员或治疗专家,可能有用。
将参照示例性系统的附图来描述本公开的各个方面,该示例性系统可以通过单个平台来递送两种治疗性iort功能,以更好地为从业者和患者提供服务并使其受益。示例性系统可以包括多个成像装置和放射治疗装置,其协作地用于执行根据本公开的iort。在某些情况下,系统可以涉及使用机器人iort系统。
如下面进一步详细解释的,机器人iort系统可以使用机械臂来帮助确保iort期间使用的x射线源的位置一致。机械臂可以有助于布置在患者体内的x射线源响应于患者的与呼吸等相关的自主运动的受控运动。如下面进一步详细解释的,可以通过使用设置在机械臂中的力传感器或通过设置在患者身上的基准标记来跟踪这种运动,从而实现这种运动控制。然而,本公开创建了机会提供进一步的手段,用以评估这种运动对肿瘤腔内的位置处实际施加的放射剂量的影响。因此,由这种呼吸活动引起的所检测x射线放射级别的变化实际上可在肿瘤腔内不同位置处测量。这些变化可以被传送到控制系统,并可以提供进一步的基础来控制机械臂。响应于在各种xrse处检测到的x射线放射的变化,机械臂可以自动移动x射线源以提供更均匀的剂量。根据下面的描述,本解决方案的这些和其他特征将变得明显。
现在参考图1,图1示出了机器人iort系统100的高级别框图表示,其对于理解本发明是有用的。示例性系统100可包括具有x射线管101的放射治疗组件102,具有换能器106的可选超声组件104,具有相关联的图像捕获装置(imagecapturedevice,icd)122的光学成像(opticalimaging,oi)组件112。系统还包括机械臂114、患者运动传感器116和生理盐水控制组件108。系统控制组件110在iort操作期间,基于从患者运动传感器组件116、超声组件104、换能器106、oi组件112和icd122中的一个或更多个获得的图像和数据来引导机械臂114。
生理盐水控制组件可以包括泵以及一个或更多个选择性地控制的阀,它们全部在与系统控制组件相关联的软件和硬件元件的控制下。泵可以连接到生理盐水溶液的贮存器或源。这样,生理盐水控制组件可以控制生理盐水流入和流出设置在机械臂114末端的球囊(未示出)的流动。当要执行iort操作时,将球囊插入到已去除癌性肿瘤的腔中并用生理盐水扩张。一旦扩张,x射线管101和放射治疗组件102用于将放射施加到由肿瘤床形成的腔的壁。在施加放射期间,生理盐水控制组件可以监视并维持球囊内的流体流通和压力。在完成iort治疗之后,生理盐水控制组件108释放生理盐水以使球囊收缩并且将球囊从腔中撤出。
机械臂114有利地被选择为机器人系统,该机器人系统提供绕多个正交轴(例如,多达七个轴)的运动自由度,并且包括轻型力和扭矩传感器(未示出),以确保在不需要安全护栏的情况下人的安全操作。该类型的示例性机器人在商业上可从各种来源获得。例如,德国奥格斯堡的kuka机器人有限公司(kukarobotergmbh)生产了一系列具有直接人机协作(human-robotcollaboration,hrc)能力的轻型机器人,这些机器人适用于直接人机交互。这些机器人包括kuka生产的lbriiwa模型。这种类型的机器人非常适合本文所述的精细操作,因为它们包括关节扭矩传感器,该关节扭矩传感器可以检测与物体的接触,并且可以通过立即减小与机器人运动相关的力和速度的级别来做出响应。
患者运动感测组件116可以包括光学传感器、超声传感器、压力传感器、激光传感器或任何其他类型的传感器,这些传感器可用于监视接受iort治疗的患者的运动。例如,这种运动可以包括在iort期间发生的呼吸运动和/或消化系统运动。患者运动传感器组件可以与机械臂114分离和/或可以被集成到机械臂中以有助于实施这种感测。在一些情况下,来自超声组件104、换能器106、光学成像组件112和图像捕获装置122的数据可用于本文所述的患者运动感测。来自这些传感器的信息可以代替从患者运动传感器组件116获取的感测数据或与从患者运动传感器组件116获取的感测数据相结合地使用。
系统控制组件110接收患者运动传感器数据并使用它来控制机械臂114。更具体地,在如本文所述的iort操作期间,根据患者运动感测数据来控制机械臂的运动,从而确保x射线管101与由于呼吸或其他身体功能导致的组织自然运动同步运动,这将相对于正在接受放射治疗的肿瘤床精确对准x射线源。对x射线管运动和位置的精确控制可以确保肿瘤床的所有区域均接收所施加放射的均匀照射。为了实现该结果,机械臂可以沿着多个运动轴(例如,多达七个运动轴)运动,以保持其在去除了癌性肿瘤的腔内的相对位置。
放射治疗组件102根据现在已知或将来已知的iort治疗方法来治疗肿瘤床。x射线管101被有利地选择为用于x射线光子颗粒的各向同性源,以执行肿瘤床的iort。进一步地,x射线管被有利地选择并有目的地设计,使得其具有相对较小的尺寸,使得其能装进已移除了癌性肿瘤的腔内,然而其足够坚固且足够大,能够承受许多治疗疗程而不会耗尽或出故障。这种方法和设计将为可重复使用的iortx射线源提供经济高效的解决方案,该射线源足够小以适合大多数或所有手术后的肿瘤床腔,但在物理上又不太小,这会理解成非常短的使用寿命和更高的使用成本。
可以是表面放射治疗组件的放射治疗组件102和x射线管101可以一起包括控制电路、用于x射线管的一个或更多个冷却元件、电源、一个或更多个高压发生器、一个或更多个可互换的施加器、以及一个或更多个硬件计时器,该硬件计时器与软件计时器协同工作以用于冗余性和其他目的。构思的是:在此使用的x射线管被选择为使得:其被优化以用于iort与肿瘤床组织之间的交互,且对更深的组织深度影响极小。例如,常规的表面放射治疗(srt)类型的x射线单元可以用于该目的。可以理解,srt类型的x射线单元产生适合于此目的的低能x射线。
在某些情况下,固态x射线射束感测组件103可以监视放射治疗组件102和x射线管101的射束输出,以及整个系统的稳定性和产出。固态x射线射束感测组件103安装到x射线管100上,并且当需要测试系统150以进行质量控制或整个系统150的诊断目的时,将其移动到x射线管100的前面。否则,它在其原始位置缩回,远离x射线管101和x射线射束,以便在本文所述的iort操作期间不会干扰。
本公开内容构思的是,除了在系统100中使用基于x射线的放射治疗之外或作为其替代,可以在系统100中使用任何其他类型的放射治疗。因此,用于放射治疗的组件可被选择为支持基于光子的放射治疗(例如,x射线和伽马射线)、基于粒子的放射治疗(例如,电子、质子、中子、碳离子、α粒子和β粒子),或可被确定为现在或将来适于iort的以上任意组合。
超声组件104可以包括控制电路、系统驱动器、操作控制软件以及换能器104,其可以是高频超声换能器,用于肿瘤床的组织成像。超声组件104经由总线和系统驱动器与系统控制组件110的软件通信。在示例性系统100中提供超声组件104和换能器106,以提供与肿瘤床相关的结构或解剖数据,而无需使受试者暴露于电离放射下。然而,本公开构思了:超声系统104中的超声组件104和换能器106可以用以下组件来代替或补充:该组件支持也不利用电离放射的任何其他类型的成像技术。例如,光学相干断层扫描或激光测距扫描(lidar)等。
超声组件104可以是能够在可接受的带宽内操作的任何超声设备。例如,超声组件和换能器106可以在大约2mhz至大约70mhz的带宽中操作,并且可以用机电或固态换能器来实现。系统100可以提供至少部分地集成在耦接到数据总线的系统100壳体内的超声组件104,换能器头106在壳体外部,如关于图2和图3所讨论的那样。超声组件104和系统100的其他组件可以与数据总线通信,以有助于将图像数据传送到系统控制组件110和/或显示设备113。合适的接口标准可以用于此目的,例如外围组件互连(pci/pcie)、通用串行总线(usb/usbii/usbiii/usb-c)、以太网或火线接口。然而,本公开构思的是可以使用任何其他接口和/或通信标准。
光学成像组件112可以包括用于对肿瘤床成像的控制电路、系统驱动器、操作控制软件以及一个或更多个图像捕获装置122。根据一个方面,光学成像组件是光谱成像装置。例如,光学成像组件可以包括以多种光学频率捕获图像数据的多光谱成像装置。这样的多光谱成像组件可以被配置为利用来自光谱的可见部分的光能用于成像目的,但是也可以利用来自可见光范围之外的频率(例如红外和近紫外)的光能。可选地,光学成像组件可以包括高光谱成像装置,其中,在捕获的图像中的每个像素处,从整个电磁光谱捕获光学信息。作为另一替代方案,光谱成像装置可以被配置用于拉曼光谱,其捕获与肿瘤床内的组织交互导致的、单色光中的光子频率的变化。作为另一替代方案,光谱成像装置可以被配置用于光声成像,其利用非电离激光脉冲或替代光源来对残留腔组织成像。
光学成像组件112经由总线和系统驱动器与系统控制组件110的软件通信。本公开构思的是:光学成像组件112和图像捕获装置122可以在系统100中用以下组件替代或补充:该组件支持从肿瘤床组织中提取分子或功能信息的任何其他类型的成像技术。例如,生物标记可用于增强本文描述的光学成像方法的有用性。众所周知,生物标记可以包括被引入组织以有助于识别疾病状况如癌症的物质。根据一个方面,生物标记可以包括引入到肿瘤床组织中的任何物质,该物质可以用于诱发能够有助于识别癌细胞的、视觉或光学上可检测的变化。现在已知或将来已知的任何生物标记可以与光学成像组件112和一个或多个图像捕获装置122结合使用,只要它可以帮助有助于识别与正在观察的肿瘤床组织有关的功能数据。
光学成像组件112可以被设置为至少部分地集成在被耦接到数据总线的系统100壳体内部,一个或更多个图像捕获装置122在壳体的外部如图2和3所示。光学成像组件112和系统100的其他组件可以利用诸如外围组件互连(pci/pcie)、通用串行总线(usb/usbii/usbiii/usb-c)、以太网或火线接口等之类的接口标准与数据总线和系统100的各个其他组件进行通信。然而,本公开构思的是可以使用任何其他接口和/或通信标准。
在某些情况下,系统100利用具有换能器106的超声组件104扫描和成像肿瘤床,以获得有关感兴趣区域的结构或解剖学信息。系统还可以利用具有图像捕获装置122的光学成像组件112来对相同的体积进行光学扫描和成像,以获得与皮肤组织或其部分有关的功能和/或代谢信息。如本文所用,本文所引用的功能和/或代谢信息可以包括与特定细胞或细胞组中起作用的生物学功能、行为或过程有关的任何信息。超声和光学扫描过程将在下面更详细地描述。可以使用配准(registration)过程来有助于对准使用超声和光学扫描方法获取的图像数据。在感兴趣区域已经由系统100扫描并成像之后,图像数据由系统的软件处理。可以对使用超声波和光学扫描方法获取的图像数据进行配准,然后将其融合或合并以形成单个图像。在融合的图像中,通过使用超声波获取的图像数据基本上被叠加在通过使用本文所述的光学扫描方法获取的图像数据上。结果是混合图像,该混合图像包括肿瘤床的详细解剖和/或结构数据,叠加有相同组织体积的功能数据。肿瘤切除后可以使用此过程,以帮助识别可能包含癌组织的肿瘤床的任何部分。
系统100由系统控制组件110控制和操作,该系统控制组件110可以包括具有母板的中央计算机,该母板以各种并行和连接的板运行操作和控制软件,从而允许其控制、通信和监视系统100的各种子组件和模块。这实现了系统100的三个主要临床组件之间的相协调的功能性,三个主要临床组件包括放射治疗组件102、机械臂114和患者运动感测组件。系统控制组件110可以与包括患者数据存储库118和系统数据存储库120的数据存储库可通信地连接。
由系统控制组件执行的软件或指令可以控制系统100的功能,验证安全机制以及服务和校准功能。控制系统组件110可以与机器可读介质通信,该机器可读介质可以是静态存储器,在其上存储了体现本文所述的方法或功能(包括此处所述的这些方法)中的任何一种或多种的一组或多组指令(例如,软件)。在系统100执行指令期间,指令还可以完全或至少部分地驻留在系统数据存储库、静态存储器或处理器内或其组合内。系统数据存储库和患者数据存储库以及处理器也可以构成机器可读介质。
患者数据存储库118和系统数据存储库120可以是固态驱动器、硬盘驱动器或其他存储设备。患者数据存储库118可以存储患者相关的数据和治疗参数,例如患者记录、治疗疗程细节以及疾病文档和照片。系统数据存储库120存储所有与系统有关的数据和参数,例如系统日志、x射线校准数据和系统诊断结果。患者数据存储库118和系统数据存储库120可以是分离的设备或物理上相结合。如果存储库118和120被结合,比如单个存储库,则可以使用一个或更多个分区。两个数据存储库将被镜像并备份到安全且加密的符合hipaa的云存储介质中。
在图2中示出了机器人iort系统200的一个示例。系统200可包括基座单元201,基座单元201具有安装在其上或与其连接的各种组件。这些组件可以包括机械臂202、放射治疗装置216、生理盐水贮存器212、生理盐水控制元件214和系统控制组件210。基本单元还可以包括光学成像组件232、超声组件234、用于存储患者和/或系统数据的数据存储装置236。基座单元201有利地是紧凑的单元,诸如具有30”×30”的占地面积的单元,并且可以被安装在脚轮211上以有助于可操纵性。基座单元201可以包括电源线,用于可选地向基座单元201中所容纳或连接到基座单元201的所有组件提供电力。就这一点而言,基座单元201可以包含一个或更多个用于控制系统200和/或分析和处理从系统200组件获得的数据的计算机217。监视器218也可以安装到基座单元201以用于用户界面。同样,可以包括终端或诸如键盘或鼠标的输入装置。
在基座单元201上提供了用于安装机械臂202的托架203。机械臂202可以包括治疗头224,治疗头224可以包括用于施加iort的可拆卸或可移动的施加器。在系统控制组件210的控制下,机械臂202与适当的机械关节或关节构件204铰接。尽管图2未示出,但还可以在机械臂202的不同点处提供额外的关节,以增加放置、定向和移动治疗头224的自由度225的数量。图2所示的关节点的数目仅是为了便于说明。本公开内容构思的是:可以提供托架203与治疗头224之间的任意数量的关节点,以便在机械臂202中提供任意数量的自由度,这可能是相对于患者动态地放置和定向治疗头从而补偿患者身体运动所需的。生理盐水导管222可以有助于生理盐水从贮存器212和生理盐水控制组件214被传送到治疗头224。类似地,可以将功率和/或控制信号从放射治疗装置216传送到治疗头224,以控制和有助于x射线管(图2中未示出)的操作。
本文所述的患者运动感测和跟踪有利地通过物理感测装置、光学感测装置或两者的集成来实现。x射线治疗头224可以直接安装在机械臂202上或附接到机械臂202。因此,可以通过从治疗头传递到机械臂的极小直接物理压力来感测施加在治疗头上的患者组织运动。这些力可以通过与正交的x、y和z坐标轴对齐的关联力矢量来限定。力感测可以通过位于整个机械臂的若干位置中的任意位置的物理传感器242、244、246、248来进行。例如,在一些情况下,物理传感器可以包括与多个机械臂关节204中的每个相关联的扭矩传感器。物理传感器可以是一个或更多个各种类型传感器的组合,比如压电的、陀螺的、固态的以及其他机制和材料。
为了有助于追踪患者的运动,可以可选地将一个或更多个基准标记226放置在患者身体的部位上。在一些情况下,基准标记可以包括光学类型的基准标记,其有助于光学跟踪与基准标记相关联的位置。基准标记的运动可以由传感器228监视。传感器228可以设置在机械臂202的一部分上或传感器支撑结构230上,该传感器支撑结构230提供了要实施iort的患者的良好可见性。传感器228可以包括适合于监视患者运动的任何类型的传感器。例如,在基准标记是光学类型的情况下,可以使用lidar方法来精确地检测每个基准标记的位置。当然,实施方式在这方面不受限制,并且可以使用任何其他合适类型的基准标记和相关联的感测系统。传感器输出由系统控制组件210监视,并由一个或更多个运动分析软件组件(跟踪系统软件)处理。
跟踪系统软件将被定期提供从物理传感器242、244、246和248接收的物理传感器信息的更新数据。同时,跟踪系统软件还有利地被提供有从一个或更多个传感器228生成的基准标记位置信息。跟踪系统软件将使用接收到的信息为机械臂生成即时校正的x、y、z坐标更新命令,该命令反映了患者组织的细微运动。随后,机械臂应移动到新的同步的x、y、z坐标/位置,以与患者的组织运动相对应。该运动校正机构将有利地以永久循环回路运行,以持续感测并跟随由呼吸或其他身体功能产生的患者组织运动。
基于这种分析,系统控制组件210控制机械臂202以确保治疗头224与患者的运动精确同步地运动。例如,治疗头可以随着患者的呼吸动作而上升和下降。
在图3中更详细地示出了治疗头224。治疗头可包括由刚性材料形成的细长管状构件304。管状构件304借助于包括合适的安装装置的基座302固定到机械臂的端部。球囊306通过轴环305或其他合适的附接机构固定到管状构件304的治疗端,使得球囊包围x射线管314。x射线管的电力由穿过密封构件322的导线316提供。端口312a、312b分别方便了流体导管310a、310b的附接。流体导管310a允许液体(例如,生理盐水)流到限定在球囊内的内部空间326。流体导管310b允许液体(例如,来自内部空间326的生理盐水)流动。在示例情况下,可以在机械臂的与附接基座302的位置相邻的一端上提供用于x射线管操作的电连接。导线316可以连接到机械臂上的电连接以向x射线管314提供电能。同样,生理盐水流体端口(未示出)可以设置在机械臂上。导管310a、310b可连接到设置在机械臂上的流体端口,以将生理盐水传送到球囊的内部空间326以及从该内部空间326传送生理盐水流体。密封构件322防止传送到球囊的生理盐水流体从可能与球囊306的内部空间326处于流体连通中的远端腔室324漏出。
成像头320可被包括在管状构件上,以提供远程操作或用于治疗记录。可以将单独的成像头330设置在球囊306内。可替代地,或除此之外,可以在管状构件304的内部提供光纤构件318。光纤可以延伸到内部空间326以在iort设置和操作过程中提供x射线源的可视图像。成像头320、330可包括支持成像模式所需的组件。例如,返回参考图1,可以提供包括图像捕获装置122的第一成像头320。第二成像头330可以包括超声换能器106。然而,本公开还构思了组合的功能性。即,单个成像头320、330可以结合超声换能器106和图像捕获装置122。
在某些情况下,包括布置在治疗头上的一个或更多个患者运动传感器328以在iort操作期间监视患者的运动可能是有利的。然而,一个或更多个传感器328不需要存在于治疗头上,而是可以设置在机械臂或其他结构上以有助于运动监视。
现在参考图4的流程图,其描述了用于机器人iort的示例性过程。该过程开始于402,并且当治疗专家移动治疗头以将其定位在已从其去除癌组织的组织腔内时继续进行至404。然后,该过程继续进行到步骤406,在该步骤中,一个或更多个基准标记可选地位于患者的身体上。根据感测的类型,基准标记的使用是可选的,但有时能够对有助于运动跟踪有帮助。在408,可以启动机械臂的运动跟踪功能,使得治疗头保持在组织腔内的选定位置。在410,外科医生可以提供组织腔的临时闭合,以有助于机器人iort。临时闭合后,iort治疗球囊在412使用生理盐水溶液扩张到预定压力。在这一点上,外科医生可以使用一个或更多个可视化工具来验证414:球囊的壁均匀地抵靠由肿瘤床限定的腔壁。
一旦满意地发现球囊已适当扩张并且放射源处于令人满意的位置,就可以在416激活放射源预定的时间段。在完成放射治疗之后,在418使球囊收缩。可以在420中断运动跟踪,之后在422将治疗头从组织腔移除。然后该过程可以在424结束或者可以执行其他治疗。
现在转向图5,示出了可与本文所述的机器人iort系统一起使用的iortx射线源500的替代类型。简而言之,该系统包括电子束枪(electronbeamgun,ebg)502和漂移管504,该漂移管被支撑在机械臂202远离基座的端部。iortx射线治疗头522位于漂移管远离ebg的端部。漂移管504包括诸如不锈钢的导电材料。替代地,漂移管可以包括具有导电内衬的陶瓷材料例如氧化铝或氮化铝。漂移管的中空内部保持在真空压力下(例如,出于本文所述实施方式的目的,合适的真空压力可以在低于约10-5托或特别是约10-9托至10-7托的范围内)。
包括电子束的电子e被ebg朝x射线目标518加速。这些电子到达漂移管的进入孔时将具有明显的动量。漂移管的中空内部保持在真空压力下,至少漂移管的内衬保持在地电位。因此,由ebg502赋予电子的动量将继续基本上以非常高的速度(例如,接近光速的速度)将电子沿漂移管的长度朝向x射线目标518传递。应当理解,随着电子沿着漂移管504的长度行进,它们不再被静电加速。
x射线目标518包括盘形元件,该盘形元件横向于电子束行进方向布置。例如,盘形元件可以设置在与电子束行进方向大致正交的平面中。在一些实施方式中,x射线目标可以包围漂移管的远离电子枪的端部,以有助于维持漂移管内的真空压力。x射线目标518几乎可以是任何材料,但是它有利地由具有高原子序数的材料例如钼、金或钨构成,以便在受到电子轰击时有助于以相对较高的效率产生x射线。
在其他方面,图5所示的布置与本文参考图3所描述的相似。x射线源(即,治疗头522)和伤口腔之间的间隙空间可填充有设置在流体气囊524内的生理盐水流体526。流体气囊可以是以流体526比如生理盐水扩张的弹性球囊状构件,从而填充x射线源与组织壁530(例如,构成肿瘤床的组织壁)之间的间隙空间528。设置在机械臂202内或机械臂202上的流体导管510、512可以有助于流体流入和流出流体气囊内部。这种布置可以通过将整个组织壁定位成与x射线源相距均匀的距离,以有助于更一致的放射照射,来帮助增强肿瘤床的放射的均匀性。在x射线目标518处产生x射线可以产生大量的热量。因此,除了填充间隙空间的流体526外,还可通过冷却剂导管506将单独的冷却剂流提供给治疗头。
构成x射线源500的各种组件(例如ebg502、漂移管504和治疗头522)可以安装在机械臂上。x射线源的位置可以如参考图1至图4所述被控制,使得x射线源的运动与接受治疗的患者的自然身体运动相协调。当然,用于机器人iort的方法不限于上述特定的iortx射线放射源。而是,现在已知或将来已知的任何合适的x射线源都可以用来有助于实施本文所述的机器人iort方法和系统。
现在参考图6,提供了可用于控制本文所述的机器人iort系统的示例性控制系统600的图示。控制系统可以包括但不限于运行windowsos的机器(或计算装置)(例如,个人计算机或服务器)。这样的机器(或计算装置)在本领域中是众所周知的,并且这里将不再详细描述。仍应理解,这样的机器被修改为实现本文描述的全部或部分方法。这样的修改可以包括软件修改、硬件修改或两者的组合。
控制系统600可以包括比图6所示的组件更多或更少的组件。然而,所示组件对于公开实现本解决方案的示例性实施方式来说是足够的。图6的硬件架构表示被配置为有助于本文所述的iort跟踪控制操作的代表性控制系统或计算装置的一个实施方式。
控制系统600的一些或全部组件可以被实施为硬件、软件和/或硬件和软件的组合。硬件包括但不限于一个或更多个电子电路。电子电路可以包括但不限于无源组件(例如,电阻器和电容器)和/或有源组件(例如,放大器和/或微处理器)。无源和/或有源组件可以被适配为、布置为和/或编程为执行本文描述的方法、过程或功能中的一个或更多个。
如图6所示,控制系统600包括用户界面602、中央处理单元(“cpu”)606、系统总线610、通过系统总线610连接到计算设备600的其他部分并可由其访问的存储器612、以及连接到系统总线610的硬件实体614。用户界面可以包括输入装置和输出装置,该输入装置和输出装置有助于进行用于控制计算装置600的操作的用户-软件交互。输入装置包括但不限于物理和/或触摸键盘650。输入装置可以经由有线或无线连接(例如,
至少一些硬件实体614执行涉及访问和使用存储器612的动作,该存储器可以是随机存取存储器(“ram”)、磁盘驱动器和/或光盘只读存储器(“cd-rom”)。硬件实体614可以包括磁盘驱动器单元616,该磁盘驱动器单元包括计算机可读存储介质618,其上存储有被配置为实现本文所描述的方法、过程或功能中的一个或更多个的一组或更多组指令620(例如,软件代码)。指令620在由计算装置600执行期间,也可以全部或至少部分地驻留在存储器612内和/或cpu606内。存储器612和cpu606还可以构成机器可读介质。如本文所用,术语“机器可读介质”是指存储一个或更多个集的指令620的单个介质或多个介质(例如,集中式或分布式数据库和/或相关联的高速缓存和服务器)。在此使用的术语“机器可读介质”还指能够存储、编码或携带一组指令620的任何介质,该指令620由控制系统600执行并且使得控制系统600执行本公开的任何一个或更多个方法。
在一些情况下,硬件实体614包括被编程为有助于对机械臂的控制的电子电路(例如,处理器)。在这方面,应当理解,电子电路可以访问并运行安装在计算装置600上的应用程序624。
现在参考图7和8,其中示出了球囊724,其能够用于使用本文所述的任何x射线源的iort。球囊724可以由诸如尼龙、pebax、pet或聚氨酯的材料形成。此外,球囊材料可以包括这种材料的混合物和/或组合物。例如,这种材料的单层、双层或多层是可能的。球囊材料被有利地选择为使得其相对于要施加的x射线放射的范围是射线可透过的。
图7和图8中所示的布置与本文参考图3和图5所描述的相似。x射线源(即,治疗头722)和伤口腔之间的间隙空间可以填充有位于气囊或球囊724内的流体726(例如,生理盐水)。球囊或流体气囊可以是弹性球囊状构件,其用流体比如生理盐水扩张,从而填充x射线源与组织壁730(例如,构成肿瘤床的组织壁)之间的间隙空间728。设置的流体导管710、712可有助于流体流入和流出球囊内部。
多个x射线放射传感器元件(xrse)732设置在球囊724的外表面734上。在图9所示的替代性实施方式中,xrse723可以被集成在构成球囊的一个或多个层内或设置在该一个或多个层之间。xrse732设置在多个预定位置。在一些情况下,这些位置可以与限定x、y和z坐标系的多个正交轴中的每个对齐。在这种情况下,与治疗头相关联的x射线放射源通常可以在正交轴相交的原点对齐。在其他情况下,多个xrse可以与限定卵形或大致球形网格的多个点对齐。本文所用的术语卵形或球形网格可以是一组点,这些点均匀地(或半均匀地)设置在由球囊所限定的卵形或近似球形的表面上。
可以采用包括任何合适类型的x射线感测技术的装置来实现本文公开的xrse。例如,这些检测器可以包括固态半导体材料(通常基于硅或锗芯片)、硅漂移检测器(sdd)或pin二极管检测器。与其他类型的x射线检测装置相比,pin二极管检测器具有优势:利用的检测器元件小得多。
固态x射线检测器在本领域中是众所周知的,在此将不进行详细描述。然而,应注意,存在可用于实现固态x射线检测器的各种类型的半导体材料,包括但不限于硅(si)、锗(ge)和碲化镉(cdte)。入射在半导体上的x射线光子将与材料相互作用以产生电子-空穴对。产生的电子-空穴对将与放射强度成比例地增加。因此,电子空穴对可以产生电信号以指示x射线放射的强度。
各种方式可有助于多个xrse与控制系统之间的电力和/或信号通信。在一些情况下,导电导线或光纤可用于促进此类功能。这些通信/电力线736可以从每个xrse732延伸到合适的连接器738,来自每个xrse的信号可通过该合适的连接器738被控制系统接收。在一些情况下,信号通信/电力线可以与球囊分开。然而,在其他情况下,可以使用印刷电路方法将通信/电力线740集成在球囊的表面中或直接布置在球囊的表面上。在这种情况下,导线可以固定到球囊的外表面,如图8所示。可选地,如图9所示,导线(例如,电力/通信导线903)可以与形成球囊的材料层(例如,在材料层902a,902b之间)集成或设置在其内。在一些情况下,电力/通信导线可以由与球囊的表面一起弯曲或伸展的材料形成,使得随着球囊的扩展和收缩,通信/电力导线保持完整。
当前的解决方案还预期了xrse和控制系统之间的无线通信。在这种情况下,每个xrse可以具有用于至和/或来自控制系统的数据通信的特定逻辑地址。可以将一个或更多个xrse连接到无线通信电路,以将测量的x射线强度数据传输到控制系统。在一些情况下,无线通信电路可以与球囊集成。可以使用任何适当的方法来实现本文描述的一个或更多个无线通信电路,包括但不限于诸如
当将某些材料暴露于x射线时,将发生电离,这涉及从原子中射出一个或更多个电子。电子的去除导致电子结构的不稳定性,从而导致较高轨道的电子“落入”较低轨道。这种活动以光子的形式释放能量。因此,发出了辐射,该辐射具有由材料决定的特定的特征能量。该活动通常被称为荧光。
现在参考图10,其示出了替代实施方式,在该替代实施方式中,xrse932响应于x射线能量,使得每个xrse932将发荧光或辐射电磁能。在一些情况下,荧光强度将对应于接收到的x射线能量的水平。随着x射线能量的增加,xrse更强地发出荧光。相反,随着x射线能量减少,xrse的荧光强度将降低。可替代地,xrse可以被配置为响应于暴露于x射线能量而经历颜色变化。一个或更多个图像捕获装置可以利用光纤934或其他成像元件来捕获示出球囊的内表面的图像。因此,治疗从业者可以接收施加到球囊内部的所有表面的x射线剂量的视觉指示。可以基于传感器颜色变化,或者根据观察x射线施加的同时发生荧光的持续时间,从视觉上评估治疗剂量。在一些情况下,控制系统可以监视和/或记录荧光的颜色变化和/或强度。使用图像处理技术,每个xrse都可以由控制系统标记并分配唯一的索引号或地址,然后可以由控制系统进行监视。这种方法的优势在于,它极大地简化了xrse,并简化了电力和数据通信所需的耦接。然而,需要另外的图像处理来捕获和评估每个xrse932接收的x射线能量。
在一些情况下,本文描述的xrse932可以以与使用x射线装备的人员使用的x射线剂量测定徽章的操作相似的方式操作。如所已知的那样,与某些此类x射线剂量测定徽章一起使用的材料(氧化铝)在暴露于x射线放射且然后以特定波长的激光辐射时会发出可见光。可以测量释放的激发能量以确定放射剂量。因此,预期在一些情况下,可以在球囊内提供激光激发源,以有助于进行本文所述的x射线剂量测定。
尽管已经参考一个或多个实施方式示出和描述了本发明,但是本领域的其他技术人员在阅读和理解本说明书和附图之后将想到等同的变更和修改。另外,尽管本发明的特定特征可能已公开在若干实施方式中的仅一个实施方式中,这种特征可以与其他实施方式的一个或更多个其他特征组合,这对于任何给定或特定的应用可能是合乎期望且有利的。
- 还没有人留言评论。精彩留言会获得点赞!