制备血小板裂解物级分的方法、血小板裂解物级分及其用于治疗中枢神经系统疾病的用途与流程
本发明涉及用于获得血小板裂解物级分的方法、所述血小板裂解物级分本身及其用于治疗中枢神经系统疾病(诸如神经退行性疾病、神经炎性疾病、神经发育和/或神经血管疾病(即中风)),以及脑损伤(诸如创伤性脑损伤或缺氧)后果的用途。
背景技术:
考虑到这些疾病给患者和护理人员带来的巨大的社会和经济影响,迫切需要开发提供神经保护、神经修复和神经形成的有效的“疾病改良策略”,从而治疗神经退行性疾病,诸如帕金森病(pd)、肌萎缩性侧索硬化症(als)和阿尔茨海默病(ad)。
考虑到缺乏有效的治疗方法,还在很大程度上等待开发提供神经修复和神经形成的有效的治疗方法,以补偿神经元的丧失和中枢神经系统的损伤,诸如分娩或心脏骤停后出现严重的缺氧或严重的创伤性脑损伤。
有实质性证据表明,作为神经元信号通路的激活剂和调节剂的神经营养因子代表了神经系统疾病的合乎逻辑的治疗策略。单个重组神经营养生长因子的应用为细胞和动物模型中的神经元保护和修复提供了令人鼓舞的结果。
血小板源性生长因子-cc(pdgf-cc)在几种神经元损伤动物模型中被证明是有效的神经保护因子,而通过脑室内(icv)途径施用的pdgf-bb和脑源性神经营养因子(bdnf)刺激神经形成。此外,在局灶性中风中的光血栓形成模型中系统性施用bdnf可以诱导神经形成并改进感觉运动功能。转化生长因子-β(tgf-β)可以促进帕金森病动物模型中多巴胺能神经元的发育和存活,以及帕金森病动物模型中的神经保护,并增强神经胶质源性神经营养因子(gdnf)在半帕金森病大鼠中的营养作用1。
临床前研究显示通过碱性成纤维细胞生长因子(b-fgf)和血管内皮生长因子-β(vegf-β)的神经保护,以及通过gdnf促进神经保护和神经修复。不幸的是,所有涉及icv高剂量单一生长因子施用的随机临床研究均未产生任何实质性的积极临床效果。当前,在这种复杂和多层面的神经退行性病变中施用单一神经营养因子不足以产生有意义的治疗结果。
因此,需要开发一种新途径,该途径可能更有效、使用更安全并且更易于制备,但这在概念上具有挑战性,特别是要寻求监管部门的批准,从而证明了受再生医学其他领域启发的更务实策略。
血小板浓缩物是一种在who基本药物模型清单上公认的治疗产品,其典型地用于预防和治疗血小板减少引起的出血性疾病。除了其在止血中的作用外,血小板还在伤口愈合和组织修复中发挥重要的生理功能2。
评估血小板和血小板裂解物的再生医学3和细胞疗法4的应用范围正在扩大。血小板在组织愈合中的治疗益处是多因素的,原因是无数的生物活性介质主要存储在α颗粒中并起协同作用。这些包括神经营养生长因子,诸如pdgf(-aa、-ab和-bb亚型)、bdnf、vegf、tgf-β、bfgf或上皮生长因子(egf)。最近表明在中风的动物模型中颅内递送血小板裂解物可刺激内源性神经干细胞(ensc)的增殖以及脑室下区域和病变周围皮层中的血管生成,从而改进功能结果并减少损伤,并表明神经保护作用5。
此外,血小板裂解物包含大量尚未完全表征的分子和化合物,但是众所周知,血小板裂解物包含血浆中的纤维蛋白原,这种蛋白作为有效的炎症诱导剂和神经突生长抑制剂在神经系统疾病中起重要作用。这可能是为什么尚未报道将血小板裂解物或衍生自血小板裂解物的产品应用于人中枢神经系统疾病(诸如帕金森病或肌萎缩性侧索硬化症)领域的原因。
技术实现要素:
因此,申请人的功劳在于能够发现新的衍生自血小板裂解物的产物,其特别用于治疗中枢神经系统的疾病,并表现出尚未被发现的特性。特别地,申请人已成功获得表现出强大神经保护作用的不同血小板裂解物级分。
在第一方面,本发明涉及一种制备血小板裂解物级分的方法,所述方法包括以下步骤:
1)提供血小板裂解物,
2)从所述血小板裂解物收集其中所述组分表现出的最大分子量为100kda的血小板裂解物级分。
根据本发明,所述方法的第一步骤在于提供血小板裂解物。该血小板裂解物可以是血小板沉淀裂解物(ppl)或混合人血小板裂解物(phpl)。优选地,该血小板裂解物是混合人血小板裂解物(phpl)。
ppl和phpl均可以根据众所周知的方法由血小板浓缩物(pc)制备,其诱导生长因子和其他活性分子的释放。
在第一实施方案中,步骤1)中提供的血小板裂解物是血小板沉淀裂解物(ppl)。ppl可以按本领域所描述的来制备6。例如,它可以按如下制备:
i)提供血小板浓缩物(pc),
ii)将所述血小板浓缩物离心,以获得血小板沉淀和第一上清液,
iii)去除上清液并将沉淀悬浮于生理缓冲液中,
iv)将所述悬浮的沉淀冷冻-解冻,
v)将步骤iv)中获得的悬浮液离心,以获得血小板沉淀物裂解物和第二上清液。
步骤i)中提供的血小板浓缩物可以通过合适的标准收集方法从自体或同种异体血小板来源(特别是从全血)获得,或通过机采方法获得,并悬浮在血浆、或血浆和血小板添加剂溶液的组合、或仅血小板添加剂溶液中7。此外,血小板浓缩物可以是白细胞减少的。
例如,步骤iii)中使用的合适的生理缓冲液可以是磷酸盐缓冲盐水(pbs)、hepes缓冲液、tris-hcl缓冲液或醋酸钠缓冲液,或生理盐水。
血小板沉淀裂解物(ppl)可以是新鲜ppl(pplf)或过期ppl(pple),优选pplf。术语新鲜ppl是指由收集后5天内处理的血小板浓缩物制备的血小板沉淀裂解物(未过期)。术语过期ppl是指由储存5天后处理的血小板浓缩物制备的血小板沉淀裂解物。
根据第二实施方案,步骤1)中提供的血小板裂解物是混合人血小板裂解物(phpl)。例如,可以通过包括以下步骤的方法来制备phpl:
a)提供血小板浓缩物,
b)分别裂解步骤a)的每种血小板浓缩物,和
c)混合步骤b)得到的裂解物,以获得混合人血小板裂解物。
步骤a)中提供的血小板浓缩物可以来自不同的供体,并且可以通过合适的标准收集方法从同种异体血小板来源获得。特别地,血小板浓缩物可以使用血沉棕黄层或富血小板血浆(prp)技术从全血中获得,或者可以通过单采技术收集。优选地,使用血沉棕黄层或(prp)技术从全血中生产血小板浓缩物8。
在“prp法”中,在确认可从含有血小板和血浆混合物的上半部分分离出红细胞(rbc)的条件下,使用软旋转离心抗凝全血,即所谓的prp。然后,通过具有经验证的加速和减速曲线的硬旋转离心血小板浓缩物。将血小板浓缩物袋在室温下静置,然后将浓缩物重新悬浮于血浆中。在“血沉棕黄层”方法中,使用具有经验证的加速和减速曲线的硬旋转离心抗凝全血,以分离顶层上的“无细胞”血浆、称为血沉棕黄层(bc)的中间层和红血球(rbc)底层。将bc层转移到卫星袋中。将少量血浆返回bc层并缓缓混合,然后再次以经验证的加速和减速曲线进行轻纺离心(lightspinningcentrifugation)。然后,将prp上清液置于血小板储存器中,并可以在22+/-2℃下储存。
在单采法中,可通过用于献血的体外医疗装置获得血小板浓缩物,该装置将血小板分离并将血液的其他部分返还给供体。
“prp法”中用于悬浮浓缩物的血浆、“血沉棕黄层”法中返回bc层的血浆、或通过单采法与血小板一起收集的血浆可被血小板添加剂溶液(pas)或血浆与pas的混合物替代,优选被血浆与pas的混合物替代。所述血浆与pas的混合物可以包含约30重量%-40重量%的血浆和约70重量%-60重量%的pas。
可以对步骤a)中提供的血小板浓缩物进行白细胞去除处理。该处理导致白细胞耗尽,这可以通过在白细胞减少过滤器上过滤或在通过单采法收集血小板期间实现。
在裂解之前,可以对步骤a)中提供的血小板浓缩物进行病毒/病原体灭活处理步骤。应用于血小板浓缩物的病毒/病原体灭活处理可以选自
还可以对血小板浓缩物进行白细胞去除处理和病毒/病原体灭活处理。优选地,在病毒/病原体灭活处理之前进行白细胞去除处理。
可以通过本领域已知的任何方法实现步骤b)的分别裂解每种血小板浓缩物。例如,可以通过一个或多个冷冻/解冻循环,通过由添加凝血酶或cacl2诱导的血小板活化,通过超声处理或通过溶剂/洗涤剂(s/d)处理来实现血小板裂解。优选地,通过一个或多个冷冻/融化循环,更优选地至少三个循环来实现步骤b)的裂解。当通过前述方法之一实现裂解时,也可以进行离心和过滤步骤以去除细胞碎片。
然后,步骤c)在于混合裂解物,以获得混合人血小板裂解物,也称为phpl。因此,通过混合来自不同供体的至少2种血小板裂解物的裂解的血小板浓缩物来获得混合hpl。优选地,通过混合从不同供体收集的至少5种、至少10种、至少20种、至少30种、至少40种、至少50种、至少100种、至少140种、至少180种、至少200和更特别地至少240种不同血小板裂解物获得混合hpl。
用于本发明的方法的合适的混合人血小板裂解物(phpl)可以是来自血液机构或商业供应商的任何混合人血小板裂解物。例如,混合人血小板裂解物可获自macopharma(tourcoing,france;multipl’30
根据该第二实施方案,可以对phpl进行诱导凝血级联活化的处理。例如,可以在搅拌下将phpl与玻璃珠(gb)和cacl2混合,或者仅使用cacl2。该处理导致在离心后去除的凝块形成,因此所得的phpl不含纤维蛋白原。不受任何理论的束缚,发明人相信该处理有助于降低根据本发明获得的血小板裂解物级分的毒性并改进神经保护作用。
该方法的第二步骤在于收集其中所述组分表现出的最大分子量为100kda的血小板裂解物级分。因此,收集的经热处理的血小板裂解物级分可以不包含分子量大于100kda的组分。
在本发明的含义中,其中所述组分表现出的最大分子量为xkda的血小板裂解物级分称为“血小板裂解物xkda级分”或“xkda级分”,例如“血小板裂解物100kda级分”或“100kda级分”。
特别地,进行收集步骤以获得血小板裂解物级分,其中所述组分表现出的最大分子量为100kda、90kda、80kda、70kda、60kda、50kda、40kda、30kda、20kda、10kda、5kda、3kda或1kda。换言之,血小板裂解物级分可以不包含分子量大于100kda、90kda、80kda、70kda、60kda、50kda、40kda、30kda、20kda、10kda、5kda、3kda或大于1kda的组分。
根据该第二步骤,如此获得的级分优选是血小板裂解物50kda级分、血小板裂解物30kda级分、血小板裂解物20kda级分、血小板裂解物10kda级分和血小板裂解物3kda级分,更优选血小板裂解物10kda级分和血小板裂解物3kda级分,甚至更优选血小板裂解物3kda级分。
令人吃惊且出乎意料的是,发明人发现,尽管对血小板裂解物进行收集步骤以去除组分,但本发明的血小板裂解物级分显示出强大的神经保护活性。实际上,如此获得的级分仍然发挥神经保护作用,同时预期根据其分子量去除一些组分将导致所述作用的丧失。仍然令人惊讶地,最小级分获得了神经保护活性,而对此据信缺乏高分子量的组分将对神经保护活性有害。
因此,本发明代表提供中枢神经系统疾病的替代治疗的重大突破。
收集步骤可以通过本领域已知的任何方法进行,所述方法导致根据其分子量分离和/或浓缩液体中所含的组分。
在一个实施方案中,收集步骤可在于分级通过离心血小板裂解物获得的上清液,以收集所谓的血小板裂解物100kda级分。在该实施方案中,可以通过超滤进行分级。根据该超滤方法,可以使用截止值为100kda的具有垂直膜的离心过滤器。因此,离心过滤器填充有在第三步骤之后获得的上清液,并进行离心。角转子、旋转速度和旋转时间可以由本领域技术人员确定。此外,本领域技术人员可以调整所使用的截止值,以获得根据本发明的所需血小板裂解物级分。
本发明的血小板裂解物级分具有降低的蛋白质含量。表述“降低的蛋白质含量”是指所述级分包含小于1.5μg/μl,优选小于1.0μg/μl,更优选小于0.70μg/μl的蛋白质。蛋白质含量可以通过本领域已知的任何方法来测定,例如通过lowry蛋白测定法或通过elisa来测定。
具体地,血小板裂解物3kda级分可具有约0.05μg/μl-约0.30μg/μl,特别是约0.05μg/μl-约0.30μg/μl的蛋白质含量,并且更特别地约0.05μg/μl-约0.1μg/μl的蛋白质含量。此外,血小板裂解物3kda级分优选不含纤维蛋白原并且不含生长因子。
本发明的方法可以包括将经热处理的血小板裂解物级分储存在-80℃以供进一步使用的额外步骤。
在一个优选的实施方案中,在收集步骤之前,本发明的方法还可包括在约50℃-约70℃的温度下将血小板裂解物热处理15分钟-45分钟的步骤;以及离心所述经热处理的血小板裂解物并保留上清液的步骤。
热处理步骤优选在不添加通常用于维持蛋白质的生物活性的稳定剂的情况下进行。例如,这种稳定剂是蔗糖、山梨醇、甘露醇或氨基酸(诸如精氨酸或赖氨酸)。
据信热处理步骤引起一些蛋白质的沉淀,因此在离心步骤之后将其去除。蛋白质含量降低对于一些应用可能是更有利的,例如在通过鼻内施用治疗中枢神经系统疾病中。
热处理步骤可以在约50℃-约70℃的温度下进行,优选在约50℃-约60℃的温度下,更优选在约54℃-58℃的温度下进行。例如,热处理步骤在56℃下进行。
热处理步骤的持续时间可以是15-45分钟,优选20-40分钟,并且更优选25-35分钟。例如,热处理步骤进行30分钟。
离心可以有利地在约2℃-6℃的温度下进行。离心步骤的持续时间为至少10分钟,并且速度可以为约8000xg-约12000xg,优选为约9000xg-约11000xg,并且更优选为约10000xg。回收上清液并用于该方法的收集步骤。
根据该实施方案,在收集步骤之后所得的血小板裂解物级分是经热处理的血小板裂解物级分。
令人惊讶且出乎意料地发现,尽管血小板裂解物经过热处理步骤和收集步骤,但根据本实施方案的经热处理的血小板裂解物级分在神经保护方面显示出强大作用。
此外,体外测定表明,根据本发明方法制备的级分,无论有没有热处理步骤,都可以保护多巴胺能细胞免于由神经毒素诱导的死亡。不受任何理论的束缚,发明人认为,级分的改进的神经保护活性是其降低的蛋白质含量(例如血纤蛋白原含量)的结果,以及分子量不大于100kda,特别是不大于50kda、30kda、20kda、10kda或3kda的化合物浓缩的结果。体外获得的结果已通过肌萎缩性侧索硬化症(als)的已知模型(其是一种过表达铜/锌超氧化物歧化酶基因突变形式的转基因小鼠)上的体内测定得到证实。
特别地,还认为收集步骤和任选的热处理导致纤维蛋白原和蛋白水解酶(诸如凝血酶或凝血酶样或产生凝血酶的凝血因子)的减少或耗尽,并且特别地热处理步骤沉淀可能有毒的热不稳定蛋白质和/或使可能有毒的热不稳定蛋白质失活,并有利地改变所得级分以及改变组分的分子量平衡并增强神经保护作用的收集中的蛋白质和生长因子平衡。因此,所得的血小板裂解物级分可以避免对大脑有毒的纤维蛋白形成的生物学风险。
因此,与悬浮于血浆中的标准人血小板裂解物相比,根据本发明获得的血小板裂解物级分提供了明显更高的安全系数,并且更适合且更有效地用于生物疗法,尤其是通过脑部施用。
如上所述,通过本发明方法获得的血小板裂解物级分提供了改进的神经保护活性。
在第二方面,本发明涉及血小板裂解物级分。可以根据上述方法获得血小板裂解物级分。因此,根据本发明的血小板裂解物级分特别是其中组分表现出的最大分子量为100kda的血小板级分。
特别地,根据本发明的血小板裂解物级分是血小板裂解物50kda级分、血小板裂解物30kda级分、血小板裂解物20kda级分、血小板裂解物10kda级分或血小板裂解物3kda级分。更优选地,本发明的级分是血小板裂解物10kda级分或血小板裂解物3kda级分,甚至更优选地是经热处理的血小板裂解物3kda级分。
本发明的血小板裂解物级分具有降低的蛋白质含量。表述“降低的含量”是指所述级分包含小于1.5μg/μl,优选小于1.0μg/μl,更优选小于0.70μg/μl的蛋白质。
具体地,血小板裂解物3kda级分可具有约0.05μg/μl-约0.30μg/μl,特别是约0.05μg/μl-约0.30μg/μl的蛋白质含量,并且更特别地具有约0.05μg/μl-约0.1μg/μl的蛋白质含量。此外,经热处理的血小板裂解物3kda级分优选不含纤维蛋白原。
可以通过上述方法获得血小板裂解物级分。
根据本发明的血小板裂解物级分显示出强大的神经保护活性,并且特别有利于治疗中枢神经系统疾病。更特别地,最小的血小板裂解物级分,即血小板裂解物10kda级分或血小板裂解物3kda级分,可以更容易地通过鼻腔以渗透入脑中并发挥神经保护作用。
在第三方面,本发明涉及根据本发明的血小板裂解物级分用作生物药物或“生物疗法”的用途。
实际上,归功于其改进的神经保护活性和其较高安全性,血小板裂解物级分可用于治疗和/或预防中枢神经系统疾病。
换言之,本发明还涉及一种治疗和/或预防中枢神经系统疾病的方法,包括向有需要的患者施用治疗有效量的本发明的血小板裂解物级分。优选地,患者是温血动物,更优选是人。
在本发明含义内的中枢神经疾病包括但不限于神经退行性疾病、神经血管疾病、神经炎性疾病、神经发育疾病(诸如自闭症和精神分裂症)、脑损伤(诸如分娩或心脏骤停后的严重缺氧或严重的颅脑外伤/创伤性脑损伤(即引起导致残疾的神经元大量丧失的严重损伤))。
在优选的实施方案中,中枢神经疾病是神经退行性疾病。在本发明含义内的神经退行性疾病包括但不限于多发性硬化症(ms)、帕金森病(pd)、亨廷顿氏病(hd)、肌萎缩性侧索硬化症(als)、中风、年龄相关性黄斑变性(amd)、视网膜退化性疾病、和痴呆,后者包括但不限于阿尔茨海默氏病(ad)、血管性痴呆、额颞痴呆、词义性痴呆和路易体痴呆。优选地,神经退行性疾病选自阿尔茨海默氏病、帕金森病、亨廷顿氏病、多发性硬化症和肌萎缩性侧索硬化,更优选选自帕金森病和肌萎缩性侧索硬化。
在其他实施方案中,中枢神经疾病是中枢神经系统损伤,诸如分娩或心脏骤停后的严重缺氧或严重的颅脑外伤(即引起导致残疾的神经元大量丧失的严重损伤)。损伤后用血小板裂解物级分进行早期治疗可增强生理神经修复和神经发生能力。
血小板裂解物级分可以原样、包封于天然或合成的纳米颗粒9或微粒中、或包含于药物溶液中施用,所述药物溶液还包含至少一种药学上可接受的载体、稀释剂、赋形剂和/或佐剂。所述药物溶液还可包含复合物、分子、肽、盐、载体或任何可以改进或有益于治疗神经系统疾病的其他化合物。
施用途径和给药方案自然取决于疾病的严重程度、患者的年龄、体重和性别等。本发明的血小板裂解物级分可用于治疗任何患者,尤其是温血动物,诸如哺乳动物,优选人。
有利地,根据本发明的血小板裂解物级分适合于在中枢神经系统中施用。具体地,所述血小板裂解物级分适用于鼻内(例如,作为黑质、纹状体和靠近鼻腔的嗅球的病理的帕金森病)或鞘内(例如,用于作为脊髓病理的肌萎缩性侧索硬化)或脑室内(icv)施用,优选封闭于脑室孔中,从而将血小板裂解物级分施用于第三脑室。
由于最小的血小板裂解物级分仍表现出神经保护活性,因此它们对于鼻内施用特别有效。实际上,归功于它们的低分子量组分,这些级分可以容易地通过鼻腔渗入大脑,这对于本发明治疗中枢神经系统的疾病的目的是有利的。此外,就安全性而言,患者使用包含更少组分的血小板裂解物从神经保护作用中获益是更加有利的。
可以通过本领域已知的方法来实现中枢神经系统的施用。例如,可以使用诸如可编程药物泵的药物递送系统进行施用。
也可以通过本领域技术人员已知的任何其他方法进行本发明的血小板裂解物级分的施用,例如静脉内、腹膜内、肌内或眼内施用、或器官的灌注或输注(即向一部分脑组织直接输注)。
可以根据各种参数,特别是根据所使用的施用方式、相关病理或期望的治疗持续时间来调节用于施用的暴露剂量。
定义
以下定义和解释是针对整个申请(包括说明书和权利要求书)中使用的术语。
“神经保护活性”或“神经保护”是指与不受神经毒素影响的神经元细胞相比,受神经毒素影响的神经元细胞的神经元结构和/或功能的保留。神经保护旨在通过停止或至少减慢神经元的丧失来预防或减缓疾病的发展和继发性损伤。例如,它是指与不患有帕金森病的患者相比,保留患有帕金森病的患者的纹状体和/或黑质致密部中神经元的数量。
“神经修复”是指补偿现有改变,并刺激受损神经活动的结构和功能恢复。
术语“患者”是指等待或接受医疗护理或将成为医疗过程对象的温血动物,更优选是人。
术语“人”是指两种性别且处于任何发育阶段的受试者(即新生儿、婴儿、少年、青少年、成人)。在一个实施方案中,人是青少年或成人,优选成人。
如本文所用,术语“治疗”是指包括减轻或消除病症或疾病和/或其伴随症状。
如本文所用,术语“预防”是指延迟或阻止病症或疾病和/或其伴随症状的发作、阻止患者患上病症或疾病、或降低患者患上病症或疾病的风险的方法。
如本文所用,术语“治疗有效量”(或更简单地为“有效量”)是指本发明的血小板裂解物级分的量,其足以在施用其的个体中实现所需的治疗或预防效果。
术语“施用”是指向病症、症状或疾病待治疗或预防的患者提供单独的或作为药学上可接受的溶液的一部分的本发明的血小板裂解物级分。
参考以下实施例和附图将更好地理解本发明。这些实施例旨在代表本发明的特定实施方案,而不旨在限制保护范围。
附图说明
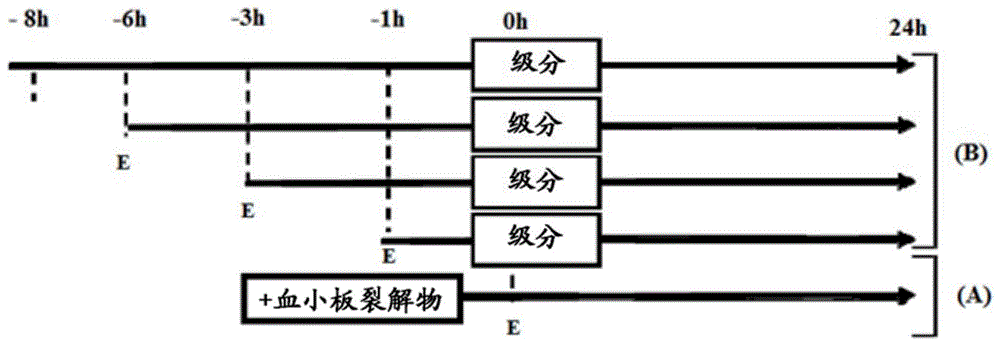
图1:用血小板裂解物和血小板裂解物级分处理的时间进程。在erastin(a)之前1h或erastin(b)之后1h、3h、6h和8h添加血小板裂解物(对照)和级分。
图2:通过细胞计数法测量的50kda、h-50kda、30kda、h-30kda、10kda、h-10kda、3kda和h-3kda级分的神经保护作用。通过碘化丙啶测定法测量活力,并相对于对照(未处理的细胞)+/-sem标准化(对于50kda、30kda、10kda,n=1;对于3kda,n=2)。
图3:通过刃天青测量的50kda、h-50kda、30kda、h-30kda、10kda和h-10kda级分的神经保护作用。在erastin(e)之前处理1h。测量活力并相对于对照(未处理的细胞)n=1标准化。
图4:通过刃天青测量的3kda和h-3kda级分的参与途径和神经保护作用。在erastin(e)之前处理1h。iakt:akt抑制剂,e:elastin。测量活力并相对于对照(未处理的细胞)+/-sem标准化(n=4)。
图5:通过刃天青测量的3kda和h-3kda级分的神经保护作用。erastin(e)后1h、3h、6h或8h处理luhmes细胞。
图6:通过h-3kda级分的细胞测定法测量的神经保护作用。在erastin(e)之前处理1h。测量活力并相对于对照(未处理的细胞)+/-sem标准化(对于phpl、h-phpl、h-phpl-gb,n=4;对于h-3kda,n=2)。
图7a:用载体和h-ppl稀释的制剂处理的雄性小鼠的体重演变。雄性wt:雄性野生型,雄性tg:雄性fvb-tg(sod1*g86r),veh:载体。
图7b:用载体和h-ppl稀释的制剂处理的雌性小鼠的体重演变。雌性wt:雌性野生型,雌性tg:雌性fvb-tg(sod1*g86r),veh:载体。
图8:用载体和h-ppl稀释的制剂处理的雄性和雌性小鼠的存活曲线。雄性tg:雄性fvb-tg(sod1*g86r),雌性tg:雌性fvb-tg(sod1*g86r)。
图9a:用载体和h-3kda制剂每周三次处理的雄性小鼠的体重演变。雄性wt:雄性野生型,雄性tg:雄性fvb-tg(sod1*g86r),veh:载体。
图9b:用载体和h-3kda制剂每周三次处理的雌性小鼠的体重演变。雌性wt:雌性野生型,雌性tg:雌性fvb-tg(sod1*g86r),veh:载体。
图10:用载体和h-3kda制剂每周三次处理的雄性和雌性小鼠的存活曲线。雄性tg:雄性fvb-tg(sod1*g86r),雌性tg:雌性fvb-tg(sod1*g86r)。
图11a:用载体和h-3kda制剂每周六次处理的雄性小鼠的体重演变。雄性wt:雄性野生型,雄性tg:雄性fvb-tg(sod1*g86r),veh:载体。
图11b:用载体和h-3kda制剂每周六次处理的雌性小鼠的体重演变。雌性wt:雌性野生型,雌性tg:雌性fvb-tg(sod1*g86r),veh:载体。
图12:用载体和h-3kda制剂每周六次处理的雄性和雌性小鼠的存活曲线。雄性tg:雄性fvb-tg(sod1*g86r),雌性tg:雌性fvb-tg(sod1*g86r)。
具体实施方式
在整个说明书、附图和权利要求书中使用以下缩写:
10kda级分:血小板裂解物10kda级分
30kda级分:血小板裂解物30kda级分
3kda级分:血小板裂解物3kda级分
50kda级分:血小板裂解物50kda级分
h-10kda级分:经热处理的血小板裂解物10kda级分
h-30kda级分:经热处理的血小板裂解物30kda级分
h-3kda级分:经热处理的血小板裂解物3kda级分
h-50kda级分:经热处理的血小板裂解物50kda级分
h-phpl:经热处理的混合人血小板裂解物
h-phpl-gb:与玻璃珠(gb)混合并进行热处理的混合人血小板裂解物
hpl:人血小板裂解物
h-ppl:经热处理的血小板沉淀裂解物
icv:脑室内
pas:血小板添加剂溶液
pbs:磷酸盐缓冲盐水
pc:血小板浓缩物
phpl:混合人血小板裂解物
pl:血小板裂解物
ppl:血小板沉淀裂解物
pple:来自过期pc的血小板沉淀裂解物
pplf:来自未过期pc的血小板沉淀裂解物
prp:富含血小板的血浆
rbc:红细胞
实施例1:以血小板沉淀裂解物(ppl)作为起始血小板裂解物材料的实验
材料和方法
1.制备血小板沉淀裂解物和血小板裂解物级分
血小板裂解物获自血小板浓缩物(etablissement
收集称为“血小板沉淀裂解物”(ppl)的上清液,等分并储存在-80℃。
将一部分ppl在56℃热处理30分钟,然后在4℃下以10000xg离心15分钟,然后将称为“经热处理的血小板沉淀裂解物”(h-ppl)的上清液等分并储存在-80℃。
通过使用amiconultra-0.5超滤管(包括不同的截止值)(amiconultra-0.5centrifugalfilterdevices,millipore)进行分级步骤从ppl和h-ppl获得血小板裂解物级分。
简言之,将500μlppl或h-ppl添加到插入收集管的过滤器中,并以40°的定角转子在4℃下以14000xg离心30分钟。根据所使用的截止值,当从ppl获得时,低于截止值的下部的滤液或血小板裂解物级分称为50kda级分、30kda级分、10kda级分和3kda级分,并且当从h-ppl获得时,低于截止值的下部的滤液或血小板裂解物级分称为h-50kda级分、h-30kda级分、h-10kda级分和h-3kda级分。
然后,将不同的血小板裂解物级分等分并储存在-80℃下用于进一步的实验。
2.luhmes细胞的维持和分化
luhmes细胞获自scholz博士的实验室(universityofkonstanz,germany),并如所描述的进行培养10。
简言之,将未分化的luhmes细胞使用nunclontm(nunc,roskilde,denmark)塑料细胞培养瓶和多孔板进行繁殖,所述培养瓶和多孔板用50μg/ml聚l-鸟氨酸和1μg/ml纤连蛋白(sigma-aldrich,st.louis,mo,usa)在37℃下于水中预包被3小时。去除包被溶液后,用无菌蒸馏水洗涤培养瓶并风干。
使细胞在湿润的95%空气、5%co2气氛中于37℃下生长。增殖培养基是含有1×n-2补充剂(invitrogen,karlsruhe,germany)、2mml-谷氨酰胺(gibco,rockville,md,usa)和40ng/ml重组bfgf(r&dsystems)的advanceddulbecco’smodifiedeagle’s培养基(advanceddmem)/f12。当达到约80%汇合时,将细胞用0.025%胰蛋白酶溶液(gibco,rockville,md,usa)分离,并以3x106个细胞/瓶传代。
为了诱导分化为神经元细胞,接种2×106个luhmes并在t75烧瓶中于增殖培养基中生长48小时,然后在含有1×n-2补充剂、2mml-谷氨酰胺(gibco)、1mm二丁酰camp(sigma-aldrich)、1μg/ml四环素(sigma-aldrich)和2ng/ml重组人gdnf(r&dsystems)的advanceddmem/f12中生长。在分化条件下培养两天后,将luhmes培养至24孔板,以在第六天进行进一步实验。
3.luhmes细胞处理
所有血小板裂解物制剂均以5%v/v使用,并针对用1.25μm的erastin诱导的细胞死亡进行测试。简言之,如前所述使用luhmes,并将不同的血小板裂解物级分在用erastin(e)处理之前1h或用erastin处理之后1、3、6和8h添加到培养基中(图1)。
4.活力测试
为了量化不同血小板裂解物级分的神经保护能力,使用碘化丙锭掺入法通过细胞计数法在24孔中评估lhumes细胞的活力(图2),并将其与对照或不同的血小板裂解物进行比较。用于实验的细胞计数器是带有488nm激光的cyantm模型(beckmancoulter)。
通过在分化的第7天和用50kda、h-50kda、30kda、h-30kda、10kda和h-10kda级分处理后24h在96孔中进行的刃天青测定来测量活力。所述测定在没有进行胰蛋白酶化的细胞培养物上进行(图3)。
通过刃天青测定法单独评估血小板裂解物h-3kda级分,以进一步测定由血小板沉淀裂解物产生的最小级分是否诱导akt信号传导途径(图4)。因此,进行了akt抑制剂的实验,并在暴露于血小板裂解物级分之前1小时,将抑制剂mk-2206以5μm的浓度添加到培养基中。
用血小板裂解液h-3kda级分处理在暴露于erastin之前1h以及暴露于erastin之后1h、3h、6h和8h进行。
5.蛋白质剂量
通过lowry蛋白测定法测量不同样品中的蛋白浓度。对于每个样品,一式两份进行测量,并且浓度以μg/μl表示。
6.统计分析
结果表示为平均值±平均值的标准误差(sem)。在检查数据的正态分布之后,使用单向anova进行统计分析。在非正态分布的情况下,进行wilcoxon和kruskal-wallis的非参数文本。p值<0.05被认为具有统计学意义。
结果
1.蛋白质剂量
2.对多巴胺能神经元的保护能力
-细胞计数测定
如图2所示,用elastin处理的luhmes细胞的活力下降到约30%。因此,elastin杀死了对照细胞,这在当同时用任何血小板裂解物级分处理luhmes细胞时未观察到。
实际上,血小板裂解物级分均不对luhmes细胞具有毒性作用。因此,血小板裂解物级分可保护luhmes细胞免受erastin诱导的死亡,并显示出强大的神经保护作用。
-刃天青测定
通过刃天青证实了通过细胞计数测定获得的结果。
如图3和图4所示,erastin有效杀死luhmes细胞,并且在暴露于elastin之前1h用根据本发明的血小板裂解物级分的处理保护luhmes细胞免于死亡。因此,血小板裂解物级分能够预防elastin的毒性作用并显示出显著的神经保护作用。
此外,图4还显示血小板裂解物h-3kda级分涉及akt信号传导途径。
暴露于erastin后添加血小板裂解物3h-kda级分时,也测试了神经保护作用,结果显示(图5),暴露于erastin前1h-8h用血小板裂解物h-3kda级分处理仍能保护luhmes细胞免于死亡。
3.结论
用血小板沉淀裂解物作为起始材料制备的根据本发明的血小板裂解物级分能够保护细胞免于由神经毒素诱导的死亡并显示有效的神经保护作用。通过两种不同的测定验证了该结果。
实施例2:以混合人血小板裂解物(phpl)作为起始血小板裂解物材料的实验
1.制备混合人血小板裂解物(phpl)和血小板裂解物级分
混合人血小板裂解物(phpl)以名称multipl’30
将一部分phpl在56℃下热处理30分钟,然后通过离心(15分钟,10000xg,4℃)纯化以获得所谓的ht-phpl。
将另一部分phpl与0.5g/ml玻璃珠(bead-002-1kg,直径为2mm,来自labbox)和cacl2(终浓度23mm;c4901无水氯化钙粉末,来自sigma-aldrich)在搅拌下混合1h。这导致血块形成,离心(6000xg在22℃下30分钟)后去除。将上清液在56℃下加热30分钟,并离心(10000xg在4℃下15分钟),然后制备等分试样,并在-80℃下储存以备进一步使用。如此获得的血小板裂解物称为h-phpl-gb。
通过使用amiconultra-0.5超滤管(包括不同的截止值)(amiconultra-0.5centrifugalfilterdevices,millipore)从h-phpl-gb获得经热处理的血小板裂解物3kda级分。
简言之,将500μlh-phpl-gb添加到插入收集管的过滤器中,并以40°的定角转子在4℃下以14000xg离心30分钟。根据所使用的截止值,将低于截止值的下部的滤液或经热处理的血小板裂解物级分称为h-3kda级分,因为它从经热处理后的血小板裂解物获得。
然后,将不同的血小板裂解物级分等分并储存在-80℃下用于进一步的实验。
2.luhmes细胞的维持和分化
如实施例1所述获得并制备luhmes细胞。
3.luhmes细胞处理
h-3kda级分以5%v/v使用,并针对由erastin诱导的细胞死亡进行测试。简言之,如前所述使用luhmes,并将h-3kda级分在用erastin(e)处理之前1h添加到培养基中。
4.活力测试
为了量化经热处理的血小板裂解物h-3kda级分的神经保护能力,使用碘化丙锭掺入法通过细胞计数法在24孔中评估lhumes细胞的活力,并与对照或不同的血小板裂解物进行比较。用于实验的细胞计数器是带有488nm激光的cyantm模型(beckmancoulter)。
5.蛋白质剂量
通过lowry蛋白测定法测量不同样品中的蛋白浓度。对于每个样品,一式两份进行测量,并且浓度以μg/μl表示。
6.结果
-蛋白质剂量
-对多巴胺能神经元的保护能力
如图6所示,用elastin处理的luhmes细胞的活力下降到约50%。因此,elastin有效地杀死了对照细胞,这在当同时用h-3kda级分处理luhmes细胞时未观察到。
因此,h-3kda级分可保护luhmes细胞免于因铁死亡而死亡,并显示出强大的神经保护作用。
该实施例显示了根据本发明的经热处理的血小板裂解物3kda级分的潜力。此外,该级分获自混合人血小板裂解物,与悬浮于血浆中的标准人血小板裂解物相比,该级分提供明显更高的安全系数。因此,该h-3kda级分更适合且更有效地用于生物疗法,尤其是通过脑部施用。
实施例3:体内测试
所有实验均根据“实验室动物护理原则”(nih出版物86-23,于1985年修订)以及当前的法国和欧洲联盟有关动物实验的法律和法规框架(thecounciloftheeuropeancommunitiesdirective86/609)进行。
所募集的小鼠是来自jax实验室的fvb-tg(sod1*g86r)m1jwg/j小鼠。将动物分组饲养在温度受控的房间(22±2℃)中,以12/12小时的光/暗周期进行(每笼10只)。食物和水为自由饲料。接收后,动物具有无处理的7天适应期。在sopf设施中实现了育种,并通过qpcr(来自尾部活检)进行了基因分型。动物通过耳环识别。
1.实验方案
在60天龄处理小鼠并称重,从67天龄到其死亡,每周两次对它们进行评估(即体重和神经评分)。
a.神经评分
-步行(0=好,1=单个后足改变,2=两个后足改变),
-尾部悬挂测试(0=好,1=单个后爪缩回,2=两个后爪缩回)
-瘫痪(0=否,1=是)
-驼背(0=否,1=是)
最高分数=6(垂死分数)
b.处理
从75天到死亡,在sod1m-fvb和wt-fvb雄性和雌性中,每周3次(制剂1和2)和每周6次(仅制剂2)施用不同的血小板裂解物制剂vs载体。sod1m-fvb小鼠是过表达铜/锌超氧化物歧化酶基因突变形式的转基因小鼠。鼻内(i.n.)施用的制剂剂量为20μl。
c.测试的血小板裂解物
测试了三种血小板裂解物制剂,并描述于下文中。
制剂1:如实施例1第1节所述的h-ppl,并在pbs中以50%稀释(稀释的h-ppl)。
制剂2:由实施例1第1节所述的h-ppl制备的经热处理的血小板裂解物3kda级分(h-3kda级分)。
d.实验组
八个组的构成如下:
雄性wt-fvb+载体
雄性wt-fvb+制剂(h-ppl、稀释的h-ppl或h-3kda级分)
雄性sod1m-fvb+载体
雄性sod1m-fvb+制剂(h-ppl、稀释的h-ppl或h-3kda级分)
雌性wt-fvb+载体
雌性wt-fvb+制剂(h-ppl、稀释的h-ppl或h-3kda级分)
雌性sod1m-fvb+载体
雌性sod1m-fvb+制剂(h-ppl、稀释的h-ppl或h-3kda级分)
2.结果
a.制剂1:稀释的h-ppl
-体重
如图7a和7b所示,用稀释的h-ppl处理在wt雄性和雌性中没有作用。
关于体重下降,在tg雄性中未观察到差异。然而,在tg雌性中,稀释的h-ppl处理将体重维持在开始的水平,直至第95天,这与载体组之间相差将近10天,并且还将死前体重延迟了10天(d102-d112)。
-存活曲线
根据体重,用稀释的h-ppl处理的tg雌性的存活期从d105延长至d116(延长11天)。在载体和处理组之间的tg雄性小鼠中未观察到这种差异(图8)。
b.制剂2:h-3kda级分
每周施用三次:
-体重
如图9a所示,在wt小鼠中,h-3kda级分对雄性体重没有影响。与雄性相反,雌性在处理开始后不久(d81)及其整个期间均出现略微下降。
在tg雄性和雌性中,均未观察到体重减轻开始的改进(与使用载体的tg小鼠相比),但是h-3kda级分对雌性小鼠的死前体重诱导了21天(d105至d126),并对雄性小鼠的死前体重诱导了7天(从d112至d119)的重要延迟(图9b)。
-存活曲线
如图10所示并根据死后体重观察到的延迟,用h-3kda级分处理可使tg雌性的存活时间延长至21天(d109至d130),并使tg雄性的存活时间延长至7天(d116至d123)。
每周施用六次:
-体重
如图11a和11b所示,在wt小鼠中,h-3kda级分对雄性和雌性体重没有影响。
在tg雄性和雌性中,均未观察到体重减轻开始的改进(与使用载体的tg小鼠相比),但是h-3kda级分对雄性小鼠的死前体重诱导了11天(d119至d130)的延迟。在tg雌性中未观察到该作用。
-存活曲线
如图12所示并根据死后体重观察到的延迟,用h-3kda级分处理可使tg雌性的存活时间延长至21天(d109至d130),并使tg雄性的存活时间延长至7天(d116至d123)。
3.结论
用稀释的h-ppl和h-3kda处理未观察到刺激。
关于用不同制剂获得的存活曲线,可以观察到作用取决于动物性别。
但是,该体内测试的主要结论是h-3kda具有优异的安全性和出色的功效以及典型的性别-剂量相关作用。实际上,用h-3kda处理在tg雄性小鼠中将生存期延长7天,并在tg雌性小鼠中将生存期增加约21天(与对照相比改进90%),在tg雄性小鼠中增加约10天(与对照相比改进48%)。这些结果显示了根据本发明的经热处理的血小板裂解物3kda级分诱导神经保护能力的潜力。
参考文献
1.gonzalez-aparicior,floresja,fernandez-espejoe.antiparkinsoniantrophicactionofglialcellline-derivedneurotrophicfactorandtransforminggrowthfactorbeta1isenhancedafterco-infusioninrats.experimentalneurology2010;226:136-47.
2.golebiewskaem,pooleaw.plateletsecretion:fromhaemostasistowoundhealingandbeyond.bloodrev2014.
3.burnouft,goubranha,chentm,etal.blood-derivedbiomaterialsand,plateletgrowthfactorsinregenerativemedicine.bloodrev2013;27:77-89.
4.burnouft,strunkd,kohm,etal.humanplateletlysate:replacingfetalbovineserumasagoldstandardforhumancellpropagation?biomaterials2016;76:371-87.
5.hayony,dashevskyo,shaie,etal.plateletlysatesstimulateangiogenesis,neurogenesisandneuroprotectionafterstroke.thrombhaemost2013;110:323-30.
6.yaelhayon;olgadashevsky;elashai;davidvaron;ronenr.lekerplateletlysatesstimulateangiogenesis,neurogenesisandneuroprotectionafterstroke.thrombhaemost2013;110:323–330
7.shihdtb,burnouft.humanbloodplateletgrowthfactorssupplementsforexvivostemcellexpansion(invitedreview).newbiotechnology,2015:32;199-211.
8.tsu-bishihd,burnouft.preparation,qualitycriteria,andpropertiesofhumanbloodplateletlysatesupplementsforexvivostemcellexpansion.newbiotechnology2015;vol32,number1.
9.victore.santo,manuelae.gomes,joaof.manoandruil;reis.chitosanchondrotinsulphatenanoparticlesforcontrolleddeliveryofplateletlysatesinboneregenerativemedicine.journaloftissueengineeringandregenerativemedicine.december2012,vol.6,issues3,pagess47-s59.
10.scholzd,poltld,genewskya,etal.rapid,completeandlarge-scalegenerationofpost-mitoticneuronsfromthehumanluhmescellline.jneurochem2011;119:957-71.
- 还没有人留言评论。精彩留言会获得点赞!