用于扩增细胞群的方法和组合物与流程
相关申请的交叉引用
本申请作为pct申请提交,并要求享有2017年10月9日提交的美国专利申请第62/570,076号以及2018年7月9日提交的美国专利申请第62/695,820号的优先权,其全部通过引用并入本文。
发明领域
本发明涉及用于扩增细胞群并且尤其是干细胞群例如造血干细胞群的方法和组合物。
背景
造血干细胞(hsc)是克隆形成细胞,其具有自我更新(扩增)和产生所有类型成熟血细胞的多谱系潜能的特性。hsc负责造血,并经历增殖和分化,以产生各种谱系的成熟血细胞,同时仍保持其自我更新的能力。自我更新的能力可在动物的整个生命周期中维持hsc群,并使hsc能够重新增生致死性照射的同基因宿主的骨髓。
早期hsc发育显示出分层的安排,从具有广泛自我更新能力的长期(lt-)hsc开始,其后是与短期(st-)hsc(具有有限的自我更新能力)和增殖性多能祖细胞(mpp)(具有多能潜力,但没有自我更新能力)相对应的扩增状态。mpp也是致敏或准备分化的阶段。mpp分化并定向成为产生所有淋巴谱系的常见淋巴祖细胞(clp)或产生所有髓样谱系的常见髓样祖细胞(cmp)。在此过程中,更原始的群体产生较少原始的细胞群,其不能产生更原始的细胞群。控制这些过程(包括hsc的多潜能、自我更新和活化(或瞬时扩增),以及从mpp到clp或cmp的谱系定向)的内在遗传程序在很大程度上仍是未知的。
为了在个体的一生中维持血细胞的恒定产生,位于骨髓小生境中的hsc(zhang,j.等人nature425,836-841,2003;calvi,l.m.等人nature425,841-846,2003;kiel,m.j.,等人cell121,1109-1121,2005;arai,f.等人cell118,149-161,2004)必须在静态和活化之间取得平衡,以便造血功能的立即需求得到满足,同时还确保长期干细胞维护。在成年人中,干细胞的静止状态和活化状态之间的动态平衡对于保护hsc避免其失去自我更新的潜力并同时支持正在进行的组织再生非常重要(li,l.andxie,t.annu.rev.cell.dev.biol.21,605-631,2005)。干细胞的过度活化和扩增在最终耗尽干细胞群和倾向于肿瘤发生上均具有风险。尽管已经鉴定出一些对干细胞活化重要的因子(heissig,b.等人cell109,625-637,2002),但是对于支配静态和活化之间的过渡的分子事件知之甚少。
hsc负责稳态和应激条件下的终身造血,这取决于干细胞自我更新和分化之间的精确平衡(li等人science,327:542-545,2010;weissman等人cell,100:157-168,2000)。因此,hsc移植是用于治疗多种疾病的挽救生命的一种疗法,这些疾病包括血液、免疫和遗传疾病以及癌症(walasek等人annalsofthenewyorkacademyofsciences1266:138-150,2012)。但是,基于hsc的治疗可能主要受到缺乏hla匹配的供体骨髓(bm)的限制。同种异体移植提供了另一种方法,但是移植物抗宿主病(gvhd)仍然是一生的挑战,因为服用免疫抑制药会产生许多副作用,例如免疫恢复迟缓、血栓性微血管病(sung等人stemcellstranslationalmedicine,2:25-32(2013);shlomchik等人naturereviews.immunology,7:340-352,2007)。从hucb移植hsc降低gvhd的风险;然而,hucb中hsc的数量少于bm中的数量或运动的外周血限制了其应用(walasek等人annalsofthenewyorkacademyofsciences,1266:138-150,2012)。已经针对hucbhsc扩增研究了靶向单分子或途径(huang等人leukemia,30:144-153,2016;boitano等人science,329:1345-1348,2010;fares等人science,345;1509-1512,2014;ansellem等人naturemedicine,9:1423-1427,2003;antonchuk等人cell,109:39-45,2002;rentas等人nature,532:508-511,2016;himburg等人naturemedicine,16:475-482,2010;north等人nature,447:1007-1011,2007;guo等人naturemedicine,2018);varnum-finney等人naturemedicine,6:1278-1281,2000;和chou等人experimentalhematology,41:479-490e474,2013)。然而,寻求其他方法以针对分化相对地有利于干细胞自我更新(zhao等人molecularcellbiology,18:31-42,2017)。
m6a是mrna中普遍存在的内部修饰,其通过调节rna加工、定位、翻译和最终的衰变来调节基因表达的结果,其由标记的“书写物”、“擦除物”和“阅读物”来调节(roundtree等人cell,169:1187-1200,2017;li等人annualreviewofgenomicsandhumangenetics,15:127-150,2014)。最近的研究已经阐明了m6a修饰在干细胞命运确定和胚胎形成过程中的内皮细胞向造血细胞转变中(batista等人cellstemcell,15:707-719,2014;geula等人science,347:1002-1006,2015;yoon等人cell,2017;zhang等人nature,549:273-276,2017;zhao等人nature,542:475-478,2017)以及在白血病的发展中(li等人cancercell,31:127-141,2017;vu等人naturemedicine,2017;barbieri等人nature,2017;weng等人cellstemcell,22:191-205e199,2018)的作用。有趣的是,m6a书写复合物mettl3和mettl14的缺陷导致在不同类型干细胞中的不同结果。例如,mettl3或mettl14ko促进了hsc的分化(vu等人naturemedicine,2017;weng等人cellstemcell,22:191-205e199,2018;barbieri等人nature,2017),同时导致小鼠胚胎干细胞(mesc)和胚胎神经元干细胞(nsc)中增强的干细胞的自我更新和维持(batista等人cellstemcell,15:707-719,2014;yoon等人cell,2017)。此外,m6a在干细胞和白血病中的生理功能是通过不同的机制介导的。在干细胞中,m6a修饰通过编码干细胞命运决定子的mrna的m6a介导的衰变来调节干细胞命运的确定(batista等人cellstemcell,15:707-719,2014;yoon等人cell,2017),而在急性骨髓性白血病(aml)中,mettl3和mettl14促进白血病发生,因为m6a修饰稳定癌基因的mrna和/或增加其翻译(vu等人naturemedicine,2017;barbieri等人nature,2017;weng等人cellstemcell,22:191-205e199,2018)。此外,先前的研究已报道fto和mettl14的致白血病功能不依赖于ythdf阅读物蛋白(li等人cancercell,31:127-141,2017;weng等人cellstemcell,22:191-205e199,2018)。
由于m6arna修饰是由标记的“书写物”、“擦除物”和“阅读物”调节的(wang等人nature,505(7481):117-120,2014),所以安装、识别和除去这样的和其他的标记的过程可能会对细胞、发育和疾病过程产生各种影响。例如,研究已经表明,m6a标记可作为关键的转录后修饰,以促进microrna(mirna)生物发生的起始(alarcon等人nature,519(7544):482-485,2015)。证据还指出,m6arna修饰可能参与干细胞向特定谱系的分化(batista,cellstemcell,15(6):707-719,2014;zhang等人nature,549(7671):273-276,2017),以及调节基因表达(dominissini等人,nature485(7397):201-206,2012;haussmann等人,nature540(7632):301-304,2016)。m6a转移酶mettl3已被鉴定为终止鼠幼稚多能性的调节剂(geula等人science,347(6225):1002-1006,2015)。还已经在小鼠t细胞中证明了m6a“书写物”蛋白mettl3会破坏t细胞稳态和分化((li等人nature,548(7667):338-342,2017),并且已发现m6arna甲基化促进xist介导的转录抑制(patil等人nature,537(7620):369-373,2016)。m6arna修饰也已显示调节紫外线诱导的dna损伤反应(xiang等人nature,543(7646):573-576,2017)。斑马鱼中的母体到合子的过渡(mzt)的研究也表明m6amrna甲基化在转录组转换和动物发育中的作用(zhao等人nature,542(7642):475-478,2017)。因此,尽管积累的证据已经使人了解了m6a的生物学功能(lence等人nature,540(7632);242-247,2016),但是在成体干细胞中m6a的功能在很大程度上是未知的。
骨髓(bm)中的造血干细胞(hsc)终生维持体内稳态造血,并且还支持骨髓消融后的再生(weissman,2000)。静态hsc在经致死照射的小鼠中的表现优于增殖性hsc,这在很大程度上归因于保护hsc免受dna损伤的静态(arai等人,2004;fleming等人,1993;wilson等人,2008)(walter等人,2015)。然而,最近的一项研究表明,hsc中的dna损伤积累与dna修复的广泛减弱和依赖于hsc静止的应答途径有关(beerman等人,2014)。实际上,尽管大多数hsc处于静止状态,但它们对诸如5-氟尿嘧啶(5fu)的化学治疗药物引起的dna损伤敏感(lerner和harrison,1990)。尚未解决的问题是造血系统如何克服骨髓消融的后果。关于hsc在发育过程中和成体中的显著异质性(benveniste等人,2010;benz等人,2012;fleming等人,1993;morita等人,2010;zhou等人,2016),提出了储备性hsc(rhsc)亚群的存在,具有耐药性和再生大量hsc以克服应激引起的骨髓消融的能力的特征(haug等人,2008;liandclevers,2010;wilson等人,2008)。然而,到目前为止,尚未提供功能证据支持血液系统中存在rhsc。
hsc被保存在复杂的bm小生境中以用于其维持和再生(liandclevers,2010;mendelsonandfrenette,2014;morrisonandscadden,2014;scadden,2014;schofield,1978)。在过去的几十年中,多项研究发现了hsc骨髓小生境成分的复杂性,包括:骨内膜(内骨表面)细胞(calvi等人,2003;zhang等人,2003),血窦内皮细胞(hooper等人,2009;kiel等人,2005),cxcl12丰富的网状(car)细胞(sugiyama等人,2006),巢蛋白+和ng2+血管周围细胞(kunisaki等人,2013;mendez-ferrer等人,2010),lepr+和prx-1+间充质干细胞和祖细胞(dingandmorrison,2013;ding等人,2012;greenbaum等人,2013),非髓鞘生成施万细胞(yamazaki等人,2011)和巨核细胞(bruns等人,2014;zhao等人,2014)。但是,bm小生境复杂性是否以及如何促进hsc异质性调节仍在很大程度上不清楚(itkin等人,2016)。此外,最初的hsc小生境最初被鉴定为松质骨区域的骨内膜中的纺锤形n-钙黏着蛋白+(n-cad+)成骨前体细胞(calvi等人,2003;xie等人,2009;zhang等人,2003),但是bm中n-cad+小生境细胞的性质和功能仍不清楚。
因此,仍然需要阐明和理解m6a和m6amrna途径的作用,以提供对干细胞增殖和分化的分子调控的理解。仍然还需要体内和离体扩增干细胞群的方法,以及提供使用这样的扩增的干细胞群进行治疗诸如通过移植入合适的受试者中的方法。
概述
在本公开内容的一个实施方案中,提供了用于扩增干细胞群的方法,该干细胞群是从选自外周血、脐带血和骨髓的组织中获得的。该方法包括调节干细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以扩增干细胞的数量。
在另一个实施方案中,提供了用于离体扩增基本上未分化的干细胞群的方法,其包括调节未分化的干细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以扩增未分化的干细胞的数量而没有干细胞群的显著分化。
根据另一个实施方案,提供了用于离体扩增造血干细胞(hsc)群的方法,所述hsc群是从选自外周血、脐带血和骨髓的组织中获得的,该方法包括调节hsc群中的n6-甲基腺苷(m6a)mrna修饰途径,以将hsc群扩增至足够的量,同时保持hsc群中的多谱系分化潜能,所述hsc群足以用于随后移植入有此需要的受试者中。
根据另一个实施方案,提供了用于将造血干细胞(hsc)离体扩增至少2倍的方法,所述扩增的hsc在移植入有此需要的哺乳动物中时能够重建hsc谱系,该方法包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入干细胞,以及在合适的培养基中培养hsc群。
根据另一个实施方案,提供了试剂盒,该试剂盒用于扩增造血干细胞(hsc)群以用于随后移植至有此需要的受试者中,该试剂盒包括用于将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入hsc群的系统,以及其使用说明。
根据另一个实施方案,提供了试剂盒,该试剂盒用于扩增造血干细胞群(hsc)群以用于随后移植入有此需要的受试者中,该试剂盒包含m6amrna修饰阅读物的抑制剂,以及其使用说明。
在另一个实施方案中,提供了向有此需要的受试者施用造血干细胞(hsc)的方法,该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有hsc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中hsc的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用hsc。
在另一个实施方案中,提供了向有此需要的受试者施用造血干细胞(hsc)的方法,该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养包含hsc群的样品足够长的时间以将样品中hsc的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用hsc。
在另一个实施方案中,提供了在有此需要的受试者中重建骨髓的方法,其包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有hsc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中hsc的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用hsc。
在另一个实施方案中,提供了在有此需要的受试者中重建骨髓的方法,其包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养包含hsc群的样品足够长的时间以使样品中的hsc数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用hsc。
在一个实施方案中,提供了扩增造血细胞(hsc)群的方法,包括在足以导致hsc群扩增至少2倍的条件下培养hsc群,其中所述扩增的hsc群适合于移植到有此需要的哺乳动物中。
在另一个实施方案中,提供了用于扩增造血干细胞(hsc)群的方法,其包括:(a)从哺乳动物获得包含hsc群的组织样品;(b)体外扩增来自样品的hsc群,其中:(i)hsc群扩增至少2倍;(ii)扩增的hsc群的总集落形成单位增加至少5倍。
在另一个实施方案中,提供了在有此需要的受试者中重建造血干细胞谱系的方法,该方法包括:(a)从哺乳动物获得包含hsc群的组织样品;(b)体外扩增来自样品的hsc群,其中:(i)hsc群扩增至少2倍;(ii)扩增的hsc群的总集落形成单位增加至少5倍;和(c)将扩增的hsc群移植到有此需要的受试者中。
在另一个实施方案中,提供了用于扩增需要这种扩增的哺乳动物中的造血干细胞群的方法,该方法包括向该哺乳动物施用治疗有效量的n6-甲基腺苷(m6a)mrna修饰途径的调节剂足够长的时间以使hsc群扩增至少2倍,使得hsc具有在哺乳动物中重建造血谱系的能力。
根据另一个实施方案,提供了用于离体扩增间充质干细胞(msc)群的方法,该msc群是从选自外周血、脐带血和骨髓的组织中获得的,该方法包括调节msc群中的n6-甲基腺苷(m6a)mrna修饰途径,以将msc群扩增到足够的数量,同时保持msc群中的多谱系分化潜能,所述msc群足以随后移植到有此需要的受试者中。
根据另一个实施方案,提供了用于使间充质干细胞(msc)离体扩增至少2倍的方法,所述扩增的msc在移植入有此需要的哺乳动物中时能够重建msc谱系,该方法包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入干细胞,以及在合适的培养基中培养msc群。
根据另一个实施方案,提供了用于扩增间充质干细胞群(msc)群以用于随后移植入有此需要的受试者的试剂盒,该试剂盒包括用于导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入msc群的系统,以及其使用说明。
根据另一个实施方案,提供了用于扩增间充质干细胞群(msc)群以随后移植入有此需要的受试者的试剂盒,该试剂盒包含m6amrna修饰阅读物的抑制剂,以及其使用说明。
在又一个实施方案中,提供了用于向有此需要的受试者施用间充质干细胞(msc)的方法,该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有msc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中的msc的数量扩增到足以移植到受试者中的数量;和(c)向所述受试者施用msc。
在另一个实施方案中,提供了用于向有此需要的受试者施用间充质干细胞(msc)的方法,该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养包含msc群的样品足够长的时间以将样品中msc的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向所述受试者施用msc。
在另一个实施方案中,提供了用于在有此需要的受试者中重建骨髓的方法,该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有msc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中的msc的数量扩增到足以移植到受试者中的数量;和(c)向所述受试者施用msc。
在另一个实施方案中,提供了在有此需要的受试者中重建骨髓的方法,该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养包含msc群的样品足够长的时间以使样品中的msc数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向所述受试者施用msc。
在一个实施方案中,提供了用于扩增间充质细胞(msc)群的方法,该方法包括在足以导致msc群扩增至少2倍的条件下培养msc群,其中所述扩增的msc群适合于移植到有此需要的哺乳动物中。
在另一个实施方案中,提供了用于扩增间充质干细胞(msc)群的方法,该方法包括:(a)从哺乳动物获得包含msc群的组织样品;(b)体外扩增来自样品的msc群,其中:(i)msc群扩增至少2倍;(ii)扩增的msc群的总集落形成单位增加至少5倍。
在另一个实施方案中,提供了在有此需要的受试者中重建间充质干细胞谱系的方法,该方法包括:(a)从哺乳动物获得包含msc群的组织样品;(b)体外扩增来自样品的msc群,其中:(i)msc群扩增至少2倍;(ii)扩增的msc群的总集落形成单位增加至少5倍;和(c)将扩增的msc群移植到有此需要的受试者中。
在又一个实施方案中,提供了用于扩增需要这种扩增的哺乳动物中的间充质干细胞群的方法,该方法包括向该哺乳动物施用治疗有效量的n6-甲基腺苷(m6a)mrna修饰剂的调节剂足够长的时间以使hsc群扩增至少2倍,使得hsc具有在哺乳动物中重建间充质谱系能力。
根据另一个实施方案,提供了用于离体扩增间充质干细胞(msc)群的方法,该msc群是从选自外周血、脐带血和骨髓的组织中获得的,该方法包括调节msc群中的n6-甲基腺苷(m6a)mrna修饰途径,以将msc群扩增到足够的数量,同时保持msc群中的多谱系分化潜能,所述msc群足以随后移植到有此需要的受试者中。
根据另一个实施方案,提供了用于使间充质干细胞(msc)离体扩增至少2倍的方法,该扩增的msc在移植入有此需要的哺乳动物中时能够重建msc谱系,该方法包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入干细胞,以及在合适的培养基中培养msc群。
根据另一个实施方案,提供了用于扩增间充质干细胞群(msc)群以用于随后移植入有此需要的受试者的试剂盒,该试剂盒包括用于将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入msc群的系统,以及其使用说明。
根据另一个实施方案,提供了用于扩增间充质干细胞群(msc)群以用于随后移植入有此需要的受试者的试剂盒,该试剂盒包含m6amrna修饰阅读物的抑制剂,以及其使用说明。
在又一个实施方案中,提供了向有此需要的受试者施用间充质干细胞(msc)的方法,该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有msc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中的msc的数量扩增到足以移植到受试者中的数量;和(c)向所述受试者施用msc。
在另一个实施方案中,提供了用于向有此需要的受试者施用间充质干细胞(msc)的方法,该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养包含msc群的样品足够长的时间以将样品中msc的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向所述受试者施用msc。
在另一个实施方案中,提供了用于在有此需要的受试者中重建骨髓的方法,包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有msc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中的msc的数量扩增到足以移植到受试者中的数量;和(c)向所述受试者施用msc。
在另一个实施方案中,提供了在有此需要的受试者中重建骨髓的方法,其包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养包含msc群的样品足够长的时间以使样品中的msc数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向所述受试者施用msc。
在一个实施方案中,提供了用于扩增间充质细胞(msc)群的方法,该方法包括在足以导致hsc群扩增至少2倍的条件下培养该msc群,其中所述扩增的msc群适合于移植到有此需要的哺乳动物中。
在另一个实施方案中,提供了用于扩增间充质干细胞(msc)的群的方法,其包括:(a)从哺乳动物获得包含msc群的组织样品;(b)体外扩增来自样品的msc群,其中:(i)msc群扩增至少2倍。
在另一个实施方案中,提供了在有此需要的受试者中重建间充质干细胞谱系的方法,该方法包括:(a)从哺乳动物获得包含msc群的组织样品;(b)体外扩增来自样品的msc群,其中:(i)msc群扩增至少2倍;和(c)将扩增的msc群移植到有此需要的受试者中。
在另一个实施方案中,提供了扩增需要这种扩增的哺乳动物中的间充质干细胞群的方法,包括向该哺乳动物施用治疗有效量的n6-甲基腺苷(m6a)mrna修饰途径的调节剂足够长的时间以使msc群扩增至少2倍,使得msc具有在哺乳动物中重建间充质谱系能力。
在另一个实施方案中,提供了从生物样品中分离间充质干细胞(msc)的方法,该方法包括使具有msc群的生物样品与一种或多种n-钙黏着蛋白抗体接触。
在另一个实施方案中,提供了如通过本文所述的任何方法制备的分离的间充质干细胞群。根据又一个实施方案,提供了如通过本文所述的任何方法制备的扩增的分离的间充质干细胞群。
根据另一个实施方案,提供了用于分离间充质干细胞(msc)群以用于随后移植入有此需要的受试者中的试剂盒。该试剂盒包括用于使包含msc的生物样品与一种或多种n-钙黏着蛋白抗体接触的系统,以及其使用说明。
根据另一个实施方案,提供了向有此需要的受试者施用间充质干细胞(msc)的方法。该方法包括:(a)通过使生物样品与一种或多种n-钙黏着蛋白抗体接触,从包含间充质干细胞(msc)群的生物样品中分离msc,和(b)向受试者施用分离的msc。
根据又一个实施方案,提供了在有此需要的受试者中重建骨髓的方法。该方法包括:(a)通过使生物样品与一种或多种n-钙黏着蛋白抗体接触,从包含间充质干细胞(msc)群的生物样品中分离msc;和(b)向受试者施用分离的msc。
根据又一个实施方案,提供了用于治疗需要选自骨髓移植、外周血移植和脐带血移植的移植的受试者的方法。该方法包括向受试者施用通过本文所述的任何方法获得的分离的msc群。
在另一个实施方案中,提供了用于扩增通过修饰从选自外周血、脐带血和骨髓的组织中获得的t细胞制备的嵌合抗原受体(car)t细胞群的方法。该方法包括调节cart细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以扩增car-t细胞的数量。
在另一个实施方案中,提供了用于离体扩增嵌合抗原受体(car)t细胞群的方法。该方法包括调节cart细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以扩增cart细胞的数量。
根据另一个实施方案,提供了用于离体扩增通过修饰从选自外周血、脐带血和骨髓的组织中获得的t细胞制备的嵌合抗原受体(car)t细胞群的方法。该方法包括调节cart细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以将cart细胞群扩增至足够的量,其足以用于随后移植入有此需要的受试者中。
在另一个实施方案中,提供了用于嵌合抗原受体(car)t细胞的离体扩增的方法,所述扩增的cart细胞在移植入有此需要的哺乳动物中时能够治疗癌症和/或血液疾病。该方法包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入cart细胞中,以及在合适的培养基中培养cart细胞群。
在另一个实施方案中,提供了用于扩增嵌合抗原受体(car)t细胞(hsc)群以用于随后移植入有此需要的受试者的试剂盒。该试剂盒包括用于将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入cart细胞群的系统,以及其使用说明。
在另一个实施方案中,提供了用于向有此需要的受试者施用嵌合抗原受体(car)t细胞的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有cart细胞群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中cart细胞的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用cart细胞。
在另一个实施方案中,提供了向有此需要的受试者施用cart细胞的方法。该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养含有cart细胞群的样品足够长的时间以将样品中cart细胞的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用cart细胞。
在另一个实施方案中,提供了用于在有此需要的受试者中治疗癌症和/或血液疾病的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有cart细胞群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中cart细胞的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用cart细胞。
在又一实施方案中,提供了在有此需要的受试者中治疗癌症和/或血液疾病的方法。该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,培养含有cart细胞群的样品足够长的时间以将样品中cart细胞的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用cart细胞。
在一个实施方案中,提供了扩增嵌合抗原受体(car)t细胞群的方法。该方法包括在足以导致cart细胞群扩增至少2倍的条件下培养cart细胞群,其中扩增的cart细胞群适合于移植到有此需要的哺乳动物中。
在又一个实施方案中,提供了用于扩增嵌合抗原受体(car)t细胞群的方法。该方法包括:(a)从哺乳动物获得包含t细胞群的组织样品;(b)用嵌合抗原受体修饰t细胞群以提供cart细胞群;和(c)体外扩增来自样品的cart细胞群,其中:(i)cart细胞群扩增至少2倍。
在另一个实施方案中,提供了用于治疗患有癌症和/或血液疾病的受试者的方法。该方法包括:(a)从哺乳动物获得包含t细胞群的组织样品;(b)用嵌合抗原受体(car)修饰t细胞群以形成cart细胞群;(c)体外扩增来自样品的cart细胞群,其中:(i)cart细胞群扩增至少2倍;和(d)将扩增的cart细胞群移植到受试者中。
在另一个实施方案中,提供了扩增需要这种扩增的哺乳动物中的嵌合抗原受体(car)t细胞群的方法。该方法包括向哺乳动物施用治疗有效量的n6-甲基腺苷(m6a)mrna修饰途径的调节剂足够长的时间以使cart细胞群扩增至少2倍,使得cart细胞具有在哺乳动物中治疗癌症和/或血液疾病的能力。
在又一个实施方案中,提供了治疗患有血液疾病的受试者的方法。该方法包括(a)从选自外周血、脐带血和骨髓的组织中获得选自干细胞和t细胞的细胞群;(b)任选地,在细胞群包含t细胞的情况下,用嵌合抗原受体(car)修饰t细胞以提供cart细胞;(c)通过调节细胞中的n6-甲基腺苷(m6a)mrna修饰途径来扩增细胞群,以扩增细胞数量;和(d)将扩增的细胞移植到受试者中以治疗血液疾病。
在以下的详细描述和实施例中进一步公开了本发明的这些和其他方面。
附图的简要说明
以下附图构成本说明书的一部分,并且被包括在内以进一步说明本发明的某些方面。通过参考这些附图中的一个或多个附图,结合在此呈现的具体实施方案的详细描述,可以更好地理解本发明。
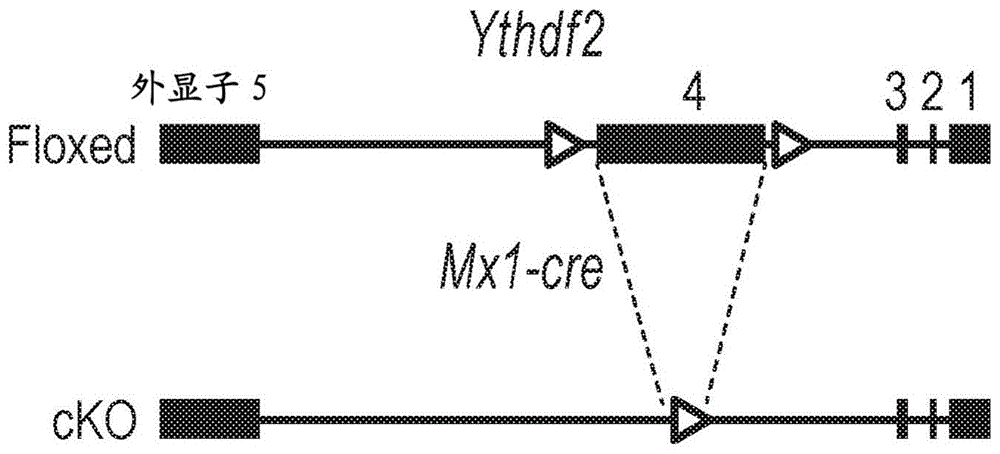
图1a-1h:ythdf2ko导致小鼠中表型hsc升高。图1a是显示mx1-cre;ythdf2f/f条件ko(cko)小鼠的hspc中ythdf2缺失的示意图。图1b显示了蛋白质印迹(左)和直方图(右),其显示了小鼠hspc中敲除ythdf2的细胞内流动验证。图1c是来自wt和ythdf2ko小鼠的bm中hspc的代表性流式细胞仪分析图(每组n=5)。图1d和1e是柱状图,显示了来自wt和ythdf2ko小鼠的bm中hspc的总有核细胞(tnc)的频率(1d)和hspc的绝对细胞数(1e)(每组n=5)。图1f是柱状图,显示了来自wt和ythdf2ko小鼠的bmtnc的绝对数量(每组n=5)。图1g和1h是柱状图,显示了wt和ythdf2ko小鼠的bm中定向祖细胞(1g)和谱系细胞(1h)的绝对数量(每组n=5)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图2a-2j:ythdf2ko导致小鼠中功能性hsc的扩增。图2a描述了用于有限稀释移植测定(lda)以确定功能性hsc的频率的实验方案。图2b是显示在移植后16周通过elda(极限稀释分析)来确定cru频率的初次lda的图(每组n=10)。图2c是显示通过将200k全骨髓(wbm)细胞与200k拯救细胞移植到受照射的受体中而进行的竞争性重建测定的图(每组n=10)。图2d和2e是柱状图,显示了来自如(2c)的移植受体小鼠的bm中供体来源的hspc的tnc频率(2d)和绝对细胞数(2e)(每组n=10)。图2f和2g是柱状图,显示了来自初次200kbm移植受体小鼠的bm中供体来源的(cd45.2+)定向祖细胞(2f)和谱系细胞(2g)的绝对细胞数(每组n=9-10)。图2h显示了使用二次lda以通过二次移植后16周通过elda确定长期cru频率的曲线图(n=10)。图2i和2j柱状图,其分别显示了在移植后4周通过移植测定和外周血分析对总移植供体细胞的功能性小鼠造血干细胞(hsc)的定量(2i),和在移植后4周通过使用b、t和髓系谱系细胞的百分比的移植测定对功能性小鼠hsc的定量(2j)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图3a-3i:ythdf2充当m6a阅读物,并通过介导mrna衰变来调节hsc基因表达。图3a是irclip-seq工作流程的示意图。图3b是显示通过meme鉴定的ythdf2结合基序的示意图,所有的irclip峰在所有三个重复中都被发现。图3c是描绘在五个转录片段中的每一个中ythdf2结合峰的分数的饼图。图3d是显示来自三个ythdf2irclip-seq重复的相交基因的ythdf2靶标的go富集分析的图。图3e显示了具有m6a峰和ythdf2irclip峰的tal1的代表性轨迹,其中m6a免疫沉淀和输入片段的覆盖率分别用红色和灰色表示,ythdf2irclip读数用黄色突出显示。图3f是显示来自wt和ythdf2ko小鼠的分选的lsk细胞的总mrna的qpcr分析的图。首先将所有ct值相对actb对照(非m6a标记的)进行标准化。然后计算比率(ythdf2ko相对于wt)(n=3)。图3g显示了代表性图像(左)和通过tal1(绿色)的wt(n=65)和ythdf2ko(n=54)hspc的染色强度的柱状图(右)的定量。图3h显示了图像,其描绘了tal1mrna的荧光原位杂交(红色)和wt和ythdf2kohspc中dcp1a(p-body标记)(品红色)、ythdf2(绿色)的荧光免疫染色,其中箭头表示共定位染色。比例尺,5μm。图3i显示了来自wt和ythdf2ko小鼠的分选的lsk细胞中tal1mrna和dcp1a共定位的定量。百分比表示每个lsk细胞中与dcp1a共定位的tal1mrna的平均频率相对总tal1mrna水平(n=9-17)。数据显示为平均值±s.e.m.。未配对的t检验。
图4a-4i:通过m6a-seq和rna-seq分析确定ythdf2在人脐带血hsc中的作用。图4a显示了描述在tss(左)和终止密码子(右)周围的窗口中的序列覆盖率的集合基因谱,其中m6aip和对照(输入)片段的覆盖率分别用红色和灰色表示。图4b描绘了显示五个非重叠的转录片段中的每一个中的m6a峰的分数的饼图。图4c描绘了维恩图,其显示了在小鼠和hucbhspc中共有且独特的m6a标记的基因。图4d描述了在小鼠和hucbhspc中共有的m6a标记的转录物的go富集分析图。图4e显示了具有m6a峰的hoxb4的代表性轨迹,其中颜色代码与图4a中的相同。图4f描述了hucbcd34+hspc中慢病毒介导的ythdf2kd的rna-seq示意图。图4g是使用对照和ythdf2kdhucbcd34+细胞的m6a标记基因(紫色线)和非m6a标记基因(黑色线)的log2(倍数变化)的累积分布图。图4h显示了来自rna-seq分析的代表性覆盖率图,显示与对照hucbcd34+细胞相比,ythdf2kd中m6a标记基因hoxb4但非m6a标记基因actb的读数增加。并且,图4i是柱状图,显示与对照和ythdf2kdhucbcd34+细胞中干细胞自我更新有关的非m6a标记的actb(作为对照)和m6a标记的转录因子的相对mrna表达水平。将来自rna-seq分析的rpkm相对于对照进行标准化。显示了调整后的p值。n.s.,不显著。
图5a-5f:ythdf2kd促进人脐带血hsc的离体扩增。图5a-5b是描绘了培养7天后,ythdf2kd中所指示的细胞相对于对照细胞的频率(5a)和绝对数量(5b)的倍数变化的柱状图。图5c是显示从转导的cd34+cd38-hucb细胞输出的cfu的柱状图和cfu-粒细胞红细胞单核细胞巨核细胞(gemm)的图像(比例尺,200μm)。图5d包含来自7天培养的对照或ythdf2kdhucb细胞的爆发集落形成单位红系细胞(bfu-e)(左)和集落形成单位-粒细胞/巨噬细胞(cfu-gm)(右)的图像(比例尺(200μm),其中各图使用独立的脐带血样本并重复两次。图5e是柱状图,显示了通过膜联蛋白v染色在转导的cd34+hucb细胞的7天培养物中cd34+cd38-细胞的凋亡分析(n=3个独立的cb样品)。图5f是柱状图,显示了在指示的人脐带血hsc(n=3个单独的人样品)中,tthdf2敲低(kd)相对于对照的倍数变化,其中慢病毒用于将对照shrna或人ythdf2shrna递送到分选的cd34+cd38-脐带血hsc中。虚线表示95%置信区间。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图6a-6g:ythdf2kd促进人脐带血功能性长期hsc的扩增。图6a是显示在体内扩增后测定hsc的频率的实验方案的图。图6b包括来自接受最高两个细胞剂量的初次受体小鼠的hcd45+gfp+重建的代表性流程图。hcd45=人cd45。图6c是显示来自接受最高两个剂量的初次受体小鼠(n=8)的bm中hcd45+gfp+植入的图;图6d是示出由初次lda确定的hsc频率的图。虚线表示95%的置信区间。图6e包括来自接受最高两个细胞剂量的二次受体小鼠的hcd45+gfp+重建的代表性流程图。图6f是显示来自接受最高两个剂量的二次受体小鼠(n=6)的bm中hcd45+gfp+植入的图。图6g是显示由二次lda确定的hsc频率的图。虚线表示95%置信区间。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图7a-7i:ythdf2kohsc在静止和归巢能力方面没有显示谱系偏倚的迹象或差异,但显示较低的凋亡率。图7a是柱状图,显示了未注射pi:pc的mx1-cre-;ythdf2f/f和mx1-cre+;ythdf2f/f小鼠的bm中hspc的绝对细胞数(每组n=3)。图7b是柱状图,显示了wt(n=3)和ythdf2ko(n=4)小鼠中hspc的细胞周期分析。图7c是柱状图,显示了wt和ythdf2ko小鼠(每组n=5)中bmhspc的凋亡分析。图7d显示了来自wt和ythdf2ko小鼠脾脏的图像和重量。图7e-7h是显示wt(n=3)和ythdf2ko(n=4)小鼠的脾脏中tnc(7e)、lskcd48-cd150+hsc(7f)、定向祖细胞(7g)和谱系细胞(7h)的绝对数量的柱状图。图7i是显示wt和ythdf2ko细胞的归巢能力的柱状图,其是通过将1×106个cfdase标记的bm细胞移植到经致死照射的小鼠中来测定的。18小时后,分析bm的归巢事件(每组n=6只小鼠)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图8a-8f:ythdf2kobm的移植受体小鼠在移植后16周未显示谱系变化或缺陷。图8a至图8c是柱状图,其描绘了在二次移植后16周来自二次200k移植受体小鼠的bm中的供体来源的(cd45.2+)tnc(8a)、定向祖细胞(8b)和谱系细胞(8c)的绝对细胞数(每组n=7-10)。图8d至8f是柱状图,其描绘了在二次移植后16周来自二次200k移植受体小鼠的脾中供体来源(cd45.2+)tnc(8d)、定向祖细胞(8e)和谱系细胞(8f)的绝对细胞数(每组n=7-10)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图9a-9k:ythdf2ko对小鼠hsc的体内扩增具有长期影响,而不会引起谱系偏倚。图9a是显示在pi:pc诱导后5-7个月通过流式细胞术分析从wt和ythdf2ko小鼠收集的bm和脾的示意图。图9b至9e是柱状图,其显示:诱导后5-7个月wt和ythdf2ko小鼠的bm中tnc(图9b)、hspc(图9c)、定向祖细胞(图9d)和谱系细胞(图9e)的绝对细胞数(每组n=4-7只小鼠)。图9f是柱状图,显示了诱导后5-7个月来自wt和ythdf2ko小鼠的脾脏的重量(每组n=4-7只小鼠)。图9g至9j是柱状图,其显示:诱导后5-7个月wt和ythdf2ko小鼠的脾脏中tnc(图9g)、lskcd48-cd150+hsc(图9h)、定向祖细胞(图9i)和谱系细胞(图9j)的绝对细胞数(每组n=4-7只小鼠)。图9k是显示了在pi:pc注射后5个月,将来自wt和ythdf2ko小鼠的75kwbm与200k拯救细胞一起移植到经致死照射的受体中示意图。移植后每4周分析来自移植受体的外周血,以确定供体来源的移植(每组n=10)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图10a-10d:小鼠hspc中m6a修饰的分子表征。图10a显示了描述在tss(上)和终止密码子(下)周围的窗口中的序列覆盖率的集合基因谱,其中m6aip和对照(输入)片段的覆盖率分别用红色和灰色表示。图10b显示了饼图,其显示了五个转录片段中每一个中的m6a峰的分数。图10c显示了在小鼠hpsc中每个片段中具有m6a峰的基因的分数随着表达水平变化的图。图10d显示了通过对hspc中放线菌素d处理后0小时和4小时的表达水平的分析所确定的,m6a标记的mrna和非m6a标记的mrna的降解速率的图。
图11a-11e:通过irclip-seq在小鼠hspc中定义ythdf2功能。图11a是显示在对照或flag-ythdf2过表达的hpc7细胞中ythdf2的免疫沉淀的图。图11b是显示ir800标记的rna-ythdf2复合物的irclip膜图像,其中红色框表示收集用于构建文库的rna-ythdf2复合物,并且使用没有uv交联的样品作为对照。图11c是显示在三个独立的ythdf2irclip-seq实验中鉴定的交叉基因的维恩图。图11d是显示ythdf2结合靶标与m6a标记的mrna的重叠的维恩图。图11e显示了具有m6a峰和ythdf2irclip峰的gata2的代表性轨迹,其中m6a免疫沉淀和输入片段的覆盖率分别用红色和灰色表示,ythdf2irclip读数用黄色突出显示。
图12a-12f:ythdf2ko增加m6a标记的mrna表达,有助于hsc扩增。图12a是柱状图,显示了从15,000个分选的bmlskflk2-细胞中提取的总rna。图12b显示了wt和ythdf2kolin-细胞(n=6)中m6arna甲基化的定量。图12c显示定量(右)和直方图(左),其显示与wtlt-hsc相比,ythdf2kolt-hsc中tal1、gata2、runx1和stat5表达增加的细胞内流式验证(每组n=3只小鼠);图12d显示了wt和ythdf2kohspc中gata2mrna(红色)的荧光原位杂交和dcp1a(p-体标记)(品红色)、ythdf2(绿色)的荧光免疫染色。箭头指示共定位染色。比例尺,5μm。图12e显示了来自wt和ythdf2ko小鼠的分选的lsk细胞中gata2mrna和dcp1a共定位的定量。百分比表示每个lsk细胞中与dcp1a共定位的gata2mrna相对于总gata2mrna水平的平均频率(n=12-20)。图12f显示了在移植后4周,cd45+群中gfp+细胞的百分比(n=10)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图13a-13g:ythdf2调节人脐带血干细胞中与干细胞自我更新有关的转录因子的表达。图13a是维恩图,显示了使用三个独立的脐带血样品在三个独立的m6a-seq实验中鉴定的交叉基因。图13b显示了饼图,其中示出了含有m6a峰的mrna和非编码rna的百分比。图13c是柱状图,显示了在hucbcd34+细胞中具有m6a修饰的转录因子的go富集分析。图13d显示了在分选的gfp+对照和ythdf2kdhucb细胞中ythdf2(上)和β-肌动蛋白(下)的蛋白质印迹的图像,显示了ythdf2的敲低效率。图13e显示对照和ythdf2kdhucbcd34+细胞的rna-seq分析的ythdf2的表达水平的柱状图(左)和代表性轨迹图(右),显示了ythdf2的敲低效率。图13f至13g是具有m6a峰的指示的转录因子的代表性轨迹图(上)和来自rna-seq分析的代表性覆盖率图(下)。指示了调整后的p值。
图14a-14c:hucb细胞中的ythdf2kd导致hsc扩增,而不改变谱系输出。图14a描绘了培养7天后对照和ythdf2kdhucb细胞中gfp+cd34+cd38-cd45ra-epcr+hsc的代表性流式图。图14b描绘了在转导的hela细胞中ythdf2蛋白敲低和过表达的确认。图14c描绘了由来自第10天培养物的ythdf2oe和对照转导的cd34+cd38-cb产生的cfu(n=3个独立的人样品)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图15a-15d:hucb细胞中的ythdf2kd导致hsc扩增,而不改变谱系输出。图15a包括初次nsg受体bm中hcd45+gfp+单核细胞、巨核细胞(mk细胞)、b细胞和红细胞的代表性流式图。图15b和15c是柱状图,其描绘了在移植后10周时来自初次nsg受体的hcd45+gfp+(图15b)和总cd45+(图15c)bm细胞中的谱系细胞的百分比(n=13-15)。图15d是柱状图,其描绘了在移植后12周时来自二次nsg受体的总cd45+bm细胞中人供体来源的谱系嵌合性的总结(n=6)。数据显示为平均值±s.e.m.。未配对的t检验。n.s.,不显著。
图16:间充质干细胞的体内扩增。图16是显示wtythdf2和ythdf2敲除(ko)的tnc中n-cad+cd105+的频率的柱状图。
图17a-17j:rhsc群的功能鉴定。图17a是针对rhsc、phsc、st-hsc和mpp的facs分选的示意图。图17b显示了通过移植测定对rhsc和phsc功能的定量。在所示的移植后周数时进行的总移植供体细胞的pb分析,以及在移植后20周时供体来源的b、t和骨髓谱系细胞的百分比(每组n=10只小鼠)。图17c显示了在移植后40周来自rhsc或phsc移植的小鼠的供体来源的细胞。图17d:追赶(chasing)后130天,rhsc和phsc中的h2b-gfp标记保留细胞(每组n=4只小鼠)。图17e显示了rhsc和phsc中的细胞周期基因表达(n=来自20只小鼠的3个重复)。图17f显示了rhsc和phsc移植的受体如所示的在移植后4周接受5fu注射。在移植后所示的周数对供体移植细胞进行pb分析。显示了移植后20周时供体来源的b、t和骨髓谱系细胞的百分比(每组n=10只小鼠)。图17g显示了5fu处理后第3天的rhsc和phsc(来自15只小鼠的库)。图17h显示了rhsc和phsc中的dna损伤基因表达(n=来自20只小鼠的3个重复)。图17i显示了来自对照小鼠和在5fu后第3天的小鼠的rhsc中的dna损伤基因(对照小鼠组中n=20,d35fu小鼠组中n=40)。*p<0.05,**p<0.01,***p<0.001。误差棒,s.e.m.。图17j显示了rhsc、phsc和5furhsc中的应激反应基因的热图。
图18a-18i:rhsc位于bm小生境中的骨内膜区域。图18a显示了小鼠胸骨骨髓(bm)的代表性全包埋图像,其中骨(白色,由二次谐波生成产生,shg)、mk(黄色,通过大小、形态和cd41表达来区分)。绿色箭头表示表型lin–cd48–cd41–cd150+cd49b–rhsc,白色箭头表示表型lin–cd48–cd41–cd150+cd49b+phsc。图18b显示了rhsc、phsc和5furhsc的代表性图像。白色箭头表示表型lin–cd48–cd41–cd150+cd49b–rhsc、表型lin–cd48–cd41–cd150+cd49b+phsc和表型lin–cd48–cd41–cd150+cd49b–5furhsc。图18c-e显示了rhsc、phsc和5furhsc与血管、mk或骨之间的相对距离(n=144rhsc,n=685phsc,n=7075furhsc)。图18f显示了对照小鼠和5fu处理后1天的小鼠中健康、凋亡和死亡的ve-cad+cd31+血管细胞的绝对数量。图18f-g显示了来自对照小鼠和5fu处理后1天的小鼠的中央骨髓(cm)中的膜联蛋白v+sytoxg─凋亡性ve-cad+cd31+内皮细胞或cm和骨中的n-cad-tomato+细胞的绝对数量。每组中n=3。*p<0.05,**p<0.01,***p<0.001。误差棒,s.e.m.。图18h-i显示了对照小鼠和5fu处理后3天的小鼠中n-cad-tomato+和ve-cad+cd31+血管的代表性图像。
图19a-19j:n-cad+细胞在bm小生境中维持功能性hsc。图19a显示了向n-cad-creert;idtr小鼠施用dt的方案,该小鼠用于b-g中所示的实验。d表示日期(例如d0表示第0天)。图19b显示了如n-cad-creert;idtr小鼠中的tomato+细胞所示的n-cad+细胞消融效率。图19c-d显示了流式细胞术分析,以确定来自注射tmx和dt后的n-cad-creert;idtr小鼠的骨髓(bm)中总有核细胞(tnc)和hspc的绝对数量(每组n=5只小鼠)。图19e-h显示了在初次1°和二次2°移植中通过移植测定法对功能性hsc的定量。在所示的移植后周数时来自总移植供体细胞的pb分析的总bm细胞,以及在移植后16周的供体来源的b、t和骨髓谱系细胞的百分比(每组n=10只小鼠)。图19i-j显示了流式细胞术分析,以确定来自注射tmx和dt后的n-cad-creert;scff/f(n-cad-creert_;scff/f,n=4只小鼠,n-cad-creert+;scff/f,n=6只小鼠)和n-cad-creert+;cxcl12f/f小鼠(n-cad-creert_;cxcl12f/f,n=3只小鼠,n-cad-creert+;cxcl12f/f,n=6只小鼠)的骨髓(bm)中hspc的绝对数量。(*p<0.05,**p<0.01,***p<0.001。误差棒,s.e.m.)。
图20a-20k:造血细胞和小生境细胞的转录组分析。图20a-b显示了对造血干和祖细胞(hspc)的皮尔逊距离树和pca分析。图20c-d显示了对bm小生境细胞的皮尔逊距离树和pca分析。图20e显示了造血干细胞和祖细胞中hsc特征基因的表达。图20f显示了小生境细胞中bm小生境特征基因的表达。图20g显示了bm小生境细胞的术语分析。图20h显示了来自骨膜内和血管周围区域的小生境细胞中基质细胞发育基因的表达。图20i显示了针对3次tmx注射后的n-cad-creert;r26-tdt;nestin-gfp小鼠和3次tmx注射后的n-cad-creert;r26-zsg;cxcl12-dsr小鼠的谱系追踪。图20j显示了来自tmx注射后的n-cad-creert;r26-tdt小鼠的酶促消化的骨髓细胞。lepr和pdfgrα被抗体染色,显示为红色峰。同种型对照显示为灰色峰。图20k显示了来自骨膜内和血管周围区域的小生境细胞中的cfu-f活性。
图21a-21g:n-cad+来源细胞的体外分化潜能和定位。图21a是实验设计。图21b显示了从酶促消化的骨髓培养的活cfu-f集落,在高放大倍数下一个集落中celltracetm和tomato+染色的细胞。图21c-e显示了来源于n-cad-creert;r26-tdt小鼠的基质细胞的体外分化:骨分化后21天的活tdtomato+细胞和培养物的碱性磷酸酶染色(21c);脂肪分化后21天的活tomato+细胞和油红o脂质染色(21d);tomato+细胞的软骨分化21天后,聚集蛋白聚糖抗体染色和甲苯胺蓝染色的软骨细胞(21e)。图21f-g显示(f-g)实验设计。图21h显示了来源于tmx注射后6小时、14小时、24小时、1周和4周的n-cad-creert;r26-tdt小鼠的细胞的定位。图21i显示了在tmx注射后1周、2周、4周和6周在小梁骨、皮质骨和中央骨髓中的tomato+细胞的百分比(1周和2周组中n=2只小鼠,4周和6周组中n=3只小鼠。*p<0.05,**p<0.01,***p<0.001。误差棒,s.e.m.)。
图22a-22k:成年小鼠中n-cad+基质细胞产生成骨细胞和脂肪细胞。图22a显示了来自tmx注射后不同时间点的n-cad-creert;r26-tdt;col2.3-gfp小鼠的代表性股骨切片,显示解剖学分布并增加tomato+col2.3-gfp+成骨细胞的产生。比例尺,100μm。图22b-c显示了在tmx后的早期时间点在6小时(22b)和14小时(22c)所示的区域i、ii、iii、iv、v和vi中n-cad-creert;r26-tdt;col2.3-gfp小鼠的高功率图像。空心箭头显示tmx后6小时和14小时的tomato+col2.3gfp+成骨细胞(黄色细胞),而实心箭头指示在小梁(ii、iv、v)和皮质(iii、vi)区域中重组的n-cad(绿色)。如col2.3-gfp的不存在所示,这些细胞是潜在未分化的。比例尺,50μm。图22d-e显示图像定量,其显示在tmx注射后6小时、14小时、24小时、2周和4周时小梁(22d)和致密骨(22e)中tomato+col2.3-gfp+和tomato+col2.3-gfp─细胞的百分比。图22f显示了图像定量,其比较了小梁骨和致密骨之间潜在未分化的tomato+col2.3-gfp─的百分比。*p<0.05,**p<0.01,***p<0.001。误差棒,s.e.m.。图22g显示了在tmx注射后4周n-cad-creert;r26-tdt;col2.3-gfp小鼠中的小梁骨(tb)和皮质骨(cb)的代表性图像。比例尺,20μm。图22h显示了在来自tmx注射后4周周脂素染色的n-cad-creert;r26-tdt小鼠的股骨部分的代表性低功率图像和高功率图像。在骨膜区域(i)、小梁骨区域附近的骨髓(ii)和中央骨髓(iii),实心箭头显示来源于n-cad+msc的tomato+周脂素+。图22i显示bodipy染色,其显示tomato+周脂素+脂肪细胞内的脂质小滴(绿色)(箭头)。比例尺,20μm。图22j-k显示在tmx注射后6小时、14小时、24小时、2周和4周时小梁骨(22j)和骨膜区域(22k)中的tomato+周脂素+脂肪细胞的图像定量。(*p<0.05,**p<0.01,***p<0.001。误差棒,s.e.m.)。
图23a-23j:n-cad+msc在发育过程中和在受伤后产生软骨细胞。图23a是实验设计。图23b显示在e14.5(tmx诱导后2天),在肋骨中与聚集蛋白聚糖+软骨细胞部分共定位的tomato+。图23c显示了股骨中软骨细胞发育的图示。图23d显示了在e12.5诱导tmx的两日龄的n-cad-creert;r26-tdt小鼠的代表性股骨切片。注意,tomato+细胞在关节表面(i)和发育中的次级骨化中心(ii)中产生聚集蛋白聚糖+软骨细胞。箭头指示tomato+聚集蛋白聚糖+细胞。图23e显示了在e12.5诱导tmx的10个月大的n-cad-creert;r26-tdt小鼠的代表性股骨切片。来自胚胎早期的tomato+细胞分化为周脂素+脂肪细胞。图23f显示了在e12.5诱导tmx的两个月大的n-cad-creert;r26-tdt小鼠的代表性股骨切片。胚胎早期的tomato+细胞分化为骨桥蛋白+肥大软骨细胞(i和ii)和成骨细胞(iii,iv,v和vi);图23g显示了针对在e12.5诱导tmx的n-cad-creert;r26-tdt小鼠的股骨沟损伤的实验设计。图23h显示了在对照小鼠和膝软骨损伤后3周的小鼠中tomato+软骨细胞的定量。图23i为无软骨损伤或软骨损伤后3周的n-cad-creert;r26-tdt小鼠的股骨远端的代表性切片。注意,在对照小鼠(i)的膝盖表面上聚集的tomato+聚集蛋白聚糖+细胞在在膝软骨损伤后3周的小鼠(ii)的对应区域上显著增加。图23j显示了图6h中的切片的aho染色,显示了在对照(i)中和在软骨损伤的位置(ii)中的阿尔辛蓝阳性的软骨细胞。
图24a-24k:5fu后的brdu测定和n-cad报告基因小鼠系。图24a-f显示了代表性图像,其显示了在5fu处理后第0、2、3、4和6天,小鼠股骨中的brdu+细胞。注意,brdu+细胞在5fu后第2天减少,并在5fu后第3天至第6天在骨(红色虚线)或血管/脂肪结构(绿色虚线)附近再活化。图24g显示了brdu+细胞的动态模型。图24h显示了5fu处理后第3至6天骨髓中brdu+细胞与骨表面的比率。图24i显示了在5fu处理后第3至6天,在骨表面附近和在血管/脂肪结构附近的brdu+细胞的百分比。图24j显示了代表性的全骨切片,其显示了在骨表面和中央骨髓中n-cad驱动的tomato+细胞。图24k显示了对照组的n-cad-tdt小鼠和5fu处理后3天的小鼠的中央骨髓(cm)和骨中n-cad驱动的tomato+细胞的绝对数量。每组中n=3。*p<0.05,**p<0.01,***p<0.001。误差棒,s.e.m.。
图25a-25b:n-cad-creert小鼠系的产生。图25a显示了n-cad-creert小鼠系的产生。图25b显示了3次tmx注射后的n-cad-creert,r26-tdt;col2.3-gfp小鼠的谱系追踪;通过cd31和ve-钙黏着蛋白抗体染色血管。
图26a-26e:小生境细胞的分选策略和特征基因表达。图26a显示了从消化的骨细胞收获的骨内膜区域中的小生境细胞。图26b显示了从消化的骨髓细胞收获的来自血管周围和血窦区域的小生境细胞。图26c显示了ng2-rfp+细胞在骨内膜和动脉周围区域的定位。图26d-e显示了小生境细胞中骨软骨形成祖细胞基因和脂肪形成祖细胞基因表达的热图。
图27a-27e:在tmx诱导后的早期时间点n-cad-creert;r26-tdt小鼠中的谱系追踪。图27a-b显示了tmx诱导后24小时和2周的n-cad-creert;r26-tdt;col2.3-gfp小鼠中的小梁骨(tb)和皮质骨(cb)的代表性图像。比例尺,20μm。图27c-e显示在tmx诱导后6小时、14小时和24小时的n-cad-creert;r26-tdt小鼠的具有高功率图像的代表性股骨切片。以周脂素抗体染色显示脂肪细胞。
图28a-28d:来自早期发育的和损伤修复中的n-cad+msc的表征。图28a显示了股骨切片的代表性图像,其显示了在产后d2tmx诱导后24小时n-cad-creert;r26-tdt中的具有聚集蛋白聚糖染色的n-cad+msc。图28b显示了在e12.5诱导tmx的两个月大的n-cad-creert;r26-tdt小鼠的代表性股骨切片。用周脂素抗体染色显示脂肪细胞。图28c显示了在e12.5诱导tmx的两日龄的n-cad-creert;r26-tdt小鼠的代表性股骨切片。用骨桥蛋白抗体染色显示发育中的骨细胞。图28d显示了对照组和膝软骨损伤后2周的e12.5tmx诱导的n-cad-creert;r26-tdt小鼠中的代表性矢状膝切片。比例尺,1mm。
图29:通常被检测为与骨表面相邻的单个细胞(白色,shg)的5fu处理后第3天的存活的rhsc(绿色,cd150+lin─cd49b─)的图像,并且增殖性hsc通常与mk相关(cd150+lin+)或在血管附近(红色,cd31+)。
图30:显示通过10kncad+hmsc和1000k总hmsc在体内产生人thpo的图。
发明详述
本发明的一个实施方案是用于扩增从选自外周血、脐带血和骨髓的组织中获得的干细胞群的方法。该方法包括调节干细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以扩增干细胞的数量。
本发明的另一个实施方案是用于扩增通过修饰从选自外周血、脐带血和骨髓的组织中获得的t细胞而获得的嵌合抗原受体(car)t细胞的细胞群的方法。该方法包括调节cart细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以扩增干细胞的数量。
在本发明中,干细胞和/或t细胞的群体可获自任何哺乳动物,例如人,以及获自任何包含干细胞和/或祖细胞和/或t细胞的组织。如上所述,在优选实施方案中,组织可以是外周血、脐带血或骨髓。
如本文所用,“扩增”、“增殖”及类似的术语是指相对于原始群体中的干细胞和/或cart细胞的数量使用本文公开的任何方法体内或离体增加群体中干细胞和/或car-t细胞的数量。与群体中干细胞和/或cart细胞的原始数量相比,扩增可能至少是40倍。更优选地,与干细胞的原始数量相比,扩增为至少2倍、4倍、5倍、8倍、10倍、15倍、20倍或更多。
在本发明中,“干细胞群”是指一组基本上未分化的细胞,其具有产生许多不同类型的细胞的能力并且具有自我更新的能力。根据本发明的干细胞的代表性的非限制性实例包括支气管肺泡干细胞(basc)、隆起的上皮干细胞(besc)、角膜上皮干细胞(cesc)、心脏干细胞(csc)、表皮神经嵴干细胞(encsc)、胚胎干细胞(esc)、内皮祖细胞(epc)、肝卵圆细胞(hoc)、造血干细胞(hsc)、造血干和祖细胞(hspc)、角质形成干细胞(ksc)、间充质干细胞(msc)、神经元干细胞(nsc)、胰腺干细胞(psc)、视网膜干细胞(rsc)和皮肤来源的前体细胞(skp)。
例如,造血干细胞具有自我更新(即扩增)的能力,并且可以产生所有类型的祖细胞(例如,cmp、gmp、mep和clp),并最终产生造血系统中所有类型的血细胞(例如,红细胞、b淋巴细胞、t淋巴细胞、天然杀伤细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、单核细胞、巨噬细胞和血小板)。作为另一个例子,间充质干细胞是能分化为各种细胞类型(例如,成骨细胞、软骨细胞、肌细胞和脂肪细胞)的多能基质细胞。
在本发明中,“嵌合抗原受体(car)t细胞群”是指已用能够结合特定抗原例如癌症细胞表面上的抗原的嵌合抗原受体修饰并可能具有靶向和杀死此类癌细胞的能力的一组t细胞。可以通过用嵌合抗原受体修饰t细胞例如通过将编码嵌合抗原受体的dna引入t细胞以在t细胞表面上表达嵌合抗原受体来制备cart细胞(davila等人scitranslmed6(224),224ra25(2014);tasian等人theradvhematol6(5),228-241(2015)。
在本发明中,“调节(modulating)”、“调整(modulation)”及类似的术语意指改变信号转导途径,例如m6amrna修饰途径中的蛋白质,包括但不限于降低或增加蛋白质的表达水平,更改此类蛋白质的序列(通过突变、翻译前或翻译后修饰或其他方式),或抑制或活化此类蛋白质(无论是通过结合、磷酸化、糖基化、易位还是其他方式)。这样的调节可以在遗传或药理学上实现。
在本发明的一方面,调节m6amrna修饰途径包括将导致m6amrna修饰途径中分子的调节的突变引入干细胞和/或car-t细胞群。在本发明的另一方面,m6amrna修饰途径的调节还包括使干细胞和/或cart细胞与m6amrna途径中的分子的调节剂接触。此类调节剂的代表性的非限制性实例包括小分子、生物制剂、反义rna、小干扰rna(sirna)及其组合。
在本发明中,短语“m6amrna修饰途径中分子的调节”是指改变m6amrna修饰途径的成员的功能,该改变的功能可以具有与抑制或减少参与mrna的m6a修饰的上游和/或下游过程的分子的功能相似的作用。此类“调节”的非限制性实例包括增加或减少参与在mrna中掺入n6-甲基腺苷修饰、去除对mrna的n6-甲基腺苷mrna修饰和/或识别和加工n6-甲基腺苷修饰的mrna中的任何过程的蛋白质的表达或功能。例如,调节可包括增加或减少mrna中的n6-甲基腺苷修饰,和/或影响mrna中此类修饰的类型和/或分布,例如通过调节m6a书写物(例如甲基转移酶)和m6a擦除物(例如脱甲基酶)中的一种或多种的活性。作为另一个例子,调节可以例如通过调节m6a阅读物(例如,识别甲基化的腺苷的rna结合蛋白)的活性来增加或减少识别对mrna的n6-甲基腺苷修饰以介导m6a依赖性功能的蛋白质的表达或功能。因此,m6amrna修饰途径调节剂中分子的调节可导致m6amrna修饰过程上游或下游的分子的活性和/或表达的调节。
在一个方面,m6amrna修饰途径的调节涉及对选自以下的分子的调节:m6amrna修饰阅读物、m6amrna修饰书写物、m6amrna修饰擦除物及其组合。m6a修饰物书写物的非限制性实例包括能够在信使rna中转录后安装m6a修饰物的甲基转移酶,并且可以包括选自mettl3、mettl14、wtap、kiaa1429及其组合的任何一种。m6a修饰擦除物的非限制性实例包括能够逆转甲基化的脱甲基酶,并且可以包括选自fti、alkbh5及其组合的任何一种。m6a修饰阅读物包括能够选择性结合m6a-甲基化的mrna以通过选择性识别甲基化mrna发挥调节功能的蛋白质。合适的m6a修饰阅读物可以包括选自ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1、elf3及其组合的任何一种。根据一方面,m6a修饰阅读物包括yth结构域蛋白质家族的蛋白质,其包括ythdf1、ythdf2、ythdf3、ythdc1、ythdc2及其组合。(参见例如,wang等人nature,505(7481):117-120,2014;frayling等人science,316:889-894,2007;zheng等人mol.cell.,49:18-29,2012;cao等人openbiol.,6(4):160003,2016;maity等人thefebsjournal,283(9):1607-1630,2016)。
如本文所用,“引入突变”是指用于产生干细胞群和/或cart细胞群的遗传组成的改变的任何常规方法。用于将突变引入干细胞群和/或cart细胞群的非限制性例子包括通过紫外线照射诱变、化学诱变、靶向诱变例如干细胞和/或cart细胞的定点诱变,以及创建转基因小鼠。根据一个方面,可以将突变引入干细胞和/或cart细胞中,以缺失、替换表达m6amrna修饰途径中的分子的基因或减少其表达,所述分子例如是选自以下的分子:m6amrna修饰阅读物、m6amrna修饰书写物、m6amrna修饰擦除物及其组合。在一方面,引入突变以缺失、替换表达m6amrna修饰阅读物(例如选自ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1、elf3及其组合中的任一种)的基因或减少其表达。在一个优选的方面,引入突变以缺失、替换表达ythdf2的基因或减少其表达。在另一方面,引入突变以缺失、替换表达m6amrna修饰书写物(例如选自mettl3、mettl14、wtap、kiaa1429及其组合中的任一种)的基因或减少其表达。在另一方面,引入突变以缺失、替换表达m6amrna修饰擦除物(例如选自fti、alkbh5及其组合中的任一种)的基因或减少其表达。
在一方面,可以通过将干细胞和/或cart细胞暴露于使表达m6amrna修饰途径中的分子的基因的至少一部分失活或缺失的mx1-cre靶向系统来引入突变(参见例如kuhn等人science,269(5229):1427-1429,1995)。在另一方面,引入将短发夹rna(shrna)掺入干细胞和/或cart细胞中以减少表达m6amrna修饰途径中的分子的基因的表达的突变。例如,可以通过将干细胞和/或cart细胞暴露于载体以递送shrna来引入shrna,所述载体可以是诸如慢病毒的病毒载体(参见例如,chira等人oncotarget,6(31):30675-30703,2015)。shrna可以能够触发基因沉默以调节基因表达(参见例如,paddison等人genesdev.,16(8):948-958,2002)。
如本文所用,“n6-甲基腺苷mrna修饰途径的调节剂”(或“m6amrna修饰途径调节剂”)是调节m6amrna修饰途径的任何成员的活性的任何试剂,其例如通过调节m6a书写物(例如,甲基转移酶)和m6a擦除物(例如脱甲基酶)中的一种或多种的活性导致例如mrna中n6-甲基腺苷修饰的增加或减少和/或mrna中此类修饰的类型和/或分布的变化。作为另一个例子,该试剂可以是增加或减少识别对mrna的n6-甲基腺苷修饰以介导m6a依赖性功能(例如通过调节m6a阅读物的活性(例如,识别甲基化腺苷的rna结合蛋白))的蛋白质的活性的试剂。因此,m6amrna修饰途径调节剂可作用于影响对mrna的m6a修饰的试剂,或作用于其上游或下游。
在一个实施方案中,可以通过下调和/或抑制m6amrna修饰途径的成员,例如下调和/或抑制m6amrna修饰阅读物来调节m6amrna修饰途径。如本文所用,“下调”是指抑制或减少m6amrna修饰途径的成员的量或抑制或减少其活性。这样的下调可以通过使用例如反义rna、sirna、抗体或小分子来实现。作为另一个例子,可以通过使干细胞和/或cart细胞与m6amrna阅读物的抑制剂接触来下调m6amrna修饰阅读物,以抑制m6amrna阅读物对m6a修饰的mrna的结合和/或识别。在一方面,被下调的m6amrna修饰阅读物选自ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1、elf3及其组合。在一个优选的方面,被下调的m6amrna修饰阅读物是ythdf2。m6amrna修饰阅读物的抑制剂可选自:(hnrnpc的抑制剂)hsa-let-7e-5p(mirt051596),hsa-mir-455-3p(mirt037890),hsa-mir-30c-5p(mirt047904),hsa-mir-186-5p(mirt045150),hsa-mir-744-5p(mirt037494),hsa-mir-18a-3p(mirt040851),hsa-mir-484(mirt042196),hsa-mir-505-5p(mirt037959),hsa-mir-615-3p(mirt039991),hsa-mir-342-3p(mirt043694),hsa-mir-3607-3p,hsa-mir-30d,hsa-mir-3916,hsa-mir-3162-5p,hsa-mir-1273d,hsa-mir-3161,hsa-mir-30a,hsa-mir-629,hsa-mir-208b,hsa-mir-489,hsa-mir-3148,hsa-mir-2113,hsa-mir-877,hsa-mir-455-5p,hsa-mir-186,hsa-mir-548o,hsa-mir-3139,hsa-mir-320a,hsa-mir-4311,hsa-mir-555,hsa-mir-3605-5p,hsa-mir-515-5p,hsa-mir-144,hsa-mir-499-5p,hsa-mir-1323,hsa-mir-548x,hsa-mir-299-5p,hsa-mir-653,hsa-mir-576-5p,hsa-mir-548p,hsa-mir-586,hsa-mir-888,hsa-mir-3647-3p,hsa-mir-484,hsa-mir-320b,hsa-mir-620,hsa-mir-30b,hsa-mir-548q,hsa-mir-29b-1,hsa-mir-570,hsa-mir-183,hsa-mir-1276,hsa-mir-208a,hsa-mir-186,hsa-mir-28-5p,hsa-mir-330-3p,hsa-mir-548am,hsa-mir-320d,hsa-mir-3175,hsa-mir-3155,hsa-mir-548aa,hsa-mir-519e,hsa-mir-1270,hsa-mir-513b,hsa-mir-599,hsa-mir-518f,hsa-mir-4301,hsa-mir-30c,hsa-mir-3135,hsa-mir-4286,hsa-mir-202,hsa-mir-4263,hsa-mir-4299,hsa-mir-606,hsa-mir-3133,hsa-mir-583,hsa-mir-3125,hsa-mir-501-5p,hsa-mir-7-1,hsa-mir-514b-3p,hsa-mir-3155b,hsa-mir-548d-3p,hsa-mir-224,hsa-mir-7-2,hsa-mir-708,hsa-mir-3199,hsa-mir-514,hsa-mir-30e(参见例如helwak等人cell,153(3):654-655,2013;whisnant等人,mbio4(2),2013:e000193);(hnrnpa2b1的抑制剂)hsa-mir-92a-3p(mirt049721),hsa-mir-30c-5p(mirt048009),hsa-mir-191-5p(mirt045809),hsa-let-7f-5p(mirt051404),hsa-mir-27b-3p(mirt046213),hsa-mir-877-3p(mirt037116),hsa-mir-615-3p(mirt040278),hsa-mir-1260b(mirt052680),hsa-mir-103a-3p(mirt027027),hsa-mir-16-5p(mirt031508),hsa-mir-1296-5p(mirt036075),hsa-mir-197-3p(mirt048098),hsa-mir-548j,hsa-mir-3678-3p,hsa-mir-607,hsa-mir-188-5p,hsa-mir-15a,hsa-mir-3653,hsa-mir-371-5p,hsa-mir-550a,hsa-mir-3622b-3p,hsa-mir-548a-5p,hsa-mir-3170,hsa-mir-3148,hsa-mir-556-3p,hsa-mir-490-3p,hsa-mir-559,hsa-mir-200c,hsa-mir-130a,hsa-mir-548y,hsa-mir-548o,hsa-mir-23c,hsa-mir-491-3p,hsa-mir-335,hsa-mir-3667-3p,hsa-mir-466,hsa-mir-23b,hsa-mir-4310,hsa-mir-127-5p,hsa-mir-548b-5p,hsa-mir-616,hsa-mir-16,hsa-mir-338-3p,hsa-mir-3200-5p,hsa-mir-362-3p,hsa-mir-448,hsa-mir-1306,hsa-mir-944,hsa-mir-3684,hsa-mir-373,hsa-mir-103a,hsa-mir-380,hsa-mir-499-5p,hsa-mir-1323,hsa-mir-323-5p,hsa-mir-3674,hsa-mir-1252,hsa-mir-33b,hsa-mir-580,hsa-mir-548c-3p,hsa-mir-103a-2,hsa-mir-548w,hsa-mir-600,hsa-mir-634,hsa-mir-586,hsa-mir-497,hsa-mir-720,hsa-mir-654-3p,hsa-mir-524-5p,hsa-mir-543,hsa-mir-548q,hsa-let-7f-2,hsa-mir-330-5p,hsa-mir-500a,hsa-mir-548l,hsa-mir-570,hsa-mir-374a,hsa-mir-1184,hsa-mir-649,hsa-mir-424,hsa-mir-3658,hsa-mir-186,hsa-mir-326,hsa-mir-548d-5p,hsa-mir-23a,hsa-mir-15b,hsa-mir-190,hsa-mir-203,hsa-mir-548h,hsa-mir-3136-5p,hsa-mir-618,hsa-mir-551b,hsa-mir-211,hsa-mir-1305,hsa-mir-513b,hsa-mir-96,hsa-mir-2117,hsa-mir-548n,hsa-mir-3910,hsa-mir-217,hsa-mir-892b,hsa-mir-502-5p,hsa-mir-548i,hsa-mir-520d-5p,hsa-mir-4299,hsa-mir-1285,hsa-mir-3133,hsa-mir-483-3p(参见例如,hafner等人cell,141(1):129-141,2010;helwak等人cell,153(3):654-655,2013);(ythdf1的抑制剂)hsa-mir-548g,hsa-mir-204,hsa-mir-3143,hsa-mir-521,hsa-mir-195,hsa-mir-3182,hsa-mir-3941,hsa-mir-34c-3p,hsa-mir-767-3p,hsa-mir-563,hsa-mir-548c-5p,hsa-mir-1911,hsa-mir-26b,hsa-mir-190b,hsa-mir-33a,hsa-mir-329,hsa-mir-221,hsa-mir-612,hsa-mir-3185,hsa-mir-3156-5p,hsa-mir-107,hsa-mir-664,hsa-mir-3657;(ythdf2的抑制剂)hsa-mir-615-3p(mirt040054),hsa-mir-106b-5p(mirt044257),hsa-mir-1(mirt023842),mir-145,hsa-mir-3607-3p,hsa-mir-200a,hsa-mir-301a,hsa-mir-519a,hsa-mir-141,hsa-mir-130b,hsa-mir-181b,hsa-mir-301b,hsa-mir-3117-3p,hsa-mir-1236,hsa-mir-181a,hsa-mir-519c-3p,hsa-mir-551b,hsa-mir-519e,hsa-mir-519b-3p,hsa-mir-19b,hsa-mir-1303,hsa-mir-608,hsa-mir-145,hsa-mir-130a,hsa-mir-181c,hsa-mir-323b-3p,hsa-mir-421,hsa-mir-515-5p,hsa-mir-3666,hsa-mir-181d,hsa-mir-146a,hsa-mir-4295,hsa-mir-454,hsa-mir-3919,hsa-mir-19a,hsa-mir-543,hsa-mir-4262(参见例如helwak等人cell,153(3):654-655,2013;selbach等人nature,455(7209):58-63,2008;yang等人jbiolchem.,292(9):3614-3623,2017);(ythdf3的抑制剂)hsa-mir-582-3p,hsa-mir-579,hsa-mir-520e,hsa-mir-520f,hsa-mir-3152-3p,hsa-mir-106a,hsa-mir-30d,hsa-mir-30a,hsa-mir-93,hsa-mir-508-5p,hsa-mir-29a,hsa-mir-3148,hsa-mir-490-5p,hsa-mir-520b,hsa-mir-20a,hsa-mir-409-3p,hsa-mir-4255,hsa-let-7i,hsa-mir-373,hsa-let-7e,hsa-mir-520c-3p,hsa-mir-3920,hsa-mir-127-5p,hsa-mir-380,hsa-mir-616,hsa-mir-4277,hsa-mir-448,hsa-mir-16-2,hsa-let-7c,hsa-mir-340,hsa-mir-373,hsa-mir-520a-3p,hsa-mir-144,hsa-mir-1265,hsa-mir-548x,hsa-mir-362-5p,hsa-mir-33b,hsa-mir-26b,hsa-mir-17,hsa-mir-569,hsa-mir-3618,hsa-mir-576-5p,hsa-mir-922,hsa-mir-302a,hsa-mir-106b,hsa-mir-888,hsa-mir-484,hsa-let-7b,hsa-mir-582-5p,hsa-let-7f,hsa-mir-30b,hsa-mir-524-5p,hsa-mir-302d,hsa-let-7d,hsa-mir-513a-5p,hsa-mir-500a,hsa-mir-570,hsa-mir-548l,hsa-mir-105,hsa-mir-374c,hsa-let-7ghsa-mir-372,hsa-mir-3658,hsa-let-7a,hsa-mir-3908,hsa-mir-302b,hsa-mir-526b,hsa-mir-190,hsa-mir-181b,hsa-mir-433,hsa-mir-98,hsa-mir-3606,hsa-mir-595,hsa-mir-548am,hsa-mir-187,hsa-mir-561,hsa-mir-181a,hsa-mir-3155,hsa-mir-655,hsa-mir-302c,hsa-mir-195,hsa-mir-26a,hsa-mir-590-3p,hsa-mir-30c,hsa-mir-502-5p,hsa-mir-495,hsa-mir-137,hsa-mir-181c,hsa-mir-520d-5p,hsa-mir-3942-5p,hsa-mir-202,hsa-mir-302e,hsa-mir-513c,hsa-mir-885-5p,hsa-mir-520a-5p,hsa-mir-583,hsa-mir-1297,hsa-mir-7-1,hsa-mir-520d-3p,hsa-mir-3155b,hsa-mir-3182,hsa-mir-519d,hsa-mir-550a,hsa-mir-7-2,hsa-mir-181d,hsa-mir-190b,hsa-mir-1912,hsa-mir-151-3p,hsa-mir-33a,hsa-mir-525-5p,hsa-mir-20b,hsa-mir-514b-5p,hsa-mir-30e,hsa-mir-4262,hsa-mir-636;(elf3的抑制剂)hsa-mir-92b-3p(mirt040734),hsa-mir-16-5p(mirt031705),hsa-mir-18a-3p(mirt040974),hsa-mir-155-5p(mirt020771),hsa-mir-484(mirt042324),hsa-let-7c-5p(mirt051776),hsa-mir-3910,hsa-mir-148b,hsa-mir-136,hsa-mir-15a,hsa-mir-488,hsa-mir-500a,hsa-mir-1297,hsa-mir-3159,hsa-mir-374c,hsa-mir-424,hsa-mir-7-1,hsa-mir-186,hsa-mir-195,hsa-mir-15b,hsa-mir-26b,hsa-mir-505,hsa-mir-1206,hsa-mir-653,hsa-mir-1283,hsa-mir-7-2,hsa-mir-196a,hsa-mir-497,hsa-mir-33a,hsa-mir-655,hsa-mir-26ahsa-mir-16,hsa-mir-151a-3p(mirt043600),hsa-mir-92a-3p(mirt049064),hsa-mir-615-3p(mirt039779),hsa-mir-877-3p(mirt036964),hsa-mir-222-3p(mirt046746),hsa-mir-423-3p(mirt042468),hsa-mir-324-3p(mirt042887),hsa-mir-124-3p(mirt022932),hsa-mir-3140-3p,hsa-mir-124,hsa-mir-198,hsa-mir-525-5p,hsa-mir-506,hsa-mir-520a-5p,hsa-mir-196a*hsa-mir-3117-3p,hsa-mir-342-5p(mirt038210),hsa-mir-378a-5p(mirt043981),hsa-mir-615-3p(mirt040086),hsa-let-7b-5p(mirt052211),hsa-mir-455-3p(mirt037879),hsa-mir-4267,hsa-mir-590-3p,hsa-mir-106b-5p(mirt044355),hsa-mir-320a(mirt044466),hsa-mir-16-5p(mirt032018),hsa-mir-155-5p(mirt021009),hsa-mir-4302,hsa-mir-191-5p(mirt045793),hsa-mir-1303(mirt035890),hsa-mir-193b-3p(mirt016316),hsa-mir-222-3p(mirt046640),hsa-mir-532-3p(mirt037924),hsa-mir-18a-3p(mirt040929),hsa-mir-92a-3p(mirt049001),hsa-mir-582-3p,hsa-mir-4265,hsa-mir-218-2,hsa-mir-1271,hsa-mir-340,hsa-mir-221,hsa-mir-20b,hsa-mir-508-3p,hsa-mir-141,hsa-mir-4325,hsa-mir-889,hsa-mir-29a,hsa-mir-129-3p,hsa-mir-129,hsa-mir-96,hsa-mir-3163,hsa-mir-187,hsa-mir-196a,hsa-mir-222,hsa-mir-1179,hsa-mir-182,hsa-mir-9*hsa-mir-32,hsa-mir-143,hsa-mir-4296(参见例如,helwak等人cell,153(3):654-656,2013;selbach等人nature,455(7209):58-63,2008;baek等人,nature,455(7209):64-71,2008;leivonen等人molcellproteomics,10(7),2011:m110.005322):(ythdc1的抑制剂)hsa-mir-20a-3p(mirt038967),hsa-mir-103a-3p(mirt027037),hsa-mir-1(mirt023492),hsa-mir-19b-3p(mirt031105),hsa-mir-100-5p(mirt048400),hsa-mir-93-5p(mirt027989),hsa-mir-16-5p(mirt031379),hsa-let-7b-5p(mirt052150),hsa-mir-520f,hsa-mir-300,hsa-mir-15a,hsa-mir-200a,hsa-mir-605,hsa-mir-30d,hsa-mir-30a,hsa-mir-3613-3p,hsa-mir-509-3-5p,hsa-mir-34c-5p,hsa-mir-324-3p,hsa-mir-1248,hsa-mir-152,hsa-mir-548t,hsa-mir-4310,hsa-mir-145,hsa-mir-516a-3p,hsa-mir-16,hsa-mir-3668,hsa-mir-4277,hsa-mir-448,hsa-mir-16-2,hsa-mir-148b,hsa-mir-509-5p,hsa-mir-103a,hsa-mir-1265,hsa-mir-2115,hsa-mir-548c-3p,hsa-mir-148a,hsa-mir-548p,hsa-mir-513a-3p,hsa-mir-497,hsa-mir-3647-3p,hsa-mir-382,hsa-mir-30b,hsa-mir-543,hsa-let-7f-2,hsa-mir-1269,hsa-mir-3164,hsa-mir-503,hsa-mir-500a,hsa-mir-449a,hsa-mir-141,hsa-mir-424,hsa-mir-3908,hsa-mir-889,hsa-mir-2116,hsa-mir-330-3p,hsa-mir-15b,hsa-mir-181b,hsa-mir-187,hsa-mir-1237,hsa-mir-449b,hsa-mir-101,hsa-mir-381,hsa-mir-618,hsa-mir-222,hsa-mir-181a,hsa-mir-432,hsa-mir-96,hsa-mir-19b,hsa-mir-195,hsa-mir-548n,hsa-mir-485-5p,hsa-mir-217,hsa-mir-30c,hsa-mir-495,hsa-mir-137,hsa-mir-1288,hsa-mir-181c,hsa-mir-3942-5p,hsa-mir-548v,hsa-mir-487a,hsa-mir-221,hsa-mir-891b,hsa-mir-205,hsa-mir-195,hsa-mir-4271,hsa-mir-3611,hsa-mir-516b,hsa-mir-181d,hsa-mir-154,hsa-mir-646,hsa-mir-153,hsa-mir-34a,hsa-mir-19a,hsa-mir-107,hsa-mir-30e和hsa-mir-4262(参见例如helwak等人cell,153(3):654-655,2013;hafner等人cell,141(1):129-141,2010;kishore等人,natmethods,8(7):559-64,2011;memczak等人nature,495(7441):333-8,2013;selbach等人nature,455(7209):58-63,2008;chi等人nature.460(7254):479-86,2009)。
在本发明中,术语“小分子”包括除多肽和核酸以外的任何化学或其他部分,其可以发挥作用以影响生物过程,特别是调节m6amrna修饰途径的成员。小分子可以包括目前已知和使用的任何数量的治疗剂,或者可以在此类分子的文库中合成以用于筛选生物学功能的治疗剂。小分子与大分子在大小上不同。本发明的小分子的分子量通常小于约5,000道尔顿(da),优选小于约2,500da,更优选小于1,000da,最优选小于约500da。
小分子包括但不限于有机化合物、拟肽及其缀合物。如本文所用,术语“有机化合物”是指除大分子例如核酸和多肽之外的任何基于碳的化合物。除碳外,有机化合物还可包含钙、氯、氟、铜、氢、铁、钾、氮、氧、硫和其他元素。有机化合物可以是芳族或脂族形式。有机化合物的非限制性实例包括丙酮,醇,苯胺,碳水化合物,单糖,寡糖,多糖,氨基酸,核苷,核苷酸,脂质,类维生素a,类固醇,蛋白聚糖,酮,醛,饱和、不饱和以及多不饱和脂肪,油和蜡,烯烃,酯,醚,硫醇,硫化物,环状化合物,杂环化合物,咪唑,和酚。本文所用的有机化合物还包括硝化的有机化合物和卤化的(例如氯化的)有机化合物。
优选的小分子相对较容易且较便宜地制造、配制或以其他方式制备。优选的小分子在多种储存条件下是稳定的。可以将优选的小分子与大分子紧密结合,以形成具有生物活性并具有改善的药物特性的分子。改善的药物特性包括有利于所需生物学活性的循环时间、分布、代谢、修饰、排泄、分泌、消除和稳定性的变化。改善的药物特性包括化学实体的毒理学和功效特性的变化。
通常,多肽模拟物(“拟肽”)是模拟多肽的生物学活性但在化学性质上不是肽的分子。虽然在某些实施方案中,拟肽是不包含肽键(即氨基酸之间的酰胺键)的分子,但是术语拟肽可以包括在特性上不完全为肽的分子,例如假肽、半肽和类肽。
如本文所用,术语“生物制剂”是指来源自生物来源而不是化学过程的产品。“生物制剂”的非限制性实例包括蛋白质、条件培养基和来自组织的部分纯化的产物。
术语“肽”、“多肽”和“蛋白质”在本文可互换使用。在本发明中,这些术语是指氨基酸的连接序列,其可以是天然的、合成的或天然和合成的修饰或组合。该术语包括抗体、抗体模拟物、结构域抗体、脂质运载蛋白和靶向蛋白酶。该术语还包括旨在产生针对肽或肽片段的抗体的含有肽或肽片段的疫苗。
本文使用的“抗体”包括igg、igm、iga、igd或ige种类的抗体,或其片段或衍生物,包括fab、f(ab')2、fd和单链抗体、双抗体、双特异性抗体和双功能抗体。抗体可以是单克隆抗体、多克隆抗体、亲和纯化的抗体或其混合物,其对所需表位或由其来源的序列具有足够的结合特异性。抗体也可以是嵌合抗体。可以通过连接本领域已知的一种或多种化学部分、肽或多肽部分来衍生抗体。抗体可以与化学部分缀合。抗体可以是人抗体或人源化抗体。这些和其他抗体在美国公开专利申请号20070065447中公开。
其他抗体样分子也在本发明的范围内。这样的抗体样分子包括例如受体陷阱(例如依那西普)、抗体模拟物(例如adnectin,基于纤连蛋白的“可寻址的”治疗性结合分子,例如来自compoundtherapeutics,inc.)、结构域抗体(天然存在的单结构域抗体(例如纳米抗体;参见例如cortez-retamozo等人,cancerres.2004apr15;64(8):2853-7)的最小的功能片段)。
合适的抗体模拟物通常可以用作本文描述的抗体和抗体片段的替代物。这样的抗体模拟物可以具有有利的性质(例如,它们可以是水溶性的、抗蛋白水解的和/或是非免疫原性的)。例如,已经提出并产生了包含模拟单克隆抗体的第二互补决定区(cdr)的合成的β-环结构的肽。参见例如,saragovi等人,science.aug.16,1991;253(5021):792-5。还通过使用肽图谱以确定“活性”抗原识别残基、分子建模和分子动力学轨迹分析来生成肽抗体模拟物,以设计包含来自多个cdr的抗原接触残基的肽模拟物。参见例如,cassett等人,biochembiophysrescommun.jul.18,2003;307(1):198-205。在例如fassina,immunomethods.october1994;5(2):121-9中提供了可在本发明的上下文中应用的有关原理、方法等的其他讨论。
如本文所用,“肽”包括靶向蛋白酶,其能够例如底物靶向抑制翻译后修饰,例如在美国专利申请公开号20060275823中公开的。
如本文所用,“反义”分子包括反义或有义寡核苷酸,其包含能够结合靶mrna(正义)或dna(反义)序列的单链核酸序列(rna或dna)。例如,在steinandcohen,cancerres.48:2659,(1988)andvanderkrol等人,biotechniques6:958,(1988)中描述了基于编码给定蛋白质的cdna序列获得反义或正义寡核苷酸的能力。
反义分子可以是修饰的或未修饰的rna、dna或混合的聚合物寡核苷酸。这些分子通过与匹配序列特异性结合而起作用,从而通过空间阻断或通过活化rnaseh酶而抑制肽合成(wu-pong,november1994,biopharm,20-33)。反义分子还可通过干扰rna加工来改变蛋白质的合成或从细胞核转运到细胞质中(mukhopadhyay&roth,1996,crit.rev.inoncogenesis7,151-190)。另外,单链dna与rna的结合可导致异源双链体的核酸酶介导的降解(wu-pong,同上)。迄今为止已显示作为rnaseh的底物的主链修饰的dna化学物是硫代磷酸酯、二硫代磷酸酯、三氟硼酸酯以及含2'-阿拉伯糖和2'-氟阿拉伯糖的寡核苷酸。
反义分子可通过与配体结合分子形成缀合物而被引入含有靶核苷酸序列的细胞中,如例如在wo91/04753中所述。合适的配体结合分子包括但不限于细胞表面受体、生长因子、其他细胞因子或与细胞表面受体结合的其他配体。优选地,配体结合分子的缀合基本上不干扰配体结合分子与其相应的分子或受体结合的能力,或阻断正义或反义寡核苷酸或其缀合形式进入细胞。或者,可以通过形成寡核苷酸-脂质复合物将正义或反义寡核苷酸引入含有靶核酸序列的细胞中,如wo90/10448中所述。
术语小干扰rna(“sirna”)是指诱导rna干扰(rnai)途径的小抑制性rna双链体。(elbashir,s.m.等人nature411:494-498(2001);caplen,n.j.等人proc.natl.acad.sci.usa98:9742-9747(2001);harborth,j.等人jcellsci.114:4557-4565(2001))。这些分子的长度可以变化(通常为18-30个碱基对),并且在其反义链中含有不同程度的与其靶mrna的互补性。某些但并非全部sirna在正义链和/或反义链的5'或3'末端具有未配对的突出碱基。术语“sirna”包括两条分开的链的双链体,以及可以形成包含双链体区的发夹结构的单链。如本文所用,sirna分子不限于rna分子,而是还包括化学修饰的核苷酸和非核苷酸。sirna基因靶向可以通过瞬时sirna转移到细胞中来实现(通过脂质体介导的转染、电穿孔或显微注射等经典方法来实现)。
在本发明的另一个方面,干细胞和/或cart细胞的数量增加至少2倍。优选地,干细胞和/或cart细胞的数量增加至少2.5倍,至少3倍,至少3.5倍,至少4倍,例如至少5倍,包括至少8倍,至少10倍,至少15倍,至少20倍或更多。出乎意料地,使用本发明的方法实现了这种水平的干细胞和/或cart细胞扩增。
如上所述,本发明的方法可以用于扩增任何干细胞群。优选地,可以根据本发明的方法扩增的干细胞可以选自造血干细胞(hsc)、造血干和祖细胞(hspc)、内皮祖细胞(epc)、间充质干细胞(msc)、心脏干细胞(csc)、神经元干细胞(nsc)及其组合。根据一方面,干细胞是hsc。根据另一方面,干细胞是msc。
本发明的方法也可能能够扩增干细胞,使得扩增的细胞的总集落形成单位(cfu)增加至少5倍,例如8倍,10倍,甚至15倍或更多的增加。此外,该方法可能能够使cfu-粒细胞红细胞单核细胞巨核细胞(gemm)集落增加至少3.8倍,例如至少4倍,5倍,和甚至至少8倍或更多。
本发明的另一个实施方案是用于离体扩增基本上未分化的干细胞群的方法。该方法包括调节未分化干细胞群中的n6-甲基腺苷mrna修饰途径,以扩增未分化干细胞的数量而不会显著分化干细胞群。
在该实施方案中,如果干细胞群中足够数量的细胞保留自我更新的能力并在移植到受体中时可产生多种分化的细胞类型(例如,在hsc群的情况下,在移植时重新增生hsc谱系(或在msc群的情况下,在移植时重新增生msc谱系)),则该干细胞群是“基本上未分化的”。如本文所用,“无显著分化”是指扩增的干细胞群具有足够数量的细胞,其维持多谱系分化潜能,从而可以在将扩增的干细胞群移植到受体中时再生全部范围的靶干谱系。因此,例如在hsc群的情况下,扩增的hsc群当移植到受体中时能够再生整个造血细胞谱系。在msc群的情况下,扩增的msc群当移植到受体中时能够再生整个间充质细胞谱系。
另一个实施方案是用于嵌合抗原受体(car)t细胞群的离体扩增的方法。该方法包括调节cart细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以扩增cart细胞的数量。
本发明的另一个实施方案是用于离体扩增从选自外周血、脐带血和骨髓的组织中获得的造血干细胞(hsc)群的方法。该方法包括调节hsc群中的n6-甲基腺苷mrna修饰途径以将hsc群扩增至足够的量,同时保持hsc群中的多谱系分化潜能,所述hsc群足以用于随后移植入有此需要的受试者中。
本发明的另一个实施方案是用于离体扩增从选自外周血、脐带血和骨髓的组织中获得的间充质干细胞(msc)群的方法。该方法包括调节msc群中的n6-甲基腺苷mrna修饰途径,以将msc群扩增至足够的量,同时保持msc群中的多谱系分化潜能,所述msc群足以用于随后移植至有此需要的受试者中。
本发明的另一个实施方案是用于离体扩增通过修饰从选自外周血、脐带血和骨髓的组织获得的t细胞而制备的嵌合抗原受体(car)t细胞群的方法。该方法包括调节cart细胞群中的n6-甲基腺苷(m6a)mrna修饰途径,以将cart细胞群扩增至足够的量,所述cart细胞群足以用于随后移植入有此需要的受试者中。
如本文所用,从组织“获得”是指从供体收集或分割组织的任何常规方法。如前所述,组织可以是包含干细胞(例如hsc和/或msc)和/或能够被嵌合抗原受体修饰的t细胞的任何组织。因此,例如,组织可以获自血液样品,例如外周血或脐带血样品,或获自骨髓。获得此类样品的方法是本领域技术人员众所周知的。在本发明中,样品可以是新鲜的,即从供体获得而不冷冻。此外,可以在扩增之前进一步处理样品以去除多余或不需要的成分。样品也可以从保存的存货中获得。例如,在外周血或脐带血的情况下,可以从这种血液的低温或以其他方式保存的库中取出样品。这样的样品可以从任何合适的供体获得。优选地,供体是哺乳动物,例如灵长类动物,例如人。此外,样品可以获自自体或异体供体或来源。优选地,样品是从自体来源获得的。
在该方法中,“保持多谱系分化潜能”是指当扩增的hsc和/或msc群在移植到需要这种移植的受试者中时,具有再生所有类型的祖细胞(例如cmp、gmp、mep和clp)和最终造血系统中的所有类型的血细胞(包括例如红细胞、b淋巴细胞、t淋巴细胞、天然杀伤细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、单核细胞、巨噬细胞和血小板)的能力。
在本发明中,“足以用于后续移植”的扩增的hsc和/或msc和/或cart细胞的量通常对应于hsc和/或msc和/或cart-细胞的数量,其将导致移植后大于约1%的移植。这是一项被接受的成功移植的措施。在本发明中,可以使用任何常规方法来确定植入百分比,包括实施例中所述的方法。这种测量可以在有或没有竞争者细胞的情况下进行,通常并且优选在没有竞争者细胞的情况下进行。(zhang,c.c.,等人,natmed,12(2):240-5,2006.zhang,c.c.andh.f.lodish,blood,105(11):4314-20,2005)。
在上述离体扩增方法中,可以如前所述实现对n6-甲基腺苷mrna修饰途径的调节。调节n6-甲基腺苷mrna修饰途径可包括将导致m6amrna修饰途径中分子的调节的突变引入干细胞和/或cart细胞中,或使干细胞和/或cart细胞接触m6amrna修饰途径中分子的调节剂,其选自小分子、生物制剂、反义rna、小干扰rna(sirna)及其组合。
在离体扩增方法的一方面,调节m6amrna修饰途径涉及对选自以下的分子的调节:m6amrna修饰阅读物、m6amrna修饰书写物、m6amrna修饰擦除物及其组合。m6a修饰物书写物的非限制性实例包括能够在信使rna中转录后安装m6a修饰物的甲基转移酶,并且可以包括选自mettl3、mettl14、wtap、kiaa1429及其组合的任何一种。m6a修饰擦除物的非限制性实例包括能够逆转甲基化的脱甲基酶,并且可以包括选自fti、alkbh5及其组合的任何一种。m6a修饰阅读物包括能够选择性结合m6a-甲基化的mrna以通过选择性识别甲基化mrna发挥调节功能的蛋白质。合适的m6a修饰阅读物可以包括选自ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1、elf3及其组合的任何一种。根据一方面,m6a修饰阅读物包括yth结构域蛋白质家族的蛋白质,其包括ythdf1、ythdf2、ythdf3、ythdc1、ythdc2及其组合。(参见例如,wang等人nature,505(7481):117-120,2014;frayling等人science,316:889-894,2007;zheng等人mol.cell.,49:18-29,2012;cao等人openbiol.,6(4):160003,2016;maity等人thefebsjournal,283(9):1607-1630,2016)。
在离体扩增方法的一方面,调节m6amrna修饰途径包括将突变引入干细胞和/或car-t细胞中,以缺失、替换表达m6amrna修饰途径中的分子的基因或减少其表达的。例如,该突变缺失、替换表达选自以下的分子的基因或减少其表达:m6amrna修饰阅读物、m6amrna修饰书写物、m6amrna擦除物及其组合。在一方面,该突变缺失、替换表达m6amrna修饰阅读物(例如选自ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1、elf3及其组合的m6amrna修饰阅读物)的基因或减少其表达。在一个优选的方面,该突变缺失、替换表达ythdf2的基因或减少其表达。在另一方面,该突变缺失、替换表达m6amrna修饰擦除物的基因(例如选自fto、alkbh5及其组合的m6amrna修饰擦除物)或减少其表达。在另一方面,该突变缺失、替换表达m6amrna修饰书写物的基因(例如选自mettl3、mettl14、wtap、kiaa1429及其组合的m6amrna修饰书写物)或减少其表达。
在离体扩增方法的一方面,可以通过本文先前公开的任何方法引入突变。例如,可以通过将干细胞和/或cart细胞暴露于mx1-cre靶向系统(参见例如,kuhn等人science,269(5229):1427-1429,1995)中来引入突变,所述mx1-cre靶向系统使表达m6amrna修饰途径中的分子的基因的至少一部分失活或缺失。在另一方面,引入将短发夹rna(shrna)掺入干细胞和/或cart细胞中以减少表达m6amrna修饰途径中的分子的基因的表达的突变。例如,可以通过将干细胞和/或car-t细胞暴露于载体以递送shrna来引入shrna,所述载体可以是诸如慢病毒的病毒载体(参见例如,chira等人oncotarget,6(31):30675-30703,2015)。shrna可能能够触发基因沉默以调节基因表达(参见例如,paddison等人genesdev.,16(8):948-958,2002)。
在这些离体扩增方法中,根据一个方面,调节m6amrna修饰途径包括下调和/或抑制m6amrna修饰途径的成员,例如下调和/或抑制m6amrna修饰阅读物。如本文所用,“下调”是指抑制或减少m6amrna修饰途径的成员的量或抑制或减少其活性。这样的下调可以通过使用例如反义rna、sirna、抗体或小分子来实现。作为另一个例子,可以通过使干细胞和/或cart细胞与m6amrna阅读物的抑制剂接触来下调m6amrna修饰阅读物,以抑制m6amrna阅读物对m6a修饰的mrna的结合和/或识别。在一方面,被下调的m6amrna修饰阅读物选自ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1、elf3及其组合。在一个优选的方面,被下调的m6amrna修饰阅读物是ythdf2。先前已经阐明了ythdf2的rna衰变作用(参见例如,wang等人nature505(7481):117-120,2014)。m6amrna修饰阅读物的抑制剂可选自:(hnrnpc的抑制剂)hsa-let-7e-5p(mirt051596),hsa-mir-455-3p(mirt037890),hsa-mir-30c-5p(mirt047904),hsa-mir-186-5p(mirt045150),hsa-mir-744-5p(mirt037494),hsa-mir-18a-3p(mirt040851),hsa-mir-484(mirt042196),hsa-mir-505-5p(mirt037959),hsa-mir-615-3p(mirt039991),hsa-mir-342-3p(mirt043694),hsa-mir-3607-3p,hsa-mir-30d,hsa-mir-3916,hsa-mir-3162-5p,hsa-mir-1273d,hsa-mir-3161,hsa-mir-30a,hsa-mir-629,hsa-mir-208b,hsa-mir-489,hsa-mir-3148,hsa-mir-2113,hsa-mir-877,hsa-mir-455-5p,hsa-mir-186,hsa-mir-548o,hsa-mir-3139,hsa-mir-320a,hsa-mir-4311,hsa-mir-555,hsa-mir-3605-5p,hsa-mir-515-5p,hsa-mir-144,hsa-mir-499-5p,hsa-mir-1323,hsa-mir-548x,hsa-mir-299-5p,hsa-mir-653,hsa-mir-576-5p,hsa-mir-548p,hsa-mir-586,hsa-mir-888,hsa-mir-3647-3p,hsa-mir-484,hsa-mir-320b,hsa-mir-620,hsa-mir-30b,hsa-mir-548q,hsa-mir-29b-1,hsa-mir-570,hsa-mir-183,hsa-mir-1276,hsa-mir-208a,hsa-mir-186,hsa-mir-28-5p,hsa-mir-330-3p,hsa-mir-548am,hsa-mir-320d,hsa-mir-3175,hsa-mir-3155,hsa-mir-548aa,hsa-mir-519e,hsa-mir-1270,hsa-mir-513b,hsa-mir-599,hsa-mir-518f,hsa-mir-4301,hsa-mir-30c,hsa-mir-3135,hsa-mir-4286,hsa-mir-202,hsa-mir-4263,hsa-mir-4299,hsa-mir-606,hsa-mir-3133,hsa-mir-583,hsa-mir-3125,hsa-mir-501-5p,hsa-mir-7-1,hsa-mir-514b-3p,hsa-mir-3155b,hsa-mir-548d-3p,hsa-mir-224,hsa-mir-7-2,hsa-mir-708,hsa-mir-3199,hsa-mir-514,hsa-mir-30e(参见例如helwak等人cell,153(3):654-655,2013;whisnant等人,mbio4(2),2013:e000193);(hnrnpa2b1的抑制剂)hsa-mir-92a-3p(mirt049721),hsa-mir-30c-5p(mirt048009),hsa-mir-191-5p(mirt045809),hsa-let-7f-5p(mirt051404),hsa-mir-27b-3p(mirt046213),hsa-mir-877-3p(mirt037116),hsa-mir-615-3p(mirt040278),hsa-mir-1260b(mirt052680),hsa-mir-103a-3p(mirt027027),hsa-mir-16-5p(mirt031508),hsa-mir-1296-5p(mirt036075),hsa-mir-197-3p(mirt048098),hsa-mir-548j,hsa-mir-3678-3p,hsa-mir-607,hsa-mir-188-5p,hsa-mir-15a,hsa-mir-3653,hsa-mir-371-5p,hsa-mir-550a,hsa-mir-3622b-3p,hsa-mir-548a-5p,hsa-mir-3170,hsa-mir-3148,hsa-mir-556-3p,hsa-mir-490-3p,hsa-mir-559,hsa-mir-200c,hsa-mir-130a,hsa-mir-548y,hsa-mir-548o,hsa-mir-23c,hsa-mir-491-3p,hsa-mir-335,hsa-mir-3667-3p,hsa-mir-466,hsa-mir-23b,hsa-mir-4310,hsa-mir-127-5p,hsa-mir-548b-5p,hsa-mir-616,hsa-mir-16,hsa-mir-338-3p,hsa-mir-3200-5p,hsa-mir-362-3p,hsa-mir-448,hsa-mir-1306,hsa-mir-944,hsa-mir-3684,hsa-mir-373,hsa-mir-103a,hsa-mir-380,hsa-mir-499-5p,hsa-mir-1323,hsa-mir-323-5p,hsa-mir-3674,hsa-mir-1252,hsa-mir-33b,hsa-mir-580,hsa-mir-548c-3p,hsa-mir-103a-2,hsa-mir-548w,hsa-mir-600,hsa-mir-634,hsa-mir-586,hsa-mir-497,hsa-mir-720,hsa-mir-654-3p,hsa-mir-524-5p,hsa-mir-543,hsa-mir-548q,hsa-let-7f-2,hsa-mir-330-5p,hsa-mir-500a,hsa-mir-548l,hsa-mir-570,hsa-mir-374a,hsa-mir-1184,hsa-mir-649,hsa-mir-424,hsa-mir-3658,hsa-mir-186,hsa-mir-326,hsa-mir-548d-5p,hsa-mir-23a,hsa-mir-15b,hsa-mir-190,hsa-mir-203,hsa-mir-548h,hsa-mir-3136-5p,hsa-mir-618,hsa-mir-551b,hsa-mir-211,hsa-mir-1305,hsa-mir-513b,hsa-mir-96,hsa-mir-2117,hsa-mir-548n,hsa-mir-3910,hsa-mir-217,hsa-mir-892b,hsa-mir-502-5p,hsa-mir-548i,hsa-mir-520d-5p,hsa-mir-4299,hsa-mir-1285,hsa-mir-3133,hsa-mir-483-3p(参见例如,hafner等人cell,141(1):129-141,2010;helwak等人cell,153(3):654-655,2013);(ythdf1的抑制剂)hsa-mir-548g,hsa-mir-204,hsa-mir-3143,hsa-mir-521,hsa-mir-195,hsa-mir-3182,hsa-mir-3941,hsa-mir-34c-3p,hsa-mir-767-3p,hsa-mir-563,hsa-mir-548c-5p,hsa-mir-1911,hsa-mir-26b,hsa-mir-190b,hsa-mir-33a,hsa-mir-329,hsa-mir-221,hsa-mir-612,hsa-mir-3185,hsa-mir-3156-5p,hsa-mir-107,hsa-mir-664,hsa-mir-3657;(ythdf2的抑制剂)hsa-mir-615-3p(mirt040054),hsa-mir-106b-5p(mirt044257),hsa-mir-1(mirt023842),mir-145,hsa-mir-3607-3p,hsa-mir-200a,hsa-mir-301a,hsa-mir-519a,hsa-mir-141,hsa-mir-130b,hsa-mir-181b,hsa-mir-301b,hsa-mir-3117-3p,hsa-mir-1236,hsa-mir-181a,hsa-mir-519c-3p,hsa-mir-551b,hsa-mir-519e,hsa-mir-519b-3p,hsa-mir-19b,hsa-mir-1303,hsa-mir-608,hsa-mir-145,hsa-mir-130a,hsa-mir-181c,hsa-mir-323b-3p,hsa-mir-421,hsa-mir-515-5p,hsa-mir-3666,hsa-mir-181d,hsa-mir-146a,hsa-mir-4295,hsa-mir-454,hsa-mir-3919,hsa-mir-19a,hsa-mir-543,hsa-mir-4262(参见例如helwak等人cell,153(3):654-655,2013;selbach等人nature,455(7209):58-63,2008;yang等人jbiolchem.,292(9):3614-3623,2017);(ythdf3的抑制剂)hsa-mir-582-3p,hsa-mir-579,hsa-mir-520e,hsa-mir-520f,hsa-mir-3152-3p,hsa-mir-106a,hsa-mir-30d,hsa-mir-30a,hsa-mir-93,hsa-mir-508-5p,hsa-mir-29a,hsa-mir-3148,hsa-mir-490-5p,hsa-mir-520b,hsa-mir-20a,hsa-mir-409-3p,hsa-mir-4255,hsa-let-7i,hsa-mir-373,hsa-let-7e,hsa-mir-520c-3p,hsa-mir-3920,hsa-mir-127-5p,hsa-mir-380,hsa-mir-616,hsa-mir-4277,hsa-mir-448,hsa-mir-16-2,hsa-let-7c,hsa-mir-340,hsa-mir-373,hsa-mir-520a-3p,hsa-mir-144,hsa-mir-1265,hsa-mir-548x,hsa-mir-362-5p,hsa-mir-33b,hsa-mir-26b,hsa-mir-17,hsa-mir-569,hsa-mir-3618,hsa-mir-576-5p,hsa-mir-922,hsa-mir-302a,hsa-mir-106b,hsa-mir-888,hsa-mir-484,hsa-let-7b,hsa-mir-582-5p,hsa-let-7f,hsa-mir-30b,hsa-mir-524-5p,hsa-mir-302d,hsa-let-7d,hsa-mir-513a-5p,hsa-mir-500a,hsa-mir-570,hsa-mir-548l,hsa-mir-105,hsa-mir-374c,hsa-let-7ghsa-mir-372,hsa-mir-3658,hsa-let-7a,hsa-mir-3908,hsa-mir-302b,hsa-mir-526b,hsa-mir-190,hsa-mir-181b,hsa-mir-433,hsa-mir-98,hsa-mir-3606,hsa-mir-595,hsa-mir-548am,hsa-mir-187,hsa-mir-561,hsa-mir-181a,hsa-mir-3155,hsa-mir-655,hsa-mir-302c,hsa-mir-195,hsa-mir-26a,hsa-mir-590-3p,hsa-mir-30c,hsa-mir-502-5p,hsa-mir-495,hsa-mir-137,hsa-mir-181c,hsa-mir-520d-5p,hsa-mir-3942-5p,hsa-mir-202,hsa-mir-302e,hsa-mir-513c,hsa-mir-885-5p,hsa-mir-520a-5p,hsa-mir-583,hsa-mir-1297,hsa-mir-7-1,hsa-mir-520d-3p,hsa-mir-3155b,hsa-mir-3182,hsa-mir-519d,hsa-mir-550a,hsa-mir-7-2,hsa-mir-181d,hsa-mir-190b,hsa-mir-1912,hsa-mir-151-3p,hsa-mir-33a,hsa-mir-525-5p,hsa-mir-20b,hsa-mir-514b-5p,hsa-mir-30e,hsa-mir-4262,hsa-mir-636;(elf3的抑制剂)hsa-mir-92b-3p(mirt040734),hsa-mir-16-5p(mirt031705),hsa-mir-18a-3p(mirt040974),hsa-mir-155-5p(mirt020771),hsa-mir-484(mirt042324),hsa-let-7c-5p(mirt051776),hsa-mir-3910,hsa-mir-148b,hsa-mir-136,hsa-mir-15a,hsa-mir-488,hsa-mir-500a,hsa-mir-1297,hsa-mir-3159,hsa-mir-374c,hsa-mir-424,hsa-mir-7-1,hsa-mir-186,hsa-mir-195,hsa-mir-15b,hsa-mir-26b,hsa-mir-505,hsa-mir-1206,hsa-mir-653,hsa-mir-1283,hsa-mir-7-2,hsa-mir-196a,hsa-mir-497,hsa-mir-33a,hsa-mir-655,hsa-mir-26ahsa-mir-16,hsa-mir-151a-3p(mirt043600),hsa-mir-92a-3p(mirt049064),hsa-mir-615-3p(mirt039779),hsa-mir-877-3p(mirt036964),hsa-mir-222-3p(mirt046746),hsa-mir-423-3p(mirt042468),hsa-mir-324-3p(mirt042887),hsa-mir-124-3p(mirt022932),hsa-mir-3140-3p,hsa-mir-124,hsa-mir-198,hsa-mir-525-5p,hsa-mir-506,hsa-mir-520a-5p,hsa-mir-196a*hsa-mir-3117-3p,hsa-mir-342-5p(mirt038210),hsa-mir-378a-5p(mirt043981),hsa-mir-615-3p(mirt040086),hsa-let-7b-5p(mirt052211),hsa-mir-455-3p(mirt037879),hsa-mir-4267,hsa-mir-590-3p,hsa-mir-106b-5p(mirt044355),hsa-mir-320a(mirt044466),hsa-mir-16-5p(mirt032018),hsa-mir-155-5p(mirt021009),hsa-mir-4302,hsa-mir-191-5p(mirt045793),hsa-mir-1303(mirt035890),hsa-mir-193b-3p(mirt016316),hsa-mir-222-3p(mirt046640),hsa-mir-532-3p(mirt037924),hsa-mir-18a-3p(mirt040929),hsa-mir-92a-3p(mirt049001),hsa-mir-582-3p,hsa-mir-4265,hsa-mir-218-2,hsa-mir-1271,hsa-mir-340,hsa-mir-221,hsa-mir-20b,hsa-mir-508-3p,hsa-mir-141,hsa-mir-4325,hsa-mir-889,hsa-mir-29a,hsa-mir-129-3p,hsa-mir-129,hsa-mir-96,hsa-mir-3163,hsa-mir-187,hsa-mir-196a,hsa-mir-222,hsa-mir-1179,hsa-mir-182,hsa-mir-9*hsa-mir-32,hsa-mir-143,hsa-mir-4296(参见例如,helwak等人cell,153(3):654-656,2013;selbach等人nature,455(7209):58-63,2008;baek等人,nature,455(7209):64-71,2008;leivonen等人molcellproteomics,10(7),2011:m110.005322):(ythdc1的抑制剂)hsa-mir-20a-3p(mirt038967),hsa-mir-103a-3p(mirt027037),hsa-mir-1(mirt023492),hsa-mir-19b-3p(mirt031105),hsa-mir-100-5p(mirt048400),hsa-mir-93-5p(mirt027989),hsa-mir-16-5p(mirt031379),hsa-let-7b-5p(mirt052150),hsa-mir-520f,hsa-mir-300,hsa-mir-15a,hsa-mir-200a,hsa-mir-605,hsa-mir-30d,hsa-mir-30a,hsa-mir-3613-3p,hsa-mir-509-3-5p,hsa-mir-34c-5p,hsa-mir-324-3p,hsa-mir-1248,hsa-mir-152,hsa-mir-548t,hsa-mir-4310,hsa-mir-145,hsa-mir-516a-3p,hsa-mir-16,hsa-mir-3668,hsa-mir-4277,hsa-mir-448,hsa-mir-16-2,hsa-mir-148b,hsa-mir-509-5p,hsa-mir-103a,hsa-mir-1265,hsa-mir-2115,hsa-mir-548c-3p,hsa-mir-148a,hsa-mir-548p,hsa-mir-513a-3p,hsa-mir-497,hsa-mir-3647-3p,hsa-mir-382,hsa-mir-30b,hsa-mir-543,hsa-let-7f-2,hsa-mir-1269,hsa-mir-3164,hsa-mir-503,hsa-mir-500a,hsa-mir-449a,hsa-mir-141,hsa-mir-424,hsa-mir-3908,hsa-mir-889,hsa-mir-2116,hsa-mir-330-3p,hsa-mir-15b,hsa-mir-181b,hsa-mir-187,hsa-mir-1237,hsa-mir-449b,hsa-mir-101,hsa-mir-381,hsa-mir-618,hsa-mir-222,hsa-mir-181a,hsa-mir-432,hsa-mir-96,hsa-mir-19b,hsa-mir-195,hsa-mir-548n,hsa-mir-485-5p,hsa-mir-217,hsa-mir-30c,hsa-mir-495,hsa-mir-137,hsa-mir-1288,hsa-mir-181c,hsa-mir-3942-5p,hsa-mir-548v,hsa-mir-487a,hsa-mir-221,hsa-mir-891b,hsa-mir-205,hsa-mir-195,hsa-mir-4271,hsa-mir-3611,hsa-mir-516b,hsa-mir-181d,hsa-mir-154,hsa-mir-646,hsa-mir-153,hsa-mir-34a,hsa-mir-19a,hsa-mir-107,hsa-mir-30e和hsa-mir-4262(参见例如helwak等人cell,153(3):654-655,2013;hafner等人cell,141(1):129-141,2010;kishore等人,natmethods,8(7):559-64,2011;memczak等人nature,495(7441):333-8,2013;selbach等人nature,455(7209):58-63,2008;chi等人nature.460(7254):479-86,2009)。
在这些离体扩增方法中,优选干细胞选自hsc、造血干和祖细胞(hspc)、内皮祖细胞(epc)、间充质干细胞(msc)、心脏干细胞(csc)、神经元干细胞(nsc)及其组合。根据某些方面,干细胞是hsc。根据其他方面,干细胞是msc。离体扩增方法也可以使用包含cart细胞的细胞群。在这些方法中,hsc和/或msc获自选自脐带血、外周血和骨髓的哺乳动物例如灵长类动物或人的组织,尽管任何含有hsc和/或msc的组织均可使用。
在离体扩增造血干细胞(hsc)群的方法的另一方面,干细胞数量的扩增是至少2倍,例如至少2.5倍,至少3倍,至少3.5倍,至少4倍,包括至少5倍,至少8倍,至少10倍,至少15倍或至少20倍或者更多。
在用于离体扩增间充质干细胞(msc)群的方法的另一方面,干细胞数量的扩增是至少2倍,例如至少2.5倍,至少3倍,至少3.5倍,至少4倍,包括至少5倍,至少8倍,至少10倍,至少15倍或至少20倍或更多。
在用于体外扩增cart细胞群的方法的另一个方面,cart细胞数量的扩增是至少2倍,例如至少2.5倍,至少3倍,至少3.5倍,至少4倍,包括至少5倍,至少8倍,至少10倍,至少15倍或至少20倍或更多。
本发明的另一个实施方案是通过本发明的方法例如用于离体扩增基本上未分化的干细胞群的方法或用于离体扩增造血干细胞(hsc)群的方法制备的扩增的基本上未分化的干细胞群。
本发明的另一个实施方案是通过本发明的方法例如用于离体扩增基本上未分化的干细胞群的方法或用于离体扩增间充质干细胞(msc)群的方法制备的扩增的基本上未分化的干细胞群。
本发明的另一个实施方案是通过本发明的方法例如用于离体扩增cart细胞群的方法制备的扩增的cart细胞群。
本发明的另一个实施方案是用于将造血干细胞(hsc)离体扩增至少2倍的方法,其中所述扩增的hsc在移植入有此需要的哺乳动物体内后能够重建hsc谱系。该方法包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入干细胞中,并在合适的培养基中培养hsc群。
本发明的另一个实施方案是用于使间充质干细胞(msc)离体扩增至少2倍的方法,其中所述扩增的msc在移植入有此需要的哺乳动物体内后能够重建msc谱系。该方法包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入干细胞中,并在合适的培养基中培养hsc群。
本发明的另一个实施方案是用于使嵌合抗原受体(car)t细胞离体扩增至少2倍的方法,其中所述扩增的cart细胞在移植到有此需要的哺乳动物受试者中时能够治疗癌症和/或血液疾病。该方法包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入cart细胞中,并在合适的培养基中培养cart细胞群。
在本发明的这个方面,“能够重建hsc谱系”是指扩增的hsc当移植到合适的哺乳动物受试者中时导致在受体中大于1%的移植,该移植的细胞能够分化为具有正常功能的造血系统所必需的细胞谱系。在本发明的这个方面,“能够重建msc谱系”是指扩增的msc当移植到合适的哺乳动物受试者中时导致在受体中大于1%的移植,该移植的细胞能够分化为具有正常功能的造血系统所必需的细胞谱系。在本发明的这个方面,“能够治疗癌症和/或血液疾病”是指扩增的cart细胞当移植到合适的哺乳动物受试者中时能够提供哺乳动物受试者正在遭受的癌症和/或血液疾病(诸如白血病和淋巴瘤中的至少一种)的治疗。在该方法中,本文可互换使用的“合适的培养基”、“流体培养基”和“培养基”是指生理上平衡的盐溶液,其可以将干细胞群和/或cart细胞群维持所需的时间,该溶液可以任选地补充本发明的合适的m6amrna修饰途径调节剂。这样的基础培养基是本领域众所周知的。适用于hsc的基础培养基的非限制性例子是stemspanmedia(stemcelltechnologies;目录号09600),其补充有10ug/ml肝素、5x青霉素/链霉素、10ng/ml重组小鼠(rm)干细胞因子和20ng/mlrm-血小板生成素。
在本发明的一方面,将hsc和/或msc和/或cart细胞离体扩增至少2倍可以通过本文描述的任何方法进行。例如,该方法可以涉及引入缺失、替换表达m6amrna修饰阅读物例如ythdf2的基因或减少其表达的突变。此外,可以通过本文描述的任何方法来引入突变,例如通过使干细胞和/或cart细胞暴露于使表达m6amrna修饰阅读物的基因的至少一部分失活或缺失的mx1-cre靶向系统。也可以通过将shrna掺入干细胞和/或car-t细胞中来引入突变,以减少表达m6amrna修饰阅读物的基因的表达。还可以提供引入靶向本文所述的其他m6amrna修饰阅读物的突变的其他方法。
在该实施方案的一方面,hsc和/或msc和/或cart细胞获自选自脐带血、外周血和骨髓的哺乳动物组织,优选灵长类动物或人组织。在该实施方案中,hsc和/或msc和/或cart细胞的数量增加至少2倍,例如至少2.5倍,至少3倍,至少3.5倍,至少4倍,包括至少5倍,至少8倍,至少10倍,至少15倍,至少20倍或更多。
本发明的另一个实施方案是用于扩增造血干细胞(hsc)群、间充质干细胞(msc)群和/或cart细胞群以用于随后移植入有此需要的受试者中的试剂盒。该试剂盒包括用于将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入hsc、msc和/或cart细胞群的系统,以及其使用说明。优选地,在试剂盒中,用于将突变引入hsc、msc和/或car-t细胞群的系统包括能够将导致表达ythdf2的基因的缺失、替换或表达减少的突变引入hsc、msc和/或car-t细胞群的一种或多种试剂。例如,试剂盒可以包括用于将突变引入hsc、msc和/或car-t细胞群的系统,该系统包括使表达m6amrna修饰阅读物的基因的至少一部分失活或缺失的mx1-cre靶向系统。该试剂盒还可包括用于将突变引入hsc、msc和/或cart细胞群的系统,该系统包含用于递送将shrna掺入hsc、msc和/或cart细胞群以减少表达m6amrna修饰阅读物的基因的表达的慢病毒的试剂。试剂盒可进一步包含本文所述的用于引入突变以调节m6amrna修饰途径(例如通过缺失、替换表达m6amrna修饰阅读物包括ythdf2的基因或减少其表达)的其他系统/方法。试剂盒及其中的组分可以以任何合适的方式包装以用于分配和/或储存。
在另一个实施方案中,提供了用于扩增造血干细胞群(hsc)群和/或间充质干细胞(msc)群和/或car-t细胞群以用于随后移植入有此需要的受试者的试剂盒。该试剂盒包含m6amrna修饰阅读物的抑制剂及其使用说明,其中该抑制剂可以是本文公开的任何抑制剂,例如ythdf2的抑制剂。
在该实施方案的一个方面,所述试剂盒能够使干细胞和/或cart细胞的数量扩增至少2倍,至少2.5倍,至少3倍,至少3.5倍,至少4倍,至少5倍,至少8倍,至少10倍,至少15倍,至少20倍或更多。
本发明的另一个实施方案是向有此需要的受试者施用造血干细胞(hsc)的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有hsc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中hsc的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用hsc。在该实施方案中,引入突变的方法以及针对m6amrna修饰阅读物的突变是如先前文公开的,例如导致表达ythdf2的基因的缺失的突变或导致将减少表达ythdf2的基因的表达的shrna掺入hsc群中的突变。此外,hsc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是向有此需要的受试者施用间充质干细胞(msc)的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有msc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中的msc的数量扩增到足以移植到受试者中的数量;和(c)向所述受试者施用msc。在该实施方案中,引入突变的方法以及针对m6amrna修饰阅读物的突变是如先前文公开的,例如导致表达ythdf2的基因的缺失的突变或导致将减少表达ythdf2的基因的表达的shrna掺入msc群中的突变。此外,msc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是向有此需要的受试者施用嵌合抗原受体(car)t细胞的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有cart细胞群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中cart细胞的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用cart细胞。在该实施方案中,引入突变的方法以及针对m6amrna修饰阅读物的突变是如先前文公开的,例如导致表达ythdf2的基因的缺失的突变或导致将减少表达ythdf2的基因的表达的shrna掺入cart细胞群中的突变。此外,cart细胞可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是向有此需要的受试者施用造血干细胞(hsc)的方法。该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,将含有hsc群的样品培养足够长的时间以使样品中hsc的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用hsc。在该方法中,抑制剂是如先前文公开的,例如,ythdf2的抑制剂。此外,hsc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是向有此需要的受试者施用间充质干细胞(msc)的方法。该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,将含有msc群的样品培养足够长的时间以使样品中的msc数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向所述受试者施用msc。在该方法中,抑制剂是如先文前公开的,例如,ythdf2的抑制剂。此外,msc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是向有此需要的受试者施用嵌合抗原受体(car)t细胞的方法。该方法包括:(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,将含有cart细胞群的样品培养足够长的时间以使样品中cart细胞的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用cart细胞。在该方法中,抑制剂是如先前文公开的,例如,ythdf2的抑制剂。此外,cart细胞可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是在有此需要的受试者中重建骨髓的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有hsc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中hsc的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用hsc。在该实施方案中,引入突变的方法以及针对m6amrna修饰阅读物的突变是如先前文公开的,例如导致表达ythdf2的基因的缺失的突变或导致将减少表达ythdf2的基因的表达的shrna掺入hsc群中的突变。此外,hsc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是在有此需要的受试者中重建骨髓的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有msc群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中的msc的数量扩增到足以移植到受试者中的数量;和(c)向所述受试者施用msc。在该实施方案中,引入突变的方法以及针对m6amrna修饰阅读物的突变是如先前文公开的,例如导致表达ythdf2的基因的缺失的突变或导致将减少表达ythdf2的基因的表达的shrna掺入msc群中的突变。此外,msc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是在有此需要的受试者中治疗癌症和/或血液疾病的方法。该方法包括:(a)将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有cart细胞群的样品中;(b)在合适的培养基中培养样品足够长的时间以使样品中cart细胞的数量扩增到足以移植到受试者中的数量;和(c)向受试者施用cart细胞。在该实施方案中,引入突变的方法以及针对m6amrna修饰阅读物的突变是如先前文公开的,例如导致表达ythdf2的基因的缺失的突变或导致将减少表达ythdf2的基因的表达的shrna掺入cart细胞群中的突变。此外,cart细胞可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
在又一个实施方案中,提供了在有此需要的受试者中重建骨髓的方法。该方法包括(a)在合适的培养基中,在m6amrna修饰阅读物的抑制剂存在下,将含有hsc群的样品培养足够长的时间以使样品中hsc的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用hsc。在该方法中,抑制剂是如先前文公开的,例如ythdf2的抑制剂。此外,hsc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
在另一个实施方案中,提供了另一种在有此需要的受试者中重建骨髓的方法。该方法包括(a)在合适的培养基中,在m6amrna修饰阅读物抑制剂存在下,将含有msc群的样品培养足够长的时间以使样品中msc的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向所述受试者施用msc。在该方法中,抑制剂是如先前文公开的,例如ythdf2的抑制剂。此外,msc可以获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,并且受试者可以是哺乳动物,例如人。
在这些方法中,“重建骨髓”是指患有其中正常骨髓功能已经受损的疾病的受试者中的全部或部分骨髓的恢复。此类疾病的非限制性实例包括血液疾病,例如再生障碍性贫血、骨髓增生异常综合症(mds)、阵发性夜间血红蛋白尿(pnh)和血液癌症,例如白血病。因此,如本文所用,“重建”是指移植的hsc和/或msc能够成功植入宿主中并分化成通常在骨髓中发现或来源于骨髓的所有细胞谱系。本文的方法的各方面可涉及将从选自脐带血、外周血和骨髓的组织中获得的hsc和/或msc移植到受试者,以治疗血液疾病,例如白血病和淋巴瘤。
在又一个实施方案中,提供了用于在有此需要的受试者中治疗癌症和/或血液疾病的另一种方法。该方法包括(a)在合适的培养基中,在m6amrna修饰阅读物抑制剂存在的情况下,将含有嵌合抗原受体(car)t细胞群的样品培养足够长的时间以使样品中cart细胞的数量扩增到足以移植到受试者中的数量;(b)从培养物中除去m6amrna修饰阅读物的抑制剂;和(c)向受试者施用cart细胞。在该方法中,抑制剂是如先前文公开的,例如ythdf2的抑制剂。此外,经修饰以制备cart细胞的t细胞可获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织,以及受试者可以是哺乳动物,例如人。
在这些方法中,“治疗受试者的癌症和/或血液疾病”是指根除患有癌症和/或血液疾病的受试者中的癌细胞、减轻症状或以其他方式减少疾病状态。癌症和/或血液疾病的非限制性实例包括血液疾病,例如再生障碍性贫血、骨髓增生异常综合症(mds)、阵发性夜间血红蛋白尿(pnh)和血液癌症,例如白血病和淋巴瘤。
在这些方法中,“足够长的时间以扩增hsc的数量”是指将培养物中的hsc扩增至足以进行一次或多次移植的hsc数量的最小时间量,并且“足够长的时间以扩增msc的数量”是指将培养物中的msc扩增至足以进行一次或多次移植的msc数量的最小时间量。同样,“足够长的时间以扩增cart细胞的数量”是指将培养物中的cart细胞扩增至足以进行一次或多次移植的cart细胞的数量的最小时间量。通常,这样的时间段可以是培养至少约10天。在某些情况下,可能希望将干细胞和/或cart细胞(例如hsc和/或msc)群扩增超过单次移植所要求的数量。例如,可能希望将干细胞和/或cart细胞(例如hsc和/或msc)群扩增到足以进行多次移植(例如大约2至大约100次移植)的数量。在这些情况下,可以通过任何常规方法,例如通过冷冻保存,将多余的细胞保存起来供以后使用。
如前所述,“足以用于移植的数量”是指在受体中实现大于1%的植入所必需的干细胞例如hsc和/或msc和/或cart细胞的最小数量。“向受试者施用hsc”是指用于向受试者递送hsc的常规方法,包括但不限于通过手术和/或静脉内递送hsc。“向受试者施用msc”是指用于将msc递送至受试者的常规方法,包括但不限于通过手术和/或静脉内递送msc。“向受试者施用cart细胞”是指用于将cart细胞递送至受试者的常规方法,包括但不限于通过手术和/或静脉内递送msc。在这些实施方案中,获得hsc和/或msc和/或t细胞的组织以及m6amrna修饰阅读物的抑制剂是如前文所公开的。
本发明的另一个实施方案是用于扩增造血干细胞(hsc)群的方法。该方法包括在足以导致hsc群扩增至少2倍的条件下培养hsc群,其中扩增的hsc群适合于移植入有此需要的哺乳动物中。在该实施方案中,“足以导致hsc群扩增的条件”是可以导致培养物中的hsc扩增例如至少2倍,例如至少2.5倍,至少3倍,至少3.5倍,至少4倍,至少5倍,至少8倍,至少10倍,至少15倍,至少20倍或更多的那些条件。“适合于移植到哺乳动物中”是指hsc的数量和质量足以支持在有此需要的哺乳动物受体(例如灵长类动物受体,包括人受体)中大于1%的植入。
本发明的另一个实施方案是用于扩增间充质干细胞(msc)的群的方法。该方法包括在足以导致msc群扩增至少2倍的条件下培养msc群,其中扩增的msc群适合于移植入有此需要的哺乳动物中。在该实施方案中,“足以导致msc群扩增的条件”是可以导致培养物中的msc扩增例如至少2倍,例如至少2.5倍,至少3倍,至少3.5倍,至少4倍,至少5倍,至少8倍,至少10倍,至少15倍,至少20倍或更多的那些条件。“适合于移植到哺乳动物中”是指msc的数量和质量足以支持在有此需要的哺乳动物受体(例如灵长类动物受体,包括人受体)中大于1%的植入。
本发明的另一个实施方案是用于扩增嵌合抗原受体(car)t细胞群的方法。该方法包括在足以导致cart细胞群扩增至少2倍的条件下培养cart细胞群,其中扩增的cart细胞群适合于移植入有此需要的哺乳动物中。在该实施方案中,“足以导致cart细胞群扩增的条件”是可以导致培养物中的cart细胞扩增例如至少2倍,例如至少2.5倍,至少3倍,至少3.5倍,至少4倍,至少5倍,至少8倍,至少10倍,至少15倍,至少20倍或更多的那些条件。“适合于移植到哺乳动物中”是指cart细胞的数量和质量足以支持在有此需要的哺乳动物受体(例如灵长类动物受体,包括人受体)中大于1%的植入。
本发明的另一个实施方案是用于治疗需要骨髓移植、外周血移植或脐带血移植的受试者的方法,该方法包括向受试者施用通过本文公开的方法(尤其是用于扩增造血干细胞(hsc)群的方法)获得的hsc群。受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是用于治疗需要骨髓移植、外周血移植或脐带血移植的受试者的方法,该方法包括向受试者施用通过本文公开的方法(尤其是用于扩增间充质干细胞(msc)群的方法)获得的msc群。受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是用于治疗患有癌症和/或血液疾病的受试者的方法,该方法包括向受试者施用通过本文公开的方法(尤其是用于扩增cart细胞群的方法)获得的cart细胞群。受试者可以是哺乳动物,例如人。
本发明的另一个实施方案是用于扩增造血干细胞(hsc)群的方法。该方法包括:(a)从哺乳动物获得包含hsc群的组织样品;(b)体外扩增来自样品的hsc群,其中(i)hsc群扩增至少2倍;和(ii)扩增的hsc群的总集落形成单位增加至少5倍。在该实施方案的一方面,hsc群扩增至少4倍,例如至少5倍,包括至少8倍,至少10倍,至少15倍,至少20倍或更多。在该实施方案的另一方面,哺乳动物是灵长类动物,包括人。优选地,所述人需要外周血移植、脐带血移植或骨髓移植。在另一方面,组织样品获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织。
本发明的另一个实施方案是用于扩增间充质干细胞(msc)群的方法。该方法包括(a)从哺乳动物获得包含msc群的组织样品;(b)体外扩增来自样品的msc群,其中(i)msc群扩增至少2倍。在该实施方案的一方面,msc群扩增至少2.5倍,例如至少3倍,至少3.5倍,至少4倍,例如至少5倍,包括至少8倍,至少10倍,至少15倍,至少20倍或更多。在该实施方案的另一方面,哺乳动物是灵长类动物,包括人。优选地,所述人需要外周血移植、脐带血移植或骨髓移植。在另一方面,组织样品获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织。
本发明的另一个实施方案是用于扩增嵌合抗原受体(car)t细胞群的方法。该方法包括(a)从哺乳动物获得包含t细胞群的组织样品;(b)用嵌合抗原受体修饰t细胞群以提供cart细胞群;(c)体外扩增来自样品的cart细胞群,其中(i)cart细胞群扩增至少2倍。在该实施方案的一方面,cart细胞群扩增至少2.5倍,例如至少3倍,至少3.5倍,至少4倍,例如至少5倍,包括至少8倍,至少10倍,至少15倍,至少20倍或更多。在该实施方案的另一方面,哺乳动物是灵长类动物,包括人。优选地,所述人患有癌症和/或血液疾病。在另一方面,所述组织样品获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织。
本发明的另一个实施方案是在有此需要的受体中重建造血干细胞谱系的方法。该方法包括:(a)从哺乳动物获得包含hsc群的组织样品;(b)体外扩增来自样品的hsc群,其中:(i)hsc群扩增至少2倍,例如至少4倍,包括至少8倍,至少10倍,至少15倍,至少20倍或更多,以及(ii)扩增的hsc群的总集落形成单位增加至少5倍;和(c)将扩增的hsc群移植到有此需要的受试者中,例如哺乳动物,包括灵长类动物或人。在该实施方案中,人受体需要外周血移植、脐带血移植或骨髓移植。因此,在另一方面,所述组织样品获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织。样品可以从自体或异体来源获得。优选地,样品是从自体来源获得的。
本发明的另一个实施方案是在有此需要的受体中重建间充质干细胞(msc)谱系的方法。该方法包括(a)从哺乳动物获得包含msc群的组织样品;(b)体外扩增来自样品的msc群,其中:(i)msc群扩增至少2倍,例如至少4倍,包括至少8倍,至少10倍,至少15倍,至少20倍或更多;和(c)将扩增的msc群移植到有此需要的受试者中,例如哺乳动物,包括灵长类动物或人。在该实施方案中,人受体需要外周血移植、脐带血移植或骨髓移植。因此,在另一方面,所述组织样品获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织。样品可以从自体或异体来源获得。优选地,样品是从自体来源获得的。
本发明的另一个实施方案是用于治疗患有癌症和/或血液疾病的受试者的方法。该方法包括(a)从哺乳动物获得包含t细胞群的组织样品;(b)用嵌合抗原受体(car)修饰t细胞群以形成cart细胞群;(c)体外扩增来自样品的cart细胞群,其中:(i)cart细胞群扩增至少2倍,例如至少4倍,包括至少8倍,至少10倍,至少15倍,至少20倍或更多;和(c)将扩增的car-t细胞群移植到有此需要的受试者中,例如哺乳动物,包括灵长类动物或人。在该实施方案中,人受体可以患有例如白血病和/或淋巴瘤。因此,在另一方面,组织样品获自任何合适的组织,例如选自脐带血、外周血和骨髓的组织。样品可以从自体或异体来源获得。优选地,样品是从自体来源获得的。
在本发明的方面,优选地,扩增的hsc群包含具有选自cd34-或cd34+/cd38-/low/thy-1+/cd90+/kit-/lo/lin-/cd133+vegfr2+(其是最原始和长期未分化的人hsc的标记);cd150+/cd48-/cd244-(其是人hsc及其祖细胞的标记);和/或cd150-/cd48-/cd244+和cd150-/cd48+/cd244+(其是非自我更新的多能造血祖细胞的标记)及其组合的表型的hsc。(参见例如,mimeault,m.,等人,stemcells:arevolutionintherapeutics-recentadvancesinstemcellbiologyandtheirtherapeuticapplicationsinregenerativemedicineandcancertherapies.clinpharmacolther.,82(3):252-64(2007))。在本发明的各方面,优选地,扩增的msc群和/或经历扩增的msc群包括具有选自n-钙黏着蛋白+和cd105+及其组合的表型的msc。即,本文描述的任何实施方案的msc群可包含选自n-钙黏着蛋白+msc和cd105+msc的至少一种msc。在一个实施方案中,msc群包含n-钙黏着蛋白+msc。
在群体中具有这些标记的hsc和/或msc的确切比例并不重要,只要扩增的hsc和/或msc群在整体上足以导致受体中至少1%的植入。
在另一个实施方案中,本发明是用于扩增需要这种扩增的哺乳动物中的造血干细胞群的方法。该方法包括向哺乳动物施用治疗有效量的n6-甲基腺苷(m6a)mrna修饰途径的调节剂足够长的时间以使hsc群扩增至少2倍,使得hsc具有在哺乳动物中重建造血谱系的能力。
在另一个实施方案中,本发明是用于扩增需要这种扩增的哺乳动物中的间充质干细胞群的方法。该方法包括向哺乳动物施用治疗有效量的n6-甲基腺苷(m6a)mrna修饰途径的调节剂足够长的时间以使msc群扩增至少2倍,使得msc具有在哺乳动物中重建间充质谱系的能力。
在另一个实施方案中,本发明是扩增需要这种扩增的哺乳动物中的嵌合抗原受体(car)t细胞群的方法。该方法包括向哺乳动物施用治疗有效量的n6-甲基腺苷(m6a)mrna修饰途径的调节剂足够长的时间以使cart细胞群扩增至少2倍,使得cart细胞具有治疗哺乳动物的癌症和/或血液疾病的能力。
在这些方法中,调节剂可以是如本文先前公开的,和/或可以通过本文公开的任何方法来执行调节。例如,调节剂可以包括用于将突变引入hsc和/或msc和/或cart细胞群的系统,该突变缺失、替换表达n6-甲基腺苷(m6a)mrna修饰阅读物例如ythdf2的基因或减少其表达。作为又一个例子,调节剂可以包含n6-甲基腺苷(m6a)mrna修饰阅读物的抑制剂,例如ythdf2的抑制剂。需要扩增的哺乳动物可以是人。
在另一个实施方案中,本发明包括从生物样品中分离间充质干细胞(msc)的方法,该方法包括使具有msc群的生物样品与一种或多种n-钙黏着蛋白抗体接触。例如,根据某些方面,生物样品包括选自外周血、脐带血和骨髓的组织。此外,在某些实施方案中,分离msc的方法可以进一步包括通过调节msc群中的n6-甲基腺苷(m6a)mrna修饰途径(例如通过本文所述的任何方法)来从生物样品中扩增msc群以扩增间充质干细胞的数量的一个或多个步骤。在一个实施方案中,从生物样品中分离后,扩增msc群。在另一个实施方案中,在从生物样品中分离msc之前,扩增生物样品中的msc群。在一个实施方案中,将msc群扩增至足够数量,同时保持msc群中的多谱系分化潜能,其足以用于随后移植入有此需要的受试者中,使得通过该方法分离的msc可以用于移植。例如,分离的msc可以被移植到人受试者中。根据又一个实施方案,可以通过与cd105抗体(附加于n-钙黏着蛋白抗体或作为n-钙黏着蛋白抗体的替代)接触来进一步从生物样品中分离msc。在又一个实施方案中,通过使生物样品与n-钙黏着蛋白抗体接触并检测与n-钙黏着蛋白抗体结合的那些细胞,n-钙黏着蛋白抗体可用于鉴定生物样品中的msc。
在一个实施方案中,分离msc的方法包括通过将导致m6amrna修饰途径中分子的调节的突变引入干细胞中或使干细胞与选自小分子、生物制剂、反义rna、小干扰rna(sirna)及其组合的m6amrna修饰途径中分子的调节剂接触调节m6amrna修饰途径(例如通过本文描述的任何调节方法)来扩增msc群。例如,在一个实施方案中,调节m6amrna修饰途径包括将突变引入干细胞中,以缺失、替换表达m6amrna修饰途径中的分子的基因或减少其表达。在一个实施方案中,该突变缺失、替换表达选自以下的分子的基因或减少其表达:m6amrna修饰阅读物、m6amrna修饰书写物和m6amrna擦除物。在又一个实施方案中,该突变缺失、替换表达m6amrna修饰阅读物的基因或减少其表达。在一个实施方案中,该突变缺失、替换表达选自以下的m6amrna修饰阅读物的基因或减少其表达:ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1和elf3。在另一个实施方案中,该突变缺失、替换表达ythdf2的基因或减少其表达。在一个实施方案中,该突变缺失、替换表达m6amrna修饰擦除物的基因或减少其表达。在一个实施方案中,该突变缺失、替换表达选自fto和alkbh5的m6amrna修饰擦除物的基因或减少其表达。在另一个实施方案中,该突变缺失、替换表达m6amrna修饰书写物的基因或减少其表达。在一个实施方案中,该突变缺失、替换表达选自metttl3,mettl14、wtap和kiaa1429的m6amrna修饰书写物的基因或减少其表达。
在另一个实施方案中,分离msc的方法包括通过使干细胞暴露于使表达m6amrna修饰途径中的分子的基因的至少一部分失活或缺失的mx1-cre靶向系统调节m6amrna修饰途径来扩增msc群。在一个实施方案中,调节m6amrna修饰途径包括引入将shrna掺入干细胞以减少表达m6amrna修饰途径中的分子的基因的表达的突变。例如,在一个实施方案中,通过将干细胞暴露于慢病毒以递送shrna来引入shrna。根据又一个实施方案,调节m6amrna修饰途径包括下调m6amrna修饰阅读物。在一个实施方案中,m6amrna修饰阅读物选自ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、hnrnpa2b1和elf3。例如,在一个实施方案中,m6amrna修饰阅读物包含ythdf2。
在一个实施方案中,分离msc的方法还包括通过使干细胞与m6amrna修饰阅读物的抑制剂接触下调m6amrna修饰阅读物来扩增msc群,所述抑制剂是本文所述的任何一种,例如选自以下的任何物质:(hnrnpc的抑制剂)hsa-let-7e-5p(mirt051596),hsa-mir-455-3p(mirt037890),hsa-mir-30c-5p(mirt047904),hsa-mir-186-5p(mirt045150),hsa-mir-744-5p(mirt037494),hsa-mir-18a-3p(mirt040851),hsa-mir-484(mirt042196),hsa-mir-505-5p(mirt037959),hsa-mir-615-3p(mirt039991),hsa-mir-342-3p(mirt043694),hsa-mir-3607-3p,hsa-mir-30d,hsa-mir-3916,hsa-mir-3162-5p,hsa-mir-1273d,hsa-mir-3161,hsa-mir-30a,hsa-mir-629,hsa-mir-208b,hsa-mir-489,hsa-mir-3148,hsa-mir-2113,hsa-mir-877,hsa-mir-455-5p,hsa-mir-186,hsa-mir-548o,hsa-mir-3139,hsa-mir-320a,hsa-mir-4311,hsa-mir-555,hsa-mir-3605-5p,hsa-mir-515-5p,hsa-mir-144,hsa-mir-499-5p,hsa-mir-1323,hsa-mir-548x,hsa-mir-299-5p,hsa-mir-653,hsa-mir-576-5p,hsa-mir-548p,hsa-mir-586,hsa-mir-888,hsa-mir-3647-3p,hsa-mir-484,hsa-mir-320b,hsa-mir-620,hsa-mir-30b,hsa-mir-548q,hsa-mir-29b-1,hsa-mir-570,hsa-mir-183,hsa-mir-1276,hsa-mir-208a,hsa-mir-186,hsa-mir-28-5p,hsa-mir-330-3p,hsa-mir-548am,hsa-mir-320d,hsa-mir-3175,hsa-mir-3155,hsa-mir-548aa,hsa-mir-519e,hsa-mir-1270,hsa-mir-513b,hsa-mir-599,hsa-mir-518f,hsa-mir-4301,hsa-mir-30c,hsa-mir-3135,hsa-mir-4286,hsa-mir-202,hsa-mir-4263,hsa-mir-4299,hsa-mir-606,hsa-mir-3133,hsa-mir-583,hsa-mir-3125,hsa-mir-501-5p,hsa-mir-7-1,hsa-mir-514b-3p,hsa-mir-3155b,hsa-mir-548d-3p,hsa-mir-224,hsa-mir-7-2,hsa-mir-708,hsa-mir-3199,hsa-mir-514,hsa-mir-30e;(hnrnpa2b1的抑制剂)hsa-mir-92a-3p(mirt049721),hsa-mir-30c-5p(mirt048009),hsa-mir-191-5p(mirt045809),hsa-let-7f-5p(mirt051404),hsa-mir-27b-3p(mirt046213),hsa-mir-877-3p(mirt037116),hsa-mir-615-3p(mirt040278),hsa-mir-1260b(mirt052680),hsa-mir-103a-3p(mirt027027),hsa-mir-16-5p(mirt031508),hsa-mir-1296-5p(mirt036075),hsa-mir-197-3p(mirt048098),hsa-mir-548j,hsa-mir-3678-3p,hsa-mir-607,hsa-mir-188-5p,hsa-mir-15a,hsa-mir-3653,hsa-mir-371-5p,hsa-mir-550a,hsa-mir-3622b-3p,hsa-mir-548a-5p,hsa-mir-3170,hsa-mir-3148,hsa-mir-556-3p,hsa-mir-490-3p,hsa-mir-559,hsa-mir-200c,hsa-mir-130a,hsa-mir-548y,hsa-mir-548o,hsa-mir-23c,hsa-mir-491-3p,hsa-mir-335,hsa-mir-3667-3p,hsa-mir-466,hsa-mir-23b,hsa-mir-4310,hsa-mir-127-5p,hsa-mir-548b-5p,hsa-mir-616,hsa-mir-16,hsa-mir-338-3p,hsa-mir-3200-5p,hsa-mir-362-3p,hsa-mir-448,hsa-mir-1306,hsa-mir-944,hsa-mir-3684,hsa-mir-373,hsa-mir-103a,hsa-mir-380,hsa-mir-499-5p,hsa-mir-1323,hsa-mir-323-5p,hsa-mir-3674,hsa-mir-1252,hsa-mir-33b,hsa-mir-580,hsa-mir-548c-3p,hsa-mir-103a-2,hsa-mir-548w,hsa-mir-600,hsa-mir-634,hsa-mir-586,hsa-mir-497,hsa-mir-720,hsa-mir-654-3p,hsa-mir-524-5p,hsa-mir-543,hsa-mir-548q,hsa-let-7f-2,hsa-mir-330-5p,hsa-mir-500a,hsa-mir-548l,hsa-mir-570,hsa-mir-374a,hsa-mir-1184,hsa-mir-649,hsa-mir-424,hsa-mir-3658,hsa-mir-186,hsa-mir-326,hsa-mir-548d-5p,hsa-mir-23a,hsa-mir-15b,hsa-mir-190,hsa-mir-203,hsa-mir-548h,hsa-mir-3136-5p,hsa-mir-618,hsa-mir-551b,hsa-mir-211,hsa-mir-1305,hsa-mir-513b,hsa-mir-96,hsa-mir-2117,hsa-mir-548n,hsa-mir-3910,hsa-mir-217,hsa-mir-892b,hsa-mir-502-5p,hsa-mir-548i,hsa-mir-520d-5p,hsa-mir-4299,hsa-mir-1285,hsa-mir-3133,hsa-mir-483-3p;(ythdf1的抑制剂)hsa-mir-548g,hsa-mir-204,hsa-mir-3143,hsa-mir-521,hsa-mir-195,hsa-mir-3182,hsa-mir-3941,hsa-mir-34c-3p,hsa-mir-767-3p,hsa-mir-563,hsa-mir-548c-5p,hsa-mir-1911,hsa-mir-26b,hsa-mir-190b,hsa-mir-33a,hsa-mir-329,hsa-mir-221,hsa-mir-612,hsa-mir-3185,hsa-mir-3156-5p,hsa-mir-107,hsa-mir-664,hsa-mir-3657;(ythdf2的抑制剂)hsa-mir-615-3p(mirt040054),hsa-mir-106b-5p(mirt044257),hsa-mir-1(mirt023842),mir-145,hsa-mir-3607-3p,hsa-mir-200a,hsa-mir-301a,hsa-mir-519a,hsa-mir-141,hsa-mir-130b,hsa-mir-181b,hsa-mir-301b,hsa-mir-3117-3p,hsa-mir-1236,hsa-mir-181a,hsa-mir-519c-3p,hsa-mir-551b,hsa-mir-519e,hsa-mir-519b-3p,hsa-mir-19b,hsa-mir-1303,hsa-mir-608,hsa-mir-145,hsa-mir-130a,hsa-mir-181c,hsa-mir-323b-3p,hsa-mir-421,hsa-mir-515-5p,hsa-mir-3666,hsa-mir-181d,hsa-mir-146a,hsa-mir-4295,hsa-mir-454,hsa-mir-3919,hsa-mir-19a,hsa-mir-543,hsa-mir-4262;(ythdf3的抑制剂)hsa-mir-582-3p,hsa-mir-579,hsa-mir-520e,hsa-mir-520f,hsa-mir-3152-3p,hsa-mir-106a,hsa-mir-30d,hsa-mir-30a,hsa-mir-93,hsa-mir-508-5p,hsa-mir-29a,hsa-mir-3148,hsa-mir-490-5p,hsa-mir-520b,hsa-mir-20a,hsa-mir-409-3p,hsa-mir-4255,hsa-let-7i,hsa-mir-373,hsa-let-7e,hsa-mir-520c-3p,hsa-mir-3920,hsa-mir-127-5p,hsa-mir-380,hsa-mir-616,hsa-mir-4277,hsa-mir-448,hsa-mir-16-2,hsa-let-7c,hsa-mir-340,hsa-mir-373,hsa-mir-520a-3p,hsa-mir-144,hsa-mir-1265,hsa-mir-548x,hsa-mir-362-5p,hsa-mir-33b,hsa-mir-26b,hsa-mir-17,hsa-mir-569,hsa-mir-3618,hsa-mir-576-5p,hsa-mir-922,hsa-mir-302a,hsa-mir-106b,hsa-mir-888,hsa-mir-484,hsa-let-7b,hsa-mir-582-5p,hsa-let-7f,hsa-mir-30b,hsa-mir-524-5p,hsa-mir-302d,hsa-let-7d,hsa-mir-513a-5p,hsa-mir-500a,hsa-mir-570,hsa-mir-548l,hsa-mir-105,hsa-mir-374c,hsa-let-7ghsa-mir-372,hsa-mir-3658,hsa-let-7a,hsa-mir-3908,hsa-mir-302b,hsa-mir-526b,hsa-mir-190,hsa-mir-181b,hsa-mir-433,hsa-mir-98,hsa-mir-3606,hsa-mir-595,hsa-mir-548am,hsa-mir-187,hsa-mir-561,hsa-mir-181a,hsa-mir-3155,hsa-mir-655,hsa-mir-302c,hsa-mir-195,hsa-mir-26a,hsa-mir-590-3p,hsa-mir-30c,hsa-mir-502-5p,hsa-mir-495,hsa-mir-137,hsa-mir-181c,hsa-mir-520d-5p,hsa-mir-3942-5p,hsa-mir-202,hsa-mir-302e,hsa-mir-513c,hsa-mir-885-5p,hsa-mir-520a-5p,hsa-mir-583,hsa-mir-1297,hsa-mir-7-1,hsa-mir-520d-3p,hsa-mir-3155b,hsa-mir-3182,hsa-mir-519d,hsa-mir-550a,hsa-mir-7-2,hsa-mir-181d,hsa-mir-190b,hsa-mir-1912,hsa-mir-151-3p,hsa-mir-33a,hsa-mir-525-5p,hsa-mir-20b,hsa-mir-514b-5p,hsa-mir-30e,hsa-mir-4262,hsa-mir-636;(elf3的抑制剂)hsa-mir-92b-3p(mirt040734),hsa-mir-16-5p(mirt031705),hsa-mir-18a-3p(mirt040974),hsa-mir-155-5p(mirt020771),hsa-mir-484(mirt042324),hsa-let-7c-5p(mirt051776),hsa-mir-3910,hsa-mir-148b,hsa-mir-136,hsa-mir-15a,hsa-mir-488,hsa-mir-500a,hsa-mir-1297,hsa-mir-3159,hsa-mir-374c,hsa-mir-424,hsa-mir-7-1,hsa-mir-186,hsa-mir-195,hsa-mir-15b,hsa-mir-26b,hsa-mir-505,hsa-mir-1206,hsa-mir-653,hsa-mir-1283,hsa-mir-7-2,hsa-mir-196a,hsa-mir-497,hsa-mir-33a,hsa-mir-655,hsa-mir-26ahsa-mir-16,hsa-mir-151a-3p(mirt043600),hsa-mir-92a-3p(mirt049064),hsa-mir-615-3p(mirt039779),hsa-mir-877-3p(mirt036964),hsa-mir-222-3p(mirt046746),hsa-mir-423-3p(mirt042468),hsa-mir-324-3p(mirt042887),hsa-mir-124-3p(mirt022932),hsa-mir-3140-3p,hsa-mir-124,hsa-mir-198,hsa-mir-525-5p,hsa-mir-506,hsa-mir-520a-5p,hsa-mir-196a*hsa-mir-3117-3p,hsa-mir-342-5p(mirt038210),hsa-mir-378a-5p(mirt043981),hsa-mir-615-3p(mirt040086),hsa-let-7b-5p(mirt052211),hsa-mir-455-3p(mirt037879),hsa-mir-4267,hsa-mir-590-3p,hsa-mir-106b-5p(mirt044355),hsa-mir-320a(mirt044466),hsa-mir-16-5p(mirt032018),hsa-mir-155-5p(mirt021009),hsa-mir-4302,hsa-mir-191-5p(mirt045793),hsa-mir-1303(mirt035890),hsa-mir-193b-3p(mirt016316),hsa-mir-222-3p(mirt046640),hsa-mir-532-3p(mirt037924),hsa-mir-18a-3p(mirt040929),hsa-mir-92a-3p(mirt049001),hsa-mir-582-3p,hsa-mir-4265,hsa-mir-218-2,hsa-mir-1271,hsa-mir-340,hsa-mir-221,hsa-mir-20b,hsa-mir-508-3p,hsa-mir-141,hsa-mir-4325,hsa-mir-889,hsa-mir-29a,hsa-mir-129-3p,hsa-mir-129,hsa-mir-96,hsa-mir-3163,hsa-mir-187,hsa-mir-196a,hsa-mir-222,hsa-mir-1179,hsa-mir-182,hsa-mir-9*hsa-mir-32,hsa-mir-143,hsa-mir-4296:(ythdc1的抑制剂)hsa-mir-20a-3p(mirt038967),hsa-mir-103a-3p(mirt027037),hsa-mir-1(mirt023492),hsa-mir-19b-3p(mirt031105),hsa-mir-100-5p(mirt048400),hsa-mir-93-5p(mirt027989),hsa-mir-16-5p(mirt031379),hsa-let-7b-5p(mirt052150),hsa-mir-520f,hsa-mir-300,hsa-mir-15a,hsa-mir-200a,hsa-mir-605,hsa-mir-30d,hsa-mir-30a,hsa-mir-3613-3p,hsa-mir-509-3-5p,hsa-mir-34c-5p,hsa-mir-324-3p,hsa-mir-1248,hsa-mir-152,hsa-mir-548t,hsa-mir-4310,hsa-mir-145,hsa-mir-516a-3p,hsa-mir-16,hsa-mir-3668,hsa-mir-4277,hsa-mir-448,hsa-mir-16-2,hsa-mir-148b,hsa-mir-509-5p,hsa-mir-103a,hsa-mir-1265,hsa-mir-2115,hsa-mir-548c-3p,hsa-mir-148a,hsa-mir-548p,hsa-mir-513a-3p,hsa-mir-497,hsa-mir-3647-3p,hsa-mir-382,hsa-mir-30b,hsa-mir-543,hsa-let-7f-2,hsa-mir-1269,hsa-mir-3164,hsa-mir-503,hsa-mir-500a,hsa-mir-449a,hsa-mir-141,hsa-mir-424,hsa-mir-3908,hsa-mir-889,hsa-mir-2116,hsa-mir-330-3p,hsa-mir-15b,hsa-mir-181b,hsa-mir-187,hsa-mir-1237,hsa-mir-449b,hsa-mir-101,hsa-mir-381,hsa-mir-618,hsa-mir-222,hsa-mir-181a,hsa-mir-432,hsa-mir-96,hsa-mir-19b,hsa-mir-195,hsa-mir-548n,hsa-mir-485-5p,hsa-mir-217,hsa-mir-30c,hsa-mir-495,hsa-mir-137,hsa-mir-1288,hsa-mir-181c,hsa-mir-3942-5p,hsa-mir-548v,hsa-mir-487a,hsa-mir-221,hsa-mir-891b,hsa-mir-205,hsa-mir-195,hsa-mir-4271,hsa-mir-3611,hsa-mir-516b,hsa-mir-181d,hsa-mir-154,hsa-mir-646,hsa-mir-153,hsa-mir-34a,hsa-mir-19a,hsa-mir-107,hsa-mir-30e和hsa-mir-4262。
根据一个实施方案,本发明包括通过本文所述的任何方法制备的分离的间充质干细胞群。例如,在某些实施方案中,本发明可包括通过本文所述的任何扩增和/或分离方法制备的扩增的分离的间充质干细胞群。
在一个实施方案中,提供了用于分离间充质干细胞(msc)群以用于随后移植入有此需要的受试者的试剂盒。该试剂盒包括用于使包含msc的生物样品与一种或多种n-钙黏着蛋白抗体接触的系统及其使用说明。在一个实施方案中,该试剂盒进一步包括用于通过将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入msc群中来扩增msc群的系统,以及其使用说明。在另一个实施方案中,用于将突变引入msc群的系统包括能够将导致表达ythdf2的基因的缺失、替换或表达减少的突变引入msc群的一种或多种试剂。在又一个实施方案中,用于将突变引入msc群的系统包括mx1-cre靶向系统,该系统使表达m6amrna修饰阅读物的基因的至少一部分失活或缺失。在一个实施方案中,用于将突变引入msc群的系统包括用于递送将shrna掺入msc群以减少表达m6amrna修饰阅读物的基因的表达的慢病毒的试剂。
根据本发明的另一个实施方案,提供了用于向有此需要的受试者施用间充质干细胞(msc)的方法。该方法包括通过使生物样品与一种或多种n-钙黏着蛋白抗体接触来从包含msc群的生物样品中分离msc,和将分离的msc施用至受试者。此外,在一个实施方案中,该方法还包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入含有msc群的生物样品中,并在合适的条件下培养该生物样品足够长的时间以将样品中msc的数量扩增到足以移植到受试者中的数量。在一个实施方案中,其中突变导致缺失表达ythdf2的基因。在一个实施方案中,突变导致减少表达ythdf2的基因的表达的shrna掺入hsc群中。根据另一方面,msc获自生物样品,所述生物样品包含选自脐带血、外周血和骨髓的组织。
根据另一个实施方案,提供了在有此需要的受试者中重建骨髓的方法。该方法包括通过使生物样品与一种或多种n-钙黏着蛋白抗体接触来从包含间充质干细胞(msc)群的生物样品中分离msc,和将分离的msc施用至受试者。此外,根据一个方面,该方法进一步包括将导致表达m6amrna修饰阅读物的基因的缺失、替换或表达减少的突变引入包含msc群的生物样品中,并在合适的条件下培养该生物样品足够长的时间以将样品中msc的数量扩增到足以移植到受试者中的数量。在一个实施方案中,msc获自生物样品,该生物样品包含选自脐带血、外周血和骨髓的组织。
根据另一个实施方案,一种用于治疗需要选自骨髓移植、外周血移植和脐带血移植的移植的受试者的方法,其包括向所述受试者施用通过本文描述的任何方法获得的分离的msc群。根据实施方案,样品来自自体或异体来源。根据又一个实施方案,样品来自自体来源。
在本发明中,“治疗有效量”是足以产生有益或期望结果的量。就哺乳动物的治疗而言,调节剂和/或扩增的细胞的“治疗有效量”是足以治疗、控制、减轻、改善或稳定哺乳动物的病症诸如骨髓疾病的量。治疗有效量可以以一个或多个剂量施用。
治疗有效量通常由医生根据具体情况确定,并且在本领域技术人员的能力范围内。确定合适的剂量时,通常会考虑几个因素。这些因素包括受试者的年龄、性别和体重、所治疗的疾病、疾病的严重程度以及所施用的药物的形式。
有效的剂型、施用方式和剂量可以凭经验确定,并且进行这种确定在本领域技术范围内。本领域技术人员应理解,剂量将随施用途径、排泄速率、治疗持续时间、所施用的任何其他药物的性质、动物的年龄、大小和物种以及医学和兽医学领域众所周知的因素而变化。通常,根据本发明的调节剂的合适剂量将是调节剂的量,其是有效产生所需效果的最低剂量。调节剂的有效剂量可以作为两个、三个、四个、五个、六个或更多个亚剂量施用,在全天中以适当的间隔分开施用。
调节剂可以以任何期望和有效的方式施用:作为用于口服摄入的药物组合物,或者以任何适当的方式用于肠胃外或其他施用,例如腹膜内、皮下、局部、皮内、吸入、肺内、直肠、阴道、舌下、肌内、静脉内、动脉内、鞘内或淋巴管内。此外,本发明的调节剂可以与其他治疗联合施用。如果需要的话,本发明的调节剂可以被包封或以其他方式保护以免受胃或其他分泌物的侵害。
虽然本发明的调节剂可单独施用,但是优选以药物制剂(组合物)的形式施用。这样的药物制剂通常包含与一种或多种药学上可接受的载体以及任选一种或多种其他化合物、药物、成分和/或材料混合的一种或多种调节剂作为活性成分。无论选择何种施用途径,都可以通过本领域技术人员已知的常规方法将本发明的调节剂配制成药学上可接受的剂型。参见例如,remington'spharmaceuticalsciences(mackpublishingco.,easton,pa.)。
药学上可接受的载体是本领域众所周知的(参见例如,remington'spharmaceuticalsciences(mackpublishingco.,easton,pa.)和thenationalformulary(americanpharmaceuticalassociation,washington,d.c.)),并且包括糖类(例如乳糖、蔗糖、甘露醇和山梨糖醇)、淀粉、纤维素制剂、磷酸钙(例如磷酸二钙、磷酸三钙和磷酸氢钙)、柠檬酸钠、水、水溶液(例如盐水、氯化钠注射液、林格氏注射液、右旋糖注射液、右旋糖和氯化钠注射液、乳酸林格氏注射液)、醇类(例如乙醇、丙醇和苄醇)、多元醇(例如甘油、丙二醇和聚乙二醇)、有机酯(例如乙基油酸酯和甘油三酸酯)、可生物降解的聚合物(例如聚丙交酯-聚乙交酯、聚(原酸酯)和聚(酸酐))、弹性体基质、脂质体、微球、油(例如玉米油、胚芽油、橄榄油、蓖麻油、芝麻油、棉籽油和花生油)、可可脂、蜡(例如栓剂蜡)、石蜡、硅酮、滑石粉、水杨酸盐等。在包含本发明调节剂的药物组合物中使用的每种药学上可接受的载体必须在与制剂的其他成分相容并且对受试者无害的意义上是“可接受的”。适用于所选剂型和预期施用途径的载体是本领域众所周知的,并且所选剂型和施用方法的可接受的载体可以使用本领域普通技术人员确定。
包含本发明的调节剂的药物组合物可以任选含有通常用于药物组合物中的其他成分和/或材料。这些成分和材料在本领域中是众所周知的,并且包括(1)填充剂或增量剂,例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(2)粘合剂,例如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、羟丙基甲基纤维素、蔗糖和阿拉伯胶;(3)保湿剂,例如甘油;(4)崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐、淀粉羟乙酸钠、交联的羧甲基纤维素钠和碳酸钠;(5)缓溶剂,例如石蜡;(6)吸收促进剂,例如季铵化合物;(7)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(8)吸收剂,例如高岭土和膨润土;(9)润滑剂,例如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇和月桂基硫酸钠;(10)悬浮剂,例如乙氧基化异硬脂醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶;(11)缓冲剂;(12)赋形剂,例如乳糖、奶糖、聚乙二醇、动植物脂肪、油、蜡、石蜡、可可脂、淀粉、黄蓍胶、纤维素衍生物、聚乙二醇、硅酮、膨润土、硅酸、滑石、水杨酸盐、氧化锌、氢氧化铝、硅酸钙和聚酰胺粉;(13)惰性稀释剂,例如水或其他溶剂;(14)防腐剂;(15)表面活性剂;(16)分散剂;(17)控释或吸收延迟剂,例如羟丙基甲基纤维素、其他聚合物基质、可生物降解的聚合物、脂质体、微球、单硬脂酸铝、明胶和蜡;(18)乳浊剂;(19)佐剂;(20)润湿剂;(21)乳化和悬浮剂;(22),增溶剂和乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苄醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油(尤其是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢呋喃醇、聚乙二醇和脱水山梨糖醇的脂肪酸酯;(23)推进剂,例如氯氟烃和挥发性未取代的烃,例如丁烷和丙烷;(24)抗氧化剂;(25)使制剂与预期受体的血液等渗的试剂,例如糖和氯化钠;(26)增稠剂;(27)包衣材料,例如卵磷脂;(28)甜味剂、调味剂、着色剂、芳香剂和防腐剂。每种这样的成分或材料在与制剂的其他成分相容并且对受试者无害的意义上必须是“可接受的”。适用于所选剂型和预期施用途径的成分和材料是本领域众所周知的,并且可以使用本领域普通技术人员确定用于所选剂型和施用方法的可接受的成分和材料。
适合口服施用的药物组合物可以是胶囊、扁囊、丸剂、片剂、粉剂、颗粒剂、在水性或非水性液体中的溶液或悬浮液、水包油或油包水液体乳液、酏剂或糖浆、锭剂、大丸剂、药糖剂或糊剂的形式。这些制剂可以通过本领域已知的方法,例如通过常规的锅包衣、混合、制粒或冻干方法来制备。
用于口服施用的固体剂型(胶囊、片剂、丸剂、糖衣丸、粉剂、颗粒剂等)可通过将活性成分与一种或多种药学上可接受的载体以及任选一种或多种填充剂、增量剂、粘合剂、湿润剂、崩解剂、溶解阻滞剂、吸收促进剂、润湿剂、吸收剂、润滑剂和/或着色剂混合来制备。可以使用合适的赋形剂将相似类型的固体组合物用作软和硬填充明胶胶囊中的填充剂。片剂可以通过压制或模制任选地与一种或多种辅助成分一起制成。可以使用合适的粘合剂、润滑剂、惰性稀释剂、防腐剂、崩解剂、表面活性剂或分散剂来制备压制的片剂。模制的片剂可以通过在合适的机器中模制来制备。片剂和其他固体剂型(例如糖衣丸、胶囊、丸剂和颗粒剂)可以任选地用包衣和衣壳(例如肠溶包衣和药物配制领域众所周知的其他包衣)进行刻痕或制备。它们也可以被配制为提供其中的活性成分的缓慢或受控释放。它们可以通过例如通过截留细菌的过滤器过滤来灭菌。这些组合物还可以任选地包含乳浊剂,并且可以是这样的组合物,使得它们仅或优选地在胃肠道的特定部分中任选地以延迟的方式释放活性成分。活性成分也可以是微囊形式。
用于口服施用的液体剂型包括药学上可接受的乳剂、微乳剂、溶液、混悬剂、糖浆和酏剂。液体剂型可包含本领域通常使用的合适的惰性稀释剂。除惰性稀释剂外,口服组合物还可包含佐剂,例如湿润剂、乳化和悬浮剂、甜味剂、调味剂、着色剂、加香剂和防腐剂。悬浮液可含有悬浮剂。
用于直肠或阴道施用的药物组合物可以以栓剂形式存在,其可以通过将一种或多种活性成分与一种或多种在室温下为固体但在体温下为液体因此会在直肠或阴道腔中融化并释放出活性化合物的非刺激性载体混合而制备。适用于阴道施用的药物组合物还包括含有本领域已知合适的这样的药学上可接受的载体的阴道栓、棉球、乳膏、凝胶、糊剂、泡沫或喷雾制剂。
用于局部或透皮施用的剂型包括粉剂、喷雾剂、软膏、糊剂、乳膏、洗剂、凝胶、溶液、贴剂、滴剂和吸入剂。活性化合物可以在无菌条件下与合适的药学上可接受的载体混合。软膏、糊剂、乳膏和凝胶可以包含赋形剂。粉剂和喷雾剂可以包含赋形剂和推进剂。
适用于肠胃外施用的药物组合物包含与一种或多种药学上可接受的无菌等渗水性或非水性溶液、分散液、悬浮液或乳剂或无菌粉剂(它们可以在使用前立即重建为无菌注射液或分散液)组合的一种或多种调节剂,其可以包含合适的抗氧化剂、缓冲剂、溶质(其使制剂与预期受体的血液等渗)或悬浮剂或增稠剂。可以例如通过使用包衣材料、在分散液的情况下通过维持所需的粒径以及通过使用表面活性剂来维持适当的流动性。这些组合物还可包含合适的佐剂,例如润湿剂、乳化剂和分散剂。也可能需要包括等渗剂。另外,可通过包含延迟吸收的试剂来引起可注射药物形式的延长吸收。
在一些情况下,为了延长含有本发明调节剂的药物的作用,希望减慢其从皮下或肌内注射的吸收。这可以通过使用水溶性差的结晶或无定形材料的液体悬浮液来实现。
药物的吸收速率随后取决于其溶解速率,其进而可取决于晶体尺寸和晶体形式。或者,可以通过将药物溶解或悬浮在油媒介物中来实现肠胃外施用的药物的延迟吸收。可通过在可生物降解的聚合物中形成活性成分的微胶囊基质来制备可注射的贮库形式。取决于活性成分与聚合物的比例以及所使用的特定聚合物的性质,可以控制活性成分的释放速率。还可以通过将药物截留在与身体组织相容的脂质体或微乳剂中来制备可注射的贮库制剂。可注射材料可以例如通过细菌截留过滤器过滤来灭菌。
制剂可以存在于单位剂量或多剂量密封的容器例如安瓿和小瓶中,并且可以在冻干条件下储存,仅需要在使用之前立即添加无菌液体载体,例如注射用水。临时注射溶液和悬浮液可以由上述类型的无菌粉末、颗粒和片剂制备。
提供以下实施例以进一步举例说明本发明的方法和组合物。这些实施例仅是举例说明性的,无意以任何方式限制本发明的范围。
实施例
本文的实施例检查ythdf2,其是公认的促进靶向的mrna衰变的m6a阅读物(wang等人blood,505:17-120,2014),至少部分目的是研究其在hsc维持中的作用。在不限于任何特定理论的情况下,据信ythdf2的操纵可能潜在地影响大量m6a标记的mrna的寿命,从而影响成体hsc的自我更新与分化,并促进hsc扩增。如以下实施例所示,ythdf2耗尽特异性扩增小鼠和人hsc,而不会扭转谱系命运。因此,据信ythdf2可能在调节hsc自我更新中起重要作用,并提供了增强hucbhsc离体扩增的新方法,包括在临床应用中。
实施例还显示了对耐药性rhsc群的功能定义,并且发现在稳态期间和在化学治疗应激下,rhsc主要通过n-cad+细胞维持在骨内膜小生境中。还显示了骨内膜区中的n-cad+细胞是间充质干细胞,并有助于rhsc的维持。
实施例a
在下面的“a”实施例中使用了以下方案。
小鼠。ythdf2条件性ko小鼠是由chuanhe和binshen实验组产生的。小鼠被饲养在stowersinstituteformedicalresearch(simr)的动物设施中,并根据研究所和nih的指导进行处理。所有程序均已通过simr的iacuc批准。
流式细胞术和hspc分选。从bm(股骨和胫骨)和脾脏收获小鼠hspc、祖细胞和谱系细胞。使用0.16m氯化铵溶液裂解红细胞,并用70μm过滤器过滤细胞以产生单细胞悬液。为了鉴定小鼠hsc,将细胞用针对sca-1(d7)、c-kit(2b8)、cd34(ram34)、flk2(a2f10)、cd48(hm48-1)、cd150(tc15-12f12.2)的抗体以及使用包括cd3(145-2c11)、cd4(rm4-5)、cd8(53-6.7)、mac-1(m1/70)、gr1(rb6-8c5)、cd45r(b220,ra3-6b2)、igm(il-41)和ter119(ter-119)的谱系混合物染色。对于祖细胞和谱系细胞,如先前所述(qian,p.等人cellstemcell,18:214-228,2016,doi:10.1016/j.stem.2015.11.001)用抗体对细胞进行染色。使用7-氨基放线菌素d(7-aad)(a1310,lifetechnologies)排除死细胞。人脐带血样品是从st.louiscordbloodbank采集的。用lymphopreptm(stemcelltechnologies)分离单核细胞,然后通过人cd34microbeadkitultrapure(miltenyibiotec)分离人cd34+脐带血细胞。为了定量人hspc,细胞用针对cd34(581)、cd38(hit2)、cd45ra(hi100)、cd90(5e10)、cd49f(goh3)、epcr/cd201(rcr-401)的抗体染色。细胞分选和分析在moflo(dako)、influx细胞分选仪(bdbiosciences)和/或macsquant(miltenyibiotec)上进行。使用flowjo软件进行数据分析。
归巢测定。如先前所述进行体内归巢测定(he等人methodsinmolecularbiology,1185:279-284,2014)。基本上,将cd45.2小鼠的全部骨髓(wbm)细胞用5μm5-(和-6)-羧基荧光素二乙酸琥珀酰亚胺酯(cfdase)(molecularprobes)在37℃下标记10分钟,洗涤3次,然后将1×106个wbm移植到经致命照射的ptprc小鼠中。18小时后,冲洗股骨和胫骨,并测定cfdase+细胞。
竞争性重建测定。通过将来自wt或ythdf2ko小鼠(cd45.2)的2×105、7.5×104或2.5×104个供体来源的wbm细胞与2×105个拯救细胞(cd45.1)一起静脉内移植到十只经致死性照射(10gy)的ptprc受体小鼠中来进行竞争性重建测定。对于二次移植,处死初次移植受体。从股骨和胫骨中分离出bm细胞,然后以1×106细胞的剂量小鼠对小鼠移植到经照射的二次受体小鼠中。在照射前三天,将baytril水给予受体小鼠,并在照射后再持续两周。使用elda软件(hu等人journalofimmunologicalmethods,347:70-78,2009)测量初次和二次cru频率,其中成功植入被定义为外周血中存在分别占总造血细胞的≥5%和≥1%的独特的cd45.2+cd45.1-群(purton等人cellstemcell,1:263-270,2007)。此外,将在移植后16周前死亡的二次移植受体小鼠计数为失败的植入。
细胞周期和凋亡测定。根据制造商的说明,使用fitc小鼠抗人ki67试剂盒(bdpharmingen)进行细胞周期分析。简而言之,如上所述,分离5×106个bm细胞并用hsc抗体染色。将细胞用4%多聚甲醛在4℃固定过夜或在室温(rt)固定1小时,然后在冰上用0.2%tritonx-100透化15分钟。将细胞用含2%fbs的pbs洗涤,然后在黑暗中与ki-67抗体在室温下孵育1小时,然后与sytoxred(invitrogen)在室温下再孵育5分钟,然后使用influx细胞分选仪进行流式细胞分析(bdbiosciences)。为了进行细胞凋亡分析,根据制造商的方案对5×106个bm细胞进行膜联蛋白v(invitrogen)和sytoxred染色。
m6arna-ip-seq。将来自c57bl/6j小鼠的105个lt-hsc、st-hsc(lskcd34+flk2-)和mpp(lskcd34+flk2+)的两个重复分选到trizol(invitrogen)中,并根据制造商的说明分离总rna。使用ambion片段化试剂(在70℃下孵育2分钟)将rna片段化为约100个核苷酸的片段。然后将样品进行turbodnase处理(ambion),然后进行苯酚-氯仿萃取,并重悬于85μl无核酸酶的水中,并将5μl保存为输入。然后,将剩余的80μlrna片段稀释到ipp缓冲液(150mmnacl、0.1%np-40、10mmtris-hcl,ph7.5)中。将rna与25μl预先结合3μg抗m6a单克隆抗体(synapticsystems)的g蛋白磁珠在ipp缓冲液中于4℃孵育3小时。珠子用200μlipp缓冲液洗涤两次,用200μl低盐缓冲液(50mmnacl,0.1%np-40,10mmtris-hcl,ph7.5)洗涤两次,再用200μl高盐缓冲液(500mmnacl,0.1%np-40,10mmtris-hcl,ph7.5)洗涤两次。然后在50℃下用300μl洗脱缓冲液(5mmtris-hclph7.5、1mmedtaph8.0、0.05%sds、4.2μl蛋白酶k(20mg/ml))处理珠子1.5小时,并用苯酚:氯仿萃取然后乙醇沉淀来回收rna。如上所述分离三份人cd34+脐带血细胞,并用trizol分离总rna。用ambion片段化试剂(在70℃下孵育2分钟50秒)将rna片段化为约100个核苷酸的片段。然后将样品进行turbodnase处理(ambion),然后进行苯酚:氯仿萃取,并重悬于18μl无核酸酶的水中,并将1μl保存为输入。按照制造商的说明,使用
在rna的m6a制备之后,在agilent2100生物分析仪上评估质量,并根据制造商关于smarterstrandedtotalrna-seqkit–picoinputmammalian(takarabioinc)的指导,使用1ng(小鼠)或10ng(人)rna使用16个循环(小鼠)或13个循环(人)pcr2扩增生成rnaseq文库。该方法使用随机引物和模板转换寡核苷酸产生互补的dna,然后连接条形码衔接子;然后通过探针导向的酶切割和随后未切割片段的富集去除核糖体来源的cdna。
通过使用1.2xspri珠浓度用于pcr1清除来修改方案以保留较低分子量的样品片段。为了除去二聚化的衔接子,用pippinprep(sagescience)2%凝胶对文库进行160-600bp大小的选择。使用生物分析仪和qubit荧光计(lifetechnologies)检查所得文库的质量和数量。然后合并等摩尔的文库并重新定量。对于小鼠m6a-seq,使用hiseq控制软件2.2.58在illuminahiseq2500仪器上将文库测序为50bp单测序片段。测序后,运行lluminaprimaryanalysis版本rta1.18.64和secondaryanalysis版本bcl2fastq2v2.18以多路解编所有文库的测序片段并生成fastq文件。对于人m6a-seq,使用nextseq控制软件2.1.2在illuminanextseq仪器上将文库测序为75bp单长。测序之后,运行illuminaprimaryanalysis版本nextseqrta2.4.11和secondaryanalysis版本bcl2fastq2v2.18以多路解编所有文库的测序片段并生成fastq文件。
质粒构建和稳定细胞系产生。使用下列引物,将小鼠ythdf2(mythdf2)从商业cdna克隆(origene#mc200730)克隆到载体pcdna5/frt/flag质粒中:mythdf2orf克隆bamhif:5'-cgcggatcctcggccagcagcctcttgga-3'和mythdf2orf克隆notir:5'-ataagaatgcggccgcctatttcccacgaccttgacgt-3'。然后将flag-mythdf2亚克隆到psicor-ef1a-ires-egfp慢病毒构建体中的ef1a启动子下(gibson
irclip-seq和数据分析。对于irclip-seq,修改了来自先前报道的方法(zarneger等人naturemethods,13:489-492,2016);simsek等人cell,169:1051-1065e1018,2017)中的程序。简而言之,通过在0.4j/cm2uv交联细胞3次对约3×108个flag-ythdf2hpc7细胞进行irclip。全细胞裂解物在裂解缓冲液(150mmkcl,10mmhepesph7.6,2mmedta,0.5%np-40,0.5mmdtt,1:100蛋白酶抑制剂混合物,400u/mlrnase抑制剂;1ml细胞沉淀和2ml裂解缓冲液)中产生。上下吸移几次,然后将mrnp裂解物在冰上孵育5分钟,然后在-80℃下与液氮一起骤冷冻。将mrnp裂解物在冰上解冻,并以15,000g离心15分钟以清除裂解物。每1ml裂解物用30μl预先与2μg抗-flag单克隆抗体(sigma)结合的蛋白质g磁珠在4℃旋转2小时来分离flag-ythdf2。收集珠子,用1ml冰冷的nt2缓冲液(200mmnacl,50mmhepesph7.6,2mmedta,0.05%np-40,0.5mmdtt,200u/mlrnase抑制剂)洗涤八次,并用200μlirclipnt2缓冲液(50mmtris,ph7.5;150mmnacl;1mmmgcl2;0.0005%np-40)洗涤一次。mrnp复合物在irclipnt2缓冲液(水体积为30μl,并补充有6μlpeg400(最终浓度为16.7%))中用0.4u/μl的rnase1(thermofisher#am2294)消化。核酸酶反应在eppendorfthermomixer中在30℃下孵育15分钟,1400r.p.m.15秒,静置90秒。通过加入0.5ml冰冷的高严格缓冲液(20mmtris,ph7.5;120mmnacl;25mmkcl;5mmedta;1%trition-x100;1%脱氧胆酸钠)来终止核酸酶消化。然后用0.25ml随后0.05ml冰冷的irclipnt2缓冲液快速漂洗免疫沉淀物。irclip衔接子的连接和文库构建遵循先前报道的方案(zarneger等人naturemethods,13:489-492,2016)。
使用fast-iclip版本0.9.3对数据进行多路解编,并使用star(2.4.2a)利用参数″--outfilterscoreminoverlread0--outfiltermatchnminoverlread0--outfiltermatchnmin0″与来自ucsc的小鼠基因组mm10进行比对。在r(3.4.1)中创建rpm标准化的基因组浏览轨迹,并使用gviz软件包(1.20.0)作图。通过取所有三个重复中发现的每个结合位点的中点、在上下游添加20个碱基并运行使用参数″-dna-modzoops-revcomp-minw5-maxw10-nmotifs10-maxsize1000000″的meme(4.11.1),鉴定出富集的基序。鉴定出基序后,我们针对transfac(1-2017)运行了tomtom(4.11.1)以鉴定已知的结合位点。使用r中的超几何检验进行go富集分析。如果bh调整后的p值小于0.05,则认为go术语富集。在柱状图中显示了感兴趣的所选项。柱状图中的条形表示被测试的列表中具有该项的基因的百分比除以基因组中具有该项的基因的百分比。通过fast-iclip在所有三个重复中发现的峰均分配给基因组中的各种特征。启动子被定义为在tss上游150个碱基。“trans_stop”定义为在转录物起始位点的上游和下游200个碱基。
脐带血转导。如先前所述进行脐带血转导(rentas,s.等人nature,532:508-511,2016,doi:10.1038/nature17665)。简而言之,在补充有生长因子白介素6(il-6;20ng/ml,peprotech)、干细胞因子(scf;100ng/ml,peprotech)、flt3配体(flt3-l;100ng/ml,peprotech)和血小板生成素(tpo;20ng/ml,peprotech)的stemspan培养基中预刺激新鲜的cd34+脐带血细胞或流式分选的cd34+cd38-细胞12-18h。然后将慢病毒以50-200的感染复数(moi)加入相同的培养基中24小时。然后在转导后维持细胞2天,然后进行体外或体内测定。人ythdf2被靶向用于靶向cdsn末端附近的5'-aaggacgttcccaatagccaa-3'的shrna敲低,如先前报道中所使用的(wang,x.等人nature505:117-120,2014,doi:10.1038/nature12730)。将杂乱shrna(种子序列5'-gcgcgatagcgctaataat-3')用作对照。
克隆生成祖细胞测定。将来自第10天培养的转导细胞(每毫升12,000个)的流式分选的gfp+脐带血细胞重新悬浮在半固体甲基纤维素培养基(methoculth4034;stemcelltechnologies)中。培养14天后进行集落计数。
人脐带血hspc培养。转导后2天,收集人脐带血cd34+或cd34+cd38-细胞,并通过流式细胞术测定gfp+百分比。为了确保在扩增前培养相同数量的gfp+细胞,将相同培养的gfp-细胞添加到具有较高gfp+百分比的细胞中,以匹配对照和hythdf2kd之间的gfp+%。然后将细胞以每毫升105的密度接种在补充有生长因子il-6(20ng/ml)、scf(100ng/ml)、flt3-l(100ng/ml)、tpo(20ng/ml)和chir99021(250nm)(stemgent)的stemspan培养基(stemcelltechnologies)中(perry等人genesanddevelopment,25:1928-1942,2011)。
人hsc异种移植。对于人脐带血hsc离体扩增分析,用人ythdf2shrna或对照shrna转导105个分选的cd34+cd38-细胞3天,然后分析转导效率(%gfp-/+)和干细胞标记。在第10天,收集培养的细胞用于干细胞标记分析。对于hubchsc初次lda测定,如上所述富集cd34+细胞,并在50moi下用人ythdf2shrna或对照shrna转导。感染后24小时更换培养基。在感染后3天,从对照或ythdf2kd细胞中分选出相同数量的gfp+细胞,并培养过夜。将分别为50k、20k和10k的三个剂量的gfp+细胞移植到经亚致死照射(3.25gy)的nsg小鼠中。hsc植入的截断值是在初次移植受体的bm中的总cd45+细胞中显示超过1%的人cd45+gfp+细胞。对于hucbhsc二次lda分析,收集来自最高两个剂量的初次受体的bm细胞,并在移植后10周混合在一起。将1.2×107、8×106、4×106的三个剂量的bm细胞分别移植到经亚致死照射(3.25gy)的nsg小鼠中。hsc植入的截断值是在二次移植受体的bm中的总cd45+细胞中显示超过0.2%的人cd45+gfp+细胞。使用elda软件(hu等人,journalofimmunologicalmethods,347:70-78,2009)评估hsc频率。对于所有人脐带血异种移植实验,均使用6-8周龄的雌性nsg小鼠。
m6a-seq数据分析。将人和小鼠的m6a-seq数据与hg19和mm10的转录组进行比对。为了鉴定m6a峰,将hg19和mm10转录组划分为25个核苷酸宽的图块。在每个图块中对m6aip和非ip(对照)样品中的测序片段数量进行计数,并使用fisher精确检验计算p值,并针对多次测试进行调整。具有显著的m6a信号富集(调整-pval<=0.05)的图块合并为更大的区域。丢弃小于100bp的区域,将大于200bp的区域划分为100至200bp的子区域;在每个区域计算相对于对照的m6a信号;在所有重复样品中具有至少2倍富集的区域被鉴定为m6a峰。通过将所有m6a峰与hg19和mm10refgene注释重叠来确定m6a峰分布和m6a标记基因。通过将m6a峰与hg19refgene重叠来鉴定m6a标记基因。为了过滤转录因子,将所有三个样品中通过m6a标记的基因与人转录因子数据库http://fantom.gsc.riken.jp/5/sstar/browse_transcription_factors_hg19进行了比较。然后使用r软件包富集go进行go术语分析。将m6a标记的人转录因子用作搜索列表,并将所有表达的基因用作背景。具有显著富集的造血相关的bp项用于生成图3c。
rna-seq。用对照或人ythdf2kd慢病毒转导人脐带血cd34+细胞,并在10天后分选出gfp+cd34+细胞。对于每组分选出12,000个gfp+cd34+细胞的三个复制,并用于提取总rna。根据制造商的指导使用smart-seqv4ultralowinputrnakitforsequencing(takara,634891)和nexteraxt(illumina,fc-131-1096),使用四纳克的高质量总rna进行cdna合成和文库制备。使用agilent2100生物分析仪和invitrogenqubit荧光计检查所得短片段文库的质量和数量。在illuminanextseq500仪器的高输出流动池中,将相等摩尔的文库合并、重新定量并测序为75个碱基对的单测序片段。测序后,运行illuminaprimaryanalysis版本nextseqrta2.4.11和secondaryanalysis版本bcl2fastq22.18以多路解编所有文库的测序片段并生成fastq文件。
对于rna-seq分析,使用ensembl87基因模型,使用具有默认参数的tophat2.0.13版,将测序片段与ucsc基因组hg38进行比对。测序片段计数是使用利用-mintersection-nonempty的htseq-count生成的。测序片段也与ercc对照序列比对,并将计数列表化。基于每个样品的ercc计数的中位数计算比例因子,并将其用于标准化。使用r(3.4.1)中的edger软件包(3.18.1)发现差异表达的基因。差异表达的基因需要具有bh调整的p值<.05和2倍的表达变化。
rna稳定性测定。在补充了10μg/ml肝素(sigma)、0.5×青霉素/链霉素(sigma)、10ng/ml重组小鼠(rm)scf(biovision,inc.)和20ng/mltpo(cellsciences,inc.)的stemspansfem培养基(stemcelltechnologies)(perry等人genesanddevelopment,25:1928-1942(2011))中在37℃5%co25%o2下培养15,000个分选的lt-hsc、st-hsc和mpp。用5μm放线菌素d(sigma)处理分选的细胞以抑制mrna转录。处理后0小时或4小时收获细胞,提取总rna并用于rna-seq。
m6arna甲基化定量。
用小鼠谱系细胞消耗试剂盒(miltenyibiotec)富集来自wt和ythdf2ko小鼠的小鼠bm谱系阴性细胞,然后用trizol(invitrogen)提取总rna。按照制造商的方案,使用m6arna甲基化定量试剂盒(abcamab185912)对lin-细胞中的m6arna甲基化进行定量。对于每组每个重复使用200ng总rna。
qpcr分析。
从wt和ythdf2ko小鼠中分选出105个lsk细胞。用trizol(invitrogen)提取总rna。cdna的合成使用高容量rna-to-cdnatm试剂盒(thermo)按照制造商的方案进行。所用的qpcr引物列于表s5中,qpcr引物用于验证wt和ythdf2kohspc中转录因子的表达水平。
蛋白质印迹和细胞内染色。为了验证ythdf2ko小鼠模型或hucb中的ko或kd效率,分别从bm或转染的hucb样品中分选了33,000个ckit+细胞或120,000个gfp+细胞。如图14b所示,使用经转导以过表达人ythdf2的hela细胞验证过表达效率。用抗ythdf2兔多克隆抗体(mbl,rn123pw)和β-肌动蛋白小鼠单克隆抗体(novus,nb600-501)进行免疫印迹。使用的二抗是irdye800cw山羊抗小鼠igg和irdye800cw山羊抗兔igg抗体(li-cor)。对于细胞内染色,将wt和ythdf2ko小鼠的bm细胞如上所述用hsc标记进行染色,然后根据制造商的说明用cytofix/cytoperm试剂盒(bdbiosciences)进行固定。用抗ythdf2抗体(mblrn123pw)、抗tal1抗体(santacruzsc-393287)、抗gata2抗体(santacruzsc-267)、抗runx1抗体(santacruzsc-365644)、抗stat5抗体(santacruzsc-74442)对经固定和透化的细胞进行免疫染色并通过alexa-488驴抗兔igg抗体(invitrogen)进行检测。
单细胞免疫染色。将来自wt和ythdf2ko小鼠的10,000个lsk分选到聚-l-赖氨酸包被的载玻片上,将其放置在湿气室中并在4℃下孵育30分钟以使细胞沉降到载玻片上。将细胞在室温下用冷甲醇固定10分钟,在室温下用通用封闭剂(biogenex)封闭30分钟,并在4℃下用小鼠tal1抗体(santacruz,sc393287)或小鼠igg对照(abcam)染色过夜。然后在4℃下用alexafluor488驴抗小鼠igg(thermofisherscientific)将细胞染色30分钟。图像是在带有yokagawacs-x1盘的perkinelmerultraview旋转盘系统上拍摄的。使用velocity软件(perkinelmer)将所有发射光收集到c9100-23hamamatsuem-ccd上。对于z堆栈,步长设置为400nm。通过imagej程序定量每个图像的染色强度。
与荧光免疫染色结合的fish。使用cytospintm4细胞离心机(thermoscientific目录号a78300003)以800rpm、1分钟在中等加速的情况下将分选的lsk旋转至显微镜载玻片(fisherscientific目录号12-544-4)上,然后立即浸入4%pfa(从16%(wt/vol)水溶液稀释,electronmicroscopysciences,目录号15710)。将细胞在室温(25±2℃)下固定30分钟。根据制造商的说明(advancedcelldiagnostics),使用rnascope多重荧光检测试剂盒进行rna原位杂交,其中进行了一些修改:不需要抗原回收,并用1:15稀释的蛋白酶iii溶液在室温下消化10分钟。靶向小鼠tal1和gata2的rnascope探针由acdbio设计和生产。原位杂交完成后,将载玻片用pbst漂洗两次,并直接进行背景封闭(backgroundbuster溶液,innovex,目录号nb306)和一抗孵育。抗ythdf2(mbl,1:500)和抗dcp1α(santacruz,sc100706,1:200)抗体用抗体稀释试剂缓冲液(lifetechnologies,目录号003118)稀释,并在4℃孵育过夜。驴抗兔alexafluor488(invitrogen,1:500)和驴抗小鼠alexafluor633(invitrogen,1:500)用于蛋白靶标多路复用。
实施例a-1
ythdf2ko导致初次小鼠中的表型hsc增加。
为了研究ythdf2对表型hsc的影响,使用crispr-cas9技术产生ythdf2f/f条件敲除小鼠,然后与mx1-cre小鼠杂交以特异性地减少造血细胞中的ythdf2表达(此后为ythdf2ko小鼠)(图1a和b)。在不存在pi:pc的情况下,bmhspc显示没有可识别的区别(图7a)。pi:pc注射后四周,与同窝野生型(wt)小鼠相比,在ythdf2ko小鼠中的长期hsc(lin-sca1+ckit+(lsk)cd34-flk2-;lt-hsc)和短期hsc(lskcd34+flk2-;st-hsc)的频率和绝对数量中观察到显著增加,但在多能祖细胞(lskcd34+flk2+;mpp)中未观察到此现象(图1c至1e)。发现长期hsc(lt-hsc)和st-hsc的频率和绝对细胞数增加2倍以上,而mpp表现出较温和的响应(图1c和1e)。尽管ythdf2ko导致bm细胞增多,但定向祖细胞包括普通髓样祖细胞(cmp)、粒细胞-巨噬细胞祖细胞(gmp)、巨核细胞-红细胞祖细胞(mep)和普通淋巴祖细胞(clp)以及成熟谱系细胞、红细胞、髓样细胞、b细胞和t细胞的绝对数量在ythdf2ko和wt小鼠之间的没有显著差异(图1f至h)。细胞周期分析显示,在ythdf2ko后,hsc或mpp的静止性没有显著变化(图7b)。值得注意的是,与wt对照相比,ythdf2kolt-、st-hsc和mpp中凋亡细胞的百分比显著减少(图7c)。为了进一步鉴定ythdf2ko小鼠中任何潜在的hsc缺陷,检查了脾脏中hsc、定向祖细胞和成熟谱系的数量,在wt和ythdf2ko小鼠之间未发现显著差异(图7d至7h)。总之,初次小鼠中的ythdf2ko特别地增加hsc数量,并且在祖细胞或谱系细胞中均无偏倚或缺陷。
实施例a-2
ythdf2ko在小鼠中扩增功能性hsc。
为了确定ythdf2ko是否扩增功能性hsc,首先通过将来自ko小鼠或其对照同窝小鼠的1×106个羧基荧光素二乙酸琥珀酰亚胺酯(cfdase)标记的bm细胞移植到经致死照射的受体小鼠中进行短期归巢测定,在突变和野生型对照之间的归巢能力方面没有发现显著差异(图7i)。然后通过移植2×105、7.5×104或2.5×104个供体bm细胞(cd45.2)以及来自ptprc突变株的2×105个受体bm细胞(cd45.1)到经致死照射的受体小鼠中进行有限稀释竞争性再增殖单位测定(lda)(图2a)。与ythdf2ko小鼠中表型hsc数量增加相一致,发现与对照组相比,ythdf2kohsc中的竞争性再增殖单位(cru)增加2.2倍(图2b)。在2×105组中,与对照组相比,在移植后16周,ythdf2ko供体细胞的总体再增殖率显著增加(图2c)。此外,与对照组相比,ythdf2kobm细胞的受体表现出在bm中供体来源的lt-hsc和st-hsc而非mpp的显著更高的频率和绝对数量(图2d和2e)。此外,发现来自突变体和wt细胞的移植受体的bm中的供体来源的定向祖细胞和bm中的成熟谱系没有显著变化(图2f和2g)。为了确定来自ythdf2ko小鼠的hsc的长期再增殖能力,进行了使用来源于初次受体的bm细胞的二次移植。值得注意的是,发现与对照相比,来自ythdf2ko细胞的cru显示出3.5倍的增加(图2h),并且在二次移植后16周时在bm和脾脏中均未显示白血病迹象(图9a至9f)。此外,在图2i和2j中,通过以3种不同剂量移植来自wt或ythdf2ko小鼠的总骨髓(bm)来进行有限稀释测定。移植后四周,观察到与wtbm细胞相比,移植了200,000个ythdf2kobm细胞的小鼠中供体细胞植入的增加。此外,这种增加没有在移植受体中产生谱系偏倚。
我们还通过在pi:pc注射后超过5个月检查bm和脾脏中的干细胞、祖细胞和谱系细胞,研究了ythdf2ko在稳态条件下对造血的长期作用(图9a)。尽管我们观察到来自ythdf2ko小鼠的bm中的lt-hsc与对照相比有适度增加(图9c),但在来自bm或脾脏的祖细胞和谱系细胞中,在ythdf2ko和对照小鼠之间没有显著的差异(图9d到9j)。这些观察结果表明,ythdf2ko在体内的长期作用既不会扭转谱系分化,也不会促进异常增殖,这与以前的报道(白血病生成不需要ythdf2)相一致。为了验证pi:pc诱导后5个月后bm中功能性hsc的频率,我们将来自wt和ythdf2ko小鼠的7.5×104个bm细胞与感受态细胞一起移植到经致死照射的受体中。我们发现,ythdf2ko导致受体中与wt对照相比显著更高的植入,这表明ythdf2ko具有在体内的对小鼠hsc扩增的长期能力(图9k)。综上所述,这些数据表明,ythdf2ko导致体内特异性和显著的小鼠hsc扩增,而不影响谱系定向。
实施例a-3
ythdf2通过m6a介导的mrna衰变来调节hsc自我更新基因的表达。
为了探索ythdf2ko如何扩增hsc的潜在机制,通过甲基化rna免疫沉淀结合高通量测序(merip-seq或m6a-seq)在从成年c57bl/6j小鼠中分选出的lt-hsc、st-hsc和mpp中对m6a甲基化组进行了作图(meyer等人cell,149:1635-1646,2012;schwartz等人cell,155:1409-1421,2013;dominissini等人nature,485:201-206,2012)。通过从两个独立的重复中鉴定出显著富集的重叠峰来选择m6a峰。与先前的研究一致(meyer等人cell,149:1635-1646,2012);dominissini等人nature,485:201-206,2012),发现在所有三个hspc群中,在mrna开放阅读框(orf)中、3'非翻译区(utr)中和终止密码子附近富含m6a峰。中等表达基因的转录物更可能被甲基化(图10a至10c)。有趣的是,已发现m6a修饰在转录因子(例如gata2、etv6、stat5和tal1)的mrna中富集,其已被证明对hsc自我更新和干细胞状态维持至关重要(wang等人blood,113:4856-5865,2009;ebina等人theembojournal,34:694-709,2015;orkin等人cell,132:631-644,2008:depater等人thejournalofexperimentalmedicine,210:2843-2850,2013;hock等人genesanddevelopment,18:2336-2341,2004;lim等人thejournalofclinicalinvestigation122:3705-3717,2012;reynaud等人blood,106:2318-2328,2005;和kato等人thejournalofexperimentalmedicine,202:169-179,2005),表明m6a修饰可能在hsc的调控中起关键作用(表s1,在hspc中通过m6a标记对hsc自我更新和维持至关重要的关键转录因子)。考虑到越来越多的证据表明,m6amrna甲基化通过促进编码参与自我更新和分化的关键信号传导途径中的转录因子和基因的mrna衰变来调节干细胞命运的确定(batista等人cellstemcell,15:707-719,2014;(geula等人science347:1001-1006,2015;yoon等人cell,2017;zhang等人nature,549:273-276,2017;zhao等人nature,542:475-478,2017;li等人cancercell,31:127-141,2017;li等人nature,548:338-342,2017),接下来通过在用放线菌素d进行转录抑制后监测mrna水平来在lt-hsc、st-hsc和mpp中测量mrna的降解速率。发现在st-hsc和mpp中,甲基化的mrna的降解速率显著快于未甲基化的mrna(图10d)。因为ythdf2是介导mrna衰变的公认m6a“阅读物”(wang等人nature,505:117-120,2014),通过在小鼠多能造血前体细胞系hpc-7中进行红外uv交联免疫沉淀测序(irclip-seq)进一步确定ythdf2的靶标(pintodo等人theembojournal,17:5744-5756,1998;zarnegar等人naturemethods,13:489-492,2016)(图3a;图11a至11c)。结果表明,57.8%的ythdf2靶mrna包含m6a峰(图11d)。ythdf2结合位点富含保守的m6a基序,并表现出m6a分布特征(图3b和3c)。ythdf2靶转录物的基因本体论(go)分析显示与造血或淋巴器官发育相关的基因的富集,表明ythdf2参与了造血功能的调节(图3d)。值得注意的是,发现在与m6a峰高度重叠的位点上,ythdf2与转录因子mrna(例如tal1和gata2的mrna)结合(图3e;图5e和表s2,来自三个irclip-seq复制的ythdf2靶向的mrna)。在wt和ythdf2ko小鼠的lskflk2-细胞的总rna质量中未观察到显著变化。尽管m6a修饰仅构成哺乳动物细胞中0.1-0.4%的腺苷核苷酸,但发现ythdf2ko导致bmlin-细胞的总rna中m6a含量增加,这表明ythdf2特异性调节了m6a标记的mrna的稳定性(图12a和12b)。一致地,总mrna的qpcr分析显示,与wt对照相比,ythdf2kolsk细胞中tal1、gata2、runx1和stat5a(其mrna已显示被m6a修饰)的水平增加(图3f)。单细胞免疫荧光染色和细胞内流式细胞术进一步显示,ythdf2kohspc表现出参与干细胞自我更新的m6a标记转录因子(如tal1、gata2、runx1和stat5)的强度显著增加,表明ythdf2在hsc自我更新中的抑制作用(图3g;图12c)。先前的研究表明,ythdf2通过将结合的mrna定位于mrna衰变位点来调节rna代谢(wang等人nature,505:117-120,2014)。为了进一步探索ythdf2调控hsc自更新的机制,对tal1mrna进行了荧光原位杂交(fish),并对mrna衰变位点的标记ythdf2和dcp1a(sheth等人science,30:805-808,2003;kedersha等人methodsinenzymology,431:61-81,2007)进行了荧光免疫染色,并在分选的wt和ythdf2kohspc中分析了它们的相对空间分布。在wt细胞中观察到tal1mrna、dcp1a和ythdf2的共定位,而在ythdf2ko对照中则显著减少(图3h和3i)。此外,通过在wt或ythdf2kohspc中将gata2mrnafish与ythdf2和dcp1a共染色确认了类似的观察结果(图12d和12e)。为了确定增加的转录因子(例如tal1)的表达是否导致了ythdf2ko小鼠中的hsc扩增,在wt和ythdf2kolsk细胞中使用短发夹(sh)rna介导的tal1敲低(kd)然后移植到经致死照射的受体中来进行拯救实验。如先前所报道,hspc中tal1的耗尽显著损害了wt细胞的重建能力,并且还拯救了ythdf2ko细胞的增加的植入(图12f)。总的来说,这些数据表明ythdf2通过实现编码干细胞更新所必需的转录因子的mrna的降解来调节hsc自我更新。
实施例a-4
通过m6a-seq和rna-seq分析ythdf2在人ucbhspc中的作用。
单个人脐带血单位中有限数量的hsc已成为临床应用(例如hsc移植)的障碍(walasek等人annalsofthenewyorkacademyofsciences,1266:138-150,2012)。ythdf2ko导致表型和功能性小鼠hsc增多的观察结果促使进行这样的测试:ythdf2是否敲低(kd)可以促进人ucbhsc的扩增。首先,进行使用从3个单独的hucb样品中分离出的cd34+细胞的m6a-seq(图13a)。如预期的那样(约90%),m6a修饰主要发生在mrna中(约95%),优先发生在mrnaorf区、3'utr中和终止密码子附近(图4a和4b;图13b)。比较了小鼠和hucbhspc中的m6a景观,发现2,239个基因通常被m6a标记(图4c)。这些通常m6a标记的转录物富含与造血和干细胞维持相关的基因(图4d)。由于负责小鼠hsc自我更新的转录因子的mrna中m6a标记的富集,接下来通过进行go术语分析来表征hucbcd34+细胞中m6a标记的转录因子转录物。在722种经鉴定的m6a标记的转录因子mrna中,主要的go术语与细胞命运决定和干细胞维持有关(图13c)。例如,据报道其过表达离体扩增人和小鼠hsc(amsellem等人naturemedicine,9:1423-1427,2003;antonchuck等人cell,109:39-45,2002)的hoxb4在hucbcd34+细胞中被m6a标记(图4e)。hsc自我更新所需和从其他细胞类型诱导hsc至关重要的其他转录因子(ebina等人theembojournal,34:694-709,2015;galan-caridad等人cell,129:345-357,2007)(例如zfx、runx1和fosb)在hucbcd34+细胞中也是m6a标记的(图13f和13g,另参见li等人,cellresearch28,904-917(2018)的文章“supressionofm6areaderythdf2prmotdhematopoeiticstemcellexpansion”的补充表s3,该文章(包括其补充表)通过引用全文并入本文,来自单独样品中的人ucbcd34+hspc中m6a标记的基因)。为了进一步分析hucbhspc中ythdf2的作用,用对照或ythdf2kdhucbcd34+细胞进行rna-seq(图4f;图13d和13e)。引人注目地,由m6a标记的转录物(包括hoxb4和其他hsc自我更新相关的转录因子)显示与对照相比ythdf2kd细胞中的输入mrna测序片段显著增加,而对于非m6a标记的基因无显著变化(图4g至4i;13f和13g)。这些结果支持ythdf2在通过rna降解调节hucbhsc自更新中的作用。
实施例a-5
通过ythdf2kd扩增hucbhsc。
为了进一步探索ythdf2的抑制是否可以扩增人hsc,如上所述,在hucbhspc中进行了短发夹(sh)rna诱导的ythdf2kd(图4f)。离体培养7天后,相对于对照细胞(尤其是最原始的cfu-粒细胞红细胞单核细胞巨核细胞(gemm)集落类型和爆发集落形成单位-红系细胞(bfu-e)),ythdf2的慢病毒敲低分别导致cd34+cd38-cd45ra-epcr+表型hsc的频率和绝对数量平均增加14.3倍和13.6倍,和导致cfu增加5.1倍,反映了ythdf2kdhucb细胞中造血功能的关键转录因子(如tal1)的较高表达水平(图5a至5d;图14a)。有趣的是,与对照细胞相比,ythdf2kdhucbhspc中的凋亡率显著减少,类似于ythdf2ko小鼠中hsc的趋势(图5e)。而且,图5f显示,与对照hsc相比,在转导后10天ythdf2敲低(kd)hsc显示出高达10倍的增加。接下来,探索过表达(oe)ythdf2对hspc功能的影响。ythdf2的过表达将hucbhspc的克隆潜力减少了2.2倍,这表明ythdf2离体负调控hsc维持(图14b和14c)。
为了确定ythdf2kd是否能在体内扩增人hsc,通过在感染后第4天移植从感染了对照和ythdf2shrna的hucbcd34+细胞中分选的gfp+细胞进行lda(图6a)。移植后10周,我们分析了来自受体nod/scidil2rgnull(nsg)小鼠的bm细胞,并在体内扩增后测量功能性hsc频率。值得注意的是,与对照组相比,ythdf2kd细胞的受体在bm中的人造血细胞(hcd45+gfp+)植入量增加9倍,而每个谱系的比例未改变(图6b和6ch;图15a和15b)。ythdf2kd显著增加初次受体的bm中髓细胞、巨核细胞和红细胞的百分比(图15c)。因此,已发现,与对照细胞相比,ythdf2kd细胞中的hsc频率增加4.4倍(图6d)。这证实了ythdf2kdhucb细胞具有被重建和经历自我更新的长期能力;将bm从初次受体移植到经亚致死照射的二次nsg受体小鼠中后12周,与对照组相比,ythdf2kd组的bm中人造血细胞嵌合性更高(图6e、6f;图15d)。来自ythdf2kd细胞的cru相对于对照细胞显示出8倍的增加(图6g)。这些数据表明,ythdf2kd显著促进了表型和功能性hucbhsc的体外扩增。
实施例a-6
本文的实施例证明,条件性缺失ythdf2(m6a阅读物)导致表型和功能性hsc的扩增而没有谱系偏倚。为了研究在体内是否存在间充质干细胞的伴随增加,将ytdhf2f/f小鼠与mx1-cre小鼠杂交,以从间充质细胞中条件性缺失ythdf2表达。pi:pc注射后九个月,从ythdf2ko及其野生型同窝动物中分离出骨髓细胞。用流式抗体免疫染色总骨髓细胞的单细胞悬液。使用特异性标记物排除造血细胞(cd45、ter119)和内皮细胞(cd31)。通过包含n-钙黏着蛋白和cd105抗体进一步纯化总骨髓基质细胞内存在的间充质干细胞。定量了标记有n-钙黏着蛋白+和cd105+的间充质干细胞。ythdf2的条件性缺失导致间充质干细胞频率的3.6倍扩增(图16)。我们的研究清楚地证实,ythdf2的损失能够在体内扩增骨髓间充质干细胞。
讨论
尽管最近的研究探索了mrnam6a修饰的生物学功能(zheng等人molecularcell,49:18-29,2013;zhou等人nature,526:591-594,2015;alarcon等人cell,162:1299-1308,2015;zhang等人cancercell,31:591-606e596,2017;lence等人nature,540:242-247,2016;haussmann等人nature,540:301-302,2016;chen等人cellstemcell,16:289-301,2015;alarcon等人nature,519:482-485,2015;xiao等人molecularcell,61:507-519,2016;wojtas等人molecularcell,68:374-387e312,2017;ivanovna等人molecularcell,67:1059-1067e1054,2017;fustin等人cell,155:793-806,2013;slobodin等人cell,169:326-337e312,2017;schwartz等人cell,159:148-162,2014;pendleton等人cell,169:824-835e814,2017;shi等人cellresearch,27:315-328,2017;huang等人naturecellbiology,20:285-295,2018;bertero等人nature,2018;liu等人nature,518:560-564,2015),本文的实施方案通过将转录后的m6a修饰与编码自我更新的关键转录因子的mrna降解进行偶联,将ythdf2鉴定为人和小鼠hsc自我更新的重要调节剂。小鼠hspc和hucbhsc中ythdf2的抑制能够导致对自我更新至关重要的多个关键tf的表达增加,从而促进表型和功能性hsc的离体扩增,而没有显著的谱系偏倚和白血病潜能。此外,干细胞小生境在一定程度上可能有助于ythdf2抑制介导的小鼠hsc扩增,因为mx1-cre可在间充质基质细胞中活化。将吸引人的是研究ythdf2对间充质干细胞(msc)的功能以及hsc和msc中ythdf2的抑制如何在体内协同扩增hsc。
鉴于m6a书写物复合体mettl3和mettl14对mrna剪接、翻译和pri-mirna加工的广泛而复杂的影响(barbieri等人nature,,2017;alarcon等人nature,519:482-485,2015;liu等人nature,518:560-564,2015),mettl3或mettl14耗尽会导致正常干细胞和白血病中的不同结局。最近的研究表明mettl3和mettl14在白血病的发展和白血病干细胞的维持中起着至关重要的作用(vu等人naturemedicine,2017;barbieri等人nature,2017;weng等人cellstemcell,22:191-205e199,2018)。相反,据信ythdf2主要参与m6a介导的mrna衰变(batista等人cellstemcell,15:707-719,2014;yoon等人cell,2017;zhang等人nature,549:273-276,2017;wang等人nature,505:117-120,2014)。根据本文的某些实施方案,据信操纵ythdf2可以延长编码对干细胞自我更新至关重要的tf的特定m6a标记的mrna的半衰期,而不影响mrna加工的其他方面。本文的实施例显示,hsc中的ythdf2耗尽既不扭转谱系定向也不诱导血液恶性肿瘤,从而减少了在hsc扩增的情况下产生白血病的风险。此外,干细胞的自我更新是一个复杂的过程,包括细胞分裂、存活、防止分化和保持干性。ythdf2缺陷的hsc显示出较低的细胞凋亡率的观察结果表明,本文的方法的实施方案也有益于干细胞自我更新的另一个特征。
使用hucbhsc移植的主要限制是一个hucb单位中hsc的数量不足。尽管先前的研究表明dlk1、sr1、musashi2和um171可以通过靶向notch、ahr信号传导或其他未知途径来扩增hucbhsc(boitano等人science,329:1345-1348,2010;fares等人science,345:1509-1512,2014;rentas等人nature,532:508-511,2016;chou等人experimentalhematologyi,41:479-490e474,2013)。因此,本文的实施方式提供了新颖有效的方法来靶向对hsc自我更新至关重要的多个关键tf并增强hsc的扩增。例如,在体外培养期间通过小化学药品或aav介导的kd减少ythdf2的水平和功能可以使ythdf2的水平和功能在体内移植后恢复,因此不会影响人患者的正常hsc维持和功能。此外,在某些实施方案中,本文所述的方法可以与其他方法组合,不仅促进人hsc的扩增,而且促进其他干细胞的扩增,从而提供了用于基于干细胞的疗法的方法。
实施例b
在下面的“b”实施例中使用了以下方案。
动物。c57bl/6-gt(rosa)26sortm1(hbegf)awai/j(idtr)、b6.cg-gt(rosa)26sortm14(cag-tdtomato)hze/j(r26rtdt)、tg(cspg4-dsred.t1)1akik/j、cxcl12tm2.1sjm/j、kitltm2.1sjm/j(scff/f)、cxcl12tm1.1sjm/j(cxcl12f/f)小鼠获自jacksonlaboratory。n-cad-creert和n-cad-tdt小鼠是由appliedstemcell,inc.产生的。为了诱导n-cad-creert;r26-tdt小鼠,将他莫昔芬(sigma)以每次注射2mg腹膜内注射3天。为了在胚胎期诱导n-cad-creert;r26-tdt,将单剂量的1.5mgtmx腹膜内(ip)注射到e12.5怀孕的雌性动物中。在e19.5进行剖腹产,将新生小鼠转移至寄养小鼠。为了在n-cad-creert;idtr小鼠中诱导n-cad+细胞消融,按指示每隔一天以每克体重50ng的剂量腹膜内注射dt(sigma)。将5fu(sigma-aldrich)以每克体重150μg在尾静脉中注射一次。注射5fu后,如文中所述分析小鼠。本研究中使用的所有小鼠系均具有c57bl/6j遗传背景。根据基因分型结果将动物随机包括在实验中。以对于研究者的盲法方式进行动物实验。图例中说明了每个实验使用的动物数量。本研究中使用的所有小鼠均被饲养在stowersinstituteformedicalresearch(simr)的动物设施中,并根据simr和美国国立卫生研究院(nih)指南进行处理。所有程序均已通过simr的机构动物护理和使用委员会(iacuc)批准。
流式细胞术。对于表型分析,从骨髓(股骨和胫骨)中收获造血细胞。使用0.16m氯化铵溶液裂解红细胞。对于细胞表面分型,使用谱系混合物(lin,藻红蛋白(pe)-cy5),包括抗cd3(145-2c11)、抗cd4(rm4-5)、抗cd8(53-6.7)、抗-mac-1(m1/70)、抗gr1(rb6-8c5)、抗b220(ra3-6b2)、抗igm(ii/41)和抗ter119(ter-119)(每百万个骨髓细胞100ng抗体混合物,ebioscience)。还按指示使用针对sca1(d7,ebioscience)、c-kit(2b8,ebioscience)、flk2(a2f10,ebioscience)、cd34(ram34,ebioscience)、cd48(hm48-1,ebioscience)、cd150(tc15-12f12.2,biolegend)和cd49b(hmα2,biolegend)的单克隆抗体(全部以每百万个骨髓细胞50ng使用)。对于外周血的谱系分析,使用针对cd45.1(a20,ebioscience)、cd45.2(104,ebioscience)、cd3、b220、mac-1和gr1的单克隆抗体。使用7-氨基放线菌素d(7-aad)(a1310,lifetechnologies)排除死细胞。对于基质小生境细胞分析,cd45(30-f11,ebioscience)、cd31(390,ebioscience)、pdgfrα-生物素(apb5,ebioscience)、lepr-bio(r&d)、cd51(克隆rm7-v,biolegend)。用生物素偶联抗体染色的样品用染色培养基洗涤,然后与链霉亲和素亮紫色421tm(biolegend,1:500)孵育。使用moflo(dako)、influx细胞分选仪(bdbiosciences)、macsquant(miltenyibiotec)或cyanadp(dako)仪器进行细胞分选和分析。使用flowjo软件进行数据分析。
全包埋胸骨hsc免疫染色。收集胸骨并用手术刀片将其切成3-4个碎片。将碎片矢状切开以暴露骨髓腔,将其固定在4%pfa中。在含有20%正常山羊血清和0.5%tritonx-100的pbs中封闭/透化,并用一抗染色3天。将组织与二抗孵育2小时(bruns等人,2014;kunisaki等人,2013)。荧光成像在连接到旋转盘共聚焦系统(csu-x1;yokogawacorporationofamerica)和配备volocity采集软件(perkinelmer)和20x/0.8plan-apochromat物镜(carlzeiss)的orca-r2相机(hamamatsu)的旋转盘共聚焦显微镜(ultraview;perkinelmer)(包括倒置显微镜(axiovert200m;carlzeissmicroimaging,jena,germany))上进行。图像被收集为一系列光学剖面图(section),步长为4μm。以足以覆盖整个样品的图块模式(10%重叠)收集图像。依序收集通道。(蓝色染料)使用405nm光(50mw二极管激光器,oem)激发,(红色染料)使用561nm光(50mw固态激光器,oem)激发,并各自使用415nm-775nm580nm-650nm波段的多带通发射光滤光片进行收集。(绿色染料)使用488nm光(50mw固态激光器,oem)激发并使用500nm-550nm的多带通发射光滤光片进行收集,(远红色染料)使用640nm光(50mw固态激光器,oem)激发,并使用455nm-515nm和660nm-750nm的多带通发射光滤光片进行收集。调整曝光时间和激光功率以补偿染色中的变化。
在荧光成像之后立即进行二次谐波产生(shg)成像。shg图像在配备了quasar检测单元、10x0.45plan-apochromat物镜(carlzeiss)和zen2012采集软件(v8.1.3,carlzeiss)的lsm-780激光扫描共聚焦显微镜(carlzeiss)上收集。图像被收集为一系列光学剖面图,步长为8μm,像素大小(1.32μm/像素)是荧光像素大小的四倍的整数倍。用900nm的激光波长拍摄shg图像,并在371-420nm下收集。作为图像比对的参考,使用dpss激光器(mellesgriot)的561nm线拍摄并与shg图像同时在566-735nm处收集cd150-pe的图像。以足以覆盖整个样品的图块模式(无重叠)收集图像。使用zen软件将图块缝合成完整的3d图像。
使用fiji软件(1.51gnationalinstitutesofhealth)分析图像。为了比对shg和荧光图像,首先减去荧光图像的背景,然后使用grid/collection缝合插件(参考http://bioinformatics.oxfordjournals.org/content/25/11/1463.abstract)将图像图块缝合成完整的3d图像。考虑到将样品从荧光显微镜转移到shg显微镜涉及少量的样品旋转,因此有必要在3个维度上重新比对shg和荧光图像。使用http://research.stowers.org/imagejplugins上的自定义插件进行shg和荧光图像集的比对。首先,通过目视检查shg和荧光数据集识别出最少8个共同的标记(landmark)。接下来,使用kabsch算法找到最佳缩放比例的旋转,以将荧光坐标转换为shg图像坐标。最后,将荧光图像中的每个3d体素转换到相应的shg位置,并使用三线性插值法找到该位置的shg强度以创建重新比对的合成图像。
图像分析是由不熟悉研究假设的研究人员进行的。通过肉眼鉴定hsc。如果细胞的形状不能用肉眼识别,或者如果细胞的形状在阳性信号视野中形成一个暗区,则认为细胞对于染色是阴性的。使用fiji和microsoftexcel软件进行小生境组分的距离测量。使用fiji中的点roi标记hsc的位置和三个小生境组分中的每一个的最近点,并将位置转移到excel,然后使用3d勾股定理计算3d中的距离。为了计算随机分布的hsc的距离,使用fiji中的自定义插件在针对观察到的hsc分析的相同图像中生成随机点roi。如果随机生成的点出现在合理的hsc位置(通过周围区域中lin+细胞的存在评估),则将其视为模拟的hsc。然后以与观察到的hsc相同的方式对模拟的hsc进行小生境距离测量。
使用origin软件通过kolmogorov-smirnov分析评估距离分布中差异的统计显著性。使用microsoftexcel中的studentt检验评估在5μm处hsc百分比变化的统计显著性。如果p<0.05,则认为变化是显著的。
附图中所示的最终图像是已减去背景并针对清晰度调整了对比度的最大投影。
移植和再增殖测定。将100个分选的phsc或rhsc细胞与1.0×105个cd45.1拯救骨髓细胞一起移植到经致死照射(10gy)的cd45.1受体中。将来自n-cad-creert;idtr和对照组小鼠的2.0×105个cd45.2bm细胞与2.0×105个cd45.1拯救骨髓细胞一起移植到经致死照射(10gy)的cd45.1受体中。移植后每4周,从下颌下静脉收集外周血。从供体来源的血细胞(cd45.2)中测量造血再增殖。
rna测序和分析。使用smarterultralowinputrna试剂盒(clonetech)从1000个纯化的细胞生成cdna,并通过nexteraxtdna文库制备试剂盒(illumina)生成文库,然后在illuminahiseq2500上测序50bp单测序片段。使用illuminabcl2fastq2v2.18将原始测序片段多路解编为fastq格式,允许最多一个不匹配。使用默认参数的tophatv2.0.13将测序片段与ucsc基因组mm10比对。使用利用“-u–max-bundle-frags100000000”cufflinksv2.2.1生成fpkm值。测序片段计数使用利用“-mintersection-nonempty”的htseq-count生成。对每个群体测序三或四个重复。数据可在ncbigeo:gse104887上获得。
cfu-f测定和体外分化。将细胞直接分选到96孔板的培养物中。将培养物在37℃、5%o2和10%co2的潮湿气氛中培养7-10天。用celltrackertmgreencmfda(lifetechnologies)对集落染色,并用celigoimagingcytometer(nexcelom)采集图像。对于体外分化,通过用0.25%胰蛋白酶/edta消化从cfu-f培养物中分离出克隆扩增的ncad-creert驱动的tomato+bm/骨基质细胞,分成3等份,并接种到允许分化的单独培养物中:stempro成骨试剂盒gibcoa10072-01、脂肪形成试剂盒a10070-01和软骨形成分化试剂盒a10071-01。用vectorred碱性磷酸酶评估成骨细胞的分化;用油红o(sigma)检测脂肪形成分化;并用甲苯胺蓝(sigma,0.1gtblue/100ml蒸馏水)检测软骨形成分化。
骨切片、免疫染色和成像。
将新鲜分离的股骨在4%多聚甲醛中固定过夜,然后在10%edta中脱钙1至3天。对于石蜡切片,用sakuratissuetekvip5组织处理仪(sakuraamerica,torrance,ca)处理骨样品,并将石蜡切片切成5um的厚度。将切片用二甲苯脱蜡,然后进行阿尔辛蓝/苏木精/橙黄g染色。对于冷冻切片,用cryojane胶带传送系统处理骨样品。将切片用powerblocktm通用封闭剂封闭30分钟至1小时,然后用兔抗聚集蛋白聚糖(millipore,1:300)、兔抗周脂素(cellsignaling,1:300)和山羊抗骨桥蛋白(r&d,1:300)染色过夜。使用驴抗山羊alexafluor488和驴抗山羊alexafluor647作为二抗(均来自invitrogen,1:300)。用抗体稀释液(invitrogen00-3218)稀释抗体。用fluoro-gel(electronmicroscopyscience1798510)固定载玻片,并用olympus载玻片扫描仪采集图像。
股骨沟手术。用2.5%异氟烷麻醉小鼠,并施用丁丙诺啡镇痛。刮除右腿皮肤并用酒精和碘擦洗。在膝盖关节外侧的皮肤上制作一个小切口。在内侧滑动皮肤以进行可视化之后,在膝盖骨内侧制作一个内部切口,延伸到股四头肌并沿着膝盖骨腱延伸以释放组织。使膝盖骨侧向半脱位,并暴露股骨远端。使用微锯对软骨下骨进行穿孔,以穿透膝关节的关节软骨。使伸肌结构(股四头肌、膝盖骨腱和膝盖骨)恢复到其原始解剖位置。用可吸收的缝合线缝合内切口,用不可吸收的缝合线缝合皮肤。
统计学。
值显示为平均值±s.e.m.。所有统计分析均使用graphpadprism5(graphpad软件)生成。studentt检验用于两组之间的比较。统计学显著性定义为p<0.05。
实施例b-1
小鼠骨髓中功能上有区别的储备性和致敏的hsc。为了探索储备性hsc(以下简称rhsc)亚群,对细胞表面标记cd49b(整联蛋白α2)进行了改编,cd49b可以区分中期hsc和永久性长期hsc(lt-hsc)(benveniste等人,2010;qian等人,2015;wagersandweissman,2005;yang等人,2005)。有趣的是,发现cd48–cd49b–亚群仅存在于常规lt-hsc(cd34–flk2–lineage–sca-1+c-kit+(lsk)细胞)中,而在短期hsc(st-hsc;cd34+flk2-lsk)或多能祖细胞(mpp;cd34+flk2+lsk)中则不存在。已提出cd48–cd49b–lt-hsc亚群富集rhsc,而cd48–cd49b+lt-hsc亚群则富集致敏的hsc(以下简称phsc)(图17a),并用再增殖测定进行了测试。已发现,rhsc和phsc均支持在接受致死性照射的小鼠中移植后长达40周的造血作用,而无显著差异(图17b),与先前的报道一致(benveniste等人,2010)。但是,与移植的rhsc相比,移植的phsc在受体中产生rhsc(减少95.4%)以及st-hsc和mpp的效率(两种群体均减少约78%)的效率非常低,这表明rhsc在层级上优于phsc(图17c)。通过使用scl-tta诱导的h2b-gfp标签保留模型,发现与phsc相比,rhsc显著富集更多的h2b-gfphigh细胞(p=0.0039),表明rhsc与phsc相比具有更慢的细胞周期(图17d)。在分子水平上,发现rhsc具有均参与维持hsc的g0期的gadd45g、cdkn1c(编码p57)和foxo1的较高表达,和细胞周期活化剂如myc、pcna、ccng2和cdk4的较低表达。rhsc和phsc之间的ki67表达没有差异,表明仅ki67表达不足以区分两个hsc亚群(图17e)。
因为rhsc的功能定义是耐药性,所以将rhsc或phsc移植到受体小鼠中,并在移植后4周用5fu攻击小鼠。如图17f所示,rhsc对5fu处理不敏感;然而,phsc显著减少其重建能力(移植后20周减少了44%)。综上所述,数据表明,cd48–cd49b–lt-hsc确实富集对化学治疗有抗性的rhsc,而cd48–cd49b+lt-hsc富集对化学治疗敏感的phsc;此外,在移植测定中,前者引起了后者,但非反之亦然。
进一步分析了急性5fu攻击对rhsc和phsc的直接后果。如图17g所示,在5fu后3天,大约92%的phsc被清除,并且只有rhsc存活,这表明rhsc必须已特别地打开了其dna修复系统以能克服化学治疗应激。为了验证该假设,分析了5fu处理后rhsc、phsc和rhsc中dna损伤反应基因的转录组谱。观察到在稳态过程中,与phsc相比,rhsc维持参与dna损伤修复系统的基因的较低的表达(图17h),但是大多数dna修复途径例如dna错配修复(mmr)、核苷酸切除修复(ner)碱基切除修复(ber)和同源重组(hr)在5fu攻击下在rhsc中被显著活化(图17i)。此外,平行地,还上调了主要属于hsp90和hsp70家族的大量应激反应基因(rodina等人,2016)(分别为1.8±0.17倍和1.4±0.1倍)(图17j),部分解释了rhsc如何在化学治疗应激下存活并重建造血系统。
总之,在bm中功能性地证明了phsc和rhsc的共存。即使在其静止状态和活化的dna修复途径的情况下,phsc仍然对化学治疗敏感,而rhsc活化其dna损伤修复和应激反应基因以在化学治疗应激下存活并产生phsc。因此,rhsc在支持严重应激下的造血再生中起着至关重要的作用。
实施例b-2
耐药性rhsc主要位于骨髓的骨内膜区域
进一步检查了来自bm小生境的外源性机制是否在稳态期间和在化学治疗应激下有助于rhsc的维持。为此,进行了全包埋hsc染色,其同时检测了rhsc和phsc在约75μm厚度骨腔内的骨(通过二次谐波产生shg实现)、巨核细胞(mk)或血管的相对分布(图18a-b)。我们的定量数据表明,43.4%的rhsc和31.0%的phsc位于距血管10μm的距离内,并且22.6%的rhsc和24.6%的phsc位于距mk10μm以内(图18c-d),与大部分hsc群位于血管周围和血窦区域的之前报道一致(acar等人,2015;bruns等人,2014;chen等人,2016;zhao等人,2014)。有趣的是,注意到16.4%的rhsc位于距骨表面10μm以内,而相比之下phsc仅为3.69%(图2e)。这些数据表明,rhsc和phsc均无偏倚地分布在血管和mk中,但与phsc相比,rhsc的位置显著靠近骨内膜骨表面(p=0.00182)。
为了测试骨内膜区域在化学治疗应激期间是否保留rhsc,在phsc被消除时,在5fu处理后第3天检查rhsc的分布(图18b)。有趣的是,我们发现在急性5fu应激时,约55%的存活rhsc被骨内膜小生境保留,这是与稳态相比约3.5倍的富集(图18e)。但是,在血管或mk附近观察到的存活rhsc的频率没有显著差异(图18c-d)。一致地,如图17g所示,观察到仅4.24%的phsc在急性5fu应激下存活。接下来,通过检查brdu标记的存活和增殖细胞,研究了bm损伤的动态过程以及5fu应激后的后续恢复。注意到在5fu处理后的第2天,brdu标记的细胞大量损失,表明由5fu诱导的活性细胞凋亡。在5fu处理后的第3天,观察到存活的brdu+细胞(主要是单细胞)主要在骨内膜区域中的骨衬细胞附近被检测到(图24a-d)。在第3.5天,观察到成对的brdu+细胞出现在骨内膜表面,表明存活细胞的活化和分裂。从第4天和第5天开始并持续,增殖细胞的数量逐渐增加,并且这些细胞通常被检测为靠近血管或潜在脂肪细胞结构的簇(第4天为约55%,第6天为约65%)(图24e-i)。该观察结果表明,骨表面是其中5fu后细胞最初存活的小生境。然后这些细胞被活化并产生子细胞,后者主要在血管中或巨核细胞附近进行扩增(zhao等人,2014)。进一步证实,存活的5fu-rhsc确实通常被检测为与骨表面相邻的单个细胞,并且增殖性hsc通常与mk相关或在血管附近。在5fu处理后第3天的存活的rhsc(绿色,cd150+lin-cd49b-)通常被检测为与骨表面相邻的单个细胞(白色,shg),并且增殖性hsc通常与mk相关(cd150+lin+)或血管附近(红色,cd31+)(图29)。
已发现骨表面中的n-cad+成骨细胞前体细胞具有抗性,而已发现osx+成骨细胞对5fu处理敏感,并且已发现n-cad+基质细胞在5fu处理后的恢复过程中产生osx+成骨细胞(sugimura等人,2012)。最近的一项研究表明,辐照后1天,由于细胞死亡,中央骨髓中的lepr+基质细胞急剧减少(zhou等人,2017)。为了追踪血管和骨内膜小生境中的早期变化,在5fu处理后第1天进行凋亡测定。发现5fu后1天凋亡的cd31+ve-钙黏着蛋白+细胞大大增加(图18f),这与先前报道的5fu后血管结构破坏一致(dominici等人,2009;sugimura等人,2012)。为了研究骨内膜小生境,建立了n-cad-tdtomato(n-cad-tdt)小鼠系,其中tomato+细胞在中央骨髓和骨表面均报告n-cad表达(图24j)。注意到在中央骨髓中凋亡的n-cad驱动的tomato+细胞显著增加,而在5fu后1天在骨内膜区中的tomato+细胞保持稳定(图18g)。在5fu处理后第3天,当造血再生开始时,中央骨髓和骨表面中n-cad驱动的tomato+细胞分别增加2.2倍和1.7倍(图18h,图24k)。cd31+血管细胞的数量也增加,但显示出扩张的和受损的结构(图18i)。综上所述,以前的报道和此数据表明,血管周围小生境中的血管和相关基质细胞(包括lepr+和n-cad+细胞)受到立即的损害,并对5fu应激敏感,而n-cad+骨内膜基质细胞保持稳定。
数据部分地解释了先前的发现,即大多数hsc主要分布在血管周围和血窦区域中(acar等人,2015;chen等人,2016;kunisaki等人,2013)。占静止hsc群51.3%的phsc在稳态中位于血管周围和血窦区域附近。然而,在应激下,rhsc更靠近骨表面并在化学治疗应激下存活。总而言之,数据表明,骨内膜小生境在保护rhsc对抗化学治疗方面起着关键作用。
实施例b-3
n-cad+小生境细胞在骨髓中维持功能性hsc包括rhsc
尽管n-cad+基质细胞是最早鉴定出的hsc小生境细胞,并且尽管骨内膜小生境中的n-cad+基质细胞对化学疗法具有抗性而osx+成骨细胞对化学疗法敏感,但是由于缺乏适当的遗传小鼠系仍然缺少n-cad+功能性支持hsc的直接证据。根据本文的方面,产生了n-cad-creert系(图25a),并显示n-cad+基质细胞产生col2.3-gfp+成骨细胞和血管周围细胞(图25b)。先前的研究表明,耗尽成熟的col2.3-gfp+成骨细胞不会影响bm细胞的整体植入(ding等人,2012;greenbaum等人,2013),但只导致lt-hsc子集的再生能力受损(bowers等人,2015)。尽管n-cad+基质细胞在发育上继续发展为osx+骨祖细胞,其进一步产生成熟的col2.3+成骨细胞,但n-cad+基质细胞对hsc维持的功能性贡献尚不清楚。为了研究n-cad+细胞的hsc小生境作用,生成了n-cad-creert诱导的dtr(编码白喉毒素受体)系(n-cad-creert;idtr),其中使n-cad+小生境细胞对白喉毒素(dt)敏感。向n-cad-creert;idtr小鼠施用三次他莫昔芬(tmx)注射,然后进行dt的腹膜内注射(隔日注射一次),并在最后一次注射后的第一天对其进行分析(图19a)。与用dt同时处理的n-cad-creert;r26-tdt小鼠相比,在n-cad-creert;idtr;r26-tdt中观察到n-cad+基质细胞的有效消融(图19b)。进一步检查了n-cad+细胞消融是否会在体内影响hsc。在消融n-cad+细胞后,与对照相比,未观察到bm中细胞结构的显著变化(图19c)。但是,hsc的数量显著减少:rhsc(减少65.0%),phsc(减少60.0%)、st-hsc(减少59.6%)和mpp(减少29.3%)(图19d)。这表明n-cad+小生境细胞有助于最原始的(包括储备的)hsc的维持。
还进行了移植测定以测试n-cad+基质细胞消融小鼠中的功能性hsc数量。已发现,n-cad+基质细胞消融小鼠的骨髓细胞给出显著较低水平的供体细胞重建(20周时减少28.3%)(图19e),以及减少的髓样细胞产生(24.5%至17.1%)(图19f)。为了进一步研究n-cad+小生境细胞是否有助于维持hsc的长期自我更新,在初次移植后20周进行了二次移植。观察到,n-cad+基质细胞消融小鼠的bm细胞在二次移植中具有深度减小的供体细胞重建能力(16周时减小40.5%)(图19g),尽管它们能够进行多谱系重建(图19h)。
此外,我们发现从n-cad+基质细胞中条件性敲除cxcl12显著减少phsc(减少48%)和st-hsc(减少28.8%),但在rhsc中未观察到显著减少。尽管存在mpp的轻微的无关紧要的增加。(图19i)。从n-cad+基质细胞中条件性缺失scf显著减少rhsc(减少60%)、phsc(减少38.6%)和st-hsc(减少53.7%),但mpp中略有增加(图19j)。总体而言,我们提供了第一个功能性证据,表明n-cad+小生境细胞通过产生维持因子来促进hsc包括rhsc的维持。
实施例b-4
造血细胞及其bm小生境细胞的转录组分析
为了理解控制不同小生境细胞如何促成hsc亚群调节的分子机制,在稳态期间对4种类型的造血干和祖细胞(hspc)和在5fu后第3天对rhsc以及对10种类型的bm小生境细胞进行转录组谱分析。bm小生境细胞是从骨内膜(b)和中央骨髓(m)的不同小生境区域收获的(图26a-b)。皮尔森距离树和主成分分析(pca)数据显示,与st-hsc和mpp相比,rhsc和phsc共有独特的转录组谱(图20a)。有趣的是,5fu处理后的rhsc似乎更靠近phsc(图20b),这表明存活的rhsc被致敏用于活化以支持化学疗法后的后续造血再生。
已发现rhsc富集大多数已公开的hsc特异性标记物,例如slamf1(cd150),h19,ctnnal1(α-catulin),fgd5,vwf,tek(tie2),procr(epcr),hoxb5和meg3(或gtl2)(acar等人,2015;chen等人,2016;qian等人,2015;sanjuan-pla等人,2013;venkatraman等人,2013)。特别地,rhsc中的vwf是phsc中的6.1倍,这表明rhsc富集大多数位于hsc层级顶端的vwf+hsc(sanjuan-pla等人,2013)。一致地,祖细胞特征基因(例如cd34,cd48和flt3(flk2)和itga2(cd49b))在rhsc中具有低表达(acar等人,2015;chen等人,2016;gazit等人,2014)。有趣的是,5fu后的rhsc具有高表达水平的cxcr4、ctnnal1(α-catulin)(park等人,2002)、esam(内皮细胞选择性黏附分子)和cd150(编码slamf1,信号传导淋巴细胞活化分子),与它们的与转换后的致敏状态相关的功能一致(图20e)。
在小生境细胞分析中,发现n-cad驱动的tdtomato(n-cad-tdt)(m)在皮尔森距离树(图20c)和pca分析(图20d)中与具有间充质干细胞(msc)潜力的其他小生境细胞(例如lepr、cxcl12-rfp和巢蛋白-gfp细胞)相比具有非常相似的转录组谱,表明n-cad+细胞可能具有msc潜能并且在调节hsc中具有相似的功能。有趣的是,ng2-rfp细胞与col2.3-gfp+成骨细胞具有非常相似的转录组谱(图20c-d)。还发现ng2-rfp细胞主要局限于骨骺或骨干中的骨内膜,但是它们也在动脉周围区域中被检测到(图26c)。
已发现pecam(cd31)、cdh5(ve-钙黏着蛋白)富含pecam-gfp+内皮细胞。pf4和adgre1富含mk和巨噬细胞(macs)。cspg4(ng2)富含ng2-rfp细胞。巢蛋白-gfp细胞不具有内源性巢蛋白(nes)表达,这与先前的报道一致(ding等人,2012;greenbaum等人,2013)。有趣的是,发现了几种标记基因例如kitl(scf)、lepr、cdh2(n-钙黏着蛋白,n-cad)、cxcl12、pdgfrα在血管周围的小生境细胞中广泛表达(图20f)。与来自骨内膜区的其他细胞(例如col2.3-gfp和ng2-rfp细胞)相比,从骨内膜区分离的n-cad-tdt(b)细胞也具有高水平的scf、cxcl12、lepr和pdgfrα表达(图20f)。我们的go术语分析表明,col2.3-gfp、pecam-gfp、mk和mac细胞高度富集rna代谢、蛋白质代谢、其他代谢途径和翻译活性,表明与处于相对较低的代谢状态的n-cad-tdt细胞和其他血管周围区域细胞相比,这些细胞处于相对活跃的功能状态。内皮细胞和血管周围细胞具有免疫系统过程和应激反应活性(图20g)。由于n-cad+细胞的转录组谱与其他msc例如lepr+、cxcl12-rfp和巢蛋白-gfp细胞相似,因此我们接下来分析并比较了来自不同小生境细胞的基质发育相关基因(图20h)。发现col2.3-gfp细胞富含成骨细胞基因col1a和祖细胞基因ly6a(sca1)(yang等人,2014)。来自骨内膜区域的n-cad-tdt(b)细胞富含软骨细胞基因spock1、col2a1和col1a2以及骨发育基因(例如tnc)。有趣的是,n-cad-tdt(b)和n-cad-tdt(m)富含大多数间充质干和祖细胞(mspc)基因,例如prrx1、pdgfrβ、pdgfrα、sp7、sox9和grem1。骨髓收获的ng2-rfp细胞也具有较高水平的mspc基因表达,例如alcam、sp7、mcam、sox9和gli1,但是具有高水平的成骨细胞和软骨细胞相关基因,例如col1a1、col2a1和col1a2。还发现在所有血管周围小生境细胞中,lepr+细胞唯一地富含gla以及几种成骨细胞和软骨细胞标记物,例如atf4和tnc。cxcl12-rfp细胞显著富含mspc基因itgav。此外,grem1富含n-cad-tdt(b)和所有血管周围小生境细胞,但不富含ng2-rfp细胞。
与早期数据一致,col2.3-gfp细胞富含更成熟的骨谱系基因(dmp1、col1a1、spp1、bglap)。巢蛋白-gfp、cxcl12-rfp和lepr与它们在富集msc基因(prrx1、pdgfrα、itgb1、grem1)中的已知作用一致(图20h)。有趣的是,除了表达msc基因外,n-cad-tdt(m)和n-cad-tdt(b)富含软骨生成(sox9、col2a1和tnc)、脂肪形成(cebpα、pparγ、adipoq)和成骨(col1a1、runx2)基因,表明n-cad+基质细胞的三潜力性质。出乎意料的是,ng2-rfp富含骨发育基因(dmp1、bglap、sp7、runx2、col1a1)和软骨生成基因(sox9、col2a1和tnc),表明其具有骨软骨形成作用(图26d-e)。这些数据有力地表明了bm中mspc的异质性。
实施例b-5
n-cad-creert诱导的报告细胞与lepr+和cxcl12+干/基质细胞大量重叠
为了证实转录分析,使用tdt或zsg报告分子进行n-cad体内谱系追踪,并发现在诱导后第3天,n-cad-creert谱系追踪的细胞与cxcl12-rfp和巢蛋白-gfp细胞部分重叠(图20i)。此外,98.3%和97.9%的n-cad-creert来源的细胞分别对lepr和pdgfrα表达呈阳性(图20j)。该结果进一步支持n-cad+基质细胞具有如转录组分析所提示的msc潜能。为了分析n-cad+基质细胞的谱系潜能,进行了集落形成单位-成纤维细胞(cfu-f)测定,以测试其增殖能力。已发现,大多数报告的小生境细胞(无论是来自骨内膜区还是来自血管周围区)在少于10个细胞中有一个具有cfu-f活性,巢蛋白-gfp+细胞除外,其仅在17.6个细胞中有一个具有cfu-f活性。来自骨的n-cad+细胞在8.79个细胞中有一个细胞具有cfu-f活性。n-cad-creert来源的骨细胞在10.7个细胞中有一个具有cfu-f活性,n-cad-creert来源的骨髓细胞在7.37个细胞中有一个具有cfu-f活性。(图20k)。大多数cfu-f集落保持tdtomato信号(图21a-b),这表明n-cad+细胞是具有cfu-f活性的mspc的主要来源。
实施例b-6
n-cad+基质细胞在体外和体内产生成骨细胞、软骨细胞和脂肪细胞
为了测试n-cad+细胞的msc潜力,通过将从由n-cad+细胞形成的个体cfu-f集落获得的细胞分成三个等分试样然后将其亚克隆到允许骨、脂肪或软骨细胞分化的培养物中来进行体外分化测定。已发现,tomato+细胞经历多谱系分化,产生碱性磷酸盐阳性的成骨细胞、油红o阳性的脂肪细胞以及聚集蛋白聚糖染色的和甲苯胺蓝阳性的软骨细胞(图21c-e)。
为了表征n-cad+基质细胞的体内功能,在一个剂量的tmx处理后分析n-cad来源的细胞的动态解剖分布(图21f、g)。有趣的是,早在tmx后6小时,在小梁骨的干骨后端中检测到所检测的n-cad来源的细胞,但在中央骨髓中仅观察到很少的细胞,这表明大部分n-cad+细胞起源于骨内膜区域(图21h)。还观察到,tmx处理后1至2周,小梁骨区域中的n-cad来源细胞数量增加2.2±0.2倍,并在此后保持稳定;在皮质骨区域中,在tmx后2周细胞数量增加2.95±0.2倍,但随后在tmx后6周下降,这表明与皮质骨区域相比,小梁骨区域中的n-cad+细胞更为静止。此外,n-cad来源的细胞在中央骨髓中持续增加直至6周,这表明n-cad来源的细胞可能在该区域内增殖和分化(图21i)。
接下来,进行体内谱系追踪测定,并且观察到n-cad+细胞以时间依赖性方式产生col2.3-gfp+成骨细胞(dacic等人,2001)(图22a,图27a-b)。早在tmx诱导后6小时(图22b)在小梁骨周区域中和在tmx诱导后14小时在致密骨区域中(图22c)检测到n-cad来源的成骨细胞。进一步的分析表明,tmx后6小时,小梁骨区域中未成熟n-cad+col2.3–细胞(1.1%±0.2%)比皮质骨区域(0.11%±0.04%)富集10倍(图22d,e)。一致地,tmx诱导后24小时和2周,与致密骨区域相比在小梁骨区域中富集更多的未成熟n-cad+col2.3–细胞(图22f)。在tmx诱导后4周,大部分的col2.3-gfp细胞(72%±6%)来源于n-cad+细胞(图22g)。
进一步观察到,在注射tmx后4周,n-cad+基质细胞在小梁骨区域产生了脂肪细胞,尤其是骨内膜细胞(图22h),并且通过bodipy脂质探针染色进一步证实了这一点(图22i)。有趣的是,n-cad+来源的脂肪细胞的频率最初迅速增加,后来又下降,这通过定量分析证明,其中在tmx诱导后分别在第6、14和24小时分别观察到39.3%±4.5%、77.1%±6.7%和17.2%±3%的n-cad+来源的细胞,表明脂肪细胞可能具有频繁的周转率(图22j-k,图27c-e)。总体而言,数据表明,在成年小鼠的稳态过程中,n-cad+基质细胞在体内产生成骨细胞和脂肪细胞谱系。
此外,发现与其他标记物相比,ncad+msc富集>10倍。例如,如图30所示,仅10kncad+hmsc在体内产生比总hmsc甚至更高的人血小板生成素(thpo或tpo)。类似地,ncad-hmsc表现出与总hmsc相似的功能。因此,用n-钙黏着蛋白抗体分离msc可以提供msc群的富集。
实施例b-7
n-cad+基质细胞在发育过程中和在损伤后产生软骨细胞
软骨生成在胎儿发育中活跃并且在成年中很少活跃(raghunath等人,2005;sophiafox等人,2009)。在出生后第2天(p2)接受tmx诱导的小鼠中,在n-cad-creert;r26-tdt小鼠股骨中的聚集蛋白聚糖+软骨细胞中未检测到tomato表达(图28a),尽管tomato+成骨细胞和软骨细胞与生长板相邻。在当生长板发育时1或2周用tmx诱导n-cad-creert;r26-tdt小鼠之后,在股骨或胫骨的软骨中的tomato+软骨细胞仍未检测到(数据未显示)。在胚胎期e12.5,(此时msc在胎儿骨中经历凝结和软骨细胞分化)开始对n-cad-creert;r26-tdt小鼠进行tmx诱导(图23a)。发现在e14.5胚胎大多数未分化的n-cad来源的tdt+细胞位于外周,而分化的n-cad来源的tomato+软骨细胞位于肋骨的中央区域(图23b)。重要的是,在p2在股骨小梁区域中,在其中形成第二骨化中心的柱状区域和浅表区域中都检测到n-cad来源的软骨细胞,这对于抵抗绝对力以用于深层保护是必不可少的(图23c,d)。一致地,在出生后2个月以及直到出生后10个月检测到n-cad来源的脂肪细胞(图23e,图28b),表明n-cad+细胞有助于发育期间的早期和长期脂肪形成。但是,在出生后2个月时检测到n-cad+细胞来源的骨桥蛋白+成骨细胞和骨细胞,而在p2早期未检测到(图23f,图28c)。这些数据表明,n-cad来源的胚胎细胞产生了所有三个骨-脂肪形成-软骨形成细胞系,并且只有处于胚胎期n-cad+才能有效地形成软骨细胞。
接下来研究损伤后成年小鼠中n-cad+细胞是否能产生软骨细胞。在于e12.5接受tmx诱导的n-cad-creert;r26-tdt小鼠中进行软骨穿孔(图23g)。在软骨损伤后2至3周,我们发现n-cad来源的软骨细胞聚集在损伤部位的愈合组织中,与未损伤的对照小鼠相比增加2倍(图23h-i)。由于手术后小鼠中的关节软骨损伤,股胫关节肿胀(图28d)。具有典型软骨细胞特征的阿尔辛蓝阳性细胞在损伤后区域中显著增加(图23j),这表明n-cad+msc响应于损伤迅速再生软骨细胞。
综上所述,数据证明在胎儿阶段(e12.5)诱导的n-cad来源的细胞可以在成体中产生软骨细胞祖细胞,并响应于损伤支持软骨细胞再生。
讨论
rhsc与phsc
已经广泛研究了hsc的异质性。hsc可以保持处于活跃、静止或深度静止状态。众所周知,hsc的静止特性与它们的长期自我更新潜能在功能上相关(foudi等人,2008;wilson等人,2008)。但是,静止的hsc群如何克服体内骨髓消融的后果尚待解决。不论它们的静止状态,大多数hsc无法在化学治疗性应激例如5fu下存活(longley等人,2003)。根据本文的方面,发现hsc亚群的一小部分可以在初次小鼠的5fu处理下存活并且在移植模型中对5fu处理具有抗性。因此,该hsc亚群被定义为rhsc,而其他静止但化学治疗敏感的hsc亚群被定义为phsc(liandclevers,2010)。尽管这两个hsc亚群在移植实验中均支持长期造血功能,但phsc很少产生rhsc,而后者能够产生phsc。在机理上,发现在稳态中rhsc与phsc相比具有减弱的dna修复系统,但是rhsc可以快速活化其dna修复途径和应激反应程序以在化学治疗应激下存活,并支持后续的造血功能以克服骨髓消融的后果。
小生境在赋予对化学疗法的抗性方面很重要
为了探索rhsc的化学抗性的外在机理,测试了它们被保存在bm的特定微环境中的想法。通过使用全包埋hsc染色(kunisaki等人,2013),首先观察到大多数hsc与血管和mk相关,如先前报道。然而,令人惊讶地发现,在稳态期间和在5fu处理后,与phsc相比,rhsc主要与骨内膜小生境相关。这表明,骨内膜小生境可以形成独特的bm微环境以保护rhsc抵抗化学治疗应激。一致地,在化学治疗应激时,大多数rhsc在富含化学抗性n-cad+基质细胞的骨内膜小生境中受到保护,而血管和血管周细胞对5fu处理敏感,导致化学疗法诱导的phsc大量损失。全包埋hsc染色在胸骨(其具有骨髓内丰富的骨分支和延伸)中进行。此特征使其与股骨中的小梁骨区域非常相似。移植测定表明n-cad+小生境细胞的耗尽影响hsc包括rhsc的维持,支持了这一观点。hsc静止也与它们的低代谢状态相关,这被认为类似于“睡眠”,并被称为hsc休眠或蛰伏(takubo等人,2013;wilson等人,2008;yamazaki等人,2011)。然而,根据本文的各个方面进一步表明,静止不是引起耐药性的唯一机制;相反,内在的应激反应程序和外在的小生境保护都促进了耐药性。
n-cad基质细胞在bm小生境中hsc维持中的身份和功能
n-cad+基质细胞是最早鉴定出的hsc小生境细胞(zhang等人,2003),并被随后的研究证实(arai等人,2004;sugiyama等人,2006)。n-cad+细胞最初基于它们的骨内膜位置被提出为成骨祖细胞。根据本文的观点,通过使两个报告系,发现n-cad+基质细胞分布在骨内膜区域和血管周围部位中。更有趣的是,发现大多数n-cad+细胞与lepr+细胞和pdgfrα+细胞重叠。转录分析显示,n-cad+细胞、lepr+细胞、cxcl12-rfp(car)细胞和巢蛋白-gfp细胞具有非常相似的基因表达模式。数据强烈表明,长期以来对hsc小生境概念的争论很可能是由于使用了不同的细胞标记而不是由于它们的细胞特性。
为了确定n-cad+基质细胞的身份,通过使用不同的小生境报告小鼠将其区域分布相对于骨髓中其他已知的小生境细胞进行可视化。n-cad+基质细胞产生72%±6%的col2.3-gfp+细胞;然而,在骨内膜区域也检测到9.3%±4.7%的n-cad+col2.3gfp-细胞。这些未成熟的细胞构成了原始的msc,这可以解释hsc小生境功能研究中col2.3-cre遗传模型的效率不足(dingandmorrison,2013;ding等人,2012;greenbaum等人,2013)。尽管n-cad-tdt+和巢蛋白-gfp+都在小梁骨区域中富集,但n-cad-tdt+集中在其中检测到移植的hsc的植入的小梁骨区域,如先前报道的那样(nilsson等人,2001;xie等人,2009),并在应激后存活,如本文所观察到的。所有这些数据表明,尽管n-cad+细胞与其他msc具有相似的转录组谱,但它们的解剖学分布可能表明它们具有独特的hsc小生境功能;实际上,已显示,n-cad+骨内膜小生境细胞在保存rhsc中起着关键作用。
通过使用诱导型dtr系统,发现n-cad+细胞的消融消除了bm中的phsc和rhsc。这可以通过骨内膜和血管周围区域中n-cad+小生境细胞的解剖学分布来解释。此外,已显示,在hsc的子集中可以检测到n-cad表达;但是,n-cad-tdt报告小鼠系不支持该观察结果(数据未显示)。这可以部分地通过它们的蛋白质和转录水平之间的不一致来解释,因为另一个n-cad-mcherry小鼠系(在蛋白质水平上的融合)确实具有一个小的hsc子集(cd49b-cd34-flt2-lsk)显示低水平的n-cad表达(初步观察)。功能性移植数据显示,n-cad+小生境细胞的消融导致hsc(包括rhsc)减少。通过从n-cad+细胞中缺失cxcl12和scf,发现n-cad+基质细胞通过产生这两个因子来促进hsc的维持和调节。总体而言,本文的各方面证明n-cad+基质细胞用作msc并支持原始hsc维持,尤其是在应激下。
从人脐带血(hucb)移植造血干细胞(hsc)对于治疗包括癌症在内的各种血液疾病具有广阔的前景,但是单个hucb单位中有限数量的hsc会限制其广泛使用。尽管大量的努力已开发出通过靶向单个分子或途径来离体扩增人hsc的多种方法,但未知是否可以实现对于干细胞自我更新必不可少的大量靶标的同时操作。最近的研究表明n6-甲基腺苷(m6a)通过影响其稳定性来调节一组对干细胞命运决定至关重要的mrna的表达。在几种m6a阅读物中,众所周知ythdf2促进靶向的mrna衰变。但是,ythdf2对成体干细胞的生理功能仍然不清楚。本文的实施方案证明条件性敲除(ko)小鼠ythdf2增加表型和功能性hsc数量,但是既不扭转谱系分化也不导致造血系统恶性肿瘤。此外,人ythdf2的敲低(kd)在2轮有限稀释移植测定中导致hucbhsc的离体扩增增加超过10倍、集落形成单位(cfu)增加5倍和功能性hucbhsc增加超过8倍。在机理上,来自小鼠造血干和祖细胞(hspc)以及来自hucbhsc的rna的m6a作图揭示了在编码对干细胞自我更新至关重要的转录因子的mrna上的m6a富集。这些m6a标记的mrna被ythdf2识别并经历mrna衰变。在ythdf2kohspc和ythdf2kdhucbhsc中,这些mrna被稳定化,导致蛋白质水平升高并促进hsc的扩增,这可通过敲低mrna(例如tal1mrna)来拯救。因此,实施方案显示了ythdf2在成体干细胞维持中的功能,并且鉴定了ythdf2在调节hsc离体扩增中的重要作用(通过控制对于hsc自我更新至关重要的多种mrna的稳定性的机制),从而具有用于未来的临床应用的强大潜力。
此外,已经充分研究了骨髓(bm)小生境对造血干细胞(hsc)的调节;然而,目前尚不清楚hsc亚群是否以及如何受到不同bm小生境的独特调控。在本文中,储备性hsc(rhsc)在功能上已与致敏的hsc(phsc)区分开,并且它们各自的bm小生境已得到进一步检查。已经发现,phsc和rhsc都可以在稳态下支持长期的造血作用;然而,phsc对化学疗法敏感,而rhsc在化学疗法下存活并支持骨髓消融后的后续再生。全包埋hsc分布研究表明,rhsc在稳态期间和在化学治疗后优先维持在富含n-钙黏着蛋白+骨衬细胞的骨内膜区域中。phsc主要与易受化学疗法侵害(与骨相比)的血管相关。转录组分析和体内谱系追踪结果显示n-钙黏着蛋白+基质细胞是功能性间充质干细胞,其在发育和再生过程中产生成骨细胞、脂肪细胞和软骨细胞。最后,证明了n-钙黏着蛋白+小生境细胞的消融或从n-钙黏着蛋白+小生境细胞缺失scf或cxcl12影响hsc数量和维持。
实施例c
使用shrna扩增car-t细胞
使用慢病毒驱动的人ythdf2shrna评估操纵ythdf2对car-t细胞扩增的作用。已在car-t慢病毒载体中成功克隆了ythdf2shrna。慢病毒已用于感染人car-t细胞,并且人car-t细胞的扩增正在进行中。预计扩增将需要数天至数周才能取得成果。相信与对照car-t群相比,在慢病毒感染的car-t细胞群中将显示出显著增强的扩增。
所有的测序数据,包括m6a-seq、irclip-seq和rna-seq数据集,都可以通过geneexpressionombibus(geo)获得,登录号为gse107957。
原始数据存储库位于http://www.stowers.org/research/publications/libpb-1248。
参考文献
以下参考文献在一定程度上提供了示例性的程序性或其他细节作为本文所示的那些的补充,这些参考文献通过引用明确地并入本文。
1.li,l.&clevers,h.coexistenceofquiescentandactiveadultstemcellsinmammals.science327,542-545(2010).
2weissman,i.l.stemcells:unitsofdevelopment,unitsofregeneration,andunitsinevolution.cell100,157-168(2000).
3walasek,m.a.,vanos,r.&dehaan,g.hematopoieticstemcellexpansion:challengesandopportunities.annalsofthenewyorkacademyofsciences1266,138-150(2012).
4sung,a.d.&chao,n.j.concisereview:acutegraft-versus-hostdisease:immunobiology,prevention,andtreatment.stemcellstranslationalmedicine2,25-32(2013).
5shlomchik,w.d.graft-versus-hostdisease.naturereviews.immunology7,340-352(2007).
6huang,x.etal.activationofoct4enhancesexvivoexpansionofhumancordbloodhematopoieticstemandprogenitorcellsbyregulatinghoxb4expression.leukemia30,144-153(2016).
7boitano,a.e.etal.arylhydrocarbonreceptorantagonistspromotetheexpansionofhumanhematopoieticstemcells.science329,1345-1348(2010).
8fares,i.etal.cordbloodexpansion.pyrimidoindolederivativesareagonistsofhumanhematopoieticstemcellself-renewal.science(newyork,n.y345,1509-1512(2014).
9amsellem,s.etal.exvivoexpansionofhumanhematopoieticstemcellsbydirectdeliveryofthehoxb4homeoprotein.naturemedicine9,1423-1427(2003).
10antonchuk,j.,sauvageau,g.&humphries,r.k.hoxb4-inducedexpansionofadulthematopoieticstemcellsexvivo.cell109,39-45(2002).
11rentas,s.etal.musashi-2attenuatesahrsignallingtoexpandhumanhaematopoieticstemcells.nature532,508-511(2016).
12himburg,h.a.etal.pleiotrophinregulatestheexpansionandregenerationofhematopoieticstemcells.naturemedicine16,475-482(2010).
13north,t.e.etal.prostaglandine2regulatesvertebratehaematopoieticstemcellhomeostasis.nature447,1007-1011(2007).
14varnum-finney,b.etal.pluripotent,cytokine-dependent,hematopoieticstemcellsareimmortalizedbyconstitutivenotch1signaling.naturemedicine6,1278-1281(2000).
15chou,s.,flygare,j.&lodish,h.f.fetalhepaticprogenitorssupportlong-termexpansionofhematopoieticstemcells.experimentalhematology41,479-490e474(2013).
16guo,b.,huang,x.,lee,m.r.,lee,s.a.&broxmeyer,h.e.antagonismofppar-gammasignalingexpandshumanhematopoieticstemandprogenitorcellsbyenhancingglycolysis.naturemedicine24,360-367(2018).
17zhao,b.s.,roundtree,i.a.&he,c.post-transcriptionalgeneregulationbymrnamodifications.naturereviews.molecularcellbiology18,31-42(2017).
18roundtree,i.a.,evans,m.e.,pan,t.&he,c.dynamicrnamodificationsingeneexpressionregulation.cell169,1187-1200(2017).
19li,s.&mason,c.e.thepivotalregulatorylandscapeofrnamodifications.annualreviewofgenomicsandhumangenetics15,127-150(2014).
20batista,p.j.etal.m(6)arnamodificationcontrolscellfatetransitioninmammalianembryonicstemcells.cellstemcell15,707-719(2014).
21geula,s.etal.stemcells.m6amrnamethylationfacilitatesresolutionofnaivepluripotencytowarddifferentiation.science347,1002-1006(2015).
22yoon,k.j.etal.temporalcontrolofmammaliancorticalneurogenesisbym6amethylation.cell171,877-889(2017).
23zhang,c.etal.m6amodulateshaematopoieticstemandprogenitorcellspecification.nature549,273-276(2017).
24zhao,b.s.etal.m6a-dependentmaternalmrnaclearancefacilitateszebrafishmaternal-to-zygotictransition.nature542,475-478(2017).
25li,z.etal.ftoplaysanoncogenicroleinacutemyeloidleukemiaasan6-methyladenosinernademethylase.cancercell31,127-141(2017).
26vu,l.p.etal.then6-methyladenosine(m6a)-formingenzymemettl3controlsmyeloiddifferentiationofnormalhematopoieticandleukemiacells.naturemedicine23,1369–1376(2017).
27weng,h.etal.mettl14inhibitshematopoieticstem/progenitordifferentiationandpromotesleukemogenesisviamrnam(6)amodification.cellstemcell22,191-205e199(2018).
28barbieri,i.etal.promoter-boundmettl3maintainsmyeloidleukaemiabym(6)a-dependenttranslationcontrol.nature552,126-131(2017).
29wang,x.etal.n6-methyladenosine-dependentregulationofmessengerrnastability.nature505,117-120(2014).
30meyer,k.d.etal.comprehensiveanalysisofmrnamethylationrevealsenrichmentin3'utrsandnearstopcodons.cell149,1635-1646(2012).
31schwartz,s.etal.high-resolutionmappingrevealsaconserved,widespread,dynamicmrnamethylationprograminyeastmeiosis.cell155,1409-1421(2013).
32dominissini,d.etal.topologyofthehumanandmousem6arnamethylomesrevealedbym6a-seq.nature485,201-206(2012).
33wang,z.,li,g.,tse,w.&bunting,k.d.conditionaldeletionofstat5inadultmousehematopoieticstemcellscauseslossofquiescenceandpermitsefficientnonablativestemcellreplacement.blood113,4856-4865(2009).
34ebina,w.&rossi,d.j.transcriptionfactor-mediatedreprogrammingtowardhematopoieticstemcells.theembojournal34,694-709(2015).
35orkin,s.h.&zon,l.i.hematopoiesis:anevolvingparadigmforstemcellbiology.cell132,631-644(2008).
36depater,e.etal.gata2isrequiredforhscgenerationandsurvival.thejournalofexperimentalmedicine210,2843-2850(2013).
37hock,h.etal.tel/etv6isanessentialandselectiveregulatorofadulthematopoieticstemcellsurvival.genes&development18,2336-2341(2004).
38lim,k.c.etal.conditionalgata2inactivationresultsinhsclossandlymphaticmispatterning.thejournalofclinicalinvestigation122,3705-3717(2012).
39reynaud,d.etal.scl/tal1expressionlevelregulateshumanhematopoieticstemcellself-renewalandengraftment.blood106,2318-2328(2005).
40kato,y.etal.selectiveactivationofstat5unveilsitsroleinstemcellself-renewalinnormalandleukemichematopoiesis.thejournalofexperimentalmedicine202,169-179(2005).
41li,h.b.etal.m6amrnamethylationcontrolstcellhomeostasisbytargetingtheil-7/stat5/socspathways.nature548,338-342(2017).
42pintodo,o.p.,kolterud,a.&carlsson,l.expressionofthelim-homeoboxgenelh2generatesimmortalizedsteelfactor-dependentmultipotenthematopoieticprecursors.theembojournal17,5744-5756(1998).
43zarnegar,b.j.etal.irclipplatformforefficientcharacterizationofprotein-rnainteractions.naturemethods13,489-492(2016).
44sheth,u.&parker,r.decappinganddecayofmessengerrnaoccurincytoplasmicprocessingbodies.science300,805-808(2003).
45kedersha,n.&anderson,p.mammalianstressgranulesandprocessingbodies.methodsinenzymology431,61-81(2007).
46lacombe,j.etal.sclregulatesthequiescenceandthelong-termcompetenceofhematopoieticstemcells.blood115,792-803(2010).
47galan-caridad,j.m.etal.zfxcontrolstheself-renewalofembryonicandhematopoieticstemcells.cell129,345-357(2007).
48zheng,g.etal.alkbh5isamammalianrnademethylasethatimpactsrnametabolismandmousefertility.molecularcell49,18-29(2013).
49zhou,j.etal.dynamicm(6)amrnamethylationdirectstranslationalcontrolofheatshockresponse.nature526,591-594(2015).
50alarcon,c.r.etal.hnrnpa2b1isamediatorofm(6)a-dependentnuclearrnaprocessingevents.cell162,1299-1308(2015).
51zhang,s.etal.m6ademethylasealkbh5maintainstumorigenicityofglioblastomastem-likecellsbysustainingfoxm1expressionandcellproliferationprogram.cancercell31,591-606e596(2017).
52lence,t.etal.m6amodulatesneuronalfunctionsandsexdeterminationindrosophila.nature540,242-247(2016).
53haussmann,i.u.etal.m6apotentiatessxlalternativepre-mrnasplicingforrobustdrosophilasexdetermination.nature540,301-304(2016).
54chen,t.etal.m(6)arnamethylationisregulatedbymicrornasandpromotesreprogrammingtopluripotency.cellstemcell16,289-301(2015).
55alarcon,c.r.,lee,h.,goodarzi,h.,halberg,n.&tavazoie,s.f.n6-methyladenosinemarksprimarymicrornasforprocessing.nature519,482-485(2015).
56xiao,w.etal.nuclearm(6)areaderythdc1regulatesmrnasplicing.molecularcell61,507-519(2016).
57wojtas,m.n.etal.regulationofm6atranscriptsbythe3'-->5'rnahelicaseythdc2isessentialforasuccessfulmeioticprograminthemammaliangermline.molecularcell68,374-387e312(2017).
58ivanova,i.etal.thernam6areaderythdf2isessentialforthepost-transcriptionalregulationofthematernaltranscriptomeandoocytecompetence.molecularcell67,1059-1067e1054(2017).
59fustin,j.m.etal.rna-methylation-dependentrnaprocessingcontrolsthespeedofthecircadianclock.cell155,793-806(2013).
60slobodin,b.etal.transcriptionimpactstheefficiencyofmrnatranslationviaco-transcriptionaln6-adenosinemethylation.cell169,326-337e312(2017).
61schwartz,s.etal.transcriptome-widemappingrevealswidespreaddynamic-regulatedpseudouridylationofncrnaandmrna.cell159,148-162(2014).
62pendleton,k.e.etal.theu6snrnam6amethyltransferasemettl16regulatessamsynthetaseintronretention.cell169,824-835e814(2017).
63shi,h.etal.ythdf3facilitatestranslationanddecayofn6-methyladenosine-modifiedrna.cellresearch27,315-328(2017).
64huang,h.etal.recognitionofrnan(6)-methyladenosinebyigf2bpproteinsenhancesmrnastabilityandtranslation.naturecellbiology20,285-295(2018).
65bertero,a.etal.thesmad2/3interactomerevealsthattgfbetacontrolsm(6)amrnamethylationinpluripotency.nature(2018).
66liu,n.etal.n(6)-methyladenosine-dependentrnastructuralswitchesregulaterna-proteininteractions.nature518,560-564(2015).
67joseph,c.etal.decipheringhematopoieticstemcellsintheirniches:acriticalappraisalofgeneticmodels,lineagetracing,andimagingstrategies.cellstemcell13,520-533(2013).
68barbieri,i.etal.promoter-boundmettl3maintainsmyeloidleukaemiabym(6)a-dependenttranslationcontrol.nature(2017).
69he,s.,nakada,d.&morrison,s.j.mechanismsofstemcellself-renewal.annualreviewofcellanddevelopmentalbiology25,377-406(2009).
70qian,p.etal.thedlk1-gtl2locuspreserveslt-hscfunctionbyinhibitingthepi3k-mtorpathwaytorestrictmitochondrialmetabolism.cellstemcell18,214-228(2016).
71he,x.c.etal.homingandmigrationassaysofhematopoieticstem/progenitorcells.methodsinmolecularbiology1185,279-284(2014).
72hu,y.&smyth,g.k.elda:extremelimitingdilutionanalysisforcomparingdepletedandenrichedpopulationsinstemcellandotherassays.journalofimmunologicalmethods347,70-78(2009).
73purton,l.e.&scadden,d.t.limitingfactorsinmurinehematopoieticstemcellassays.cellstemcell1,263-270(2007).
74perry,j.m.etal.cooperationbetweenbothwnt/{beta}-cateninandpten/pi3k/aktsignalingpromotesprimitivehematopoieticstemcellself-renewalandexpansion.genes&development25,1928-1942(2011).
75simsek,d.etal.themammalianribo-interactomerevealsribosomefunctionaldiversityandheterogeneity.cell169,1051-1065e1018(2017).
76acar,m.,kocherlakota,k.s.,murphy,m.m.,peyer,j.g.,oguro,h.,inra,c.n.,jaiyeola,c.,zhao,z.,luby-phelps,k.,andmorrison,s.j.(2015).deepimagingofbonemarrowshowsnon-dividingstemcellsaremainlyperisinusoidal.nature526,126-130.
77arai,f.,hirao,a.,ohmura,m.,sato,h.,matsuoka,s.,takubo,k.,ito,k.,koh,g.y.,andsuda,t.(2004).tie2/angiopoietin-1signalingregulateshematopoieticstemcellquiescenceinthebonemarrowniche.cell118,149-161.
78beerman,i.,seita,j.,inlay,m.a.,weissman,i.l.,androssi,d.j.(2014).quiescenthematopoieticstemcellsaccumulatednadamageduringagingthatisrepaireduponentryintocellcycle.cellstemcell15,37-50.
79benveniste,p.,frelin,c.,janmohamed,s.,barbara,m.,herrington,r.,hyam,d.,andiscove,n.n.(2010).intermediate-termhematopoieticstemcellswithextendedbuttime-limitedreconstitutionpotential.cellstemcell6,48-58.
80benz,c.,copley,m.r.,kent,d.g.,wohrer,s.,cortes,a.,aghaeepour,n.,ma,e.,mader,h.,rowe,k.,day,c.,eta!.(2012).hematopoieticstemcellsubtypesexpanddifferentiallyduringdevelopmentanddisplaydistinctlymphopoieticprograms.cellstemcell10,273-283.
81bowers,m.,zhang,b.,ho,y.,agarwal,p.,chen,c.c.,andbhatia,r.(2015).osteoblastablationreducesnormallong-termhematopoieticstemcellself-renewalbutacceleratesleukemiadevelopment.blood125,2678-2688.
82bruns,i.,lucas,d.,pinho,s.,ahmed,j.,lambert,m.p.,kunisaki,y.,scheiermann,c.,schiff,l.,poncz,m.,bergman,a.,eta!.(2014).megakaryocytesregulatehematopoieticstemcellquiescencethroughcxcl4secretion.natmed20,1315-1320.
83calvi,l.m.,adams,g.b.,weibrecht,k.w.,weber,j.m.,olson,d.p.,knight,m.c.,martin,r.p.,schipani,e.,divieti,p.,bringhurst,f.r.,eta!.(2003).osteoblasticcellsregulatethehaematopoieticstemcellniche.nature425,841-846.
84chen,j.y.,miyanishi,m.,wang,s.k.,yamazaki,s.,sinha,r.,kao,k.s.,seita,j.,sahoo,d.,nakauchi,h.,andweissman,i.l.(2016).hoxb5markslong-termhaematopoieticstemcellsandrevealsahomogenousperivascularniche.nature530,223-227.
85dacic,s.,kalajzic,i.,visnjic,d.,lichtler,a.c.,androwe,d.w.(2001).col1a1-driventransgenicmarkersofosteoblastlineageprogression.jboneminerres16,1228-1236.
86ding,l.,andmorrison,s.j.(2013).haematopoieticstemcellsandearlylymphoidprogenitorsoccupydistinctbonemarrowniches.nature495,231-235.
87ding,l.,saunders,t.l.,enikolopov,g.,andmorrison,s.j.(2012).endothelialandperivascularcellsmaintainhaematopoieticstemcells.nature481,457-462.
88dominici,m.,rasini,v.,bussolari,r.,chen,x.,hofmann,t.j.,spano,c.,bernabei,d.,veronesi,e.,bertoni,f.,paolucci,p.,eta!.(2009).restorationandreversibleexpansionoftheosteoblastichematopoieticstemcellnicheaftermarrowradioablation.blood114,2333-2343.
89fleming,w.h.,alpern,e.j.,uchida,n.,ikuta,k.,spangrude,g.j.,andweissman,i.l.(1993).functionalheterogeneityisassociatedwiththecellcyclestatusofmurinehematopoieticstemcells.thejournalofcellbiology122,897-902.
90foudi,a.,hochedlinger,k.,vanburen,d.,schindler,j.w.,jaenisch,r.,carey,v.,andhock,h.(2008).analysisofhistone2b-gfpretentionrevealsslowlycyclinghematopoieticstemcells.naturebiotechnology.
91gazit,r.,mandal,p.k.,ebina,w.,ben-zvi,a.,nombela-arrieta,c.,silberstein,l.e.,androssi,d.j.(2014).fgd5identifieshematopoieticstemcellsinthemurinebonemarrow.thejournalofexperimentalmedicine211,1315-1331.
92greenbaum,a.,hsu,y.m.,day,r.b.,schuettpelz,l.g.,christopher,m.j.,borgerding,j.n.,nagasawa,t.,andlink,d.c.(2013).cxcl12inearlymesenchymalprogenitorsisrequiredforhaematopoieticstem-cellmaintenance.nature495,227-230.
93haug,j.s.,he,x.c.,grindley,j.c.,wunderlich,j.p.,gaudenz,k.,ross,j.t.,paulson,a.,wagner,k.p.,xie,y.,zhu,r.,eta!.(2008).n-cadherinexpressionleveldistinguishesreservedversusprimedstatesofhematopoieticstemcells.cellstemcell2,367-379.
94hooper,a.t.,butler,j.m.,nolan,d.j.,kranz,a.,iida,k.,kobayashi,m.,kopp,h.g.,shido,k.,petit,i.,yanger,k.,eta!.(2009).engraftmentandreconstitutionofhematopoiesisisdependentonvegfr2-mediatedregenerationofsinusoidalendothelialcells.cellstemcell4,263-274.
95itkin,t.,gur-cohen,s.,spencer,j.a.,schajnovitz,a.,ramasamy,s.k.,kusumbe,a.p.,ledergor,g.,jung,y.,milo,i.,poulos,m.g.,eta!.(2016).corrigendum:distinctbonemarrowbloodvesselsdifferentiallyregulatehaematopoiesis.nature538,274.
96kiel,m.j.,yilmaz,o.h.,iwashita,t.,terhorst,c.,andmorrison,s.j.(2005).slamfamilyreceptorsdistinguishhematopoieticstemandprogenitorcellsandrevealendothelialnichesforstemcells.cell121,1109-1121.
97kunisaki,y.,bruns,i.,scheiermann,c.,ahmed,j.,pinho,s.,zhang,d.,mizoguchi,t.,wei,q.,lucas,d.,ito,k.,eta!.(2013).arteriolarnichesmaintainhaematopoieticstemcellquiescence.nature.
98lerner,c.,andharrison,d.e.(1990).5-fluorouracilspareshemopoieticstemcellsresponsibleforlongtermrepopulation.experimentalhematology18,114-118.
99li,l.,andclevers,h.(2010).coexistenceofquiescentandactiveadultstemcellsinmammals.science(newyork,ny327,542-545.
100longley,d.b.,harkin,d.p.,andjohnston,p.g.(2003).5-fluorouracil:mechanismsofactionandclinicalstrategies.naturereviewscancer3,330-338.
101mendelson,a.,andfrenette,p.s.(2014).hematopoieticstemcellnichemaintenanceduringhomeostasisandregeneration.natmed20,833-846.
102mendez-ferrer,s.,michurina,t.v.,ferraro,f.,mazloom,a.r.,macarthur,b.d.,lira,s.a.,scadden,d.t.,ma'ayan,a.,enikolopov,g.n.,andfrenette,p.s.(2010).mesenchymalandhaematopoieticstemcellsformauniquebonemarrowniche.nature466,829-834.
103morita,y.,ema,h.,andnakauchi,h.(2010).heterogeneityandhierarchywithinthemostprimitivehematopoieticstemcellcompartment.thejournalofexperimentalmedicine207,1173-1182.morrison,s.j.,andscadden,d.t.(2014).thebonemarrownicheforhaematopoieticstemcells.nature505,327-334.
104nilsson,s.k.,johnston,h.m.,andcoverdale,j.a.(2001).spatiallocalizationoftransplantedhemopoieticstemcells:inferencesforthelocalizationofstemcellniches.blood97,2293-2299.
105park,b.,nguyen,n.t.,dutt,p.,merdek,k.d.,bashar,m.,sterpetti,p.,tosolini,a.,testa,j.r.,andtoksoz,d.(2002).associationoflbcrhoguaninenucleotideexchangefactorwithalpha-catenin-relatedprotein,alpha-catulin/ctnnal1,supportsserumresponsefactoractivation.thejournalofbiologicalchemistry277,45361-45370.
106qian,p.,he,x.c.,paulson,a.,li,z.,tao,f.,perry,j.m.,guo,f.,zhao,m.,zhi,l.,venkatraman,a.,eta!.(2015).thedlk1-gtl2locuspreserveslt-hscfunctionbyinhibitingthepi3k-mtorpathwaytorestrictmitochondrialmetabolism.cellstemcell.
107raghunath,j.,salacinski,h.j.,sales,k.m.,butler,p.e.,andseifalian,a.m.(2005).advancingcartilagetissueengineering:theapplicationofstemcelltechnology.currentopinioninbiotechnology16,503509.
108rodina,a.,wang,t.,yan,p.,gomes,e.d.,dunphy,m.p.,pillarsetty,n.,koren,j.,gerecitano,j.f.,taldone,t.,zong,h.,eta!.(2016).theepichaperomeisanintegratedchaperomenetworkthatfacilitatestumoursurvival.nature538,397-401.
109sanjuan-pla,a.,macaulay,i.c.,jensen,c.t.,woll,p.s.,luis,t.c.,mead,a.,moore,s.,carella,c.,matsuoka,s.,jones,t.b.,eta!.(2013).platelet-biasedstemcellsresideattheapexofthehaematopoieticstem-cellhierarchy.nature.
110scadden,d.t.(2014).niceneighborhood:emergingconceptsofthestemcellniche.cell157,41-50.schofield,r.(1978).therelationshipbetweenthespleencolony-formingcellandthehaemopoieticstemcell.bloodcells4,7-25.
111sophiafox,a.j.,bedi,a.,androdeo,s.a.(2009).thebasicscienceofarticularcartilage:structure,composition,andfunction.sportshealth1,461-468.
112sugimura,r.,he,x.c.,venkatraman,a.,arai,f.,box,a.,semerad,c.,haug,j.s.,peng,l.,zhong,x.b.,suda,t.,eta!.(2012).noncanonicalwntsignalingmaintainshematopoieticstemcellsintheniche.cell150,351-365.
113sugiyama,t.,kohara,h.,noda,m.,andnagasawa,t.(2006).maintenanceofthehematopoieticstemcellpoolbycxcl12-cxcr4chemokinesignalinginbonemarrowstromalcellniches.immunity25,977988.
114takubo,k.,nagamatsu,g.,kobayashi,c.i.,nakamura-ishizu,a.,kobayashi,h.,ikeda,e.,goda,n.,rahimi,y.,johnson,r.s.,soga,t.,eta!.(2013).regulationofglycolysisbypdkfunctionsasametaboliccheckpointforcellcyclequiescenceinhematopoieticstemcells.cellstemcell12,49-61.
115venkatraman,a.,he,x.c.,thorvaldsen,j.l.,sugimura,r.,perry,j.m.,tao,f.,zhao,m.,christenson,m.k.,sanchez,r.,yu,j.y.,eta!.(2013).maternal-imprintingath19-igf2locusmaintainsadulthematopoieticstemcellquiescence.nature500,345-349.
116wagers,a.j.,andweissman,i.l.(2005).differentialexpressionof{alpha}2integrinseparateslong-termandshort-termreconstitutinglin-/lothy1.1loc-kit+sca-1+hematopoieticstemcells.stemcells(dayton,ohio).walter,d.,lier,a.,geiselhart,a.,thalheimer,f.b.,huntscha,s.,sobotta,m.c.,moehrle,b.,brocks,d.,bayindir,i.,kaschutnig,p.,eta!.(2015).exitfromdormancyprovokesdna-damage-inducedattritioninhaematopoieticstemcells.nature520,549-552.
117weissman,i.l.(2000).stemcells:unitsofdevelopment,unitsofregeneration,andunitsinevolution.cell100,157-168.
118wilson,a.,laurenti,e.,oser,g.,vanderwath,r.c.,blanco-bose,w.,jaworski,m.,offner,s.,dunant,c.f.,eshkind,l.,bockamp,e.,eta!.(2008).hematopoieticstemcellsreversiblyswitchfromdormancytoself-renewalduringhomeostasisandrepair.cell135,1118-1129.
119xie,y.,yin,t.,wiegraebe,w.,he,x.c.,miller,d.,stark,d.,perko,k.,alexander,r.,schwartz,j.,grindley,j.c.,eta!.(2009).detectionoffunctionalhaematopoieticstemcellnicheusingreal-timeimaging.nature457,97-101.
120yamazaki,s.,ema,h.,karlsson,g.,yamaguchi,t.,miyoshi,h.,shioda,s.,taketo,m.m.,karlsson,s.,iwama,a.,andnakauchi,h.(2011).nonmyelinatingschwanncellsmaintainhematopoieticstemcellhibernationinthebonemarrowniche.cell147,1146-1158.
121yang,g.,zhu,l.,hou,n.,lan,y.,wu,x.m.,zhou,b.,teng,y.,andyang,x.(2014).osteogenicfateofhypertrophicchondrocytes.cellresearch24,1266-1269.
122yang,l.,bryder,d.,adolfsson,j.,nygren,j.,mansson,r.,sigvardsson,m.,andjacobsen,s.e.(2005).identificationoflin(-)sca1(+)kit(+)cd34(+)flt3-short-termhematopoieticstemcellscapableofrapidlyreconstitutingandrescuingmyeloablatedtransplantrecipients.blood105,2717-2723.
123zhang,j.,niu,c.,ye,l.,huang,h.,he,x.,tong,w.g.,ross,j.,haug,j.,johnson,t.,feng,j.q.,eta!.(2003).identificationofthehaematopoieticstemcellnicheandcontrolofthenichesize.nature425,836-841.
124zhao,m.,perry,j.m.,marshall,h.,venkatraman,a.,qian,p.,he,x.c.,ahamed,j.,andli,l.(2014).megakaryocytesmaintainhomeostaticquiescenceandpromotepost-injuryregenerationofhematopoieticstemcells.natmed20,1321-1326.
125zhou,b.o.,yu,h.,yue,r.,zhao,z.,rios,j.j.,naveiras,o.,andmorrison,s.j.(2017).bonemarrowadipocytespromotetheregenerationofstemcellsandhaematopoiesisbysecretingscf.naturecellbiology19,891-903.
126zhou,f.,li,x.,wang,w.,zhu,p.,zhou,j.,he,w.,ding,m.,xiong,f.,zheng,x.,li,z.,eta!.(2016).tracinghaematopoieticstemcellformationatsingle-cellresolution.nature533,487-492.
表s1
表s1.hspc中m6a标记了对hsc自我更新和维持至关重要的关键转录因子。
gata2
gfi1
pbx1
lmo2
etv6
erg
runx1
tal1
hoxa9
meis1
kmt2a
kmt2b
kmt2c
kmt2d
bmi1
sox4
evi1
stat3
stat5a
hoxb4
zfx
foxo3
foxp1
表s2
表s2.来自三个irclip-seq重复的ythdf2靶向mrna
表s4
表s4.用于计算cru的人供体来源的嵌合性的百分比
*对照10k组也移植7只小鼠。但是,2只小鼠在分析时间点之前死亡,部分是由于造血恢复缺陷。
表s4(续)
表s5
表s5.用于验证wt和ythdf2kohspc中转录因子表达水平的qpcr引物。
- 还没有人留言评论。精彩留言会获得点赞!