一种替芬泰片剂及其制备方法与流程
本发明涉及抗乙肝药物技术领域,特别是一种替芬泰片剂及其制备方法。
背景技术:
治疗乙肝的常用药物有拉米夫定、恩替卡韦、替诺福韦,拉米夫定的抗病毒能力差,不能将乙肝病毒彻底清除,无法根治,停药后容易复发,容易产生耐药性;恩替卡韦抗病毒能力稍强,但其存在一定的耐药性和毒性,同时存在患者依从性低的缺点;替诺福韦的抗病毒能力虽强,但其具有肾脏损伤的风险,特别是对于有基础肾脏病、有糖尿病、高血压患者,会增加肾脏损伤的风险,具有患者依从性低的缺点。
替芬泰的体外抗病毒试验表明替芬泰对hbsag和hbv-dna有明显的抑制作用,抑制强度有量效关系。替芬泰的拉米夫定和恩替卡韦耐药a64细胞试验证明,替芬泰对拉米夫定和恩替卡韦等核苷类药物耐药细胞显示良好的抗乙肝效果。用替芬泰做dhbv感染的鸭试验,替芬泰有明显的抗乙肝病毒效果,并无明显停药后反跳现象。通过初步作用机制研究,替芬泰抗乙肝病毒的作用不是通过pgrna的表达或抑制dna聚合酶的活性实现,而是通过抑制细胞内cccdna的表达实现。此外,替芬泰对不同化学性肝损伤均有较好的保肝降酶效果,且优于核苷类药物。替芬泰适用于伴有丙氨酸氨基转移酶[alt]升高和病毒活动复制的肝功能代偿以及对拉米夫定、恩替卡韦等核苷类药物耐药的成年慢性乙型肝炎病人的治疗。
替芬泰{n-[n-苯甲酰基-o-(2-二甲氨基乙基)-l-酪氨酰基]-l-苯丙氨醇},其结构式如附图3所示,替芬泰具有二肽的化学骨架,与核苷药物和干扰素等药物的化学骨架不同,具有较强的抗乙肝病毒的活性。
对替芬泰进行的药学、药效学、药代动力学和毒理学等临床前研究结果表明替芬泰体内外均有抗hbv作用,重复性好,具有良好的量效关系和时效关系,作用机制明确,停药后不易反弹,对核苷类似物耐药病毒株有效,优于核苷类似物,未发现对心、肝、肾等大器官的副作用,安全性好,样品稳定,质量可控。
综上所述,常用的乙肝治疗药物,不能兼具抗病毒能力强、停药不反弹、对心肝肾无毒副作用,患者依从性高、不产生耐药性的特点,而现有技术中未见替芬泰用于制作乙肝治疗药物。
技术实现要素:
本发明的目的,在于提供了一种替芬泰片剂及其制备方法。本发明中的替芬泰片剂具有抗病毒能力强、停药不反弹、对心肝肾无毒副作用、患者依从性高、不产生耐药性的特点,本发明中的制备方法简单,重现性好,制得的替芬泰片剂稳定性好。
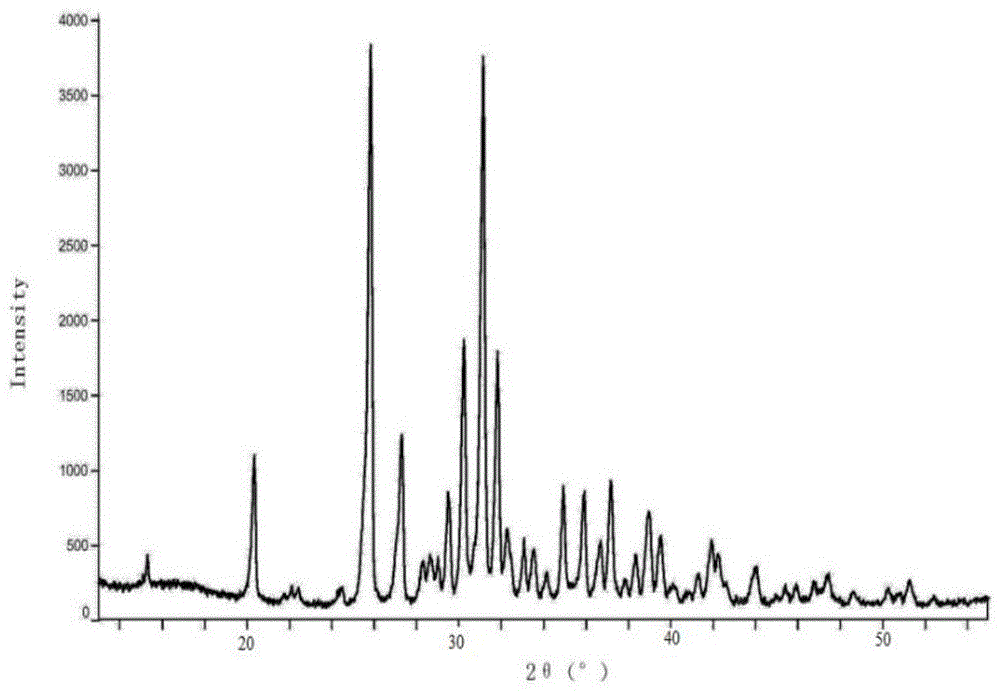
本发明的技术方案:一种替芬泰片剂,由以下重量份的原料制得,晶型替芬泰250-320份,稀释剂180~250份,崩解剂20-30份,粘合剂7-12份,润滑剂2.5-6份,所述晶型替芬泰的xrpd图谱在2θ为15.3±0.2°、20.3±0.2°、24.4±0.2°、25.8±0.2°、37.3±0.2°、28.3±0.2°、28.7±0.2°、29.0±0.2°、29.6±0.2°、30.3±0.2°、31.2±0.2°、31.9±0.2°、32.4±0.2°、33.0±0.2°、33.5±0.2°、34.2±0.2°、34.9±0.2°、35.9±0.2°、36.6±0.2°、37.2±0.2°、38.3±0.2°、38.9±0.2°、39.5±0.2°、41.9±0.2°、42.3±0.2°、44.0±0.2°、46.8±0.2°、47.4±0.2°、51.3±0.2°处具有衍射峰,所述晶型替芬泰的dsc特征峰位于175.8~176.9℃。
前述的替芬泰片剂中,所述稀释剂选自无水乳糖、微晶纤维素、麦芽糊精中的一种或多种。
前述的替芬泰片剂中,所述崩解剂选自低取代羟丙基纤维素、羧甲基淀粉钠、交联羧甲基纤维素钠中的一种或几种。
前述的替芬泰片剂中,所述粘合剂选自羟丙基纤维素、聚乙烯吡咯烷酮、交联聚乙烯基吡咯烷酮中的一种或几种。
前述的替芬泰片剂中,所述润滑剂选自硬脂酸镁、滑石粉、硬脂酸富马酸钠、微粉硅胶中的一种或几种。
前述的替芬泰片剂中,所述晶型替芬泰的xrpd图谱如附图1所示,所述晶型替芬泰的dsc图如附图2所示。
前述的替芬泰片剂中,所述晶型替芬泰的制备方法为,
将替芬泰粗品溶解于乙醇中,所述替芬泰粗品中替芬泰的含量为94%以上,至替芬泰粗品与乙醇的配比为1:7-10g/ml;于60-90℃条件下,滴加石油醚,至有固体析出时停止滴加石油醚;静置至析出类白色固体;将类白色固体过滤,真空干燥得到白色粉末即为晶型替芬泰。
前述的替芬泰片剂中,所述替芬泰粗品与乙醇的配比为1:6.7g/ml。
前述的替芬泰片剂的制备方法,包括以下步骤,将晶型替芬泰粉碎过150-250目筛;将稀释剂和崩解剂预处理,使其水分含量在1.5%以下;将晶型替芬泰、稀释剂和崩解剂混合均匀,加入粘合剂,湿法制粒,干燥;加入润滑剂混合均匀,压片即得。
前述的替芬泰片剂的制备方法中,所述粘合剂为质量分数为6%-10%的水溶液。
与现有技术比较,本发明以特定晶型的替芬泰为原料,制得的替芬泰片剂具有抗病毒能力强、停药不反弹、对心肝肾无毒副作用、患者依从性高、不产生耐药性的特点,为乙肝患者用药提供了更好的选择。本发明中特定晶型的替芬泰原料溶液在温度40℃±2℃、相对湿度为75%±5%条件下放置6个月后,其溶液澄清度没有下降;溶液中的物质也没有明显变化,溶液中的成份与0月相比几乎没有增加,本发明中特定晶型的替芬泰原料具有非常好的稳定性;本发明中替芬泰的相对安全剂量是片剂中的替芬泰含量的18-30倍,安全性高,相对于乙型肝炎临床常用药物核苷类抗病毒药物、干扰素等具有耐药性或肾毒性或骨髓抑制而言,替芬泰未发现对心、肝、肾等大器官的副作用,这是替芬泰在安全性上最大的优势,这对于长期服药的乙型肝炎病人,特别是乙型肝炎肾功能异常的病人又多了一种服药选择;本发明中替芬泰片剂的稳定性好,有效期达24个月;本发明中晶型替芬泰的制备方法简单,重现性好,制得的晶型替芬泰稳定性好;本发明中替芬泰片剂的制备方法简单,重现性好,易于工业化生产。因此,本发明中的替芬泰片剂具有抗病毒能力强、停药不反弹、对心肝肾无毒副作用、患者依从性高、不产生耐药性的特点,本发明中的制备方法简单,重现性好,制得的替芬泰片剂稳定性好。
附图说明
图1为替芬泰片剂中晶型替芬泰的x-粉末衍射图;
图2为替芬泰片剂中晶型替芬泰的dsc图;
图3为替芬泰的结构式;
图4为替芬泰片剂在ph6.8的磷酸盐缓冲液中的溶出时间与溶出量的关系图;
图5为替芬泰片剂在ph4.5的磷酸盐缓冲液中的溶出时间与溶出量的关系图;
图6为替芬泰片剂在ph1.0的盐酸溶液中的溶出时间与溶出量的关系图;
图7为替芬泰片剂在水中的溶出时间与溶出量的关系图;
图8为01批替芬泰片剂的溶出时间与溶出量的关系图;
图9为02批替芬泰片剂的溶出时间与溶出量的关系图;
图10为03批替芬泰片剂的溶出时间与溶出量的关系图。
具体实施方式
下面结合附图和实施例对本发明作进一步的说明,但并不作为对本发明限制的依据。
实施例1。
晶型替芬泰的制备
将替芬泰粗品(替芬泰含量94%以上)溶解于乙醇中,所述替芬泰粗品的重量为100g,所述乙醇的配比为750ml,然后滴加石油醚(60~90℃),当发现有固体析出时停止滴加石油醚(60~90℃),上述反应液静止至得到类白色固体,将类白色固体过滤,真空干燥得到白色粉末即为晶型替芬泰(标记为晶型替芬泰01号样品)85.8g,收率85.8%。
该晶型替芬泰的x射线粉末衍射图中,在反射角2θ为15.3°、20.3°、24.4、25.8°、37.3°、28.3°、28.7°、29.0°、29.6°、30.3°、31.2°、31.9±0.2°、32.4°、33.0°、33.5°、34.2°、34.9°、35.9±0.2°、36.6±0.2°、37.2±0.2°、38.3°、38.9°、39.5°、41.9°、42.3°、44.0°、46.8°、47.4°、51.3°处具有衍射峰,xprd图谱如图1所示:dsc特征峰位于175.8~176.9℃,其dsc图如图2所示。
实施例2。
晶型替芬泰的制备
将替芬泰粗品(替芬泰含量94%以上)溶解于乙醇中,所述替芬泰粗品的重量为100g,所述乙醇的配比为900ml,然后滴加石油醚(60~90℃),当发现有固体析出时停止滴加石油醚(60~90℃),上述反应液静止至得到类白色固体,将类白色固体过滤,真空干燥得到白色粉末即为晶型替芬泰84.7g(标记为晶型替芬泰02号样品),收率84.4%。
该晶型替芬泰的x射线粉末衍射图中,在反射角2θ为15.3°、20.3°、24.4、25.8°、37.3°、28.3°、28.7°、29.0°、29.6°、30.3°、31.2°、31.9±0.2°、32.4°、33.0°、33.5°、34.2°、34.9°、35.9±0.2°、36.6±0.2°、37.2±0.2°、38.3°、38.9°、39.5°、41.9°、42.3°、44.0°、46.8°、47.4°、51.3°处具有衍射峰,xprd图谱如图1所示:dsc特征峰位于175.8~176.9℃,其dsc图如图2所示。
实施例3。
晶型替芬泰的制备
将替芬泰粗品(替芬泰含量94%以上)溶解于乙醇中,所述替芬泰粗品的重量为100g,所述乙醇的配比为950ml,然后滴加石油醚(60~90℃),当发现有固体析出时停止滴加石油醚(60~90℃),上述反应液静止至得到类白色固体,将类白色固体过滤,真空干燥得到白色粉末即为晶型替芬泰85.7g(标记为晶型替芬泰03号样品),收率85.6%。
该晶型替芬泰的x射线粉末衍射图中,在反射角2θ为15.3°、20.3°、24.4、25.8°、37.3°、28.3°、28.7°、29.0°、29.6°、30.3°、31.2°、31.9±0.2°、32.4°、33.0°、33.5°、34.2°、34.9°、35.9±0.2°、36.6±0.2°、37.2±0.2°、38.3°、38.9°、39.5°、41.9°、42.3°、44.0°、46.8°、47.4°、51.3°处具有衍射峰,xprd图谱如图1所示:dsc特征峰位于175.8~176.9℃,其dsc图如图2所示。
实施例4。
替芬泰片剂
替芬泰片剂,按表1处方的原料制得1500片片剂:
表1替芬泰片剂处方1
替芬泰片剂的制备方法
替芬泰片剂的制备方法,包括以下步骤:将晶型替芬泰粉碎过150目筛;将稀释剂和崩解剂预处理,使其水分含量在1.5%以下;将晶型替芬泰、稀释剂和崩解剂混合均匀,加入粘合剂,湿法制粒,干燥;加入润滑剂混合均匀,压片即得(标记为片剂01批)。
实施例5。
替芬泰片剂,按表2处方的原料制得1500片片剂:
表2替芬泰片剂处方2
替芬泰片剂的制备方法
替芬泰片剂的制备方法,包括以下步骤:将晶型替芬泰粉碎过200目筛;将稀释剂和崩解剂预处理,使其水分含量在1.5%以下;将晶型替芬泰、稀释剂和崩解剂混合均匀,加入粘合剂,湿法制粒,干燥;加入润滑剂混合均匀,压片即得(标记为片剂02批)。
实施例6。
替芬泰片剂,按表3处方的原料制得1500片片剂:
表3替芬泰片剂处方3
替芬泰片剂的制备方法
替芬泰片剂的制备方法,包括以下步骤:将晶型替芬泰粉碎过250目筛;将稀释剂和崩解剂预处理,使其水分含量在1.5%以下;将晶型替芬泰、稀释剂和崩解剂混合均匀,加入粘合剂,湿法制粒,干燥;加入润滑剂混合均匀,压片即得(标记为片剂03批)。
试验例1。
晶型替芬泰的稳定性试验
根据(中国药典2015年版四部通则9001)相关规定对本发明中晶型替芬泰进行了加速试验。在温度40℃±2℃、相对湿度为75%±5%条件下放置6个月,分别于第0、1、2、3、6个月末分别取样,有关物质的变化情况,结果见表4:
表4晶型替芬泰的稳定性试验结果
以上结果表明,本发明中的晶型替芬泰在温度40℃±2℃、相对湿度为75%±5%条件下放置6个月后,有关物质没有明显变化,基本没有增加,说明本发明所述片剂中的晶型替芬泰具有非常好的稳定性。
试验例2。
将01批-03批片剂分别在900mlph6.8的磷酸盐缓冲液、ph4.5的磷酸盐缓冲液、0.1mol/l盐酸溶液、水(中国药典2015版)中测定溶出度,采用中国药典2015版四部溶出度测定法第二法(桨法)测定,转速设定为50rpm,温度设定为37℃,分别测定10min的溶出度。检测结果如表5所示,溶出时间与溶出量的关系见图4-图7:
表5将01批-03批片剂在相应介质中的溶出时间与溶出量关系图
将01批-03批片剂做溶出度全检测试,全检结果汇总如表6所示:三批供试品片质量均一,溶出时间与溶出量的关系见图8-图10。
表601批-03批片剂溶出度全检测试结果
本申请人对三批供试品的中试放大试验表明,本研究确立的处方与工艺重现性良好,不同批次片剂的溶出曲线一致,其他指标也完全一致三批供试品片质量均一。
综上所述,申请人认为本制剂的处方合理,工艺简单,质量可靠,是很好的临床用药选择。
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员当可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!