一种生物活性玻璃复合支架及应用的制作方法
本发明属于骨组织工程支架领域,具体涉及一种生物活性玻璃复合支架及应用。
背景技术:
眼眶爆裂性骨折是指大于眶口的物体钝性作用于眼眶,使眶底和(或)眶内壁薄弱处发生骨折和碎裂,但眶缘连续性保持完整,眶内容疝出至上颌窦和(或)筛窦内,导致眼球内陷和移位、眼球运动障碍、复视、眶下神经支配区感觉异常、甚至视力下降等。眼眶爆裂性骨折这一概念,是1957年由smith和regan首次提出。随着社会发展和生活节奏的改变,交通事故、拳击打击、户外运动伤等各种因素所致眼眶爆裂性骨折数量的增加已经引起了教育部及卫生部的重视。
目前,其治疗方法包括保守治疗和手术治疗。对于损伤轻,复视及眼球内陷程度为轻度,未伴有明显运动障碍等并发症的患者,通过应用激素、抗生素等药物抗炎消肿保守治疗,多可自行恢复。当影像学检查显示软组织嵌顿或出现复视、眼球运动受限、眼球突出等症状时,必须行手术治疗。通过植入植入体,对眼眶结构进行重建,恢复正常眶腔容积和眼球运动。植入体的选择上可分为自体骨、异体骨和人工骨。自体骨移植是治疗骨缺损的“金标准”,表现出良好的骨传导性、骨诱导性和成骨特性,但供体骨来源有限,且对患者造成二次创伤限制了其在临床上的应用。异体骨具有与自体骨相似的特性,但移植物内存在异体细胞,因此必须脱矿质和去抗原化才可被使用,同时也存在包括骨折、不愈合、感染和病毒性疾病转移等问题,此外免疫原性反应以及毛细血管浸润不良可能导致新组织生长延迟。人工骨支架材料为骨缺损治疗提供了新思路,然而目前科研和临床上使用的骨修复材料均存在不足。
支架作为人工骨的基本要素,除了需要具有良好的三维贯通孔结构、良好的生物相容性、可控的生物降解能力、一定的机械性能,同时还应具有骨传导、骨诱导和促进血管生成等功能。目前单一材料制备的支架难以同时具备多种功能,所以复合材料支架是未来的研究方向。45s5生物活性玻璃具有良好骨传导性,具有同时结合骨组织和软组织的能力,而且具有良好的生物相容性和生物降解性,被认为是一种极具潜力的人工骨支架材料。但45s5生物活性玻璃所制备的三维多孔支架存在力学性能较脆以及缺乏骨诱导性等问题。
45s5生物活性玻璃(45wt%sio2、24.5wt%na2o、24.5wt%cao和6wt%p2o5)为1969年larryhench教授研发的,它在植入大鼠6周后,表现出具有同时粘合骨和肌肉的能力。这一玻璃成分被美国佛罗里达大学注册为45s5生物活性玻璃(bg)。它改变了生物材料领域的方向,从原来的生物惰性材料向生物活性材料转移。
技术实现要素:
本发明的目的是为了克服现有技术存在的缺点和不足,而提供一种生物活性玻璃复合支架及应用。
本发明所采取的技术手段如下:通过45s5bg粉末混合xls(硅酸镁锂)粉末通过模板复制和高温烧结法制备得到。模板复制方法是将玻璃浆料涂覆聚合物(例如聚氨酯)泡沫来制备玻璃支架的生坯。具有多孔结构的聚合物仅用作玻璃涂层的牺牲模板。将聚合物模板浸入浆料中,随后玻璃颗粒渗透并粘附到聚合物的表面上。挤出过量的浆料,在泡沫支柱上留下或多或少均匀的涂层。干燥后,高温去除聚合物模板,得到制备的玻璃支架。该方法复制了多孔聚合物泡沫的宏观结构,并在支架内产生了独特的微观结构。
所述xls粉末的百分含量为0-5wt%。
所述xls粉末的百分含量为3wt%。
具体制备步骤如下:
(1)将聚己内酯加入到碳酸二甲酯中,溶解;
(2)将45s5bg粉末和xls粉末加入到聚己内酯溶液中,得到浆液;
(3)将pu膜浸泡在该浆液中,然后挤出多余的浆液,并于烘箱中干燥,得到45s5bg生胚;
(4)将45s5bg生胚在高温下进行烧结,得到生物活性玻璃复合支架。
步骤(3)中,pu膜浸泡在该浆液中,然后挤出多余的浆液,并于烘箱中干燥后,再次浸泡到浆液中,然后挤出多余的浆液,浸泡-烘干重复2-5次。
步骤(4)中,高温烧结的过程如下:以2℃/min的速率从室温升到400℃,然后400℃保温1h,去除pu膜,接着同样以2℃/min的速率升到1000℃,并保温1h,使45s5bg生胚形成三维多孔支架,最后以5℃/min的速率降到室温,得到生物活性玻璃复合支架。
上述的生物活性玻璃复合支架作为人工骨支架材料的应用。
本发明的有益效果如下:添加硅酸镁锂后制成的生物活性玻璃复合支架具有更好的力学性能,且具有较好的骨诱导性。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,根据这些附图获得其他的附图仍属于本发明的范畴。
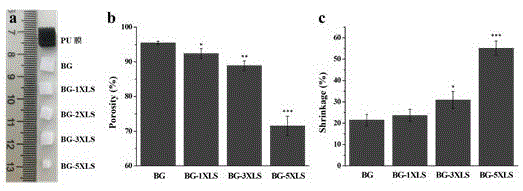
图1为bg支架和bg-xls复合支架的大体形貌(a)、孔隙率(b)、收缩率(c)(*p<0.05,**p<0.01,***p<0.001);
图2为g(a、d)、bg-1xls(b、e)和bg-3xls(c、f)支架的sem图;
图3为(a)bg-3xls支架被切割制造成各种形状;(b)各支架的机械性能(*p<0.05,**p<0.01,***p<0.001);
图4为bg支架的压缩强度曲线;
图5为bg(a、d)、bg-1xls(b、e)和bg-3xls(c、f)支架在sbf中浸泡1d和4d的sem图及能谱分析;
图6为rbmsc细胞与bg、bg-1xls和bg-3xls支架共培养1d、4d和7d的细胞生存率(*p<0.05,**p<0.01);
图7为mc3t3-e1细胞与bg(a、d)、bg-1xls(b、e)和bg-3lxs(c、f)支架共培养1d和4d的sem图;
图8为rbmsc分别在培养基(a)、bg(b)、bg-1xls(c)和bg-3xls(d)浸提液中培养7d后行alp染色。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
以下实施例、对比例所用原料均为市售所得。
实施例1,生物活性玻璃复合支架的制备:
a)将0.4g聚己内酯(pcl)加入到10ml碳酸二甲酯(dmc)中,在60℃下搅拌溶解;
b)冷却至室温,然后将4g45s5bg粉末加入到该溶液中,同时加入1wt%xls粉末搅拌均匀分散,得到45s5bg-xls浆液;
c)将预先准备好的10×10×10mm3大小的pu膜浸泡在该浆液中,然后挤出多余的浆液,并于60℃烘箱中干燥过夜,得到45s5bg生胚,如此重复两次,以增加生胚中45s5bg的含量;
d)最后经高温烧结得到bg-xls复合支架。烧结过程如下:以2℃/min的速率从室温升到400℃,然后400℃保温1h,去除pu膜,接着同样以2℃/min的速率升到1000℃,并保温1h,使45s5bg生胚形成三维多孔支架,最后以5℃/min的速率降到室温,得到生物活性玻璃复合支架(以下简称bg-1xls支架)。
实施例2,生物活性玻璃复合支架的制备:
a)将0.4g聚己内酯(pcl)加入到10ml碳酸二甲酯(dmc)中,在60℃下搅拌溶解;
b)冷却至室温,然后将4g45s5bg粉末加入到该溶液中,同时加入3wt%xls粉末搅拌均匀分散,得到45s5bg-xls浆液;
c)将预先准备好的10×10×10mm3大小的pu膜浸泡在该浆液中,然后挤出多余的浆液,并于60℃烘箱中干燥过夜,得到45s5bg生胚,如此重复两次,以增加生胚中45s5bg的含量;
d)最后经高温烧结得到bg-xls复合支架。烧结过程如下:以2℃/min的速率从室温升到400℃,然后400℃保温1h,去除pu膜,接着同样以2℃/min的速率升到1000℃,并保温1h,使45s5bg生胚形成三维多孔支架,最后以5℃/min的速率降到室温,得到生物活性玻璃复合支架(以下简称bg-3xls支架)。
实施例3,生物活性玻璃复合支架的制备:
a)将0.4g聚己内酯(pcl)加入到10ml碳酸二甲酯(dmc)中,在60℃下搅拌溶解;
b)冷却至室温,然后将4g45s5bg粉末加入到该溶液中,同时加入5wt%xls粉末搅拌均匀分散,得到45s5bg-xls浆液;
c)将预先准备好的10×10×10mm3大小的pu膜浸泡在该浆液中,然后挤出多余的浆液,并于60℃烘箱中干燥过夜,得到45s5bg生胚,如此重复两次,以增加生胚中45s5bg的含量;
d)最后经高温烧结得到bg-xls复合支架。烧结过程如下:以2℃/min的速率从室温升到400℃,然后400℃保温1h,去除pu膜,接着同样以2℃/min的速率升到1000℃,并保温1h,使45s5bg生胚形成三维多孔支架,最后以5℃/min的速率降到室温,得到生物活性玻璃复合支架(以下简称bg-5xls支架)。
对比例一,45s5生物活性玻璃支架的制备:
a)将0.4g聚己内酯(pcl)加入到10ml碳酸二甲酯(dmc)中,在60℃下搅拌溶解;
b)冷却至室温,然后将4g45s5bg粉末加入到该溶液中,搅拌均匀分散,得到45s5bg浆液;
c)将预先准备好的10×10×10mm3大小的pu膜浸泡在该浆液中,然后挤出多余的浆液,并于60℃烘箱中干燥过夜,得到45s5bg生胚,如此重复两次,以增加生胚中45s5bg的含量;
d)最后经高温烧结得到45s5bg支架。烧结过程如下:以2℃/min的速率从室温升到400℃,然后400℃保温1h,去除pu膜,接着同样以2℃/min的速率升到1000℃,并保温1h,使45s5bg生胚形成45s5bg三维多孔支架,最后以5℃/min的速率降到室温,得到45s5生物活性玻璃支架(以下简称bg支架)。
以下为对实施例1-3所得到的生物活性玻璃复合支架与对比例1所得的生物活性玻璃支架的相关性能的测试:
1.支架孔隙率和收缩率
(1)支架孔隙率检测
通过公式1和公式2计算支架孔隙率,测定时,每组测定10个样品,取平均值。
ρbg:45s5bg的密度,为2.7g/cm3;
ρxls:xls的密度,为2.53g/cm3;
n:xls的含量。
(2)支架收缩率测量
使用公式3计算支架收缩率,测定时,每组测定10个样品,取平均值。
l:支架的边长。
图1分别为支架的大体形貌(a),孔隙率(b)和收缩率(c),利用公式1和2计算得出bg支架的孔隙率为95.5%,随着xls含量的增加,复合支架的孔隙率逐渐降低,在xls为3wt%时,孔隙率为88.8%,而当xls的含量提高到5wt%时,孔隙率仅71.5%。利用公式3-2计算支架的收缩率,结果显示支架的收缩程度与支架的孔隙率呈负相关,随着xls含量的增加,支架的收缩率逐渐增大。bg支架的收缩率为21.5%,在xls为3wt%时,收缩率为30.9%,而当xls的含量提高到5wt%时,支架的收缩率为55.1%。理想情况下,三维结构的孔隙度应大于90%,以成功促进细胞粘附和生长,骨骼向内生长,营养物质的运输和代谢物的排出。而且收缩率越小越容易控制支架烧结的形状。
2.使用sem对bg、bg-1xls、bg-3xls支架进行微观形貌观察。
使用扫描电子显微镜(scanningelectronmicroscope,sem)观察bg支架微观形貌,结合sem图及nanomeasure软件计算支架孔径大小,每组样品取100个孔,求其平均值。操作步骤如下:
a)将支架用导电胶固定于铜板上;
b)然后用真空镀膜机在支架表面镀上一层金,以增加其导电性;
c)利用sem对样品形貌进行观察、拍摄(加速电压为10kv)。
如图2所示,观察到三种支架均具有良好的贯通多孔结构(a~c),bg-3xls支架的孔径直径要小于bg和bg-1xls支架,其范围为100~500μm,这将有利于细胞的长入及支架内血管的形成。图2(d~f)可观察到支架的表面具有颗粒样的外观,同时具有纳米级微孔结构,大量微孔的存在,有利于提高支架的比表面积。
3.力学性能测试
使用万能测试机对bg-1xls、bg-3xls及bg-5xls支架的压缩强度进行测试,加载速度为1mm/min,每组样品测10个,求其平均值。样品尺寸约为10×10×10mm3。
如图3(a)所示,bg-3xls复合支架可以被切割成不同的形状,以满足不同骨缺损形状的需求。图3(b)所示,bg支架的压缩模量为0.36mpa,松质骨的压缩强度在0.2~4.0mpa之间,bg支架的压缩强度落在这个范围内,但更接近下限制,不适合临床安全植入。随着xls含量的增加,压缩模量逐渐增加,当xls含量为3wt%时,压缩模量为3.55mpa,基本可以满足松质骨的要求,当xls含量达到5wt%时,支架的压缩模量可达9.91mpa。结合支架孔隙率、收缩率及力学性能数据,xls含量为3wt%为较优添加量,后续实验仅对比研究bg、bg-1xls和bg-3xls复合支架。
如图4所示,支架呈现典型的脆性材料力学行为,在应力集中部位的薄壁支柱破裂时,表现出表观应力的突然下降,支架作为一个整体,当其他部位的薄壁支柱成为新的受力点时,出现表观应力的突然上升,表现为典型的锯齿样外观。
4.体外羟基磷灰石形成实验
sbf溶液的配置:
a)依次将7.995gnacl,0.353gnahco3,0.224gkcl,0.228gk2hpo4•3h2o,0.305gmgcl2•6h2o和0.071gna2so4搅拌溶于350ml超纯水中,待上一种试剂完全溶解后再加入下一种试剂;
b)然后将溶有6.118gtris的20ml1mol/l的hcl倒入上诉溶液;
c)再缓慢加入溶有0.277gcacl2的溶液,快速搅拌;
d)最后用1mol/l的hcl调节ph值至7.4,并定容到1l。置于4℃保存。
实验步骤:
支架分三组(1d、4d和7d组),每组10个,分别浸泡于装有10mlsbf溶液的聚四氟乙烯瓶中,置于37℃、60rpm的摇床,每两天换一次sbf,分别于不同的时间点(1、4和7d)取出支架,用乙醇和超纯水冲洗,干燥后进行sem观察。
图5(a~c)所示,支架浸泡在sbf中1d时,所有支架表面均有类磷灰石晶体形成,虽然晶体形成的方式有所不同,相对于bg支架bg-3xls复合支架晶体的数量更加的多也更加的小,但在第4d时(d~f),所有的支架都可以观察到典型的花菜样羟基磷灰石形成,能谱结果显示钙与磷的比值约为1.5:1,与人体的羟基磷灰石比例类似,表明xls的添加不会干扰磷灰石的形成。
5.支架浸提液的提取
bg、xls-sint和bg-1xls、bg-3xls支架按每10mg支架浸泡于1ml培养基的比例浸泡在培养基中,置于37℃、5%co2的培养箱中,同样方法,将未浸泡支架的培养基作为对照组。浸泡的培养基在第1、3、5、7d进行收集并更换新培养基,收集到的培养基用于相应天数细胞实验的换液。
6.细胞存活率检测
兔骨髓间充质干细胞(rbmsc)为贴壁细胞,使用rbmsc细胞完全培养基,置于37℃、5%co2恒温培养箱中培养。以下操作均在生物安全柜中进行,并提前紫外灭菌30min。
6.1细胞复苏
a)将培养基放在37℃的恒温水浴箱中预热备用;
b)预先准备一个25cm2培养瓶和15ml离心管,在培养瓶上做好标记(细胞株名称、传代数、日期以及操作者),在培养瓶和离心管中分别加入3ml和9ml预热好的培养基;
c)从液氮罐取出要复苏的细胞,并置于37℃水浴中迅速融解;
d)将融解的细胞悬液转移至加有9ml培养基的离心管中,吹打均匀;
e)离心:1000rpm,5min;
f)弃上清,加入1ml培养基,重新吹打均匀,转移至预先装有培养基的培养瓶中;
g)将培养瓶置于37℃、5%co2的培养箱中,次日换液。
6.2细胞换液
a)将培养基放在37℃的恒温水浴箱中预热备用;
b)弃去培养瓶中的培养基,并加入4ml预热的培养基;
c)将培养瓶置于37℃、5%co2的培养箱中培养。
6.3细胞传代
a)预先将培养基、0.05%胰酶及dpbs放入37℃恒温水浴箱中预热备用;
b)弃去培养瓶中的培养基,加入2mldpbs轻洗细胞后弃去;
c)加入2ml预热好的0.05%胰酶,放入培养箱中孵育2min,待细胞脱离瓶底,加入2ml培养基中和胰酶;
d)充分吹打细胞,然后转移至15ml无菌离心管,离心1000rpm,5min;
e)弃上清,加入2ml培养基,吹打均匀,吸取1ml细胞悬液加到预先装有3ml培养基的培养瓶中(以1:2传代为例)。标记细胞株名称、传代数、日期以及操作者。
f)将培养瓶置于37℃、5%co2的培养箱中培养。
6.4细胞冻存
a)预先将培养基、fbs、0.05%胰酶及dpbs放入37℃恒温水浴箱中预热备用;
b)按照2.2.5.3的方法将细胞消化、离心、弃去上清;
c)配制细胞冻存液:70%细胞培养基,20%fbs和10%dmso;
d)按照5×106/ml的浓度将细胞悬浮于冻存液中;
e)把含有细胞的冻存液,分装到冻存管(每管1ml),封口,并注明细胞名称,代数,冻存时间,操作者,放入冻存盒;
f)将冻存盒置于-80℃冰箱过夜,最后取出冻存管于液氮罐中长期储存。
6.5细胞相容性检测
将rbmsc细胞按照1×105/孔接种于24孔板中,培养24h后,弃去原培养基,加入第1d收集的浸提液,后每2天用相对应的浸提液进行细胞换液。在培养的第1、4和7d,使用cck-8试剂盒对细胞活性检测,步骤如下:
a)弃去原培养基,用pbs溶液清洗;
b)加入含有10%cck-8液的培养基;
c)37℃、5%co2恒温培养箱中孵育1h;
d)移取100μl上清液至96孔板,酶标仪测定450nm下的吸光度(od)值;
根据od值计算细胞存活率:
比较bg、bg-1xls,bg-3xls支架的细胞相容性。如图6所示,rbmsc细胞在三种支架的浸提液中培养1d、3d和5d的细胞生存率。在1d时,所有的支架均显现出一定的细胞毒性(p<0.05),但总体的细胞生存率均在85%以上。在细胞培养4d和7d后,所有组均没有进一步的细胞毒性。
7.扫描电镜观察:
将经过灭菌的bg、bg-1xls、bg-3xls支架置于24孔板中,吸取细胞浓度1×106个/ml的溶液50μl接种到支架上,每经过30min,向支架缓慢滴加50μl新鲜培养基,重复3次,最后向孔板中加入800μl培养基,补齐至1ml,继续培养1d、4d,进行sem观察。步骤如下:
a)将含细胞的支架用pbs清洗两遍;
b)用2.5%戊二醛在4℃下固定3h;
c)细胞固定后,用30%、50%、70%、90%和100%的乙醇对样品进行梯度脱水,每次15min;
d)脱水后,将支架置于叔丁醇中,在-20℃冰箱中过夜;
e)然后进行冷冻干燥;
f)最后导电胶固定于铜板上,镀金后进行sem观察。
通过观察细胞在支架表面的形貌,可以直观的反应材料细胞毒性的大小。如图7(a~c)所示,在培养1d后,细胞能很好的在三种支架(bg、bg-1xls、bg-3xls支架)表面粘附,细胞呈伸张状态,且伸出伪足,表明细胞状态良好。在培养4d后(d~f),可以观察到各实验组中,细胞数量都明显增多,细胞呈现多边形,并有连接成片的趋势。上述结果表明细胞能很好的在三组支架中生长、增殖,支架具有好的细胞相容性。
8.碱性磷酸酶(alp)染色
实验分4组(bg、bg-1xls、bg-3xls支架浸提液组和不含支架的对照组)将细胞按照1×105/孔接种于24孔板中,细胞培养24h后,弃去原培养基,加入支架浸提液,每2天换液1次,继续培养至第7d,进行alp染色。步骤如下:
准备工作:固定液的配置:65ml丙酮+8ml37%多聚甲醛溶液+25ml柠檬酸盐溶液;染色液配置:1ml亚硝酸钠溶液+1mlfrv-碱性溶液共混后加入45ml去离子水中,两分钟加入1mlas-bi溶液。
a)去除原培养基;
b)加入固定液300μl,30s后,去除;
c)加入去离子水500μl,45s后,去除;
d)加入染色液300μl,室温下避光孵育15min;
e)移除染色液,去离子水清洗2次;
f)荧光显微镜下观察、拍照。
图8为rbmsc细胞在不含支架的空白对照组和三组支架(bg、bg-1xls、bg-3xls支架)浸提液中培养7d的alp染色图。细胞培养7d后,bg支架组中alp染色呈阳性的细胞要少于空白对照组,对细胞的alp活性有一定的抑制作用。在含xls的bg支架组中,通过染色观察alp表达随着xls含量的增加而增高,在xls含量为3%时,实验组的alp活性显著高于空白对照组。上述结果表明,在bg支架中添加xls可以促进bg支架的骨诱导性。
通过上述实施例和对比例的相关检测结果对比可得:
a)bg支架存在力学性能差和无骨诱导性等缺点;
b)随着xls含量的增加,复合支架的孔隙率逐渐降低,xls的含量为3wt%时,支架的孔隙率为88.8%;
c)支架的机械性能与xls的含量呈正相关,bg-3xls复合支架的压缩强度为3.55mpa,满足一般的非承重骨植入的要求;
d)体外生物活性实验结果表明所有的支架都能形成羟基磷灰石;
e)体外细胞相容性实验表面所有支架均具有良好的细胞相容性;
f)bg-3xls支架有着比bg支架更高的骨诱导作用。
以上结论表明在bg支架中添加xls可以改善bg支架机械性能同时获得成骨分化能力,同时保持其良好的骨整合能力,3wt%xls为最优添加量。
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
- 还没有人留言评论。精彩留言会获得点赞!