利用穿膜肽改性葡聚糖制备葡聚糖-穿膜肽高分子脂质体及其制备方法、应用与流程
本发明属于纳米材料制备技术领域,涉及一种利用穿膜肽改性葡聚糖制备葡聚糖-穿膜肽高分子脂质体及其制备方法、应用。
背景技术:
药物用于治疗生物体疾病的历史非常悠久,而药物递送系统(drugdeliverysystem,dds,药物传递系统)是指在空间、时间及剂量上全面调控药物在生物体内分布的技术体系。其目标是将适量的药物递送到正确的位置,从而增加药物的利用效率,提高疗效,降低成本,减少毒副作用,以期到达输送药物和治疗的目的。近年来,脂质体在药物递送系统中发展迅速,被人们形象地称为"生物导弹",其特征是由类脂(卵磷脂、磷脂酰胆碱、神经鞘磷脂)双层分子组成的空心球,类似于生物膜的脂质双分子层结构,粒径一般在25nm-5μm之间。在制备过程中,可通过改变表面的性质,如粒径大小、表面电荷等,提高脂质体药物对靶区的选择性和定向性,控制药物的组织分布,从而降低毒性减少副作用。药物被包在脂质体内,在组织中的扩散速度降低,在血液中释放减慢,从而延长药物发挥作用的时间。由于其特殊的类细胞膜结构,脂质体细胞有较大的亲和力,且能增加药物对细胞的通透性,从而提高了药物在患病部位的浓度和作用,起到增强疗效的作用。通过改变脂质体的给药方式、给药部位和粒径来调整其靶向,或者在脂质体上连接某种识别分子,通过其与靶细胞的特异性结合来实现专一靶向性。
然而传统脂质体仍存在一定的缺陷,比如:1.分散性较差,容易聚集沉淀;2.传统脂质体稳定性较差,有较高的泄露现象出现;3.传统脂质体的可修饰性有待提高;4.传统脂质体易被生物体内的酶类物质降解;5.传统脂质体容易被生理屏障,例如泪液,黏液等捕获难以跨越生理障碍。因此急需建立一种更为有效的药物递送方式,可以避免传统脂质体存在的缺陷,极大的提高药物递送。
技术实现要素:
鉴于传统脂质体存在的缺陷,分散性较差,容易聚集沉淀,稳定性较差,有较高的泄露现象出现,以及有限的可修饰性,并且传统脂质体容易被生理屏障,例如泪液,黏液等捕获清除,难以跨越生理障碍。因此急需建立一种更为有效的药物递送方式,极大的提高药物递送,且可以更为有效的跨越生理障碍,本发明提供一种穿膜肽改性葡聚糖及葡聚糖-穿膜肽高分子脂质体及其制备方法。
本发明是一种基于穿膜肽改性葡聚糖及具有较好跨越生理屏障例如泪液黏液等的葡聚糖-穿膜肽高分子类脂质体,分散性和稳定性优于传统脂质体,且具有良好的可修饰性。所制得的穿膜肽改性葡聚糖,为葡聚糖的修饰提供了一种新的方法。所制得的葡聚糖-穿膜肽高分子脂质体,具有良好的可修饰性,分散性和稳定性较好,粒径均匀,生物相容性好,有效粒径在90-150nm。本发明所选的葡聚糖是一种水溶性的天然多糖,具有良好的生物相容性,生物降解性和无细胞毒性,使其广泛应用于生物医药等领域;所选的赖氨酸是必需氨基酸之一,赖氨酸的存在可使组装后后的双分子层带正电荷并易于功能化修饰;并选择细胞穿膜肽来对高分子脂质体进行表面修饰,辅助药物载体跨越生理障碍。细胞穿膜肽tat是从hiv病毒中提取的一种短肽,无毒、高效,长度一般不超过30个氨基酸且富含碱性氨基酸,带正电荷,可以通过静电吸附作用与黏液中的负电蛋白作用,延长其在黏液中的停留时间。
本发明制备了一种穿膜肽改性葡聚糖及葡聚糖-穿膜肽高分子脂质体。
本发明的第一个技术方案如下:利用穿膜肽改性葡聚糖制备葡聚糖-穿膜肽高分子脂质体,利用葡聚糖-穿膜肽双亲性高分子经过乳化溶剂蒸发法自组装形成葡聚糖-穿膜肽高分子脂质体,组装成的葡聚糖-穿膜肽高分子脂质体,粒径在90-150纳米之间,表面zeta电位为+12mv左右;
所述的穿膜肽改性葡聚糖高分子的结构式如下:
其中,葡聚糖的分子量为5000-20000。
本发明的穿膜肽改性葡聚糖组装形成高分子脂质体。
本发明的葡聚糖-穿膜肽双亲性高分子的制备方法,步骤如下:
将叔丁氧羰基-赖氨酸(boc-lysine)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐按摩尔比1:5-15溶于二甲基亚砜中,在氩气保护下反应10-20min,然后将葡聚糖、4-二甲氨基吡啶按摩尔比为1:1-6溶于二甲基亚砜中加入,在氩气保护下反应12-48h,反应结束后,二甲基亚砜透析24-72h,纯水透析24-72h后,然后按boc-lysine、三氟乙酸摩尔比为1:10-35加入三氟乙酸反应8-15h以除去boc。然后将溶于水的穿膜肽、溶于二甲基亚砜的3-(2-吡啶二巯基)丙酸n-羟基琥珀酰亚胺酯(spdp)按摩尔比1:1-5中加入上述体系,反应10-24h,反应结束后,纯水透析10-48h,冻干得到葡聚糖-穿膜肽高分子。
所述的boc-lysine溶于二甲基亚砜浓度为0.05-0.2g/ml。
所述的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶于二甲基亚砜浓度为0.05-0.15g/ml。
所述的葡聚糖溶于二甲基亚砜浓度为0.05-0.1g/ml。
所述的4-二甲氨基吡啶溶于二甲基亚砜浓度为0.01-0.1g/ml。
所述的穿膜肽溶于水浓度为0.001-0.05g/ml。
所述的spdp溶于二甲基亚砜浓度为0.001-0.03g/ml。
本发明的葡聚糖-穿膜肽高分子脂质体的应用,步骤如下:
1)取葡聚糖-穿膜肽双亲性高分子溶解在二氯甲烷中,形成有机相;
2)将3-8ml去离子水置于冰浴中,在超声波发生器作用下,将上述有机相滴入去离子水中,功率为70-120w下超声2-8分钟后得到乳液;
3)将得到的乳液在25-50℃下通过旋转蒸发仪进行旋蒸3-10分钟,除去有机相,得到基于葡聚糖-穿膜肽的高分子脂质体溶液。
所述的乳液中有机相溶液:去离子水体积比为1:10-20。
组装成的葡聚糖-穿膜肽高分子脂质体,粒径在90-150纳米之间,表面zeta电位为+12mv左右,粒径均匀,分散性好。
有益效果
本发明所制得的穿膜肽改性葡聚糖,为葡聚糖的修饰提供了一种新的方法。本发明葡聚糖-穿膜肽高分子脂质体的有益效果包括:利用表面正电位的穿膜肽tat与黏液中带负电的蛋白静电吸引,增加药物的黏液停留时间,使其具有良好的跨越生理屏障的能力,且具有良好的可修饰性,分散性和稳定性较好,粒径均匀,生物相容性好,有效粒径在90-150nm。
与现有技术相比,采用本发明制备方法所制得的高分子脂质体保持了均匀粒径同时,生物相容性好,利用表面正电位的穿膜肽tat与黏液中带负电的蛋白静电吸引,增加药物的黏液停留时间,使其具有良好的跨越生理屏障的能力,有望提供一种跨越生理屏障的药物递送方式。
附图说明
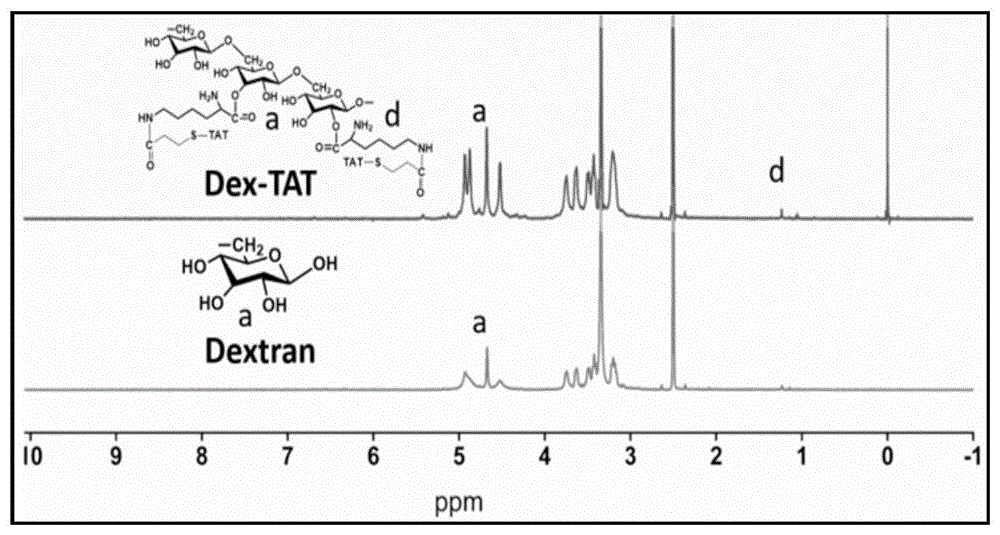
图1:葡聚糖-穿膜肽双亲性高分子的核磁共振氢谱图。
图2:葡聚糖-穿膜肽双亲性高分子的红外光谱图。
图3:葡聚糖-穿膜肽双亲性高分子的紫外光谱图。
图4:葡聚糖-穿膜肽高分子脂质体的粒度分析图。
图5:葡聚糖-穿膜肽高分子脂质体的电位图。
图6:葡聚糖-穿膜肽高分子脂质体的透射照片。
具体实施方式
以下通过实施例对本发明作进一步的阐述,但本发明不限于此。
葡聚糖-穿膜肽双亲性高分子的制备方法,步骤如下:
将叔丁氧羰基-赖氨酸(boc-lysine)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐按摩尔比1:5-15溶于二甲基亚砜中,在氩气保护下反应10-20min,然后将葡聚糖、4-二甲氨基吡啶按摩尔比为1:1-6溶于二甲基亚砜中加入,在氩气保护下反应12-48h,反应结束后,二甲基亚砜透析24-72h,纯水透析24-72h后,然后按boc-lysine、三氟乙酸摩尔比为1:10-35加入三氟乙酸反应8-15h以除去boc。然后将溶于水的穿膜肽、溶于二甲基亚砜的3-(2-吡啶二巯基)丙酸n-羟基琥珀酰亚胺酯(spdp)按摩尔比1:1-5中加入上述体系,反应10-24h,反应结束后,纯水透析10-48h,冻干得到葡聚糖-穿膜肽高分子。
所述的boc-lysine溶于二甲基亚砜浓度为0.05-0.2g/ml。
所述的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶于二甲基亚砜浓度为0.05-0.15g/ml。
所述的葡聚糖溶于二甲基亚砜浓度为0.05-0.1g/ml。
所述的4-二甲氨基吡啶溶于二甲基亚砜浓度为0.01-0.1g/ml。
所述的穿膜肽溶于水浓度为0.001-0.05g/ml。
所述的spdp溶于二甲基亚砜浓度为0.001-0.03g/ml。
本发明的葡聚糖-穿膜肽高分子脂质体的制备方法,步骤如下:
1)取葡聚糖-穿膜肽双亲性高分子溶解在二氯甲烷中,形成有机相,2)将3-8ml去离子水置于冰浴中,在超声波发生器作用下,将上述有机相滴入去离子水中,功率为70-120w下超声2-8分钟后得到乳液;3)将得到的乳液在25-50℃下通过旋转蒸发仪进行旋蒸3-10分钟,除去有机相,得到基于葡聚糖-穿膜肽的高分子脂质体溶液。
所述的乳液中有机相溶液:去离子水体积比为1:10-20。
实施例1
葡聚糖-穿膜肽双亲性高分子的合成。
取叔丁氧羰基-赖氨酸(boc-lysine)0.05g溶于1ml二甲基亚砜中,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐0.75g溶于15ml二甲基亚砜中,在氩气保护下反应10min,然后使0.3g葡聚糖溶于6ml二甲基亚砜中,0.01g4-二甲氨基吡啶溶于1ml二甲基亚砜并加入,在氩气保护下反应12h,反应结束后,二甲基亚砜透析24h,纯水透析24h后,然后加入500μl三氟乙酸反应8h以除去boc。然后将0.015g穿膜肽溶于15ml纯水,0.005gspdp溶于5mldmso中加入上述体系,反应10h,反应结束后,纯水透析10h,冻干得到葡聚糖-穿膜肽高分子。如图1核磁共振氢谱图、图2红外光谱图、图3紫外光谱图特征峰,证明葡聚糖-穿膜肽双亲性高分子合成成功。
实施例2
葡聚糖-穿膜肽双亲性高分子的合成。
取叔丁氧羰基-赖氨酸(boc-lysine)0.08g溶于1ml二甲基亚砜中,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐0.8g溶于15ml二甲基亚砜中,在氩气保护下反应12min,然后使0.34g葡聚糖溶于7ml二甲基亚砜中,0.02g4-二甲氨基吡啶溶于1ml二甲基亚砜并加入,在氩气保护下反应18h,反应结束后,二甲基亚砜透析30h,纯水透析32h后,然后加入600μl三氟乙酸反应9h以除去boc。然后将0.018g穿膜肽溶于6ml纯水,0.007gspdp溶于1mldmso中加入上述体系,反应13h,反应结束后,纯水透析12h,冻干得到葡聚糖-穿膜肽高分子。
实施例3
葡聚糖-穿膜肽双亲性高分子的合成。
取叔丁氧羰基-赖氨酸(boc-lysine)0.1g溶于2ml二甲基亚砜中,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐0.84g溶于11ml二甲基亚砜中,在氩气保护下反应15min,然后使0.37g葡聚糖溶于5ml二甲基亚砜中,0.028g4-二甲氨基吡啶溶于1ml二甲基亚砜并加入,在氩气保护下反应25h,反应结束后,二甲基亚砜透析38h,纯水透析40h后,然后加入700μl三氟乙酸反应10h以除去boc。然后将0.02g穿膜肽溶于4ml纯水,0.01gspdp溶于1mldmso中加入上述体系,反应15h,反应结束后,纯水透析20h,冻干得到葡聚糖-穿膜肽高分子。
实施例4
葡聚糖-穿膜肽双亲性高分子的合成。
取叔丁氧羰基-赖氨酸(boc-lysine)0.15g溶于1ml二甲基亚砜中,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐0.9g溶于9ml二甲基亚砜中,在氩气保护下反应18min,然后使0.45g葡聚糖溶于5ml二甲基亚砜中,0.035g4-二甲氨基吡啶溶于1ml二甲基亚砜并加入,在氩气保护下反应30h,反应结束后,二甲基亚砜透析48h,纯水透析50h后,然后加入850μl三氟乙酸反应13h以除去boc。然后将0.025g穿膜肽溶于5ml纯水,0.012gspdp溶于1mldmso中加入上述体系,反应20h,反应结束后,纯水透析32h,冻干得到葡聚糖-穿膜肽高分子。
实施例5
葡聚糖-穿膜肽双亲性高分子的合成。
取叔丁氧羰基-赖氨酸(boc-lysine)0.2g溶于1ml二甲基亚砜中,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐1.0g溶于10ml二甲基亚砜中,在氩气保护下反应20min,然后使0.5g葡聚糖溶于5ml二甲基亚砜中,0.048g4-二甲氨基吡啶溶于1ml二甲基亚砜并加入,在氩气保护下反应48h,反应结束后,二甲基亚砜透析72h,纯水透析72h后,然后加入1ml三氟乙酸反应15h以除去boc。然后将0.03g穿膜肽溶于7ml纯水,0.015gspdp溶于1mldmso中加入上述体系,反应24h,反应结束后,纯水透析48h,冻干得到葡聚糖-穿膜肽高分子。
实施例6
乳化-溶剂蒸发法。采用乳化-溶剂蒸发法制备葡聚糖-穿膜肽脂质体过程如下:
1)精确称取葡聚糖-穿膜肽双亲性高分子10mg,溶于200μl二氯甲烷中,形成有机相;
2)将3ml去离子水置于冰浴中,在超声波发生器作用下,将上述有机相滴入去离子水中,功率为70w下超声2分钟后得到乳液;
3)将得到的乳液在25℃下通过旋转蒸发仪进行旋蒸3分钟,除去有机相,得到基于葡聚糖-穿膜肽的高分子脂质体溶液。
如图4粒度分析图结果所示,所制备的葡聚糖-穿膜肽脂质体的有效粒径为100nm;如图5电位图结果所示,所制备的葡聚糖-穿膜肽脂质体的表面电位为12mv;如图6葡聚糖-穿膜肽脂质体的透射照片所示,所制备的葡聚糖-穿膜肽脂质体粒径均匀,分散性好。
实施例7
1)精确称取葡聚糖-穿膜肽双亲性高分子13mg,溶于250μl二氯甲烷中,形成有机相;
2)将4ml去离子水置于冰浴中,在超声波发生器作用下,将上述有机相滴入去离子水中,功率为80w下超声3分钟后得到乳液;
3)将得到的乳液在30℃下通过旋转蒸发仪进行旋蒸5分钟,除去有机相,得到基于葡聚糖-穿膜肽的高分子脂质体溶液。所制备的葡聚糖-穿膜肽脂质体有效粒径为110nm,表面电位为10mv。
实施例8
1)精确称取葡聚糖-穿膜肽双亲性高分子16mg,溶于300μl二氯甲烷中,形成有机相;
2)将5ml去离子水置于冰浴中,在超声波发生器作用下,将上述有机相滴入去离子水中,功率为90w下超声4分钟后得到乳液;
3)将得到的乳液在38℃下通过旋转蒸发仪进行旋蒸7分钟,除去有机相,得到基于葡聚糖-穿膜肽的高分子脂质体溶液。所制备的葡聚糖-穿膜肽脂质体有效粒径为125nm,表面电位为11mv。
实施例9
1)精确称取葡聚糖-穿膜肽双亲性高分子18mg,溶于350μl二氯甲烷中,形成有机相;
2)将6ml去离子水置于冰浴中,在超声波发生器作用下,将上述有机相滴入去离子水中,功率为100w下超声7分钟后得到乳液;
3)将得到的乳液在42℃下通过旋转蒸发仪进行旋蒸8分钟,除去有机相,得到基于葡聚糖-穿膜肽的高分子脂质体溶液。所制备的葡聚糖-穿膜肽脂质体有效粒径为140nm,表面电位为13mv。
实施例10
1)精确称取葡聚糖-穿膜肽双亲性高分子20mg,溶于400μl二氯甲烷中,形成有机相;
2)将8ml去离子水置于冰浴中,在超声波发生器作用下,将上述有机相滴入去离子水中,功率为120w下超声8分钟后得到乳液;
3)将得到的乳液在50℃下通过旋转蒸发仪进行旋蒸10分钟,除去有机相,得到基于葡聚糖-穿膜肽的高分子脂质体溶液。所制备的葡聚糖-穿膜肽脂质体有效粒径为150nm,表面电位为12mv。
- 还没有人留言评论。精彩留言会获得点赞!