Rac1活性抑制剂在制备治疗阿尔茨海默病的药物中的应用的制作方法
本发明涉及医药领域,具体涉及通过抑制小g蛋白rac1活性来治疗阿尔茨海默病所导致的认知损伤,以及抑制小g蛋白rac1活性的小分子化合物,即rac1活性抑制剂,在制备治疗阿尔茨海默病的药物中的应用。
背景技术:
阿尔茨海默病(alzheimer’sdisease,ad)是一种神经退行性疾病。遗忘速度加快被认为是该疾病的典型症状,但通过抑制遗忘来治疗ad的机制尚无报道,并且基于该机制的小分子化合物也没有报道。
rac1(ras-relatedc3botulinumtoxinsubstrate)是小g蛋白rho家族中的一员。现有技术中到目前为止还没有人从遗忘的角度把rac1与ad联系起来,已有的文献是从体外实验中发现导致ad的有毒蛋白abeta-42能激活rac1,造成神经元细胞骨架改变,进而引发细胞死亡。
目前rac1活性抑制剂主要用于治疗癌症。
技术实现要素:
本发明的目的之一是提供rac1活性抑制剂的药物新用途。
本发明所提供的rac1活性抑制剂的药物新用途,为:rac1活性抑制剂在制备治疗阿尔茨海默病的药物中的应用。
上述应用,具体可为:rac1活性抑制剂在制备治疗阿尔茨海默病所导致的认知损伤的药物中的应用。
所述rac1活性抑制剂可为:ehop-016((n4-(9-ethyl-9h-carbazol-3-yl)-n2-(3-morpholin-4-yl-propyl)-pyrimidine-2,4-diamine))、cs7171((1-(3,4-dichlorophenyl)-4-(4-hydroxy-3-nitrobenzyliden)pyrazolidine-3,5-dione),结构式如式i所示)、jkf-034(1-benzenesulfonyl-4-benzyl-piperazine,结构式如式ii所示)、secramine(pelishhe,petersonjr,salvarezzasb,rodriguez-boulane,chenj-l,stamnesm,etal.secramineinhibitscdc42-dependentfunctionsincellsandcdc42activationinvitro.natchembiol2006;2:39–46.doi:10.1038/nchembio751)、azd0530(hennequinlf,allenj,breedj,curwenj,fennellm,greentp,etal.
n-(5-chloro-1,3-benzodioxol-4-yl)-7-[2-(4-methylpiperazin-1-yl)ethoxy]-5-(tetrahydro-2h-pyran-4-yloxy)quinazolin-4-amine,anovel,highlyselective,orallyavailable,dual-specificc-src/ablkinaseinhibitor.jmedchem2006;49:6465–88.doi:10.1021/jm060434q)、nsc23766(düttings,heidenreichj,cherpokovad,amine,zhangsc,ahmadianmr,etal.criticaloff-targeteffectsofthewidelyusedrac1inhibitorsnsc23766andeht1864inmouseplatelets.jthrombhaemost2015.doi:10.1111/jth.12861.)、mbq-167(humphries-bickleyt,castillo-pichardol,hernandez-o-farrille,borrero-garciald,forestier-romani,gerenay,etal.characterizationofadualrac/cdc42inhibitormbq-167inmetastaticcancer.molcancerther2017:molcanther.0442.2016.doi:10.1158/1535-7163.mct-16-0442.)、aza1(zinsk,lucast,reichlp,abrahamd,aharinejads.arac1/cdc42gtpase-specificsmallmoleculeinhibitorsuppressesgrowthofprimaryhumanprostatecancerxenograftsandprolongssurvivalinmice.plosone2013;8:e74924.doi:10.1371/journal.pone.0074924.)、aza197(zinsk,gunawardhanas,lucast,abrahamd,aharinejads.targetingcdc42withthesmallmoleculedrugaza197suppressesprimarycoloncancergrowthandprolongssurvivalinapreclinicalmousexenograftmodelbydownregulationofpak1activity.jtranslmed2013;11:295.doi:10.1186/1479-5876-11-295.)、compound19(delmarmaldonadom,dharmawardhanes.targetingracandcdc42gtpasesincancer.cancerres2018;78:3101–11.doi:10.1158/0008-5472.can-18-0619.)、zinc08010136(cardamaga,cominmj,hornosl,gonzalezn,defelipel,turjanskiag,etal.preclinicaldevelopmentofnovelrac1-gefsignalinginhibitorsusingarationaldesignapproachinhighlyaggressivebreastcancercelllines.anticanceragentsmedchem2014;14:840–51.)、zinc07949036(ferrin,corsinia,bottinop,clericif,continia.virtualscreeningapproachfortheidentificationofnewrac1inhibitors.jmedchem2009;52:4087–90.doi:10.1021/jm8015987.)、69391(cardamaga,cominmj,hornosl,gonzalezn,defelipel,turjanskiag,etal.preclinicaldevelopmentofnovelrac1-gefsignalinginhibitorsusingarationaldesignapproachinhighlyaggressivebreastcancercelllines.anticanceragentsmedchem2014;14:840–51.)、1a-116(cardamaga,cominmj,hornosl,gonzalezn,defelipel,turjanskiag,etal.preclinicaldevelopmentofnovelrac1-gefsignalinginhibitorsusingarationaldesignapproachinhighlyaggressivebreastcancercelllines.anticanceragentsmedchem2014;14:840–51.)、itx3(bouquiern,vignale,charrasses,weillm,schmidts,leonettij-p,etal.acellactivechemicalgefinhibitorselectivelytargetsthetrio/rhog/rac1signalingpathway.chembiol2009;16:657–66.doi:10.1016/j.chembiol.2009.04.012.)、itx1(bouquiern,vignale,charrasses,weillm,schmidts,leonettij-p,etal.acellactivechemicalgefinhibitorselectivelytargetsthetrio/rhog/rac1signalingpathway.chembiol2009;16:657–66.doi:10.1016/j.chembiol.2009.04.012.)、cpypp(nishikimia,urunot,duanx,caoq,okamuray,saitoht,etal.blockadeofinflammatoryresponsesbyasmall-moleculeinhibitoroftheracactivatordock2.chembiol2012;19:488–97.doi:10.1016/j.chembiol.2012.03.008.)、ggtase1inhibitor(p61a6(zimonjicdb,chanln,tripathiv,luj,kwono,popescunc,etal.invitroandinvivoeffectsofgeranylgeranyltransferaseiinhibitorp61a6onnon-smallcelllungcancercells.bmccancer2013;13:198.doi:10.1186/1471-2407-13-198.)、statins(tanakas,fukumotoy,nochiokak,minamit,kudos,shiban,etal.statinsexertthepleiotropiceffectsthroughsmallgtp-bindingproteindissociationstimulatorupregulationwitharesultantrac1degradation.arteriosclerthrombvascbiol2013;33:1591–600.doi:10.1161/atvbaha.112.300922.))、eht1864(tanakas,fukumotoy,nochiokak,minamit,kudos,shiban,etal.statinsexertthepleiotropiceffectsthroughsmallgtp-bindingproteindissociationstimulatorupregulationwitharesultantrac1degradation.arteriosclerthrombvascbiol2013;33:1591–600.doi:10.1161/atvbaha.112.300922.)、compound1(wahlao,contrerasji,arnstjl,taylorma,natarajana,ouellettemm,etal.discoveryandcharacterizationofsmallmoleculerac1inhibitors.oncotarget2017;8:34586–600.doi:10.18632/oncotarget.16656.)、mls000532223(surviladzez,wallera,wuy,romeroe,edwardsbs,wandinger-nessa,etal.identificationofasmallgtpaseinhibitorusingahigh-throughputflowcytometrybead-basedmultiplexassay.jbiomolscreen2010;15:10–20.doi:10.1177/1087057109352240.)、r-ketorolac(guoy,kenneysr,mullercy,adamss,rutledget,romeroe,etal.r-ketorolactargetscdc42andrac1andaltersovariancancercellbehaviorscriticalforinvasionandmetastasis.molcancerther2015;14:2215–27.doi:10.1158/1535-7163.mct-15-0419.)、mtx(bidaud-meynarda,armad,taoujis,laguerrem,dessolinj,rosenbaumj,etal.anovelsmall-moleculescreeningstrategyidentifiesmitoxantroneasarhogtpaseinhibitor.biochemj2013;450:55–62.doi:10.1042/bj20120572.)、osu-3012(porchialm,guerram,wangy-c,zhangy,espinosaav,shinoharam,etal.
2-amino-n-{4-[5-(2-phenanthrenyl)-3-(trifluoromethyl)-1h-pyrazol-1-yl]-phenyl}acetamide(osu-03012),acelecoxibderivative,directlytargetsp21-activatedkinase.molpharmacol2007;72:1124–31.doi:10.1124/mol.107.037556.)、fl172(maksimoskaj,fengl,harmsk,yic,kissilj,marmorsteinr,etal.targetinglargekinaseactivesitewithrigid,bulkyoctahedralrutheniumcomplexes.jamchemsoc2008;130:15764–5.doi:10.1021/ja805555a.)、frax597(licciullis,maksimoskaj,zhouc,troutmans,kotas,liuq,etal.frax597,asmallmoleculeinhibitorofthep21-activatedkinases,inhibitstumorigenesisofneurofibromatosistype2(nf2)-associatedschwannomas.jbiolchem2013;288:29105–14.doi:10.1074/jbc.m113.510933.)、phox-11(parkj-m,hany-m,jeongm,chungmh,kwoncil,kokh,etal.synthetic8-hydroxydeoxyguanosineinhibitedmetastasisofpancreaticcancerthroughconcertedinhibitionsofermandrho-gtpase.freeradicbiolmed2017;110:151–61.doi:10.1016/j.freeradbiomed.2017.06.003.)、187-1(petersonjr,lokeyrs,mitchisontj,kirschnermw.achemicalinhibitorofn-wasprevealsanewmechanismfortargetingproteininteractions.procnatlacadsciusa2001;98:10624–9.doi:10.1073/pnas.201393198.)和wiskostatin(delmarmaldonadom,dharmawardhanes.targetingracandcdc42gtpasesincancer.cancerres2018;78:3101–11.doi:10.1158/0008-5472.can-18-0619.)中的至少一种:
本发明的另一个目的是提供一种治疗阿尔茨海默病或治疗阿尔茨海默病所导致的认知损伤的药物。
所述药物包含rac1活性抑制剂。
上述化合物ehop-016、cs7171、jkf-034在制备治疗阿尔茨海默病或治疗阿尔茨海默病所导致的认知损伤的药物中的应用也属于本发明的保护范围。
本发明还提供一种治疗阿尔茨海默病或治疗阿尔茨海默病所导致的认知损伤的药物的筛选方法,包括:首先检测待筛选化合物能否抑制rac1的活性,其次检测其bbb通透性。
本发明还发现了一种治疗ad的机制。
所述治疗ad的机制,为:抑制遗忘调控分子rac1的活性。
本发明还提供一种诊断患者是否患有ad的方法,所述方法为:检测患者的遗忘调控分子rac1的活性,如rac1活性升高,则该患者患有ad。
本发明还提供一种治疗ad的方法。
本发明所提供的治疗ad的方法,为:向患者施加有效剂量的抑制rac1的物质。
所述抑制rac1的物质可为:ehop-016、cs7171、jkf-034、secramine、azd0530、nsc23766、mbq-167、aza1、aza197、compound19、zinc08010136、zinc07949036、69391、1a-116、itx3、itx1、cpypp、ggtase1inhibitor(p61a6、statins)、eht1864、compound1、mls000532223、r-ketorolac、osu-3012、fl172、frax597、phox-11、187-1和wiskostatin中的至少一种。
所述ad具体可为阿尔茨海默病所导致的认知损伤,其中,所述认知损伤指空间学习和记忆能力的损伤。
本发明首次发现在ad患者及ad转基因小鼠的海马脑区以及ad转基因果蝇模型的大脑中,调控遗忘的rac1蛋白活性异常的升高,并且通过抑制rac1蛋白活性的手段能显著的改善ad遗忘速度过快的病症。因此,我们的发现提供了一项治疗ad认知损伤的途径,即通过抑制遗忘调控蛋白rac1的活性来实现,并且我们还发现了2个小分子化合物能通过抑制rac1活性改善ad遗忘。
附图说明
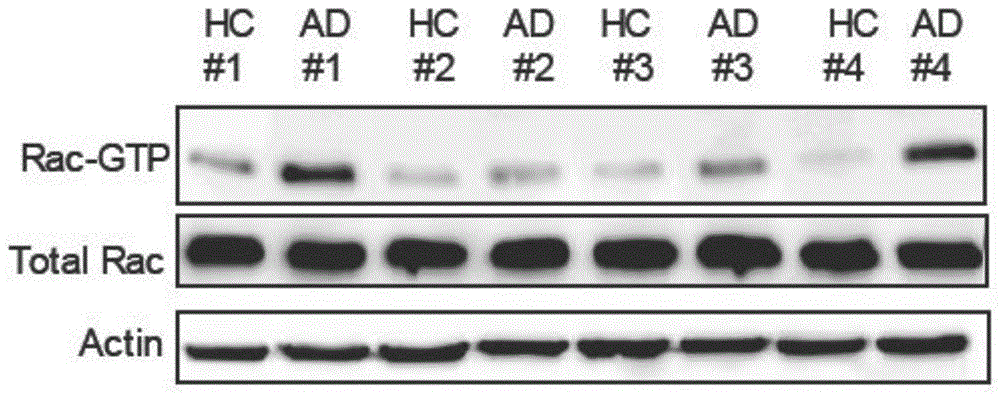
图1为ad患者与健康人对照组海马脑区中rac1活性的生化检测图。
图2为统计ad患者与健康人对照组海马脑区中总rac1含量和激活态rac1(rac1-gtp)的统计图。
图3为测试9个月和12个月ad转基因小鼠海马脑区中rac1活性的生化图。
图4为用rac1-gtp的elisa试剂盒检测abeta42蛋白在h293t细胞中激活rac1的统计图。
图5为制备寡聚体的abeta42蛋白检测的生化图。
图6为在ad转基因小鼠海马脑区中rac1激活后的下游pak蛋白磷酸化水平升高的生化图。
图7为rac1活性抑制剂ehop-016抑制了ad转基因小鼠海马脑区中rac1活性并改善ad转基因小鼠空间学习记忆的图。
图8为在ad转基因小鼠海马脑区中注射能特异在兴奋性神经元中表达rac1活性缺失突变并改善ad转基因小鼠空间学习能力的图。
图9为在ad转基因小鼠海马脑区中注射能特异在兴奋性神经元中表达rac1活性缺失突变改善了记忆图。
图10为通过rac1抑制剂和注射rac1活性缺失突变病毒都能改善长时程增强的图。
图11为小分子化合物cs7171、cs7170和jkf-034的结构式。
图12为小分子化合物cs7171和jkf-034抑制ad转基因小鼠海马脑区中rac1活性并改善ad转基因小鼠空间学习记忆的图。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,均可从商业途径得到。
实施例1、
一、抑制rac1活性治疗ad导致的认知损伤机制的发现
首先通过免疫印记试验(westernblot),我们检测了ad病人大脑海马脑区的rac1激活形式(rac-gtp)、总rac1(totalrac)以及内参蛋白(actin)(图1)。通过数据分析发现ad的海马脑区中rac1的活性显著高于健康人群(hc)海马脑区中rac1活性,即rac-gtp与totalrac的比值差异明显,而总rac1的表达量在两组人群样本中没有差异(图2)。在不同年龄的ad小鼠模型(app/ps1)中,3月龄的app/ps1小鼠海马组织中,rac1的活性有升高的趋势但没有统计差异,在9月龄和12月龄的app/ps1小鼠海马组织中,rac1的活性显著升高(图3)。在293t细胞系中加入人源的致病蛋白amyloidbeta42(aβ42)会激活rac1活性(图4),而加入人源aβ42以50-80kda和10-15kda的寡聚体形式存在为主(图5),在7-8月龄的app/ps1小鼠海马组织中,rac1的下游蛋白pak磷酸化水平也显著升高(图6)。
ehop-016(n4-(9-ethyl-9h-carbazol-3-yl)-n2-(3-morpholin-4-yl-propyl)-pyrimidine-2,4-diamine)被报道可以抑制rac1的活性。口服给予app/ps1小鼠模型ehop-016(10mg/kg)7天,免疫印记试验发现ehop-016能显著地抑制海马脑区中的rac1蛋白活性。给药7天后进行水迷宫记忆测试发现,ehop-016能显著性的改善app/ps1小鼠的空间记忆损伤(图7)。通过包装腺病毒rac1的显性抑制突变,并注射到12月龄app/ps1小鼠的海马脑区能抑制海马脑区中的rac1蛋白活性,并且能改善app/ps1小鼠的空间学习能力(图8)和记忆能力(图9)。
长时程增强作用为认为是细胞层面反映学习与记忆的指标。我们发现在6月龄的app/ps1小鼠海马脑片中,长时程增强的维持会出现维持损伤。通过给予rac1活性抑制剂ehop-016能显著改善该维持损伤。同样的,在注射过携带有rac1的显性抑制突变病毒的app/ps1海马脑片中,长时程增强作用维持的损伤也得到了改善(图10)。因此,从以上数据都支持我们的发现,即通过抑制小g蛋白rac1的活性,能够在细胞层面、实验动物行为层面改善阿尔茨海默ad小鼠模型的学习和记忆损伤。
二、抑制rac1活性且改善ad认知症状的小分子化合物
通过筛选我们发现了小分子化合物cs7171和jkf-034(图11)能够抑制rac1活性(图12),并且cs7171(1-(3,4-dichlorophenyl)-4-(4-hydroxy-3-nitrobenzyliden)pyrazolidine-3,5-dione)和jkf-034(1-benzenesulfonyl-4-benzyl-piperazine)还能改善app/ps1小鼠的空间记忆损伤。我们又对这两个化合物的血脑屏障透过性、药代和肝微粒代谢稳定性进行了测试。mdr-mdck细胞可作为一种体外血脑屏障(blood-brainbarrier,bbb)透过性的评价模型,利用该细胞模型发现jkf-034具有更高的bbb穿透性(permeabilitycoefficient)达到(a-b,57.33×10-6cm/sec),而cs7171表现出中等bbb穿透性达到(a-b,7.91×10-6cm/sec),因此,相比之下jkf-034能更有效的穿透bbb(表1)。在药代实验中,两个化合物都在口服后快速吸收,其tmax参数从0.25至5小时。jkf-034的半衰期是cs7171的十倍左右。cs7171和jkf-034的生物利用度分别是28.2和19.3。cs7171的较高的生物利用度提示了较高的成药性(表2)。在代谢稳定性实验中,cs7171和jkf-034的半衰期均小于30分钟,说明两个化合物都代谢的比较快速(表3)。
表1化合物cs7171、jkf-034的bbb穿透性
表2化合物cs7171、jkf-034的生物利用度
表2化合物cs7171、jkf-034的半衰期
我们认为能抑制rac1活性的小分子化合物都有可能具有通过抑制过快遗忘而改善ad所导致的认知问题。所以,以下小分子均有可能具有治疗ad的作用:
1)通过调节rhogdi的secramine,azd0530;
2)通过抑制gef与rac1结合的nsc23766,ehop-016,mbq-167,aza1,aza197,compound19,zinc08010136,zinc07949036,69391,1a-116,itx3,itx1,cpypp;
3)通过调节rac1-gtp迁移到膜上的ggtase1inhibitor:p61a6,statins;
4)通过抑制核苷酸结合的eht1864,compound1,mls000532223,r-ketorolac,mtx;
5)通过抑制下游作用蛋白的osu-3012,fl172,frax597,phox-11,187-1和wiskostatin。
- 还没有人留言评论。精彩留言会获得点赞!