黄芩三种成分协同增强FGF2促细胞增殖的用途的制作方法
本发明属分子生物学技术领域,具体涉及黄芩三种成分协同增强fgf2促细胞增殖的用途。
背景技术:
中药成分复杂多样,开发切实可行的现代中药活性成分快速筛选和识别是中药现代研究与开发的关键。生物活性成分的筛选是中药研究领域的重要内容。传统的化学分离、结构鉴定、活性筛选模式到活性导向化学分离存在目标不明确、操作繁琐、工作量大、周期长、活性成分在分离过程中易丢失等诸多不足。现代药理学研究表明,药物与生物大分子(如酶、受体、dna、rna等)的亲和是其发挥作用的第一步。我们开发了一种快速筛选中药中生物活性成分的方法:多室电泳分离系统并联用高效液相色谱串联质谱技术。该技术能在生理状态将溶液状态的蛋白质分离,满足靶分子亲和技术中快速将靶分子-活性分子复合物从孵育溶液中分离出来,减少分离过程中复合物解离的要求。多室电泳的优势在于:1)具有简便快速、作用靶点明确、靶点无需标记、筛选单靶点多成分、筛选多靶点多成分等;2)多室、多维、体外“可视”、动态分析活性成分与靶点的协同作用及变化;3)从单方或复杂组方活性成分中筛选与已知靶点结合的未知活性成分,同时发现促进已知成分与靶点的结合效应的活性成分。该技术与已有筛选技术相比,具有简便快速、作用靶点明确、靶点无需标记、无需固定化、筛选单靶点多成分、筛选多靶点多成分等优势。研究报道:基于多室电泳分离系统在ph为7.4,电压8v,分离时间15min的条件下从孵化后的溶液中分离出酶-活性成分复合物,并联用高效液相色谱串联质谱技术对筛选出的活性成分进行定性分析,并筛选出七种潜在的α–葡萄糖苷酶抑制剂。
fgf2可促进细胞分裂增殖,参与包括小鼠乳腺上皮、肺上皮、唾液腺上皮等多种组织分支形态发生。fgf2在乳腺导管上皮细胞、肌上皮细胞和腺泡上皮细胞中均有表达。fgf2与乳腺分支形成密切相关,可控制小鼠乳腺导管延长,促进乳腺发育过程中细胞增殖和乳腺上皮扩张。
黄芩(scutellariabaicalensisgeorgi)是药用植物黄芩的根部,具有去热燥湿、清火解毒、安胎、调节免疫、防治糖尿病、抗炎抗凋亡等作用。相关研究表明,黄芩的抗菌及抗病毒作用较强,其所含的黄芩素及黄芩苷可有效抑制体外多种革兰氏阳性及阴性菌,并能对导致病性皮肤真菌起到有效的抑制作用,此外黄芩苷及黄芩素在抗肿瘤、抗过敏、抗动脉粥样硬化以及对肝脏和中枢神经系统保护中也有一定的作用。黄芩中富含的多种黄酮类化合物黄芩苷及黄芩素,汉黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷,汉黄芩苷具有一定的抗肿瘤活性,千层纸素a-7-0-β-d-葡萄糖醛酸苷具有抗氧化作用。因此,其药理应用广泛及开发前景广阔,具有较大的研究应用空间。
技术实现要素:
本发明目的是为解决中药成分之间的协同作用及中药与蛋白药物联合给药的协同作用的问题,而提供黄芩三种成分协同增强fgf2促细胞增殖的应用。
黄芩提取物-fgf2复合物,它是黄芩提取物与fgf2共孵化获得的复合物,所述的黄芩提取物为黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷或汉黄芩苷,获得的复合物为fgf2-黄芩苷复合物、fgf2-千层纸素a-7-0-β-d-葡萄糖醛酸苷复合物或fgf2-汉黄芩苷复合物;
所述的孵化为:
1)取黄芩提取物,用其5~20倍重量的甲醇溶解黄芩提取物,得到甲醇溶液;
2)将fgf2靶蛋白溶解于pbs缓冲液,得fgf2pbs溶液;
3)fgf2pbs溶液和黄芩提取物甲醇溶液,混合;
4)在36~38℃下孵化25~35min,真空冷冻干燥,得到黄芩提取物-fgf2复合物;
步骤2)所述的pbs缓冲液的浓度为10mm、ph值为6.8;
步骤3)所述的fgf2pbs溶液和黄芩提取物甲醇溶液,按体积比1:1混合;
步骤4)在37℃下孵化30min。
fgf2-黄芩苷复合物、fgf2-千层纸素a-7-0-β-d-葡萄糖醛酸苷复合物和/或fgf2-汉黄芩苷复合物在促细胞增殖方面的应用。
发明详述:本发明以电泳原理为基础,再结合靶分子亲和原理,依据生物大分子的两性研发的。在生理状态下将溶液状态的蛋白质分离,满足靶分子亲和技术中快速将靶分子-活性分子复合物从孵育溶液中分离出来,减少分离过程中复合物解离的要求。具有简便快速、作用靶点明确、靶点无需标记、筛选单靶点多成分、筛选多靶点多成分等优势;多室、多维、体外“可视”、动态分析活性成分与靶点的协同作用及变化;从单方或复杂组方活性成分中筛选与已知靶点结合的未知活性成分,同时发现促进已知成分与靶点的结合效应的活性成分。
本发明提供了黄芩提取物-fgf2复合物,它是黄芩提取物与fgf2共孵化获得的复合物,所述的黄芩提取物为黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷或汉黄芩苷,获得的复合物为fgf2-黄芩苷复合物、fgf2-千层纸素a-7-0-β-d-葡萄糖醛酸苷复合物或fgf2-汉黄芩苷复合物;所述的孵化为:1)取黄芩提取物,用其5~20倍重量的甲醇溶解黄芩提取物,得到甲醇溶液;2)将fgf2靶蛋白溶解于pbs缓冲液,得fgf2pbs溶液;3)fgf2pbs溶液和黄芩提取物甲醇溶液,混合;4)在36~38℃下孵化25~35min,真空冷冻干燥,得到黄芩提取物-fgf2复合物;fgf2-黄芩苷复合物、fgf2-千层纸素a-7-0-β-d-葡萄糖醛酸苷复合物和/或fgf2-汉黄芩苷复合物在促细胞增殖方面的应用。细胞实验结果表明,黄芩提取物-fgf2复合物对细胞的增值效果比fgf2单独给药效果更佳明显。
附图说明
图1总离子扫描色谱图;
图2总离子扫描色谱放大图;
图314v电压下负接收室mrm模式分段检测色谱图;
图4电泳后负接受室mrm分段检测色谱图;
图53种活性成分结构式示意图;(1):黄芩苷,(2):千层纸素a-7-0-β-d-葡萄糖醛酸苷,(3):汉黄芩苷;
图6fgf2与黄芩活性成分结合方式示意图;
图7黄芩活性物质给药浓度筛选结果;bc:黄芩苷,wgs:汉黄芩苷,oxs:千层纸素a-7-0-β-d-葡萄糖醛酸苷;
图8fgf2的给药浓度筛选结果;
图9药物和fgf2单独给药以及协同给药24h后细胞增值结果;
图10药物和fgf2单独给药以及协同给药48h后细胞增值结果。
具体实施方式
实施例1黄芩提取液的制备
药店购买干燥黄芩饮片,除杂质,将干燥的黄芩研磨成均一的粉末,称取2g粉末加入20ml甲醇进行超声波萃取,萃取3次,每次20min,过滤后合并萃取液,过0.22μm滤膜,吹氮浓缩吹干,超纯水回溶,过0.22μm滤膜,在4℃下保存直至使用。
实施例2筛选黄芩提取液中与fgf2结合的成分
1、fgf2-黄芩活性成分复合物的制备
fgf2冻干粉溶解于10mmph6.8乙酸铵缓冲液,得fgf2乙酸铵溶液;按fgf2乙酸铵溶液:黄芩提取液(v:v)=1:1配比,混合,形成fgf2-黄芩提取液混合液;在37℃下孵化30min,使黄芩提取液中的活性成分与fgf2结合,形成fgf2-黄芩活性成分复合物;
2、多室电泳分离
孵化后的fgf2-黄芩提取液混合液作为样品溶液,黄芩提取液作为对照溶液,分别为实验组和对照组;采用多室电泳技术,装置参考cn104307368a发明专利所述的专用电泳分离装置;电泳装置的进样室由两个醋酸纤维素膜组成,其孔径≤0.2μm;醋酸纤维素膜的两端分别为正电极室和负电极室,在正电极室和负电极室加入缓冲溶液,使正电极室和负电极室的液面高度与进样室中样品的高度相同,无液面差;具体操作步骤如下:
1)将裁剪好的醋酸纤维素膜和超滤膜浸泡在缓冲溶液中5分钟,使膜完全浸湿;
2)用超纯水洗瓶清洗膜表面,再用干净的缓冲溶液浸泡;
3)根据聚四氟乙烯隔片裁剪醋酸纤维素膜和超滤膜各2片;
4)共3片聚四氟乙烯隔片(厚),每2片隔片中间放一片醋酸纤维素膜(/),例如:厚隔片/厚隔片/厚隔片;
5)共2片聚四氟乙烯隔片(薄),薄隔片与厚隔片中间放一片超滤膜(\),例如:薄隔片\厚隔片/厚隔片/厚隔片\薄隔片;
6)步骤4)和5)组合后,放在俩电极槽之间,套上夹片拧紧,注意:膜保持平整状态,不可使膜变形;
7)底部涂抹少许凡士林,粘在玻璃片上,确保密封性良好;
8)组装好的分离系统与缓冲系统链接,调节开关使缓冲液平稳流动;
9)俩接收室中各放100μl缓冲溶液,用注射针将100μl样品溶液或对照溶液,加到电泳装置的进样室中;
10)将电极室放入电极槽,施加电压12v、时间15min;
11)电泳结束后,取出各室中溶液于1.5ml离心管中,待用;
3、fgf2-黄芩活性成分复合物的解离
用600μl甲醇解离接收室中的溶液,1200rpm离心取上清液;将上清液浓缩到100μl,分别转移到进样瓶等待检测;其余各室的溶液用相同方法解离,作为实验参考;
实施例3与fgf2结合的黄芩活性成分的定性分析
1、实施例2解离后的接收室中的溶液,进行hplc高效液相色谱—串联质谱和核磁共振波谱分析;
色谱条件:
色谱柱:c18(4.6mm×150mm、5μm)
流动相:0.1%甲酸水溶液(a)、0.1%甲酸乙腈溶液(b)
进样量:5μl
流速:0.5mlmin-1
梯度洗脱流程:
时间(min)流动相b(%)
00
70
1025
2040
3065
4080
质谱条件:
电喷雾离子源,负离子模式,采用全扫描模式;喷雾气压力:30psi;干燥气(n2)流速:13.0l/min,干燥气温度:300℃;毛细管电压:2500v,毛细管出口电压:135v;质量数扫描范围:100-600m/z。
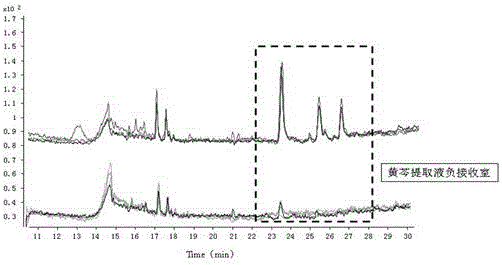
实验组和对照组总离子扫描色谱图及放大图分别如图1、2所示;从图中可以看出黄芩中有3种活性成分与fgf2结合并且迁移致负接收室;保留时间见表1;经鉴定,黄芩提取液负接收室中编号1、2、3的活性成分分别为黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷、汉黄芩苷,表明黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷、汉黄芩苷可与fgf2结合,形成相应的复合物;
2、mrm检测(质谱多反应检测)
实验组和对照组分别进行mrm检测,进行在14v电压条件下的负接收室溶液的质谱分析,mrm模式分段检测色谱图如图3;从图中fgf2-黄芩提取液负接收室和黄芩提取液负接收室总离子色谱图对比,说明黄芩提取液中有3个活性成分与fgf2有结合并对比标准品初步定性出3个活性成分分别为黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷、汉黄芩苷。
采用多室电泳分离得到的接收室中的溶液作为样品,进行mrm分段检测;具体操作如下:首先建立了黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷、汉黄芩苷三种活性成分的mrm检测方法,方法信息见表2;负接受室mrm分段检测色谱图见图4,结果表明筛选出的3个活性成分确定为黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷、汉黄芩苷;活性成分的结构式详见图5;
3、fgf2与黄芩活性成分的结合方式
利用autodock软件对三种化合物与fgf2进行计算机拟合,考察小分子与蛋白的结合位点及氢键数;
a.fgf2与黄芩苷结合位点(图6a):asn-27:27位的天冬酰胺(2个氢键);arg-120:120位的精氨酸(1个氢键);lys-125:125位的赖氨酸(1个氢键);lys-135:135位的赖氨酸(2个氢键);
b.fgf2与千层纸素a-7-0-β-d-葡萄糖醛酸结合位点(图6b):asn-27:27位的天冬酰胺(5个氢键);arg-120:120位的精氨酸(2个氢键);lys-135:135位的赖氨酸(1个氢键);
c.fgf2与汉黄芩苷结合位点(图6c):asn-27:27位的天冬酰胺(1个氢键):arg-120:120位的精氨酸(2个氢键);lys-125:125位的赖氨酸(1个氢键);lys-135:135位的赖氨酸(2个氢键);
fgf2与3种活性成分的结合,均是以氢键结合;黄芩苷与汉黄芩苷结合位点完全一样,但是氢键数不一样;千层纸素a-7-0-β-d-葡萄糖醛酸苷缺少125位的赖氨酸(lys-125)上的氢键。
实施例4与fgf2结合的黄芩活性成分的定量分析
1、bca蛋白浓度检测实验
采用bca法测定fgf2-黄芩活性成分复合物中蛋白浓度;
具体内容:按照bca蛋白浓度检测说明书配置标准曲线样品,将标准曲线样品以及经多室电泳后的样品往96孔板加入20μl,以及加入bca工作液,60℃孵化30min,利用酶标仪在吸光值562nm处检查。
bca标准曲线的回归方程:y=0.11107+0.00117x,r2=0.9999;蛋白浓度为0.5mg/ml;
2、制作标准曲线
hplc-ms/ms实验平台线性范围和灵敏度的评估,分别称取黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷和汉黄芩苷的标准品分别为1mg,0.5mg,0.5mg溶解于5ml甲醇溶液中,取50μl移至5ml容量瓶中,即制成表2中s6浓度样本。用s6样本倍比稀释成s1-s6梯度浓度的样本,用于标准曲线确定和线性关系验证。s1浓度水平样本稀释至更低浓度梯度上机检测,测定信噪比(s/n),直至s/n10:1.在平行处理5个样本,满足精密度(rsd)小于20%,则此时的样本浓度即为仪器的检测下限。
hplc-ms/ms平台标准曲线是由工作站软件自动处理给出,其主要原理是根据检测的s1~s6系列浓度和相应的峰面积,绘制标准浓度-标准浓度面积的曲线,并计算曲线方程和相关系数r。
回归方程见下表4;
3、三种成分与fgf2结合的黄芩活性成分定量分析及结合比例计算
依据实施例2和实施例3获得与fgf2结合的三种成分,结合实施例4中的标准曲线,进行定量分析;黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷、汉黄芩苷三种活性成分成分摩尔浓度的具体测定方法为将mrm检测fgf2+黄芩提取液负接收室和黄芩提取液负接收室以及制作完的标准曲线使用定量软件计算活性成分摩尔比;结果见表5
,可以得出黄芩苷、千层纸素a-7-0-β-d-葡萄糖醛酸苷、汉黄芩苷与fgf2蛋白结合后小分子之间的比例为3:1:1;
实施例5fgf2-黄芩活性成分复合物的制备
1、fgf2-黄芩苷复合物
取黄芩苷标准品,用其10倍重量的甲醇溶解黄芩苷标准品,得到黄芩苷甲醇溶液;fgf2靶蛋白溶解于10mmph6.8pbs缓冲液,得fgf2pbs溶液;按fgf2pbs溶液:黄芩苷甲醇溶液(v:v)=1:1配比,混合,形成fgf2-黄芩苷混合液;在37℃下孵化30min,使黄芩苷甲醇溶液中的黄芩苷与fgf2结合,形成fgf2-黄芩苷复合物;将孵化后的混合液真空冷冻干燥,即得到fgf2-黄芩苷复合物;
2、fgf2-千层纸素a-7-0-β-d-葡萄糖醛酸苷复合物
制备方法同fgf2-黄芩苷复合物相同;
3、fgf2-汉黄芩苷复合物
制备方法同fgf2-黄芩苷复合物相同。
实施例6fgf2-黄芩活性成分复合物的制备
1、fgf2-黄芩苷复合物
取黄芩苷标准品,用其10倍重量的100%二甲基亚砜溶液溶解黄芩苷标准品,得到黄芩苷二甲基亚砜溶液;fgf2靶蛋白溶解于10mmph6.8pbs缓冲液,得fgf2pbs溶液;按fgf2乙酸铵溶液:黄芩苷二甲基亚砜溶液(v:v)=1:1配比,混合,形成fgf2-黄芩苷混合液;在37℃下孵化30min,使黄芩苷二甲基亚砜溶液中的黄芩苷与fgf2结合,形成fgf2-黄芩苷复合物;将孵化后的混合液真空冷冻干燥,即得到fgf2-黄芩苷复合物。
2、fgf2-千层纸素a-7-0-β-d-葡萄糖醛酸苷复合物
制备方法同fgf2-黄芩苷复合物相同;
3、fgf2-汉黄芩苷复合物
制备方法同fgf2-黄芩苷复合物相同。
实施例7三种成分与fgf2联合给药促细胞增殖实验
1.给药浓度的筛选
根据实施例2-4过程中定性定量分析确定了三种活性物质黄芩苷(bc)、千层纸素a-7-0-β-d-葡萄糖醛酸苷(oxs)、汉黄芩苷(wgs),同时确定黄芩苷:千层纸素a:汉黄芩苷的比例为3:1:1进行给药浓度筛选;同时筛选fgf2的给药浓度;
具体步骤如下:
1)将nih3t3细胞用含10%fbs的dmem调整到浓度为2*104个/ml,接种于96孔板,每孔100ul;
2)在浓度的5%co2下、37℃恒温培养箱中培养24h后,化合物组加入无血清dmem稀释的化合物:图7中化合物的浓度如下:化合物单体梯度给药,给药浓度为:200μm、100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm、0.78125μm;图8fgf2组给药浓度为200ng/ml、100ng/ml、50ng/ml、25ng/ml、12.5ng/ml、6.25ng/ml、3.125ng/ml、1.5625ng/ml、0.7825ng/ml;
3)设立无细胞空白对照组(只加入无血清dmem),无细胞药物对照组(无血清dmem稀释的各种浓度药物),和细胞对照组(只加入无血清dmem),均设5个复孔;实验重复3次;
4)培养48h后,加入mtt,每孔20ul,5%co2,37℃恒温培养箱中培养48h后,在镜下观察是否形成紫色丝状或圆形结晶,加入100uldmso,轻轻震荡10min后,用酶标仪在562nm波长下,检测各孔od值;
结果见图7、8;如图7所示,黄芩三个成分3个活性成分单独个化合物给药时对细胞对细胞无促进增值作用,确定化合物给药浓度在50-1.5625μm;从图8中可知,fgf2单独给药时,fgf2的给药浓度为50ng/ml,促细胞增殖作用最好。
2.联合给药增殖作用的效果
基于上述给药浓度筛选结果基础上,三种化合物和fgf2按照实施例4中筛选的化合物的比例3:1:1联合给药;三种化合物的给药浓度范围在30-1.13μm梯度给药,fgf2给药浓度50ng/ml固定给药;具体步骤如下:
1)将nih3t3细胞用含10%fbs的dmem调整到浓度为2*104个/ml,接种于96孔板,每孔100ul;
2)在浓度的5%co2下、37℃恒温培养箱中培养24h后,化合物组加入无血清dmem稀释的化合物:图9、图10中化合物浓度如下:
n:空白对照组:只加入无血清dmem;
bc:从左至右依次为黄芩苷30.00μm、15.00μm、7.50μm、3.75μm;
wgs:从左至右依次为汉黄芩苷9.56μm、4.78μm、2.39μm、1.295μm;
oxs:从左至右依次为千层纸素a-7-0-β-d-葡萄糖醛酸苷9.04μm、4.52μm、2.26μm、1.13μm;
fgf2:加入无血清dmem稀释,使fgf2浓度为50ng/ml;
fgf2+bc:从左至右依次为(1)黄芩苷=30.00μm、50ng/ml的fgf2,(2)黄芩苷=15.00μm、50ng/ml的fgf2,(3)黄芩苷=7.50μm、50ng/ml的fgf2,(4)黄芩苷=3.75μm、50ng/ml的fgf2;
fgf2+wgs:从左至右依次为(1)50ng/ml的fgf2、汉黄芩苷=9.56μm,(2)50ng/ml的fgf2、汉黄芩苷=4.78μm,(3)50ng/ml的fgf2、汉黄芩苷=2.39μm,(4)50ng/ml的fgf2、汉黄芩苷=1.295μm;
fgf2+oxs:从左至右依次为(1)50ng/ml的fgf2、千层纸素a-7-0-β-d-葡萄糖醛酸苷=9.04μm,(2)50ng/ml的fgf2、千层纸素a-7-0-β-d-葡萄糖醛酸苷=4.52μm,(3)50ng/ml的fgf2、千层纸素a-7-0-β-d-葡萄糖醛酸苷=2.26μm,(4)50ng/ml的fgf2、千层纸素a-7-0-β-d-葡萄糖醛酸苷=1.13μm;
bc+wgs+oxs:从左至右依次为(1)黄芩苷=30.00μm、汉黄芩苷=9.56μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=9.04μm,(2)黄芩苷=15.00μm、汉黄芩苷=4.78μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=4.52μm,(3)黄芩苷=7.50μm、汉黄芩苷=2.39μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=2.26μm,(4)黄芩苷=3.75μm、汉黄芩苷=1.295μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=1.13μm;
fgf2+bc+wgs+oxs:从左至右依次为(1)50ng/ml的fgf2、黄芩苷=30.00μm、汉黄芩苷=9.56μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=9.04μm,(2)50ng/ml的fgf2、黄芩苷=15.00μm、汉黄芩苷=4.78μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=4.52μm,(3)50ng/ml的fgf2、黄芩苷=7.50μm、汉黄芩苷=2.39μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=2.26μm,(4)50ng/ml的fgf2、黄芩苷=3.75μm、汉黄芩苷=1.295μm、千层纸素a-7-0-β-d-葡萄糖醛酸苷=1.13μm;
3)设立无细胞空白对照组(只加入无血清dmem),无细胞药物对照组(无血清dmem稀释的各种浓度药物),和细胞对照组(只加入无血清dmem),均设5个复孔;实验重复3次;
4)培养48h后,加入mtt,每孔20ul,5%co2,37℃恒温培养箱中培养48h后,在镜下观察是否形成紫色丝状或圆形结晶,加入100uldmso,轻轻震荡10min后,用酶标仪在562nm波长下,检测各孔od值;
结果见图9、10所示,黄芩三个化合物单独给药时对细胞几乎没有促进增值作用,但是3种活性成分协同给药时,对细胞是有促进增值效果的;三个化合物分别与fgf2结合,以及三个化合物与fgf2联合,给药时对细胞的增值效果都比fgf2单独给药效果更佳明显且给药24h和48h对比48h对细胞增殖作用效果显著;结论:根据结合比例后给药,对细胞有促进增值作用。
- 还没有人留言评论。精彩留言会获得点赞!