miR-124-3p与其类似物在制备抗乳腺癌疾病药物中的应用的制作方法
本发明属于生物医药技术领域,具体涉及miR-124-3p与其类似物在制备抗乳腺癌疾病药物中的应用。
背景技术:
乳腺癌是一个世界范围内严重危害女性健康的恶性肿瘤。2015年发表的中国癌症统计数据中女性最常见恶性肿瘤为乳腺癌,占所有女性癌症的15%,是45岁以下女性最常见的癌症死因。2019年美国最新统计数据中,乳腺癌在女性新发癌症中排第一位,独占30%,死亡率也仅次于肺癌,为15%。乳腺癌目前的临床治疗以个体化治疗为主导,DNA芯片技术对乳腺癌分子水平特征研究的发展,使得根据基因表达谱的乳腺癌分类系统对治疗方式的指导意义日趋明显,建立在基因检测基础上的复发转移风险评估也影响着治疗的决策。现有化疗、放疗、内分泌治疗、针对Her2的靶向治疗都对乳腺癌患者的预后有明显的帮助,但这些治疗并非一把“万能钥匙”,无法完全覆盖所有亚型的乳腺癌,仍有一部分不敏感的难治型乳腺癌以及明显耐药的问题出现。因此,更深入地多方面地认识乳腺癌的发生发展及耐药机制,有助于开拓新的治疗渠道,开发新药物,这是针对耐药和难治性乳腺癌的治疗策略之一。比如Her2阳性乳腺癌患者耐药后,使用拉帕替尼和帕妥珠单抗,内分泌治疗耐药患者使用mTOR抑制剂,三阴性乳腺癌化疗耐药后针对BRCA1或血管内皮生长因子(vascular endothelial growth factor,VEGF)进行治疗,这些均是由临床需要所催生出的新型治疗方法。因此,通过对乳腺癌发生发展及耐药机制的深入理解,研发新的治疗靶点,下调耐药,增加治疗的覆盖广度,以提高乳腺癌群体的无病生存率和总体生存率,仍将是目前乳腺癌治疗的重点研究方向。
MicroRNA是近年来在果蝇、线虫、小鼠和人等多种生命体中被发现的一类具有转录后调节活性的小分子RNA,长度约为22个核苷酸。通过文库的构建和测序,人们掌握了microRNA的大量序列信息,通过对这些序列进行生物信息学比对分析,人们发现:大部分microRNA在物种间高度保守,在进化上高度同源,其通过与mRNA(messenger RNA)的3’非翻译区(3’untranslational region,3’-UTR)相互作用从而调控mRNA的翻译,进而广泛参与发育、肿瘤、炎症等多种生物学活动。研究发现,miRNA在许多人类肿瘤中均有异常的表达,它们或通过改变癌基因或抑癌基因的表达,直接影响肿瘤的生长、增殖和凋亡,或与肿瘤的表型、分期及患者生存有相关性,从而以早期诊断和监测病情的生物标志物的身份出现。例如:miR-200家族,可以通过靶向抑制ZEB1等转录因子的表达,从而抑制上皮间质化,最终抑制了肿瘤的侵袭。
成熟的miR-124-3p是由RNA聚合酶Ⅱ转录而来的转录初产物(pri-miRNA)加工而成。Pri-miRNA在细胞核内被Drosha核酸内切酶切成约70个核苷酸的茎环状RNA链,被称为miRNA前体(pre-miRNA)。Pre-miRNA由核质/细胞质转运蛋白5(exportin-5)转运到胞浆中,由双链RNA专一性RNA内切酶Dicer酶切成21~23个核苷酸的双链RNA,其中一条即为成熟的miRNA,另一条为互补链。成熟的miR-124与Argonaute蛋白家族结合形成RNA诱导沉默复合物(RNA-induced silencing complex,RISC)。通过核酸序列互补结合于靶基因mRNA的3'非编码区,发挥抑制靶基因mRNA翻译或降解靶基因mRNA的作用。
miR-124-3p是中枢神经系统中含量最多的一种miRNA,在哺乳动物脑的发育过程中,miR-124-3p的表达量在胎儿时期逐渐增加,在胚胎发育后期达到顶峰,出生后一直处于高表达水平。miR-124-3p可以识别上百种靶mRNA,对神经系统的发育有着决定性意义。许多研究表明,由于miR-124-3p含量减少其对下游靶基因的抑制作用减弱,通过不同通路导致了肿瘤的发生。在神经管母细胞瘤及多形性成胶质细胞瘤的患者瘤细胞中检测到miR-124-3p表达减少,导致CDK-6的异常增高,而该项指标增高是预后差的标志。在肝癌细胞中,miR-124-3p的表达也显著减少,导致磷脂酰肌醇3激酶(PI3K)催化亚基的表达增加,最终通过PI3K/Akt通路导致细胞大量增殖。临床研究也表明,结直肠癌患者的癌细胞中miR-124-3p的表达量显著低于正常水平。
技术实现要素:
本发明的目的是提供miR-124-3p与其类似物在制备抗乳腺癌疾病药物中的应用,开发了miR-124-3p的新的医药用途,具体是指miR-124-3p在恶性肿瘤诊断及分子靶向治疗中的应用,揭示了miR-124-3p在乳腺癌诊断和治疗中的潜在价值。
为了达到上述目的,本发明的技术方案如下:
本发明的第一方面,提供miR-124-3p的新的医药用途,具体是指miR-124-3p与其类似物在制备抗乳腺癌疾病药物中的应用,所述的miR-124-3p的序列如下:5’-UAAGGCACGCGGUGAAUGCCAA-3’。
本发明所述的miR-124-3p可以来自被分离细胞,或者可通过人工合成的方式获得。
进一步,所述miR-124-3p与其类似物包括但不限于:miR-124-3p序列;特异性干扰miR-124-3p基因表达、加工的小干扰分子,如siRNA分子、miRNA分子、反义核苷酸等;含有miR-124-3p序列的表达质粒;含有miR-124-3p序列的高表达腺病毒或慢病毒。
本发明中,所述的抗乳腺癌疾病药物是指能够提高或增加miR-124-3p表达量的试剂。
本发明中,所述的药物能够通过靶向分子MGAT5抑制乳腺癌细胞的增殖和迁移。进一步的,miR-124-3p通过直接靶向MGAT5的3’-UTR区域发挥作用。
又,所述的抗乳腺癌是指预防或治疗乳腺癌。
本发明第二方面,还提供一种药物组合物,该药物组合物以miR-124-3p为唯一活性成份,或者是含有miR-124-3p的药物组合物。
进一步,所述的药物组合物是指含有有效量的所述的miR-124-3p或其促进剂,以及药学上可接受的载体。
进一步,所述“药学上可接受的”的成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质。所述“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。所述“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。在组合物中药学上可接受的载体可含有液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、pH缓冲物质等。
本发明的miR-145-3p的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:miR-124-3p的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病、患者的体重、患者的免疫状况、给药的途径等。
本发明中,任何适用的给药途径都是可以的,包括但不限于:口服、静脉内注射、皮下注射、肌肉给予、局部给予、植入、缓释给予等;优选的,所述给药方式是非肠道给予的。
本发明的第三方面,提供miR-124-3p在制备乳腺癌疾病诊断试剂或诊断试剂盒中的应用。
进一步,所述的诊断试剂为检测miR-124-3p表达量或有效量的试剂。
再,所述的诊断试剂盒包含检测miR-124-3p表达量或有效量的试剂。
所述的诊断试剂盒包含:(i)检测miR-124-3p有效量的一种或多种试剂;(ii)选自下组中的一种或多种物质:容器、使用说明书、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂,例如用于混悬或固定细胞的溶液,可检测的标签或标记,使核酸易于杂交的溶液,用于裂解细胞的溶液,或用于核酸纯化的溶液。
本发明中,所述的检测miR-124-3p表达量或有效量的试剂包括对miR-124-3p具有检测特异性的PCR引物,引物序列如下:
上游引物(Forward Primer):CGACGTAAGGCACGCG;
下游引物(Reverse Primer):CAGTGCAGGGTCCGAGGTAT。
本发明通过试验验证了,过表达miR-124-3p可显著抑制乳腺癌细胞的增殖和迁移能力。本发明研究发现,miR-124-3p在MGAT5的3’-UTR区域存在保守的靶位点,并通过试验验证了:乳腺癌组织中MGAT5mRNA的表达量显著高于正常乳腺组织,且miR-124-3p的作用靶点是MGAT5,miR-124-3p通过直接靶向MGAT5的3’-UTR区域发挥作用。
本发明中过表达MGAT5可修复过表达miR-124-3p对乳腺癌细胞增殖能力的抑制作用,过表达MGAT5也可抵消由miR-124-3p上调引起的乳腺癌细胞克隆形成能力的下降,上调MGAT5的表达可以修复由于过表达miR-124-3p对乳腺癌细胞迁移能力的抑制作用,干扰MGAT5的表达可以抵消由于下调miR-124-3p对乳腺癌细胞迁移能力的促进作用。因此,过表达miR-124-3p可以有效的抑制乳腺癌细胞的增殖和迁移能力,而这个作用的发挥,是通过抑制癌基因MGAT5的表达来实现的。同时miR-124-3p在体内同样可以通过靶向MGAT5对乳腺癌肿瘤的生长的起到抑制作用
本发明的有益效果:
本发明通过在乳腺癌细胞中过表达miR-145-3p表明,miR-124-3p可抑制细胞的增殖和迁移。此外,在乳腺癌患者中,乳腺癌组织中miR-124的表达量显著低于正常乳腺组织,且差异具有统计学意义(P<0.05),其临床参考价值和可信度较高,其低表达与患者总生存率密切相关,提示miR-124-3p水平可能作为乳腺癌患者诊断和临床预后的重要标记物。为治疗乳腺癌及临床预后提供了诊断依据和作用靶点。
本发明经实验证明,在乳腺癌发生过程中,miR-124-3p的表达受到显著抑制;恢复miR-124-3p的表达可以通过靶向分子MGAT5抑制乳腺癌细胞的增殖和迁移,从而发挥抗肿瘤作用。
本发明为乳腺癌诊断和临床预后提供了潜在的重要标识物,也为乳腺癌的临床治疗提供了新的潜在分子靶点。
附图说明
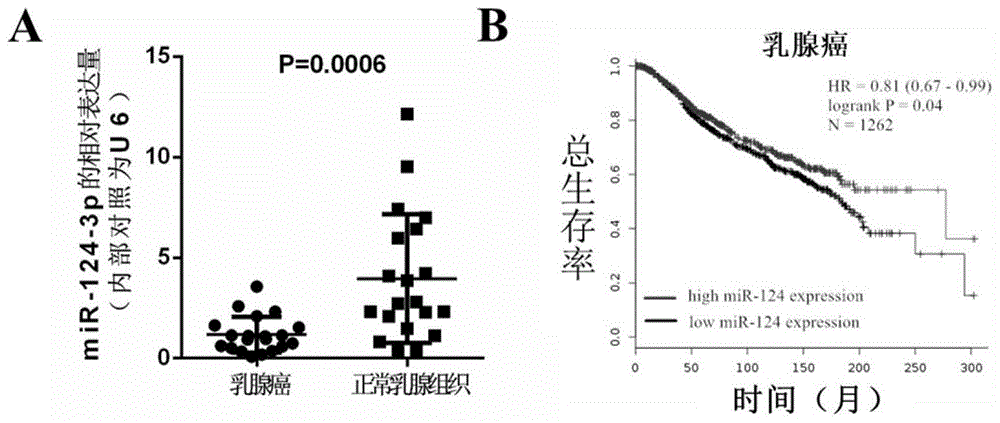
图1为本发明实施例1中(A)qRT-PCR法抽提20对患者的乳腺癌及正常乳腺组织标本中miR-124-3p的表达定量分析结果,(B)1262名乳腺癌患者miR-124的表达与总体存活率(OS)之间的关系分析结果。
图2为本发明实施例2中miR-124-3p抑制乳腺癌细胞的增殖能力结果,其中,(A)-(B)为CCK-8细胞活力试验检测各组细胞的增殖活性结果,(C)EDU细胞增殖实验检测各组细胞的增殖能力结果;(D)克隆形成实验检测各组细胞的克隆形成能力结果。数据以均值±标准差(n=3)的形式表达,*P<0.05,**P<0.01。
图3为本发明实施例2中miR-124-3p抑制乳腺癌细胞的迁移能力结果,其中,(A)为Transwell实验结果,(B)为划痕实验实验结果。数据以均值±标准差(n=3)的形式表达,*P<0.05,**P<0.01。
图4为本发明实施例3中(A)miR-124-3p与MGAT5靶位点配对结合的示意图;(B)双荧光报告基因的检测结果;(C)20对患者的乳腺癌及正常乳腺组织标本的MGAT5mRNA的表达定量分析结果;(D)乳腺癌组织中miR-124-3p及MGAT5mRNA表达量相关性分析结果;(E)RT-PCR实验结果;(F)Western blot实验结果。
图5为本发明实施例4中(A)CCK-8细胞活力实验结果;(B)EDU实验结果;(C)克隆形成实验结果;(D)Transwell实验结果;(E)划痕实验结果。
图6为本发明实施例4中(A)CCK-8细胞活力实验结果;(B)EDU实验结果;(C)克隆形成实验结果;(D)Transwell实验结果;(E)划痕实验结果。
图7为本发明实施例5中(A)和(C)为各组处死后小鼠及解剖出的相应皮下瘤体照片;(B)为过表达组统计结果;(D)为干扰组统计结果。数据以均值±标准差(n=5)的形式表达。*,p<0.05;**,p<0.01。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
除非另有描述,本发明的实施将采用分子生物学、微生物学、重组DNA和免疫学的常规技术,这些均是本领域技术人员所知的。这些技术在下列文献中有完整的描述:例如,Sambrook《分子克隆实验指南》第2版(1989);《DNA克隆》第I和II卷(D.N.Glover编辑1985);《寡核苷酸合成》(M.J.Gait编辑,1984);《核酸杂交》(B.D.Hames和S.J.Higgins编辑.1984);以及《实验免疫学手册》I-IV卷(D.C.Weir和C.C.Blackwell编辑1986)。或者,可按照试剂生产商所提供的说明书进行。
除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1乳腺癌患者中miR-124-3p的表达分析及验证
收集上海长海医院甲乳外科乳腺癌手术20位患者的癌和正常乳腺组织样本,所有患者均在术前签署知情同意书,并通过上海长海医院伦理委员会的批准。术中取好乳腺癌组织及对应正常乳腺组织标本,编号后迅速放入液氮罐中,转移至–80℃冰箱保存。
实时荧光定量PCR:常规方法抽提20位患者的乳腺癌及正常乳腺组织标本的RNA,通过颈环结构的特异性引物(序列为:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCATTCAC)反转录miR-124-3p,测序显示反转录出的miR-124-3p的核苷酸序列为:5’-UAAGGCACGCGGUGAAUGCCAA-3’,然后进行实时荧光定量PCR检测,上游引物:CGACGTAAGGCACGCG;下游引物:CAGTGCAGGGTCCGAGGTAT,以双标准曲线方法定量,以U6的表达作为内参,分析各样本的miR-124-3p浓度,分析结果参见图1A,统计后发现,miR-124-3p在乳腺癌中的表达量显著低于正常乳腺组织(P=0.0006)。
将METABRIC数据库中1262名乳腺癌患者miR-124的表达与的总体存活率(OS)之间的关系用在线生物信息学工具Kaplan-Meier绘图仪分析,分析结果参见图1B,由图1B发现miR-124表达水平高的患者与低miR-124表达水平的患者相比,具有更好的生存获益,P<0.05。
以上结果显示,在乳腺癌发生过程中,miR-124-3p的表达会发生下调,而miR-124-3p的表达量,与患者总生存率预后呈负相关。这些提示miR-124-3p具有一定的诊断和预后价值。
实施例2 miR-124-3p抑制乳腺癌的增殖和和迁移
乳腺癌细胞培养:本发明所使用的人乳腺癌细胞系MDA-MB-231、MCF-7及293T细胞均购置于中国科学院典型培养物保藏委员会细胞库,用含有10%灭活胎牛血清(FBS,GIBCO,CA,USA)和双抗的DMEM培养基(Dulbecco’s modified Eagle’s medium,Invitrogen),置于含有5%的二氧化碳的37℃恒温湿化的培养箱中培养。其中培养MCF-7细胞所需培养基,每100ml中加入20IU胰岛素。
为了研究在乳腺癌中miR-124-3p下调所产生的生物学效应,申请人委托上海吉玛生物制药公司合成了miR-124-3p的模拟剂(mimics)用于体外高表达miR-124-3p、抑制剂(inhibitor)用于体外干扰表达miR-124-3p。
序列为:miR-124mimic:UAAGGCACGCGGUGAAUGCC;
miR-124inhibitor:GGCAUUCACCGCGUGCCUUA。
inhibitor NC:CAGUACUUUUGUGUAGUACAA;
mimic NC:UUGUACUACACAAAAGUACUG。
使用Lipofectamine3000转染试剂将miR-124-3p模拟剂(mimics)或miR-124-3p抑制剂(inhibitor)转染乳腺癌细胞系MDA-MB-231、MCF-7 72h后,采用CCK-8细胞增殖检测技术,结果参见图2A-B。其中,CCK-8细胞活力试验检测各组细胞的增殖活性结果显示:与mimic NC组的细胞相比,过表达miR-124显着降低了MDA-MB-231和MCF-7乳腺癌细胞的活力(图2A),可见,与对照组相比,恢复miR-124-3p的表达可显著抑制乳腺癌细胞的增殖;与Inhibitor NC组的细胞相比,抑制miR-124的表达显着增加了乳腺癌细胞系MDA-MB-231和MCF-7的细胞活力(图2B),可见,干扰miR-124-3p的表达,乳腺癌细胞的增殖能力显著升高。
进而,本发明分别将转染miR-124-3p mimics或miR-124-3p inhibitor及相应对照组小分子72小时后的乳腺癌细胞,进行EDU染色,荧光显微镜拍摄并统计细胞核染色结果,发现转染miR-124-3p mimics后可以显著减少乳腺癌细胞增殖能力,转染miR-124-3p inhibitor后,乳腺癌细胞的增殖能力显著升高(图2C),结果显示:与阴性对照组的细胞相比,过表达miR-124-3p显着降低了MDA-MB-231和MCF-7乳腺癌细胞的增殖能力;相反,抑制miR-124的表达则显着增加了乳腺癌细胞系MDA-MB-231和MCF-7细胞的增殖能力。为了验证上述实验结果,本发明将转染后的乳腺癌细胞进行克隆形成实验,待大多数单个克隆中细胞数>50后,4%多聚甲醛固定细胞,结晶紫染液染色30min,晾干后数码相机拍照整,克隆计数,结果参见图2D。结果显示:与对照组相比,过表达miR-124-3p组细胞克隆形成的数量明显减少,而抑制miR-124-3p的表达后,乳腺癌细胞克隆形成数量明显多于对照组(图2D)。上述研究结果提示,miR-124-3p可以抑制乳腺癌细胞的增殖。
接下来,本发明探讨了miR-124-3p对乳腺癌细胞迁移能力的影响。将转染48小时后的细胞制备成密度为1×105/ml的细胞悬液,取100-200μl细胞悬液加入Transwell小室;小室外加入500μl含FBS或趋化因子的培养基。常规培养12-48h。用棉签擦去基质胶和上室内的细胞,结晶紫染色后于正置显微镜进行观察和拍照,统计结果显示:Transwell实验验证各组细胞的穿孔能力,实验结果显示:过表达miR-124-3p组的细胞与阴性对照组相比,穿过小孔的细胞数明显下降,而干扰miR-124-3p组的细胞穿过小孔的细胞数较对照组明显增加(图3A)。同时,本发明将转染后的乳腺癌细胞铺于6孔板中,待细胞铺满皿底后,用小枪头垂直于背后的横线划痕,制造伤口模型。用PBS洗涤3次,加入无血清培养基。记录此时的划痕大小为0h,放入37℃5%CO2培养箱培养。按24h、48h取样,拍照,观察并统计分析划线愈合程度,结果显示:与阴性对照组相比,过表达miR-124-3p组的细胞划痕愈合能力显著下降,相反的,抑制miR-124-3p的表达,细胞划痕愈合能力显著升高(图3B)。这些结果表明,miR-124-3p可以抑制乳腺癌细胞的迁移能力。
实施例3、miR-124-3p直接靶向调控分子MGAT5的表达
本发明探讨了miR-124-3p作用的靶分子。
本发明研究中首先通过TargetScan(www.targetscan.Org)在线软件分析其作用的靶点,结合前述实验结果,推测MGAT5可能是miR-124-3p发挥抗肿瘤作用的靶点,miR-124-3p与MGAT5靶位点配对结合的示意图如图4A。通过构建上述分子的双荧光报告基因表达载体,我们发现miR-124-3p在MGAT5的3’-UTR区域存在保守的靶位点。
将293T细胞(5×103)接种到96孔板,待细胞达到对数生长期,将80ng构建好的MGAT5 3'-UTR-WT、MGAT5 3'-UTR-MUT、GP-miRGLO分别和8ng miR-124-3p mimics、mimicsNC,与1ul Lipofectamine3000共转染,48小时后按照Promega公司的Dual Luciferase Assay kit试剂盒说明书操作步骤,测定各组报告基因荧光素酶的活性,并以GP-miRGLO作为内对照,得到各组报告基因表达情况的数据,结果如图4B,与miR-124-3p mimics共转染组荧光值较对照组及突变组显著下降,因此,我们证实miR-124-3p的作用靶点是MGAT5。
qPCR检测实施例1中20对乳腺癌与对应正常乳腺组织中MGAT5mRNA的表达量定量分析,以β-actin的表达作为内参,结果显示:乳腺癌组织中MGAT5mRNA的表达量显著高于正常乳腺组织(P=0.0047)(图4C)。将实施例1中20对乳腺癌与正常乳腺组织中miR-124与MGAT5mRNA的表达水平进行相关性分析,结果显示:乳腺癌组织中miR-124-3p及MGAT5mRNA表达量相关性分析结果显示二者呈负相关性,r=-0.5815,P<0.01(图4D)。
进一步通过qPCR和Western Blot实验证实,转染miR-124-3mimics能够降低乳腺癌细胞系中MGAT5mRNA及蛋白水平的表达(图4E、F),上述结果显示,miR-124-3p通过直接靶向MGAT5的3’-UTR区域发挥作用。
进一步,本发明分别用miR-124-3p mimics、miR-124-3p inhibitor及相应的阴性对照瞬时转染乳腺癌细胞系MDA-MB-231、MCF-7,分别抽提RNA及蛋白,进行RT-PCR和Western Blot实验。RT-PCR实验结果显示(图4E):在两个细胞系中,过表达miR-124-3p后,MGAT5的mRNA表达水平明显降低(P<0.001);干扰miR-124-3p的表达后,MGAT5的mRNA表达量明显上升。Western blot实验验证过表达或干扰miR-124-3p的表达后,MGAT5蛋白表达量的变化,结果参见图4F。实验结果表明:过表达miR-124-3p之后,MGAT5蛋白表达量较对照组明显下降,抑制miR-124-3p的表达后,MGAT5蛋白表达量明显上升。数据以均值±标准差(n=3)的形式表达,*P<0.05,**P<0.01。通过qPCR和Western Blot实验证实,转染miR-124-3p mimics能够降低乳腺癌细胞系中MGAT5mRNA及蛋白水平的表达,上述结果提示,miR-124-3p通过直接靶向MGAT5的3’-UTR区域发挥作用。
实施例4:体外实验验证miR-124-3p通过靶向调节MGAT5抑制乳腺癌细胞的增殖和迁移
设计miR-124-3p及MGAT5的干扰及过表达序列,构建入PGLMV-6395载体,利用病毒载体转染细胞,收集病毒液获得过表达和下调miR-124和MGAT5慢病毒。采用不同的感染复数(20-200)对MDA-MB-231、MCF-7进行转染,24h后弃去病毒液,继续培养48h后荧光显微镜下观察转染效率,确定最佳MOI。在MDA-MB-231、MCF-7细胞中转染最佳MOI值的慢病毒溶液(共分为8组:miR-124-3p,MGAT5,NC和miR-124-3p+MGAT5;miR-124-3p inhibitor,sh-MGAT5,sh-NC和miR-124-3p inhibitor+sh-MGAT5),进行细胞孵育,36h后弃去病毒液,继续培养36h。在各组细胞培养皿中加入氨苄,继续培养72h,通过氨苄抗性筛选培养稳转细胞株。检测各组细胞的增殖及迁移能力的变化。
本实施例构建合成了包含过表达miR-124-3p、MGAT5质粒的慢病毒载体及对应阴性对照病毒,共分为miR-124-3p,MGAT5,NC和miR-124-3p+MGAT5等4个组别,转染MDA-MB-231、MCF-7细胞系,筛选稳转细胞株后,检测各组细胞的增殖及迁移能力的变化,结果如下:
CCK-8细胞活力实验结果如图5A所示,实验结果显示:过表达MGAT5组的细胞活力较NC组明显增加,而过表达miR-124-3p组细胞活力较NC组明显下降。但是当同时过表达MGAT5和miR-124-3p时,我们发现细胞活力较单独过表达miR-124-3p组显著恢复,即,由此可以证明:过表达MGAT5可以修复过表达miR-124-3p对乳腺癌细胞增殖能力的抑制作用。
EDU细胞增殖实验显示了同样的结果,参见图5B:单独过表达MGAT5或miR-124-3p后细胞增殖能力呈相反的改变,MGAT5组细胞增殖能力显著高于miR-124-3p组的细胞。但是miR-124-3p+MGAT5组可显著降低单独过表达miR-124-3p对细胞增殖能力的抑制作用。同时,我们还检测了各组细胞克隆形成的能力,结果参见图5C,结果显示:过表达MGAT5也可抵消由miR-124-3p上调引起的乳腺癌细胞克隆形成能力的下降。
Transwell实验结果参见图5D,结果显示:过表达miR-124-3p组的穿过小孔细胞数量显著低于NC组,而上调MGAT5组的细胞穿过小孔的数量显著高于NC组,同时过表达MGAT5和miR-12-3p 4的细胞,穿过小孔的能力较单独过表达miR-124-3p组显著提高。同样的,划痕实验结果(参见图5E)也证明MGAT组细胞划痕愈合能力显著高于NC组,而过表达miR-124-3p组恰好相反,但miR-124-3p+MGAT5组较单独过表达mir-124-3p时细胞划痕愈合能力明显提高。由此可见上调MGAT5的表达可以修复由于过表达miR-124-3p对乳腺癌细胞迁移能力的抑制作用。
本实施例构建合成了包含沉默miR-124-3p、MGAT5表达质粒的慢病毒载体及对应阴性对照病毒,共分为miR-124-3p inhibitor,sh-MGAT5,sh-NC和miR-124-3p inhibitor+sh-MGAT5等4个组别,转染MDA-MB-231、MCF-7细胞系,筛选稳转细胞株后,检测各组细胞的增殖及迁移能力的变化,结果如下:
CCK-8实验结果参见图6A,结果显示与阴性对照组sh-NC相比,抑制miR-124-3p的表达,可显著提高乳腺癌细胞活力,但miR-124-3p inhibitor+sh-MGAT5组的细胞活力则显着降低,与对照组无明显差异。EDU试验结果参见图6B,结果显示,与miR-124-3p inhibitor组相比,miR-124-3p inhibitor+sh-MGAT5组细胞增殖能力明显降低。克隆形成实验结果如图6C,结果显示miR-124-3p inhibitor+sh-MGAT5组中的细胞克隆数量明显低于miR-124-3p inhibitor组。Transwell实验结果如图6D,结果显示:干扰miR-124-3p组的穿过小孔细胞数量明显高于sh-NC组,而下调MGAT5组穿过小孔的数量显著低于sh-NC组,同时过表达MGAT5和miR-124-3p的细胞,穿过小孔的能力较单独过表达miR-124组显著提高,与sh-NC组无明显差异,可见,与miR-124-3p inhibitor组相比,miR-124-3p inhibitor+sh-MGAT5组中细胞的迁移能力显著下调。划痕实验也得到了同样的结果,如图6E所示:sh-MGAT5组细胞划痕愈合能力显著低于sh-NC组,而miR-124-3p inhibitor组细胞划痕愈合能力显著提高,但miR-124-3p inhibitor+sh-MGAT5组较mir-124-3p inhibitor组细胞划痕愈合能力明显下降。由此可见干扰MGAT5的表达可以抵消由于下调miR-124-3p对乳腺癌细胞迁移能力的促进作用。
综合上述过表达及干扰补救试验,可以得到这样的结论:过表达miR-124-3p可以有效的抑制乳腺癌细胞的增殖和迁移能力,而这个作用的发挥,是通过抑制癌基因MGAT5的表达来实现的。
实施例5:体内实验中高表达miR-124-3p可以抑制乳腺癌生长。
本实施例选取4-6周龄BALB/C雌性裸鼠作为乳腺癌细胞的荷瘤载体。将实施例4中8组慢病毒稳转MDA-MB-231细胞复苏后,传6-7代,细胞状态稳定后,待细胞布满瓶底时取对数生长期细胞配成细胞悬液,在小鼠第二对乳腺的脂肪垫内注射1×106个MDA-MB-231稳转细胞。每3天测量一次肿瘤大小,4-6周后颈椎脱臼法处死小鼠,解剖肿瘤,图7A及7C为各组处死后小鼠及解剖出的相应皮下瘤体。测量肿瘤长短径后,计算肿瘤生长曲线。过表达组结果如图7B,结果显示:与NC组相比,过表达MGAT5后,肿瘤生长速度最快,miR-124-3p组肿瘤生长速度最慢,体积最小。而miR-124-3p+MGAT5组的肿瘤生长速度明显较miR-124-3p组快,与NC组无明显差异。干扰组统计结果如图7D,结果显示:sh-MGAT5组肿瘤体积最小,生长速度最慢,而miR-124-3p inhibitor组则完全相反,肿瘤生长速度最快,体积最大。miR-124-3p inhibitor+sh-MGAT5组肿瘤的生长速度则明显慢于miR-124-3p inhibitor组,与sh-NC组无明显差异。这些结果表明miR-124-3p在体内同样可以通过靶向MGAT5对乳腺癌肿瘤的生长的起到抑制作用。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!