一种转基因玉米对鹌鹑肠道菌群试验管理软件系统的制作方法
本发明涉及转基因玉米试验,具体涉及一种转基因玉米对鹌鹑肠道菌群试验管理软件系统。
背景技术:
目前,自1996年开始商业化种植以来,全球转基因作物产业发展迅速,到2016年全球转基因作物种植面积达1.851亿公顷,与1996年相比增加了110多倍。作为世界三大禾谷类作物之一的玉米,在我国粮食生产中占有重要地位,而玉米螟一直是玉米的主要害虫。转bt抗虫玉米通过转入苏云金芽孢杆菌的晶体蛋白基因使玉米自身产生抗虫蛋白而达到抗虫目的,对靶标害虫玉米螟有很好的控制作用。因此,转基因抗虫玉米的食用安全性问题显得尤为重要。
肠道是接受来自环境、细菌和食物抗原的第一道防线,也是宿主最大的免疫器官所在,与宿主的营养代谢,机体免疫等有着重要的关系。目前在对抗虫转基因玉米非预期效应的研究中,长期饲用转基因作物是否会引起肠道菌群的变化已经成为转基因生物安全评价的一个热点。
技术实现要素:
本发明的主要目的在于提供一种转基因玉米对鹌鹑肠道菌群试验管理软件系统。
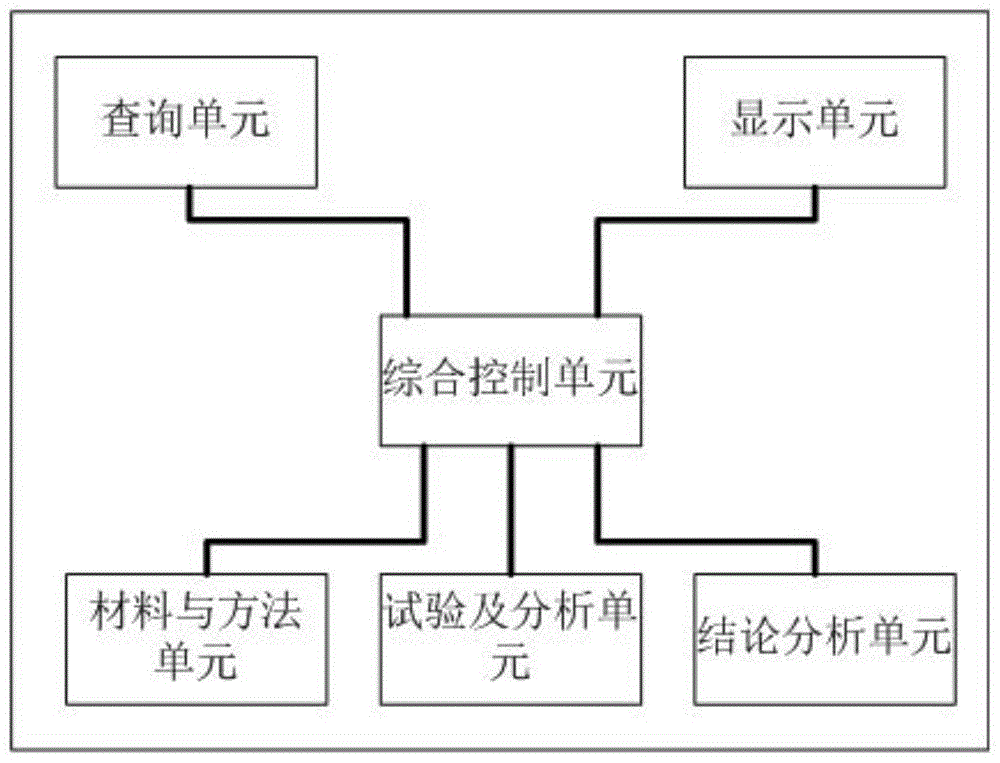
本发明采用的技术方案是:一种转基因玉米对鹌鹑肠道菌群试验管理软件系统,包括综合控制单元、查询单元、显示单元、材料与方法单元、试验及分析单元、结论分析单元;所述综合控制单元分别链接查询单元、显示单元、材料与方法单元、试验及分析单元、结论分析单元;
所述材料与方法单元用以鹌鹑肠道菌群试验的材料及方法步骤统计;
所述试验及分析单元用以鹌鹑肠道菌群试验的具体数据统计及分析;
所述结论分析单元用以对鹌鹑肠道菌群试验的数据进行结果分析及输出结果;
所述综合控制单元用以对试验管理软件系统进行综合控制;
所述查询单元用以查询材料与方法单元、试验及分析单元、结论分析单元的相应数据;
所述显示单元用以显示材料与方法单元、试验及分析单元、结论分析单元的相应数据或曲线。
进一步地,所述材料与方法单元包括鹌鹑分组单元、检测指标单元;
所述鹌鹑分组单元用以对试验鹌鹑进行分组;
检测指标单元用以对试验鹌鹑进行固定时间的试验,统计分析肠道菌群对鹌鹑的影响,包括外源基因测定单元、生产性能测定单元、高通量测序分析肠道菌群单元。
更进一步地,所述外源基因测定单元包括pcr反应体系单元和pcr反应程序单元;
所述pcr反应体系单元包括pcr检测的成分及体积;
所述pcr反应程序单元包括pcr反应温度、作用、反应时间。
更进一步地,所述生产性能测定单元用以每周记录所有试验鹌鹑的体重,并记录该鹌鹑屠宰后的全净膛率、胸肌率、腿肌率、腹脂率。
更进一步地,所述高通量测序分析肠道菌群单元用以高通量测序分析鹌鹑肠道菌群。
更进一步地,所述试验及分析单元包括组分分析单元、鹌鹑日常表现统计单元、鹌鹑体内部分脏器外源基因测定单元、转基因玉米对鹌鹑体重影响单元、转基因玉米对鹌鹑生产性能影响单元、分析鹌鹑肠道菌群单元。
更进一步地,所述组分分析单元用以对营养成分、氨基酸、霉菌毒素的分析;
其中的营养成分包括粗脂肪、粗灰分、总磷、粗蛋白、钙;其中的氨基酸包括色氨酸、胱氨酸、天冬氨酸、苏氨酸、丝氨酸、谷氨酸、脯氨酸、甘氨酸、甘氨酸+丝氨酸、丙氨酸、缬氨酸、蛋氨酸、蛋氨酸+胱氨酸、异亮氨酸、亮氨酸、酪氨酸、赖氨酸、精氨酸;
其中的霉菌毒素包括黄曲霉素、玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、伏马毒素;
鹌鹑日常表现统计单元包括对鹌鹑的精神状态、两眼有神情况、精神活泼情况,对外界刺激反应灵敏情况的统计;
鹌鹑体内部分脏器外源基因测定单元用于对鹌鹑体内部分脏器外源基因的检测;
转基因玉米对鹌鹑体重影响单元用以统计转基因玉米对鹌鹑体重的影响;
转基因玉米对鹌鹑生产性能影响单元用以统计鹌鹑全净膛率、胸肌率、腿肌率和腹脂率;
分析鹌鹑肠道菌群单元包括测序基本数据分析单元、多样性分析单元、鹌鹑肠道微生物群落组成比较分析单元;
所述粪便微生物基因组dna的提取和pcr扩增单元用以对鹌鹑粪便样品优质序列即有效测序序列分析;
所述多样性分析单元包括alpha多样性分析和beta多样性分析;
所述鹌鹑肠道微生物群落组成比较分析单元包括基于门分类水平进行分析和基于属分类水平进行分析。
更进一步地,所述结论分析单元包括结论显示单元及结论输出单元;所述显示单元显示试验结论;所述结论输出单元通过对上述分组的鹌鹑实验数据进行对比,输出试验结论。
本发明的优点:
本发明的转基因玉米对鹌鹑肠道菌群试验管理软件系统操作方便,能够方便转基因玉米对鹌鹑肠道菌群试验管理,能灵活使用。
除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。下面将参照图,对本发明作进一步详细的说明。
附图说明
构成本申请的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1是本发明实施例的一种沙转基因玉米对鹌鹑肠道菌群试验管理软件系统结构框图;
图2是本发明实施例的一种沙转基因玉米对鹌鹑肠道菌群试验管理软件系统的材料与方法单元结构框图;
图3是本发明实施例的一种沙转基因玉米对鹌鹑肠道菌群试验管理软件系统的外源基因测定单元结构框图;
图4是本发明实施例的一种沙转基因玉米对鹌鹑肠道菌群试验管理软件系统的试验及分析单结构框图;
图5是本发明实施例的一种沙转基因玉米对鹌鹑肠道菌群试验管理软件系统的鹌鹑肠道菌群单元结构框图;
图6是本发明实施例的一种沙转基因玉米对鹌鹑肠道菌群试验管理软件系统的结论分析单元结构框图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
参考图1,如图1所示,一种转基因玉米对鹌鹑肠道菌群试验管理软件系统,包括综合控制单元、查询单元、显示单元、材料与方法单元、试验及分析单元、结论分析单元;所述综合控制单元分别链接查询单元、显示单元、材料与方法单元、试验及分析单元、结论分析单元;
所述材料与方法单元用以鹌鹑肠道菌群试验的材料及方法步骤统计;
所述试验及分析单元用以鹌鹑肠道菌群试验的具体数据统计及分析;
所述结论分析单元用以对鹌鹑肠道菌群试验的数据进行结果分析及输出结果;
所述综合控制单元用以对试验管理软件系统进行综合控制;
所述查询单元用以查询材料与方法单元、试验及分析单元、结论分析单元的相应数据;
所述显示单元用以显示材料与方法单元、试验及分析单元、结论分析单元的相应数据或曲线。
参考图2,如图2所示,所述材料与方法单元包括鹌鹑分组单元、检测指标单元;
所述鹌鹑分组单元用以对试验鹌鹑进行分组;
检测指标单元用以对试验鹌鹑进行固定时间的试验,统计分析肠道菌群对鹌鹑的影响,包括外源基因测定单元、生产性能测定单元、高通量测序分析肠道菌群单元。
优选的,本发明采用转cry1ab和bar基因双抗抗虫玉米(2a-7)及其亲本非转基因玉米(郑58);从每种玉米中随机选取3个样本进行成分分析,营养成分(灰分、脂肪、粗纤维、水分和粗蛋白等)分析遵循国标(中华人民共和国国家标准,2004a-d;2010a-c)。
试验动物为40只日本鹌鹑购于南京市江宁区青龙山动物繁殖场,14d龄雌雄各半。采用不锈钢笼饲养,每笼5只鹌鹑,雌雄分开。通过自由采食装置摄取饮用水和饲料。饲养温度为24±2℃,相对湿度50~70%,气流速度0.13~0.18m/min,室内换气次数为8~15次/min。光照时间为12h。室内每天用0.2%过氧乙酸喷洒墙壁架子,地面用0.1%新洁尔灭拖地。
将40只鹌鹑在适应性喂养1周后随机分成2组,每组20只(♂10只,♀10只),分别饲喂添加转基因玉米2a-7和非转基因玉米郑58的饲料。试验期为42d。
参考图3,如图3所示,所述外源基因测定单元包括pcr反应体系单元和pcr反应程序单元;
所述pcr反应体系单元包括pcr检测的成分及体积;
所述pcr反应程序单元包括pcr反应温度、作用、反应时间。
本发明以日本鹌鹑为实验动物,开展为期42天的喂养试验,期间记录鹌鹑生产性能,定性pcr检测重要脏器中外源基因的存在,利用16srrna高通量测序技术分析鹌鹑长期食用含抗虫转基因玉米的饲料对肠道菌群的影响,以确定抗虫转基因玉米通过肠道所产生的非预期效应。
采用定性pcr方法对饲喂转基因抗虫玉米,各组鹌鹑的肝脏、肾脏、盲肠肠壁和回肠肠壁的转基因外源基因在鹌鹑体内的表达情况进行检测。
所述生产性能测定单元用以每周记录所有试验鹌鹑的体重,并记录该鹌鹑屠宰后的全净膛率、胸肌率、腿肌率、腹脂率。
每周记录所有试验鹌鹑体重。在42d时,每个重复随机抽取5只,空腹称体质量,颈部放血处死,屠宰后分离胸肌、腿肌和腹脂肪等,计算全净膛率、胸肌率、腿肌率和腹脂率。
全净膛率=[半净膛质量(即屠体去除气管、食道、嗉囊、肠、脾、胰、胆、生殖器官、肌胃内容物及角质膜后的质量)-心、肝、肌胃、腺胃、肺、腹脂、头和脚的质量]/宰前质量×100%;
胸肌率=两侧胸肌质量/全净膛质量×100%;
腿肌率=两侧腿肌质量/全净膛质量×100%;
腹脂率=腹脂质量/(全净膛质量+腹脂质量)×100%
所述高通量测序分析肠道菌群单元用以高通量测序分析鹌鹑肠道菌群。
实验第21和42d每组随机挑选6只鹌鹑(雄性),处死后立即放超净工作台上,在无菌条件下采集各组盲肠内容物,充分混匀,用e.z.n.astooldnakit(omega)试剂盒提取粪便细菌基因组dna,于-80℃保存备用。模板dna各40μl,利用特异性引物进行pcr扩增。根据pcr产物浓度进行等量混样,充分混匀后检测pcr产物,对目的条带进行胶回收纯化。使用truseqdnapcr-freesamplepreparationkit建库试剂盒进行文库构建,构建好的文库经过qubit和q-pcr定量,文库合格后,使用hiseq2500pe250进行上机测序。基于illuminahiseq测序平台,利用双末端测序(paired-end)的方法,构建小片段文库进行双末端测序。通过对reads拼接过滤,otus聚类,并进行物种注释及丰度分析,α多样性分析,β多样性分析。
参考图4,如图4所示,所述试验及分析单元包括组分分析单元、鹌鹑日常表现统计单元、鹌鹑体内部分脏器外源基因测定单元、转基因玉米对鹌鹑体重影响单元、转基因玉米对鹌鹑生产性能影响单元、分析鹌鹑肠道菌群单元。
所述组分分析单元用以对营养成分、氨基酸、霉菌毒素的分析;
其中的营养成分包括粗脂肪、粗灰分、总磷、粗蛋白、钙;其中的氨基酸包括色氨酸、胱氨酸、天冬氨酸、苏氨酸、丝氨酸、谷氨酸、脯氨酸、甘氨酸、甘氨酸+丝氨酸、丙氨酸、缬氨酸、蛋氨酸、蛋氨酸+胱氨酸、异亮氨酸、亮氨酸、酪氨酸、赖氨酸、精氨酸;
其中的霉菌毒素包括黄曲霉素、玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇、伏马毒素;
鹌鹑日常表现统计单元包括对鹌鹑的精神状态、两眼有神情况、精神活泼情况,对外界刺激反应灵敏情况的统计;
鹌鹑体内部分脏器外源基因测定单元用于对鹌鹑体内部分脏器外源基因的检测;
转基因玉米对鹌鹑体重影响单元用以统计转基因玉米对鹌鹑体重的影响;
转基因玉米对鹌鹑生产性能影响单元用以统计鹌鹑全净膛率、胸肌率、腿肌率和腹脂率;
42d实验结束后,解剖鹌鹑分离胸肌、腿肌和腹脂肪等,计算全净膛率、胸肌率、腿肌率和腹脂率,结果显示两组鹌鹑全净膛率、胸肌率、腿肌率和腹脂率之间比较均无显著差异。
参考图5,如图5所示,分析鹌鹑肠道菌群单元包括测序基本数据分析单元、多样性分析单元、鹌鹑肠道微生物群落组成比较分析单元;
所述粪便微生物基因组dna的提取和pcr扩增单元用以对鹌鹑粪便样品优质序列即有效测序序列分析;
本发明选取鹌鹑在饲喂14d和42d后的盲肠内容物以及回肠内容物的样品,分别提取基因组dna,1%琼脂糖凝胶电泳检测合格后,利用2%琼脂糖凝胶电泳检测样品中微生物16srrna基因v4~v5区pcr扩增产物,结果显示pcr扩增条带大小为442bp左右片段,与预期片段大小符合。因此,扩增的pcr产物可以进行后续高通量测序。
优质序列即有效测序序列中含有特异性扩增引物、不含模糊碱基、长度大于可供分析标准的序列。44份粪便样品共获得有效序列4441978条,优质序列的长度主要集中在420~460之间,与之前pcr扩增结果一致。
样本稀释曲线是用来比较测序数量不同的样本物种的丰富度,在<5000条序列时,out数量随序列数增加而迅速增加;在5000~10000条序列时,out数目增加缓慢;之后则趋于平台期。测序结果表明测序量可以覆盖大多数的微生物,并能够反映转基因玉米组和非转基因玉米组鹌鹑盲肠和回肠内容物中微生物菌群多样性组成。
所述多样性分析单元包括alpha多样性分析和beta多样性分析;
alpha多样性是指一个特定区域或生态系统内的多样性。chao或ace指数越大,说明群落丰富度越高;shannon值越大,simpson指数值越小,说明群落多样性越低;coverage指数越接近于1,说明测序深度已经基本覆盖到样品中所有的物种。
beta多样性分析通过分析不同样品的out组成可以反映样品间的差异,如微生物组成越相似,反映在pca图中的距离越近。对两组鹌鹑盲肠和回肠内容物细菌群落进行pca分析,两组鹌鹑盲肠和回肠微生物差异较大,但单独观察14d或42d盲肠或回肠otu组成,转基因玉米组与非转基因玉米组在pca得分图上距离较近,说明两组肠道微生物没有显著差异,具有相似的功能特征。
所述鹌鹑肠道微生物群落组成比较分析单元包括基于门分类水平进行分析和基于属分类水平进行分析。
在门分类水平进行肠道菌群结构分析,通过序列比对和注释,无论是14d还是42d取样,两组样本在门类分类水平上最高归属10个门类,占优势的门类主要有拟杆菌门(bacteroidetes)、厚壁菌门(firmicutes)、放线菌门(actinobacteria)和变形菌门(proteobacteria),占到门水平微生物的96%以上,其中盲肠内拟杆菌门(在盲肠占菌门总数的40-50%左右)为最优势菌门,而在回肠内则是厚壁菌门(在回肠占菌门总数的60-90%左右)。
回肠中的厚壁菌门在14d取样时占比约90%左右,拟杆菌门占比不到10%,而在42d取样的回肠中厚壁菌门下降到60%-70%,拟杆菌门则上升到10%-20%,且新出现的螺旋菌门和脱铁杆菌门等其他菌属的占比也有所上升,表明鹌鹑从幼年到成年肠道中的肠道菌群多样性有所提高。不同时间点两个玉米品种组间比较无差异,表明转基因玉米组与非转基因玉米组鹌鹑肠道微生物在门分类水平上组成相似。
在属分类水平上,这些菌群在分类学上最高归属于55个属,无论是14d还是42d取样,盲肠内菌群主要以拟杆菌属(bacteroides)为最优势菌属,而在回肠则是乳杆菌属(lactobacillus)。无论是在盲肠还是回肠,在喂养42d后肠道中最优势菌属占菌落总数比例与14d相比都有所下降,尤以回肠较为明显,乳杆菌属从占比50-70%下降到30%左右,同门水平结果一致,说明鹌鹑从幼年到成年,肠道中菌群逐渐健全,菌群多样性提高。两个不同玉米品种组间比较无差异,表明转基因玉米组与非转基因玉米组鹌鹑肠道微生物在属分类水平上同样组成相似。
参考图6,如图6所示,所述结论分析单元包括结论显示单元及结论输出单元;所述显示单元显示试验结论;所述结论输出单元通过对上述分组的鹌鹑实验数据进行对比,输出试验结论。
所述结论输出单元输出试验结论:通过对上述分组的鹌鹑实验数据进行对比,转基因玉米组鹌鹑肠道群落丰富度略低于非转基因玉米组,而多样性略高于非转基因玉米组,但两者之间无显著性差异,但两者之间无显著性差异,且在pca得分图上距离较近,表明饲喂两种玉米饲粮对鹌鹑盲肠和回肠的alpha多样性和beta多样性没有显著差异,转基因玉米组和非转基因玉米组鹌鹑肠道微生物群落多样性具有相似的水平;喂转基因玉米饲粮未对鹌鹑肠道微生物群落产生不良影响。
本发明以日本鹌鹑为实验动物,开展为期42天的喂养试验,期间记录鹌鹑生产性能,利用16srrna高通量测序技术分析鹌鹑长期食用含抗虫转基因玉米的饲料对肠道菌群的影响,来检测抗虫转基因玉米通过肠道所产生的可能非预期效应。主要研究结论如下:
(1)普通pcr检测两组鹌鹑肝脏、肾脏、盲肠和回肠中外源基因mcry1ab和bar基因的存在,扩增结果中未出现目的基因的条带。
(2)42d实验期间,无论雄性还是雌性鹌鹑生长趋势基本一致。两组鹌鹑全净膛率、胸肌率、腿肌率和腹脂率等生产性能指标均正常,相比较无显著差异。
(3)鹌鹑肠道微生物out分属于10个门,55个属。在门水平上盲肠和回肠的最优势菌群分别是拟杆菌门(bacteroidetes)和厚壁菌门(firmicutes),相对丰度分别为40-50%以及60-90%。在属水平上,盲肠和回肠内分别是拟杆菌属(bacteroides)和乳杆菌属(lactobacillus)含量较高,分别占到总菌落种群的20-30%和30-70%。不同时间点两个玉米品种组间比较均无差异,表明转基因玉米组与非转基因玉米组鹌鹑肠道微生物在门和属分类水平上组成相似。
多样性分析结果可知,盲肠的群落丰富度均显著高于回肠,而群落多样性低于回肠。42d肠道群落丰富度高于14d,但群落多样性低于14d。转基因玉米组鹌鹑肠道群落丰富度略低于非转基因玉米组,而多样性略高于非转基因玉米组,但两者之间无显著性差异,但两者之间无显著性差异,且在pca得分图上距离较近,表明饲喂两种玉米饲粮对鹌鹑盲肠和回肠的alpha多样性和beta多样性没有显著差异,转基因玉米组和非转基因玉米组鹌鹑肠道微生物群落多样性具有相似的水平。
综上可知,为期42d鹌鹑喂养试验之后,未在两组鹌鹑肝脏、肾脏、盲肠和回肠中检测到外源基因mcry1ab和bar基因的存在,鹌鹑生产性能各项指标均正常。饲喂转基因玉米对鹌鹑盲肠和回肠微生物菌群alpha多样性和beta多样性、otu组成均没有显著差异,两组鹌鹑肠道微生物在不同水平上组成相似,初步表明饲喂转基因玉米饲粮未对鹌鹑肠道微生物群落产生不良影响。
本发明的转基因玉米对鹌鹑肠道菌群试验管理软件系统操作方便,能够方便转基因玉米对鹌鹑肠道菌群试验管理,能灵活使用。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!