基于小檗碱衍生物及鼠李糖脂的抗菌纳米粒的制作方法
本发明涉及纳米递药系统,具体涉及用于清除生物膜的抗菌纳米粒,特别是用于杀灭或清除定植于上皮细胞黏液层内部或之下的细菌的纳米制剂。
背景技术:
幽门螺杆菌(h.pylori)是一个多鞭毛,螺旋杆状的微需氧革兰氏阴性菌,该菌能够引起胃炎,胃溃疡,胃癌等恶性疾病。早期使用阿莫西林、克拉霉素和质子泵抑制剂的三联疗法用来治疗h.pylori,在过去几年中,h.pylori对抗生素(包括克拉霉素和甲硝唑)的耐药性有所增加。为提高h.pylori的清除率,以三联疗法衍生的四联疗法成为治疗h.pylori感染的一线治疗方法。四联疗法在三联疗法的基础上加了铋剂,用以保护受损的胃黏膜。尽管四联疗法对h.pylori的清除率高于三联疗法,但是其根除h.pylori的效果也在逐渐下降,此外,长期大剂量的抗生素的使用,不仅使得毒副作用增加,也使h.pylori的耐药性升高,导致h.pylori的治疗面临严重的挑战。
研究表明h.pyloribiofilm是导致h.pylori对抗生素耐药性提高和清除率低的主要原因。h.pylori定植在胃粘液的底部,胃黏液还是一层重要的物理屏障,可以有效的抵抗外来物质对胃组织的损伤,同时黏液的不断分泌和清除,也使得一些物质可以被清除到体外。基于这种保护屏障,在h.pylori感染的部位,抗生素很难达到有效的杀菌浓度,导致药物对h.pylori的清除率下降。因此有效的克服黏液屏障,使药物能足量的到达h.pylori感染部位,也是提高h.pylori治疗效果的关键。
技术实现要素:
本发明要解决的技术问题在于克服细菌生物膜障碍,提高药物抗菌效果,最终达到清除细菌的目的。本发明通过纳米制剂破坏细菌形成的生物膜,通过释放的抗菌药物杀死膜内细菌,实现了对细菌的显著抑制、杀灭和清除。
本发明的一个方面提供一种抗菌纳米粒,由小檗碱衍生物与鼠李糖脂自组装形成,其中所述小檗碱衍生物为小檗碱经修饰而在选自第8、12和13位的碳原子上具有c8-20烷基取基,或在第9位碳原子上具有c8-20烷氧基取代。
在一些实施方式中,所述纳米粒经激光粒度仪测定的粒径为100nm至200nm,zeta电势介于-20mv至-60mv。在一些实施方式中,所述纳米粒经激光粒度仪测定的粒径为120nm至180nm,优选为150nm至180nm,更优选160nm至175nm,更优选170nm至175nm,更优选170nm、171nm、172nm、173nm、174nm或175nm。在一些实施方式中,所述纳米粒的zeta电势介于-30mv至-60mv,优选-40至-60mv,更优选-30至-55mv,更优选-35至-50mv,更优选-40值-50mv,更优选-40mv、-41mv、-42mv、-43mv、-44mv、-45mv、-46mv、-47mv、-48mv、-49mv或-50mv。
在一些实施方式中,所述小檗碱衍生物为在第9位碳原子上具有c10-18烷氧基取代。更优选地,所述小檗碱衍生物为9-o-正十烷基小檗碱,9-o-正十二烷基小檗碱,9-o-正十六烷基小檗碱或9-o-正十八烷基小檗碱。更优选地,所述小檗碱衍生物为9-o-正十烷基小檗碱或9-o-正十二烷基小檗碱。最优选地,所述小檗碱衍生物为9-o-正十烷基小檗碱。
在一些实施方式中,在所述纳米粒中,小檗碱衍生物:鼠李糖脂的重量比为1:2至1:10。优选地,在所述纳米制剂中,小檗碱衍生物:鼠李糖脂的重量比为1:4。
在一些实施方式中,所述纳米粒能够至少部分地穿过覆盖在上皮细胞层上的黏液层。在一些实施方式中,所述纳米粒能够完全穿过覆盖在上皮细胞层上的黏液层。
本发明的另一个方面提供本发明的抗菌纳米粒在制备抗细菌制剂中的应用,其中所述细菌为产生物膜细菌。
在一些实施方式中,所述产生物膜细菌为革兰氏阴性产生物膜细菌。在另一些实施方式中,所述产生物膜细菌为革兰氏阳性产生物膜细菌。在一些实施方式中,所述产生物膜细菌为微需氧菌(如h.pylori)、需氧菌(如p.aeruginosa)、兼性厌氧菌(如e.coli和s.aureus)或厌氧菌(如s.mutans)。在一些实施方式中,所述产生物膜细菌为h.pylori、e.coli、p.aeruginosa、s.aureus或s.mutans。在优选的实施方式中,所述产生物膜细菌为定植在上皮细胞分泌的黏液层内部或下方的细菌。在优选的实施方式中,所述产生物膜细菌为h.pylori。
本发明的再一个方面提供一种药物组合物,其包含本发明所述的抗菌纳米粒以及药学上可接受的载体。
本发明的再一个方面提供一种杀灭生物体内细菌的方法,所述方法包括将本发明的抗菌纳米粒与所述细菌接触,其中所述细菌为产生物膜细菌。
在一些实施方式中,所述产生物膜细菌为革兰氏阴性产生物膜细菌。在另一些实施方式中,所述产生物膜细菌为革兰氏阳性产生物膜细菌。在一些实施方式中,所述产生物膜细菌为微需氧菌(如h.pylori)、需氧菌(如p.aeruginosa)、兼性厌氧菌(如e.coli和s.aureus)或厌氧菌(如s.mutans)。在一些实施方式中,所述产生物膜细菌为h.pylori、e.coli、p.aeruginosa、s.aureus或s.mutans。在优选的实施方式中,所述产生物膜细菌为定植在上皮细胞分泌的黏液层内部或下方的细菌。在优选的实施方式中,所述产生物膜细菌为h.pylori。
本发明将bd与rhl自组装制备成纳米粒,用以清除产生物膜细菌(如h.pylori)的生物膜的感染。在所述产生物膜细菌为定植在上皮细胞分泌的黏液层内部或下方的细菌(例如h.pylori)的情况下,rhl可以增加纳米粒表面的亲水性、降低bd的正电性,通过避免与疏水、荷负电的黏蛋白作用,提高纳米粒的穿黏液能力。纳米粒穿透黏液后,到达h.pylori感染的部位,通过rhl破坏eps清除biofilm暴露出游离菌,纳米粒直接发挥抗菌作用,从而降低h.pylori的耐药性。
附图说明
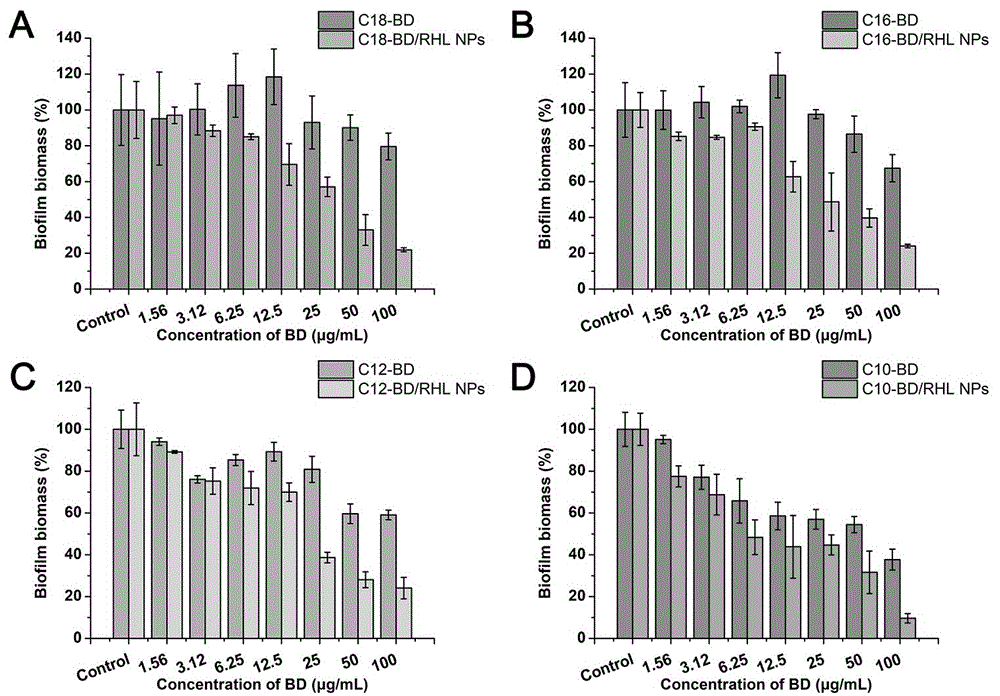
图1.结晶紫法评价bd/rhlnps对h.pyloribiofilm的清除作用:(a)c18-bd/rhlnps(b)c16-bd/rhlnps(c)c2-bd-rhlnps(d)c10-bd/rhlnps。
图2.死活菌荧光标记法评价bd/rhlnps对h.pyloribiofilm的清除作用。
图3.bd/rhlnps对分散出biofilm的h.pylori活性影响。
图4.bd和rhl抑制h.pyloribiofilm再形成能力:(a)c18-bd(b)c16-bd(c)c12-bd(d)c10-bd(e)rhl。
图5.bd/rhlnps抑制h.pyloribiofilm再形成能力。
图6.bd/rhlnps抑制h.pylori在mgc803细胞上的黏附能力。
图7.transwell法测定bd/rhlnps黏液穿透的papp值,***p<0.001vsbdnps,#p<0.05,##p<0.01vsc18-bd/rhlnps,&p<0.05vsc16-bd/rhlnps,δp<0.05vsc12-bd/rhlnps。
图8.bd/rhlnps对黏液-biofilm模型中清除h.pyloribiofilm效果,***p<0.001vs对照,#p<0.05vsc18-bd/rhlnps,&p<0.05vsc16-bd/rhlnps,δp<0.05vsc12-bd/rhlnps。
图9.结晶紫法考察sds、rhl和nac对五种biofilm的清除作用:(a-c)h.pylori(d-f)e.coli(g-i)p.aeruginosa(j-l)s.aureus(m-o)s.mutans,*,显著性p<0.05,**,显著性p<0.01,***,显著性p<0.001。
图10.扫描电镜法考察sds、rhl和nac对五种biofilm的清除作用。
图11.死活菌荧光标记法考察sds、rhl和nac对五种biofilm的清除作用。
图12.sds、rhl和nac对五种biofilm的抑制作用:(a-c)h.pylori(d-f)e.coli(g-i)p.aeruginosa(j-l)s.aureus(m-o)s.mutans,误差棒表示标准偏差(sd).*,显著性p<0.05,**,显著性p<0.01,***,显著性p<0.001。
具体实施方式
定义
“小檗碱衍生物”或“bd”在本文中是指小檗碱经修饰而在选自第8、12和13位的碳原子上具有c8-20烷基取基,或在第9位碳原子上具有c8-20烷氧基取代。术语c8-20烷基或类似表达是指具有8至20个碳原子的直链或支链烷基链。在第9位碳原子上具有c8-20烷氧基取代是指小檗碱的第9位碳原子的-och3被c8-20烷氧基取代。
在一些实施方式中,所述小檗碱衍生物为在第9位碳原子上具有c10-18烷氧基取代。更优选地,所述小檗碱衍生物为9-o-正十烷基小檗碱,9-o-正十二烷基小檗碱,9-o-正十六烷基小檗碱或9-o-正十八烷基小檗碱。更优选地,所述小檗碱衍生物为9-o-正十烷基小檗碱或9-o-正十二烷基小檗碱。最优选地,所述小檗碱衍生物为9-o-正十烷基小檗碱。上述小檗碱衍生物的制备方法可见于公开文献(例如song,j.etal,2019.mitochondrialtargetingnanodrugsself-assembledfrom9-o-octadecylsubstitutedberberinederivativeforcancertreatmentbyinducingmitochondrialapoptosispathways.journalofcontrolledrelease,294:27-42、zl201310218544.0或zl201310218566.7)。在本文中为简便起见,以取代基+小檗碱衍生物来命名所使用的小檗碱衍生物,如无具体指明,均为9-o-取代的小檗碱衍生物,如十二烷基小檗碱衍生物是指9-o-正十二烷基小檗碱。
生物膜(biofilm)是指微生物自发黏附在生物或者非生物材料的表面并被其自身分泌的胞外聚合物(extracellularpolymericmatrix,eps)所包裹的微生物群体。biofilm是细菌为适应恶劣的生存环境自发形成的一种保护机制,其内部细菌与游离细菌相比有更高的宿主免疫防御性和较低的生长速率等特征,使biofilm内的细菌具有较高的耐药性,与游离细菌相比耐药性提高10-1000倍。导致抗生素的治疗效果降低。
“产生物膜细菌”是指能够在生物体内自发形成生物膜(biofilm)的细菌。在条件适宜的情况下,细菌均可以形成biofilm。在一些实施方式中,所述产生物膜细菌为革兰氏阴性产生物膜细菌。在另一些实施方式中,所述产生物膜细菌为革兰氏阳性产生物膜细菌。在一些实施方式中,所述产生物膜细菌为微需氧菌(如h.pylori)、需氧菌(如p.aeruginosa)、兼性厌氧菌(如e.coli和s.aureus)或厌氧菌(如s.mutans)。在一些实施方式中,所述产生物膜细菌为h.pylori、e.coli、p.aeruginosa、s.aureus或s.mutans。在优选的实施方式中,所述产生物膜细菌为定植在上皮细胞分泌的黏液层内部或下方的细菌。在优选的实施方式中,所述产生物膜细菌为h.pylori。
如本文所用,术语“组合物”指适于给预期动物对象施用以达到治疗目的的制剂,其含有至少一种药物活性组分,例如化合物。任选地,所述组合物还含有至少一种药物学上可接受的载体或赋形剂。
术语“药学上可接受的”表示所述物质不具有这样的特性,即考虑到将被治疗的疾病或病症以及各自的施用途径,该特性将会使理性谨慎的医学从业者避免给患者服用该物质。例如,对于可注射物来说,通常要求这样的物质是基本无菌的。
本文使用的“治疗”包括给予本申请的化合物或其药学上可接受的盐,以减轻疾病或病症的症状或并发症,或消除疾病或病症。本文使用的术语“减轻”用于描述病症的迹象或症状的严重性降低的过程。症状可减轻而没有消除。在一种实施方案中,给予本申请的药物组合物导致消除迹象或症状。
药物组合物
在本发明中,“药物组合物”是指包含本发明的纳米粒和药学上可接受的载体的组合物,其中纳米粒和药学上可接受的载体以混合形式存在于组合物中。所述组合物一般将被用于人类对象的治疗。然而,它们也可以被用于治疗在其它动物对象中的相似的或相同的病症。在本文中,术语“对象”、“动物对象”和类似术语指人和非人类脊椎动物,例如哺乳动物,如非人类灵长类,竞技动物和商业动物,例如马、牛、猪、绵羊、啮齿类动物,和宠物(如狗和猫)。
合适的剂型,部分地取决于用途或给药的途径,例如经口、经皮、经粘膜、吸入或通过注射(肠胃外)。此类剂型应当使该化合物能够到达靶细胞。其它因素在本领域中是熟知的,包括需要考虑的事项,诸如毒性和延迟化合物或组合物发挥其效应的剂型。
载体或赋形剂可以被用于生产组合物。所述载体或赋形剂可以被选择为促进化合物的给药。载体的例子包括碳酸钙、磷酸钙、各种糖(例如乳糖、葡萄糖或蔗糖)、或淀粉类型、纤维素衍生物、明胶、植物油、聚乙二醇和生理相容性溶剂。生理上相容性溶剂的例子包括注射用水(wfi)无菌溶液、盐溶液和葡萄糖。
可以通过不同的路径施用组合物或组合物的组分,包括静脉内、腹膜内、皮下、肌内、经口、经粘膜、直肠、经皮或吸入。在一些实施方式中,优选注射剂或冻干粉针剂。对口服而言,例如,化合物可以被配制为常规口服剂型,例如胶囊、片剂,以及液体制剂,例如糖浆、酏剂和浓缩滴剂。
作为选择,可以使用注射(肠胃外给药),例如肌内的、静脉内的、腹膜内的和/或皮下的。对于注射而言,本发明的组合物或其组分被配制为无菌液体溶液,优选在生理相容的缓冲液或溶液中,例如盐水溶液、hank溶液或ringer溶液。另外,组合物或其组分可以被配制为固体形式,并在使用之前一刻被再溶解或悬浮。也可以生产冻干粉形式。
给药也可以通过经粘膜、局部或经皮方式。对于经粘膜、局部或经皮给药,在配方中使用适合待穿透的屏障的穿透剂。这样的穿透剂在本领域中是普遍已知的,包括,例如,对于经粘膜给药,胆汁盐和梭链孢酸衍生物。另外,去垢剂可以用于促进穿透。经粘膜给药,例如,可以通过鼻喷雾或栓剂(经直肠或阴道)。
通过标准程序可以确定待施用的各种组分的有效量,考虑的因素对象的年龄、大小和体重以及与对象有关的病症。这些因素和其它因素的重要性对本领域普通技术人员而言是熟知的。一般而言,剂量将在被治疗的对象的大约0.01mg/kg至50mg/kg之间,优选在0.lmg/kg至20mg/kg之间。可以使用多次剂量。
本发明的组合物或其组分还可以与治疗相同疾病的其他治疗剂结合使用。这种结合使用包括在不同时间施用这些化合物以及一种或多种其他治疗剂,或同时使用这种化合物和一种或多种其他治疗剂。在一些实施方式中,可对本发明的一种或多种化合物或结合使用的其他治疗剂的剂量进行修改,例如,通过本领域技术人员已知的方法降低相对于单独使用的化合物或治疗剂的剂量。
实施例
1.自组装纳米粒的制备与表征
方法
小檗碱衍生物/鼠李糖脂自组装纳米粒(bd/rhlnps)的制备:分别称取十烷基小檗碱衍生物(c10-bd)、十二烷基小檗碱衍生物(c12-bd)、十六烷基小檗碱衍生物(c16-bd)和十八烷基小檗碱衍生物(c18-bd),加入dmso超声溶解,使浓度为5mg/ml。配制浓度为2mg/ml的鼠李糖脂(rhl)水溶液。取四种小檗碱衍生物(bd)溶液搅拌下滴加到rhl溶液中,待bd溶液滴完后继续搅拌2min,即形成bd/rhlnps。bd/rhlnps在3500kd透析袋中透析6h除去有机溶剂。观察溶液的外观性状,并测定其粒径和电势。
bd和rhl的质量比筛选:精密吸取bd溶液一定量滴加到不同浓度的rhl溶液中,使bd与rhl的质量比分别为1:40、1:20、1:10、1:8、1:5、1:4和1:2制备bd/rhlnps,测定粒径和电势。
结果
如表1、2、3和4所示,bd与rhl的质量比为1:4时,四种bd/rhlnps均具有较小的粒径和pdi值,粒径均一,电势为负值。
表1c10-bd与rhl质量比对纳米粒粒径和电势的影响
表2c12-bd与rhl质量比对纳米粒粒径和电势的影响
表3c16-bd与rhl质量比对纳米粒粒径和电势的影响
表4c18-bd与rhl质量比对纳米粒粒径和电势的影响
2.自组装纳米粒对h.pyloribiofilm的清除作用方法
h.pylori最低抑菌浓度(mic)的测定
(1)样品溶液的配制:用含10%fbs的bhi培养基稀释bd和bd/rhlnps溶液,使bd浓度为37.5、18.75、9.375、4.69、2.34、1.17、0.6、0.3和0.15μg/ml。(2)种板与加药:将od600值为0.1的菌悬液用培养基稀释30倍后按100μl/孔加至孔板中,再加入50μl样品溶液。将孔板放至37℃,100rpm转速下振荡培养48h。(3)mic值的测定:培养结束后,用酶标仪测定od600值,计算各组的mic值。
bd/rhlnps对h.pyloribiofilm的清除作用:
biofilm的培养:将od600值为0.1的菌悬液以500μl/孔加至48孔板中,37℃微需氧条件下,静置培养72h后,可形成h.pyloribiofilm。
(1)结晶紫染色法:采用两倍稀释法稀释bd及其bd/rhlnps,使bd浓度约为100、50、25、12.5、6.25、3.12和1.56μg/ml。待biofilm形成后,吸弃培养基,加入500μl样品溶液。微需氧,37℃条件下孵育24h。孵育结束后将孔板取出,用无菌pbs清洗3遍,加入500μl甲醇固定后用1%结晶紫染色15min。加入pbs再次清洗后,加入500μl95%乙醇,振荡混匀,用酶标仪测定od570值,计算四种bd/rhlnps清除biofilm的能力。
(2)死活菌荧光标记法:用无菌pbs清洗h.pyloribiofilm,随后加入100μg/ml的样品溶液。孵育24h后,吸弃培养基,加入syto9/pi溶液避光孵育15min,随后将培养皿置于激光共聚焦(clsm)下观察biofilm三维结构及细菌存活情况。
结果
bd/rhlnps对游离h.pylori的mic结果如表5所示。c10-bd和c12-bd及其相应的自组装纳米粒c10-bd/rhlnps和c12-bd/rhlnps具有较小的mic值,显示了较强的抗游离h.pylori作用。
表5bd和bd/rhlnps对游离h.pylori的mic值
结晶紫法结果如图1所示,纳米粒中c10-bd/rhlnps和c12-bd/rhlnps对h.pyloribiofilm的清除率较高,与其对h.pylori的抗菌活性较强有关。死活菌荧光标记法结果与结晶紫法类似,c10-bd/rhlnps组清除作用最强(图2)。
3.自组装纳米粒抑制biofilm再形成作用方法
bd/rhlnps对biofilm被破坏后从中分散出的h.pylori的杀菌能力:
采用syto9/pi荧光标记法测定分散出biofilm的h.pylori的存活率。具体操作步骤如下:h.pyloribiofilm形成后,用无菌pbs清洗3遍,去除游离细菌,加入500μl,100μg/ml的样品溶液孵育24h。孵育结束后收集每孔上清液,离心去除培养基,获得h.pylori沉淀。随后加入syto9/pi溶液重悬,并避光孵育15min。最后将菌悬液加至96孔黑标板中,测定syto9荧光强度,计算bd/rhlnps对从biofilm分散出的h.pylori的杀菌能力。
bd/rhlnps抑制h.pyloribiofilm再形成的作用:
根据bd和rhl的mic值,配制一系列包含mic值在内的不同浓度的样品溶液,以250μl/孔加至48孔板中,随后加入od600值为0.1的h.pylori菌悬液,使药物和菌悬液充分混合均匀,并在37℃微需氧条件下孵育24h,孵育结束后使用结晶紫法测定biofilm的形成量。配制浓度依次为3.12、6.25、12.5、25、50、100和200μg/ml的bd/rhlnps溶液,按照上述相同的方法,测定bd/rhlnps抑制biofilm形成的能力。
bd/rhlnps抑制h.pylori在细胞上黏附的作用:
将对数生长期mgc803细胞以105个/孔接种到24孔激光共聚焦板内,培养24h,使细胞完全贴壁。贴壁后用pbs清洗1遍,加入hoechst荧光染料避光孵育30min进行细胞标记。收集菌悬液,使用syto9荧光染料标记h.pylori。将分别标记的h.pylori和mgc803细胞混合,同时加入100μg/mlbd/rhlnps溶液,共同孵育2h。孵育结束后,将孔板经pbs清洗后,置于clsm下观察拍照。
结果
bd/rhlnps对从biofilm中分散的h.pylori的杀灭能力如图3所示,c10-bd和c10-bd/rhlnps处理后荧光强度最低,说明这两种纳米粒对分散的h.pylori的杀灭作用最强。
bd/rhlnps抑制biofilm再形成作用的结果见图4和图5,从图4可知几种bd和rhl均能在mic值浓度以下,不同程度地抑制h.pyloribiofilm形成,而与图5对比可知,bd/rhlnps抑制作用更强,在浓度为6.25μg/ml时,c10-bd/rhlnps和c12-bd/rhlnps能够完全抑制h.pyloribiofilm形成,抑制率分别为99.06%和99.25%。
bd/rhlnps抑制h.pylori在细胞上黏附的作用见图6,bd/rhlnps处理后,在细胞表面黏附的h.pylori明显减少。以上3个实验结果说明,bd/rhlnps能有效杀死分散菌并抑制其再黏附形成biofilm,因而能阻止感染复发。
4.自组装纳米粒克服黏液屏障
方法
bd/rhlnps穿黏液效果评价:
称取40mg新鲜黏液至24孔transwell小室中,加入200μl样品溶液到黏液上层,接收室加入500μl水。随后将transwell孔板置于37℃,100rpm恒温振荡箱中振荡,于规定时间取接收室中样品溶液测定荧光强度,根据以下公式计算纳米粒的表观渗透系数(papp)。
其中
bd/rhlnps对黏液-biofilm混合模型中biofilm的清除作用:
将黏液加入至transwell小室后紫外照射6h除菌,随后将小室转移至含biofilm的孔板中构建黏液-biofilm混合模型。在黏液上层加入样品溶液孵育24h后,加刃天青溶液至biofilm中继续孵育2h,测定荧光强度,考察在黏液屏障条件下,纳米粒清除biofilm的效果。
结果
由图7所示,与bdnps相比,bd/rhlnps的黏液穿透能力明显增强,特别是c10-bd/rhlnps,其表观渗透系数是bdnps的4.33倍。而在黏液-biofilm混合模型中可见(图8),即使存在黏液屏障,bd/rhlnps对黏液底部的h.pyloribiofilm的清除作用也较强,以c10-bd/rhlnps的清除作用最强,清除率达83.5%。
5.自组装纳米粒广谱抗bioiflm能力
方法
sds、rhl和nac的mic值:
按2倍梯度稀释三种物质,使sds和rhl的浓度依次为30、15、7.5、3.75、1.86、0.93、0.47、0.24、0.12和0.06mg/ml。nac的浓度依次是240、120、60、30、15、7.5、3.75、1.86、0.93和0.47mg/ml。将od600值为0.1的五种菌悬液用培养基稀释30倍后按100μl/孔加至孔板中,再加入50μl样品溶液。将孔板放至37℃,100rpm转速下振荡培养24h。培养结束后,用酶标仪测定od600值,得出三种物质的mic值。
sds、rhl和nac对biofilm的清除作用:
biofilm培养:h.pylori:种板菌悬液od600值为0.1,微需氧条件,培养72h;e.coli:种板菌悬液浓度为0.1/30,培养48h;p.aeruginosa:种板菌悬液od600为0.1,培养24h;s.aureus:种板菌悬液浓度为0.1/10,培养24h;s.mutans:种板菌悬液od600值为0.13,厌氧条件,培养48h。
(1)结晶紫法:配制sds、rhl和nac溶液,使sds和rhl浓度为10、5、2.5、1.25、0.62、0.31和0.16mg/ml;nac浓度为80、40、20、10、5、2.5和1.25mg/ml。用pbs清洗五种细菌的biofilm,加入500μl样品溶液,将孔板继续培养24h。按照前文结晶紫法测定sds、rhl和nac对五种菌成熟biofilm清除能力。
(2)扫描电镜法:在细胞爬片上培养五种细菌biofilm,以sds、rhl和nac的4倍mic的浓度加药。孵育24h后,加入2.5%戊二醛固定过夜后用pbs清洗3遍,随后分用30%、50%、70%和90%乙醇脱水一次,100%乙醇脱水三次,每次10min。将细胞爬片干燥,并在表面喷金后用sem观察biofilm形态和药物清除效果。
(3)死活菌荧光标记法:用无菌pbs清洗h.pyloribiofilm,以sds、rhl和nac的4倍mic的浓度加药。孵育24h后,避光加入syto9/pi溶液并孵育15min,随后将培养皿置于激光共聚焦(clsm)下观察biofilm三维结构及细菌存活情况。
sds、rhl和nac抑制biofilm再形成的作用:
根据三种物质的mic值,配制一系列包含mic值在内的不同浓度的样品溶液,以250μl/孔加至48孔板中,随后加入等量od600值为0.1的菌悬液,将孔板置于37℃,孵育24h。按照前述结晶紫方法测定sds、rhl和nac对五种细菌biofilm形成的抑制作用。
结果
sds、rhl和nac的mic值:sds、rhl和nac对五种细菌的mic值见表6,从结果中可以看出,sds的抗菌能力强于rhl和nac,对五种细菌都有最小的mic值。此外,sds与rhl对革兰氏阳性菌的抗菌能力高于革兰氏阴性菌,rhl甚至对e.coli和p.aeruginosa没有抗菌效果。而nac的抗菌效果与细菌类型无关,对五种细菌的mic值为5-10mg/ml。
表6sds、rhl和nac对五种细菌的mic值(mg/ml)
sds、rhl和nac对biofilm的清除作用:为探究sds、rhl和nac清除biofilm能力是否具有广谱性,我们选用了五种不同类型的细菌:分别属于微需氧菌(h.pylori),好氧菌(p.aeruginosa),兼性厌氧菌(e.coli和s.aureus)和厌氧菌(s.mutans),这些细菌又属于革兰氏阳性菌(s.aureus和s.mutans)和阴性菌(h.pylori,e.coli和p.aeruginosa),通过测定对不同类型细菌biofilm的清除作用,可以对sds、rhl和nac的广谱抗biofilm能力探究的更准确全面。结果如图9所示,sds和rhl均能有效清除5种成熟biofilm,因此推测rhl抗biofilm的能力具有广谱非特异性,nac对h.pyloribiofilm没有清除效果,不具有广谱性。扫描电镜和死活菌染色方法结果(图10,图11)与结晶紫法一致,均说明sds和rhl清除biofilm能力具有广谱性。
sds、rhl和nac抑制biofilm再形成的作用:sds、rhl和nac抑制五种细菌的biofilm再形成的能力,结果如图12所示。sds和rhl均可抑制所有五种菌biofilm形成,具有广谱非特异性,然而nac能促进除p.aeruginosa外的其他四种细菌biofilm的形成,不具有广谱性。综上,rhl对biofilm的清除和抑制均具有广谱性,结合bd的广谱抗菌活性,推测我们构建的bd/rhlnps也适用于清除其他细菌biofilm,为治疗biofilm感染提供新方法。
本发明将rhl抗biofilm作用和bd抗h.pylori作用结合,构建了由rhl和四种不同链长bd形成的自组装纳米粒(bd/rhlnps)。bd/rhlnps可穿透黏液层到达h.pylori感染部位发挥清除h.pyloribiofilm的作用,可提高h.pylori清除率。此外我们证明rhl具有广谱抗biofilm能力,由于bd具有广谱抗biofilm能力,因此推测本发明中的bd/rhlnps也可以清除其他细菌biofilm,为治疗biofilm感染提供新方法。
- 还没有人留言评论。精彩留言会获得点赞!