抗菌肽YD在制备治疗肝脏纤维化药物中的应用的制作方法
本发明属于生物医药技术领域,涉及一种具有抗菌作用多肽的新的医药用途,具体涉及抗菌多肽抗菌肽yd在制备治疗肝脏纤维化药物中的应用。
背景技术:
肝纤维化是一个由各种致病因子共同参与的复杂的生理病理过程,涉及到多种细胞、细胞因子、信号转导通路等,病理表现主要为肝细胞外基质(extracellularmatrixc,ecm)合成和降解失衡,造成细胞外基质在肝脏中沉积,引起肝脏结构变化并影响肝功能。如不及时治疗,纤维化的过程长期持续就会发展成为肝硬化、肝功能衰竭甚至肝癌。肝纤维化是各种慢性肝脏疾病的共同病理过程。慢性肝病是全球发病率和死亡率的主要原因,每10万人中有360人受慢性肝病影响,在总死亡率中居第12位(jmagnresonimaging.2017,45:
1276-1295)。
肝纤维化是各种慢性肝病发展成肝硬化的早期可逆阶段,应尽可能在此阶段或者肝硬化早期进行肝纤维化的逆转,防止向肝硬化晚期及肝癌的发展。目前防治肝纤维的策略主要有:去除肝病的病因、减轻炎症和氧化应激、保护肝细胞不受损伤;抑制肝星状细胞的激活、活化;诱导活化肝星状细胞凋亡;抑制ecm合成,促进ecm降解等。临床上主要用于缓解肝纤维化的药物有水飞蓟宾、甘草次酸、吡非尼酮、糖皮质醇等,但由于这些药物导致的副作用发生较为频繁,抗纤维化作用机制尚不明确,所以这些药物在临床应用中很受限制,因此开发安全有效的新型抗肝纤维化药物具有重要的临床意义(seminarsinliverdisease2016;36:87-98)。
多肽药物因为其适应症广泛且疗效显著、安全性高、体内不易产生蓄积,与其他药物的相互作用比较小等优点受到众多研究人员的关注。在新药研发、生产、使用过程中独具特色,已成为当前国际新药研发的重要方向之一。目前还没有多肽药物直接以抗肝纤维化为适应证进入临床研究。抗菌肽是生物体内先天免疫系统中的重要组成部分,具有趋化作用、促进生长、伤口愈合等免疫调节和抗炎活性。抗菌肽yd是jincheolyoo等人于2017年从解淀粉芽孢杆菌cbs抗菌肽yd1中分离纯化得到由10个氨基酸组成的多肽,序列信息为apkgvqgpng,抗菌肽yd对革兰氏阳性菌和革兰氏阴性菌均有抗菌活性且具有非常好的热稳定性,酸碱稳定性和酶解稳定性,在脂多糖诱导的小鼠巨噬细胞(raw264.7)模型中展示了很好的抗氧化作用(ambexpress.2017,7:8;foodchem.2018,239:502-510)。但是抗菌肽yd在治疗肝纤维化方面的作用至今还没有报道。本发明建立了四氯化碳诱导的肝纤维化小鼠模型和脂多糖诱导的raw264.7炎症细胞模型,说明抗菌肽yd能够通过介导抗炎活性从而逆转肝纤维化的发展。
技术实现要素:
本发明的目的是提供一种抗菌肽yd的医药新用途,即在治疗肝脏纤维化药物中的应用。
本发明采用的技术方案如下:抗菌肽yd在制备治疗肝脏纤维化药物中的应用;其以抗菌肽yd为活性成分,采用药剂学常规工艺和辅料,制备成各种剂型的抗肝脏纤维化药物。
本发明所述的抗肝脏纤维化药物的剂型为肌肉注射剂或口服剂。
本发明所述的抗菌肽yd是通过采用经典的“fmoc”保护策略的固相多肽合成法合成。
本发明通过动物实验与细胞实验,在细胞和分子水平分别通过一系列实验证实了抗菌肽yd在治疗肝脏纤维化中的药理学活性:
一、动物实验
1.小鼠建模与给药
用四氯化碳(ccl4)诱导构建小鼠肝纤维化模型:
spf级别健康雄性c57bl/6小鼠,体重18-20g,由兰州大学实验动物中心(glp)提供,整个实验过程的执行均受到兰州大学实验动物伦理委员会的许可与监督(动物操作许可证文号:syxkgan2013-0003)。动物适应性饲养1周后,随机分为两组,即空白组与模型组:模型组,剂量为0.5ml/100g体质量,腹腔注射20%ccl4玉米油溶液诱导肝纤维化模型,每周两次;空白组小鼠,予腹腔注射等量玉米油溶液。所有小鼠均以普通饲料喂养及自由饮水,共造模6周。
造模后空白对照组与模型组、抗菌肽组均予标准小鼠基础饲料喂养。除空白组外,各组于造模开始后第3周开始每天进行腹腔注射给药治疗。按《动物与人体的每公斤体重剂量折算系数表》计算出小鼠模型实验所需用药剂量:空白对照组和模型对照组腹腔注射生理盐水;抗菌肽组腹腔注射抗菌肽yd(500μg/kg),至第6周末结束。给药结束后禁食过夜,次日称重麻醉,眼球静脉取血,以3000r/min离心10min,收集血清,置于-80℃冰箱储存待测相关血清学指标。肝组织以预冷的生理盐水冲洗后分叶:置入4%多聚甲醛中固定以待制备石蜡切片,剩余肝组织液氮速冻分装入冻存管,于-80℃冰箱保存备用。
2.小鼠肝脏组织病理切片
肝组织用4%多聚甲醛在4℃固定24h后,依次使用70%、80%、90%、95%和100%的乙醇脱水。接着采用二甲苯溶液处理30min并重复1次后,放入55-65℃已溶化的石蜡内浸渍40min,重复1次,待石蜡完全浸入组织块后进行包埋。包埋后在切片机上切成蜡片,于40℃的水面进行展平,展平后放置在清洁的载玻片上,置于60℃烤箱中烘烤。制片后分别进行he与天狼星红染色。
3.肝组织石蜡切片he染色
石蜡切片65℃烘干1h,进行he染色。染色流程:二甲苯(i)20min,二甲苯(ii)20min,无水乙醇(i)15min,无水乙醇(ii)15min,95%乙醇10min,90%乙醇5min,80%乙醇5min,苏木素7min,流水冲洗去苏木素液,1%盐酸乙醇1s,流水冲洗,伊红染色20s,流水冲洗,75%乙醇1s,85%乙醇1s,95%乙醇1s,100%乙醇1s,二甲苯(ii)1s,二甲苯(i)1s,晾干30min,中性树胶封片。
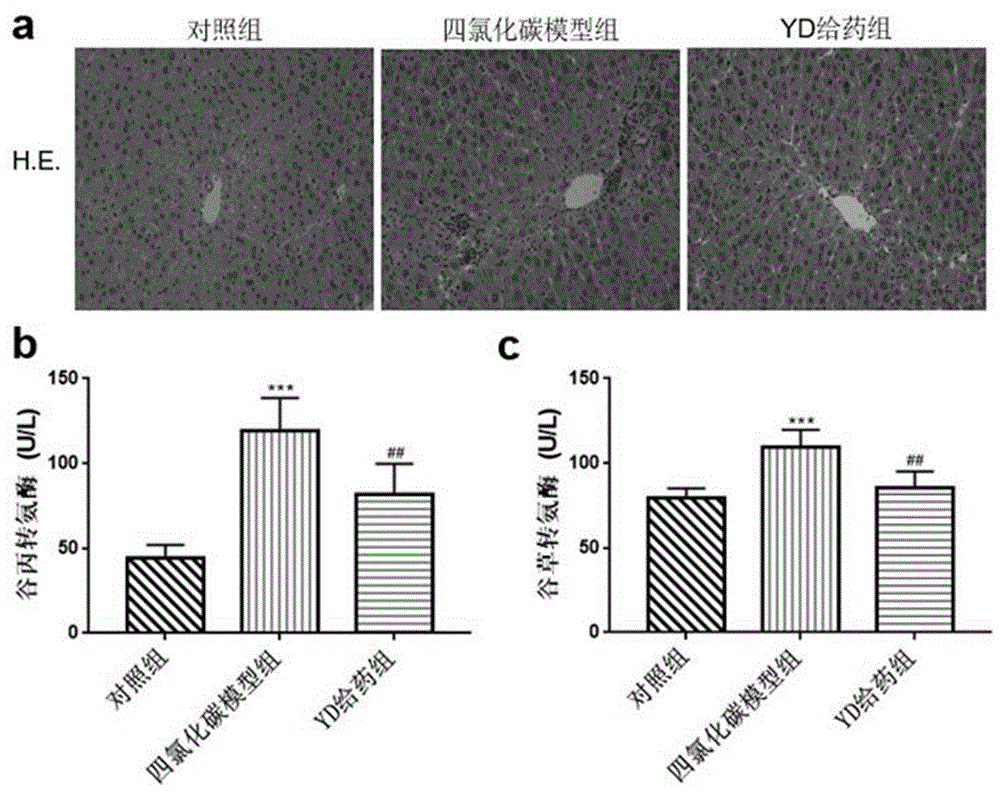
实验结果见图1。如图1a所示,he染色实验结果显示,对照组小鼠的肝小叶结构清晰完整,肝细胞呈多面体形,未产生胶原纤维堆积和炎症。四氯化碳模型组小鼠的肝小叶结构紊乱且不完整,肝索被大量沉积的胶原纤维分隔,并伴有炎症细胞浸润。抗菌肽yd给药组小鼠肝小叶分隔不明显但组织结构较完整,中央静脉周围可见部分肝索结构,胶原纤维沉积较少,纤维化程度减轻。
4.肝功能检测
在肝功能检查中,谷丙转氨酶(alt)反映肝细胞受损的指标,谷草转氨酶(ast)是反映肝细胞坏死的标准。alt和ast结合起来反映肝功能的状况。当器官发生纤维化时,血清中alt和ast的含量会明显升高。本发明通过alt和ast测试盒测定对照组、四氯化碳模型组和抗菌肽yd给药组小鼠血清中的alt和ast含量,通过酶标仪测定血清中alt和ast的含量。具体实验过程为:
将给药实验结束后的小鼠用乙醚麻醉,从眼眶静脉丛取血,置于已灭菌的1.5mlep管中,室温下自然凝固20-30min后,离心30min(5000r/min),收集上清,使用测试盒测定alt和ast含量。
实验结果见图1,如图1b和1c所示,与对照组相比,四氯化碳模型组小鼠血清中alt和ast含量明显升高,差异极显著(p<0.01);与四氯化碳模型组相比,抗菌肽yd给药组小鼠血清中alt和ast含量明显降低,差异极显著(p<0.01)。以上结果说明,经过抗菌肽yd的腹腔注射给药,与模型组相比,小鼠血清与肝脏组织中反映纤维化指标的因子含量均显著下降,抗菌肽yd抑制了小鼠肝脏纤维化的发生发展。
5.肝组织石蜡切片天狼星红染色
石蜡切片65℃烘干1h,进行天狼星红染色。染色流程:二甲苯(i)20min,二甲苯(ii)20min,无水乙醇(i)15min,无水乙醇(ii)15min,95%乙醇10min,90%乙醇5min,80%乙醇5min,避光条件下天狼星红染色1h,0.5%冰醋酸5s,流水冲洗,伊红染色20s,流水冲洗,75%乙醇1s,85%乙醇1s,95%乙醇1s,100%乙醇1s,二甲苯(ii)1s,二甲苯(i)1s,未干时中性树胶封片。
实验结果见图2,siriusred染色结果显示,对照组肝组织内有少量胶原分布。四氯化碳模型组支气管壁周围和肝泡隔区域,可见蓝色胶原纤维明显增多。抗菌肽yd给药组与模型组相比,胶原纤维沉积明显减少。统计结果显示,与模型组相比,抗菌肽yd给药组的胶原含量显著降低(图2b),抗菌肽yd能明显改善小鼠肝脏纤维化程度。
6.免疫组化检测肝组织石蜡切片α-sma和collageni的表达量
α-sma是肌成纤维细胞的主要标志,collageni是细胞外基质(ecm)的主要成分,二者含量都能够反映纤维化的程度。本实验通过免疫组化检测抗菌肽yd给药后小鼠肝脏组织中α-sma和collageni的表达量。
石蜡切片65℃烘干1h,进行脱蜡流程:二甲苯(i)20min,二甲苯(ii)20min,无水乙醇(i)15min,无水乙醇(ii)15min,95%乙醇10min,90%乙醇5min,80%乙醇5min,柠檬酸缓冲液高温高压15min进行抗原修复,室温静置1h,3%双氧水10min,pbs洗3次,10%bsa37℃孵育1h,加入一抗(浓度:α-sma,collageni和cd68都为1:400),4℃过夜孵育,pbs洗3次,加入二抗(浓度为1:100)室温孵育1h,pbs洗3次,dab显色,苏木素染色25s,流水冲洗,1%盐酸乙醇1s,流水冲洗,75%乙醇1s,85%乙醇1s,95%乙醇1s,100%乙醇1s,二甲苯(ii)1s,二甲苯(i)1s,晾干30min,中性树胶封片。
实验结果见图2,如图2所示,与对照组相比,四氯化碳模型组的肝组织α-sma和collageni含量明显升高,差异极显著(p<0.01);与四氯化碳模型组相比,抗菌肽yd给药组的肝组织α-sma和collageni含量明显降低,统计结果显示(2c和2d),差异极显著(p<0.01)。
7.实时荧光定量聚合酶链式反应(rt-pcr)检测肝组织的α-平滑肌肌动蛋白(α-sma)及胶原蛋白(collageni)的表达
本实验通过rt-pcr检测抗菌肽yd给药后小鼠肝脏组织中α-sma和collageni的基因表达量。用rt-pcr法检测小鼠肝脏组织中α-sma和collageni的蛋白表达量,是评价药物是否具有抗纤维化作用的重要指标。
实验动物取材后,称取小鼠肝组织30mg,使用transzol试剂盒提取rna,使用nanodrop进行rna浓度测定;取1微克rna使用反转录试剂盒合成cdna,然后sybrgreen法上机检测。α-sma的引物(上游引物序列:gtcccagacatcagggagtaa;下游引物序列tcggatacttcagcgtcagga),collageni的引物(上游引物序列:gctcctcttaggggccact;下游引物序列ccacgtctcaccattgggg),gapdh引物序列(上游引物序列:aggagtaagaaaccctggac;下游引物序列:ctgggatggaattgtgag)。程序:95°c预变性1min,95°c15s和55°c30s反应40次,使用livak法处理数据。
实验结果见图3。如图3a,3b结果所示,通过rt-pcr,实验小鼠经四氯化碳作用后,肝脏组织中α-sma和collageni的基因表达上调,经过抗菌肽yd给药作用后,α-sma和collageni水平明显降低,在小鼠组织转录水平证明抗菌肽yd能够抑制肝脏纤维化的发生与发展。
8.western-blotting(wb)检测α-平滑肌肌动蛋白(α-sma),胶原蛋白(collageni)及nf-κb的表达
a、提取蛋白
实验动物取材后,称取小鼠肝组织30mg,加入裂解液(50mmtris-hcl(ph8.0),150mmnacl,0.02%nan3,0.1%sds,1%np-40,0.5%去氧胆酸钠,1mmedta,1mmripa)使用匀质器破碎,混匀,12000r/min离心后,取上清;使用bca蛋白浓度测定试剂盒进行蛋白浓度测定;
b、蛋白裂解、变性
将各样本的蛋白浓度用裂解液稀释一致,100℃煮10min,使蛋白充分变性;
c、电泳
每个孔道加入总量50μg的蛋白,恒压电泳(80v)跑浓缩胶30min,然后电压换成120v,跑分离胶至染料到达凝胶底部;
d、转膜
整个装置在冰上进行,250ma转膜1.5h,之后,tbst溶液漂洗3次,
e、封闭
5%脱脂牛奶或5%bsa中慢摇封闭1h;
f.一抗浓度:collageni为1:500,α-sma,gapdh,p-p65,p65,p-ikbα,ikbα都为1:1000,于4℃冰箱过夜孵育;孵育完后,用tbst溶液漂洗3次,每次10min。二抗浓度:1:10000,于室温下孵育1h;孵育完后,用tbst溶液漂洗3次,每次10min;
g.显影观察分析
实验结果见图4和图8。通过免疫印迹测定(图4),实验小鼠经四氯化碳作用后,肝脏组织中α-sma和collageni的表达上调,经过抗菌肽yd给药作用后,α-sma和collageni水平明显降低。实验小鼠经四氯化碳作用后,肝脏组织中p-p65和p-ikbα的表达上调,nf-κb通路激活,经过抗菌肽yd给药作用后,p-p65和p-ikbα水平明显降低,进而抑制nf-κb通路(图8)。在小鼠组织蛋白水平证明抗菌肽yd能够抑制肝脏纤维化的发生与发展及纤维化病程中的炎症反应。
9.与炎症相关重要因子含量检测
肝脏纤维化早期以炎症反应为主,在炎症反应过程中常出现炎性细胞、免疫效应细胞和其他相关细胞因子。其中重要的有肿瘤坏死因子-α(tnf-α),通过促进间质细胞的有丝分裂、调控胶原合成和沉积等多途径影响基质代谢;白细胞介素(il)通过从炎症损伤等参与肝纤维化的形成。发生纤维化时,炎症因子含量升高。本实验通过elisa方法测定正常组、模型组和抗菌肽yd给药组血清中tnf-α、il-1β含量。
试验血样来源同实验4,收集血清使用elisa试剂盒测定tnf-α、il-1β含量。实验结果见图6。如图6a所示,与对照组相比,四氯化碳模型组小鼠血清中tnf-α含量明显升高;与四氯化碳模型组相比,抗菌肽yd给药组小鼠血清中tnf-α含量明显降低。如图6b所示,与对照组相比,四氯化碳模型组小鼠血清中il-1β含量明显升高;与四氯化碳模型组相比,抗菌肽yd给药组小鼠血清中il-1β含量降低。以上结果说明,经过抗菌肽yd给药,与四氯化碳模型组相比,小鼠血清中相关炎症因子含量均显著下降,抗菌肽yd抑制了纤维化病程中的炎症反应。
10.免疫组化检测肝组织石蜡切片cd68的表达量
cd68是巨噬细胞的标志物,炎症反应招募大量巨噬细胞积聚,cd68的含量增多。
实验方法同动物实验6。
实验结果见图7,如图7所示,与对照组相比,四氯化碳模型组的肝组织cd68含量明显升高,差异极显著(p<0.01);与四氯化碳模型组相比,抗菌肽yd给药组的肝组织cd68含量明显降低。
以上结果说明在动物实验中,四氯化碳可引起小鼠肝脏发生炎症反应,激活nf-κb信号通路,分泌更多的分泌炎症因子,激活肝星状细胞,引起纤维化发生,但经过抗菌肽yd处理后,通过下调信号通路中关键因子磷酸化p65和磷酸化iκbα的表达,阻止了细胞分泌炎症因子,抑制炎症反应进而阻碍了肝脏纤维化的发生发展。
二、细胞实验
本实验以肝纤维化研究中广泛应用的肝星状细胞lx-2为体外肝纤维化细胞模型,以药物研究中广泛应用的巨噬细胞raw264.7经脂多糖诱导为体外炎症细胞模型,通过体外细胞实验对抗菌肽yd在治疗肝纤维化中的药理学活性进行鉴定。
1.细胞培养
lx-2细胞和raw264.7细胞由甘肃省新药临床前研究重点实验室提供,分别将lx-2,raw264.7细胞消化处理,混匀计数,按照每孔250000个细胞的浓度稀释,再按照每孔2ml加入6孔板中,将培养板放入37℃、5%co2的恒温培养箱中,培养24h;吸去培养板中原培养基,加入无血清培养基,饥饿培养12h。
2.细胞毒性检测
cck8法测定不同浓度抗菌肽yd对lx-2细胞与raw264.7细胞的毒性作用
分组加药:(1)无处理的对照组;(2)抗菌肽yd(12.5μmol/l)组;(3)抗菌肽yd(25μmol/l)组;(4)抗菌肽yd(50μmol/l)组;(5)抗菌肽yd(100μmol/l)组;(6)抗菌肽yd(100μmol/l)组,每组设5个平行孔,然后继续在培养箱中培养48h。每孔加入cck8溶液10μl,培养箱孵育2h,450nm波长测吸光值。实验结果见图9。如图9a和b所示,当抗菌肽yd作用浓度在0-200μm范围内,对lx-2细胞与raw264.7细胞的增殖活性都没影响,即无毒性。
3.wb检测lx-2细胞α-sma及collageni表达
a、分组加药
(1)无处理的对照组;(2)抗菌肽yd(50μmol/l);(3)抗菌肽yd(100μmol/l)组;然后在培养箱中培养48h。
b、提取蛋白
培养48h后提取蛋白以检测α-sma及collageni;提取蛋白后使用bca法测定蛋白浓度;
步骤c-g依次为蛋白裂解、变性;电泳;转膜;封闭;实验过程同动物实验8;
实验结果见图5,如图5a所示,与对照组相比,抗菌肽yd作用后,α-sma及collageni蛋白表达下调。如图5b,5c所示,对图5a进行统计,与对照组相比,50μmol/l和100μmol/l的抗菌肽yd干预后,α-sma及collageni的表达均显著减弱。
3.wb检测脂多糖诱导的raw264.7炎症细胞模型nf-κb通路的表达
nf-κb能调节多种参与炎症反应的细胞因子和蛋白酶类的基因转录过程,与炎症的发生密切相关。脂多糖激活巨噬细胞会分泌白细胞介素(il-1β和il-6)和肿瘤坏死因子-α(tnf-α)等促炎性细胞因子,并招募t细胞和中性粒细胞,引发炎症反应,促进纤维化的发展。
本实验通过wb方法,检测raw264.7细胞经抗菌肽yd处理后,在脂多糖诱导下磷酸化p65和磷酸化iκbα表达变化,鉴定抗菌肽yd通过抗炎途径达到抗肝脏纤维化的作用。
a、分组加药
(1)无处理的正常对照组;(2)1ug/ml脂多糖模型组;(3)抗菌肽yd(50μmol/l)+1ug/ml脂多糖组;(4)抗菌肽yd(100μmol/l)+1ug/ml脂多糖组,然后继续在培养箱中培养;
b、提取蛋白
培养1h后提取蛋白以检测p65和iκbα;提取蛋白后使用bca法测定蛋白浓度;
步骤c-g依次为蛋白裂解、变性;电泳;转膜;封闭;实验过程同动物实验8;
实验结果见图10,如图10a所示,与对照组相比,脂多糖及抗菌肽yd作用后,总p65及总iκbα蛋白表达无明显差异,脂多糖作用后,磷酸化p65和磷酸化iκbα蛋白表达上调;与脂多糖组相比,抗菌肽yd干预后,磷酸化p65和磷酸化iκbα蛋白表达有所下调。如图10b,10c所示,对图10a进行统计,与对照组相比,脂多糖作用后,磷酸化p65和磷酸化iκbα蛋白表达显著增加;50μmol/l和100μmol/l的抗菌肽yd干预后,磷酸化p65和磷酸化iκbα的表达较脂多糖组均显著减弱。
以上结果说明在细胞实验中,脂多糖激活了巨噬细胞内nf-κb信号通路,引起纤维化发生,但经过抗菌肽yd处理后,通过下调信号通路中关键因子磷酸化p65和磷酸化iκbα的表达,阻止了细胞分泌炎症因子,进而抑制了肝脏纤维化的发生发展。
综上所述,本发明化学合成抗菌肽yd后,作用于两种细胞模型(人肝星状细胞(lx-2)模型和脂多糖诱导的小鼠巨噬细胞(raw264.7)炎症模型)和体内肝纤维化小鼠模型,通过检测抗菌肽yd作用于模型细胞后肝纤维化相关因子的表达,抗菌肽yd作用于模型动疗后组织切片染色观察分析、血清学指标与参与纤维化重要因子的表达水平,在细胞水平与分子水平,均证实抗菌肽yd通过抑制nf-κb信号通路进而阻碍肝脏纤维化的发生发展,具有抗肝脏纤维化作用,并且细胞毒性低,可以用于肝脏纤维化治疗药物的制备。
附图说明
图1为小鼠肝损伤检测:
图中:a为he染色结果,b为谷丙转氨酶,c为谷草转氨酶。
图2为小鼠肝脏组织中纤维化病理切片染色和纤维化重要标志物免疫组化检测结果:
图中:a为天狼星红染色及免疫组化检测小鼠肝脏组织α-sma,collageni表达,b为天狼星红染色统计结果,c为免疫组化检测小鼠肝脏组织α-sma含量统计结果,d为免疫组化检测小鼠肝脏组织collageni含量统计结果。
图3为rt-pcr检测小鼠肝脏组织中纤维化重要标志物结果:
图中:a为rt-pcr检测小鼠肝脏组织中α-sma表达实验结果,b为rt-pcr检测小鼠肝脏组织中collageni表达实验结果。
图4为wb检测小鼠肝脏组织α-sma与collageni表达结果:
图中:a为wb实验结果,b为α-sma表达量统计结果,c为collageni表达量统计结果。
图5为wb检测lx-2细胞的表达collageni与α-sma表达结果:
图中:a为collageni表达统计结果,b为α-sma表达统计结果。
图6为小鼠血清中炎症相关因子血清学检测结果:
图中:a为肿瘤坏死因子α含量,b为白细胞介素1β含量。
图7为免疫组化检测小鼠肝脏组织中重要炎症标志物cd68检测结果:
图中:a为免疫组化检测小鼠肝脏组织cd68表达,b为免疫组化检测小鼠肝脏组织cd68含量统计结果。
图8为wb检测肝脏组织中nf-κb信号通路的表达结果:
图中:a为wb检测p-ikbα和p-p65表达实验结果,b为p-p65表达统计结果,c为p-ikbα表达统计结果。
图9为抗菌肽yd对lx-2细胞和raw264.7细胞的毒性作用:
图中:a为lx-2细胞存活率统计结果,b为raw264.7细胞存活率统计结果
图10为wb检测raw264.7细胞在脂多糖诱导下nf-κb信号通路的表达结果:
图中:a为wb检测p-ikbα和p-p65表达实验结果,b为p-p65表达统计结果,c为p-ikbα表达统计结果。
具体实施方式
下面通过具体实施例对本发明抗菌肽yd作为活性成分,在制备抗肝纤维化药物中的应用作进一步说明。
实施例1
抗菌肽yd肌肉注射用冻干粉的制备
配方:抗菌肽yd(纯度大于95%)30.0g
特异性蛋白稳定剂、冻干保护剂/赋形剂30.0g
渗透压调节剂(血浆313mosm/kgh2o)0.5-1l
ph调节剂(ph4-9)0.5-1l
制药用水加至总体积60l
冻干粉总质量60.0-70.0g
工艺:按制备冻干粉的常规工艺操作,共制成冻干粉剂1000支,每支含抗菌肽yd冻干粉60-70mg,避光保存。
上述非特异性蛋白稳定剂、冻干保护剂优选甘露醇,赋形剂优选乳糖,渗透压调节剂优选nacl,ph调节剂优选柠檬酸/tris-hcl缓冲液。
实施例2
抗菌肽yd口服制剂的制备
配方:抗菌肽yd(纯度大于95%)50.0g
填充剂85.0g
黏合剂5.0g
润滑剂10.0g
共计200.0g
工艺:按制备胶囊剂的常规工艺制成1000粒,每粒胶囊含抗菌肽yd有效成分50mg,对胶囊采用肠溶材料丙烯酸树脂包衣,制成肠溶衣制剂。填充剂、黏合剂、润滑剂等辅料均为药剂学常规辅料。
除此之外,口服制剂还可将上述填充剂、黏合剂、润滑剂等辅料由聚酯材料包裹制成微球、微囊和毫微球,由壳聚糖包裹制备成脂质体或纳米粒,加入胆固醇、磷酯和游离脂肪酸制备成微乳制剂等。各剂型的制备工艺均为药剂学常规工艺。
- 还没有人留言评论。精彩留言会获得点赞!