蓝花参提取物在制备治疗或预防炎症性肠病的药物中的应用的制作方法
本发明涉及医药领域,特别是涉及蓝花参提取物在制备治疗或预防炎症性肠病的药物中的应用。
背景技术:
炎症性肠病(inflammatoryboweldisease,ibd)是一种累及回肠、结肠、直肠的慢性、特发性肠道炎症性疾病,主要包括克罗恩病(crohndisease,cd)和溃疡性结肠炎(ulcerativecolitis,uc)。病理特征主要为结肠粘膜及粘膜下层连续或非连续性炎症反应,临床表现为腹痛、腹泻、便血、乏力、营养失调、体重减轻等。近年来,炎症性肠病的发病率和患病率逐年增加,其临床治疗费用不断增高,部分患者可出现肠出血和肠穿孔,甚至结肠癌,是严重威胁人类生命的一大疾病。目前用于炎症性肠病的药物,主要包括5-氨基水杨酸类、糖皮质激素、免疫抑制剂如硫唑嘌呤,和生物制剂tnf-α抗体大分子。尽管这些药物能缓解炎症性肠病患者的临床症状和体症,但大多数患者仍易复发,迁延不愈,而且这些药物还存在严重的不良反应,以及导致感染和恶性肿瘤发生的风险,因此,寻找新颖有效而安全的药物就显得尤其紧迫。
一直以来,传统中药对于临床慢性难治性疾病有其独特疗效。一些来源于天然植物的中药如穿心莲、十里香、芦荟、麦草、马蓝的提取物已被报道用于炎症性肠病。蓝花参(wahlenbergiamarginata)是一种生长分布于我国西南和长江流域以南的桔梗科蓝花参属的植物。其根或全草广泛地作为一种少数民族医药应用于小儿感冒、肺虚咳嗽、支气管肺炎等呼吸道疾病,小儿疳积,牙痛,疟疾,高血压等的治疗,但未报道用于炎症性肠病的治疗。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供蓝花参提取物在制备治疗或预防炎症性肠病的药物中的应用。
为实现上述目的及其他相关目的,本发明提供一种蓝花参提取物在制备治疗和/或预防炎症性肠病或其相关疾病的药物中的应用。
可选地,所述蓝花参提取物是通过索氏提取法提取得到。
可选地,所述蓝花参提取物的提取方法包括:将蓝花参粉碎成粉末,加入索氏提取器的套管中,向蒸馏瓶中加入溶剂,加热回流,得到提取液,将所述提取液干燥,得到固体粉末状蓝花参提取物。
可选地,提取所述蓝花参提取物时,采用的有机溶剂选自乙谜所述溶剂选自乙醚、二氯甲烷、氯仿、乙酸乙酯、乙腈、乙醇、甲醇、水中的至少一种。
可选地,所述提取液的干燥方式为真空干燥或常温干燥。
可选地,所述炎症性肠病包括但不限于溃疡性结肠炎、克罗恩病。
可选地,所述炎症性肠病的临床表现包括体重减轻、腹泻、便血。
可选地,所述蓝花参提取物抑制炎症性肠病结肠中炎症细胞因子的生成。
可选地,所述炎症细胞因子包括tnf-α、inf-γ、il-1β、il-6、il-17a。
可选地,所述蓝花参提取物抑制炎症性肠病结肠中炎症细胞的浸润。
可选地,所述炎症细胞包括白细胞、巨噬细胞、中性粒细胞、cd4+t淋巴细胞、th1淋巴细胞、th17淋巴细胞。
可选地,所述蓝花参提取物降低炎症性肠病结肠组织中氧化分子的水平,增加抗氧化分子的水平。
可选地,所述氧化分子包括氧自由基(ros)、丙二醛(mda)。
可选地,所述抗氧化分子包括谷胱甘肽(gsh)、超氧化物歧化酶(sod)、过氧化氢酶(cat)。
可选地,所述蓝花参提取物减轻炎症性肠病结肠粘膜上皮屏障功能障碍。
本发明还提供一种蓝花参提取物的制备方法,包括:采用索氏提取法对蓝花参进行提取得到所述蓝花参提取物。
可选地,将所述蓝花参制成粉末后加入所述索氏提取器的套管中,将溶剂加入所述索氏提取器的蒸馏瓶中,加热条件下反复回流,得到提取液。
可选地,所述溶剂选自有机溶剂、无机溶剂中的至少一种。
可选地,所述有机溶剂选自乙醚、二氯甲烷、氯仿、乙酸乙酯、乙腈、乙醇、甲醇中的至少一种。
可选地,所述无机溶剂选自双蒸水、去离子水、超纯水中的的至少一种。
可选地,所述蓝花参粉末与所述溶剂的质量比为1:(4-20)。
可选地,回流的时间为4-8h。
可选地,将所得提取液干燥,得到所述蓝花参提取物,该提取物为粉末状。
可选地,所述干燥方式为真空干燥。
可选地,所述提取液的干燥温度为10-30℃。
本发明还提供上述制备方法制得的蓝花参提取物。
本发明还提供含有效剂量的上述蓝花参提取物的用于防治炎症性肠病的药品或保健品。
本发明还提供含有效剂量的上述蓝花参提取物的用于缓解腹泻或便血症状的药品或保健品。
如上所述,本发明的有益效果在于:本发明提供了一种蓝花参提取物的制备方法,通过索氏提取法从蓝花参中提取得到有效活性成分-蓝花参提取物,并经过大量的实验验证研究,发现将蓝花参提取物应用于炎症性肠病及其相关疾病中,可以改善并减轻炎症性肠炎所致的体重减轻、腹泻、肠道出血、结肠变短、结肠组织病理性损伤等问题,抑制炎症性肠炎结肠组织中炎症细胞(巨噬细胞、中性粒细胞、t淋巴细胞和b淋巴细胞)的渗出,增强炎症性肠炎结肠组织中细胞因子tnf-α、inf-γ、il-1β、il-6、il-17a的生成,增强炎症性肠炎结肠组织中抗氧化物谷胱甘肽(gsh)、超氧化物歧化酶(sod)和过氧化氢酶(cat)水平和活性,减少结肠组织中氧自由基ros和丙二醛(mda)生成,改善炎症性肠炎肠道上皮屏障功能,且安全有效,不良反应少。本发明开发了蓝花参提取物的一种新用途,可以将其制作成药品或保健品,用于防治炎症性肠病及其相关疾病,为临床炎症性肠病的预防/治疗炎症性肠病提供了一个新的选择。
附图说明
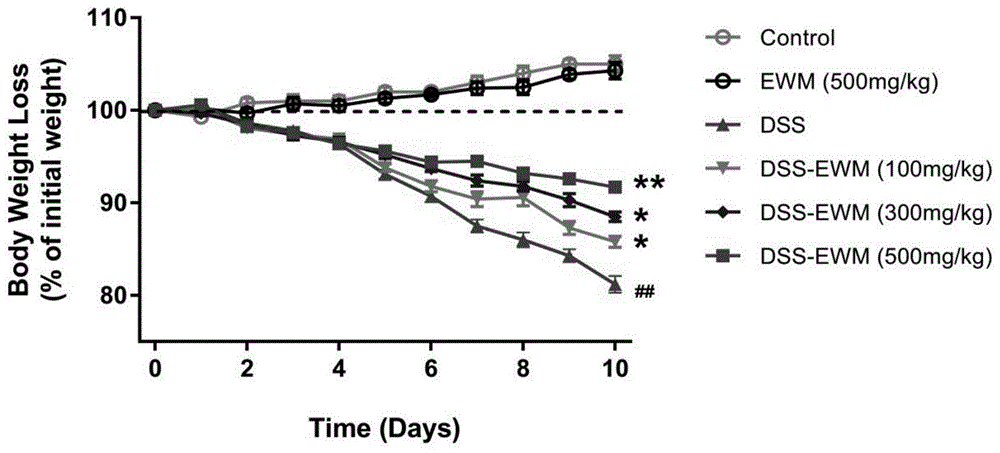
图1显示为本发明实施例4中,蓝花参提取物(ewm)对dss诱导炎症性肠病小鼠体重变化图。
图2显示为本发明实施例4中,蓝花参提取物(ewm)对dss诱导炎症性肠病小鼠疾病活性指数(dai)的影响结果图。
图3显示为本发明实施例5中,蓝花参提取物(ewm)对dss诱导小鼠炎症性肠病结肠大体长度变化结果图。
图4显示为本发明实施例5中,蓝花参提取物(ewm)对dss诱导小鼠炎症性肠病结肠长度变化的统计结果图。
图5显示为本发明实施例5中,蓝花参提取物(ewm)对dss诱导小鼠炎症性肠病结肠组织he染色结果图。
图6显示为本发明实施例6中,蓝花参提取物(ewm)对dss诱导小鼠炎症性肠病结肠组织白细胞浸润的实验结果图(图中红色标记为cd45阳性白细胞)。
图7显示为本发明实施例6中,蓝花参提取物(ewm)对dss诱导小鼠炎症性肠病结肠组织不同类型白细胞浸润的实验结果图。
图8显示为本发明实施例6中,蓝花参提取物(ewm)对dss诱导小鼠炎症性肠病结肠组织中炎症细胞因子的实验结果图(其中nd为未检测到)。
图9显示为本发明实施例7中,蓝花参提取物(ewm)对dss诱导小鼠炎症性肠病结肠组织中氧化和抗氧化分子的实验结果图。
图10显示为本发明实验例9中,蓝花参提取物(ewm)对dss诱导小鼠体重丢失、疾病活动指数和结肠长度的实验结果图(其中nd为未检测到)。
图11显示为本发明实验例10中,蓝花参提取物(ewm)对dss诱导小鼠体重丢失、疾病活动指数和结肠长度的实验结果图(其中nd为未检测到)。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
本发明拟用天然植物蓝花参为原料,通过化学萃取的方法,提取蓝花参的有效活性成分-蓝花参提取物,用于炎症性肠病的防治应用。
本发明选取蓝花参植物提取物,作为一种安全而有效的炎症性肠病的治疗药物。
本发明技术方案之一是提供用于防治炎症性肠病的蓝花参提取物的制备方法,具体包括以下三个步骤:将干燥无发霉的蓝花参全草机械粉碎成粉末,得到蓝花参粉末;以质量比1:4-20的比例,分别将蓝花参粉末和水或不同极性的有机溶剂,加入到索氏提取器,在回流温度下浸泡4-8小时,反复提取2-5次,得到蓝花参萃取液;随后将蓝花参萃取液常温真空干燥,得到固体粉末状蓝花参提取物。所需有机溶剂包括但不限于乙醚、二氯甲烷、氯仿、乙酸乙酯、乙腈、乙醇、甲醇中的至少一种。
本发明技术方案之二是上述蓝花参提取物或含有效剂量的上述蓝花参提取物可用于防治炎症性肠病的药品或保健品。
本发明技术方案之三是上述蓝花参提取物或含有效剂量的上述蓝花参提取物可用于缓解腹泻或便血症状的药品或保健品。
本发明技术方案之四是上述蓝花参提取物可呈剂量(100-500mg/kg)依赖地改善葡聚糖硫酸钠(dss)诱导的炎症性肠病,包括缓解小鼠体重减轻,减少疾病活性指数,逆转结肠长度缩短,减轻结肠组织炎症反应和病理性损伤。
本发明技术方案之五是上述蓝花参提取物可呈剂量(100-500mg/kg)依赖地减轻葡聚糖硫酸钠(dss)诱导的炎症性肠病结肠局部炎症反应,包括减少结肠组织中细胞因子tnf-α、inf-γ、il-1β、il-6、il-17a的产生,抑制结肠组织中巨噬细胞、中性粒细胞、t淋巴细胞、b淋巴细胞等炎症细胞的浸润。
本发明技术方案之五是上述蓝花参提取物可呈剂量(100-500mg/kg)依赖地减轻葡聚糖硫酸钠(dss)诱导的炎症性肠病结肠局部氧应激反应,包括减少结肠组织中氧自由基ros和丙二醛(mda)生成,增加谷胱甘肽(gsh),超氧化物歧化酶(sod),和过氧化氢酶(cat)水平和活性。
本发明技术方案之六是上述蓝花参提取物可呈剂量(100-500mg/kg)依赖地减轻葡聚糖硫酸钠(dss)诱导的炎症性肠病肠道上皮屏障功能障碍,包括减少dss诱导fitc-dextran从肠道粘膜上皮漏入血液中的浓度。
实施例1
蓝花参提取物的制备方法:
将干燥的蓝花参机械粉碎成粉末,筛网过目得到平均直径约0.8mm粉末,称取10克蓝花参粉末放入到索氏提取器,100毫升甲醇加入圆底烧瓶,随后加热圆底烧瓶,溶剂蒸发、冷凝、浸出、回流,在回流温度提取6小时,收集圆底烧瓶中蓝花参萃取液,常温下真空干燥,得到灰绿色固体片状蓝花参甲醇提取物2.18克,得率为21.8%。
实施例2
将干燥的蓝花参机械粉碎成粉末,筛网过目得到平均直径约0.8mm粉末,称取10克蓝花参粉末放入到索氏提取器,100毫升二氯甲烷加入圆底烧瓶,随后加热圆底烧瓶,溶剂蒸发、冷凝、浸出、回流,在回流温度提取5小时,收集圆底烧瓶中蓝花参萃取液,常温下真空干燥,得到灰绿色固体片状蓝花参二氯甲烷提取物2.24克,得率为22.4%。
实施例3
蓝花参提取物的制备方法:
将干燥的蓝花参机械粉碎成粉末,筛网过目得到平均直径约0.8mm粉末,称取10克蓝花参粉末放入到索氏提取器,100毫升二氯甲烷加入圆底烧瓶,随后加热圆底烧瓶,溶剂蒸发、冷凝、浸出、回流,在回流温度提取5小时,收集圆底烧瓶中蓝花参萃取液,常温下真空干燥,得到蓝花参二氯甲烷提取物。将上述索氏提取器中剩余的蓝花参,通过重新换加100毫升甲醇圆底烧瓶,再次加热到溶剂蒸发、冷凝、浸出、回流5小时,收集圆底烧瓶中甲醇蓝花参萃取液,常温真空干燥,得到蓝花参二氯甲烷提取后甲醇提取物。
实施例4-8所采用的蓝花参提取物(extractofwahlenbergiamarginata,ewm)均来自实施例1。
实施例4
蓝花参提取物(extractofwahlenbergiamarginata,ewm)改善葡聚糖硫酸钠(dss)诱导的小鼠炎症性肠病体重减轻和疾病活性指数:
实验材料:葡聚糖硫酸钠购自mpbiomedicals公司,实验动物为4-8周,体重18~22克spf级雄性c57/bl6j小鼠,来源于重庆医科大学实验动物中心,动物使用许可证号为syxk(渝)2015-0001,饲养在温度(24±2)℃、12/12小时光照/黑暗(即12h光照、12h黑暗)的室内,常规饲料喂养,自由饮水进食,小鼠适应一周后开始建立模型和药物干预实验。
实验分组及干预:小鼠随机分为6组,分别为空白正常组、药物对照组(500mg/kg)、dss炎症性肠炎模型组、小剂量蓝花生提取物干预组(100mg/kg)、中剂量蓝花生提取物干预组(300mg/kg)、大剂量蓝花生提取物干预组(500mg/kg),共6组,每组7只。dss炎症性肠炎模型组和不同剂量蓝花参提取物干预组,小鼠自由饮用含2.5%(质量体积百分比)dss的水溶液7天,随后换成无dss水饮用3天;空白正常组和药物对照组,只饮用无dss水,药物对照组和不同剂量蓝花参干预组,每日灌胃给予相应剂量蓝花参提取物,其中药物对照组和大剂量蓝花参提取物干预组,灌胃药物剂量为500mg/kg,小剂量、中剂量蓝花参提取物干预组的灌胃药物剂量分别为100mg/kg或300mg/kg。
动物观察评价:从饮用dss开始,每天观察小鼠活动状态,精神情况,大便性状,有无腹泻和便血发生,并每日称重记录小鼠体重。
动物观察结果:空白正常组和药物对照组小鼠活动自如,精神状态好,dss肠炎模型组小鼠,从第三天开始,烦燥不安,精神状态变差,至第十天时,反应迟钝,精神状态极差,不同剂量蓝花参提取物干预组,动物活动和精神状态均有一定程度改善;不同实验组小鼠体重变化如图1所示,从图1中可以看出,从第三天开始,dss肠炎模型组小鼠体重逐渐下降蓝花参提取物可呈剂量依赖地逆转dss诱导的小鼠体重丢失;进一步根据体重下降、腹泻指数和便血程度,计算小鼠疾病活动指数(diseaseactivityindex,dai)评分(参考wirtz,setal.natureprotocols2017,12,1295),结果如图2所示,从图2中可以看出,在饮用含2.5%dss的水第十天,相对于饮用无dss水的小鼠,dai评分显著增高,而在蓝花参提取物(ewm)干预组,dai评分呈剂量依赖地降低。
实施例5
蓝花参提取物减轻葡聚糖硫酸钠(dss)诱导的小鼠炎症性肠病结肠病变:
实验材料:苏木精,伊红,多聚甲醛
实验分组及干预:动物分组与干预同实施例4,小鼠饮用dss第10日后,麻醉处死,收取小鼠结肠组织。
分析和检测方法:观察结肠大体结构变化,测量结肠长度,随后取远端结肠组织多聚甲醛固定,脱水、石蜡包埋后切片,行苏木精-伊红染色(he),显微镜下观察其病理变化,并评分。
结肠病变结果:图3和图4分别为本实施中各组dss诱导小鼠炎症性肠病结肠大体长度变化结果图和统计结果图,从图3和图4中可以看出,相对于空白正常组和药物对照组小鼠结肠长度,dss肠炎模型组小鼠结肠明显变短,不同剂量蓝花参提取物(ewm)干预组,则结肠长度剂量依赖地增长;图5为本实施例中各组dss诱导小鼠炎症性肠病结肠组织白细胞浸润的实验结果图(图中红色标记为cd45阳性白细胞),从图5中可以看出,进一步结肠组织he染色病理分析发现,dss炎症性肠病模型组,粘膜及粘膜下层炎症细胞渗出明显,粘膜上皮细胞丢失,粘膜结构破坏,而不同剂量蓝花参提取物干预组,有呈现不同程度的缓解。实施例6
蓝花参提取物减轻葡聚糖硫酸钠(dss)诱导的小鼠炎症性肠病结肠炎症细胞浸润和炎症细胞因子的产生:
实验材料:抗体cd45-pe(货号103106)、cd45-fitc(货号103108)、cd11b-apc(货号101212)和f4/80-fitc(货号123108)购于biolegend公司,抗体ly6g-pe(货号551461)、cd3-fitc(货号553061)、cd3-pe(货号553063)、cd4-pe-cy5(货号553654)、cd4-apc-cy7(货号552051)、cd8-pe(货号555635)、nk1.1-pe(货号557391)、foxp3-pe(货号560408)、tnf-α(货号561063)、inf-γ-pe(货号554412)、il-17a-pe(货号559502)、il-4-pe(货号554435)、细胞因子tnf-α(货号、il-1β(货号、inf-γ(货号、il-6(货号elisa试剂盒均购自美国becton,dickinsonandcompany公司,il-17aelisa试剂盒(货号m1700)购自于r&dsystems公司。
实验分组及干预:动物分组与干预方法同实施例4,小鼠饮用dss第10日后,麻醉处死,收取小鼠结肠,分成三份,其中第一部分多聚甲醛固定6小时,蔗糖脱水后oct包埋,行冰冻切片,随后用于组织免疫荧光分析;第二部分取200mg结肠组织剪碎,后加入胶原酶消化15分钟,离心后分离和收集结肠组织中炎症细胞,流式细胞仪分析;100mg结肠组织加入组织裂解液匀浆后,12000转离心,取上清,做elisa。
检测和分析方法:取oct包埋的结肠冻存组织,在莱卡cm1950切片机上行10μm切片,5%胎牛血清封闭后,加入pe标记的cd45抗体,4℃孵育过夜,tbst漂洗后,加入dapi染色5分钟,随后防荧光淬灭封片剂封片,荧光显微镜下观察并照相,结果如图6所示;不同实验组结肠组织提取的非实质细胞,细胞计数仪分析所提组织中细胞总数,随后分别加入不同荧光标记的细胞标记分子流式抗体,避光染色30分钟,pbs洗涤后,上流式细胞仪检测不同白细胞及其亚型;取不同实验组结肠组织组织裂解后的上清50μl,加入包被不同细胞因子抗体的96孔板,4℃孵育过夜,洗去未结合的组织上清,加入生物素标记的二抗室温孵育1小时,洗去未结合二抗后,加入hrp交联的亲和素结合30分钟,随后加入显色剂tmb,酶标仪450nm检测吸光度,根据标准曲线计算细胞因子的含量。
结肠炎症反应结果:图6为本实施例中各组dss诱导小鼠的炎症性肠病结肠组织白细胞浸润的实验结果图(图中红色标记为cd45阳性白细胞),从图6的免疫荧光分析结果可见,相对于空白和蓝花参提取物对照组,dss模型组结肠组织中白细胞(cd45+)的显著增加,不同剂量蓝花参提取物则剂量依赖性地减少dss诱导结肠组织中白细胞的渗出;进一步流式分析渗出白细胞类型的结果如图7所示,dss处理组结肠组织中巨噬细胞(cd45+cd11b+)、中性粒细胞(cd45+ly6g+)、cd4+t淋巴细胞(cd3+cd4+)、th1淋巴细胞(cd3+cd4+infγ+)、th17淋巴细胞(cd3+cd4+il17+)均显著增加,treg淋巴细胞轻度增加(cd3+cd4+foxp3+),而蓝花参干预组则剂量依赖地减轻这些类型白细胞的渗出;elisa结果如图8所示(其中nd为未检测到),相对于空白和蓝花参提取物对照组,dss模型组结肠组织中细胞因子tnf-α、inf-γ、il-1β、il-6和il-17a均显著增高,而蓝花参干预组则剂量依赖地抑制dss诱导的结肠组织中上述细胞因子的增高。
实施例7
蓝花参提取物影响葡聚糖硫酸钠(dss)诱导的小鼠炎症性肠病结肠氧化和抗氧化分子生成:
实验材料:氧自由基(ros)、丙二醛(mda)、谷胱甘肽(gsh)、超氧化物歧化酶(sod)、和过氧化氢酶(cat)检测试剂盒购于南京碧云天生物技术有限公司。
实验分组及干预:动物分组与干预同实施例4,小鼠饮用dss第10日后,麻醉处死,收取小鼠结肠组织。
检测和分析方法:取100mg结肠组织,组织裂解液裂解后,4度离心取上清,分别按相应试剂盒说明,用酶标仪分析。
结肠氧应激结果:图9为本实施例中各组dss诱导小鼠的炎症性肠病结肠组织中氧化和抗氧化分子的实验结果,从图9中可以看出,,空白组和蓝花参对照组结肠组织中,ros和mda含量较低,而在dss模型组,其结肠组织中ros和mda的含量显著增强,进一步蓝花参干预组则呈剂量依赖地抑制dss诱导的ros和mda增强;值得注意的是,抗氧化分子结果则表现为,相对于空白组,蓝花生对照组谷胱甘肽(gsh)含量,超氧化物歧化酶(sod)和过氧化氢酶(cat)活性轻度增加,而dss模型组结肠组织中谷胱甘肽(gsh)含量,超氧化物歧化酶(sod)和过氧化氢酶(cat)活性则显著下降,不同剂量蓝花参干预组,则呈剂量依赖地增加谷胱甘肽(gsh)含量,超氧化物歧化酶(sod)和过氧化氢酶(cat)活性。
实施例8
蓝花参提取物减轻葡聚糖硫酸钠(dss)诱导的小鼠炎症性肠病肠道上皮屏障的损伤:
实验材料:fitc-dextran(4kd)购自sigma-aldrich公司。
实验分组及干预:动物分组与干预方法同实施例4,小鼠饮用dss第10日后,灌胃400mg/kgfitc-dextran(0.5ml),4小时后麻醉处死小鼠,血清被收集,避光。
检测和分析方法:不同实验组血清中fitc-dextran用荧光分光光度计检测(激发波长488nm,发射波长520nm)。
肠道上皮屏障结果:通过检测血清中漏入的fitc-dextran浓度可评价肠道粘膜上皮屏障的损伤程度,结果显示,正常和蓝花参对照组(500mg/kgewm)血清中fitc-dextran浓度分别为0.91±0.05μg/ml和0.87±0.09μg/ml,而dss模型组为10.47±1.32μg/ml,低、中、高剂量蓝花参干预组,血清中fitc-dextran浓度分别为9.12±1.17μg/ml、7.02±0.84μg/ml、4.39±0.53μg/ml。此结果提示,蓝花生呈剂量依赖地改善肠道上皮屏障功能。
实施例9
采用实施例2制得的蓝花参提取物,参照实施例4和5的方法进行实验,评价蓝花参提取物对小鼠体重、疾病活动指数(dai)和结肠长度的影响,实验结果如图10所示(其中nd为未检测到),从图10中可以看出,实施例2制得的蓝花参提取物的作用与实施例1制得的蓝花参提取物的作用基本一致。
实施例10
采用实施例3制得的蓝花参提取物,参照实施例4和5的方法进行实验,评价蓝花参提取物对小鼠体重、疾病活动指数(dai)和结肠长度的影响,实验结果如图11所示(其中nd为未检测到),从图11中可以看出,实施例2制得的蓝花参提取物的作用与实施例1制得的蓝花参提取物的作用基本一致。
综上所述,经过申请人大量的实验研究发现,从蓝花参中提取得到的有效成分-蓝花参提取物,可以用于防治炎症性肠病及其相关疾病,改善并减轻炎症性肠炎所致的体重减轻、腹泻、肠道出血、结肠变短、结肠组织病理性损伤等问题,抑制炎症性肠炎结肠组织中炎症细胞(巨噬细胞、中性粒细胞、t淋巴细胞和b淋巴细胞)的渗出,增强炎症性肠炎结肠组织中细胞因子tnf-α、inf-γ、il-1β、il-6、il-17a的生成,增强炎症性肠炎结肠组织中抗氧化物谷胱甘肽(gsh)、超氧化物歧化酶(sod)和过氧化氢酶(cat)水平和活性,减少结肠组织中氧自由基ros和丙二醛(mda)生成,改善炎症性肠炎肠道上皮屏障功能,且安全有效,不良反应少。本发明开发了蓝花参提取物的一种新用途,可以将其制作成药品或保健品,用于防治炎症性肠病及其相关疾病,为临床炎症性肠病的预防/治疗炎症性肠病提供了一个新的选择。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!