胜红蓟总黄酮的应用的制作方法
本发明涉及医药领域,具体涉及胜红蓟总黄酮在制备抗菌消炎药物和抗癌药物中的应用。
背景技术:
胜红蓟,原产中南美洲,19世纪中叶进入我国,现已大面积分布。因其能适应各种农田土壤、垃圾场及废墟,而且繁殖能力特别强大面积地扩散危害,成为农业生产领域中的恶性杂草。因此,寻找一套有效的控制手段,防止其进一步扩散与危害显得尤为重要,而胜红蓟资源开发与利用正是该入侵植物综合防控的重要手段。
植物次生代谢产物含有黄酮类化合物,胜红蓟也不例外。黄酮类化合物是以黄酮(2-苯基色原酮)为母核而衍生的一类黄色色素,其中包括黄酮的同分异构体及其氢化和还原产物,也即以c6-c3-c6为基本碳架的一系列化合物。黄酮类化合物在植物界分布很广,在植物体内大部分与糖结合成苷类或碳糖基的形式存在,也有的以游离形式存在。
其他植物总黄酮已被报道具有良好的药理作用,如刺梨总黄酮可用于预防和治疗酒精性肝病,蓝莓叶总黄酮可用于防治急性肝损伤,金银花总黄酮可应用于制备治疗阿尔兹海默疾病的药物等等;而胜红蓟的黄酮含量很高,若能发现其药用价值并加以利用,则可将胜红蓟的植物入侵变废为宝,有效防控胜红蓟。
技术实现要素:
为解决上述问题,本发明提供一种胜红蓟总黄酮的应用,使胜红蓟能被有效的加以利用。
本发明提供的技术方案如下;
胜红蓟总黄酮在制备抗菌消炎药物中的应用。
胜红蓟总黄酮在制备抗癌药物中的应用。
在一个实施例中,所述抗菌消炎药物是用于治疗阴道炎的抗菌消炎药物。
在一个实施例中,所述抗癌药物是用于治疗宫颈癌hela细胞系的药物。
在一个实施例中,制备胜红蓟总黄酮的方法,包括以下步骤::
s1将胜红蓟全草打粉称重,采用冷浸法在室温下加入浓度为60±10%的乙醇,胜红蓟全草与乙醇料液比为1:20~1:40,提取时间为24±12h,提取1-2次,过滤,收集滤液;
s2取滤液用95±1%乙醇去除多糖和蛋白质,再减压浓缩至无醇味,加水混悬后加入到装有经hcl预处理的d101大孔吸附树脂的层析柱上,上样完毕后吸附4±1h,用3-5倍体积的水进行洗脱,再用4-7倍体积的70±5%乙醇洗脱,乙醇洗脱流份减压浓缩后,冷冻干燥得胜红蓟总黄酮粉末。
在一个实施例中,步骤s1所述乙醇浓度为60%。
在一个实施例中,步骤s1所述胜红蓟全草与乙醇料液比为1:30。
上述方案的有益效果如下:
1.胜红蓟作为本国的入侵植物,具有繁殖力强,扩散面积广的特点,提取其有效药理成分,开发其应用,用于制备抗菌消炎药物和抗癌药,具有变废为宝的意义。
2.采用胜红蓟总黄酮制备抗菌消炎药,能替代抗生素,有效解决耐药性问题。
3.胜红蓟总黄酮能有效抑制宫颈癌细胞hela的增殖,可以开发成一种新的抗癌药。
4.研究了胜红蓟总黄酮的提取方法,发现采用浓度为60%的乙醇溶液、提取时间24h、提取料液比1:30,仅需提取1次即可获得较高提取率。采用本方法制备胜红蓟总黄酮,具有工艺简单,提取效率高,能耗低的特点,可运用于大规模的生产。
附图说明
图1a是不同浓度胜红蓟总黄酮处理后大肠杆菌的生长曲线;
图1b是不同浓度胜红蓟总黄酮处理后金黄色葡萄球菌的生长曲线;
图1c是不同浓度胜红蓟总黄酮处理后铜绿假单胞菌杆菌的生长曲线;
图2a是小鼠的白细胞计数(wbc)结果图;
图2b是小鼠的降钙素原(pct)检验结果图;
图2c是小鼠的c反应蛋白(crp)检验结果图;
图2d是小鼠的白介素6(il-6)检验结果图;
图2e是小鼠的白介素10(il-10)检验结果图;
图3是各处理组小鼠外阴恢复情况图;
图4是mtt法检测胜红蓟总黄酮对癌细胞hela的增殖抑制作用结果图;
图5是胜红蓟总黄酮对hela细胞集落形成能力的影响图;
图6是划痕实验观察胜红蓟总黄酮对hela细胞的细胞迁移能力的影响图;
图7是吖啶橙/溴化乙锭染色法观察胜红蓟总黄酮对癌细胞hela的细胞核形态的影响图;
图8a是无添加胜红蓟总黄酮对宫颈癌细胞hela细胞周期的影响图;
图8b是50ug/ml胜红蓟总黄酮对宫颈癌细胞hela细胞周期的影响图;
图8c是100ug/ml胜红蓟总黄酮对宫颈癌细胞hela细胞周期的影响图;
图8d是200ug/ml胜红蓟总黄酮对宫颈癌细胞hela细胞周期的影响图;
图8e是400ug/ml胜红蓟总黄酮对宫颈癌细胞hela细胞周期的影响图;
图9a是宫颈癌细胞hela在g1期的二倍体比例图;
图9b是宫颈癌细胞hela在s期的二倍体比例图;
图9c是宫颈癌细胞hela在g2/m期的二倍体比例图。
具体实施方案
实施例一
将胜红蓟全草打粉称重,采用冷浸法在室温下加入60%乙醇,料液比为1:30,提取时间为24h,提取1次,过滤,收集滤液。
取滤液用95%乙醇去除多糖和蛋白质,再减压浓缩至无醇味,加水混悬后加入到装有经hcl预处理的d101大孔吸附树脂的层析柱上,上样完毕后吸附4h,用4倍体积的水进行洗脱,再用6倍体积70%乙醇洗脱,乙醇洗脱流份减压浓缩后,冷冻干燥得胜红蓟总黄酮粉末。
对得到的黄酮粉末采用比色测定方法:
胜红蓟总黄酮粉末与去离子水在试管中混匀,加入5%的亚硝酸钠溶液0.5ml,放置5min后加入10%的硝酸铝溶液0.5ml,摇匀,6min后再加入1mol/l的氢氧化钠溶液4ml,摇匀,15min后用分光光度计在波长510nm处进行测定。以芦丁对吸光度的标准曲线作为对照,测定除去空白后混合液的吸光度。
得到胜红蓟总黄酮的纯度为46.55±0.61%。
表1大孔树脂纯化后的黄酮含量及纯度
实施例二
最低抑菌浓度(mic)测定
细菌生长曲线测定
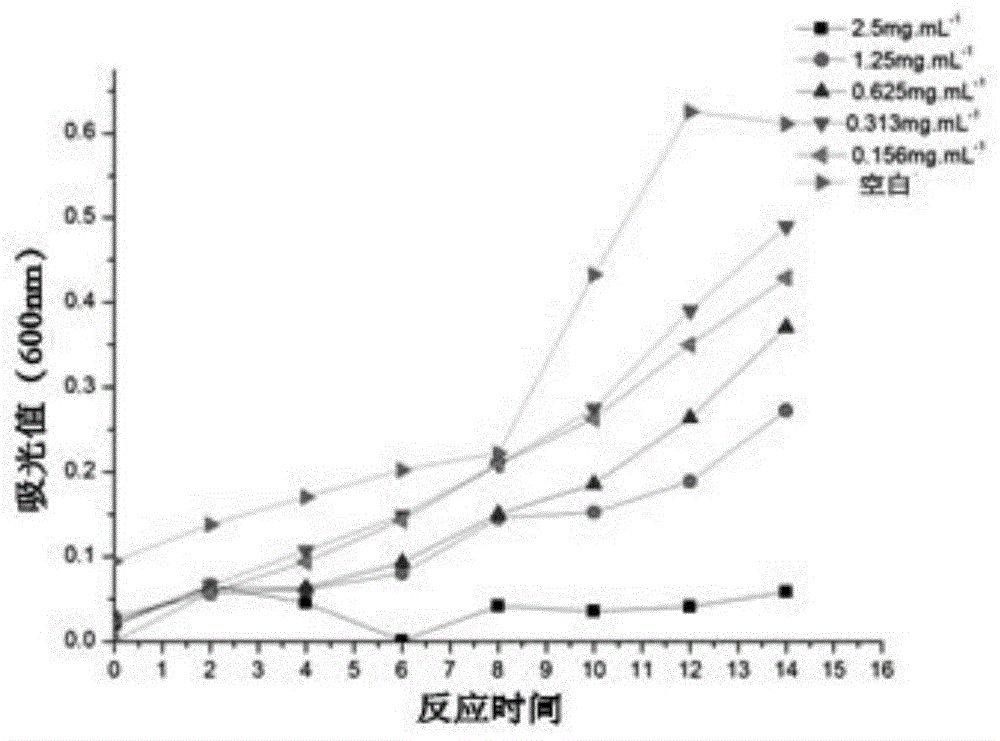
精密称取实施例一制备的胜红蓟总黄酮粉末0.01342g置于2ml已灭菌的lb肉汤培养基中得到浓度为3.125mg·ml-1的胜红蓟总黄酮lb肉汤培养液,吸取400μl于第1孔中,第2孔中加入200μl,依此倍减,在每孔中加入100μl待测菌悬液,将每孔用无菌lb肉汤培养基补齐,使每孔中液体总体积为500μl,这样就得到每种菌的胜红蓟总黄酮测试浓度为2.5mg·ml-1、1.25mg·ml-1、0.625mg·ml-1、0.3125mg·ml-1、0.156mg·ml-1,用微型震荡器震荡后,在600nm处测吸光值a,每隔2h测一次吸光值,将8次所测的吸光值连成线即为细菌生长曲线。检查前事先对台面进行消毒灭菌,并点上酒精灯,在酒精灯焰10cm半径内操作。
最小抑菌浓度(mic)测定
根据细菌生长曲线浓度设计24、48孔板加样方案,使24、48孔板中每种菌的黄酮测试浓度为10mg·ml-1、5mg·ml-1、2.5mg·ml-1、1.25mg·ml-1、0.625mg·ml-1、0.3125mg·ml-1、0.156mg·ml-1,将3种菌的菌悬液100μl接种于各浓度梯度孔中,接种后置37℃震荡培养箱中培养,转速为120rpm·min-1培养24h,观察结果,记录无菌生长的胜红蓟总黄酮的最低浓度。每个处理重复3次。
最小杀菌浓度(mbc)测定
分别吸取0.1ml上面48孔板中的培养物,吸取的时候用枪头轻轻吹打混匀,移种在不含药物的lb营养琼脂培养基上,经孵育过夜,分别计数单菌落,其单菌落数少于5个的药物浓度即为最低杀菌浓度(mbc),设3次重复。
胜红蓟总黄酮处理后的细菌生长曲线如图1a至图1c所示,总黄酮浓度为2.5mg·ml-1,金葡菌和大肠杆菌的生长曲线平缓无上升趋势,由此可确定胜红蓟总黄酮对金黄色葡萄球菌及大肠杆菌的最小杀菌浓度为2.5mg·ml-1。铜绿假单胞菌的最小杀菌浓度无法根据生长曲线来确定。其他浓度处理都能快速生长,所有的处理组的生长曲线都在对照组的曲线之下,可以确定胜红蓟总黄酮在浓度为0.156mg·ml-1时就能抑菌。
实施例三
胜红蓟总黄酮对细菌性阴道炎的抗炎应用
取40只雌性小鼠(清洁级icr雌性小鼠,购自福建医科大学动物实验中心,证书编号scxk(闽)2016-0002)。随机分为空白对照组、阳性对照左氧氟沙星组、阴性对照模型组,胜红蓟总黄酮处理组,赤地利总黄酮处理组,每组小鼠8只。其中,对阳性对照组、阴性对照组、胜红蓟处理组,赤地利总黄酮组进行细菌性阴道炎造模,每天给予小鼠阴道注射由大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌按1:1:1配制成的混合菌悬液,直至小鼠阴道口可见明显红肿和脓状物流出。空白对照组和阴性对照组不给药,阳性对照组根据药品用药指导转换成小鼠用药量,每天阴道局部给药0.5mg·ml-1左氧氟沙星溶液0.2ml,胜红蓟总黄酮和赤地利总黄酮处理组按实施例二所得的最小杀菌浓度给药0.1ml,浓度分别为2.5mg·ml-1和10mg·ml-1。注射菌悬液和给药时都将小鼠灌胃器折弯成一定弧度,采用一次性针筒连接小鼠灌胃器每天给小鼠阴道注射,连续给药7d。
血液采集及炎症因子检测
对小鼠眼眶静脉取血,收集血液于ep管中,取部分血液于事先加入抗凝剂edta钠盐溶液的ep管中做白细胞计数,其余室温静置2h离心,取上层血清,进行elisa检测小鼠血清中的降钙素原(pct)、c反应蛋白(crp)、白介素6(il-6)、白介素10(il-10)。
小鼠阴道病理切片制作及观察
将取完眼眶静脉血的小鼠迅速解剖,取其阴道及宫颈组织,用生理盐水冲洗表面血液后用滤纸轻轻吸去表面后,迅速将其用事先配制好的10%甲醛固定14h,取出后冲洗去除表面杂物,进行病理切片,在显微镜底下观察组织变化。
胜红蓟总黄酮对雌性icr小鼠阴道炎治疗作用
对血液炎症因子的影响
检验小鼠血液中的炎症因子,并将酶标仪中读取的各个血清样本炎症因子(pct、crp、il-6、il-10)吸光值代入拟合的曲线中进行计算和分析,结果如图2a-图2e所示。
白细胞(wbc)计数结果:三个给药组的白细胞计数明显下降,且差异显著(f5,12=473.810,p=0.000);胜红蓟组小鼠白细胞计数最低,为(0.733±0.088)×109个;赤地利组次之为(1.033±0.088)×109个。
降钙素原(pct)检验结果:各处理间差异显著(f5,12=1372.179,p=0.000),模型组pct最高为1038.628±26.111ng/ml,三个给药组都明显降低pct,;抗生素组pct下降幅度最显著,是所有处理组中最低,检验值为(19.862±0.613)ng·ml-1;胜红蓟总黄酮处理组(68.310±0.943ng·ml-1)略高于抗生素组,但比赤地利组(143.262±0.497ng·ml-1)低,且差异显著,说明胜红蓟总黄酮抗感染能力(即抑菌作用)比赤地利好。
c-反应蛋白(crp)检验结果:各处理间差异显著(f5,12=1175.755,p=0.000),模型组crp最高为613.703±15.182ng·ml-1,三个给药组都明显降低crp,;赤地利组crp下降最多,其检验值为65.499±0.376ng·ml-1;胜红蓟组次之检验值为81.008±0.414ng·ml-1,且差异显著;抗生素组下降排在第三,与其他组差异显著。
白介素6(il-6)检验结果:各处理间差异显著(f5,12=9.882,p=0.001),模型组差异显著(f5,12=9.882,p=0.001)最高,检出值为20.667±0.714pg·ml-1。胜红蓟组能够明显抑制il-6表达,其检验值仅为11.282±0.906pg·ml-1;赤地利组、阳性组与模型组差异不显著;空白对照组il-6与胜红蓟组差异不显著,与模型组、赤地利组、阳性组差异显著。
白介素10(il-10)检验结果:模型组和空白组il-10的检出量很高,与抗生素组和赤地利组差异显著(f5,12=8.462,p=0.001);胜红蓟组的il-10比赤地利组、阳性组高,与模型组、空白组差异不显著;赤地利组的检验值最低为21.185±2.887pg/ml。
模型组的所有炎症因子包括白细胞计数都是最高,两种植物总黄酮均具有抗炎作用,而胜红蓟总黄酮抗炎效果比赤地利总黄酮显著。胜红蓟总黄酮能够直接抑制细菌感染引起的急性蛋白表达,还能够通过降低白细胞数量而抑制il-6表达,进而刺激il-10的表达。赤地利总黄酮也能够直接抑制细菌感染引起的急性蛋白表达,虽然能够降低白细胞计数却无法抑制白介素6的表达,也无法刺激白介素10的表达。抗生素仅能直接抑制细菌感染,无法调节il-6和il-10的表达。
胜红蓟总黄酮对雌性icr小鼠阴道组织的影响
给药结束后在采血取样前对各组小鼠进行外阴症状观察如图3所示,模型组阴道口有大量脓状物,且阴道口红肿。空白组、阳性组、胜红蓟组都无脓状物,阴道口也相对正常,赤地利组阴道口稍微有点发红。通过显微镜观察切片可见,模型组的小鼠阴道组织基底层鳞状细胞被破坏,宫颈柱状细胞出现大量细胞核缺失,组织中有大量炎症细胞浸润。空白组的阴道和宫颈的上皮细胞排列规则,组织中无炎症细胞浸润。阳性对照组中,有发现细胞出现细胞核缺失,但是基本上恢复较好,未发现炎症细胞浸润,说明左氧氟沙星对细菌性阴道炎的治疗效果良好。在胜红蓟处理组当中也可见治疗效果较好,组织中没有炎细胞浸润,虽然上表皮部分细胞由于造模导致细胞发生凋亡和坏死,但是基底层鳞状细胞排列规则且较光滑,也未见增生,说明没有慢性炎症的存在。赤地利组也有治疗效果,但是没有完全治愈,上皮细胞也发生凋亡缺核,基底层可见少量增生,组织中还有部分炎细胞浸润,组织外有炎细胞渗出。
实施例四
胜红蓟总黄酮对宫颈癌细胞hela的增殖抑制作用
mtt法检测胜红蓟总黄酮对hela的增殖抑制率
配制mtt溶液,使总黄酮的最终浓度分别为50μg·ml-1、100μg·ml-1、200μg·ml-1、300μg·ml-1、400μg·ml-1、500μg·ml-1,空白对照加入灭菌超纯水。于波长490nm酶标仪上检测od值,参考波长为630nm;计算细胞增值率(%),细胞增值率(%)=od胜红蓟组/od对照组×100%。
胜红蓟总黄酮对hela细胞集落形成能力的影响
取对数生长期的宫颈癌细胞(来源于厦门大学生命科学学院),制成细胞悬液,对细胞悬液反复吹打,使细胞充分分散,调整细胞悬液密度为1×103个/ml细胞,添加低(50μg/ml)、中(200μg/ml)、高(400μg·ml-1)三种不同浓度的胜红蓟总黄酮处理24h后接入琼脂培养基中观察胜红蓟总黄酮对hela细胞集落形成能力的影响。
将上述处理中的细胞悬液1.5ml移入小烧杯中,加入40℃5%琼脂等体积混匀成0.25%半固体琼脂培养基,立即加入铺有底层琼脂的培养皿中,待凝固后,将其置于37℃5%co2培养箱中静置培养2周后,观察hela细胞在平板上形成集落能力的变化。
ao/eb染色法观察胜红蓟总黄酮对hela细胞形态的影响
添加低(50μg·ml-1)、中(200μg·ml-1)、高(400μg·ml-1)三种不同浓度的胜红蓟总黄酮对人癌细胞系hela处理24h后,接种于细胞瓶内,经过效应物处理预定时间后,胰酶消化,连同旧培养液上清一起离心(1000rpm,5min),弃上清,pbs洗涤,再次离心(1000rpm,5min),弃上清,加入少量吖啶橙/溴乙锭染液悬浮细胞,取一滴细胞悬液于载玻片上,滴加少量甘油,加盖玻片,于荧光显微镜下观察细胞核的形态并拍照。
细胞划痕实验观察胜红蓟总黄酮对hela迁移能力的影响
用黑色记号笔在6孔板背后,每隔0.5-1cm均匀划横线,横穿过孔,每孔穿过3条线,并在板上做好处理组记号,将对数生长的细胞接种于6孔板,每个孔内分别加入胜红蓟总黄酮,使其终浓度为50μg·ml-1、200μg·ml-1、400μg·ml-1,对照不加药,培养24h后,用枪头划痕,使划痕与板背后的横线垂直,每孔也是3条线。用pbs洗细胞2次,去除划下的细胞,加入无血清培养基后;放入37℃培养箱中培养。取出于显微镜下观察并拍照。
pi单染流式细胞术检测细胞周期变化
取对数生长期的细胞,经过不同浓度的胜红蓟总黄酮处理24h,胜红蓟总黄酮终浓度为50μg·ml-1、100μg·ml-1、200μg·ml-1、300μg·ml-1、400μg·ml-1,设对照,三次重复。取出后1000rpm离心5min,收集所有细胞,用无菌pbs缓冲液洗涤两次,再次离心5min(1000rpm),去掉上清液,每个离心管的细胞重新用200μl预冷的pbs悬浮,再缓慢注入800μl预冷的无水乙醇,进行细胞固定,在4℃下保存待检。细胞上机检测前低速离心除去乙醇,用pbs洗涤2次,再离心(1000rpm,5min),去除上清液,每个离心管分别加入500μlpbs重新悬浮的细胞,然后加入10μl10mg·ml-1无dnase的rnasea,37℃孵育30min,转入冰浴,加入25μl10mg·ml-1pi,置于冰板上避光染色30min,300目筛绢过滤,于流式细胞仪中进行检测。
annexinv-fitc/pi双染流式细胞术检测细胞凋亡情况
将处于对数生长期的细胞,经过不同浓度的胜红蓟总黄酮处理24h后,1000rpm离心5min,收集所有细胞,用pbs洗涤后用胰酶消化细胞,并收集于ep管中,再离心(1000rpm,5min),pbs洗涤2次后再离心,加入100μl结合液(bindingbuffer)重新悬浮细胞,再在每个离心管中加入10μlannexinv-fitc和10μlpi,于室温避光孵育15min后,加入400μl结合液(bindingbuffer);1h内避光送流式细胞仪检测。
细胞内活性氧ros的测定
(1)将处于对数生长期的细胞,经过不同浓度的药物处理不同时间后,1000rpm离心5min,收集细胞,pbs洗涤,再次离心,弃上清。
(2)加入终浓度为10μmol·l-1的dcfh-da培养液重新悬浮细胞,37℃避光孵育30min后,离心,弃上清,再加入1mlpbs缓冲液漂洗,离心,弃上清;加入缓冲液重新悬浮细胞,300目筛绢过滤,于流式细胞仪中进行检测及数据分析。
结果与分析
胜红蓟总黄酮对hela细胞的增殖抑制率
对癌细胞系hela分别处理24h,运用mtt法测定细胞的增殖抑制率,如图4所示,各处理组与对照组的抑制率差异显著(f7,16=14.438,p=0.000)。结果表明,胜红蓟总黄酮对癌细胞hela的体外增殖有明显的抑制作用,而且具有浓度依赖。ic50刚好处在黄酮添量浓度为300μg/ml-400μg·ml-1,计算结果为334.171μg·ml-1。
胜红蓟总黄酮对hela细胞集落形成能力的影响
处理后细胞在平板上形成集落能力的变化结果表明,如图5所示,hela细胞具有较强的集落形成能力,胜红蓟总黄酮能有效抑制hela细胞的集落形成能力而且与浓度呈正效应。低浓度胜红蓟总黄酮对其集落形成能力影响很小,琼脂板中的细胞集落数与对照组相近,当浓度达到400μg·ml-1时hela细胞的集落数较少。
胜红蓟总黄酮对hela细胞迁移的影响
在普通光学显微镜观察的结果如图6所示,培养24h后,对照组中hela细胞呈梭形,胞体饱满,边缘光滑,轮廓清晰。50μg·ml-1胜红蓟总黄酮处理24h后,少量细胞变成圆形。200μg·ml-1胜红蓟总黄酮处理24h后,部分细胞由梭形变为不规则多边形,少量细胞变成圆形,细胞密度下降。400μg·ml-1胜红蓟总黄酮处理24h后,部分细胞变成圆形,部分细胞飘落,细胞数量急剧下降。说明胜红蓟总黄酮影响hela细胞迁移,且有浓度效应。
胜红蓟总黄酮对hela细胞形态结构的影响
从图7可以观察到,ao/eb染色后,对照组中的细胞呈正常结构,细胞核紧密排列,核染色质均匀分布,发出淡绿色荧光,少数细胞核发出明亮的绿光,个别细胞核发出橘红光。胜红蓟总黄酮处理hela细胞24h后,低浓度(50μg·ml-1)处理组的细胞核数量和形态与对照组无明显差别。中浓度(200μg·ml-1)的胜红蓟总黄酮处理hela细胞24h后,细胞结构发生了变化,细胞核排列疏松,部分细胞发出明亮绿光和橘红光。对细胞进行高浓度(400μg·ml-1)处理后,细胞结构发生改变,细胞核排列更疏松,数量明显减少,细胞核发出明亮橘红光,表明大量细胞发生了核染色质的凝集,细胞膜的破损,细胞发生了凋亡。
胜红蓟总黄酮对hela细胞生长周期变化的影响
通过流式细胞仪pi单染色法检测,得到不同浓度胜红蓟总黄酮处理的宫颈癌hela细胞生长周期。如图8a至图9c所示,低浓度胜红蓟总黄酮对细胞生长周期没有明显影响,差异不显著,随着浓度增大,对细胞生长周期的影响越来越明显,而且差异显著(g1期:f5,12=15.508,p=0.000;s期:f5,12=81.485,p=0.000;g2/m期:f5,12=32.248,p=0.000)。胜红蓟总黄酮会抑制g1期细胞比例增加,当浓度达到200μg·ml-1以上时与对照差异显著。当浓度达到400μg·ml-1时,g1期的细胞比例比对照下降了将近10%,为(41.23±0.460)%。胜红蓟总黄酮会促进s期细胞的生长,随着浓度的增加s期细胞比例增加。低浓度胜红蓟总黄酮s期细胞比例与对照差异不显著。100μg·ml-1以上浓度的与对照差异显著,且总黄酮组间也差异显著。当浓度为400μg·ml-1时,s期细胞比例为(41.23±0.460)%,其增加量为对照组的90.497%。胜红蓟总黄酮会阻滞细胞与g2/m期,而且有浓度正效应。低浓度(50μg·ml-1)胜红蓟总黄酮g2/m期的细胞比例与对照组无差异显著性(p<0.05)。当浓度达到100μg·ml-1以上,g2/m期的细胞比例开始下降,且与对照组差异显著(p<0.05)。当浓度为400μg·ml-1时,g2/m期的细胞比例为(12.867±0.163)%,下降量为对照组的93.052%。
胜红蓟总黄酮对宫颈癌hela细胞周期具有明显的影响,且呈浓度正效应。胜红蓟总黄酮阻滞g1和g2/m期细胞生长,而促进s期细胞生长。阻滞g1期的效果没有g2/m期明显,由此说明,胜红蓟总黄酮通过阻滞g2/m期抑制宫颈癌hela细胞的增殖。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!