一种运用水溶液制备高效抗凝血生物材料的方法及相应材料与流程
本发明涉及一种具有抗凝血性能的生物材料制备方法,属于需与血液相接触的生物材料表面改性技术。
背景技术:
随着医疗技术的进步,生物材料(血液净化滤器、血液净化循环管路、心脑血管支架等)在临床上的应用日益广泛,这些生物材料与血液直接接触时均会激活血小板、凝血系统、补体系统等,导致生物材料表面血栓形成,制约其临床功效的发挥。为解决生物材料表面血栓形成难题,目前临床上应用得较普遍的方案是全身使用抗凝(肝素、低分子肝素、华法林、达比加群等)、抗血小板/抗栓(阿司匹林、氯吡格雷)药物,但是全身使用这些药物会影响患者全身凝血系统,增加患者的出血风险。这一两难问题在高危出血风险的患者(如手术后又需要进行血液净化治疗的患者)身上更加明显,令临床工作变得十分棘手。因此,对与血液相接触的生物材料表面进行局部抗凝/抗栓改性,是材料学与医学这一学术交叉领域种尤其重要和必要的研究热点。对生物材料表面进行局部抗凝/抗栓改性能提高其抗凝血性能及生物相容性,最大程度减少或避免系统性抗凝/抗栓药物的使用,为高危出血患者的侵入性治疗提供技术保障。
目前生物材料表面改性的方法主要包括改进材料表面理化性质和在材料表面吸附或接枝生物功能分子,后者是功能化材料最有效的途径之一。物理吸附操作简便,但其吸附物易于脱落,作用时间短;化学接枝稳固不易脱落,但合成工艺复杂,且合成条件苛刻,效果有限,不利于工业化大生产。
以血液净化滤器改性为例,国内外学者通过表面改性的方法接枝或涂抹肝素至不同材料表面,提高了材料的抗凝性能。国际上有gambro公司研发的evodial抗凝改性滤器,已上市并初步投入临床的使用。该滤器在膜表面接枝肝素,使之在局部发挥抗凝效能,但其临床应用效果并不优于无肝素生理盐水冲洗的方法。肝素需要抗凝血酶ⅲ的存在才能发挥抗凝作用,对部分抗凝血酶ⅲ水平偏低或缺乏的患者,其抗凝效果大打折扣。此外,肝素只能抑制血液中游离的凝血酶,对与血栓结合的凝血酶无效。肝素可与血小板4因子结合,刺激体内免疫系统产生抗体,导致肝素诱导的血小板减少症的发生。
技术实现要素:
本发明解决的技术问题是:生物材料的抗凝/抗栓效果欠佳,应用范围有限;生物材料的局部抗凝改性方法比较复杂,反应条件苛刻。
现有主流生物材料改性方法中,主要是通过将肝素或类肝素分子与其它化学物质在有机溶剂中分多步反应进行的生物材料本体修饰。该方法反应过程复杂,不能保证抗凝药物等活性物质仅表达于生物材料表面,药物浪费严重;且反应过程中往往需要多次使用有机溶剂做溶媒,而有机溶剂完全清除困难,有机溶剂进入人体后不利于患者健康,同时也不利于生物材料的生物相容性提高。
表面改性技术能最大限度地保留生物材料原本具有的优良理化性能,并使抗凝药物集中在生物材料表面(因生物材料与人体血液相接触主要是在生物材料表面),具有一举两得之效。但是,用于人体的植入材料部分采用高分子材料,这些高分子材料多可溶解于有机溶剂,故有机溶剂不利于生物材料的表面改性。
对于植入材料,尤其是易受有机溶剂侵蚀的植入材料,目前尚没有能够比较好地在其表面进行抗凝血修饰的方法。
本申请的发明人在研发中意外发现,当ph值在弱碱性的一个特殊范围内时、通过适当比例的盐酸多巴胺、三羟甲基氨基甲烷的共同作用,能够将一种特殊的抗凝抗栓剂在水溶液中进行植入材料表面的抗凝处理。
这种抗凝抗栓剂就是阿加曲班。申请人发现,阿加曲班通过其非药理活性的氨基与聚多巴胺层发生席夫碱反应或迈克尔加成反应,能够接枝在生物材料(比如血液净化膜)表面,在生物材料表面起到高效抗凝效能,而无抗凝剂入体,不影响体内凝血状况。
之所以现有技术中大多在有机溶剂中进行抗凝药物的枝接主要是因为药物和高分子生物材料在有机溶剂中的溶解性高,有利于合成反应进行。而某些药物(如阿加曲班)在水中的溶解性低,在水溶液中所需要的反应条件往往较在有机溶剂中苛刻,且反应条件较难摸索。但是,申请人发现,存在一些特殊的反应条件和温度,可以实现在水溶液中实现抗凝枝接,并且水溶液中的这种过程可以一次性实现而不需要像肝素枝接那样需要采用多步法进行。水溶液中生物材料表面修饰异常困难,申请人利用肝素、尿激酶等大量材料进行了实验,效果均不理想。
具体而言,本发明提供一种高效抗凝血生物材料的制备方法,其特征在于,包括以下步骤:
(1)制备含有活性分子和抗凝/抗栓药物的水溶液,水溶液ph值为8.0-8.5,所述活性分子浓度为1-2mg/ml,所述抗凝/抗栓药物为阿加曲班,所述阿加曲班浓度为0.2-3mg/ml;该水溶液的ph值通过稀盐酸和三羟甲基氨基甲烷调节,
(2)将需要改性的生物材料表面浸没在上述水溶液中反应,得到表面附着有惰性分子层和抗凝药物的生物材料。
在一种优选实现方式中,所述活性分子为盐酸多巴胺。
在另一种优选实现方式中,当所述阿加曲班浓度小于预定值时,通过延长溶解时间或超声分散方式将阿加曲班直接溶于ph8.5的水溶液中,当所述阿加曲班浓度大于预定值时,先将阿加曲班溶解于少量乙醇溶液中,再加入ph8.5的水溶液。
在另一种优选实现方式中,所述步骤(2)的反应条件为在20-30℃下避光反应2-24h。
在另一种优选实现方式中,所述生物材料为不溶于水的高分子材料或金属或3d打印材料。
在另一种优选实现方式中,所述生物材料为不溶于水的高分子材料,至少包括:聚砜、聚醚砜、聚丙烯腈、聚烯烃、聚乙烯醇。
在另一种优选实现方式中,重复所述步骤(1)和所述步骤(2),以加强生物材料表面的抗凝/抗栓作用。
另一方面,本发明提供一种采用所述方法制备的高效抗凝血生物材料,其特征在于,所述生物材料包括附着在生物表面上的惰性分子层、以及接枝在惰性分子层上的抗凝/抗栓药物;所述惰性分子层、生物材料均不能溶解于特定水溶液。
在另一种优选实现方式中,所述惰性分子层为聚多巴胺层,所述抗凝/抗栓药物为阿加曲班。
申请人发现,如所需阿加曲班浓度较小时(如0.2mg/ml)可以直接用ph8.5的水溶液溶解(通过延长溶解时间或超声分散有利于溶解),如所需阿加曲班浓度较大时(如1mg/ml)需先将阿加曲班溶解于少量乙醇溶液中,再加入ph8.5的水溶液。阿加曲班浓度越大,抗凝/抗栓作用越强。
优选地,在室温(20-30℃)下避光反应2-4h。
优选地,用作基底的生物材料为高分子材料,优选为聚醚砜、聚砜、聚烯烃膜、聚丙烯腈膜、聚乙烯醇膜、再生纤维素膜中的任意一种。
优选地,活性分子包括盐酸多巴胺、壳聚糖、纤维素中的任意一种。
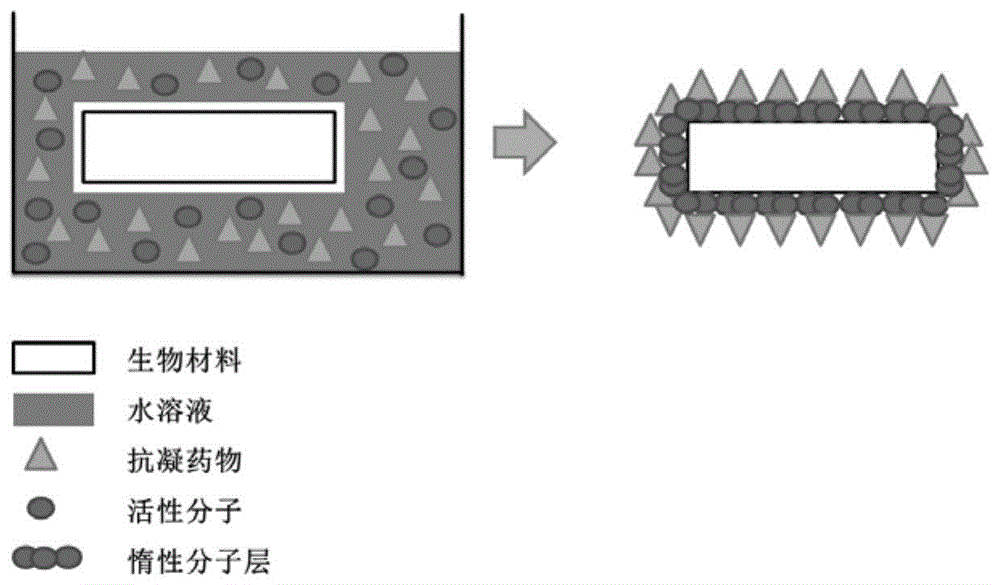
本发明方法首先通过配制包含活性分子(盐酸多巴胺)和抗凝药物(阿加曲班)水溶液,再将待改性的生物材料浸没在上述水溶液中,使水溶液中的活性物质与需要改性部位充分反应,使起固定作用的惰性分子层和起抗凝抗栓作用的药物层在生物材料表面同时生成,使血液净化膜表面局部直接发挥抗凝抗栓作用。通过改善亲水性、抑制凝血酶生成等多重抑制血栓形成的机制实现在体外局部高效抗凝。此为一种原创的生物材料局部抗凝抗栓技术。
技术效果
实验研究证明,本发明提供的方法进行修饰后的血液净化膜,其接枝的药物分子依然具有较好的抗凝效果,而高分子材料的本体性能并未受到明显的影响。
本发明方法运用水溶液制备高效抗凝血生物材料,因为水溶液可塑形强,因此本发明方法可应用于各种形状的生物材料改性,如血液净化滤器中的中空纤维、形状各异的心脑血管支架等。本发明的制备方法使用水相作为反应溶剂,反应在弱碱性条件下进行,反应条件温和,成本低,改性过程中没有使用有毒的有机溶剂,也无有毒副产物产生,经济环保;整个改性过程简单易行,改性后的血液净化膜具有良好的血液相容性、抗凝性能且本体性能并未受到明显影响,在体外循环、抗凝涂层、生物传感器等领域中有着巨大的应用前景。
本发明方法中,整个表面改性过程实验条件简单,可控性强,经济环保。通过生物材料表面的直接凝血酶抑制剂(阿加曲班)减少生物材料局部血栓形成,不影响机体凝血系统,且血液相容性显著提高
本发明方法所制备的抗凝血材料不仅可以抑制游离的凝血酶,还抑制与纤维蛋白血栓结合的凝血酶,且不引起抗体的产生,不会导致血小板减少症,且其空间位阻小,更适合应用于血液净化膜改性。
另外,本发明方法还具有如下优点:接枝的抗凝药物阿加曲班无抗原性,不会发生肝素诱导所致的血小板减少症。接枝的抗凝药物阿加曲班不依赖抗凝血酶iii发挥抗凝活性。
附图说明
图1表示运用水溶液制备高效抗凝血生物材料的方法示意图。
图2表示各组血液净化膜的傅里叶红外光谱。
图3表示各组血液净化膜的扫描电镜平面图和截面图。
图4表示各组血液净化膜的静态水接触角。
图5表示各组血液净化膜的抗凝血功能对比。
图6-7表示本发明的血液净化膜与对比例中的净化膜的抗凝血功能对比。
具体实施方式
下面结合实施例对本发明作进一步说明。
本发明下述实施例是以血液净化膜为例进行说明的。
下述实施例中,分别制备了具有抗凝/抗栓性能的血液净化膜,但本发明技术方案适用于所有需与血液相接触的生物材料表面抗凝/抗栓改性。该血液净化膜包括:高分子材料(聚醚砜)、附着在聚醚砜表面上的惰性分子层(聚多巴胺层)、以及接枝在聚多巴胺层上的阿加曲班。
实施例1
本实施例中的运用水溶液制备高效抗凝血生物材料的方法采用如下的步骤:
①称取0.6g三羟甲基氨基甲烷完全溶解于50ml纯水中,再加入20%hcl盐酸溶液0.6ml,配制成ph=8.5的水溶液,备用。
②称取3g聚醚砜原料,0.5g聚乙二醇,将两者溶解于13.2g二甲基亚砜(dmso)中,常温条件下,磁力搅拌48h,制备成18wt.%均质透明聚醚砜铸膜液,静置48h脱泡,再根据液-液相转换法在4℃纯水中刮取聚醚砜平面膜,再使用纯水浸泡、清洗,干燥备用;
③称取10mg阿加曲班,盐酸多巴胺50mg,将两者溶解于50ml步骤①所配制的ph8.5的水溶液中,阿加曲班浓度为0.2mg/ml,盐酸多巴胺浓度为1mg/ml。
④选取若干表面光滑、厚度均匀的聚醚砜平面膜浸没在步骤③所制备的水溶液中,室温(20-30℃)下避光反应2h、4h、6h、8h、24h,得到表面具有黑褐色惰性聚多巴胺分子层和阿加曲班的抗凝改性聚醚砜膜,用纯水冲洗抗凝改性聚醚砜膜数十次,干燥,氮气下保存备用。
实施例2
本实施例中的运用水溶液制备高效抗凝血生物材料的方法,采用如下的步骤:
①称取0.6g三羟甲基氨基甲烷完全溶解于50ml纯水中,再加入20%hcl盐酸溶液0.6ml,配制成ph=8.5的水溶液,备用。
②称取3g聚醚砜原料,0.5g聚乙二醇,将两者溶解于13.2g二甲基亚砜(dmso)中,常温条件下,磁力搅拌48h,制备成18wt.%均质透明聚醚砜铸膜液,静置48h脱泡,再根据液-液相转换法在4℃纯水中刮取聚醚砜平面膜,再使用纯水浸泡、清洗,干燥备用;
③称取50mg阿加曲班加入10ml乙醇中,使阿加曲班完全溶解,盐酸多巴胺50mg,将阿加曲班乙醇溶液和盐酸多巴胺加入40ml步骤①所配制的ph8.5的水溶液中,阿加曲班浓度为1mg/ml,盐酸多巴胺浓度为1mg/ml。
④选取若干表面光滑、厚度均匀的聚醚砜平面膜浸没在步骤③所制备的水溶液中,室温(20-30℃)下避光反应2h、4h、6h、8h、24h,得到表面具有黑褐色惰性聚多巴胺分子层和阿加曲班的抗凝改性聚醚砜膜,用纯水冲洗抗凝改性聚醚砜膜数十次,干燥,氮气下保存备用。
实施例3
本实施例中的运用水溶液制备高效抗凝血生物材料的方法,采用如下的步骤:
①称取0.6g三羟甲基氨基甲烷完全溶解于50ml纯水中,再加入20%hcl盐酸溶液0.6ml,配制成ph=8.5的水溶液,备用。
②称取3g聚醚砜原料,0.5g聚乙二醇,将两者溶解于13.2g二甲基亚砜(dmso)中,常温条件下,磁力搅拌48h,制备成18wt.%均质透明聚醚砜铸膜液,静置48h脱泡,再根据液-液相转换法在4℃纯水中刮取聚醚砜平面膜,再使用纯水浸泡、清洗,干燥备用;
③称取300mg阿加曲班加入30ml乙醇中,使阿加曲班完全溶解,盐酸多巴胺100mg,将阿加曲班乙醇溶液和盐酸多巴胺加入70ml步骤①所配制的ph8.5的水溶液中,阿加曲班浓度为3mg/ml,盐酸多巴胺浓度为2mg/ml。
④选取若干表面光滑、厚度均匀的聚醚砜平面膜浸没在步骤③所制备的水溶液中,室温(20-30℃)下避光反应2h、4h、6h、8h、24h,得到表面具有黑褐色惰性聚多巴胺分子层和阿加曲班的抗凝改性聚醚砜膜,用纯水冲洗抗凝改性聚醚砜膜数十次,干燥,氮气下保存备用。
以实施例2所制备的改性膜为例,将各种血液净化膜进行以下实验表征。其中,各种膜的代号如下:pes聚醚砜膜;pes-ag抗凝改性聚醚砜膜。
如图2所示(其中,上方曲线为pes,下方曲线为pes-ag):活性盐酸多巴胺分子在碱性水溶液中反应形成聚多巴胺,与未改性的pes相比,在3335.7cm-1处出现宽峰,此为-oh、-nh的伸缩振动峰,说明pes表面存在聚多巴胺层;与未改性的pes相比,在1623.38cm-1处为-c=n-的吸收振动变化,此为阿加曲班与多巴胺分子发生席夫碱反应而形成,说明阿加曲班共价接枝成功。
如图3所示:在平面图(左侧)中,经抗凝改性后pes-ag较pes稍粗糙;在截面图(右侧)中,经抗凝改性(2h)后pes的非对称指状结构和均匀分布的孔状结构未受到明显影响。
如图4所示:经抗凝改性改性后的pes-ag亲水角显著下降,这是因为聚多巴胺层中含有大量的亲水基团-nh2和-oh,使得改性后的pes-ag亲水性明显提高。
由图5所示:pes与空白对照相比,凝血时间变化无统计学差异;经抗凝改性改性后的pes-ag的凝血指标(部分活化凝血酶时间(aptt)、凝血酶原时间(pt)、凝血酶时间(tt))与未改性的pes和空白对照组相比,均明显延长,具有统计学差异,说明阿加曲班已成功接枝于聚醚砜膜上,且接枝后其仍具有药理活性,抗凝效果优异。
注:每组样品重复测量3次,实验数据以x±s表示,采用spss22.0统计软件分析,对各膜样品组进行方差齐性检验,采用单因素方差分析(one-wayanova),组间两两比较采用lsd检验,p<0.05为有统计学意义。
申请人尝试过接枝肝素、尿激酶等药物,抗凝效果远远弱于阿加曲班,说明并不是所有的药物都适合水溶液中进行枝接。
对比例1
①称取0.6g三羟甲基氨基甲烷完全溶解于50ml纯水中,再加入20%hcl盐酸溶液0.6ml,配制成ph=8.5的水溶液,备用。
②称取3g聚醚砜原料,0.5g聚乙二醇,将两者溶解于13.2g二甲基亚砜(dmso)中,常温条件下,磁力搅拌48h,制备成18wt.%均质透明聚醚砜铸膜液,静置48h脱泡,再根据液-液相转换法在4℃纯水中刮取聚醚砜平面膜,再使用纯水浸泡、清洗,干燥备用;
③取肝素1支(12500u/2ml)/尿激酶1支(100000u/支,是白色粉末,先溶解于2ml水中),盐酸多巴胺50mg,将两者溶解于50ml步骤①所配制的ph8.5的水溶液中,肝素浓度为240u/ml(尿激酶浓度1923u/ml),盐酸多巴胺浓度为1mg/ml。
④选取若干表面光滑、厚度均匀的聚醚砜平面膜浸没在步骤③所制备的水溶液中,室温(20-30℃)下避光反应2h、4h、6h、8h、24h,得到表面具有黑褐色惰性聚多巴胺分子层和肝素的抗凝改性聚醚砜膜,用纯水冲洗抗凝改性聚醚砜膜数十次,干燥,氮气下保存备用。
对比结果如图6中所示,从图中可以看出,位于中间的本发明的pes-ag的凝血指标明显优于其他材料。图6中ag表示阿加曲班,hep表示肝素,uro表示尿激酶。这可能是由于肝素和尿激酶在水溶液中的枝接效率明显低于在有机溶剂中,也低于阿加曲班在水中的枝接效果。并且阿加曲班自身的抗凝效果也优于二者。
申请人尝试将生物材料先与药物溶液相接触,再放入盐酸多巴胺水溶液中,这种方法的抗凝效果也没有本发明实施例中效果好。
对比例2
①称取0.6g三羟甲基氨基甲烷完全溶解于50ml纯水中,再加入20%hcl盐酸溶液0.6ml,配制成ph=8.5的水溶液,备用。
②称取10mg阿加曲班,将其溶解于50ml步骤①所配制的ph8.5的水溶液中,阿加曲班浓度为0.2mg/ml。
③称取3g聚醚砜原料,0.5g聚乙二醇,将两者溶解于13.2g二甲基亚砜(dmso)中,常温条件下,磁力搅拌48h,制备成18wt.%均质透明聚醚砜铸膜液,静置48h脱泡,再根据液-液相转换法在4℃纯水中刮取聚醚砜平面膜,再使用纯水浸泡、清洗,干燥备用;
④选取若干表面光滑、厚度均匀的聚醚砜平面膜浸没在步骤③所制备的水溶液中,室温(20-30℃)下避光反应2h、4h、6h、8h、24h,得到表面吸附有阿加曲班的聚醚砜膜,干燥,氮气下保存备用。
⑤称取盐酸多巴胺50mg,将其溶解于50ml步骤①所配制的ph8.5的水溶液中,盐酸多巴胺浓度为1mg/ml。
⑥将步骤④所制备膜浸没在步骤⑤所制备的水溶液中,室温(20-30℃)下避光反应2h、4h、6h、8h、24h,得到含有阿加曲班的黑褐色聚多巴胺聚醚砜膜,干燥,氮气下保存备用。
本对比例方法中,将本发明的一步拆成两步,先泡在阿加曲班药物里面,但是药和膜不能牢固结合,所以再泡到多巴胺里面,把药物封在膜于聚多巴胺层中,参见图7中的pes-ag-ployd。这两步还可以换一下顺序,即先泡多巴胺,再泡到阿加曲班药物中,参见图7中的pes-ployd-ag。
对比结果如图7所示,图中表示polyd聚多巴胺,ag阿加曲班。从图中可以看出两步法所制备的抗凝材料的抗凝效果都不如本发明的一步法。
- 还没有人留言评论。精彩留言会获得点赞!