哺乳动物角膜的脱细胞方法与流程
本发明属于组织工程
技术领域:
,具体涉及一种将哺乳动物角膜经过预处理和脱细胞等步骤制备得到脱细胞角膜的方法。
背景技术:
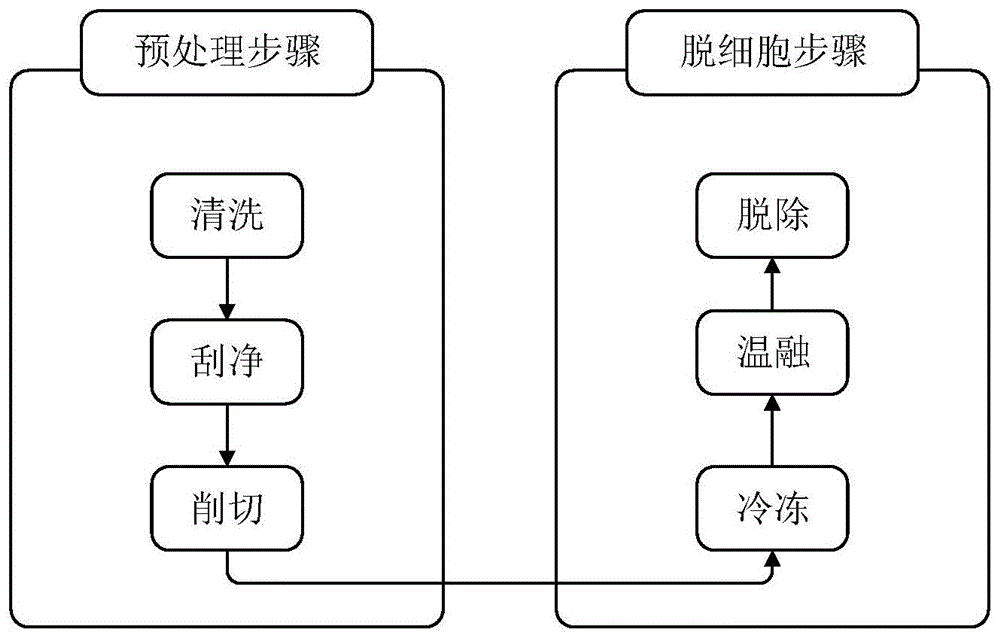
:角膜病是引起角膜盲的第二大原因。其中80%的角膜病患者可通过角膜移植来避免致盲。然而,受我国传统文化的影响,角膜的捐献较少,导致于同种异体角膜供体匮乏,全国每年接受角膜移植的手术仅仅3000余例,而人工角膜的出现给角膜病患者带来了希望。最初的人工角膜停留在无机或有机材料加工而成的角膜替代物。但是这些材料无法模拟天然角膜的微观结构,生物相容性差,使其在临床使用推广中受限。随着组织工程学的兴起,人们将焦点集中在天然的动物角膜材料。利用脱细胞的方法去除异种角膜的外源细胞及抗原物质,从而获得异种无细胞的角膜细胞外基质材料。组织工程角膜材料在临床应用须要满足三个最基本的要求,一是异种角膜细胞被脱除的彻底性,二是角膜的透明度,三是角膜的生理弧度。组织工程角膜材料移植到患者身上时,如果异种细胞脱除不彻底,将产生免疫排斥反应,导致移植效果不佳;角膜材料移植后透明是最终目的,如果脱细胞过程中对微观结构破坏较大,移植后透明度恢复不好,依然影响患者视力,患者的生活并未得到改善;角膜削切手段会影响削切后板层的生理弧度,如果削切平整,弧度会很好的保留,而且切面的平整度将直接影响角膜移植的成功率以及移植后的恢复情况,以上均为临床应用须要考虑的重要因素。目前国内外学者对猪、牛、羊等哺乳动物角膜进行了大量的试验研究,但仍无法满足临床要求。目前常用的脱细胞方法包括化学法、物理法和生物酶法。常规单一的化学法或者物理法脱细胞需要长时间的作用才能达到脱细胞效果,且长时间的作用又会造成角膜胶原蛋白的微观结构破坏。专利文献201510074946.7(
专利名称::一种人工角膜的制备方法)利用板层刀制备板层角膜,钻取指定大小的角膜片,通过冻融、超声联合核酸内切酶降解法进行脱细胞。该方法中利用板层刀获取板层角膜,无法保证切面的平整性,从而影响移植后与植床的贴合性,导致术后透明度的恢复。专利文献201410230365.3(
专利名称::一种板层角膜基质支架及其制备方法)将动物角膜依次进行低渗溶胀、反复冻融、利用dna酶和rna酶的缓冲体系进行酶消化处理。专利文献201610080864.8(
专利名称::利用新鲜牛角膜以制备牛角膜基质的方法及应用方法)将牛角膜浸泡在低渗溶液中,取出角膜上皮细胞得到包含前弹力层和部分基质层的牛角膜基质,反复冻融后再用缓冲液漂洗,放入脱细胞试剂中浸泡脱细胞,再用超纯水对牛角膜基质进行冲洗,最后放入脱水剂中浸泡、灭菌,制得牛角膜基质。以上两件专利技术均使用了低渗溶液,这种溶液致使角膜易溶胀,对角膜基质结构破坏性较大,且未对脱细胞后的角膜进行孵育软化。技术实现要素:针对现有技术的缺点和局限,本发明提供一种采用物理方法和低毒性试剂,制备得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质的方法。该方法是广泛应用于哺乳动物角膜的脱细胞方法,包括预处理步骤和脱细胞步骤,所述预处理步骤包括清洗、刮净和削切;所述脱细胞步骤包括冷冻、温融和脱除。其中:清洗是指将获取的哺乳动物眼球用清洗液进行清洗,所述清洗液为含有抗生素的无菌pbs溶液;所述抗生素为医药领域已知的抗生素。刮净是指刮去角膜上皮层以使前弹力层暴露,以去除上皮层细胞。削切是指对清洗刮净后的角膜进行削切,本领域技术人员可以根据后续处理要求及临床使用需求确定板层角膜的厚度。申请人经过大量试验总结认为,当厚度为200-500μm时,既便于后续处理,又使制成的角膜能够满足临床使用需求。冷冻包括将角膜密封后置于液氮中5-60min;本领域技术人员可以根据角膜的具体数量选择冷冻所需的具体时长,冷冻时间过短可能起不到细胞冰冻结晶的目的,进而导致细胞破碎不彻底,冷冻时间过长可能导致角膜胶原纤维损伤,进而导致角膜基本结构难以恢复,并且生产成本增加。温融包括将冷冻后的角膜置于水浴中以使其解冻;解冻是指使被冷冻的角膜解冻变为类似冷冻前状态的过程。脱除包括先将温融后的角膜放入脱细胞试剂中进行振荡处理,再将角膜置于等渗液中进行超声处理。所述脱细胞试剂可以选用本领域现有技术中常用的脱细胞试剂,比如专利文献cn104001217a中公开的脱细胞试剂。在本发明非限制性的优选实施方式中,所述脱细胞试剂优选包含0.2-1.0%(w/v)中性蛋白酶和0.01-0.20%(w/v)edta或其钠盐;所述等渗液为:具有不会使角膜结构改变的渗透压参数的溶液;其中,中性蛋白酶的作用是破坏细胞结构,加速细胞的裂解,edta的作用是结合金属离子,破坏细胞对ecm的粘附,二者一起使用时,edta能够促进中性蛋白酶的脱细胞效果,并且有利于保持角膜胶原纤维基本结构不被破坏。在本发明非限制性的实施方式中,所述哺乳动物为猪。但本领域技术人员熟知,本发明提供的技术方案是针对角膜细胞进行的处理,与哺乳动物的细胞种类并无关系,只要是哺乳动物角膜细胞即可适用于此方法进行处理,进而制备得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。在本发明非限制性的实施方式中,密封是指将角膜置于密闭容器中加以密封,防止在冷冻过程中染菌污染。在本发明非限制性的实施方式中,所述密封是指将角膜置于密闭容器中加以密封,防止在冷冻过程中染菌污染。在本发明非限制性的优选实施方式中,所述抗生素为常规剂量的磷霉素和/或链霉素,优选剂量为磷霉素30-200万单位/l,链霉素30-200万单位/l。抗生素的作用是抑菌或杀菌,从而控制微生物的生长和繁殖。在本发明非限制性的上述实施方式中,通过冷冻使细胞被冷冻,通过温融使细胞解冻,冷冻和温融促使细胞破碎,进而有利于去除细胞。反复交替重复冷冻和温融,更有利于细胞破碎和去除,但重复次数过多将使角膜基本结构受到破坏。优选交替重复冷冻和温融1-5次。在本发明非限制性的上述实施方式中,所述脱除步骤包括将角膜放入脱细胞试剂中进行振荡处理,再将角膜置于等渗液中进行超声处理,先在脱细胞试剂中振荡,再在等渗液中超声,在温和的环境中脱除细胞,能够使角膜基本结构得以保持。重复脱除步骤更有利于细胞彻底脱除,但重复次数过多将使角膜基本结构受到破坏。优选重复脱除1-8次。在本发明非限制性的上述实施方式中,所述削切使用的工具优选飞秒激光仪。具体使用时可在飞秒激光机的交互界面设定厚度参数,进行激光切割获取板层角膜,厚度为200-500μm符合临床应用要求。飞秒激光切割具有脉冲窄、能量集中,热扩散时间短的特点,因而对角膜周围组织的损伤很小,而且削切边界清楚,削切面光滑,有利于临床使用时角膜基质与创面的贴合。在本发明非限制性的上述实施方式中,温融可将角膜放置常温空气中解冻,优选使用水浴解冻,水浴的温度过高将使角膜变性,温度过低则达不到使角膜细胞有效破碎的目的,所述水浴的优选温度是20-37℃。在本发明非限制性的上述实施方式中,除了水浴的温度,将冷冻后的角膜置于水浴中的持续时长也将影响角膜细胞的破碎,进而影响角膜细胞的脱除,置于水浴中时间过短起不到解冻的效果,置于水浴中时间过长则会使角膜泡发,使角膜基本结构难以复原,优选将冷冻后的角膜置于水浴中的持续时长为10-30min。在本发明非限制性的上述实施方式中,所述振荡处理优选为:在4-45℃的脱细胞试剂中振荡10-120min。本领域的技术人员熟知,角膜与酶的接触时间越短,越有利于其基本结构的保持,申请人经过大量试验总结认为,使角膜浸没在脱细胞液中同时进行振荡处理之后,再在等渗液中进行超声,可以有效缩短角膜与酶的接触时间,并且在达到脱掉细胞目的的同时,能够使角膜胶原纤维基本结构得以保持。在本发明非限制性的上述实施方式中,所述等渗液为具有不会使角膜结构改变的渗透压参数的溶液,所述等渗液优选为生理盐水或/和pbs缓冲液。在本发明非限制性的上述实施方式中,超声频率和持续时长参数与水浴的参数具有类似的道理,超声频率过高或过低、持续时长过短或过长都会影响角膜细胞的脱除效果,所述超声的优选频率为10-100khz,超声持续时长优选为8-15min。在本发明非限制性的上述实施方式中,本发明提供的哺乳动物角膜的脱细胞方法还包括软化步骤,所述软化步骤包括:将脱细胞后的角膜放入软化液中静置,再放入水中振荡处理。所述软化液含有聚乙烯比咯烷酮。在本发明非限制性的上述实施方式中,所述软化步骤在角膜脱细胞之后,含有聚乙烯比咯烷酮的软化液能够保护板层角膜在软化液中不被溶胀,促进角膜胶原结构的恢复,使角膜更加透明,提高临床应用效果。在本发明非限制性的上述实施方式中,在水中振荡处理的主要作用是清洗,洗掉残留的软化液,最大程度的保证临床使用的安全性。所述软化液的温度优选为2-37℃,所述静置的持续时长优选为10-60min;在水中振荡处理的持续时长优选为1-10min。在本发明非限制性的优选实施方式中,振荡处理可以重复1-5次。在本发明非限制性的上述实施方式中,所述软化液含有聚乙烯比咯烷酮,优选还含有透明质酸和l-天冬氨酸。在本发明非限制性的上述实施方式中,所述软化液含有聚乙烯比咯烷酮,优选还含有透明质酸或l-天冬氨酸。在本发明非限制性的优选实施方式中,所述软化液含有0.1-5%聚乙烯比咯烷酮。在本发明非限制性的优选实施方式中,所述软化液的成分优选为:含有0.1-5%聚乙烯比咯烷酮、0.1-3%透明质酸、0.1%-4%l-天冬氨酸,其余为水。与现有技术相比,本发明使用温和的中性蛋白酶和edta作为脱细胞试剂,有利于保持角膜的微观结构。本发明将角膜浸于脱细胞液中振荡处理之后,再在等渗液中进行超声,有效缩短角膜与酶的接触时间,在达到脱掉细胞目的的同时,能够使角膜胶原纤维基本结构得以保持。附图说明附图1本发明提供的哺乳动物角膜的脱细胞方法的操作流程图附图2本发明实施例7制备得到的脱细胞角膜移植给家兔的术后照片附图3本发明对比实施例11用两种方法分别制备得到的脱细胞角膜的实验结果照片附图4本发明对比实施例12用两种方法分别制备得到的脱细胞角膜的实验结果照片具体实施方式下面结合附图对本发明非限制性的实施方式进一步说明。需要说明的是,下述具体实施方式仅为举例说明,不应理解为对本发明技术方案的限定。本发明所述板层角膜是指去除角膜上皮层而获取的包括前弹力层和基质层且能够用于临床移植的角膜,如未特殊标注,本发明具体实施方式所述角膜与板层角膜含义相同;如未特殊标注,本发明具体实施方式的试验环境为满足三类医疗器械洁净度的环境;本发明具体实施方式所使用的水为注射用水;本发明具体实施方式所述脱细胞试剂成分以及软化液成分的百分比%含量单位均为质量体积比。实施例1本实施例示例了哺乳动物猪角膜的脱细胞方法,包括预处理步骤和脱细胞步骤,所述预处理步骤包括清洗、刮净和削切;所述脱细胞步骤包括冷冻、温融和脱除;其中:清洗是指将获取的哺乳动物眼球用清洗液进行清洗,所述清洗液为含有抗生素的无菌pbs溶液,所述抗生素为医药领域已知的抗生素;刮净是指刮去角膜上皮层以使前弹力层暴露,以去除上皮层细胞;削切是指对清洗刮净后的角膜进行削切,以获取厚度为200-500μm的板层角膜。冷冻是指将角膜密封后置于液氮中5-60min;温融是指将冷冻后的角膜置于水浴中以使其解冻;解冻是指使被冷冻的角膜解冻变为类似冷冻前状态的过程;脱除是指先将温融后的角膜放入脱细胞试剂中进行振荡处理,再将角膜置于等渗液中进行超声处理。所述脱细胞试剂包含0.2-1.0%中性蛋白酶和0.01-0.20%edta;所述等渗液为:具有不会使角膜结构改变的渗透压参数的溶液。本实施例未记载的试验条件及参数,本领域的技术人员均可选择本领域通常选用的参数进行实施,进而得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。本实施例使用温和的中性蛋白酶和edta作为脱细胞试剂,有利于保持角膜的微观结构。本实施例将角膜浸于脱细胞液中振荡处理之后,再在等渗液中进行超声,有效缩短角膜与酶的接触时间,在达到脱掉细胞目的的同时,能够使角膜胶原纤维基本结构得以保持。实施例2本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有磷霉素30万单位/l的无菌pbs溶液,经过刮净和削切后获得250μm厚度的板层角膜。将角膜密封后置于液氮中60min;取出后先放入20℃水浴中30min,再放入4℃的含有1.0%中性蛋白酶和0.01%edta的水溶液中振荡120min,随后置于生理盐水中超声处理8min,超声频率为10khz,得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。实施例3本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有链霉素200万单位/l的无菌pbs溶液,经过刮净和削切后获得300μm厚度的板层角膜。将角膜密封后置于液氮中5min;取出后先放入37℃水浴中10min,再放入45℃的含有0.2%中性蛋白酶和0.20%edta的水溶液中振荡10min,随后置于pbs缓冲液中超声处理15min,超声频率为100khz,得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。实施例4本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有磷霉素100万单位/l的无菌pbs溶液,经过刮净和削切后获得400μm厚度的板层角膜。将角膜密封后置于液氮中45min;取出后先放入26℃水浴中19min,再放入25℃的含有0.6%中性蛋白酶和0.10%edta的水溶液中振荡100min,随后置于任意比例的生理盐水和pbs缓冲液中超声处理11min,超声频率为60khz,得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。实施例5本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有磷霉素200万单位/l的无菌pbs溶液,经过刮净和削切后获得200μm厚度的板层角膜。将角膜密封后置于液氮中15min;取出后先放入23℃水浴中15min,交替重复冷冻和温融5次。再放入14℃的含有0.3%中性蛋白酶和0.12%edta的水溶液中振荡110min,随后置于生理盐水中超声处理9min,超声频率为60khz;重复脱除2次;得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。实施例6本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有链霉素80万单位/l的无菌pbs溶液,经过刮净和削切后获得500μm厚度的板层角膜。将角膜密封后置于液氮中50min;取出后先放入30℃水浴中19min,交替重复冷冻和温融2次。再放入25℃的含有0.9%中性蛋白酶和0.02%edta的水溶液中振荡60min,随后置于pbs缓冲液中超声处理15min,超声频率为90khz;重复脱除1次;得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。实施例7本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有磷霉素50万单位/l链霉素20万单位/l的无菌pbs溶液,经过刮净和削切后获得300μm厚度的板层角膜。将角膜密封后置于液氮中10min;取出后先放入27℃水浴中30min,交替重复冷冻和温融1次。再放入24℃的含有0.4%中性蛋白酶和0.1%edta的水溶液中振荡10min,随后置于任意比例的生理盐水和pbs缓冲液中超声处理8min,超声频率为12khz;重复脱除4次;得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。取实施例7制备的脱细胞角膜给家兔进行角膜移植作为试验组。结果试验组术后3天角膜植片透明,上皮愈合面积达到植片一半,术后7天基本完成角膜上皮愈合,术后1个月时,上皮恢复正常,角膜透明度较好,可区分植片与植床部位,术后3个月时角膜完全恢复透明,不易区分植片与植床部位。术后照片见附图2,其中照片a为术后1个月,照片b为术后3个月。动物实验结果显示:试验组角膜植片给家兔移植术后1个月内角膜透明,上皮化良好,术后3个月角膜植片整合良好,角膜透明。实施例8本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有磷霉素50万单位/l的无菌pbs溶液,经过刮净和削切后获得350μm厚度的板层角膜。将角膜密封后置于液氮中5min,取出后先放入20℃水浴中30min。再放入20℃的含有0.4%中性蛋白酶和0.01%edta的水溶液中振荡10min,随后置于任意比例的生理盐水和pbs缓冲液中超声处理15min,超声频率为10khz;重复脱除8次。最后先将脱细胞后的角膜放入含有5%聚乙烯比咯烷酮的2℃的软化液中静置,再放入水中振荡处理5min;重复1次。得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。实施例9本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有链霉素20万单位/l的无菌pbs溶液,经过刮净和削切后获得400μm厚度的板层角膜。将角膜密封后置于液氮中45min,取出后先放入37℃水浴中10min,此处交替重复冷冻和温融1次。再放入24℃的含有1.0%中性蛋白酶和0.2%edta的水溶液中振荡20min,随后置于任意比例的生理盐水和pbs缓冲液中超声处理15min,超声频率为12khz。最后先将脱细胞后的角膜放入含有0.1%聚乙烯比咯烷酮、3%透明质酸、0.1%l-天冬氨酸的37℃的软化液中静置,再放入水中振荡处理1min;重复5次。得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。实施例10本实施例示例了哺乳动物角膜的脱细胞方法,在实施1的基础上,清洗液选用了含有磷霉素50万单位/l链霉素20万单位/l的无菌pbs溶液,经过刮净和削切后获得450μm厚度的板层角膜。将角膜密封后置于液氮中10min,取出后先放入24℃水浴中20min,此处交替重复冷冻和温融5次。再放入24℃的含有0.4%中性蛋白酶和0.3%edta的水溶液中振荡30min,随后置于任意比例的生理盐水和pbs缓冲液中超声处理6min,超声频率为40khz;重复脱除1次。最后先将脱细胞后的角膜放入含有2.5%聚乙烯比咯烷酮、0.1%透明质酸、4%l-天冬氨酸的27℃的软化液中静置,再放入水中振荡处理10min。得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。上述实施例1-10未记载的试验条件及参数,本领域的技术人员可在不付出创造性劳动的情况下选择本领域通常选用的参数进行试验,得到透明性好、结构致密,接近于人体角膜的自然特性的脱细胞角膜基质。下表1显示了实施例1-10制备所得脱细胞角膜的检测结果,其中体外透光率检测的方法采用以下方法:取脱细胞角膜固定于紫外-可见光分光光度计的样品仓中,表面滴加1滴人工泪液,立即在560nm波长检测透光率。本领域技术人员也可根据本领域检测透光率的常规方法检测并计算出透光率。表1在本发明非限制性的上述实施例制备所得脱细胞角膜的检测结果实施例透明度弧度状态显微结构保持度体外透光率/%实施例1与天然角膜相似置于平面可观察到弧度与天然角膜结构相似73.2实施例2与天然角膜相似置于平面可观察到弧度与天然角膜结构相似75.5实施例3与天然角膜相似置于平面可观察到弧度与天然角膜结构相似71.7实施例4与天然角膜相似置于平面可观察到弧度与天然角膜结构相似73.4实施例5与天然角膜相似置于平面可观察到弧度与天然角膜结构相似72.9实施例6与天然角膜相似置于平面可观察到弧度与天然角膜结构相似75.3实施例7与天然角膜相似置于平面可观察到弧度与天然角膜结构相似74.4实施例8与天然角膜相似置于平面可观察到弧度与天然角膜结构相似73.5实施例9与天然角膜相似置于平面可观察到弧度与天然角膜结构相似75.3实施例10与天然角膜相似置于平面可观察到弧度与天然角膜结构相似73.8实施例11本实施例将两种脱细胞方法进行了对比。第一种:在实施1的基础上,清洗液选用了含有磷霉素30万单位/l的无菌pbs溶液,经过刮净和削切后获得350μm厚度的板层角膜。将角膜密封后置于液氮中20min;取出后先在室温环境下放置12h使角膜恢复至室温,交替重复冷冻和解冻4次,再放入生理盐水中进行常温常压下的超声波清洗,超声工作频率200khz,超声时长为35min;随后将角膜置于缓冲液中用55μg/ml限制性核酸酶i酶解角膜基质细胞dna持续200min,得到脱细胞角膜基质。其中,该缓冲液以mem为溶剂,加入0.2%谷氨酸、2%碳酸钠-碳酸氢钠缓冲液、20mol/l钠离子和30mol/l氯离子,ph值为7.0~7.5,渗透压为345mosm/l。第二种:在实施1的基础上,清洗液选用了含有磷霉素60万单位/l的无菌pbs溶液,经过刮净和削切后获得350μm厚度的板层角膜。将角膜密封后置于液氮中10min;取出后先放入23℃水浴中25min,交替重复冷冻和温融2次。再放入37℃的含有0.05%中性蛋白酶和0.02%edta的水溶液中保持48h,随后置于生理盐水中超声处理9min,超声频率为20khz;得到脱细胞角膜基质。本实施例的两种脱细胞方法制备得到的脱细胞角膜基质的对比结果见表2。照片见附图3。表2在本发明非限制性的上述实施例制备所得脱细胞角膜基质的检测结果结果显示,从角膜透明度来看,本实施例第二种方法制备的角膜透明度比第一种方法高。并且第二种方法制备的角膜在30000x显微观察下显示其胶原纤维结构致密,而第一种方法制备的角膜胶原纤维有断裂。实施例12本实施例将两种脱细胞方法进行了对比。第一种:在实施1的基础上,清洗液选用了含有磷霉素60万单位/l的无菌pbs溶液,经过刮净和削切后获得400μm厚度的板层角膜。将角膜密封后置于液氮中10min;取出后先放入23℃水浴中25min,交替重复冷冻和温融2次。再放入37℃的含有0.05%胰蛋白酶和0.02%edta的水溶液中保持48h,随后置于生理盐水中超声处理9min,超声频率为20khz;得到脱细胞角膜基质。第二种:在实施1的基础上,清洗液选用了含有磷霉素60万单位/l的无菌pbs溶液,经过刮净和削切后获得400μm厚度的板层角膜。将角膜密封后置于液氮中10min;取出后先放入23℃水浴中25min,交替重复冷冻和温融2次。再放入23℃的含有0.25%中性蛋白酶和0.05%edta的水溶液中振荡10min,随后置于生理盐水中超声处理9min,超声频率为20khz;得到脱细胞角膜基质。本实施例的两种脱细胞方法制备得到的脱细胞角膜基质的组织学观察结果见表3。显微照片见附图4。表3在本发明非限制性的上述实施例制备所得脱细胞角膜基质的检测结果结果显示,从角膜透明度来看,本实施例第二种方法制备的角膜透明度比第一种方法稍高。并且第二种方法制备的角膜在30000x显微观察下显示其胶原纤维排列规则、结构致密,而第一种方法制备的角膜胶原纤维排列较乱、偶有断裂。以上所述仅为本发明具体实施方式中较佳实施例,并非对本发明保护的技术方案的限定,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术方案范围内,对本发明的技术方案的发明构思进行等同替换或改变,都应涵盖在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于抑制在哺乳动物细胞中和在人中的hiv复制的方法
- 在哺乳动物细胞中将非天然氨基酸遗传掺入蛋白质的制作方法
- 通过电磁刺激哺乳动物活细胞生产的天然糖基化哺乳动物生物分子的制作方法
- 在哺乳动物宿主细胞中高水平表达重组抗体的制作方法
- 调控由哺乳动物细胞培养物产生的蛋白质唾液酸化的方法
- 通过细菌性来源的完整小细胞向哺乳动物细胞递送功能性核酸的制作方法
- 一种用于哺乳动物细胞培养用的凹凸棒土制备方法
- 将治疗性细胞给予哺乳动物中枢神经系统的方法、药物组合物和制品的制作方法
- 适用于治疗哺乳动物异常细胞生长的6-[2-(甲基-氨甲酰基)苯基硫基]-3-e-[2-(吡啶-2 ...的制作方法
- 电穿孔装置及用其进行哺乳动物细胞电穿孔的方法