一种抑制生物被膜形成的方法和组合物与流程
本申请涉及生物技术领域,特别涉及一种抑制生物被膜形成的方法和组合物。
背景技术:
生物被膜(或称“菌膜”)通常是指由胞外聚合物包裹的微生物群体,并且在自然、工业和医疗等领域中普遍存在。生物被膜可以增强微生物的存活性,使它们能够共同适应不断变化的条件。例如,在医学研究中,研究表明约65%的人类细菌感染与生物被膜有关,并且生物被膜中微生物的抗生素抗性比游离状态的微生物高数百甚至数千倍。生物被膜细菌对抗生素和宿主免疫系统具有很强的抵抗力,从而导致严重的临床问题,引起许多慢性和难治性感染疾病。
生物被膜最重要的特征之一是自我分泌的eps(extracellularpolymericsubstances,胞外多聚物),主要由多糖、蛋白质和细胞外dna(edna)组成,其作为基质或凝胶,将生物被膜细胞保持在一起,保护细胞免受抗生素和流体中的剪切力环境。通过形成基质包裹的多细胞聚集体,细胞也可以逃避哺乳动物宿主中巨噬细胞的吞噬。eps不仅促进微生物(例如,细菌)附着于各种表面(例如,生物医学材料或生物体的粘膜表面),还可以捕获抗生素或减少抗生素渗入微生物所形成的细菌群落。因此,在某些情况下,大多数药物只能杀死生物被膜外层的微生物,但是生物被膜内的微生物却能够逃避抗生素的杀伤作用而得以持续生存下去,这也是细菌产生耐药性的一个主要原因。因此,生物被膜是一种潜在的持续感染源,其可能引起与临床生物被膜相关的难治性感染。
细菌的另外一个特征则是能够产生具有毒性的毒力因子,如铜绿假单胞菌能够产生嗜铁素、绿菌素和蛋白酶等多种毒力因子来侵染受感染的寄主细胞。而毒力因子的产生则受到一套精确调控的系统控制。目前已知研究最为广泛的是微生物群体感应系统(quorumsensing,qs)。在铜绿假单胞菌中,存在着至少三种以上的qs系统,分别是lasr/lasi,rhlr/rhli和pqs系统。三个系统分别相互作用并调节不同的毒力因子的表达,最终达到控制细菌毒力的效果。因此,近些年来研究人员针对这三个系统开发了很多化学抑制剂以达到阻止该类病原细菌引起的侵染。然而仍然存在许多问题,如成本高、效果不够理想以及抑制机理不清楚等问题。因此,迫切需要开发用于有效抑制由微生物形成的生物被膜的制剂(例如,组合物)和方法。
技术实现要素:
本申请一方面提供了一种抑制细菌生物被膜形成的方法。所述方法包括使用有效量的香豆素-查尔酮复合物处理细菌,所述香豆素-查尔酮复合物的分子结构如下:
其中,r1选自-h、-ch3、-och3、-cl、-br、-f、-oh、-no2;r2选自-och3、-cl、-br、-no2。
在一些实施例中,所述香豆素-查尔酮复合物通过在转录水平上减少细菌内ps1多糖的产生抑制生物被膜形成。
在一些实施例中,所述香豆素-查尔酮复合物通过降低细胞内c-di-gmp的水平抑制生物被膜形成,所述c-di-gmp能促进游离微生物转换为生物被膜。
在一些实施例中,所述香豆素-查尔酮复合物通过减少群体感应抑制生物被膜形成,其中通过下调细菌的群体感应基因的表达以达到减少群体感应调控的毒力因子,所述群体感应基因包括lasr,rhlr或pqsr中的至少一个。
在一些实施例中,所述有效量的香豆素-查尔酮复合物的浓度约为5mm。
在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少30%的生物被膜的生成。
在一些实施例中,所述有效量的香豆素-查尔酮复合物进一步减少细菌的毒性。
在一些实施例中,所述细菌包括革兰氏阴性细菌。
在一些实施例中,所述革兰氏阴性细菌包括铜绿假单胞菌或大肠杆菌。
在一些实施例中,所述细菌包括革兰氏阳性细菌。
在一些实施例中,所述革兰氏阳性细菌包括金黄色葡萄球菌。
在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少50%的生物被膜的生成。
在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少60%的生物被膜的生成。
在一些实施例中,所述细菌为金黄色葡萄球菌,且在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少30%的金黄色葡萄球菌生物被膜的生成。
在一些实施例中,所述细菌为大肠杆菌,且在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少60%的大肠杆菌生物被膜的生成。
在一些实施例中,所述细菌为铜绿假单胞菌,且在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少70%的铜绿假单胞菌生物被膜的生成。
在一些实施例中,所述香豆素-查尔酮复合物的结构式如下:
本申请的另一方面提供一种用以抑制生物被膜形成的组合物。所述组合物包括有效量的香豆素-查尔酮复合物,其分子结构如下:
其中,r1选自-h、-ch3、-och3、-cl、-br、-f、-oh、-no2;r2选自-och3、-cl、-br、-no2。
在一些实施例中,所述组合物被配置为在转录水平上减少ps1多糖的产生。
在一些实施例中,所述组合物被配置为通过降低细胞内c-di-gmp的水平抑制生物被膜形成,所述c-di-gmp能够促进游离生物转换为生物被膜。
在一些实施例中,所述组合物被配置为通过减少群体感应抑制生物被膜形成,其中通过下调细菌的群体感应基因的表达以达到减少群体感应调控的毒力因子,所述群体感应基因包括lasr,rhlr或pqsr中的至少一个。
在一些实施例中,所述有效量的香豆素-查尔酮复合物的浓度约为5mm。
在一些实施例中,在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少30%的生物被膜的生成。
在一些实施例中,所述组合物进一步被配置为减少所述细菌的毒性。
在一些实施例中,所述细菌包括革兰氏阴性细菌。
在一些实施例中,所述革兰氏阴性细菌包括辋绿假单胞菌或大肠杆菌。
在一些实施例中,所述细菌包括革兰氏阳性细菌。
在一些实施例中,所述革兰氏阳性细菌包括金黄色葡萄球菌。
在一些实施例中,所述细菌为金黄色葡萄球菌,且在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少30%的金黄色葡萄球菌生物被膜的生成。
在一些实施例中,所述细菌为大肠杆菌,且在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少60%的大肠杆菌生物被膜的生成。
在一些实施例中,所述细菌为铜绿假单胞菌,且在其他条件相同时,所述有效量的香豆素-查尔酮复合物抑制至少70%的铜绿假单胞菌生物被膜的生成。
在一些实施例中,所述组合物进一步包括抗生素,所述抗生素包括以下至少一种:阿莫西林、多西环素、四环素、米诺环素、头孢氨苄、头孢呋辛、环丙沙星、莫西沙星、克林霉素、林可霉素、克拉霉素、阿奇霉素、磺胺吡啶、磺胺沙唑、达巴万辛、奥托拉万辛、庆大霉素、妥布霉素、美罗培南、多利培南、甲硝唑、阿奇霉素、左氧氟沙星。
在一些实施例中,所述组合物进一步被配置为增强所述细菌对所述抗生素的敏感性。
在一些实施例中,所述组合物进一步被配置为降低所述抗生素的最小抑菌浓度以及最小生物被清除浓度。
在一些实施例中,其特征在于,所述有效量的香豆素-查尔酮复合物的浓度约为5mm。
在一些实施例中,所述组合物包含的香豆素-查尔酮复合物的结构式如下:
附图说明
本申请将以示例性实施例的方式进一步说明,这些示例性实施例将通过附图进行详细描述。这些实施例并非限制性的,在这些实施例中,相同的编号表示相同的结构,其中:
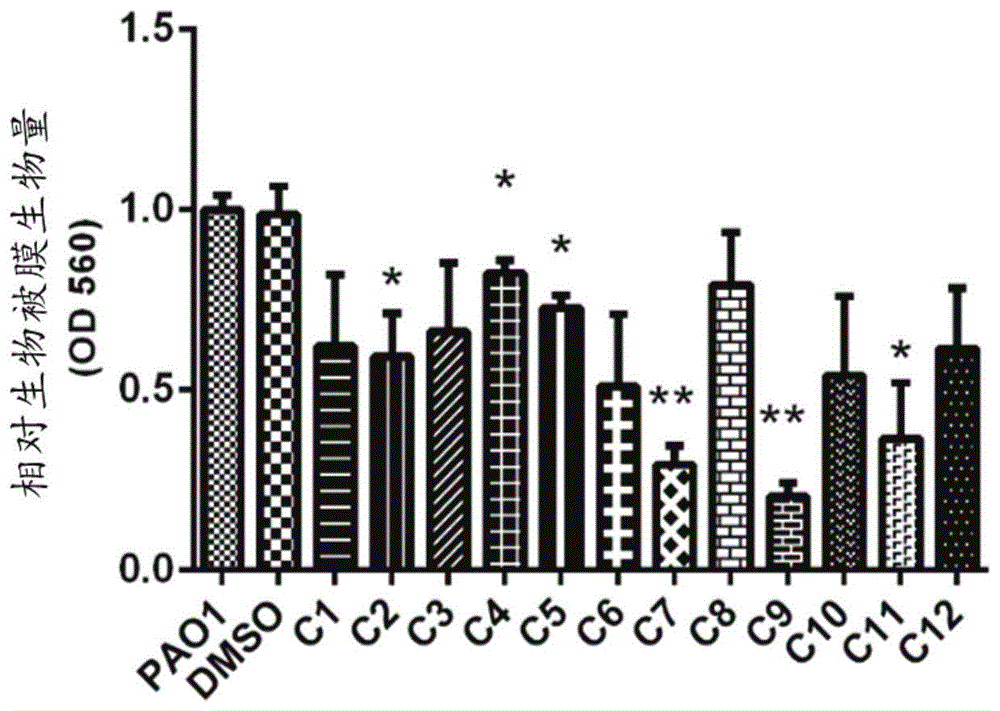
图1是所述香豆素-查尔酮复合物(c1-c12)对于细菌生物被膜的抑制效果的示意图;
图2是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的细菌生长曲线;
图3是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的对于细菌运动性的影响的示意图;
图4是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的psl多糖产生的示意图;
图5是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的psla::lacz的转录活性的示意图;
图6是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的细胞内c-di-gmp水平的示意图;
图7是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的细胞内c-di-gmp水平的另一示意图;
图8a至图8d是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的细胞内qs基因表达的示意图;
图9是所述香豆素-查尔酮复合物c9与qs调节子的结合的示意图;
图10是空白组、对照组和所述香豆素-查尔酮复合物c9处理后的实验组的细菌的毒力的示意图;
图11a至图11c是所述香豆素-查尔酮复合物c9的稳定性的示意图;
图12是所述香豆素-查尔酮复合物c9抑制金黄色葡萄球菌和大肠杆菌形成的细菌生物被膜的示意图;
图13是所述香豆素-查尔酮复合物c9增强抗生素药物的敏感性的示意图;
图14a至图14b是所述香豆素-查尔酮复合物c9降低细菌生物被膜对药物的最小抑菌浓度的示意图。
图15a至图15b是所述香豆素-查尔酮复合物c9降低细菌生物被膜对药物的最小生物被膜浓度的示意图。
具体实施方式
为了更清楚地说明本申请实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本申请的一些示例或实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图将本申请应用于其它类似情景。除非从语言环境中显而易见或另做说明,图中相同标号代表相同结构或操作。
如本申请和权利要求书中所示,除非上下文明确提示例外情形,“一”、“一个”、“一种”和/或“该”等词并非特指单数,也可包括复数。一般说来,术语“包括”与“包含”仅提示包括已明确标识的步骤和元素,而这些步骤和元素不构成一个排它性的罗列,方法或者设备也可能包含其它的步骤或元素。
本申请描述的“cdra蛋白”、“蛋白cdra”、“胞外蛋白cdra”和“cdra”之间可以互换使用,是指由铜绿假单胞菌合成的胞外蛋白或其他类似微生物的同源蛋白。应当理解的是,术语“cdra蛋白”、“蛋白cdra”、“胞外蛋白cdra”和“cdra”还可以包括cdra蛋白的野生型和突变型。cdra蛋白包括全长式、成熟式、cdra蛋白的活性片段和/或cdra蛋白的衍生蛋白。
本申请中的术语“psl多糖”、“胞外多糖psl”等可以互换使用,是指由铜绿假单胞菌或其他类似微生物的多糖合成位点合成的细胞外多糖。本申请中的术语“培养基”、“平板”等可以互换使用,是指可提供给微生物生长繁殖的,由不同营养物质组合配制而成的营养基质。
本发明的一个方面提供了一种抑制生物被膜的方法,所述方法包括使用有效量的香豆素-查尔酮复合物(例如,c1-c12)处理细菌。所述香豆素-查尔酮复合物的结构式如下所示:
其中,r1选自-h、-ch3、-och3、-cl、-br、-f、-oh、-no2;r2选自-och3、-cl、-br、-no2。从上述图示可知,所披露的香豆素-查尔酮复合物,具有高度相似的骨架结构。
生物被膜(biofilm)又叫细菌聚集体,是一种微生物聚集体,聚集体内微生物细胞在物体表面上相互粘结并镶嵌在自身分泌的胞外聚合物(eps)基质中。在一些实施例中,易形成生物被膜的微生物可以是细菌,例如,铜绿假单胞菌(pseudomonasaeruginosa)、施氏假单胞菌(pseudomonasstutzeri)、鲍氏不动杆菌(acinetobacterbaumannii)、金黄色葡萄球菌(staphylococcusaureus)、肺炎链球菌(streptococcuspneumonia)、多粘芽孢杆菌(paenibacilluspolymyxa)、首蓿根瘤菌(sinorhizobiummeliloti)、解淀粉芽孢杆菌(bacillusamyloliquefaciens)等。易于形成生物被膜的物体表面可以包括金属、玻璃、塑料、岩石、纺织品、羊毛、海绵、人/动物器官或组织(例如,肺、耳朵、皮肤等)等或其任意组合。
胞外多糖是重要的胞外聚合物。在一些实施例中,胞外多糖可以有助于维持生物被膜结构,是生物被膜的重要成分。在一些实施例中,胞外多糖可以是线性的长链分子。在一些实施例中,胞外多糖还可以是枝杈状的长链分子。在一些实施例中,胞外多糖可以使菌落之间产生分层并建立运输营养物质和代谢废物的通路。在一些实施例中,胞外多糖还可以为生物被膜提供保护作用,使其免受各种外界压力,例如,干燥、免疫因子、吞噬细胞和变形虫等。在一些实施例中,生物被膜的形成可以与多种胞外多糖相关。例如,铜绿假单胞菌生物被膜的形成与psl、pel和海藻酸盐三种多糖相关。
在一些实施例中,psl多糖是一种重要的胞外多糖。psl多糖是由d-甘露糖、d-葡萄糖和l-鼠李糖形成的四糖重复单位组成的。psl多糖可以由15个共转录的基因(psla~pslo,pa223~pa2245)组成的基因簇所编码的一系列蛋白共同合成,其中,前11个是合成psl多糖所必需的。例如,铜绿假单胞菌pa14由于psla~psld基因的缺失导致其丧失了合成psl多糖的能力。
在一些实施例中,psl多糖对于菌体吸附于介质表面、维持生物被膜结构、提供细胞与细胞、细胞与介质表面的相互作用至关重要,是生物被膜形成必不可少的成分。在一些实施例中,ps1可以形成纤维网状物,其使细菌群落进入并覆盖生物被膜。在一些实施例中,psl多糖可以增强菌细胞之间、菌细胞与介质间的黏附作用。在一些实施例中,psl多糖还可以改变菌落的形态。在一些实施例中,psl多糖具有信号功能,可以通过刺激两个二鸟苷酸siad和sadc来升高菌细胞之间第二信使分子c-di-gmp的水平,形成一个独特的正反馈调节回路,最终提高psl多糖的产量。在一些实施例中,psl多糖还可以赋予菌体抗原性,保护菌细胞免受宿主免疫系统攻击。例如,psl多糖可通过增强菌细胞与上皮细胞的接触直接刺激nf-kb的活性并促进鞭毛介导的促炎信号。再例如,铜绿假单胞菌的psl多糖可以通过限制补体介导的调理作用减弱中性白细胞的吞噬以及氧化应激反应的产生。在一些实施例中,psl多糖还可以在细菌抗生素耐药性的产生中发挥作用。例如,psl多糖可以促进细菌对生物被膜抑制剂山梨醇酯80(polysorbate80)的抗性。又例如,生物被膜中依赖psl多糖形成的微菌落结构使铜绿假单胞菌对抗生素的处理变得不敏感。
在一些实施例中,有效量的香豆素-查尔酮复合物可以减少psl多糖的产生,从而引起生物被膜的分散。在一些实施例中,含有有效量的香豆素-查尔酮复合物的溶液、悬浮液、乳液或其任意组合形式的组合物可用于处理细菌,以抑制、减少、分散或破坏已经形成或即将形成的生物被膜。在一些实施例中,可以使用含有有效量的香豆素-查尔酮复合物的固体形式的组合物,例如,乳膏、粉末、颗粒等。在一些实施例中,有效量的香豆素-查尔酮复合物为香豆素-查尔酮复合物c9,其可减少ps1多糖的产生(参见图4及其相关描述)。
环二鸟苷酸(cyclicdiguanylate,c-di-gmp)是一种在细菌中普遍存在的第二信使分子。在一些实施例中,c-di-gmp可以参与调解细菌的多种生理过程,例如,鞭毛介导的运动、细胞分化、细胞形态、从游离状态到生物被膜状态的转变、生物被膜形成、毒力因子的产生等中的一种或多种。
在一些实施例中,细菌胞内以c-di-gmp主导的基因、蛋白网络被认为是生物被膜形成的关键。c-di-gmp作为第二信使广泛存在于微生物群体中。如,铜绿假单胞菌、月牙柄杆菌、大肠杆菌、木醋杆菌等。细菌胞内c-di-gmp浓度可在10nm到10μm的广大区间内变化。在一些实施例中,有效量的香豆素-查尔酮复合物可以减少c-di-gmp的产生,以达到抑制生物被膜形成的目的。在一些实施例中,有效量的香豆素-查尔酮复合物为香豆素-查尔酮复合物c9,其可以减少c-di-gmp的产生(参见图7及其相关描述)。
群体感应(quorumsensing,qs)是指微生物群体在其生长过程中,由于群体密度的增加,导致其生理和生化特性发生变化,显示出少量菌体或单个菌体所不具备的群体特征行为。群体特征行为可以包括生物发光、抗生素合成、生物被膜形成、次级代谢产物生成和毒力因子产生等。在一些实施例中,微生物的群体感应可以包括多种群体感应系统。例如,铜绿假单胞菌主要包括三个不同级别的群体感应系统,分别是las、rhl和pqs,对应的三种自诱导信号分子分别是:n-3-氧十二烷酰高丝氨酸内酯(3-oxo-c12-hsl)、n-丁酰高丝氨酸内酯(c4-hsl)和喹诺酮分子。信号分子与相应的受体蛋白(例如,转录因子lasr、rhlr和pqsr)结合后可以激活一系列基因,例如,lasi、rhli和pqsa的转录。
在一些实施例中,群体感应过程与生物被膜的形成有着极为密切的联系。例如,敲除lasi的铜绿假单胞菌突变株只能形成均一的薄层生物被膜,且对各种杀菌剂(例如,双氧水和妥布霉素等)的耐受性大大减弱。在一些实施例中,群体感应系统可以帮助细菌分泌胞外聚合物。例如,铜绿假单胞菌的las系统可以控制胞外弹性蛋白酶和水解酶的分泌、rhl系统可以控制生物表面活性剂鼠李糖脂的分泌、pqs系统可以促进绿脓青素和凝集素leca的分泌。在一些实施例中,群体感应系统还可以调控细菌的表面运动能力。在一些实施例中,有效量的香豆素-查尔酮复合物可以下调qs基因的表达水平。在一些实施例中,所述香豆素-查尔酮复合物可以是香豆素-查尔酮复合物c9。
一些实施例中,有效量的香豆素-查尔酮复合物可以用于抑制由铜绿假单胞菌、大肠杆菌、金黄色葡萄球菌等形成的生物被膜。如图12及其相关描述所示,使用有效量的香豆素-查尔酮复合物c9处理后,金黄色葡萄球菌生物被膜减少了30%,大肠杆菌生物被膜减少了60%。
本发明的另一个方面提供了一种抑制生物被膜的组合物,所述组合物可以包括香豆素支架结构和查尔酮支架结构。所述香豆素(2h-1-苯并吡喃-2-酮)结构具有苯和α-吡喃酮环的连接结构,并且实际上含有富含电子且具有高电荷传输性质的π-π共轭体系,通过弱键相互作用使其衍生物容易与生物体内酶和受体的多样性相互作用。在一些实施例中,香豆素衍生物具有显著的生物活性,例如,抗菌、抗病毒、抗结核、抗炎、抗氧化和抗癌等活性中的一种或多种。示例性的香豆素衍生物,如华法林、armillarisina、hymecromone、carbochromen、phenprocoumon和novobiocin等。所述查尔酮(1,3-二芳基-2-丙烯-1-酮)结构的两个芳环通过三碳α,β-不饱和羰基体系连接。在一些实施例中,查尔酮衍生物可以具有显着的生物活性,例如,抗菌、抗病毒、抗真菌、抗疟、抗hiv等活性中的一种或多种。在一些实施例中,查尔酮衍生物对各种癌细胞具有显着的细胞毒活性。在一些实施例中,香豆素支架结构和查尔酮支架结构对其相结合而成的复合物可以在生物活性方面产生协同效应,包括,c1~c12。
在一些实施例中,所述组合物可以减少细菌对psl的产生和c-di-gmp的产生,以抑制生物被膜的产生(参见图4至图6及其相关描述)。在一些实施例中,所述组合物中包含的香豆素-查尔酮复合物为香豆素-查尔酮复合物c9。
在一些实施例中,所述香豆素支架结构可以具有甲基、乙基、醛基、甲氧基、乙氧基、羧基等基团中的一种或多种。在一些实施例中,可以通过修饰香豆素和/或查尔酮的取代基团来改善香豆素-查尔酮复合物抑制生物被膜形成或降解生物被膜的能力。例如,可以增强与lasr的结合能力。
在一些实施例中,所述组合物可以包含香豆素-查尔酮复合物以及合适的载体或助剂。其中,香豆素-查尔酮复合物可以预防或分散生物被膜或细菌聚集体。所述载体可以是溶解香豆素-查尔酮复合物或其他试剂的溶剂或溶液(例如,水、盐溶液等)。所述助剂可以包括缓冲剂、ph调节剂、能增强香豆素-查尔酮复合物分散生物被膜或细菌聚集体能力的试剂等中的一种或多种的组合。
在一些实施例中,所述组合物还可以包含抗生素。如前所述,生物被膜可以为嵌入生物被膜中的细菌提供结构支持和保护,并有助于细菌对抗生素和/或不利环境的抗性。在一些实施例中,组合物中的有效成分香豆素-查尔酮复合物破坏生物被膜后可以暴露细菌,一旦生物被膜被破坏,细菌可能失去生物被膜提供的保护和结构支持,从而使细菌更易受抗生素的影响。在一些实施例中,破坏生物被膜可以提高细菌对抗生素的敏感性。在一些实施例中,抗生素可以包括阿莫西林、多西环素、四环素、米诺环素、头孢氨苄、头孢呋辛、环丙沙星、莫西沙星、克林霉素、林可霉素、克拉霉素、阿奇霉素、磺胺吡啶、磺胺沙唑、达巴万辛、奥托拉万辛、庆大霉素、妥布霉素、美罗培南、多利培南、甲硝唑、阿奇霉素、左氧氟沙星等或其任意组合。在一些实施例中,所述组合物所包含的香豆素-查尔酮复合物可以是香豆素-查尔酮复合物c9。
在一些实施例中,所述组合物可以是液体、固体、或半固体。例如,液体形式的组合物可以是溶液。固体形式的组合物可以是片状物、粉末、微粒、纳米颗粒等。半固体形式的组合物可以是悬浮液、乳状物、膏状物等。
在一些实施例中,分散生物被膜或细菌聚集体的方法还可包括磁力搅拌、机械搅拌、涡旋震荡、超声处理、组织匀浆等中的一种或其任意组合。使用香豆素-查尔酮复合物处理可以与一种或多种上述方法组合使用。
在一些实施例中,当组合物用于抑制、预防或分散生物被膜或细菌聚集体时,香豆素-查尔酮复合物的有效浓度可以是0.1μm-100mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是0.1mm-100mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-100mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-90mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-80mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-70mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-60mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-50mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-40mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-30mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-20mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1-10mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是1mm-9mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是2mm-8mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是3mm-7mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是4mm-6mm。在一些实施例中,香豆素-查尔酮复合物的有效浓度可以是5mm。在一些实施例中,所述组合物所包含的香豆素-查尔酮复合物可以是香豆素-查尔酮复合物c9。
在一些实施例中,所述组合物中包含的有效量的香豆素-查尔酮复合物可以用于减少至少10%、20%、30%、40%、50%、60%、70%、80%或90%由铜绿假单胞菌、大肠杆菌、金黄色葡萄球菌等形成的生物被膜。所述组合物所包含的有效量的香豆素-查尔酮复合物可以是香豆素-查尔酮复合物c9。
在一些实施例中,当组合物用于预防或分散生物被膜或细菌聚集体时,温度可以是5-75℃。在一些实施例中,温度可以是10-70℃。在一些实施例中,温度可以是15-65℃。在一些实施例中,温度可以是20-60℃。在一些实施例中,温度可以是25-55℃。在一些实施例中,温度可以是30-50℃。在一些实施例中,温度可以是35-45℃。在一些实施例中,温度可以是36-44℃。在一些实施例中,温度可以是37-43℃。在一些实施例中,温度可以是38-42℃。在一些实施例中,温度可以是39-41℃。
在一些实施例中,可以使用包含香豆素-查尔酮复合物的组合物接触生物被膜或细菌聚集体。在一些实施例中,可以将包含香豆素-查尔酮复合物的组合物添加到细菌的生长培养基中。例如,当需要监测细菌的生长状态或需要测量细菌的生长曲线时。所述组合物所包含的香豆素-查尔酮复合物可以是香豆素-查尔酮复合物c9。
用于确定细菌数量的示例性方法可以包括间接培养计数法和直接计数法。在一些实施例中,间接培养计数法可以包括平板菌落计数法、最可几率计数法(mpn法,亦称为倍比稀释法)等。在一些实施例中,直接计数法可以包括光学显微镜计数法、荧光显微镜计数法、最可几率数-聚合酶链式反应法、混浊度(比浊)计数法、电阻抗法以及流式细胞仪测定法等。
本领域已知许多不同类型的载体。例如已知质粒和病毒载体如逆转录病毒载体。哺乳动物表达质粒典型具有复制起点、合适的启动子及任选增强子、必需的核糖体结合位点、聚腺苷酸化位点、剪接供体和受体位点、转录终止序列,及5’侧翼非转录序列。示例的载体可以包括:质粒(其也可以是另一类型载体的运载体)、腺病毒、腺伴随病毒(aav)、慢病毒(例如,修饰的hiv-1、siv或fiv)、逆转录病毒(例如,asv、alv或momlv),以及转座子(例如,sleepingbeauty、p-元件、tol-2、frogprince、piggybac)。
本发明提供的一种用于抑制细菌生物被膜形成的方法及组合物,其主要优点可以包括:自身稳定的香豆素-查尔酮复合物可以高效抑制细菌生物被膜的形成,并减少细菌的毒性。同时所述香豆素-查尔酮复合物与抗生素联用能够增强细菌对抗生素的敏感性,并降低抗生素的最小抑菌浓度和最小生物被膜清除浓度。所述香豆素-查尔酮复合物有望成为广谱的抗生物被膜药物。
以下将通过实施例对本发明进行详细描述。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料和化学品试剂,如无特殊说明均为从生化试剂公司购买得到的。以下实施例中的定量实验,均设置为三次重复实验,结果取平均值。
材料与试剂
所有溶剂和化学试剂都是购买后直接使用的,不需进一步纯化。原料3-乙酰香豆素购自merck。
lb(luria-bertani)固体培养基的配制使用了10g胰蛋白胨、5g酵母提取物、10gnacl、20g琼脂糖和1000ml蒸馏水。
lb液体培养基的配制使用了10g胰蛋白胨、5g酵母提取物、10gnacl和1000ml蒸馏水。
jensen液体培养基的配制使用了5gnacl、2.51gk2hpo4、15.56gl-谷氨酸一钠、2.81g缬氨酸、1.32g苯丙氨酸、13.87g葡萄糖、0.165gmgso4·7h2o、0.105mgcacl2·2h2o、5.5μgfeso4·7h2o、12μgznso4·7h2o和1000ml蒸馏水。
z-buffer的配制使用了16.1g/lna2hpo4·7h2o、5.5g/lnah2po4·7h2o、0.75g/lkcl、0.246g/l、mgso4·7h2o、调ph至7.0,121℃灭菌30min。
不同氧分压血清瓶的制备:在血清瓶中注满灭菌水,塞上胶塞时可在胶塞上插一针头,以排除气泡。胶塞上插两个针头,一个接排水管,另一个接进气管,将血清瓶中的水用高纯氮(99.99%n2)置换,继续通气和排气3min,使瓶内气压与大气压平衡。按照空气中氧浓度为20.8%计算,氧终浓度为0.1%时,打入0.29ml空气,在打空气之前按照算出的体积,先从瓶中抽出等体积的氮气,依次类推制备不同氧分压的气体瓶。
tbst溶液的制备使用了20mmtris、137mmnacl、0.1%吐温20,其ph最终被调节为7.6。
lbns固体培养基的制备使用了5g酵母提取物、10g胰蛋白胨、15g琼脂粉以及1000ml蒸馏水。
lbns液体培养基的制备使用了5g酵母提取物、10g胰蛋白胨以及1000ml蒸馏水
swimming培养基的制备使用了细菌用胰蛋白胨10g/l、酵母提取液5g/l、琼脂粉1.5g/l。
twitching培养基的制备使用了细菌用胰蛋白胨10g/l、酵母提取液5g/l、琼脂粉1%。
碱性磷酸酶缓冲液的配制使用了12.14gtris、8gnacl、0.2033gmgcl2·6h2o,其ph最终被调节至9.0。
细菌菌株
铜绿假单胞菌pao1是一种野生型铜绿假单胞菌(见参考文献,geneticrecombinationinpseudomonasaeruginosa.jgenmicrobiol.1955.13:572-581.)。
wfpa800是缺失psla上游启动子的铜绿假单胞菌突变菌株。通过删除psl操纵子的启动子来制备wfpa800(见参考文献,analysisofpseudomonasaeruginosaconditionalpslvariantsrevealsrolesfbrthepslpolysaccharideinadhesionandmaintainingbiofilmstructurepostattachment.jbacteriol,2006.188:8213-8221.)。
wfpa801是psl过表达的铜绿假单胞菌突变菌株(见参考文献,analysisofpseudomonasaeruginosaconditionalpslvariantsrevealsrolesfbrthepslpolysaccharideinadhesionandmaintainingbiofilmstructurepostattachment.jbacteriol,2006.188:8213-8221.)。
psla::lacz是p-半乳糖苷酶基因插入在铜绿假单胞菌的多糖合成位点的突变体。引物序列是seqidno:1(f:5’-ggcctgtttccctacct-3’);seqidno:2(r:5’-gcggatgtcgtggttg-3’)。
pao1/pcdra::gfp(asv)c是将cdra启动子与gfp基因融合的铜绿假单胞菌突变体。制备pcdra::gfp(asv)c的所使用的质粒是pcdra-gfp。
实施例1:香豆素-查尔酮复合物(c1-12)的制备
采用claisen-schmidt缩合反应合成了香豆素-查尔酮复合物(c1-c12)。以复合物c9为例。将等当量的3-乙酰香豆素(0.01mol)和取代的苯甲醛(0.01mol)加入50ml单颈圆底烧瓶中,向反应混合物中加入10ml乙醇并搅拌5min。随后向混合物中加入2~3滴哌啶并回流12~15h。利用薄层色谱(tlc)检查反应进程。在本实施例中,使用己烷∶乙酸乙酯(70∶30)系统作为流动相,在预涂硅胶板(merck,具有荧光指示剂uv254)上监测所有反应的进程,通过紫外线(254nm)照射使斑点可视化。反应完成后,将反应混合物在碎冰中淬灭;过滤固体产物,用水洗涤,用乙醇重结晶。其他香豆素-查尔酮衍生物(包括c1-c8、c10-c12)的合成与上述方法一致。
实施例2:生物被膜测定
取1%接种量的过夜培养的菌液接种到100μljensen液体培养基中,同时,分别加入c1~c12和不加入任何物质,于96孔pvc板(costar)中,30℃静置培养过夜。
采用结晶紫法检测吸附在96孔板上的菌体生物量,步骤如下:(1)用排枪吸走游离及松散吸附的菌体,并在生理盐水轻柔地洗3次。(2)加入120μl0.1%结晶紫溶液对小孔内牢固吸附的细菌细胞进行染色,室温下静置30min。(3)取出pvc板,用排枪吸走结晶紫,并用生理盐水洗净未吸附的结晶紫。(4)用200μl30%乙酸溶液溶解吸附在pvc板上的结晶紫,用分光光度计在560nm下对乙酸液进行od值测量。
本实施例比较了c1~c12对生物被膜的影响。如图1所示,c9、c7和c11分别降低了铜绿假单胞菌pao1生物被膜含量的70%、60%和55%,从图1中可以看出,c9在5mm时,其抑制率可达70%,1mm-5mm时,可以明显抑制铜绿假单胞菌生物被膜的形成。
实施例3:生长曲线分析
将铜绿假单胞菌pao1(光密度od600≈1.5)在lb液体培养基中培养过夜,取1%接种量的菌液接种在新鲜配制的lb液体培养基中。分别向两份等量的菌液中,加入和不加入5mm香豆素-查尔酮复合物c9,在200rpm的振荡培养箱中37℃下培养24小时。每小时取菌液样品,用分光光度计在600nm下对菌液进行od值测量,以追踪细菌生长。
本实施例比较了向菌液中加入和不加入香豆素-查尔酮复合物c9对od600读数的影响。结果如图2所示,加入香豆素-查尔酮复合物c9的菌液组的od600读数与对照组读数无明显差异。本实施例说明香豆素-查尔酮复合物c9对铜绿假单胞菌pao1的生长没有显著性影响。
实施例4:细菌运动性分析
将pao1菌种接种到lbns琼脂平板上,在37℃下培养过夜。取单菌落接种到含有和不含香豆素-查尔酮复合物c9的swimming平板表面,在37℃下培养24h。之后测量swimming平板上细菌游动所形成的半透明区域的直径。
将pao1菌种接种到lbns琼脂平板上,在37℃下培养过夜。取单菌落穿刺接种到含有和不含香豆素-查尔酮复合物c9的twitching平板底部,在37℃下培养24h。细菌在琼脂与塑料板交界面的生长即为twitching运动。在培养基内添加1%的ttc,细菌运动范围就会变为红色,之后测量twitching平板上红色区域的直径。
本实施例分析了细菌运动性能。如图3所示,香豆素-查尔酮复合物c9对铜绿假单胞菌的生长以及鞭毛介导的游动能力和菌毛介导的蹭行运动没有任何影响,结合图2,这表明香豆素-查尔酮复合物c9对生物被膜的抑制不是由于任何影响关于生长或鞭毛或菌毛的功能。
实施例5:psl免疫印迹分析
在37℃条件下,分别将铜绿假单胞菌pao1接种在含有香豆素-查尔酮c9(5mm)和含有dmso(5mm)的jensen培养基中37℃下振荡培养24小时。测定过夜培养的菌液的od600值,收集10个od的菌液。10光学密度[5mlod600为2的培养物]。在13000r/min下将菌液离心5min,弃去上清液。将沉淀物分散在100μl0.5m的edta中,并在100℃下煮沸5min后离心,弃去沉淀物。向上清液中加入蛋白酶k(终浓度,0.5mg/ml),60℃温浴1h后,在80℃下处理30min,使蛋白酶k失活,得到多糖提取液。将3ul多糖提取液点在硝酸纤维素膜上,晾干。用tbst润洗3次后,在室温下用10%脱脂乳封闭1h。加入anti-psl抗体(即,第一抗体)(1∶25,000)在25℃下处理1h。再次用tbst润洗3次后,加入山羊抗兔igg(即,第二抗体)(1∶10,000)。用碱性磷酸酶缓冲液润洗后,加入5mlwesternblue(promegatm)进行显色。使用imagelabtm5.1软件对免疫印迹数据进行定量分析。
本实施例分析了香豆素-查尔酮复合物c9对铜绿假单胞菌产生psl的影响。如图4所示,香豆素-查尔酮复合物c9减少了60%的psl产生。
实施例6:β-半乳糖苷酶的活性分析
将1%接种量的铜绿假单胞菌(psla::lacz菌株变体)的过夜培养菌液接种在含有和不含香豆素-查尔酮复合物c1~c12的jensen培养基中,在37℃下培养至菌液的od600=0.5。将5ml菌液重新分散在200mlz-buffer中,并冷冻/解冻3次,以裂解细菌。将细菌裂解液置于离心管中,离心收集菌体。用无氮的lb培养基润洗菌体2次,并将其稀释至od600=0.2~0.4。将1ml稀释好的菌液接入含不同氧分压的10ml血清瓶中,然后置于30℃水浴摇床100rpm诱导4h,开始测定β-半乳糖苷酶活性。
β-半乳糖苷酶活性测定方法参见文献sambrookj,fritschef,maniatist.molecularcloning:alaborarymanual.second.,newyork:coldspringharborlaboratorypress,1989。
β-半乳糖苷酶活性的单位数即:
millerunits=1000×(0d420-1.7×od550)/(t×v×od600)(1)
其中,t为时间(单位:min);v为体积(单位:ml)。
实施例7:psla::lacz转录融合上影响psl的产生
将psla基因的atg起始密码子前的500bp左右dna片段克隆到mini-ctxlacz载体的多克隆位点上(注意选择的启动子片段不能影响移码突变)。将重组质粒(以pth2为例)转化至大肠杆菌s17-1λpir中。之后将活化好的pao1接种到5mllbns培养基中,s17-1/pth2菌株接种到5mllb+四环素(tet)(12.5μg/l)培养基中,于37℃摇培200rpm过夜。将过夜培养的菌液离心重悬到无抗培养基中,使pao1与s17/pth2菌液od600比值约为1∶2,以提高接合效率。在lbns无抗平板上点7μlpao1菌液,无菌工作台中风干。接着在pao1的斑点上点7μls17/pth2,风干。之后37℃过夜培养。将过夜培养的菌泥涂布在lbns+tet(100μg/l)+irg(25μg/l)的平板上,37℃培养至长出单菌落。用attb2/ctx1引物(attb2,gtcgccgccggcgatgc,ctx1,cctcgttcccagtttgttcc)验证,若pcr产物大小为950bp则正确,即质粒整合在铜绿假单胞菌染色体attb/p位点。过夜培养所得单菌落,同时过夜培养sm10/pflp2。两株菌重复接合操作,将过夜培养的菌泥涂布在lbns+羧苄青霉素(carb)(300μg/l)+irg(25μg/l)的平板上,37℃培养至长出单菌落。挑取单菌落,在10%蔗糖平板上划线,放入30℃恒温箱培养至长出单菌落。挑取10%蔗糖平板上的单菌落分别点在lbns无抗平板和lbns+carb(300μg/l)平板上。选择在无抗平板上生长但在carb平板上不长的菌落进行下一步pcr验证。使用attb4/attb5(attb4,cgccctatagtgagtcg,attb5,cgccccaacctcgctgg)作为引物,以待验证菌株基因组为模板进行pcr验证,pcr产物大小为450bp则构建正确。至此,psla启动子融合lacz的表达菌株构建成功。
psla::lacz转录融合的结果进一步表明香豆素-查尔酮复合物c9在转录水平上影响psl的产生,如图5所示。
实施例8:细胞内的c-di-gmp的分析
细胞内的c-di-gmp控制着细菌在游离生物和生物被膜之间的生活方式转换。为了分析香豆素-查尔酮复合物c9对细胞内c-di-gmp浓度的影响,使用了直接和间接方法来测量铜绿假单胞菌中的c-di-gmp水平。
由于胞外蛋白cdra的转录表达量与体内信号分子环二鸟苷酸(c-di-gmp)的浓度有关,所以利用pao1/pcdra::g印(asv),间接分析c-di-gmp。
如图6所示,本实施例表明香豆素-查尔酮复合物c9显着降低了pao1/pcdra::gfp(asv)的荧光强度。
从用或不用香豆素-查尔酮复合物c9生长的pao1菌株中直接提取c-di-gmp,通过lc-ms/ms直接测量细胞内的c-di-gmp。如图7所示,香豆素-查尔酮复合物c9处理显示c-di-gmp浓度降低2倍,这与cdra::g印(asv)报告基因的结果一致。
本实施例表明,香豆素-查尔酮复合物c9可以降低铜绿假单胞菌pao1细胞内c-di-gmp的水平。
实施例9:基因表达水平分析-香豆素-查尔酮复合物c9下调qs基因的表达水平
qs系统调节生物被膜形成和许多毒力因子的表达。为了进一步研究了香豆素-查尔酮复合物c9是否对qs调节系统产生了影响。本实施例利用绿色荧光蛋白(gfp)作为报告基因,检查香豆素-查尔酮复合物c9对qs系统的影响。本实验中,我们利用铜绿假单胞细菌中的三个qs系统中的转录调节因子基因(分别为lasr,rhlr和pqsr)进行qs系统基因表达的研究。我们通过pcr扩将3个基因的启动子区域与无启动子的gfp融合表达载体pprobe-at进行转录融合,构建成含有指示lasr,rhlr和pqsr基因表达水平的转录融合质粒,并以此来作为3个qs系统表达的代表。
将过夜培养的菌液接种在新鲜配制的lb液体培养基中,使其od600=0.25,再培养2h。在96孔板中进行测定。分别在4h、8h、12h、16h、20、24h测量荧光。通过测量od600的同时监测细菌生长。通过将荧光值除以每个样品的od600值来归一化基因表达水平。
通过gfp融合检查香豆素-查尔酮复合物c9对三种已知qs调节子lasr、rhlr和pqsr的转录的影响。结果如图8a至图8d显示,香豆素-查尔酮复合物c9分别下调了lasr、rhlr和pqsr的转录。
分子对接分析用于理解香豆素-查尔酮复合物c9如何干扰qs调节。配体对接结果表明香豆素-查尔酮复合物c9可以强烈地结合lasr和pqsr,并且香豆素-查尔酮复合物c9显示出与pqsa的弱结合(图9)。对接的活性化合物方案如表(1)所示。
表(1):对接结果:香豆素-查尔酮复合物c9与lasr、pqsr和pqsa的结合能(kcal/mol)和相互作用的氢键残基
实施例10:减少铜绿假单胞菌的毒力
将接种有化合物香豆素-查尔酮复合物c9(5mm)的pao1培养物注入大白菜模型中,在37℃下培养36h,并观察菌落表型和计算菌落形成单位(colony-formingunits,cfu)。
本实施例利用大白菜模型进行了体内实验,研究香豆素-查尔酮复合物c9是否影响铜绿假单胞菌的毒力。如图10所示,结果表明化合物香豆素-查尔酮复合物c9减少了大白菜中60%的铜绿假单胞菌毒力。该结果与香豆素-查尔酮复合物c9对qs调节的影响一致。
实施例11:香豆素-查尔酮复合物c9的稳定性及其作为抗生物被膜药物的潜力
化合物的物理化学性质(例如,生物被膜渗透性和亲脂性)显着受其pka值的影响。由于人体ph值可变范围既包括酸性也包括碱性,因此化合物在不同的ph范围内是否稳定非常重要。
使用uv-vis光谱分析来研究在ph值为3.4-8.4的条件下香豆素-查尔酮复合物c9的稳定性。发现化合物香豆素-查尔酮复合物c9的初始ph为6.9,并且通过缓慢滴定用hcl(25mm),该ph逐渐降至约ph=2。在达到ph=2后,通过缓慢加入koh(25mm)滴定化合物直至ph达到12。以这种方式,绘制ph与加入的koh体积的关系图,以找出当量点,从而得到pka。
本实施例研究了香豆素-查尔酮复合物c9的稳定性。如图11a至图11c所示,发现活性香豆素-查尔酮复合物c9的pka值为5.66,这表明该化合物具有穿过脂质膜屏障被吸收的能力,并且还可以进入靶细胞起作用。在ph范围3.4至8.4的紫外吸收光谱法进一步支持香豆素-查尔酮复合物c9的稳定性。首先,继续向香豆素-查尔酮复合物c9(初始ph=6.9)中加入hcl(25mm)直至ph达到3.4(图11b),导致330nm处吸收带的强度增加。随后通过用koh(25mm)滴定将ph3.4逐渐降至ph8.4(图11c)。反应的可逆性表明在用hcl滴定期间发生质子化。同样清楚的是,吸光带在整个实验中保持其位置,没有检测到额外的条带,以及原始吸收带保持完整,这阐明了香豆素-查尔酮复合物c9在不同的ph条件下是稳定的。香豆素-查尔酮复合物c9的稳定性表明其作为抗qs和抗生物被膜药物的巨大潜力。
实施例12:香豆素-查尔酮复合物c9对其他细菌生物被膜的影响
采用上述96孔板结晶紫法生物被膜检测法,如图12所示,香豆素-查尔酮复合物c9显示对革兰氏阳性病原体(例如,金黄色葡萄球菌)或革兰氏阴性细菌(例如,大肠杆菌)的生物被膜具有抑制作用。相对于金黄色葡萄球菌生物被膜(减少30%),其对大肠杆菌生物被膜具有更好的活性(约60%减少)。
实施例13:香豆素-查尔酮复合物c9与抗生素联用的效果
在该实验中,香豆素-查尔酮复合物(5mm)c9添加至培养基中,相应抗生素的抑菌圈通过常规滤纸片法测量。如图13所示,经过香豆素-查尔酮复合物c9处理的铜绿假单胞菌(右图)对氟诺喹酮类抗生素(cip)的敏感性明显大于对照组(左图),表明香豆素-查尔酮复合物c9能够通过某种未知途径或者机制增强细菌对抗生素的敏感性,具有减少抗生素耐药性的潜力。
实施例14:香豆素-查尔酮复合物c9处理后可降低铜绿假单胞菌最小抑菌浓度(mic)和最小生物被膜清除浓度(mbec)
参照mbectm高通量实验操作手册的方法(innovotech)测量卡尔加里生物被膜装置(cgm,cbd)小柱上形成的生物被膜经香豆素-查尔酮复合物c9处理后的mic和mbec值。mic值由经香豆素-查尔酮复合物(5mm)c9处理后的生物被膜在添加抗生素的培养基中培养24小时后96孔版中的游离细胞测得,mbec通过将经香豆素-查尔酮复合物c9(5mm)处理后的生物被膜在添加抗生素的培养基中处理24小时后的生物被膜超声破碎后继续在37度培养24小时后测得。
如图14a至图14b,以及图15a至图15b所示,香豆素-查尔酮复合物c9处理后的生物被膜对环丙沙星和妥布霉素的mbec和mic,同对照组相比均显著降低。
上文已对基本概念做了描述,显然,对于本领域技术人员来说,上述详细披露仅仅作为示例,而并不构成对本申请的限定。虽然此处并没有明确说明,本领域技术人员可能会对本申请进行各种修改、改进和修正。该类修改、改进和修正在本申请中被建议,所以该类修改、改进、修正仍属于本申请示范实施例的精神和范围。
一些实施例中使用了描述成分、属性数量的数字,应当理解的是,此类用于实施例描述的数字,在一些示例中使用了修饰词“大约”、“近似”或“大体上”来修饰。除非另外说明,“大约”、“近似”或“大体上”表明所述数字允许有±20%的变化。相应地,在一些实施例中,说明书和权利要求中使用的数值参数均为近似值,该近似值根据个别实施例所需特点可以发生改变。在一些实施例中,数值参数应考虑规定的有效数位并采用一般位数保留的方法。尽管本申请一些实施例中用于确认其范围广度的数值域和参数为近似值,在具体实施例中,此类数值的设定在可行范围内尽可能精确。
针对本申请引用的每个专利、专利申请、专利申请公开物和其他材料,如文章、书籍、说明书、出版物、文档等,特此将其全部内容并入本申请作为参考。与本申请内容不一致或产生冲突的申请历史文件除外,对本申请权利要求最广范围有限制的文件(当前或之后附加于本申请中的)也除外。需要说明的是,如果本申请附属材料中的描述、定义、和/或术语的使用与本申请所述内容有不一致或冲突的地方,以本申请的描述、定义和/或术语的使用为准。
最后,应当理解的是,本申请中所述实施例仅用以说明本申请实施例的原则。其他的变形也可能属于本申请的范围。因此,作为示例而非限制,本申请实施例的替代配置可视为与本申请的教导一致。相应地,本申请的实施例不仅限于本申请明确介绍和描述的实施例。
- 还没有人留言评论。精彩留言会获得点赞!