用于治疗肛门直肠疾病的局部氨氯地平盐的制作方法
用于治疗肛门直肠疾病的局部氨氯地平盐
[0001]
本公开内容涉及含有氨氯地平(amlodipine)盐的局部药物凝胶组合物。含有氨氯地平盐的局部药物凝胶组合物适用于治疗肛门直肠疾病,例如痔疮、肛裂(急性和慢性)、肛门直肠手术后的疼痛症状、肛周脓肿、脱垂的血栓痔(prolapsed thrombosed piles)、肛周血肿、侵袭括约肌的癌症(肛门直肠癌)、肛门疱疹、肛门疣、肛门瘙痒、痉挛性肛部痛、便秘、肛门出血和克罗恩氏病或其他与炎性肠病有关的肛门直肠病症。
[0002]
肛门直肠疾病是指肛门和/或直肠的疾病。最常见的症状包括痔疮、肛门疣、肛裂、肛门直肠脓肿和肛瘘。
[0003]
当直肠和肛门的组织肿胀和发炎时,就会形成痔疮。痔疮可位于肛门内部(内痔)或肛门周围区域(外痔)。症状包括疼痛、发炎和瘙痒。
[0004]
对于轻度痔疮病例的治疗可以包括坐浴、冷敷布、止痛药和非处方局部药物。对于慢性痔疮,有几种选择,如痔带、注射剂和红外线凝结法(infrared coagulation)。对于最严重的病例,保留外科手术选择,如痔切除术和吻合术(stapling)。
[0005]
湿疣或肛门疣由人乳头瘤病毒(hpv)引起,并形成于肛门周围的皮肤上。乳头瘤病毒有很多类型。有些类型会在手和脚上产生疣,而另一些会引起生殖器疣和肛门疣。许多人说肛门疣没有引起任何并发症。其他人则说肛门部位有瘙痒、出血或潮湿。
[0006]
肛门疣的治疗包括烧灼术、软膏剂或特殊类型的酸(鬼臼酸(podophyllin acid)或二氯乙酸)。治愈肛门疣需要几种治疗方法。即使疣已被“去除”,病毒仍会残留在皮肤组织中。几个月后必须随访。
[0007]
肛裂是肛门组织(lining)的小撕裂。这些撕裂可由硬、干的大便,腹泻和发炎引起。症状包括瘙痒、疼痛和出血。
[0008]
当肛裂通过4-8周的保守疗法而治愈时,它是急性的。如果这种疗法失效,肛裂就会变成慢性的(s.schlichtemeier,a.engel,aust prescr,2016,39,第14页)。
[0009]
肛裂的总发病率为1.1/1000人年,转化为平均终生风险为7.8。大约40%的患者会发展成慢性肛裂。
[0010]
尚不完全清楚和了解肛裂的病理生理学。广泛接受的科学解释(m.h.madalinski,world j gastrointest pharmacol ther,2011,2(2),第9页;m.m.van meegdenburg,m.trzpis,e heineman,p.m.a.broens,medical hypotheses,2016,94,第25页;m.van outryve,acta chirurgica belgica,2006,106(5),第517页)是,急性损伤导致肛门内括约肌的局部疼痛和痉挛。这种痉挛和由此产生的高静息肛门括约肌压力导致血流量减少和缺血以及愈合不良。除非这个循环被打破,否则肛裂将持续或变成慢性肛裂。
[0011]
临床医生一致认为,肛门括约肌中持续升高的静息压力在肛裂的发病机理中起着至关重要的作用。schouten等人(w.r.schouten,j.w.briel,j.j.auwerda,dis colon rectum,1994,37,第664页)表明,分别由多普勒激光血流仪和肛门直肠测压法测得的肛膜血流速率与肛门静息压力成反比。压力增加导致血流量降低。患有肛裂的患者静息压力高且灌注率低。这种低灌注可归因于左右直肠下动脉背侧末端分支之间小动脉吻合的缺乏。当静息括约肌压力充分地高于小细动脉中的压力时,在该区域产生肛裂。因此,慢性肛裂可
被视为缺血性溃疡。此外,maria等人(g.maria,d.brisinda,m.p.ruggieru,等人surgery,1999,126,第535页)在肛裂患者而非对照中证实了抗内皮抗体。这些抗体激活内皮,产生血管收缩和促凝血活性。该机制还诱导肛膜的缺血和肛裂的形成。作为缺血性溃疡的肛裂的终末期是纤维化病变,伴有伴随性肥大乳头和岗哨皮赘(sentinel skin tag)。纤维化是治愈的重要障碍,并可导致弛缓性溃疡。肛裂的慢性炎症还可引起局部脓肿和瘘管形成。
[0012]
大多数急性肛裂借助于外用局部麻醉药和大便软化剂消退。另外,一部分继续变为慢性。无论它们的成因是什么,已知它们与静息张力增加有关。因此,针对肛裂的治疗的目标在于降低静息肛门压力,这又导致流向后连合的血流量增加和肛裂的愈合。
[0013]
降低肛门括约肌中张力的传统治疗方法是肛门扩张术,其中在深度全身麻醉下将4根手指逐渐插入肛门中并轻轻分开,从而以放射状破坏内括约肌的纤维。这种方法对大小便控制的风险很明显,据估计暂时性失禁的风险为30%,永久性大便失禁的风险最高达10%。因此,它已失去了大多数外科医生的青睐。优选的方法是外侧内括约肌切开术,其可以通过开放式或封闭式技术进行。
[0014]
尽管外侧括约肌切开术已经成为用于治疗肛裂的黄金标准,但是这些并发症促使人们寻求其他降低肛门压力的方法。研究已经集中于寻找用药理学方法降低肛门压力,同时使肛门内括约肌环完整无缺的方法。
[0015]
已尝试使用多种新型药剂进行化学括约肌切开术,所述药剂包括局部gtn、钙通道阻滞剂如硝苯地平(nifedipine)或地尔硫卓(diltiazem)和肉毒杆菌毒素。发现其中一些药剂可有效治愈慢性肛裂,且副作用可忽略不计,现在被认为是用于慢性肛裂的一线治疗方法。
[0016]
仅批准三硝酸甘油酯(gtn)软膏剂用于治疗与慢性肛裂相关的中度至重度疼痛。在进行并提交给世界各地监管机构的三项三期研究中,用rectogesic 4mg/g直肠软膏剂(rectal ointment)治疗的患者的肛裂的愈合与安慰剂无统计学差异(公众评估报告,uk/h/0823/001/mr)。施用gtn引起的严重头痛导致30%的患者停止使用gtn。已经测试了各种浓度的gtn,但0.2%的剂量(每天2-3次)提供与较高浓度相同的治愈率,但头痛的发病率较低。使头痛降到最低和/或消除头痛的最佳方法是以卧位在肛门区域上施用gtn。由于脑血管的血管扩张而引起在头部立即感到上涌或发热,其很快消退。然后,患者可以起床并恢复正常活动。由于gtn的作用方式是通过皮肤吸收(如用于治疗心绞痛的经皮硝化膏(nitropaste)),因此在肛管中施用gtn是不必要的,并且会引起过度的疼痛。在匆忙中和以坐姿或站姿施用gtn增加头痛的发病率(6%与56%),并且可能导致治疗的提前终止(a.m.abcarian,h.abcarian,internal medicine review,2018,4(1),第1页)。
[0017]
ccb已经在冠心病中使用了许多年,因为钙通道的阻断在小动脉壁中产生了平滑肌松弛。多项研究表明,局部ccb与gtn一样有效,且副作用较少(k.n.zaghiyan和p.fleshner,clin colon rectal surg,2011,24,第22页)。尽管在慢性肛裂的治疗中使用了ccb,含有ccb的认可产品仍可在市场上买到。在其他情况下,只有含有ccb的复方乳膏或软膏剂可用于治疗。复方药物具有几个缺点,如从事复方的药房数量有限、医师必须为复方ccb写“处方”(超说明书用药(off-label use)),以及复方药物的浓度在药房、药方之间和每个管内变化很大并且缺乏报销(reimbursement)。
[0018]
ccb降低了进入心脏和血管壁的细胞的钙的量。钙通过离子通道进入这些细胞。这
些通道被ccb阻断,从而降低了进入心脏和血管壁的细胞的钙的量。结果,血管松弛,并且心肌接收更多的含氧血液,这就是ccb能够降低血压和治疗心绞痛的方式。一些ccb还阻滞钙进入心脏中的传导细胞,并具有减慢心率的附加作用。
[0019]
ccb有两种不同的化学类别:二氢吡啶类(如硝苯地平和氨氯地平)和非二氢吡啶类(地尔硫卓和维拉帕米(verapamil))。这两类均有助于松弛和扩大动脉,但非二氢吡啶类对心脏的传导系统有额外的作用,并且可有助于控制某些快速的心律(如心房颤动)。这是因为非二氢吡啶类也阻滞钙进入心脏中的传导细胞,这具有减慢心率的作用。
[0020]
用局部施用的氨氯地平盐靶向肛门内括约肌依赖于药物物质的有效经皮通量。
[0021]
存在重要且非常长期的需求来确定可局部施用以治疗肛门直肠疾病的药剂,并且这些药剂对风险比例(risk ration)具有有利的益处。最佳地,此类药剂应主要在局部起作用,并且全身吸收不应导致血浓度足够高而引起显著的全身作用或毒性。
技术实现要素:
[0022]
提供了一种用于局部治疗肛门直肠疾病的组合物,其含有治疗量的钙通道阻滞剂,如氨氯地平盐。
[0023]
还提供了一种用于局部治疗肛门直肠疾病的组合物,其通过以下方法制备,该方法包括将钙通道阻滞剂如氨氯地平盐溶解或悬浮在用于局部施用的合适制剂中。还提供一种包含氨氯地平盐和载体的局部药物凝胶组合物。
[0024]
还提供了一种用于局部治疗肛门直肠疾病的方法和组合物,其限制了显著的全身作用并减少了由当前批准的疗法引起的不良事件的发生。
[0025]
还提供了一种用于治疗肛门直肠疾病的局部药物凝胶组合物,所述肛门直肠疾病为例如痔疮、肛裂(急性和慢性)、肛门直肠手术后的疼痛症状、肛周脓肿、脱垂的血栓痔、肛周血肿、侵袭括约肌的癌症(肛门直肠癌)、肛门疱疹、肛门疣、肛门瘙痒、痉挛性肛部痛、便秘、肛门出血和克罗恩氏病或其他与炎性肠病有关的肛门直肠病症。
[0026]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0027]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0028]
约5-75%w/w的至少一种二元醇溶剂;
[0029]
约0.1-10%w/w的至少一种胶凝剂;
[0030]
约0.001-5%w/w的至少一种防腐剂;
[0031]
约5-75%w/w的甘油;
[0032]
约1-20%w/w的乙醇;和
[0033]
约10-40%w/w的水。
[0034]
还提供了一种苯磺酸氨氯地平的局部药物凝胶组合物,其包含:
[0035]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0036]
约5-75%w/w的至少一种二元醇溶剂;
[0037]
约0.1-10%w/w的羟乙基纤维素;
[0038]
约5-75%w/w的甘油;
[0039]
约1-20%w/w的乙醇;和
[0040]
约10-40%w/w的水。
[0041]
还提供了一种苯磺酸氨氯地平的局部药物凝胶组合物,其包含:
[0042]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0043]
约5-75%w/w的丙二醇;
[0044]
约0.1-10%w/w的至少一种胶凝剂;
[0045]
约5-75%w/w的甘油;
[0046]
约1-20%w/w的乙醇;和
[0047]
约10-40%w/w的水。
[0048]
还提供了一种苯磺酸氨氯地平的局部药物凝胶组合物,其包含:
[0049]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0050]
约5-75%w/w的丙二醇;
[0051]
约0.1-10%w/w的羟乙基纤维素;
[0052]
约0.01-5%w/w的对羟基苯甲酸甲酯;
[0053]
约5-75%w/w的甘油;
[0054]
约1-20%w/w的乙醇;和
[0055]
约10-40%w/w的水。
[0056]
还提供了一种用于治疗肛门直肠疾病的方法,其包括将本文所述的局部药物凝胶组合物局部施用于需要其的患者的皮肤表面。
[0057]
参考以下详细描述,本发明的这些和其他方面将变得显而易见。为此,本说明书中提及的所有出版物、专利和专利申请均通过引用的方式纳入本文中,其程度如同每个单独的出版物、专利或专利申请被明确地和单独地指出通过引用的方式纳入。
附图说明
[0058]
本发明的新的特征在所附权利要求中具体阐述。通过参考以下详细描述,将更好地理解本发明的特征和优点,所述详细描述阐述了其中利用本发明的原理的示例性实施方案以及附图(本文中也称为“图(figure)”和“图(fig.)”),其中:
[0059]
图1显示了口服施用(口服)或以0.2%局部药物凝胶局部施用(局部)后第28天,雌性哥廷根小型猪(minipigs)中氨氯地平的平均
±
sd血浆水平曲线。
具体实施方案
[0060]
尽管已经在本文中示出和描述了本发明的优选实施方案,但是对于本领域技术人员而言显而易见的是,这样的实施方案仅作为示例提供。在不脱离本发明的情况下,本领域技术人员现在将想到许多变化、改变和替换。应当理解,本文描述的本发明的实施方案的各种替代方案可以用于实施本发明。目的是,以下权利要求限定本发明的范围,并且由此涵盖这些权利要求范围内的方法和结构及其等同物。
[0061]
在以下描述中,阐述了某些具体细节以便提供对各种实施方案的透彻理解。然而,本领域技术人员将理解,可以在没有这些细节的情况下实施本发明。在其他实例中,未示出或详细描述公知的结构,以避免不必要地混淆实施方案的描述。除非上下文另外要求,否则在以下整个说明书和权利要求书中,词语“包含(comprise)”及其变体(如“包含(comprises)”和“包含(comprising)”)应以开放、包括的含义来解释,即“包括,但不限于”。
此外,本文提供的标题仅是为了方便,并不解释所要求保护的发明的范围或含义。
[0062]
在整个说明书中,对“一个实施方案”或“实施方案”或“一些实施方案”或“某个实施方案”的引用意指结合该实施方案描述的具体特征、结构或特性包括在至少一个实施方案中。因此,在整个说明书各处出现的短语“在一个实施方案中”或“在实施方案中”或“在一些实施方案中”或“在某个实施方案中”不一定全部是指同一个实施方案。此外,在一个或多个实施方案中,具体特征、结构或特性可以任何合适的方式结合。
[0063]
氨氯地平是一种二氢吡啶钙拮抗剂,其抑制钙离子跨膜流入血管平滑肌和心肌。实验数据表明氨氯地平与二氢吡啶结合位点和非二氢吡啶结合位点均结合。心肌和血管平滑肌的收缩过程取决于细胞外钙离子通过特定离子通道进入这些细胞的运动。氨氯地平选择性抑制钙离子跨细胞膜的流入,对血管平滑肌细胞的作用大于对心肌细胞的作用。可以在体外检测到负性肌力作用,但是在治疗剂量下在正常动物中未观察到这种作用。氨氯地平不会影响血清钙浓度。在生理ph范围内,氨氯地平是一种离子化的化合物(pka=8.6),其与钙通道受体的动力学相互作用的特征在于与受体结合位点的缔合和解离速率逐渐增加,从而逐渐产生作用。
[0064]
氨氯地平是一种外周动脉血管扩张剂,其直接作用于血管平滑肌以引起外周血管阻力降低和血压降低。
[0065]
对高血压患者施用治疗剂量后,氨氯地平产生血管扩张作用,从而降低仰卧和站立时的血压。这些血压降低并不会伴随慢性剂量导致心率或血浆儿茶酚胺水平发生显著变化。尽管在慢性稳定型心绞痛患者的血流动力学研究中,氨氯地平的急性静脉内施用降低了动脉血压并增加了心率,但在临床试验中长期口服施用氨氯地平并没有导致血压正常的心绞痛患者的心率或血压发生临床上显著的变化。
[0066]
在长期每天一次口服施用的情况下,维持至少24小时的降压有效性。血浆浓度与在年轻和老年患者中的作用有关。氨氯地平使血压降低的幅度还与治疗前升高的高度有关;因此,患有中度高血压(舒张压为105-114mmhg)的个体的反应比患有轻度高血压(舒张压为90-104mmhg)的患者高约50%。血压正常的受试者在血压方面没有临床上显著的变化(+1/-2mmhg)。
[0067]
氨氯地平不会改变正常动物或人的窦房结功能或房室传导。在慢性稳定型心绞痛患者中,10mg的静脉施用不会显著改变起搏后a-h和h-v传导以及窦房结恢复时间。在接受氨氯地平及其伴随的β-受体阻滞剂的患者中获得了相似的结果。在将氨氯地平与β-受体阻滞剂结合施用于患有高血压或心绞痛的患者的临床研究中,未观察到对心电图参数的不利影响。在仅针对心绞痛患者的临床试验中,氨氯地平疗法不会改变心电图间隔或产生更高程度的av阻滞。
[0068]
口服施用治疗剂量的氨氯地平后,吸收在6至12小时之间产生峰值血浆浓度。绝对生物利用度估计在64至90%之间。食物的存在不会改变氨氯地平的生物利用度。
[0069]
氨氯地平通过肝代谢被大量(约90%)转化为非活性代谢物,其中10%的母体化合物和60%的代谢物从尿液中排出。体外研究已表明,高血压患者中约有93%的循环药物与血浆蛋白结合。从血浆中消除是双相的(biphasic),其中终末消除半衰期约为30-50小时。连续每日施用7至8天后,达到了氨氯地平的稳态血浆水平。
[0070]
氨氯地平的药代动力学受肾脏损害的影响并不显著。因此,肾衰竭患者可以接受
通常的初始剂量。
[0071]
老年患者和肝功能不全患者的氨氯地平清除率降低,导致auc增加约40-60%,并且可能需要较低的初始剂量。在中度至重度心力衰竭患者中观察到类似的auc增加。
[0072]
氨氯地平适用于治疗高血压以降低血压,对症治疗慢性稳定型心绞痛、确诊或疑似的血管痉挛性心绞痛,并降低住院治疗心绞痛的风险以及降低冠状动脉血运重建手术的风险。
[0073]
氨氯地平通常的初始降压口服剂量为5mg,每天一次,最大剂量为10mg,每天一次。慢性稳定型或血管痉挛性心绞痛的推荐剂量为5-10mg,在老年人和肝功能不全患者中建议更低的剂量。大多数患者将需要10mg以获得足够的效力。年龄在6-17岁的儿科患者中,有效的降压口服剂量为2.5mg至5mg,每天一次。尚未在儿科患者中研究每天超过5mg的剂量。
[0074]
如本文所用,“氨氯地平盐”是指氨氯地平的酸加成盐。酸加成盐可以通过本领域公知的方法制备,并且可以由有机酸和无机酸形成。合适的酸包括1-羟基-2-萘甲酸、2,2-二氯乙酸、2-羟基乙磺酸、2-氧代戊二酸、4-乙酰氨基苯甲酸、4-氨基水杨酸、乙酸、己二酸、抗坏血酸(l)、天冬氨酸(l)、苯磺酸、苯甲酸、樟脑酸(+)、樟脑-10-磺酸(+)、癸酸(capric acid)(癸酸(decanoic acid))、己酸(caproic acid)(己酸(hexanoic acid))、辛酸(caprylic acid)(辛酸(octanoic acid))、碳酸、肉桂酸、柠檬酸、环己烷氨基磺酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸(gentisic acid)、葡庚糖酸(d)、葡糖酸(d)、葡萄糖醛酸(d)、谷氨酸、戊二酸、甘油磷酸、乙醇酸、马尿酸、氢溴酸、盐酸、异丁酸、乳酸(dl)、乳糖酸、月桂酸、马来酸、苹果酸(-l)、丙二酸、扁桃酸(dl)、甲磺酸、萘-1,5-二磺酸、萘-2-磺酸、烟酸、硝酸、油酸、草酸、棕榈酸、双羟萘酸(pamoic acid)、磷酸、丙酸(proprionic acid)、焦谷氨酸(-l)、水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、酒石酸(+l)、硫氰酸、甲苯磺酸(p)以及十一碳烯酸。
[0075]
同样,如在本说明书和所附权利要求书中所使用的,单数形式“一个/一种(a)”、“一个/一种(an)”和“该”包括复数个对象,除非内容另外明确规定。
[0076]
如本文所用,“苯磺酸氨氯地平”可称为3-乙基-5-甲基(
±
)-2-[(2-氨基乙氧基)甲基]-4-(2-氯苯基)-1,4-二氢-6-甲基-3,5-吡啶二甲酸酯,单苯磺酸盐。其经验式为c
20
h
25
cln2o5·
c6h6o3s,其结构式为:
[0077][0078]
苯磺酸氨氯地平是一种白色结晶粉末,分子量为567.1。其微溶于水,难溶于乙醇。将苯磺酸氨氯地平片配制成用于口服施用的相当于2.5、5和10mg氨氯地平的白色片剂。除活性成分苯磺酸氨氯地平外,每片均含有以下非活性成分:微晶纤维素、无水磷酸氢钙、羟乙酸淀粉钠和硬脂酸镁。苯磺酸氨氯地平在水溶液中不稳定。为了开发口服可用的液体制剂,进行了各种尝试(m.friciu等人cjhp,2016,69(4),第327页;i.
等人,contemporary materials,2014,v-2(2014),第214页;z.stoiljkovic等人,chem.ind.chem.eng.q.,2014,20(2)第295页;c.milap等人,nahata,j am pharm assoc.,1999,39,第375页;a.abdoh等人,pharm.dev.tecnol.,2004,9(1),第15页),然而至今尚未开发出稳定的液基制剂。
[0079]
已进行了开发钙通道拮抗剂的透皮系统的工作(zeng,等人,drug development and industrial pharmacy,2010,36(6),第724页;y.jiang,等人,pharmazie,2008,63,第356页;patel,等人,asian journal of pharmaceutical and clinical research,2010,3(1),第31页)。mcdaid等人(international journal of pharmaceutics,1996,133,第71页)研究了苯磺酸氨氯地平的局部吸收,并证实尽管使用了渗透促进剂,并通过乙醇在各种速率控制膜上增加了热力学梯度,但该化合物过于亲水,而无法使用方便的装置区域进行足够的透皮递送。研究了一系列亲水性碱和疏水性碱的氨氯地平通过无毛小鼠皮肤的渗透,并检验了在3%羧甲基纤维素钠凝胶基质中渗透促进剂、1%月桂基硫酸钠和20%丙二醇的影响。使用兔子进行了体内研究,以评估储库型装置的适用性。利用从涉及人腹部皮肤的体外研究中获得的数据,可以预测在1周的时间段内将类似装置施用到人皮肤上而产生的血浆分布,并发现不足以用于临床。在动物模型中未观察到因施用透皮装置而引起的不良局部作用。氨氯地平的治疗性血浆水平在3-10ng/ml的范围内。每小时平均吸收率为1.24μg/cm2,将导致使用20cm2的暴露区域每天递送0.59mg氨氯地平的剂量。此剂量低于~3.2mg的所需水平。佩戴该装置3天后,目视检查兔子的两个施用部位是否有局部刺激的迹象。在两个施用部位均未观察到局部刺激,这证实即使在佩戴几天后,该装置在皮肤施用时也具有良好的耐受性。这些结果并不出人意料,因为众所周知ca
2+
拮抗剂在急性和慢性炎症模型中以剂量依赖性方式抑制活性。
[0080]
本发明基于以下发现:可以通过包含钙通道阻滞剂如氨氯地平盐的局部制剂来治疗肛门直肠疾病。另外,该治疗可针对施用部位和靠近的周围区域,而没有明显的类似全身作用。
[0081]
提供了一种包含氨氯地平盐和载体的局部药物凝胶组合物。
[0082]
一方面,局部药物凝胶组合物包含氨氯地平盐和载体,其中氨氯地平盐以选自约1%w/w、约0.5%w/w、约0.2%w/w、约0.1%w/w、约0.05%w/w和0.01%w/w的浓度(以游离碱计)存在。
[0083]
在一个实施方案中,载体包含至少一种二元醇溶剂、至少一种胶凝剂和至少一种稀释剂。
[0084]
在一个实施方案中,载体还包含一种或多种选自防腐剂和抗氧化剂的组分。
[0085]
在一个实施方案中,载体包含一种或多种选自羟乙基纤维素、对羟基苯甲酸甲酯、乙醇、水、丙二醇和甘油的组分。
[0086]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0087]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0088]
约5-75%w/w的至少一种二元醇溶剂;
[0089]
约0.1-10%w/w的至少一种胶凝剂;和
[0090]
约0.001-5%w/w的至少一种防腐剂。
[0091]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0092]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0093]
约5-75%w/w的至少一种二元醇溶剂;
[0094]
约0.1-10%w/w的至少一种胶凝剂;
[0095]
约0.001-5%w/w的至少一种防腐剂;和
[0096]
至少一种稀释剂。
[0097]
在一个实施方案中,氨氯地平盐选自苯磺酸氨氯地平、马来酸氨氯地平、甲磺酸氨氯地平(amlodipine mesylate)、己二酸氨氯地平、樟脑磺酸氨氯地平(amlodipine camsylate)和烟酸氨氯地平(amlodipine nicotinate)。在一个实施方案中,氨氯地平盐选自苯磺酸氨氯地平、马来酸氨氯地平和甲磺酸氨氯地平。在一个实施方案中,氨氯地平盐为苯磺酸氨氯地平。
[0098]
在一个实施方案中,氨氯地平盐以选自约0.01%w/w至约1%w/w的浓度(以游离碱计)存在。在一个实施方案中,氨氯地平盐以选自约1%w/w、约0.5%w/w、约0.2%w/w、约0.1%w/w、约0.05%w/w和0.01%w/w的浓度(以游离碱计)存在。
[0099]
在一个实施方案中,至少一种二元醇溶剂选自丙二醇、聚乙二醇、乙二醇、丁二醇、己二醇,及其混合物。
[0100]
在一个实施方案中,二元醇溶剂为聚乙二醇。
[0101]
在一个实施方案中,至少一种二元醇溶剂以约5-75%w/w的量存在。在一个实施方案中,至少一种二元醇溶剂以约5-50%w/w的量存在。在一个实施方案中,至少一种二元醇溶剂以约10-40%w/w的量存在。在一个实施方案中,至少一种二元醇溶剂以约15-30%w/w,如约20-30%w/w,例如约25%w/w的量存在。
[0102]
在一个实施方案中,至少一种胶凝剂选自卡波姆、黄原胶、阿拉伯胶、黄蓍胶、海藻酸钠、明胶、改性淀粉、羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羧甲基纤维素、羧甲基纤维素钠、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、马来酸酐和甲基乙烯基醚之间形成的共聚物、甲基丙烯酸酯衍生物、聚环氧乙烷(polyethylene oxides)、聚氧乙烯-聚氧丙烯共聚物、聚乙烯醇及其混合物。
[0103]
在一个实施方案中,至少一种胶凝剂选自卡波姆、黄原胶、阿拉伯胶、黄蓍胶、海藻酸钠、明胶、改性淀粉、羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素、马来酸酐和甲基乙烯基醚之间形成的共聚物、甲基丙烯酸酯衍生物、聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物、聚乙烯醇及其混合物。
[0104]
在一个实施方案中,胶凝剂为羟乙基纤维素。
[0105]
在一个实施方案中,至少一种胶凝剂以约0.1-10%w/w的量存在。在一个实施方案中,至少一种胶凝剂以约0.1-5%w/w的量存在。在一个实施方案中,至少一种胶凝剂以约1-5%w/w的量存在。在一个实施方案中,至少一种胶凝剂以约1-4%w/w的量存在。在一个实施方案中,至少一种胶凝剂以约1、约2、约3或约4%w/w的量存在。
[0106]
在一个实施方案中,至少一种防腐剂选自尼泊金甲酯(methyl paraben)、对羟基苯甲酸丙酯、氯甲酚、thomersal、山梨酸、山梨酸钾、对羟基苯甲酸甲酯(methyl parahydroxybenzoate)及其混合物。
[0107]
在一个实施方案中,防腐剂为对羟基苯甲酸甲酯。
[0108]
在一个实施方案中,防腐剂以约0.001-5%w/w的量存在。在一个实施方案中,防腐
剂以约0.001-1%w/w的量存在。在一个实施方案中,防腐剂以约0.001-0.005%w/w,如约0.001、约0.002、约0.003、约0.004或约0.005%w/w的量存在。
[0109]
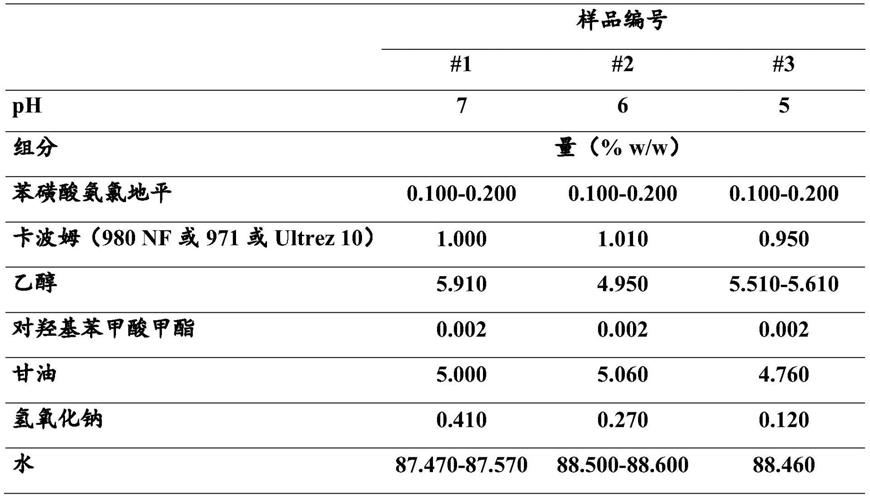
在一个实施方案中,局部药物凝胶组合物还包含至少一种稀释剂。
[0110]
在一个实施方案中,至少一种稀释剂选自乙醇、丙醇、2-丙醇、水、甘油及其混合物。
[0111]
在一个实施方案中,至少一种稀释剂包含约5-75%w/w的甘油,如约5-70%w/w、约5-65%w/w、约5-60%w/w、约5-55%w/w、约5-50%w/w、约5-45%w/w或约4-40%w/w。
[0112]
在一个实施方案中,至少一种稀释剂包含约1-20%w/w的乙醇,如约1-15%w/w或约5-15%w/w,例如约5、约6、约7、约8、约9、约10、约11、约12、约13、约14或约15%w/w。
[0113]
在一个实施方案中,至少一种稀释剂包含约10-40%w/w的水,如约10-35%w/w或15-30%w/w,例如约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29或约30%w/w。
[0114]
在一个实施方案中,至少一种稀释剂是甘油、乙醇和水的混合物。在一个实施方案中,至少一种稀释剂是约5-75%w/w的甘油;约1-20%w/w的乙醇;以及约10-40%w/w的水的混合物。在一个实施方案中,至少一种稀释剂是约30-50%w/w的甘油、约5-15%w/w的乙醇和约15-35%w/w的水的混合物。在一个实施方案中,至少一种稀释剂是约20-30%w/w的甘油、约5-15%w/w的乙醇和约15-35%w/w的水的混合物。在一个实施方案中,至少一种稀释剂是约40%w/w的甘油、约9-10%w/w的乙醇和约20-25%w/w的水的混合物。
[0115]
在一个实施方案中,局部凝胶组合物还包含局部麻醉剂如利多卡因或抗炎剂如cox、cox-1或cox-2抑制剂或它们的混合物。
[0116]
在一个实施方案中,局部凝胶组合物还可包含至少一种或多种选自以下的其他成分或赋形剂:抗氧化剂、碱化剂(alkalizer或alkalizing agent)、缓冲剂、保湿剂、湿润剂、表面活性剂、中和剂、螯合剂和软化剂(emollient)。在一个实施方案中,局部凝胶组合物还可包含至少一种或多种选自以下的其他成分或赋形剂:缓冲剂、保湿剂、湿润剂、表面活性剂、中和剂、螯合剂和软化剂。
[0117]
在一个实施方案中,局部药物凝胶组合物还包含至少一种抗氧化剂。在一个实施方案中,至少一种抗氧化剂选自乙二胺四乙酸二钠、亚硫酸钠、焦亚硫酸钠、没食子酸丙酯、乙二胺四乙酸三钠、生育酚衍生物、丁基化羟基甲苯(butylated hydroxyl toluene)、丁基化羟基茴香醚(butylated hydroxyl anisole)、抗坏血酸、富马酸、苹果酸、柠檬酸,及其混合物。
[0118]
在一个实施方案中,至少一种抗氧化剂以等于或小于5%w/w的量存在。在一个实施方案中,药物凝胶组合物不包含至少一种抗氧化剂。
[0119]
在一个实施方案中,局部药物凝胶组合物还包含至少一种碱化剂(alkalizer或alkanizing agent)。
[0120]
在一个实施方案中,至少一种碱化剂包括有机和无机碱性化合物。无机碱性盐的实例包括氢氧化铵,碱金属盐,以及碱土金属盐如氧化镁、氢氧化镁、氢氧化钙、氢氧化钠、氢氧化钾、氢氧化锂、氢氧化铝、碳酸钾、碳酸氢钠及其组合。
[0121]
在一个实施方案中,碱化剂是氢氧化钠水溶液。
[0122]
在一个实施方案中,局部药物凝胶组合物还包含类固醇如泼尼松龙、busenonide
或氢化可的松,麻醉剂如乙酰水杨酸、局部作用的利多卡因,以及舒缓剂(soothant),或局部药物凝胶组合物与上述物质共同施用。
[0123]
在一个实施方案中,局部药物凝胶组合物还包含用于目前肛裂或痔疮治疗中的典型组分,如氧化锌、苯甲酸苄酯、氧化铋、次没食子酸铋或秘鲁香脂。
[0124]
一方面,局部药物凝胶组合物包含氨氯地平盐、羟乙基纤维素、对羟基苯甲酸甲酯、乙醇、水、丙二醇和甘油,其中氨氯地平盐的存在浓度选自约1%w/w、约0.5%w/w、约0.2%w/w、约0.1%w/w、约0.05%w/w和0.01%w/w,以游离碱计。
[0125]
一方面,局部药物凝胶组合物基本上由氨氯地平盐、羟乙基纤维素、对羟基苯甲酸甲酯、乙醇、水、丙二醇和甘油组成,其中氨氯地平盐的存在浓度选自约1%w/w、约0.5%w/w、约0.2%w/w、约0.1%w/w、约0.05%w/w和0.01%w/w,以游离碱计。
[0126]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0127]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0128]
约5-75%w/w的至少一种二元醇溶剂;
[0129]
约0.1-10%w/w的至少一种胶凝剂;
[0130]
约0.001-5%w/w的至少一种防腐剂;
[0131]
约5-75%w/w的甘油;
[0132]
约1-20%w/w的乙醇;和
[0133]
约10-40%w/w的水。
[0134]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0135]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0136]
约5-75%w/w的至少一种二元醇溶剂;
[0137]
约0.1-10%w/w的至少一种胶凝剂;
[0138]
约0.001-5%w/w的至少一种防腐剂;
[0139]
约5-75%w/w的甘油;
[0140]
约1-20%w/w的乙醇;和
[0141]
约10-40%w/w的水。
[0142]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0143]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0144]
约5-75%w/w的丙二醇;
[0145]
约0.1-10%w/w的至少一种胶凝剂;
[0146]
约5-75%w/w的甘油;
[0147]
约1-20%w/w的乙醇;和
[0148]
约10-40%w/w的水。
[0149]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0150]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0151]
约5-75%w/w的丙二醇;
[0152]
约0.1-10%w/w的至少一种胶凝剂;
[0153]
约5-75%w/w的甘油;
[0154]
约1-20%w/w的乙醇;和
[0155]
约10-40%w/w的水。
[0156]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0157]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0158]
约5-75%w/w的丙二醇;
[0159]
约0.1-10%w/w的羟乙基纤维素、卡波姆、羧甲基纤维素,或其混合物;
[0160]
约0.01-5%w/w的对羟基苯甲酸甲酯;
[0161]
约5-75%w/w的甘油;
[0162]
约1-20%w/w的乙醇;和
[0163]
约10-40%w/w的水。
[0164]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0165]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0166]
约5-75%w/w的丙二醇;
[0167]
约0.1-10%w/w的羟乙基纤维素、卡波姆、羧甲基纤维素,或其混合物;
[0168]
约0.01-5%w/w的对羟基苯甲酸甲酯;
[0169]
约5-75%w/w的甘油;
[0170]
约1-20%w/w的乙醇;和
[0171]
约10-40%w/w的水。
[0172]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0173]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0174]
约5-75%w/w的丙二醇;
[0175]
约0.1-10%w/w的羟乙基纤维素;
[0176]
约0.01-5%w/w的对羟基苯甲酸甲酯;
[0177]
约5-75%w/w的甘油;
[0178]
约1-20%w/w的乙醇;和
[0179]
约10-40%w/w的水。
[0180]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0181]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0182]
约5-75%w/w的丙二醇;
[0183]
约0.1-10%w/w的羟乙基纤维素;
[0184]
约0.01-5%w/w的对羟基苯甲酸甲酯;
[0185]
约5-75%w/w的甘油;
[0186]
约1-20%w/w的乙醇;和
[0187]
约10-40%w/w的水。
[0188]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0189]
约0.01-1%w/w的氨氯地平盐,以游离碱计;
[0190]
约5-75%w/w的至少一种二元醇溶剂;
[0191]
约0.1-10%w/w的羟乙基纤维素;
[0192]
约5-75%w/w的甘油;
[0193]
约1-20%w/w的乙醇;和
[0194]
约10-40%w/w的水。
[0195]
还提供了一种氨氯地平盐的局部药物凝胶组合物,其包含:
[0196]
约0.01-1%w/w的苯磺酸氨氯地平,以游离碱计;
[0197]
约5-75%w/w的至少一种二元醇溶剂;
[0198]
约0.1-10%w/w的羟乙基纤维素;
[0199]
约5-75%w/w的甘油;
[0200]
约1-20%w/w的乙醇;和
[0201]
约10-40%w/w的水。
[0202]
在一个实施方案中,氨氯地平盐的局部药物凝胶制剂在室温下可稳定储存至少24个月的时间,测定标准限为95-105%。
[0203]
在一个实施方案中,氨氯地平盐的局部药物凝胶制剂在2-8℃的温度下可稳定储存至少24个月的时间,测定标准限为95-105%。
[0204]
在另一方面,在室温下至少24个月的储存期中,局部药物凝胶制剂中氨氯地平盐的降解杂质(有关物质)小于约2.5%。
[0205]
在另一方面,在约2-8℃的温度下至少24个月的储存期中,局部药物凝胶制剂中氨氯地平盐的降解杂质(有关物质)小于约2.5%。
[0206]
在另一方面,与口服施用相比,在局部药物凝胶制剂中局部施用的氨氯地平盐的相对生物利用度小于10%。药物凝胶制剂的局部施用28天导致组织病理学结果无局部耐受性。
[0207]
在一个实施方案中,通过kinexus pro流变仪(malvern instruments ltd.)在10s-1
剪切速率下测得的局部药物凝胶组合物的剪切粘度在约5至30pas的范围内。
[0208]
在一个实施方案中,局部药物凝胶组合物的ph在约4.0-8.0的范围内。
[0209]
在一个实施方案中,局部药物凝胶组合物的密度在约0.9-1.5g/ml的范围内。
[0210]
在一个实施方案中,将局部药物凝胶组合物配制成软膏剂、乳膏、混悬剂、洗剂、粉剂、溶液剂、糊剂、凝胶剂、喷雾剂、泡沫剂、油剂、气雾剂、栓剂或灌肠剂。
[0211]
在一个实施方案中,将局部药物凝胶组合物施用于患有肛门直肠疾病如痔疮、肛裂和肛门直肠手术后的疼痛症状的患者的皮肤的受影响区域。
[0212]
本文公开了用于治疗肛门直肠疾病的局部药物凝胶组合物,所述肛门直肠疾病为例如痔疮、肛裂(急性和慢性)、肛门直肠手术后的疼痛症状、肛周脓肿、脱垂的血栓痔、肛周血肿、侵袭括约肌的癌症(肛门直肠癌)、肛门疱疹、肛门疣、肛门瘙痒、痉挛性肛部痛、便秘、肛门出血和克罗恩氏病或其他与炎性肠病有关的肛门直肠病症。
[0213]
还提供了一种用于治疗肛门直肠疾病的方法,其包括将权利要求1至15中任一项所述的局部药物凝胶组合物局部施用于需要其的患者的皮肤表面。
[0214]
在一个实施方案中,肛门直肠疾病选自痔疮、肛裂(急性和慢性)、肛门直肠手术后的疼痛症状、肛周脓肿、脱垂的血栓痔、肛周血肿、侵袭括约肌的癌症(肛门直肠癌)、肛门疱疹、肛门疣、肛门瘙痒、痉挛性肛部痛、便秘、肛门出血和克罗恩氏病或其他与炎性肠病有关的肛门直肠病症。
[0215]
本文还公开了一种用于制备氨氯地平盐的局部凝胶制剂的方法。该制备方法包括以下步骤:
[0216]
搅拌至少一种稀释剂、至少一种二元醇溶剂、氨氯地平盐、至少
[0217]
一种防腐剂和至少一种胶凝剂以形成凝胶;和
[0218]
加入水至所需的总重量/体积。
[0219]
在一个实施方案中,所述制备方法包括以下步骤:
[0220]
将乙醇、二元醇溶剂和水混合并均质化;
[0221]
将氨氯地平盐和防腐剂溶于乙醇、二元醇溶剂和水中;
[0222]
将胶凝剂加入溶解的溶液中;
[0223]
将溶液混合并均质化以获得凝胶;
[0224]
在连续搅拌下将甘油加入到凝胶中;
[0225]
加入水至所需的总重量/体积。
[0226]
在一个实施方案中,用于制备氨氯地平盐的局部凝胶制剂的方法包括以下步骤:
[0227]
将乙醇、二元醇溶剂和水混合并均质化;
[0228]
将氨氯地平盐和对羟基苯甲酸甲酯溶于乙醇、二元醇溶剂和水中;
[0229]
将羟乙基纤维素加入到完全溶解的(b)溶液中;
[0230]
将溶液混合并均质化以获得凝胶;
[0231]
在连续搅拌下将甘油加入到凝胶中;
[0232]
加入水至所需的总重量/体积。
[0233]
下面的实施例并非旨在限制本发明的范围,而是结合以上详细描述和一般说明进行阅读,提供对本发明的进一步理解以及用于制备本发明组合物的方法的概述。
[0234]
实施例
[0235]
实施例1
[0236]
使用卡波姆制备苯磺酸氨氯地平局部药物凝胶组合物
[0237]
使用卡波姆作为胶凝剂制备苯磺酸氨氯地平局部药物凝胶组合物。所制备的凝胶的组成总结于表1中。
[0238]
表1.使用卡波姆制备的局部药物凝胶组合物
[0239]
[0240]
实施例#1的方法:将0.2-0.4g苯磺酸氨氯地平溶解在9.8g乙醇中。向溶液中加入87.8
–
87.6g水并充分混合。将2g卡波姆加入到制备的溶液中并充分搅拌直至完全溶解。分别地,将0.828g氢氧化钠溶解在107.2g水中,并加入2ml 0.2%的对羟基苯甲酸甲酯乙醇溶液。将两种溶液混合在一起以形成凝胶。将10g甘油加入到凝胶中并充分均质化。
[0241]
实施例#2的方法:将0.2-0.4g苯磺酸氨氯地平溶解在9.8g乙醇中。向溶液中加入87.8-87.6g水并充分混合。将2g卡波姆加入到制备的溶液中并充分搅拌直至完全溶解。分别地,将0.540g氢氧化钠溶解在107.5g水中,并加入2ml 0.2%的对羟基苯甲酸甲酯乙醇溶液。将两种溶液混合在一起以形成凝胶。将10g甘油加入到凝胶中并充分均质化。
[0242]
实施例#3的方法:将0.2g卡波姆溶解在100g水中。将0.25g氢氧化钠溶解在86g水中。将两种溶液混合在一起以形成凝胶。将2ml 0.2%的对羟基苯甲酸甲酯乙醇溶液、10g甘油和9.9-10g 2-4%的苯磺酸氨氯地平乙醇溶液加入到凝胶中并充分均质化。
[0243]
实施例2
[0244]
使用羧甲基纤维素制备苯磺酸氨氯地平局部药物凝胶组合物
[0245]
使用羧甲基纤维素作为胶凝剂制备苯磺酸氨氯地平局部药物凝胶组合物。所制备的凝胶的组成总结于表2中。
[0246]
表2.使用羧甲基纤维素制备的局部药物凝胶组合物
[0247][0248]
实施例#4的方法:将0.1-0.2g苯磺酸氨氯地平溶解在4.9g乙醇中,然后向溶液中加入5g 0.2%的对羟基苯甲酸甲酯乙醇溶液和87.8-87.9g水。向溶液中加入2g羧甲基纤维素以形成凝胶。将5g甘油在凝胶中均质化。
[0249]
实施例3
[0250]
使用羟乙基纤维素制备苯磺酸氨氯地平局部药物凝胶组合物
[0251]
使用羟乙基纤维素作为胶凝剂制备苯磺酸氨氯地平局部药物凝胶组合物。所制备的凝胶的组成总结于表3中。
[0252]
表3.使用羟乙基纤维素制备的局部药物凝胶组合物
[0253][0254]
实施例5的方法:将0.2-0.4g苯磺酸氨氯地平溶解在9.8g乙醇中,然后向溶液中加入2g 0.2%的对羟基苯甲酸甲酯乙醇溶液和173.6-173.8g水。将4g羟乙基纤维素加入到制备的溶液中并充分混合以形成凝胶。将10g甘油在凝胶中均质化。
[0255]
实施例6的方法:将0.14-0.28g苯磺酸氨氯地平溶解在9.86g乙醇中,然后向溶液中加入1g 0.2%的对羟基苯甲酸甲酯乙醇溶液和46.95-47.00g水。向溶液中加入2g羟乙基纤维素并充分混合以形成凝胶。将40g甘油在凝胶中均质化。
[0256]
实施例7的方法:将9.6g乙醇、25g丙二醇和23.02-23.16g水充分混合。将0.14-0.28g苯磺酸氨氯地平和0.1g对羟基苯甲酸甲酯溶解在溶剂混合物中。将2g羟乙基纤维素加入到溶剂混合物中并充分混合以形成凝胶。将40g甘油在凝胶中均质化。
[0257]
实施例4
[0258]
使用羟乙基纤维素制备马来酸氨氯地平和甲磺酸氨氯地平局部药物凝胶组合物
[0259]
使用羟乙基纤维素作为胶凝剂制备马来酸氨氯地平和甲磺酸氨氯地平局部药物凝胶组合物。所制备的凝胶的组成总结于表4中。
[0260]
表4.使用羟乙基纤维素但使用不同的氨氯地平盐(不是苯磺酸氨氯地平)制备的局部药物凝胶组合物
[0261][0262]
实施例8的方法:将9.6g乙醇、25g丙二醇和23.14-23.27g水充分混合。将0.13-0.26g马来酸氨氯地平和0.004g对羟基苯甲酸甲酯溶解在溶剂混合物中。将2g羟乙基纤维素加入到溶剂混合物中并充分混合以形成凝胶。将40g甘油在凝胶中均质化。
[0263]
实施例9的方法:将9.6g乙醇、25g丙二醇和23.15-23.27g水充分混合。将0.12-0.258g甲磺酸氨氯地平和0.004g对羟基苯甲酸甲酯溶解在溶剂混合物中。将2g羟乙基纤维素加入到溶剂混合物中并充分混合以形成凝胶。将40g甘油在凝胶中均质化。
[0264]
实施例5
[0265]
将根据实施例1-4制备的苯磺酸氨氯地平局部药物凝胶组合物在室温和4℃下储存在封闭的小瓶中,以研究稳定性。在不同时间点通过rp-hplc方法进行有关物质检测。与使用卡波姆制备的组合物相比,使用羟乙基纤维素制备的苯磺酸氨氯地平局部药物凝胶组合物更稳定。使用羟乙基纤维素制备的不同氨氯地平盐的局部药物凝胶在4℃和室温下储存1个月后显示出不同的分解特性。在两种储存条件下,只有使用羟乙基纤维素制备的苯磺酸氨氯地平凝胶具有令人满意的降解特性(表5)。
[0266]
表5.不同局部药物凝胶组合物中氨氯地平随时间的分解。样品#1-5的苯磺酸氨氯地平含量为0.1%。样品#6-9的氨氯地平含量为0.1%。
[0267][0268]
实施例6
[0269]
苯磺酸氨氯地平局部药物凝胶组合物的体外渗透性
[0270]
使用透析测量研究了苯磺酸氨氯地平、甲磺酸氨氯地平和马来酸氨氯地平凝胶的体外渗透性。供体室含有4000mg局部药物凝胶组合物,而受体介质是磷酸盐缓冲液,ph 7.4(100ml)。在37
±
0.5℃下进行测量。透析膜是snakeskin透析管,3.5k mwco(35mm干内径)。与用不同氨氯地平盐或使用卡波姆作为胶凝剂制备的组合物相比,使用羟乙基纤维素制备的苯磺酸氨氯地平局部药物凝胶组合物显示出明显更高的体外渗透性。与其他凝胶相比,使用羟乙基纤维素制备的苯磺酸氨氯地平局部药物凝胶组合物的受体室的氨氯地平含量高1.7倍(表6)。
[0271]
表6.苯磺酸氨氯地平、甲磺酸氨氯地平和马来酸氨氯地平凝胶的体外渗透性
[0272][0273]
实施例7
[0274]
在小型猪中进行28天皮肤耐受性研究,然后进行8天的恢复期
[0275]
方法
[0276]
这项研究的目的是获得在28天的时间内每天两次局部施用(皮肤)的小型猪中0.2%w/w氨氯地平局部药物凝胶组合物的皮肤局部耐受性和皮肤刺激性的信息,并评估8天恢复期后任何作用的可逆性。另外,还研究了全身暴露的药代动力学特征。
[0277]
将氨氯地平凝胶或安慰剂测量到塑料刮板上,并均匀涂抹在左右治疗部位(治疗面积:约20cm2)。施用位点未封闭。
[0278]
药代动力学研究:在最后一次治疗后,在以下时间点将约3ml血液收集到含有k3-edta作为抗凝剂的塑料小瓶中:治疗后0分钟、1小时、2小时、4小时、6小时、8小时、12小时、16小时、24小时、36小时和48小时(11个样品/动物)。使用atrc开发的可靠的lc-ms/ms方法在小型猪血浆中对氨氯地平进行定量。氨氯地平的氘代类似物(氨氯地平-d4)用作内标(is)。血浆蛋白用甲醇沉淀,并将上清液通过梯度洗脱进行反相色谱分离。在以正离子模式电喷雾电离后,在以下转换过程中以mrm模式检测分析物:氨氯地平:409.10
→
238.15m/z,is:413.10
→
238.15m/z,校准范围:50pg/ml-50ng/ml,lloq:50pg/ml。使用经过验证的phoenix软件版本6.3(pharsight corporation,usa)进行药代动力学分析。使用非房室方法评估个体和平均的血浆水平与时间的关系曲线。结果如图1和表7所示。结论是0.2%的氨氯地平凝胶的28天重复局部施用导致非常低的总全身暴露。在重复施用结束时,所有测得的血浆浓度均保持低于300pg/ml,并且平均c
最大
和auc
0-24小时
值均约为以相同剂量重复口服施用后获得的值的5%。
[0279]
表7.在雌性哥廷根小型猪中口服施用氨氯地平片或局部施用0.2%的局部药物凝
胶后的药代动力学参数。
[0280][0281]
存活率、死亡率和临床体征:在治疗日每天记录三次(第一次治疗前一次,之后两次),在无治疗日每天记录两次存活率、死亡率和临床体征。在研究过程期间没有发生死亡。在研究期间未观察到与氨氯地平凝胶有关的临床体征。
[0282]
体重:在适应期间,然后在治疗日,在施用前,进行两次体重测量。在用安慰剂和氨氯地平凝胶治疗的动物之间,在体重增加方面没有与测试项目有关的差异。
[0283]
局部耐受性:在治疗期间(治疗前)和恢复期每天两次观察动物的治疗皮肤区域(两侧),以评估局部耐受性,特别考虑红斑、水肿、炎症、过敏性、感染、生物膜形成、缺血、坏死、丹毒和蜂窝织炎。在整个研究过程中,在治疗部位未观察到与氨氯地平凝胶或安慰剂有关的局部耐受性结果。
[0284]
尸检:在恢复期结束时(研究第37天)。尸检期间在任何动物中均未观察到与氨氯地平凝胶或安慰剂有关的肉眼可见的发现。
[0285]
组织病理学:对来自所有动物治疗部位的样品进行完整的组织病理学检查。用安慰剂或氨氯地平凝胶皮肤暴露28天并恢复8天后未观察到与治疗有关的作用或毒性。
[0286]
总之,在28天内每天两次用局部(皮肤)氨氯地平凝胶以2mg/动物/治疗的剂量水平对小型猪进行的皮肤耐受性研究没有导致不良作用。根据结果,在所有动物中,2mg/动物/治疗剂量的耐受性良好。
[0287]
由前面的描述,本领域技术人员可以容易地确定本发明的基本特征,并且在不脱离本发明的精神和范围的情况下,可以对本发明进行各种改变和修改以使其适应各种用途和条件。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1