信使RNA的无泵包封的制作方法
相关申请的交叉引用
本申请要求2018年10月19日提交的美国临时申请序列号62/747,838的优先权,该临时申请的公开内容据此以引用的方式并入。
背景技术:
信使rna疗法(mrt)正在成为治疗多种疾病的越来越重要的方法。mrt涉及信使rna(mrna)至有需要的患者的施用。所施用的mrna在患者体内产生mrna编码的蛋白质。脂质体和/或脂质纳米颗粒通常被用于包封mrna以实现mrna的有效体内递送。然而,目前用于产生负载mrna的脂质纳米颗粒的方法由于低包封效率、低mrna回收率和/或异质性粒度而受到影响。目前方法的另一个缺点是需要使用专用设备(诸如齿轮泵、蠕动泵等等)来进行包封方法。在某些位置,诸如患者护理环境,这种专用设备可能不容易获得。
技术实现要素:
本发明特别提供了脂质纳米颗粒制剂和mrna包封的改进方法。具体而言,本发明基于以下令人惊讶的发现:即用于核酸的脂质包封的基于重力的混合过程具有可重复的、高效的包封效率。
本发明提供了使用基于重力的混合过程的具有成本效益、稳健和对使用者友好的mrna包封方法。用于包封核酸的基于重力的混合过程的一些有益效果包括例如可变性较小,液体的无脉冲流动在不需要机器驱动的执行器的情况下实现精确、可重现的混合流速。本文所述的重力混合过程的其他优点包括不需要校准或冗长的设置、具有成本效率、低维护和稳健的物理设计(例如,无移动部分和/或最少的附件)。本文所述的发明特别提供了一种可扩展的系统,所述系统允许在独立于容量的情况下以最小的材料损失同时制备多种制剂。此外,本文所述的发明提供了过程变量的灵活性,至少是因为重力作用下的流动可以根据流动路径的直径微调,这继而在流速方面允许更大的灵活性。
因此,在一个方面,本发明提供了一种将信使rna(mrna)包封于脂质体中的方法,所述方法包括:a.以第一受控流速提供包含mrna溶液的第一流,b.以第二受控流速提供包含脂质溶液的第二流,以及c.将所述第一流和所述第二流混合以形成包封mrna的脂质体,其中在不使用泵的情况下实现所述第一受控流速和所述第二受控流速。
在另一个方面,本发明提供了一种将信使rna(mrna)包封于脂质体中的方法,所述方法包括:a.以第一受控流速提供包含mrna溶液的第一流,b.以第二受控流速提供包含脂质溶液的第二流,以及c.将所述第一流和所述第二流混合以形成包封mrna的脂质体,d.其中步骤a-c中的每个在重力进料下和无外部压力的情况下进行。
在一些实施方案中,如权利要求1或2所述的方法,其中所述第一流由第一导管提供;并且所述第二流由第二导管提供,并且其中所述第一导管和所述第二导管通过接头来连接,从而将所述mrna溶液和所述脂质溶液混合。
在一些实施方案中,所述接头包括t型连接器或y型连接器。
在一些实施方案中,所述第一导管被连接至容纳所述mrna溶液的第一储集器,并且所述第二导管被连接至容纳所述脂质溶液的第二储集器。
在一些实施方案中,第一限流控制所述第一受控流速,并且第二限流控制所述第二受控流速。
在一些实施方案中,所述第一限流和所述第二限流提供相同的受控流速。
在一些实施方案中,所述第一限流和所述第二限流提供不同的受控流速。
在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.0×。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.2×。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.5×。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.8×。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约2.0×。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约2.5×。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约3.0×。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.0×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.2×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.5×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约1.8×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约2.0×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约2.5×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约3.0×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约3.5×或更大。在一些实施方案中,所述第一受控流速与第二受控流速的比率为约4.0×或更大。
在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.0×。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.2×。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.5×。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.8×。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约2.0×。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约2.5×。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约3.0×。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.0×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.2×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.5×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约1.8×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约2.0×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约2.5×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约3.0×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约3.5×或更大。在一些实施方案中,所述第二受控流速与第一受控流速的比率为约4.0×或更大。
在一些实施方案中,所述第一限流包括所述第一导管的第一直径,并且所述第二限流包括所述第二导管的第二直径。
在一些实施方案中,所述第一限流包括第一储集器的第一直径,并且所述第二限流包括第二储集器的第二直径。
在一些实施方案中,所述第一限流包括第一储集器-导管连接部的第一直径,并且所述第二限流包括第二储集器-导管连接部的第二直径。
在一些实施方案中,所述第一限流包括第一导管-接头连接部的第一直径,并且所述第二限流包括第二导管-接头连接部的第二直径。如权利要求7-10中任一项所述的方法,其中所述第一直径与所述第二直径相同。
在一些实施方案中,所述第一直径与所述第二直径不同。
在一些实施方案中,所述第一直径大于所述第二直径。
在一些实施方案中,所述第一直径比所述第二直径大1.2×、1.5×、1.8×、2.0×、2.5×、1.2×或更大、1.5×或更大、1.8×或更大、2.0×或更大、2.5×或更大。在一些实施方案中,所述第一直径比所述第二直径大约3.0×、3.5×、4.0×、4.5×、5.0×、5.5×、6.0×或更大。
在一些实施方案中,所述第一直径大于所述第二直径的量提供1:1、2:1、3:1、4:1、5:1、10:1、1:1或更大、2:1或更大、3:1或更大、或者4:1或更大、或者5:1或更大、或者10:1或更大的第一受控流率与第二受控流率的比率。
在一些实施方案中,所述第一导管的所述第一直径选自以下范围:0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm。
在一些实施方案中,所述第二导管的所述第二直径选自以下范围:0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm。
在一些实施方案中,所述第一受控流速的范围为约0.1-1ml/min、1-150ml/min、150-250ml/min、250-500ml/min、500-1000ml/min、1000-2000ml/min、2000-3000ml/min、3000-4000ml/min或4000-5000ml/min。
在一些实施方案中,所述第一受控流速为约50ml/min。在一些实施方案中,所述第一受控流速为约100ml/min。在一些实施方案中,所述第一受控流速为约150ml/min。在一些实施方案中,所述第一受控流速为约200ml/min。在一些实施方案中,所述第一受控流速为约250ml/min。在一些实施方案中,所述第一受控流速为约300ml/min。在一些实施方案中,所述第一受控流速为约400ml/min。在一些实施方案中,所述第一受控流速为约500ml/min。
在一些实施方案中,所述第二受控流速的范围为约0.1-1ml/min、1-150ml/min、150-250ml/min、250-500ml/min、500-1000ml/min、1000-2000ml/min、2000-3000ml/min、3000-4000ml/min或4000-5000ml/min。
在一些实施方案中,所述第二受控流速为约10ml/min。在一些实施方案中,所述第二受控流速为约50ml/min。在一些实施方案中,所述第二受控流速为约100ml/min。在一些实施方案中,所述第二受控流速为约150ml/min。在一些实施方案中,所述第二受控流速为约200ml/min。在一些实施方案中,所述第二受控流速为约250ml/min。在一些实施方案中,所述第二受控流速为约300ml/min。在一些实施方案中,所述第二受控流速为约400ml/min。在一些实施方案中,所述第二受控流速为约500ml/min。
在一些实施方案中,所述脂质溶液包含一种或多种阳离子脂质、一种或多种辅助脂质和一种或多种peg修饰的脂质。
在一些实施方案中,所述脂质溶液还包含一种或多种基于胆固醇的脂质。
在一些实施方案中,所述一种或多种基于胆固醇的脂质是胆固醇和/或peg化的胆固醇。
在一些实施方案中,所述脂质溶液包含预先形成的脂质纳米颗粒。
在一些实施方案中,所述脂质溶液是预先形成的脂质纳米颗粒的悬浮液。
在一些实施方案中,所述第一流包含约50%或更多的水,并且所述第二流包含约50%或更多的乙醇。
在一些实施方案中,所述第一流包含约85-99%的水,并且所述第二流包含约85-99%的乙醇。
在一些实施方案中,所述第一流和所述第二流中的每一者包含50%或更多的水。
在一些实施方案中,所述方法产生粒度范围为约40-150nm的脂质纳米颗粒。
在一些实施方案中,约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的所述脂质纳米颗粒的粒度为150nm或更小。
在一些实施方案中,约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%的所述脂质纳米颗粒的粒度为100nm或更小。
在一些实施方案中,大于约70%、75%、80%、85%、90%、95%、96%、97%、98%、99%的所述脂质纳米颗粒的粒度范围为50-80nm。
在一些实施方案中,所述方法产生至少约60%的包封效率。在一些实施方案中,所述方法产生至少约65%的包封效率。在一些实施方案中,所述方法产生至少约70%的包封效率。在一些实施方案中,所述方法产生至少约75%的包封效率。在一些实施方案中,所述方法产生至少约80%的包封效率。在一些实施方案中,所述方法产生至少约85%的包封效率。在一些实施方案中,所述方法产生至少约90%的包封效率。在一些实施方案中,所述方法产生至少约95%的包封效率。在一些实施方案中,所述方法产生至少约96%的包封效率。在一些实施方案中,所述方法产生至少约97%的包封效率。在一些实施方案中,所述方法产生至少约98%的包封效率。在一些实施方案中,所述方法产生至少约99%的包封效率。
在一些实施方案中,所述方法产生至少约50%的mrna的回收率。在一些实施方案中,所述方法产生至少约55%的mrna的回收率。在一些实施方案中,所述方法产生至少约60%的mrna的回收率。在一些实施方案中,所述方法产生至少约65%的mrna的回收率。在一些实施方案中,所述方法产生至少约70%的mrna的回收率。在一些实施方案中,所述方法产生至少约75%的mrna的回收率。在一些实施方案中,所述方法产生至少约80%的mrna的回收率。在一些实施方案中,所述方法产生至少约85%的mrna的回收率。在一些实施方案中,所述方法产生至少约90%的mrna的回收率。在一些实施方案中,所述方法产生至少约95%的mrna的回收率。在一些实施方案中,所述方法产生至少约96%的mrna的回收率。在一些实施方案中,所述方法产生至少约97%的mrna的回收率。在一些实施方案中,所述方法产生至少约98%的mrna的回收率。在一些实施方案中,所述方法产生至少约99%的mrna的回收率。
在一些实施方案中,所述方法产生至少0.1mg的经包封的mrna。在一些实施方案中,所述方法产生至少0.5mg的经包封的mrna。在一些实施方案中,所述方法产生至少1mg的经包封的mrna。在一些实施方案中,所述方法产生至少5mg的经包封的mrna。在一些实施方案中,所述方法产生至少10mg的经包封的mrna。在一些实施方案中,所述方法产生至少100mg的经包封的mrna。在一些实施方案中,所述方法产生至少500mg的经包封的mrna。在一些实施方案中,所述方法产生至少1,000mg的经包封的mrna。
在一些实施方案中,所述方法产生不需要进一步纯化的脂质纳米颗粒。
在一些实施方案中,所述方法还包括将脂质纳米颗粒收集在容纳件或导管中的步骤。
在一些实施方案中,所述mrna是经密码子优化的。
在一些实施方案中,所述mrna是未经修饰的。
在一些实施方案中,所述mrna是经修饰的。
在一些实施方案中,所述方法包括第一流和对应的第二流的多个配对。
在一些实施方案中,在步骤c中,所述第一流和第二流的每个配对的混合同时发生。
在一些实施方案中,所述方法包括所述第一流和所述第二流的至少10、20、30、40、50、100、150、200个配对。
在一些实施方案中,每个单独的第一流提供不同的mrna溶液。
在一些实施方案中,第一流的至少一个子集提供相同的mrna溶液。
在一些实施方案中,每个单独的第二流提供不同的脂质溶液。
在一些实施方案中,第二流的至少一个子集提供相同的脂质溶液。
在另一个方面,本发明提供了一种递送用于体内蛋白质产生的mrna的方法,所述方法包括将包封如前述权利要求中任一项所述的方法产生的mrna的脂质纳米颗粒的组合物施用于受试者。
在另一个方面,本发明提供了一种用于将信使rna(mrna)包封于脂质纳米颗粒中的系统,所述系统包括用于以第一受控流速提供mrna溶液的第一导管,以及用于以第二受控流速提供脂质溶液的第二导管,其中所述第一导管和所述第二导管通过接头来连接以促进所述mrna溶液和所述脂质溶液的混合,并且其中所述第一受控流速和所述第二受控流速无需使用泵即可实现。
在一些实施方案中,所述接头包括t型连接器或y型连接器。
在一些实施方案中,所述第一导管被连接至用于容纳所述mrna溶液的第一储集器,并且所述第二导管被连接至用于容纳所述脂质溶液的第二储集器。
在一些实施方案中,所述第一导管具有第一直径,并且所述第二导管具有第二直径。
在一些实施方案中,所述第一直径与所述第二直径相同。
在一些实施方案中,所述第一直径与所述第二直径不同。
在一些实施方案中,所述第一直径大于所述第二直径。
在一些实施方案中,所述第一导管的所述第一直径选自以下范围:0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm。
在一些实施方案中,所述第二导管的所述第二直径选自以下范围:0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm。
在一些实施方案中,所述系统还包括收集所产生的脂质纳米颗粒的容纳件或导管。
在下述详细描述、附图和权利要求书中,本发明的其他特征、目的和优点是显而易见的。然而,应当理解,虽然具体实施方式、附图和权利要求指出了本发明的实施方案,但是仅以说明性方式给出,而不应解释为限制性方式。在本发明的范围内的各种变化和修改对于所属领域的技术人员将变得显而易见。
附图说明
附图仅用于说明的目的,而非限制。
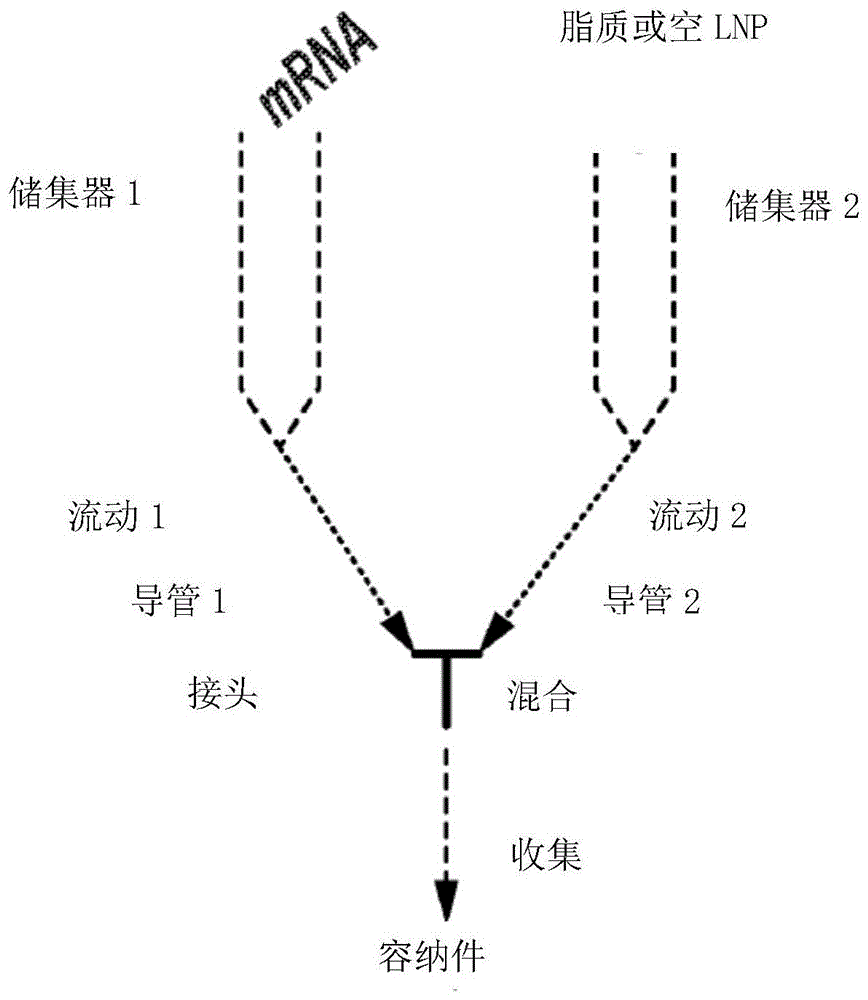
图1是无泵核酸脂质纳米颗粒包封方法的示意图。该示意图描绘了容纳核酸溶液(mrna)的储集器1、容纳脂质或空脂质纳米颗粒(lnp)的储集器2、导管1和导管2,来自储集器1和储集器2的液体分别流过导管1和导管2。来自导管1的流动(流动1)和来自导管2的流动(流动2)在接头(描绘为t型接头)处汇合和混合。在混合时,包封的核酸即被收集在容纳件中。
图2a和2b是描绘示例性方法的示意图,所述方法在混合点处包括“t”型接头(图2a)或“y”型接头(图2b)。
图3a和3b是描绘直径对流过过程导管的液体流动的影响的示意图。图3a描绘了具有大直径的导管。图3b描绘了具有小直径的导管。
图4(分图a-d)是一系列示意图,它们示出了放置调节过程中的液体的直径和流动的限流器的示例性位置。图4的分图a描绘了不具有限流器的储集器、导管和接头。图4的分图b描绘了储集器和导管,其中所述导管附接有限流器。图4的分图c描绘了储集器和导管,其中所述导管在接头附近附接有限流器。图4的分图d描绘了储集器和导管,其中限流器放置在储集器上。
图5a和5b是一系列示意图,它们描绘了用于控制过程中的流速和所得的混合物的一个实施方案。图5a示出了储集器、导管和接头,其中所述接头处于向上位置。该向上位置防止液体的流动并且允许清空管路。图5b描绘了储集器、导管和接头,其中所述接头处于伸出位置。该向下位置允许导管填充液体并且在接头处混合。
图6描绘了固定系统中的过程的示意图,其中储集器1和储集器2中的液体跟随重力流过导管并且在接头处混合。
图7描绘了串联过程的示意图,其中液体被同时添加至储集器对,随后液体被连续添加至接下来的储集器对。
图8描绘了其中使用多个导管对的高通量过程的示意图。
定义
为了使本发明更容易理解,首先在下文定义了某些术语。以下术语和其他术语的其他定义阐述在整个说明书中。
烷基:如本文所用,“烷基”是指具有1个至20个碳原子的直链或支链饱和烃基的基团(“c1-20烷基”)。在一些实施方案中,烷基基团具有1个至3个碳原子(“c1-3烷基”)。c1-3烷基的例子包括甲基(c1)、乙基(c2)、正丙基(c3)和异丙基(c3).在一些实施方案中,烷基基团具有8个至12个碳原子(“c8-12烷基”)。c8-12烷基基团的实例包括但不限于正辛基(c8)、正壬基(c9)、正癸基(c10)、正十一烷基(c11)、正十二烷基(c12)等。前缀“n-”(正)是指非支链的烷基基团。例如,正c8烷基是指-(ch2)7ch3、正c10烷基是指-(ch2)9ch3,等等。
氨基酸如本文所用,术语“氨基酸”在其最广泛的意义上是指可以掺入多肽链中的任何化合物和/或物质。在一些实施方案中,氨基酸具有一般结构h2n–c(h)(r)–cooh。在一些实施方案中,氨基酸是天然存在的氨基酸。在一些实施方案中,氨基酸是合成氨基酸;在一些实施方案中,氨基酸是d-氨基酸;在一些实施方案中,氨基酸是l-氨基酸。“标准氨基酸”是指在天然存在的肽中通常发现的二十种标准i-氨基酸中的任一种。“非标准氨基酸”是指除标准氨基酸以外的任何氨基酸,无论其是合成制备的还是从天然来源获得的。如本文所用,“合成氨基酸”涵盖化学修饰的氨基酸,包括但不限于盐、氨基酸衍生物(例如酰胺)和/或取代物。氨基酸,包括肽中的羧基和/或氨基末端氨基酸,可以通过甲基化、酰胺化、乙酰化、保护基和/或用其他化学基团取代来修饰,这些化学基团可以改变肽的循环半衰期,而不会对其活性产生不利影响。氨基酸可以参与二硫键。氨基酸可包含一种或多种翻译后修饰,其例如与一种或多种化学实体(例如,甲基基团、乙酸根基团、乙酰基基团、磷酸根基团、甲酰基部分、类异戊二烯基团、硫酸根基团、聚乙二醇部分、脂质部分、碳水化合物部分和生物素部分等)结合。术语“氨基酸”与“氨基酸残基”可互换使用,并且可以指游离氨基酸和/或肽的氨基酸残基。无论该术语是指游离氨基酸还是肽的残基,从使用该术语的上下文将是显而易见的。
大气压:如本文所用,术语“大气压”意指由大气的重量施加的压力,它在海平面处具有的平均值为约101,325帕斯卡。
大约或约:如本文所用,当应用于一个或多个目的值时,术语“大约”或“约”指与所述参考值相似的值。在某些实施方案中,术语“大约”或“约”指落入所述值任一方向(大于或小于)中的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少的一系列值,除非另有说明或从上下文中另外显而易见的(除非该数字超过可能值的100%)。
包封:如本文所用,术语“包封”或语法等同形式是指将单独的mrna分子限制在纳米颗粒内的过程。
重力进料:如本文所用,术语“重力进料”意指在不使用泵的情况下使用重力将物质(例如液体)从一个位置移动到另一个位置。
改进、增加或减少:如本文所用,术语“改善”、“增加”或“减少”或语法等同项表示相对于基线测量值,诸如在本文所述治疗开始之前同一个体的测量值,或在没有本文所述治疗的情况下对照受试者(或多个对照受试者)的测量值的值。“对照受试者”是患有与所治受试者相同形式的疾病,其年龄与所治受试者大约相同的受试者。
杂质:如本文使用的,术语“杂质”是指在限定量的液体、气体或固体内,与目标材料或化合物的化学组成不同的物质。杂质也被称为污染物。
体外:如本文所用,术语“体外”是指在人工环境中,例如在试管或反应容器中,在细胞培养物中等,而不是在多细胞生物体内发生的事件。
体内:如本文所用,术语“体内”是指在多细胞生物体诸如人和非人动物内发生的事件。在基于细胞的系统的上下文中,该术语可用于指在活细胞内发生的事件(与例如体外系统相反)。
分离的:如本文所用,术语“分离的”是指(1)与最初生产时(无论是天然的和/或在实验环境中)与之相关联的至少一些组分分离,和/或(2)由人工生产、制备和/或制造的物质和/或实体。分离的物质和/或实体可以与最初与它们相关联的其他组分的约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或大于约99%分离。在一些实施方案中,分离的试剂的纯度为约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或超过99%。如本文所用,如果一种物质基本上不含其他组分,则该物质是“纯的”。如本文所用,分离的物质和/或实体的纯度百分比的计算不应包括赋形剂(例如,缓冲剂、溶剂、水等)。
信使rna(mrna):如本文所用,术语“信使rna(mrna)”是指编码至少一种肽、多肽或蛋白质的多核苷酸。如本文所用,mrna涵盖经修饰的和未经修饰的rna二者。mrna可以含有一个或多个编码和非编码区。mrna可以从天然来源纯化,使用重组表达系统来产生和任选地纯化,化学合成等。在适当情况下,例如在化学合成分子的情况下,mrna可以包含核苷类似物,诸如具有经化学修饰的碱基或糖、主链修饰的类似物等。
核酸:如本文所用,术语“核酸”在其最广泛的意义上是指可以掺入多核苷酸链中的任何化合物和/或物质。在一些实施方案中,核酸是由磷酸二酯键掺入或可以由磷酸二酯键掺入多核苷酸链的化合物和/或物质。在一些实施方案中,“核酸”是指单独的核酸残基(例如,核苷酸和/或核苷)。在一些实施方案中,“核酸”是指包含单个核酸残基的多核苷酸链。在一些实施方案中,“核酸”涵盖rna以及单链和/或双链dna和/或cdna。此外,术语“核酸”、“dna”、“rna”和/或类似术语包括核酸类似物,即具有除磷酸二酯骨架以外的类似物。例如,所谓的“肽核酸”被认为在本发明的范围内,该术语是本领域已知的,并且在主链中具有肽键而不是磷酸二酯键。术语“编码氨基酸序列的核苷酸序列”包括彼此互为简并形式和/或编码相同的氨基酸序列的所有核苷酸序列。编码蛋白质的核苷酸序列和/或rna可包括内含子。核酸可从天然来源纯化,使用重组表达系统产生且任选地纯化,化学合成等。适当时,例如在化学合成的分子的情况下,核酸可包含核苷类似物,例如具有化学修饰的碱基或糖、主链修饰等的类似物。除非另外指明,否则核酸序列以5'至3'方向呈现。在一些实施方案中,核酸是或包含天然核苷(例如,腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷);核苷类似物(例如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、5-甲基胞苷、c-5丙炔基胞苷、c-5丙炔基-尿苷、2-氨基腺苷、c5-溴尿苷、c5-氟尿苷、c5-碘尿苷、c5-丙炔基尿苷、c5-丙炔基胞苷、c5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、o(6)-甲基鸟苷和2-硫代胞苷);经化学修饰的碱基;经生物修饰的碱基(例如,甲基化碱基);插入的碱基;经修饰的糖(例如,2’-氟核糖、核糖、2’-脱氧核糖、阿拉伯糖和己糖);和/或经修饰的磷酸基团(例如,硫代磷酸和5’-n-亚磷酰胺键)。在一些实施方案中,本发明特别涉及“未修饰的核酸”,它意指未经化学修饰以促进或实现递送的核酸(例如,多核苷酸和残基,包括核苷酸和/或核苷)。
泵:如本文所用,术语“泵”是指用于驱动或压缩流体或气体的装置。多种类型的“泵”是已知的,包括例如隔膜泵、离心泵、活塞泵、蠕动泵、脉冲泵和凸轮泵。泵可以包括机械致动装置和/或手动致动装置。
盐:如本文所用,术语“盐”是指确实由或可能由酸与碱之间的中和反应产生的离子化合物。
基本上:如本文所用,术语“基本上”是指表现出全部或接近全部范围或程度的目标特征或性质的定性条件。生物学领域的普通技术人员将理解,生物学和化学现象很少(如果曾经有)完成和/或继续完成或达到或避免绝对结果。因此,在本文中使用术语“基本上”来捕获许多生物学和化学现象中固有的潜在完整性缺失。
产率:如本文所用,术语“产率”是指与作为起始材料的总mrna相比,包封后回收的mrna的百分比。在一些实施方案中,术语“回收率”与术语“产率”可互换使用。
在以下部分中详细描述了本发明的各个方面。部分的使用并不意在限制本发明。每个部分可以适用于本发明的任何方面。在本申请中,除非另有说明,否则“或”的使用意指“和/或”。
具体实施方式
本发明特别提供了脂质纳米颗粒制剂和核酸包封的改进方法。本发明部分基于以下令人惊讶的发现:即核酸包封可以使用控制脂质和核酸的混合比率的重力在大气压力下可重复地进行,以产生经包封的核酸。以这种方式使用重力,混合可以在不使用泵或除大气压之外的外部压力(例如泵压)的情况下进行。因此,用于控制本文所述的方法的流速的压力是大气压和排出压力(例如,管和储集器中的压力)。本文提供的包封方法确保了核酸(包括例如mrna)的稳定性,并且产生高包封效率(例如,约75%至95%之间或更高的包封效率)。
本文所述的包封方法允许在各种环境中使用所述方法,例如在大规模商业过程制造中,其中大量加压液体(诸如乙醇)可能带来安全性和操作问题。本文公开的包封方法的其他用途包括“病床边”商业过程制造,例如用于现场(诸如在医院药房)制备小规模商业产品。在又一个用途中,本文所述的方法可以用于现场商业过程制造环境,其中昂贵的设备和维护可以是有挑战性的。在又一个用途的实例中,本文所述的方法可以用于经包封的核酸的高通量制备,例如用于筛选目的,其中大量泵和其他机器的购买、校准和维护会抑制快速和高通量测试。
本文所述的包封方法可以应用于本领域描述的将mrna包封于脂质纳米颗粒中的各种其他方法。如本文所用,过程a是指通过将mrna与脂质混合物混合而无需首先将脂质预先形成为脂质纳米颗粒来包封mrna的常规方法。如本文所用,过程b是指通过将预先形成的脂质纳米颗粒与mrna混合来包封信使rna(mrna)的过程。与过程b相比,过程a不涉及脂质纳米颗粒的预先形成。过程a和过程b包括分别在wo2016004318和wo2018089801中描述的那些过程,这两个专利据此以引用的方式并入。在一些实施方案中,本文所述的包封方法可以用于制备空脂质纳米颗粒。
因此,本文提供的发明允许通过使用基于重力的混合过程在各种规模和环境下进行高效、可重复的核酸的脂质包封,以产生经包封的核酸。
核酸的基于重力的包封
在本公开的一个方面,提供了一种将核酸包封于脂质体中的方法。在一些实施方案中,所述包封方法包括:1)第一储集器,提供溶于水溶液的所期望的核酸;2)第二储集器,提供脂质和/或脂质纳米颗粒(lnp)的溶液;3)用于第一储集器和第二储集器的导管,允许核酸、脂质和/或lnp的流动;4)用于混合核酸和脂质和/或lnp的接头;以及5)用于收集lnp中的经混合/经包封的核酸的容纳件或导管。包封核酸的示例性方法的示意图如图1所示。
在一些实施方案中,所述包封方法包括:1)第一储集器,提供mrna溶液;2)第二储集器,提供脂质和/或脂质纳米颗粒(lnp)的溶液;3)用于第一储集器和第二储集器的导管,允许mrna溶液和脂质和/或lnp的流动;4)用于混合mrna和脂质和/或lnp的接头;以及5)用于收集lnp中的经混合包封的mrna的容纳件或导管。
在一些实施方案中,经包封的mrna适用于递送以进行体内蛋白质产生,所述递送包括将通过本文所述的方法产生的包封mrna的脂质纳米颗粒的组合物施用于受试者。因此,在一些实施方案中,提供了一种递送用于体内蛋白质产生的mrna的方法,所述递送包括将通过本文所述的方法产生的包封mrna的脂质纳米颗粒的组合物施用于受试者。
在本公开的另一个方面,本文所述的方法用于产生脂质体递送媒介物,例如,脂质纳米颗粒(lnp)或脂质体。在一些实施方案中,所述方法包括:1)储集器,提供一种或多种类型脂质的溶液;2)第二储集器,提供一种或多种类型脂质的另一种溶液;3)用于第一储集器和第二储集器的导管,允许脂质溶液的流动;4)用于混合脂质的接头;以及5)用于收集所产生的脂质体递送媒介物的容纳件或导管。在一些实施方案中,第一储集器和第二储集器具有相同的一种或多种类型脂质的溶液。
在本公开的另一个方面,提供了一种用于包封核酸的系统。因此,在一些实施方案中,所述系统包括:1)第一储集器,提供溶于水溶液的所期望的核酸;2)第二储集器,提供脂质和/或脂质纳米颗粒(lnp)的溶液;3)用于第一储集器和第二储集器的导管,允许核酸、脂质和/或lnp的流动;4)用于混合核酸和脂质和/或lnp的接头;以及5)用于收集lnp中的经混合/经包封的核酸的容纳件或导管。
基于重力的包封方法中的受控流速
设想了各种控制液体流速的方式以及所产生的混合过程,以实现核酸的可重复的包封。在一些实施方案中,通过调整储集器、导管和/或接头中的一者或多者的直径来控制液体流速。在实施方案中,通过使用特定直径的储集器、导管和/或接头来控制储集器、导管和/或接头的直径。在实施方案中,通过在储集器、导管和/或接头中的一者或多者中提供限流来调整储集器、导管和/或接头的直径。
因此,在实施方案中,通过在第一储集器和/或第二储集器中提供限流来控制液体流速和混合过程。在一些实施方案中,通过在储集器-导管连接部处提供限流来控制液体流速和混合过程。在一些实施方案中,通过在与第一储集器和/或第二储集器相关的导管中提供限流来控制液体流速和混合过程。在一些实施方案中,液体流速和混合过程通过在导管-接头连接部处提供限流来控制。在一些实施方案中,通过在接头中提供限流来控制液体流速和混合过程。提供上述限流中的任何一者或多者允许微调液体流速和混合过程。
在一些实施方案中,通过调整储集器、导管和/或接头中的一者或多者的直径来控制液体流动和混合过程。因此,在一些实施方案中,将第一储集器和/或第二储集器的直径调整至所期望的直径,从而提供与第一储集器相关的第一直径和与第二储集器相关的第二直径。设想了实现所期望的直径的任何方法,包括例如使用被制造为具有一定直径的储集器,或将限流器放置于储集器上以实现所期望的直径。在一些实施方案中,第一储集器的直径约在1cm-100cm、100cm-1dm、1dm-100dm、10m-50m之间。在一些实施方案中,第二储集器的直径在1cm-100cm、100cm-1dm、1dm-100dm、10m-50m之间。在一些实施方案中,第一储集器和第二储集器具有相同的直径。在一些实施方案中,第一储集器的直径大于第二储集器的直径。在一些实施方案中,第二储集器的直径大于第一储集器的直径。在一些实施方案中,第一储集器的直径为第二储集器的直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。在一些实施方案中,第二储集器的直径为第二储集器的直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。
在一些实施方案中,通过调整导管中的一者或多者的直径来控制液体流动和混合过程。在一些实施方案中,过程使用如图1所描绘的第一导管和第二导管,从而提供与第一导管相关的第一直径和与第二导管相关的第二直径。第一导管和第二导管的所期望直径通过本领域已知的任何方法来实现,例如通过使用具有特定制造直径的导管,或通过在导管上放置限流器以实现所期望的导管直径。在一些实施方案中,第一导管的直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm、100cm-1dm、1dm-100dm、100dm-1m之间。在一些实施方案中,第一导管约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm之间。在一些实施方案中,第二导管的直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm、100cm-1dm、1dm-100dm、100dm-1m之间。在一些实施方案中,第二导管的直径约在0.1mm-1mm、1mm-100mm、100mm-1cm和1cm-100cm之间。在一些实施方案中,第一导管和第二导管具有相等的直径。在实施方案中,第一导管的直径大于第二导管。在实施方案中,第二导管的直径大于第一导管。在实施方案中,第一导管的直径为第二导管的直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。在实施方案中,第二导管的直径为第二导管的直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。
在一些实施方案中,液体流动和混合过程通过调整储集器-导管连接部处的直径来控制。在一些实施方案中,过程具有分别与储集器1和储集器2相关的第一储集器-导管连接部和第二储集器-导管连接部,并且如图1所描绘,从而提供与第一储集器-导管连接部相关的第一直径和与第二储集器-导管连接部相关的第二直径。第一储集器-导管和第二储集器-导管连接部的所期望直径通过本领域已知的任何方法来实现,例如通过使用具有特定制造直径的储集器-导管连接部,或通过将限流器放置于储集器-导管连接部上,以实现所期望的储集器-导管连接部直径。在一些实施方案中,第一储集器-导管连接部的直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm、100cm-1dm、1dm-100dm、100dm-1m之间。在一些实施方案中,第一储集器-导管约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm之间。在一些实施方案中,第二储集器-导管的直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm、100cm-1dm、1dm-100dm、100dm-1m之间。在一些实施方案中,第二储集器-导管的直径约在0.1mm-1mm、1mm-100mm、100mm-1cm和1cm-100cm之间。在一些实施方案中,第一储集器-导管和第二储集器-导管具有相等的直径。在一些实施方案中,第一储集器-导管的直径大于第二储集器-导管。在一些实施方案中,第二储集器-导管的直径大于第一储集器-导管。在一些实施方案中,第一储集器-导管的直径为第二储集器-导管的直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。在一些实施方案中,第二储集器-导管的直径为第二储集器-导管的直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。
在一些实施方案中,通过调整接头处的直径来控制液体流动和混合过程。在一些实施方案中,接头是t形连接器或y形连接器。在一些实施方案中,接头是t形连接器。在一些实施方案中,接头是y形连接器。在一些实施方案中,过程具有接头,所述接头具有连接至第一导管的第一直径,并且所述接头具有连接至第二导管的第二直径。图1中描绘了与第一导管和第二导管的接头和相关的接头。接头的第一直径和第二直径的所期望直径通过本领域已知的任何方法来实现,例如通过使用具有特定制造的第一直径和/或第二直径的接头,或通过在接头的第一直径和/或第二直径处放置限流器,以实现所期望的储集器-导管连接部直径。在一些实施方案中,接头的第一直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm、100cm-1dm、1dm-100dm、100dm-1m之间。在一些实施方案中,接头的第一直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm之间。在一些实施方案中,接头的第二直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、1cm-100cm、100cm-1dm、1dm-100dm、100dm-1m之间。在一些实施方案中,接头的第二直径约在0.1mm-1mm、1mm-100mm、100mm-1cm、以及1cm-100cm之间。在一些实施方案中,接头的第一直径和第二直径相等。在一些实施方案中,接头的第一直径大于接头的第二直径。在一些实施方案中,接头的第二直径大于接头的第一直径。在一些实施方案中,接头的第一直径为接头的第二直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。在一些实施方案中,接头的第二直径为接头的第二直径的1.2×、1.5×、1.8×、2.0×、2.5×或更大。
如上文所述调整第一直径和第二直径允许获得受控流速从而获得受控的混合过程。第一直径的调整允许产生第一流速,并且第二直径的调整允许产生第二流速。在一些实施方案中,第一直径与第二直径相同。在一些实施方案中,第一直径与第二直径不同。在一些实施方案中,第一直径大于第二直径。在一些实施方案中,第一直径大于第二直径的量提供第一受控流速与第二受控流速的比率。在一些实施方案中,第一受控流速与第二受控流速的比率为约1:1、2:1、3:1、4:1、5:1、10:1、1:1或更大、2:1或更大、3:1或更大、或者4:1或更大、或者5:1或更大、或者10:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约1:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约1:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约2:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约2:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约3:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约3:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约4:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约4:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约5:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约5:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约10:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约10:1或更大。在一些实施方案中,过程a的第一受控流速与第二受控流速的比率为约1:1。在一些实施方案中,过程a的第一受控流速与第二受控流速的比率为约2:1。在一些实施方案中,过程a的第一受控流速与第二受控流速的比率为约3:1。在一些实施方案中,过程a的第一受控流速与第二受控流速的比率为约4:1。在一些实施方案中,过程a的第一受控流速与第二受控流速的比率为约5:1。在一些实施方案中,过程a的第一受控流速与第二受控流速的比率为约1:1。在一些实施方案中,过程b的第一受控流速与第二受控流速的比率为约1:1。在一些实施方案中,过程b的第一受控流速与第二受控流速的比率为约2:1。在一些实施方案中,过程b的第一受控流速与第二受控流速的比率为约3:1。在一些实施方案中,过程b的第一受控流速与第二受控流速的比率为约4:1。
在一些实施方案中,第二直径大于第一直径的量提供第一受控流速与第二受控流速的比率。在一些实施方案中,第二受控流速与第一受控流速的比率为约1:1、2:1、3:1、4:1、5:1、10:1、1:1或更大、2:1或更大、3:1或更大、或者4:1或更大、或者5:1或更大、或者10:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约1:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约1:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约2:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约2:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约3:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约3:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约4:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约4:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约5:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约5:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约10:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约10:1或更大。
如本文所述的直径的调整用于产生受控流速,以实现核酸与脂质的所期望的混合。在一些实施方案中,第一受控流速得以实现,其中所述流速为约0.1-1ml/min、1-150ml/min、150-250ml/min、250-500ml/min、500-1000ml/min、1000-2000ml/min、2000-3000ml/min、3000-4000ml/min或4000-5000ml/min。在一些实施方案中,第一受控流速为约0.1-1ml/min。在一些实施方案中,第一受控流速为约1-150ml/min。在一些实施方案中,第一受控流速为约150-250ml/min。在一些实施方案中,第一受控流速为约250-500ml/min。在一些实施方案中,第一受控流速为约500-1000ml/min。在一些实施方案中,第一受控流速为约1000-2000ml/min。在一些实施方案中,第一受控流速为约2000-3000ml/min。在一些实施方案中,第一受控流速为约3000-4000ml/min。在一些实施方案中,第一受控流速为约4000-5000ml/min。在一些实施方案中,第一受控流速约在150和250ml/min之间(例如约150ml/min、155ml/min、160ml/min、165ml/min、170ml/min、175ml/min、180ml/min、185ml/min、190ml/min、195ml/min、200ml/min、205ml/min、210ml/min、215ml/min、220ml/min、225ml/min、230ml/min、235ml/min、240ml/min、245ml/min或250ml/min)。
在一些实施方案中,第二受控流速得以实现,其中所述流速为约0.1-1ml/min、1-150ml/min、150-250ml/min、250-500ml/min、500-1000ml/min、1000-2000ml/min、2000-3000ml/min、3000-4000ml/min或4000-5000ml/min。在一些实施方案中,第二受控流速为约0.1-1ml/min。在一些实施方案中,第二受控流速为约1-150ml/min。在一些实施方案中,第二受控流速为约150-250ml/min。在一些实施方案中,第二受控流速为约250-500ml/min。在一些实施方案中,第二受控流速为约500-1000ml/min。在一些实施方案中,第二受控流速为约1000-2000ml/min。在一些实施方案中,第二受控流速为约2000-3000ml/min。在一些实施方案中,第二受控流速为约3000-4000ml/min。在一些实施方案中,第二受控流速为约4000-5000ml/min。在一些实施方案中,第二受控流速约在25和75ml/min之间(例如约25ml/min、26ml/min、27ml/min、28ml/min、29ml/min、30ml/min、31ml/min、32ml/min、33ml/min、34ml/min、35ml/min、36ml/min、37ml/min、38ml/min、39ml/min、40ml/min、41ml/min、42ml/min、43ml/min、44ml/min、45ml/min、46ml/min、47ml/min、48ml/min、49ml/min、50ml/min、51ml/min、52ml/min、53ml/min、54ml/min、55ml/min、56ml/min、57ml/min、58ml/min、59ml/min、60ml/min、61ml/min、62ml/min、63ml/min、64ml/min、65ml/min、66ml/min、67ml/min、68ml/min、69ml/min、70ml/min、71ml/min、72ml/min、73ml/min、74ml/min或75ml/min)。在一些实施方案中,第一受控流速为约50ml/min。
在一些实施方案中,第一受控流速与第二受控流速的比率为约1:1、2:1、3:1、4:1、5:1、10:1、1:1或更大、2:1或更大、3:1或更大、或者4:1或更大、或者5:1或更大、或者10:1或更大。因此,在一些实施方案中,第一受控流速与第二受控流速的比率为约1:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约2:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约3:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约4:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约5:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约10:1。在一些实施方案中,第一受控流速与第二受控流速的比率为约1:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约2:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约3:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约4:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约5:1或更大。在一些实施方案中,第一受控流速与第二受控流速的比率为约10:1或更大。
在一些实施方案中,第二受控流速与第一受控流速的比率为约1:1、2:1、3:1、4:1、5:1、10:1、1:1或更大、2:1或更大、3:1或更大、或者4:1或更大、或者5:1或更大、或者10:1或更大。因此,在一些实施方案中,第二受控流速与第一受控流速的比率为约1:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约2:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约3:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约4:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约5:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约10:1。在一些实施方案中,第二受控流速与第一受控流速的比率为约1:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约2:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约3:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约4:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约5:1或更大。在一些实施方案中,第二受控流速与第一受控流速的比率为约10:1或更大。
在一些实施方案中,第一流速是受控的,并且第二流速是不受控的。例如,在一些实施方案中,将一个流动以受控流速混合到含有所期望的组分的储集器中。因此,在一些实施方案中,核酸溶液的流速是受控的。在一些实施方案中,脂质溶液或lnp的流速是受控的。在一些实施方案中,核酸溶液的流速是受控的,并且脂质溶液或lnp的流速是受控的。在一些实施方案中,第一流动包含核苷酸。在一些实施方案中,第二流动包含脂质溶液或lnp。在一些实施方案中,第一流动和第二流动包含核酸。在一些实施方案中,核酸可以是dna或rna。在一些实施方案中,第一流动和第二流动包含脂质溶液或lnp。
基于重力的包封方法–受控混合
在一些实施方案中,将含有溶解的脂质的脂质溶液和水性或缓冲溶液混合到溶液中,使得脂质可以形成没有mrna的纳米颗粒(或空的预先形成的脂质纳米颗粒)。在一些实施方案中,将mrna溶液和预先形成的脂质纳米颗粒溶液混合到溶液中,使得mrna变成被包封在脂质纳米颗粒中。这种溶液也被称为调配物或包封溶液。合适的调配物或包封溶液包括溶剂,诸如乙醇。例如,合适的调配物或包封溶液包括约10%乙醇、约15%乙醇、约20%乙醇、约25%乙醇、约30%乙醇、约35%乙醇或约40%乙醇。
控制本文所述的方法中的流速允许核酸在脂质中的可重复的包封。本文所述的方法中的受控流速还允许脂质纳米颗粒(lnp)的可重复的产生。受控流速实现了第一流动和第二流动的组分的可重复的混合。在一些实施方案中,第一流动和第二流动的混合在如图1所描绘的接头处发生。在一些实施方案中,接头是t型连接器(也称为“t字形”连接器)或“y”型连接器。在一些实施方案中,接头是t-连接器。在一些实施方案中,接头是y型连接器。在一些实施方案中,t-连接器具有对称臂、不对称臂或具有不同直径的臂。在一些实施方案中,t-连接器具有对称臂。在一些实施方案中,t-连接器具有不对称臂。在一些实施方案中,t-连接器含有具有不同直径的臂。在一些实施方案中,y-连接器具有对称臂、不对称臂或具有不同直径的臂。在一些实施方案中,y-连接器具有对称臂。在一些实施方案中,y-连接器具有不对称臂。在一些实施方案中,y-连接器含有具有不同直径的臂。在一些实施方案中,流速和所产生的混合过程受到在接头处的连接器的一个或多个臂的直径的控制。在一些实施方案中,连接器的臂的直径受到放置于臂上的限流器的控制。在一些实施方案中,连接器臂的直径是预制的。在一些实施方案中,流速受到放置于连接器的一个或多个臂处的旋塞的控制。
在一些实施方案中,将包含核酸的第一导管连接在t-连接器或y-连接器的一个臂处,并且将包含脂质溶液或lnp的第二导管连接在t-连接器或y-连接器接头的另一个臂处,从而在t-连接器或y-连接器接头处混合来自第一导管和第二导管的溶液。溶液的混合引起核酸在脂质纳米颗粒中的包封。
在一些实施方案中,将包含mrna第一导管连接在t-连接器或y-连接器的一个臂处,并且将包含脂质溶液或lnp的第二导管连接在t-连接器或y-连接器接头的另一个臂处,从而在t-连接器或y-连接器接头处混合来自第一导管和第二导管的溶液。溶液的混合引起mrna在脂质纳米颗粒中的包封。
在一些实施方案中,将包含第一脂质溶液的第一导管连接在t-连接器或y-连接器的一个臂处,并且将包含第二脂质溶液的第二导管连接在t-连接器或y-连接器接头的另一个臂处,从而在t-连接器或y-连接器接头处混合来自第一导管和第二导管的溶液。溶液的混合引起液体纳米颗粒(lnp)的产生。在一些实施方案中,第一脂质溶液和第二脂质溶液是相同的。在一些实施方案中,第一脂质溶液是阳离子脂质溶液,并且第二脂质溶液是非阳离子(在本文中也称为“辅助脂质”)脂质溶液。在一些实施方案中,第一脂质溶液是阳离子脂质溶液,并且第二脂质溶液是peg化的脂质溶液。在一些实施方案中,第一脂质溶液是非阳离子脂质溶液,并且第二脂质溶液是peg化的脂质溶液。在一些实施方案中,第一脂质溶液是阳离子脂质溶液,并且第二脂质溶液是基于胆固醇的脂质溶液。在一些实施方案中,第一脂质溶液是基于胆固醇的脂质溶液,并且第二脂质溶液是非阳离子脂质溶液。在一些实施方案中,第一脂质溶液是基于胆固醇的脂质溶液,并且第二脂质溶液是peg化的脂质溶液。在一些实施方案中,脂质溶液包含预先形成的脂质纳米颗粒。在一些实施方案中,脂质溶液包括预先形成的脂质纳米颗粒的悬浮液。
在一些实施方案中,第一流动包含mrna溶液,并且第二流动包含脂质溶液。在实施方案中,第一流动包含约在50%-99%之间的水(例如50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的水)。在一些实施方案中,第一流动包含约50%的水。在一些实施方案中,第一流动包含约55%的水。在一些实施方案中,第一流动包含约60%的水。在一些实施方案中,第一流动包含约65%的水。在一些实施方案中,第一流动包含约70%的水。在一些实施方案中,第一流动包含约75%的水。在一些实施方案中,第一流动包含约80%的水。在一些实施方案中,第一流动包含约85%的水。在一些实施方案中,第一流动包含约90%的水。在一些实施方案中,第一流动包含约95%的水。在一些实施方案中,第一流动包含约96%的水。在一些实施方案中,第一流动包含约97%的水。在一些实施方案中,第一流动包含约98%的水。在一些实施方案中,第一流动包含约99%的水。
在一些实施方案中,第二流动包含约在50%-99%之间的乙醇(例如50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的乙醇)。在一些实施方案中,第二流动包含约50%的乙醇。在一些实施方案中,第二流动包含约55%的乙醇。在一些实施方案中,第二流动包含约60%的乙醇。在一些实施方案中,第二流动包含约65%的乙醇。在一些实施方案中,第二流动包含约70%的乙醇。在一些实施方案中,第二流动包含约75%的乙醇。在一些实施方案中,第二流动包含约80%的乙醇。在一些实施方案中,第二流动包含约85%的乙醇。在一些实施方案中,第二流动包含约90%的乙醇。在一些实施方案中,第二流动包含约95%的乙醇。在一些实施方案中,第二流动包含约96%的乙醇。在一些实施方案中,第二流动包含约97%的乙醇。在一些实施方案中,第二流动包含约98%的乙醇。在一些实施方案中,第二流动包含约99%的乙醇。
在一些实施方案中,第一流和第二流的混合产生包含约5%-60%的乙醇(例如约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或60%的乙醇)的混合物。在实施方案中,第一流和第二流的混合产生包含约5%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约10%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约15%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约20%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约25%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约30%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约35%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约40%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约45%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约50%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约55%的乙醇的混合物。在实施方案中,第一流和第二流的混合产生包含约60%的乙醇的混合物。
本文所述的方法实现了可重复的高核酸包封效率。在一些实施方案中,使用本文所述的方法,将mrna以约在60%-100%之间的效率(例如,约75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、98%或99%的包封效率)包封于脂质中。在一些实施方案中,将mrna以约60%的效率包封于脂质中。在一些实施方案中,将mrna以约65%的效率包封于脂质中。在一些实施方案中,将mrna以约70%的效率包封于脂质中。在一些实施方案中,将mrna以约75%的效率包封于脂质中。在一些实施方案中,将mrna以约76%的效率包封于脂质中。在一些实施方案中,将mrna以约77%的效率包封于脂质中。在一些实施方案中,将mrna以约78%的效率包封于脂质中。在一些实施方案中,将mrna以约79%的效率包封于脂质中。在一些实施方案中,将mrna以约80%的效率包封于脂质中。在一些实施方案中,将mrna以约81%的效率包封于脂质中。在一些实施方案中,将mrna以约82%的效率包封于脂质中。在一些实施方案中,将mrna以约83%的效率包封于脂质中。在一些实施方案中,将mrna以约84%的效率包封于脂质中。在一些实施方案中,将mrna以约85%的效率包封于脂质中。在一些实施方案中,将mrna以约86%的效率包封于脂质中。在一些实施方案中,将mrna以约87%的效率包封于脂质中。在一些实施方案中,将mrna以约88%的效率包封于脂质中。在一些实施方案中,将mrna以约89%的效率包封于脂质中。在一些实施方案中,将mrna以约90%的效率包封于脂质中。在一些实施方案中,将mrna以约91%的效率包封于脂质中。在一些实施方案中,将mrna以约92%的效率包封于脂质中。在一些实施方案中,将mrna以约93%的效率包封于脂质中。在一些实施方案中,将mrna以约94%的效率包封于脂质中。在一些实施方案中,将mrna以约95%的效率包封于脂质中。
使用本文所述的方法的包封的核酸具有约40-150nm的纳米颗粒粒度。在一些实施方案中,包封效率为约60%。在一些实施方案中,包封效率为约65%。在一些实施方案中,包封效率为约70%。在一些实施方案中,包封效率为约75%。在一些实施方案中,包封效率为约80%。在一些实施方案中,包封效率为约85%。在一些实施方案中,包封效率为约90%。在一些实施方案中,包封效率为约95%。在一些实施方案中,包封效率为约96%。在一些实施方案中,包封效率为约97%。在一些实施方案中,包封效率为约98%。在一些实施方案中,包封效率为约99%。
本文所述的方法具有大量的mrna回收率。在实施方案中,方法产生至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的mrna回收率。在实施方案中,方法产生至少约50%的mrna回收率。在实施方案中,方法产生至少约55%的mrna回收率。在实施方案中,方法产生至少约60%的mrna回收率。在实施方案中,方法产生至少约65%的mrna回收率。在实施方案中,方法产生至少约70%的mrna回收率。在实施方案中,方法产生至少约75%的mrna回收率。在实施方案中,方法产生至少约80%的mrna回收率。在实施方案中,方法产生至少约85%的mrna回收率。在实施方案中,方法产生至少约90%的mrna回收率。在实施方案中,方法产生至少约95%的mrna回收率。在实施方案中,方法产生至少约96%的mrna回收率。在实施方案中,方法产生至少约97%的mrna回收率。在实施方案中,方法产生至少约98%的mrna回收率。在实施方案中,方法产生至少约99%的mrna回收率。
在一些实施方案中,方法产生至少约0.1mg、0.5mg、1mg、5mg、10mg、100mg、500mg或1,000mg的经包封的mrna。在一些实施方案中,方法产生至少约0.1mg的经包封的mrna。在一些实施方案中,方法产生至少约0.5mg的经包封的mrna。在一些实施方案中,方法产生至少约1mg的经包封的mrna。在一些实施方案中,方法产生至少约5mg的经包封的mrna。在一些实施方案中,方法产生至少约10mg的经包封的mrna。在一些实施方案中,方法产生至少约100mg的经包封的mrna。在一些实施方案中,方法产生至少约500mg的经包封的mrna。在一些实施方案中,方法产生至少约1000mg的经包封的mrna。
在一些实施方案中,第一流和第二流的混合同时发生。在一些实施方案中,第一流和第二流的混合不同步发生。
在一些实施方案中,本文公开的方法的使用产生不需要进一步纯化的脂质纳米颗粒。
高通量制剂
基于重力的包封方法是可构造的,从而可以设想多个流动。多个流动可以实现高通量方法。在实施方案中,实现了流水线操作方式,其中液体被同时添加至储集器对,随后液体被连续添加至接下来的储集器对。图7和图8中示出了描绘多个流的基于重力的包封方法的实施方案。在一些实施方案中,使用第一导管流(流动1)和第二导管流(流动2)的多个配对。例如,在一些实施方案中,方法包括第一导管流和第二导管流的至少约1个、5个、10个、20个、30个、40个、50个、100个、150个、200个、250个或300个配对。在一些实施方案中,方法包括第一导管流和第二导管流的1个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约5个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约10个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约20个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约30个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约40个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约50个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约100个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约150个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约200个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约250个配对。在一些实施方案中,方法包括第一导管流和第二导管流的约300个配对。
在一些实施方案中,每个单独的第一流提供不同的核酸溶液。在一些实施方案中,每个单独的第一流提供相同的核酸。在一些实施方案中,每个单独的第一流提供不同的mrna溶液。在一些实施方案中,每个单独的第一流提供相同的mrna溶液。在一些实施方案中,每个单独的第二流提供不同的脂质溶液。在一些实施方案中,每个单独的第二流提供相同的脂质溶液。
信使(mrna)
本文所述的基于重力的包封方法可以与任何类型的核酸一起使用。在一些实施方案中,核酸是rna,包括例如信使rna(mrna)、反义rna(arna)、小干扰rna(sirna)、crisprrna(crrna)、长非编码rna(lncrna)、微rna(mirna)、piwi相互作用rna(pirna)、短发夹rna(shrna)、反式作用sirna(tasirna)、重复序列相关的sirna(rasirna)、7skrna(7sk)、增强子rna(erna)、核糖体rna(rrna)、信号识别颗粒rna(srprna)、转运rna(trna)、小核rna(snrna)、小核仁rna(snorna)、smyrna(smy)、小卡哈尔(cajal)体特异性rna(scarna)和向导rna(grna)。在实施方案中,rna是mrna。
本发明可以用于包封任何mrna。mrna通常被认为是将信息从dna携带到核糖体的rna类型。mrna的存在通常非常短暂,并且包括加工和翻译,然后是降解。通常,在真核生物体中,mrna加工包括在n(5')末端添加一个“帽”,和在c(3')末端添加一个“尾巴”。典型的帽是7-甲基鸟苷帽,其是通过5'-5'-三磷酸键与第一个转录的核苷酸连接的鸟苷。帽的存在对于提供对存在于大多数真核细胞中的核酸酶的抗性很重要。尾巴通常是聚腺苷酸化事件,由此聚腺苷酰基部分被添加到mrna分子的3'末端。这种“尾巴”的存在用于保护mrna免受核酸外切酶降解。信使rna被核糖体翻译成组成蛋白质的一系列氨基酸。
可以根据多种已知方法中的任一种合成mrna。例如,可以经由体外转录(ivt)来合成根据本发明的mrna。简而言之,ivt通常使用线性或环状dna模板进行,该模板包含启动子,三磷酸核糖核苷酸库,可能包含dtt和镁离子的缓冲系统以及适当的rna聚合酶(例如,t3、t7或sp6rna聚合酶),dnasei,焦磷酸酶和/或rnase抑制剂。确切条件将根据具体应用而改变。
在一些实施方案中,可以在调配和包封之前纯化体外合成的mrna,以除去不期望的杂质(包括在mrna合成过程中使用的各种酶和其他试剂)。
本发明可以用于调配和包封各种长度的mrna。在一些实施方案中,本发明可以用于调配和包封长度等于或大于约1kb、1.5kb、2kb、2.5kb、3kb、3.5kb、4kb、4.5kb、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kb、15kb或20kb的体外合成的mrna。在一些实施方案中,本发明可以用于调配和包封长度在约1-20kb、约1-15kb、约1-10kb、约5-20kb、约5-15kb、约5-12kb、约5-10kb、约8-20kb或约8-15kb范围内的体外合成的mrna。
本发明可以用于调配和包封未经修饰的mrna或者含有通常增强稳定性的一个或多个修饰的mrna。在一些实施方案中,修饰选自经修饰的核苷酸、经修饰的糖磷酸主链、5’和/或3’非翻译区。
在一些实施方案中,mrna的修饰可以包括rna的核苷酸的修饰。根据本发明的经修饰的mrna可以包括例如主链修饰、糖修饰或碱基修饰。在一些实施方案中,mrna可以由天然存在的核苷酸和/或核苷酸类似物(修饰的核苷酸)合成,包括但不限于嘌呤(腺嘌呤(a)、鸟嘌呤(g))或嘧啶(胸腺嘧啶(t)、胞嘧啶(c)、尿嘧啶(u)),以及嘌呤和嘧啶的修饰的核苷酸类似物或衍生物,诸如1-甲基腺嘌呤、2-甲基腺嘌呤、2-甲硫基-n-6-异戊烯基腺嘌呤、n6-甲基腺嘌呤、n6-异戊烯基腺嘌呤、2-硫代胞嘧啶、3-甲基胞嘧啶、4-乙酰基胞嘧啶、5-甲基胞嘧啶,2,6-二氨基嘌呤、1-甲基鸟嘌呤、2-甲基鸟嘌呤、2,2-二甲基鸟嘌呤、7-甲基鸟嘌呤、肌苷、1-甲基肌苷、假尿嘧啶(5-尿嘧啶)、二氢尿嘧啶、2-硫尿嘧啶、4-硫尿嘧啶、5-羧甲基氨基甲基-2-硫尿嘧啶、5-(羧羟甲基)尿嘧啶、5-氟尿嘧啶、5-溴尿嘧啶、5-羧甲基氨基甲基尿嘧啶、5-甲基-2-硫尿嘧啶、5-甲基尿嘧啶、n-尿嘧啶-5-氧乙酸甲酯、5-甲基氨基甲基尿嘧啶、5-甲氧基氨基甲基-2-硫尿嘧啶、5'-甲氧基羰基甲基尿嘧啶、5-甲氧基尿嘧啶、尿嘧啶-5-氧乙酸甲酯、尿嘧啶-5-氧乙酸(v)、1-甲基假尿嘧啶、辫苷、β-d-甘露糖基辫苷、怀丁氧苷和焦磷酰胺、硫代磷酸酯、肽核苷酸、甲基膦酸酯、7-脱氮鸟苷、5-甲基胞嘧啶和肌苷。此类类似物的制备是本领域的技术人员已知的,例如来自美国专利号4,373,071、美国专利号4,401,796、美国专利号4,415,732、美国专利号4,458,066、美国专利号4,500,707、美国专利号4,668,777、美国专利号4,973,679、美国专利号5,047,524、美国专利号5,132,418、美国专利号5,153,319、美国专利号5,262,530和5,700,642,这些专利的全部公开内容以引用的方式包括于本文中。
通常,mrna合成包括在n(5')末端添加一个“帽”,在c(3')末端添加一个“尾巴”。帽的存在对于提供对存在于大多数真核细胞中的核酸酶的抗性很重要。“尾巴”的存在用于保护mrna免受核酸外切酶降解。
因此,在一些实施方案中,mrna包括5’帽结构。通常按如下方式添加5’帽:首先,rna末端磷酸酶从5’核苷酸除去一个末端磷酸基团,剩下两个末端磷酸酯;然后通过鸟苷酸转移酶将三磷酸鸟苷(gtp)加入末端磷酸酯中,产生5’5’5三磷酸酯键;然后用甲基转移酶将鸟嘌呤的7-氮甲基化。2’-o-甲基化也可以出现在7-甲基鸟苷三磷酸残基之后的第一碱基和/或第二碱基处。帽结构的实例包括但不限于m7gpppnp-rna、m7gpppnmp-rna和m7gpppnmpnmp-rna(其中m表示2’-o-甲基残基)。
在一些实施方案中,mrna包括5’和/或3’非翻译区。在一些实施方案中,5’非翻译区包括一个或多个影响mrna的稳定性或翻译的元件,例如铁应答元件。在一些实施方案中,5’非翻译区的长度可以在约50和500个核苷酸之间。
在一些实施方案中,3’非翻译区包括一个或多个聚腺苷酸化信号,影响mrna在细胞中定位稳定性的蛋白质结合位点,或一个或多个mirna结合位点。在一些实施方案中,3’非翻译区的长度可以在50和500个核苷酸之间或更长。
虽然在一些实施方案中体外转录反应所提供的mrna是所期望的,但是在本发明的范围内设想了mrna的其他来源,包括从细菌、真菌、植物和/或动物产生的mrna。
在一些实施方案中,本文所述的方法中使用的mrna是未经修饰的。在一些实施方案中,本文公开的方法中使用的mrna是经修饰的。在一些实施方案中,本文所述的方法中使用的mrna是经密码子优化的。
本发明可以用于调配和包封编码各种蛋白质的mrna。
mrna溶液
可以在溶液中提供mrna以与脂质溶液混合,使得可以将mrna包封在脂质纳米颗粒中。合适的mrna溶液可以是含有待以各种浓度包封的mrna的任何水溶液。例如,合适的mrna溶液可以含有浓度等于或大于约0.01mg/ml、0.05mg/ml、0.06mg/ml、0.07mg/ml、0.08mg/ml、0.09mg/ml、0.1mg/ml、0.15mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml、0.6mg/ml、0.7mg/ml、0.8mg/ml、0.9mg/ml、或1.0mg/ml的mrna。在一些实施方案中,合适的mrna溶液可以含有浓度范围为约0.01-1.0mg/ml、0.01-0.9mg/ml、0.01-0.8mg/ml、0.01-0.7mg/ml、0.01-0.6mg/ml、0.01-0.5mg/ml、0.01-0.4mg/ml、0.01-0.3mg/ml、0.01-0.2mg/ml、0.01-0.1mg/ml、0.05-1.0mg/ml、0.05-0.9mg/ml、0.05-0.8mg/ml、0.05-0.7mg/ml、0.05-0.6mg/ml、0.05-0.5mg/ml、0.05-0.4mg/ml、0.05-0.3mg/ml、0.05-0.2mg/ml、0.05-0.1mg/ml、0.1-1.0mg/ml、0.2-0.9mg/ml、0.3-0.8mg/ml、0.4-0.7mg/ml、或0.5-0.6mg/ml的mrna。在一些实施方案中,合适的mrna溶液可以含有浓度最多约5.0mg/ml、4.0mg/ml、3.0mg/ml、2.0mg/ml、1.0mg/ml、.09mg/ml、0.08mg/ml、0.07mg/ml、0.06mg/ml、或0.05mg/ml的mrna。
通常,合适的mrna溶液还可以含有缓冲剂和/或盐。一般来讲,缓冲剂可以包括hepes、硫酸铵、碳酸氢钠、柠檬酸钠、乙酸钠、磷酸钾和磷酸钠。在一些实施方案中,缓冲剂的合适浓度可以在约0.1mm至100mm、0.5mm至90mm、1.0mm至80mm、2mm至70mm、3mm至60mm、4mm至50mm、5mm至40mm、6mm至30mm、7mm至20mm、8mm至15mm、或9至12mm的范围内。在一些实施方案中,缓冲剂的合适浓度为或大于约0.1mm、0.5mm、1mm、2mm、4mm、6mm、8mm、10mm、15mm、20mm、25mm、30mm、35mm、40mm、45mm或50mm。
示例性的盐可包括氯化钠、氯化镁和氯化钾。在一些实施方案中,mrna溶液中盐的合适浓度可以在约1mm至500mm、5mm至400mm、10mm至350mm、15mm至300mm、20mm至250mm、30mm至200mm、40mm至190mm、50mm至180mm、50mm至170mm、50mm至160mm、50mm至150mm、或50mm至100mm的范围内。在合适的mrna溶液中的盐浓度为或大于约1mm、5mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm或100mm。
在一些实施方案中,合适的mrna溶液可以具有在约3.5-6.5、3.5-6.0、3.5-5.5.、3.5-5.0、3.5-4.5、4.0-5.5、4.0-5.0、4.0-4.9、4.0-4.8、4.0-4.7、4.0-4.6、或4.0-4.5范围内的ph。在一些实施方案中,合适的mrna溶液可以具有为或不大于约3.5、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.2、5.4、5.6、5.8、6.0、6.1、6.3和6.5的ph。
可以使用各种方法来制备适合用于本发明的mrna溶液。在一些实施方案中,可以将mrna直接溶解在本文所述的缓冲溶液中。在一些实施方案中,可以通过在与脂质溶液混合以进行包封之前将mrna储液与缓冲溶液混合来产生mrna溶液。在一些实施方案中,可以通过在与脂质溶液混合以进行包封之前立即将mrna储液与缓冲溶液混合来产生mrna溶液。在一些实施方案中,合适的mrna储备溶液可以在水中含有浓度为或大于约0.2mg/ml、0.4mg/ml、0.5mg/ml、0.6mg/ml、0.8mg/ml、1.0mg/ml、1.2mg/ml、1.4mg/ml、1.5mg/ml、or1.6mg/ml、2.0mg/ml、2.5mg/ml、3.0mg/ml、3.5mg/ml、4.0mg/ml、4.5mg/ml、或5.0mg/ml的mrna。
在一些实施方案中,使用泵将mrna储液与缓冲溶液混合。示例性的泵包括但不限于齿轮泵、蠕动泵和离心泵。
通常,以比mrna储液的流速更大的流速混合缓冲溶液。例如,缓冲溶液可以以mrna储液的流速至少大1×、2×、3×、4×、5×、6×、7×、8×、9×、10×、15×或20×的流速混合。在一些实施方案中,以在约100-6000ml/min(例如,约100-300ml/min、300-600ml/min、600-1200ml/min、1200-2400ml/min、2400-3600ml/min、3600-4800ml/min、4800-6000ml/min、或60-420ml/min)之间范围内的流速混合缓冲溶液。在一些实施方案中,以等于或大于约60ml/min、100ml/min、140ml/min、180ml/min、220ml/min、260ml/min、300ml/min、340ml/min、380ml/min、420ml/min、480ml/min、540ml/min、600ml/min、1200ml/min、2400ml/min、3600ml/min、4800ml/min、或6000ml/min的流速混合缓冲溶液。
在一些实施方案中,以在约10-600ml/min(例如,约5-50ml/min、约10-30ml/min、约30-60ml/min、约60-120ml/min、约120-240ml/min、约240-360ml/min、约360-480ml/min、或约480-600ml/min)之间范围内的流速混合mrna储液。在一些实施方案中,以等于或大于约5ml/min、10ml/min、15ml/min、20ml/min、25ml/min、30ml/min、35ml/min、40ml/min、45ml/min、50ml/min、60ml/min、80ml/min、100ml/min、200ml/min、300ml/min、400ml/min、500ml/min、或600ml/min的流速混合mrna储液。
脂质溶液
根据本发明,脂质溶液含有适合于形成用于包封mrna的脂质纳米颗粒的脂质混合物。在一些实施方案中,合适的脂质溶液是基于乙醇的。例如,合适的脂质溶液可以含有溶解在纯乙醇(即,100%乙醇)中的所需脂质的混合物。在另一个实施方案中,合适的脂质溶液是基于异丙醇的。在另一个实施方案中,合适的脂质溶液是基于二甲基亚砜的。在另一个实施方案中,合适的脂质溶液是合适溶剂(包括但不限于乙醇、异丙醇和二甲基亚砜)的混合物。
合适的脂质溶液可以含有各种浓度的所需脂质的混合物。例如,合适的脂质溶液可以含有总浓度等于或大于约0.1mg/ml、0.5mg/ml、1.0mg/ml、2.0mg/ml、3.0mg/ml、4.0mg/ml、5.0mg/ml、6.0mg/ml、7.0mg/ml、8.0mg/ml、9.0mg/ml、10mg/ml、15mg/ml、20mg/ml、30mg/ml、40mg/ml、50mg/ml、或100mg/ml的所期望的脂质的混合物。在一些实施方案中,合适的脂质溶液可以含有总浓度在约0.1-100mg/ml、0.5-90mg/ml、1.0-80mg/ml、1.0-70mg/ml、1.0-60mg/ml、1.0-50mg/ml、1.0-40mg/ml、1.0-30mg/ml、1.0-20mg/ml、1.0-15mg/ml、1.0-10mg/ml、1.0-9mg/ml、1.0-8mg/ml、1.0-7mg/ml、1.0-6mg/ml、或1.0-5mg/ml范围内的所需脂质的混合物。在一些实施方案中,合适的脂质溶液可以含有总浓度为最多约100mg/ml、90mg/ml、80mg/ml、70mg/ml、60mg/ml、50mg/ml、40mg/ml、30mg/ml、20mg/ml、或10mg/ml的所需脂质的混合物。
任何所需脂质可以任何适合于包封mrna的比率混合。在一些实施方案中,合适的脂质溶液含有所需脂质的混合物,所述所需脂质包括阳离子脂质、辅助脂质(例如,非阳离子脂质和/或胆固醇脂质)和/或peg化的脂质。在一些实施方案中,合适的脂质溶液含有所需脂质的混合物,所述所需脂质包括一种或多种阳离子脂质、一种或多种辅助脂质(例如,非阳离子脂质和/或胆固醇脂质)和一种或多种peg化的脂质。
在一些实施方案中,在方法中使用的脂质溶液包含一种或多种阳离子脂质、一种或多种辅助脂质和一种或多种peg修饰的脂质。在一些实施方案中,脂质溶液包含一种或多种阳离子脂质。在一些实施方案中,脂质溶液包含一种或多种辅助脂质。在一些实施方案中,脂质溶液包含一种或多种peg修饰的脂质。在一些实施方案中,脂质溶液包含一种或多种阳离子脂质和一种或多种辅助脂质。在一些实施方案中,脂质溶液包含一种或多种阳离子脂质和一种或多种peg修饰的脂质。在一些实施方案中,脂质溶液包含一种或多种辅助脂质和一种或多种peg修饰的脂质。
阳离子脂质
如本文所用,短语“阳离子脂质”是指在选定ph诸如生理ph下具有净正电荷的多种脂质物质中的任何一种。
用于本发明的组合物和方法的合适的阳离子脂质包括如国际专利公开wo2010/144740中所述的阳离子脂质,该专利公开以引用的方式并入本文。在某些实施方案中,本发明的组合物和方法包括阳离子脂质、(6z,9z,28z,31z)-三十七碳-6,9,28,31-四烯-19-基4-(二甲基氨基)丁酸,所述阳离子脂质具有以下化合物结构:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2013/149140中所述的可电离阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括下式之一的阳离子脂质:
或其药学上可接受的盐,其中r1和r2各自独立地选自由以下项组成的组:氢、任选地取代的不同饱和或不饱和的c1-c20烷基和任选地取代的不同饱和或不饱和的c6-c20酰基;其中l1和l2各自独立地选自由以下项组成的组:氢、任选地取代的c1-c30烷基、任选地取代的不同不饱和的c1-c30烯基和任选地取代的c1-c30炔基;其中m和o各自独立地选自由以下项组成的组:零和任何正整数(例如,其中m为三);并且其中n为零或任何正整数(例如,其中n为一)。在某些实施方案中,本发明的组合物和方法包括阳离子脂质(15z,18z)-n,n-二甲基-6-((9z,12z)-十八碳-9,12-二烯-l-基)二十四碳-15,18-二烯-1-胺(“hgt5000”),所述阳离子脂质具有以下化合物结构:
(hgt-5000)
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括阳离子脂质(15z,18z)-n,n-二甲基-6-((9z,12z)-十八碳-9,12-二烯-1-基)二十四碳-4,15,18-三烯-l-胺(“hgt5001”),所述阳离子脂质具有以下化合物结构:
(hgt-5001)
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括阳离子脂质和(15z,18z)-n,n-二甲基-6-((9z,12z)-十八碳-9,12-二烯-1-基)二十四碳-5,15,18-三烯-1-胺(“hgt5002”),所述阳离子脂质具有以下化合物结构:
(hgt-5002)
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括在国际专利公开wo2010/053572中描述为氨基醇类脂质的阳离子脂质,该专利公开以引用的方式并入本文。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2016/118725中所述的阳离子脂质,该专利公开以引用的方式并入本文。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2016/118724中所述的阳离子脂质,该专利公开以引用的方式并入本文。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括具有通式14,25-二-十三烷基15,18,21,24-四氮杂-三十八烷的阳离子脂质及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2013/063468和wo2016/205691中所述的阳离子脂质,这些专利公开中的每个以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
或其药学上可接受的盐,其中rl的每个实例独立地是任选地取代的c6-c40烯基。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2015/184256中所述的阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
或其药学上可接受的盐,其中每个x独立地是o或s;每个y独立地是o或s;每个m独立地为0至20;每个n独立为1至6;每个ra独立地是氢、任选地取代的c1-50烷基、任选地取代的c2-50烯基、任选地取代的c2-50炔基、任选地取代的c3-10碳环基、任选地取代的3-14元杂环基、任选地取代的c6-14芳基、任选地取代的5-14元杂芳基或卤素;并且每个rb独立地是氢、任选地取代的c1-50烷基、任选地取代的c2-50烯基、任选地取代的c2-50炔基、任选地取代的c3-10碳环基、任选地取代的3-14元杂环基、任选地取代的c6-14芳基、任选地取代的5-14元杂芳基或卤素。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质“靶标23”:
(靶标23)
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2016/004202中所述的阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
或其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
或其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
或其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如美国临时专利申请序列号62/758,179中所述的阳离子脂质,该临时专利申请以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
或其药学上可接受的盐,其中每个r1和r2独立地是h或c1-c6脂族;每个m独立地为具有1至4的值的整数;每个a独立地是共价键或亚芳基;每个l1独立地是酯、硫酯、二硫键或酸酐基团;每个l2独立地是c2-c10脂族;每个x1独立地是h或oh;以及每个r3独立地是c6-c20脂族。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
(化合物1)
或其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
(化合物2)
或其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
(化合物3)
或其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如j.mcclellan,m.c.king,cell2010,141,210-217和whitehead等人.,naturecommunications(2014)5:4277中所述的阳离子脂质,这些文献以引用的方式并入本文。在某些实施方案中,本发明的组合物和方法的阳离子脂质包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2015/199952中所述的阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2017/004143中所述的阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2017/075531中所述的阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
或其药学上可接受的盐,其中l1或l2中的一者是-o(c=o)-、-(c=o)o-、-c(=o)-、-o-、-s(o)x、-s-s-、-c(=o)s-、-sc(=o)-、-nrac(=o)-、-c(=o)nra-、nrac(=o)nra-、-oc(=o)nra-或-nrac(=o)o-;并且l1或l2中的另一者是-o(c=o)-、-(c=o)o-、-c(=o)-、-o-、-s(o)x、-s-s-、-c(=o)s-、sc(=o)-、-nrac(=o)-、-c(=o)nra-、nrac(=o)nra-、-oc(=o)nra-或-nrac(=o)o-或直接键;g1和g2各自独立地是未取代的c1-c12亚烷基或c1-c12亚烯基;g3是c1-c24亚烷基、c1-c24亚烯基、c3-c8亚环烷基、c3-c8亚环烯基;ra是h或c1-c12烷基;r1和r2各自独立地是c6-c24烷基或c6-c24烯基;r3是h、or5、cn、-c(=o)or4、-oc(=o)r4或-nr5c(=o)r4;r4是c1-c12烷基;r5是h或c1-c6烷基;并且x为0、1或2。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2017/117528中所述的阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在一些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2017/049245中所述的阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法的阳离子脂质包括具有下式之一的化合物:
及其药学上可接受的盐。对于这四个通式中的任一者,r4独立地选自-(ch2)nq和-(ch2)nchqr;q选自由以下项组成的组-or、-oh、-o(ch2)nn(r)2、-oc(o)r、-cx3、-cn、-n(r)c(o)r、-n(h)c(o)r、-n(r)s(o)2r、-n(h)s(o)2r、-n(r)c(o)n(r)2、-n(h)c(o)n(r)2、-n(h)c(o)n(h)(r)、-n(r)c(s)n(r)2、-n(h)c(s)n(r)2、-n(h)c(s)n(h)(r)和杂环;并且n为1、2或3。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2017/173054和wo2015/095340中所述的阳离子脂质,这些专利公开中的每个以引用的方式并入本文。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质:
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括如国际专利公开wo2012/170889中所述的可切割阳离子脂质,该专利公开以引用的方式并入本文。在一些实施方案中,本发明的组合物和方法包括具有下式的阳离子脂质:
其中r1选自由以下项组成的组:咪唑、胍、氨基、亚胺、烯胺、任选地取代的烷基氨基(例如,烷基氨基,诸如二甲基氨基)和吡啶基;其中r2选自由以下两个通式之一组成的组:
并且其中r3和r4各自独立地选自由以下项组成的组:任选地取代的不同饱和或不饱和的c6-c20烷基和任选地取代的不同饱和或不饱和的c6-c20酰基;并且其中n为零或任何正整数(例如,一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五、十六、十七、十八、十九、二十或更多)。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质“hgt4001”:
(hgt4001)
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质“hgt4002”:
(hgt4002)
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质“hgt4003”:
(hgt4003)
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质“hgt4004”:
(hgt4004)
及其药学上可接受的盐。在某些实施方案中,本发明的组合物和方法包括具有以下化合物结构的阳离子脂质“hgt4005”:
(hgt4005)
及其药学上可接受的盐。
用于本发明的组合物和方法的其他合适的阳离子脂质包括可切割的阳离子脂质,如2018年5月16日提交的美国临时申请no.62/672,194中所述,该临时申请以引用的方式并入本文。在某些实施方案中,本发明的组合物和方法包括阳离子脂质,所述阳离子脂质为美国临时申请no.62/672,194中所述的通式中的任一者或者结构(1a)-(21a)和(1b)-(21b)和(22)-(237)。在某些实施方案中,本发明的组合物和方法包括具有根据式(i')的结构的阳离子脂质,
其中:
rx独立地为-h、-l1-r1或–l5a-l5b-b’;
l1、l2和l3中的每个独立地为共价键、-c(o)-、-c(o)o-、-c(o)s-或-c(o)nrl-;
每个l4a和l5a独立地为-c(o)-、-c(o)o-或-c(o)nrl-;
每个l4b和l5b独立地为c1-c20亚烷基、c2-c20亚烯基或c2-c20亚炔基;
每个b和b’为nr4r5或5元至10元含氮的杂芳基;
每个r1、r2和r3独立地为c6-c30烷基、c6-c30烯基或c6-c30炔基;
每个r4和r5独立地为氢、c1-c10烷基;c2-c10烯基;或c2-c10炔基;并且
每个rl独立地为氢、c1-c20烷基、c2-c20烯基或c2-c20炔基。
在某些实施方案中,本发明的组合物和方法包括阳离子脂质,所述阳离子脂质为62/672,194的化合物(139),所述化合物具有以下化合物结构:
(“18:1碳尾核糖脂质”)。
在一些实施方案中,本发明的组合物和方法包括阳离子脂质、n-[l-(2,3-二油烯基氧基)丙基]-n,n,n-三甲基氯化铵(“dotma”)。(feigner等人.proc.nat'lacad.sci.84,7413(1987);美国专利号4,897,355,该专利以引用的方式并入本文)。适用于本发明的组合物和方法的其他阳离子脂质包括例如5-羧基精胺基甘氨酸二-十八烷基酰胺(“dogs”);2,3-二油烯基氧基-n-[2-(精胺-羧胺)乙基]-n,n-二甲基-l-丙铵(“dospa”)(behr等人.proc.nat.'lacad.sci.86,6982(1989),美国专利号5,171,678;美国专利号5,334,761);l,2-二油酰基-3-二甲基铵-丙烷(“dodap”);l,2-二油酰基-3-三甲基铵-丙烷(“dotap”)。
适用于本发明的组合物和方法的附加的示例性阳离子脂质还包括:l,2-二硬脂酰氧基-n,n-二甲基-3-氨基丙烷(“dsdma”)、1,2-二油烯基氧基-n,n-二甲基-3-氨基丙烷(“dodma”)、1,2-二亚油基氧基-n,n-二甲基-3-氨基丙烷(“dlindma”)、l,2-二亚油烯基氧基-n,n-二甲基-3-氨基丙烷(“dlendma”)、n-二油烯基-n,n-二甲基氯化铵(“dodac”)、n,n-二硬脂酰基-n,n-二甲基溴化铵(“ddab”)、n-(l,2-二肉豆蔻基氧基丙-3-基)-n,n-二甲基-n-羟乙基溴化铵(“dmrie”)、3-二甲基氨基-2-(胆甾-5-烯-3-β-氧基丁烷-4-氧基)-l-(顺式,顺式-9,12-十八碳二烯氧基)丙烷(“clindma”)、2-[5'-(胆甾-5-烯-3-β-氧基)-3'-氧杂戊氧基)-3-二甲基-l-(顺式,顺式-9',l-2'-十八碳二烯氧基)丙烷(“cplindma”)、n,n-二甲基-3,4-二油烯基氧基苄胺(“dmoba”)、1,2-n,n'-二油烯基氨甲酰基-3-二甲基氨基丙烷(“docarbdap”)、2,3-二亚油酰氧基-n,n-二甲基丙基胺(“dlindap”)、l,2-n,n'-二亚油基氨甲酰基-3-二甲基氨基丙烷(“dlincarbdap”)、l,2-二亚油酰基氨甲酰基-3-二甲基氨基丙烷(“dlincdap”)、2,2-二亚油基-4-二甲基氨基甲基-[l,3]-二氧戊环(“dlin-k-dma”)、2-((8-[(3p)-胆甾-5-烯-3-基氧基]辛基)氧基)-n,n-二甲基-3-[(9z,12z)-十八碳-9,12-二烯-1-基氧基]丙烷-1-胺(“辛基-clindma”)、(2r)-2-((8-[(3β)-胆甾-5-烯-3-基氧基]辛基)氧基)-n,n-二甲基-3-[(9z,12z)-十八碳-9,12-二烯-1-基氧基]丙烷-1-胺(“辛基-clindma(2r)”)、(2s)-2-((8-[(3p)-胆甾-5-烯-3-基氧基]辛基)氧基)-n,fsl-二甲基3-[(9z,12z)-十八碳-9,12-二烯-1-基氧基]丙烷-1-胺(“辛基-clindma(2s)”)、2,2-二亚油基-4-二甲基氨基乙基-[l,3]-二氧戊环(“dlin-k-xtc2-dma”)和2-(2,2-二((9z,12z)-十八碳-9,l2-二烯-1-基)-l,3-二氧戊环-4-基)-n,n-二甲基乙胺(“dlin-kc2-dma”)(参见wo2010/042877,该专利以引用方式并入本文;semple等人,naturebiotech.28:172-176(2010))。(heyes,j.,等人.,jcontrolledrelease107:276-287(2005);morrissey,dv.,等人.,nat.biotechnol.23(8):1003-1007(2005);国际专利公开wo2005/121348)。在一些实施方案中,一种或多种阳离子脂质包含咪唑、二烷基氨基或胍鎓部分中的至少一种。
在一些实施方案中,适用于本发明的组合物和方法的一种或多种阳离子脂质包括2,2-二亚油基-4-二甲基氨基乙基-[1,3]-二氧戊环(“xtc”);(3ar,5s,6as)-n,n-二甲基-2,2-二((9z,12z)-十八碳-9,12-二烯基)四氢-3ah-环戊二烯并[d][1,3]二氧杂环戊烯-5-胺(“alny-100”)和/或4,7,13-三(3-氧代-3-(十一烷基氨基)丙基)-n1,n16-二-十一烷基-4,7,10,13-四氮杂十六烷-1,16-二酰胺(“nc98-5”)。
在一些实施方案中,本发明的组合物包含一种或多种阳离子脂质,所述阳离子脂质以重量计占组合物(例如脂质纳米颗粒)中的总脂质含量的至少约5%、10%、20%、30%、35%、40%、45%、50%、55%、60%、65%或70%。在一些实施方案中,本发明的组合物包含一种或多种阳离子脂质,所述阳离子脂质以摩尔%计占组合物(例如,脂质纳米颗粒)中的总脂质含量的至少约5%、10%、20%、30%、35%、40%、45%、50%、55%、60%、65%或70%。在一些实施方案中,本发明的组合物包含一种或多种阳离子脂质,所述阳离子脂质以重量计占组合物(例如,脂质纳米颗粒)中的总脂质含量的约30-70%(例如,约30-65%、约30-60%、约30-55%、约30-50%、约30-45%、约30-40%、约35-50%、约35-45%或约35-40%)。在一些实施方案中,本发明的组合物包含一种或多种阳离子脂质,所述阳离子脂质以摩尔%计占组合物(例如,脂质纳米颗粒)中的总脂质含量的约30-70%(例如,约30-65%、约30-60%、约30-55%、约30-50%、约30-45%、约30-40%、约35-50%、约35-45%或约35-40%)。
非阳离子/辅助脂质
在一些实施方案中,合适的脂质溶液包含一种或多种非阳离子/辅助脂质。如本文使用的,短语“非阳离子脂质”指任何中性、两性离子或阴离子脂质。如本文使用的,短语“阴离子脂质”指在选择的ph,例如生理ph下携带净负电荷的许多脂质物质中的任一种。非阳离子脂质包括但不限于二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二棕榈酰磷脂酰胆碱(dppc)、二油酰磷脂酰甘油(dopg)、二棕榈酰磷脂酰甘油(dppg)、二油酰磷脂酰乙醇胺(dope)、棕榈酰油酰磷脂酰胆碱(popc)、棕榈酰油酰-磷脂酰乙醇胺(pope)、4-(n-马来酰亚胺甲基)-环己烷-l-甲酸二油酰-磷脂酰乙醇胺(dope-mal)、二棕榈酰磷脂酰乙醇胺(dppe)、二豆蔻酰磷酸乙醇胺(dmpe)、二硬脂酰-磷脂酰-乙醇胺(dspe)、磷脂酰丝氨酸、鞘脂、脑苷脂、神经节苷脂、16-o-单甲基pe、16-o-二甲基pe、18-1-反式pe、l-硬脂酰-2-油酰-磷脂酰乙醇胺(sope)、或它们的混合物。
在一些实施方案中,此类非阳离子脂质可以单独使用,但是优选地与其他脂质(例如,阳离子脂质)组合使用。在一些实施方案中,非阳离子脂质可包含脂质体中存在的总脂质的约5%至约90%、或约10%至约70%的摩尔比。在一些实施方案中,非阳离子脂质是中性脂质,即在其下配制和/或施用组合物的条件下不携带净电荷的脂质。在一些实施方案中,脂质体中非阳离子脂质的百分比可大于5%、大于10%、大于20%、大于30%或大于40%。
在一些实施方案中,非阳离子脂质以重量或摩尔计可以占合适的脂质溶液中的总脂质的至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%。在一些实施方案中,一种或多种非阳离子脂质以重量或摩尔计占合适的脂质溶液中的总脂质的约30-50%(例如,约30-45%、约30-40%、约35-50%、约35-45%或约35%-40%)。
在一些实施方案中,一种或多种非阳离子脂质被用于本文所述的方法中。在一些实施方案中,一种或多种非阳离子脂质包括选自由以下各项组成的组的非阳离子脂质:dspc(1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱)、dppc(1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱)、dope(1,2-二油烯基-sn-甘油-3-磷酸乙醇胺)、dopc(1,2-二油烯基-sn-甘油-3-磷脂酰胆碱)、dppe(1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺)、dmpe(,2-二豆蔻酰基-sn-甘油-3-磷酸乙醇胺)、dopg(1,2-二油酰基-sn-甘油-3-磷酸-(1'-rac-甘油))以及它们的组合。
基于胆固醇的脂质
在一些实施方案中,合适的脂质溶液包含一种或多种基于胆固醇的脂质。例如,合适的基于胆固醇的阳离子脂质包括例如dc-choi(n,n-二甲基-n-乙基甲酰胺基胆固醇)、l,4-双(3-n-油基氨基-丙基)哌嗪(gao等人biochem.biophys.res.comm.179,280(1991);wolf等人biotechniques23,139(1997);美国专利号5,744,335)或ice。在一些实施方案中,基于胆固醇的脂质可包含脂质体中存在的总脂质的约2%至约30%、或约5%至约20%的摩尔比。在一些实施方案中,脂质纳米颗粒中的基于胆固醇的脂质的百分比可以为大于5%、大于10%、大于20%、大于30%或大于40%。
在一些实施方案中,一种或多种基于胆固醇的脂质以重量或摩尔计占合适的脂质溶液中的总脂质的至少约5%、10%、20%、30%、40%、50%、60%或70%。在一些实施方案中,一种或多种基于胆固醇的脂质以重量或摩尔计占合适的脂质溶液中的总脂质的约30-50%(例如,约30-45%、约30-40%、约35-50%、约35-45%或约35%-40%)。
peg化的脂质
在一些实施方案中,合适的脂质溶液包含一种或多种peg化的脂质。本发明还设想了聚乙二醇(peg)修饰的磷脂和衍生化的脂质(诸如,衍生化的神经酰胺(peg-cer),包括n-辛酰基鞘氨醇-1-[琥珀酰(甲氧基聚乙二醇)-2000](c8peg-2000神经酰胺))单独或优选地与其他脂质调配物(它包含转移媒介物(例如,脂质纳米颗粒))一起组合的使用。设想的peg修饰的脂质包括但不限于长度为最多5kda的聚乙二醇链,所述聚乙二醇链共价连接至具有一条或多条c6-c20长度的烷基链的脂质。此类组分的添加可以防止复合物聚集,并且还可以提供延长循环寿命和增加脂质-核酸组合物至靶组织的递送的手段(klibanov等人.(1990)febsletters,268(1):235-237),或者可以选择它们以在体内迅速地从调配物中交换出来(参见美国专利号5,885,613)。特别有用的可交换脂质是具有较短酰基链(例如,c14或c18)的peg-神经酰胺。本发明的peg修饰的磷脂和衍生化的脂质可以包含以摩尔比计脂质体转移媒介物中存在的总脂质的约0%至约20%、约0.5%至约20%、约1%至约15%、约4%至约10%、或约2%。
根据各种实施方案,包含脂质纳米颗粒的阳离子脂质、非阳离子脂质和/或peg修饰的脂质的选择,以及这些脂质与彼此的相对摩尔比基于所选择的脂质的特征、预期靶细胞的性质、待递送的mrna的特征。其他考虑因素包括例如,烷基链的饱和度以及所选脂质的大小、电荷、ph、pka、融合性和毒性。因此,可相应地调节摩尔比。
在一些实施方案中,使用聚合物作为载体,单独或与包括本文所述的各种脂质的其他载体组合,配制合适的递送媒介物。因此,在一些实施方案中,如本文所用,脂质体递送媒介物还涵盖包含聚合物的纳米颗粒。合适的聚合物可包括例如聚丙烯酸酯、聚氰基丙烯酸烷基酯、聚丙交酯、聚丙交酯-聚乙交酯共聚物、聚己内酯、葡聚糖、白蛋白、明胶、海藻酸盐、胶原、壳聚糖、环糊精、鱼精蛋白、peg化鱼精蛋白、pll、peg化pll和聚乙烯亚胺(pei)。当存在pei时,它可为分子量范围为10至40kda的支化pei,例如25kda支化pei(sigma#408727)。
用于本发明的合适的脂质体可以包含各种比率的本文所述的阳离子脂质、非阳离子脂质、胆固醇脂质、peg修饰的脂质和/或聚合物中的任一者中的一者或多者。作为非限制性实例,合适的脂质体调配物可以包含选自以下的组合:ckk-e12、dope、胆固醇和dmg-peg2k;c12-200、dope、胆固醇和dmg-peg2k;hgt4003、dope、胆固醇和dmg-peg2k;ice、dope、胆固醇和dmg-peg2k;或者ice、dope和dmg-peg2k。
在多个实施方案中,阳离子脂质(例如,ckk-e12、c12-200、ice和/或hgt4003)以摩尔比计占脂质体的约30-60%(例如,约30-55%、约30-50%、约30-45%、约30-40%、约35-50%、约35-45%或约35-40%)。在一些实施方案中,阳离子脂质(例如,ckk-e12、c12-200、ice和/或hgt4003)的百分比以摩尔比计等于或大于脂质体的约30%、约35%、约40%、约45%、约50%、约55%或约60%。
在一些实施方案中,一种或多种阳离子脂质与一种或多种非阳离子脂质与一种或多种基于胆固醇的脂质与一种或多种peg修饰的脂质的比率可以分别地在约30-60:25-35:20-30:1-15之间。在一些实施方案中,一种或多种阳离子脂质与一种或多种非阳离子脂质与一种或多种基于胆固醇的脂质与一种或多种peg修饰的脂质的比率分别地为大约40:30:20:10。在一些实施方案中,一种或多种阳离子脂质与一种或多种非阳离子脂质与一种或多种基于胆固醇的脂质与一种或多种peg修饰的脂质的比率分别地为大约40:30:25:5。在一些实施方案中,一种或多种阳离子脂质与一种或多种非阳离子脂质与一种或多种基于胆固醇的脂质与一种或多种peg修饰的脂质的比率分别地为大约40:32:25:3。在一些实施方案中,一种或多种阳离子脂质与一种或多种非阳离子脂质与一种或多种基于胆固醇的脂质与一种或多种peg修饰的脂质的比率为大约50:25:20:5。在一些实施方案中,一种或多种甾醇脂质与一种或多种非阳离子脂质与一种或多种peg修饰的脂质的比率为50:45:5。在一些实施方案中,一种或多种甾醇脂质与一种或多种非阳离子脂质与一种或多种peg修饰的脂质的比率为50:40:10。在一些实施方案中,一种或多种甾醇脂质与一种或多种非阳离子脂质与一种或多种peg修饰的脂质的比率为55:40:5。在一些实施方案中,一种或多种甾醇脂质与一种或多种非阳离子脂质与一种或多种peg修饰的脂质的比率为55:35:10。在一些实施方案中,一种或多种甾醇脂质与一种或多种非阳离子脂质与一种或多种peg修饰的脂质的比率为60:35:5。在一些实施方案中,一种或多种甾醇脂质与一种或多种非阳离子脂质与一种或多种peg修饰的脂质的比率为60:30:10。
在一些实施方案中,用于本发明的合适的脂质体包含ice和dope的ice:dope摩尔比>1:1。在一些实施方案中,ice:dope摩尔比<2.5:1。在一些实施方案中,ice:dope摩尔比在1:1和2.5:1之间。在一些实施方案中,ice:dope摩尔比为大约1.5:1。在一些实施方案中,ice:dope摩尔比为大约1.7:1。在一些实施方案中,ice:dope摩尔比为大约2:1。在一些实施方案中,用于本发明的合适的脂质体包含ice和dmg-peg-2k的ice:dmg-peg-2k摩尔比>10:1。在一些实施方案中,ice:dmg-peg-2k摩尔比<16:1。在一些实施方案中,ice:dmg-peg-2k摩尔比为大约12:1。在一些实施方案中,ice:dmg-peg-2k摩尔比为大约14:1。在一些实施方案中,用于本发明的合适的脂质体包含dope和dmg-peg-2k的dope:dmg-peg-2k摩尔比>5:1。在一些实施方案中,dope:dmg-peg-2k摩尔比<11:1。在一些实施方案中,dope:dmg-peg-2k摩尔比为大约7:1。在一些实施方案中,dope:dmg-peg-2k摩尔比为大约10:1。在一些实施方案中,用于本发明的合适的脂质体包含ice、dope和dmg-peg-2k的ice:dope:dmg-peg-2k摩尔比为50:45:5。在一些实施方案中,用于本发明的合适的脂质体包含ice、dope和dmg-peg-2k的ice:dope:dmg-peg-2k摩尔比为50:40:10。在一些实施方案中,用于本发明的合适的脂质体包含ice、dope和dmg-peg-2k的ice:dope:dmg-peg-2k摩尔比为55:40:5。在一些实施方案中,用于本发明的合适的脂质体包含ice、dope和dmg-peg-2k的ice:dope:dmg-peg-2k摩尔比为55:35:10。在一些实施方案中,用于本发明的合适的脂质体包含ice、dope和dmg-peg-2k的ice:dope:dmg-peg-2k摩尔比为60:35:5。在一些实施方案中,用于本发明的合适的脂质体包含ice、dope和dmg-peg-2k的ice:dope:dmg-peg-2k摩尔比为60:30:10。
在一些实施方案中,本发明还设想了聚乙二醇(peg)修饰的磷脂和衍生化的脂质(例如衍生化的神经酰胺(peg-cer),包括n-辛酰基-鞘氨醇-l-[琥珀酰(甲氧基聚乙二醇)-2000](c8peg-2000神经酰胺))的使用。设想的peg修饰的脂质包括但不限于长度为最多2kda、最多3kda、最多4kda或最多5kda的聚乙二醇链,所述聚乙二醇链共价连接至具有一条或多条c6-c20长度的烷基链的脂质。在一些实施方案中,peg修饰的或peg化的脂质是peg化的胆固醇或peg-2k。在一些实施方案中,特别有用的可交换脂质是具有较短的酰基链(例如,c14或c18)的peg-神经酰胺。
在合适脂质溶液中,peg修饰的磷脂和衍生化的脂质可以按重量计或按摩尔计占总脂质的不大于约0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%。在一些实施方案中,在合适的脂质溶液中,peg修饰的脂质可以按重量计或按摩尔浓度计占总脂质的约5%或更少。在一些实施方案中,在合适的脂质溶液中,peg修饰的脂质可以按重量计或按摩尔浓度计占总脂质的约4%或更少。在一些实施方案中,在合适的脂质溶液中,peg修饰的脂质通常按重量计或按摩尔浓度计占总脂质的3%或更少。在一些实施方案中,在合适的脂质溶液中,peg修饰的脂质通常按重量计或按摩尔浓度计占总脂质的2%或更少。在一些实施方案中,在合适的脂质溶液中,peg修饰的脂质通常按重量计或按摩尔浓度计占总脂质的1%或更少。在一些实施方案中,在合适的脂质溶液中,peg修饰的脂质按重量计或按摩尔浓度计占总脂质的约1-5%、约1-4%、约1-3%或约1-2%。在一些实施方案中,在合适的脂质溶液中,peg修饰的脂质按重量计或按摩尔浓度计占总脂质的约0.01-3%(例如,约0.01-2.5%、0.01-2%、0.01-1.5%、0.01-1%)。
可以用于制备并包含在预先形成的脂质纳米颗粒中的各种脂质组合,即阳离子脂质、非阳离子脂质、peg修饰的脂质和任选地胆固醇,在文献和本文中有描述。例如,合适的脂质溶液可以含有ckk-e12、dope、胆固醇和dmg-peg2k;c12-200、dope、胆固醇和dmg-peg2k;hgt5000、dope、胆固醇和dmg-peg2k;hgt5001、dope、胆固醇和dmg-peg2k;ckk-e12、dppc、胆固醇和dmg-peg2k;c12-200、dppc、胆固醇和dmg-peg2k;hgt5000、dppc、胆固醇和dmg-peg2k;hgt5001、dppc、胆固醇和dmg-peg2k;或者ice、dope和dmg-peg2k。脂质的其他组合在本领域中有描述,例如2017年11月10日提交的pct/us17/61100,以wo2018/089790公开,标题为“novelice-basedlipidnanoparticleformulationfordeliveryofmrna”;2018年3月7日提交的pct/us18/21292,以wo2018/165257公开,标题为“polyanionicdeliveryofnucleicacids”;2018年6月11日提交的pct/us18/36920,标题为“poly(phosphoesters)fordeliveryofnucleicacids”。包含脂质混合物的阳离子脂质、非阳离子脂质和/或peg修饰的脂质的选择以及此类脂质彼此的相对摩尔比基于一种或多种所选的脂质的特征和待包封的mrna的特征性质。其他考虑因素包括例如,烷基链的饱和度以及所选脂质的大小、电荷、ph、pka、融合性和毒性。因此,可相应地调节摩尔比。
在多个实施方案中,阳离子脂质(例如,ckk-e12、c12-200、ice和/或hgt4003)以摩尔比计占脂质体的约30-60%(例如,约30-55%、约30-50%、约30-45%、约30-40%、约35-50%、约35-45%或约35-40%)。在一些实施方案中,阳离子脂质(例如,ckk-e12、c12-200、ice和/或hgt4003)的百分比以摩尔比计等于或大于脂质体的约30%、约35%、约40%、约45%、约50%、约55%或约60%。
所提供的包封mrna的纳米颗粒
与现有技术的方法相比,根据本发明的方法产生更均质和更小的粒度(例如,粒度为约75-150nm,例如75、80、85、90、95、100、105、110、115、120、125、130、135、140、145或150nm)以及显著改善的包封效率和/或mrna回收率。
因此,本发明提供包含本文所述的纯化纳米颗粒的组合物。在一些实施方案中,组合物中的大多数纯化的纳米颗粒(即,大于约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的纯化的纳米颗粒)具有小于约100nm(例如,小于约95nm、约90nm、约85nm、约80nm、约75nm、约70nm、约65nm、约60nm、约55nm、或约50nm)的粒度。在一些实施方案中,基本上所有纯化的纳米颗粒都具有小于100nm(例如,小于约95nm、约90nm、约85nm、约80nm、约75nm、约70nm、约65nm、约60nm、约55nm、或约50nm)的粒度。
另外,通过本发明的方法获得了具有窄的粒径范围的更均匀的纳米颗粒。例如,在本发明提供的组合物中,大于约70%、75%、80%、85%、90%、95%、96%、97%、98%、99%的纯化的纳米颗粒具有在约40-90nm(例如,约40-85nm、约40-80nm、约40-75nm、约40-70nm、约40-65nm、或约40-60nm)的范围内的粒度。在一些实施方案中,基本上所有的纯化的纳米颗粒的粒度都在约40-90nm(例如约40-85nm、约40-80nm、约40-75nm、约40-70nm、约40-65nm或约40-60nm)的范围内。
在一些实施方案中,本发明提供的组合物中的纳米颗粒的分散度或分子尺寸异质性量度(pdi)为小于约0.3(例如,小于约0.3、0.2、0.15、0.14、0.13、0.12、0.11、0.10、0.09或0.08)。
在一些实施方案中,由本发明提供的组合物中超过约75%、80%、85%、90%、95%、96%、97%、98%或99%的纯化脂质纳米颗粒囊封每个单独的颗粒内的mrna。在一些实施方案中,组合物中的基本上所有的纯化脂质纳米颗粒在每个单独的颗粒内囊封mrna。
在一些实施方案中,根据本发明的组合物含有至少约1mg、5mg、10mg、100mg、500mg或1000mg的囊封mrna。在一些实施方案中,根据本发明的方法导致回收超过约60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的mrna。
还通过以下实施例来进一步展示本发明,这些实施例不应被解释为限制性的。在整个本申请中引用的所有参考文献、专利和公开的专利申请的内容均以引用的方式整体并入本文用于所有目的。
纯化
在一些实施方案中,脂质纳米颗粒中的经包封的核酸(例如,经包封的mrna)被进一步纯化和/或浓缩。可以使用各种纯化方法。在一些实施方案中,使用切向流过滤来纯化脂质纳米颗粒。切向流过滤(tff)(也被称为交叉流过滤)是其中待过滤的材料切向地穿过过滤器而不是通过过滤器的一种过滤类型。在tff中,非所需渗透物穿过过滤器,而所需渗余物沿着过滤器传递且在下游收集。重要的是,应注意,所需材料通常包含在tff中的渗余物中,其与传统的死端过滤中通常遇到的情况相反。
取决于待过滤的材料,tff通常用于微过滤或超过滤。微过滤通常被定义为过滤器具有0.05μm与1.0μm之间的孔尺寸的情况,而超过滤通常包括孔尺寸小于0.05μm的过滤器。孔尺寸还确定标称分子量限值(nmwl),其也称为特定过滤器的分子量截止(mwco),其中微过滤膜通常具有大于1,000千道尔顿(kda)的nmwl且超过滤过滤器具有1kda与1,000kda之间的nmwl。
切向流过滤的主要优点是,在传统的“死端”过滤期间可能聚集在过滤器中并阻塞过滤器的非渗透性颗粒(有时被称为“滤饼”)代替地沿着过滤器表面转移。此优点允许在需要连续操作的工业过程中广泛使用切向流过滤,这是因为停机时间显著减小,因为过滤器通常不需要被移除和清洁。
切向流过滤可用于包括浓缩和渗滤等的若干目的。浓缩是借以从溶液中去除溶剂,同时保留溶质分子的过程。为了有效地浓缩样品,使用具有基本上低于待保留的溶质分子的分子量的nmwl或mwco的膜。一般来说,技术人员可选择具有低于靶分子的分子量三至六倍的nmwl或mwco的过滤器。
渗滤是分馏过程,其中小的非所需颗粒穿过过滤器,同时将较大的所需纳米颗粒维持在渗余物中,而不改变那些纳米颗粒的在溶液中的浓度。渗滤通常用于从溶液中去除盐或反应缓冲液。渗滤可以是连续的或不连续的。在连续渗滤中,以与产生滤液相同的速率将渗滤溶液添加到样品进料中。在不连续渗滤中,首先稀释溶液并且接着浓缩回起始浓度。可以重复不连续渗滤,直到达到纳米颗粒的所需浓度。
在一些实施方案中,纯化和/或浓缩步骤包括透析、凝胶过滤、离心(例如使用amicon离心过滤器)、真空和压力机(例如french压力机)。
纯化和/或浓缩的脂质纳米颗粒可以在所需缓冲液(例如pbs)中配制。
治疗适应症
在一些实施方案中,本发明可以用于将mrna包封于脂质中,从而产生脂质包封的mrna,以用于治疗各种障碍、疾病、病症和/或综合征。在以下段落中描述了如本文所述的本发明的选择用途的非限制性实例。
在一些实施方案中,本发明提供了一种用于产生包含编码肽或多肽的包封mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗人受试者。在一些实施方案中,包含包封mrna的脂质的治疗组合物用于递送至受试者的肺或肺细胞中。在某些实施方案中,本发明提供了一种用于产生治疗组合物的方法,所述治疗组合物包含包封编码在受试者中可以是缺陷的或无功能的内源性蛋白质的mrna的脂质。在某些实施方案中,本发明提供了一种用于产生治疗组合物的方法,所述治疗组合物包含包封编码在受试者中可以是缺陷的或无功能的内源性蛋白质的mrna的脂质。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的肺或肺细胞。在某些实施方案中,本发明可用于制造编码囊性纤维化跨膜传导调整因子cftr的mrna的方法。cftrmrna被递送至需要用于治疗囊性纤维化的治疗组合物的受试者的肺部。在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的肝或肝细胞。此类肽和多肽可包括与尿素循环紊乱相关的、与溶酶体贮积紊乱相关的、与糖原贮积紊乱相关的、与氨基酸代谢紊乱相关的、与脂质代谢或纤维化紊乱相关的、与甲基丙二酸血症相关或与任何其他代谢紊乱相关的那些,对于所述代谢紊乱,以富集的全长mrna递送至或治疗肝脏或肝细胞提供治疗有益效果。
在某些实施方案中,本发明提供了一种用于产生包含包封编码与尿素循环障碍相关的蛋白质的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码鸟氨酸转氨甲酰酶(otc)蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码精氨琥珀酸合成酶1蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码氨基甲酰磷酸合成酶i蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码精氨琥珀酸裂合酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码精氨酸酶蛋白的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码与溶酶体贮积紊乱相关的蛋白质的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码α半乳糖苷酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码葡萄糖脑苷脂酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码异氰酸酯-2-硫酸酯酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码艾杜糖苷酸酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码n-乙酰基-α-d-葡糖胺苷酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码乙酰肝素n-硫酸酯酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码半乳糖胺-6硫酸酯酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码β-半乳糖苷酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码溶酶体脂肪酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码芳基硫酸酯酶b(n-乙酰半乳糖胺-4-硫酸酯酶)蛋白的mrna的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码转录因子eb(tfeb)的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码与糖原贮积紊乱相关的蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码酸性α-葡糖苷酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码葡萄糖-6-磷酸酶(g6pc)蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码肝糖原磷酸化酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码肌肉磷酸甘油酸突变酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码糖原解支化酶的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码与氨基酸代谢相关的蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码苯丙氨酸羟化酶的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码戊二酰-coa脱氢酶的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码丙酰基-coa羧化酶的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码草酸酶丙氨酸-乙醛酸氨基转移酶的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码与脂质代谢或纤维化疾病相关的蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码mtor抑制剂的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码atp酶磷脂转运8b1(atp8b1)蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码一种或多种nf-κb抑制剂的mrna的脂质的治疗组合物的方法,所述抑制剂诸如i-κbα、干扰素相关的发育调整剂1(ifrd1)和沉默调节蛋白1(sirt1)中的一种或多种。在某些实施方案中,本发明提供了一种用于产生包含包封编码ppar-γ蛋白或活性变体的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码与甲基丙二酸血症相关的蛋白质的mrna的脂质的治疗组合物的方法。例如,在某些实施方案中,本发明提供了一种用于产生包含包封编码甲基丙二酰辅酶a突变酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码甲基丙二酰辅酶a差向异构酶蛋白的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封mrna的脂质的治疗组合物的方法,对于所述治疗组合物,递送至或治疗肝脏可以提供治疗有益效果。在某些实施方案中,本发明提供了一种用于产生包含包封编码atp7b蛋白(也被称为威尔逊(wilson)病蛋白)的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码胆色素原脱氨酶的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码一种或多种凝结酶的mrna的脂质的治疗组合物的方法,所述凝结酶诸如因子viii、因子ix、因子vii和因子x。在某些实施方案中,本发明提供了一种用于产生包含包封编码人血色素沉着病(hfe)蛋白的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的心血管系统或心血管细胞。在某些实施方案中,本发明提供了一种用于产生包含包封编码血管内皮生长因子a蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码松弛素蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码骨形态发生蛋白9蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码骨形态发生蛋白2受体蛋白的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的肌肉或肌肉细胞。在某些实施方案中,本发明提供了一种用于产生包含包封编码肌营养不良蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码人源线粒体蛋白(frataxin)的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的心肌或心肌细胞。在某些实施方案中,本发明提供了一种用于产生包含包封编码调整肌肉组织或肌肉细胞中钾通道和钠通道中的一者或两者的蛋白质的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码调整肌肉组织或肌肉细胞中kv7.1通道的蛋白质的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码调整肌肉组织或肌肉细胞中nav1.5通道的蛋白质的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的神经系统或神经系统细胞。例如,在某些实施方案中,本发明提供了一种用于产生包含包封编码存活运动神经元1蛋白的mrna的脂质的治疗组合物的方法。例如,在某些实施方案中,本发明提供了一种用于产生包含包封编码存活运动神经元2蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码人源线粒体蛋白(frataxin)的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码atp结合盒亚家族d成员1(abcd1)蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码cln3蛋白的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的血液或骨髓或者血细胞或骨髓细胞。在某些实施方案中,本发明提供了一种用于产生包含包封编码β球蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码布鲁顿(bruton)酪氨酸激酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码一种或多种凝结酶的mrna的脂质的治疗组合物的方法,所述凝结酶诸如因子viii、因子ix、因子vii和因子x。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的肾或肾细胞。在某些实施方案中,本发明提供了一种用于产生包含包封编码iv型胶原α5链(col4a5)蛋白的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于递送至或治疗受试者的眼或眼细胞。在某些实施方案中,本发明提供了一种用于产生包含包封编码atp结合盒亚家族a成员4(abca4)蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码视网膜劈裂素蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码视网膜色素上皮特异性65kda(rpe65)蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码290kda的中心体蛋白(cep290)的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码肽或多肽的mrna的脂质的治疗组合物的方法,所述治疗组合物用于向受试者或受试者的细胞递送疫苗或用疫苗治疗。例如,在某些实施方案中,本发明提供了一种用于产生包含包封编码来自诸如病毒之类的传染源的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自流感病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自呼吸道合胞病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自狂犬病病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自巨细胞病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自轮状病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自肝炎病毒的抗原的mrna的脂质的治疗组合物的方法,所述肝炎病毒诸如甲型肝炎病毒、乙型肝炎病毒或丙型肝炎病毒。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自人乳头瘤病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自单纯疱疹病毒的抗原的mrna的脂质的治疗组合物的方法,所述单纯疱疹病毒诸如单纯疱疹病毒1或单纯疱疹病毒2。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自人免疫缺陷病毒的抗原的mrna的脂质的治疗组合物的方法,所述人免疫缺陷病毒诸如人免疫缺陷病毒1型或人免疫缺陷病毒2型。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自人间质肺炎病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自人副流感病毒的抗原的mrna的脂质的治疗组合物的方法,所述人副流感病毒诸如人副流感病毒1型、人副流感病毒2型或人副流感病毒3型。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自疟疾病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自寨卡病毒的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码来自基孔肯雅病毒的抗原的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码与受试者的癌症相关的抗原或从受试者的癌细胞中鉴定的抗原的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码从受试者自身的癌细胞确定的抗原的mrna的脂质的治疗组合物的方法,即提供个性化的癌症疫苗。在某些实施方案中,本发明提供了一种用于产生包含包封编码从突变kras基因表达的抗原的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码抗体的mrna的脂质的治疗组合物的方法。在某些实施方案中,抗体可以是双特异性抗体。在某些实施方案中,抗体可以是融合蛋白的一部分。在某些实施方案中,本发明提供了一种用于产生包含包封编码针对ox40的抗体的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码针对vegf的抗体的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码针对组织坏死因子α的抗体的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码针对cd3的抗体的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码针对cd19的抗体的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码免疫调整剂的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码白介素12的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码白介素23的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码白介素36γ的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码一种或多种干扰素基因(sting)蛋白刺激物的组成型活性变体的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码核酸内切酶的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码rna指导的dna核酸内切酶蛋白(诸如cas9蛋白)的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码大范围核酸酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码转录激活因子样效应子核酸酶蛋白的mrna的脂质的治疗组合物的方法。在某些实施方案中,本发明提供了一种用于产生包含包封编码锌指核酸酶蛋白的mrna的脂质的治疗组合物的方法。
在某些实施方案中,本发明提供了一种用于产生包含包封编码用于治疗眼睛疾病的mrna的脂质的治疗组合物的方法。在一些实施方案中,所述方法用于产生包含包封编码视网膜劈裂素的mrna的脂质的治疗组合物。
实施例
以下实施例,包括进行的实验和获得的结果,仅出于说明目的而提供,不应解释为对本公开的限制。
脂质材料
除非另外指明,否则以下实施例中所述的制剂含有不同比率的多组分脂质混合物,所述脂质混合物采用一种或多种阳离子脂质、辅助脂质(例如,非阳离子脂质和/或胆固醇脂质)和peg化的脂质,它们被设计为包封各种核酸材料。
实施例1:基于重力的核酸包封
本实施例展示了基于重力的核酸包封方法。如本文所用,过程a是指通过将mrna与脂质混合物混合而无需首先将脂质预先形成为脂质纳米颗粒来包封mrna的常规方法。如本文所用,过程b是指通过将预先形成的脂质纳米颗粒与mrna混合来包封信使rna(mrna)的过程。与过程b相比,过程a不涉及脂质纳米颗粒的预先形成。过程a和过程b包括分别在wo2016004318和wo2018089801中描述的那些过程,这两个专利据此以引用的方式并入。
图1展示了使用本文所述的方法的示例性包封方法。本发明的示例性包封方法可以应用于过程a和过程b二者。图1所示的示例性过程包括:1)第一储集器,提供溶于水溶液的所期望的核酸;2)第二储集器,提供脂质和/或脂质纳米颗粒(lnp)的溶液;3)用于第一储集器和第二储集器的导管,允许核酸、脂质和/或lnp的流动;4)用于混合核酸和脂质和/或lnp的接头;以及5)用于收集lnp中的经混合/经包封的核酸的容纳件或导管。
所述过程使用重力和大气压作为力来驱动分别地从储集器1(含有mrna溶液的储集器)和储集器2(含有脂质或lnp溶液的储集器)通过导管1(mrna溶液流动)和通过导管2(脂质或lnp溶液流动)的液体的流动。来自储集器1和储集器2的溶液在接头(即“y”连接器或“t”连接器)处汇合,从而以特定的流速混合在一起。mrna溶液与含有脂质或lnp的溶液的混合引起mrna在脂质纳米颗粒中的包封。随后经包封的mrna被收集于容纳件中。
各个接头可以与本文公开的方法一起使用。分别如图2a和2b所示,接头的选项包括例如使用“t”连接器或“y”连接器。
该过程被用于使用各种阳离子脂质(包括表1中列出的脂质)成功地包封mrna,该过程应用于过程a和过程b二者。所测量的大气压和排出压力基本上为0。包封方法运行的结果如下表1所示。
表1:使用基于重力的包封方法进行的mrna的包封
*除非另外指明,否则适用过程a。
如表1所示,对于使用ckk-e12和ccbene进行的包封,重力包封方法获得的包封效率在约79%和87%之间。此外,经包封的mrna的粒度在约49nm至约102nm的范围内,具有低pdi值,均低于0.3。
实施例2:过程中液体流速的控制
液体流速可以在图1所示的过程中进行控制,以实现所期望的流速和所得的混合性质。一种控制储集器中含有的溶液的流速和混合的方式是调整储集器(例如,储集器1和/或储集器2)、导管和/或接头中的至少一者的直径。图3a和3b展示了对导管的直径的调整以及由于导管直径而对液体流速产生的所得的影响。如图3a和3b所示,直径越大,液体通过导管的流量越大。
一种实现所期望的直径和所得的流速的方式是通过将限流器(例如,洗耳球、盖子和夹子)放置于储集器、导管和/或接头中的一者或多者中。限流器在过程的这些部分中的每个的放置如图4a-4d所示。限流器的放置将改变来自储集器的液体流过所述限流器的直径,从而产生流速的调整以及在接头处发生的混合。
控制流速和所得的混合过程的另一种方式是向上移动连接器,以允许清空导管管路,并且同时由于高度而限制液体流动(即重力控制)。在向下移动连接器时,来自储集器1和储集器2的液体将混合。这种控制混合过程的方式如图5a和5b所示。或者,可以保持系统恒定添加液体,以使得制剂混合是固定系统的结果。这如图6所示。
实施例3:高通量制剂过程
如本文所述的方法也可以在高通量场景中使用。例如,可以连接如本文所述的一系列过程,以使得所述过程将包括第一导管流和第二导管流的至少10个、20个、30个、40个、50个、100个、150个、200个、250个、300个或更多个配对。如果需要的话,这将允许例如第一导管流提供多种mrna溶液。同样,如果需要的话,第二导管流可以提供多种脂质溶液。通过这种方式,实现了类似于流水线的操作方式,以使得液体被同时添加至储集器对,然后液体被连续添加至接下来的储集器对。这如图7所示。示例性的高通量过程如图8所示。
等效物和范围本领域的技术人员将认识到或能够使用不超过常规实验来确定本文所描述的本发明的具体实施方案的许多等效物。本发明的范围并非旨在限于以上说明书,而是如以下权利要求书中所述。
- 还没有人留言评论。精彩留言会获得点赞!