用于治疗再生障碍性贫血的药物组合物的制作方法
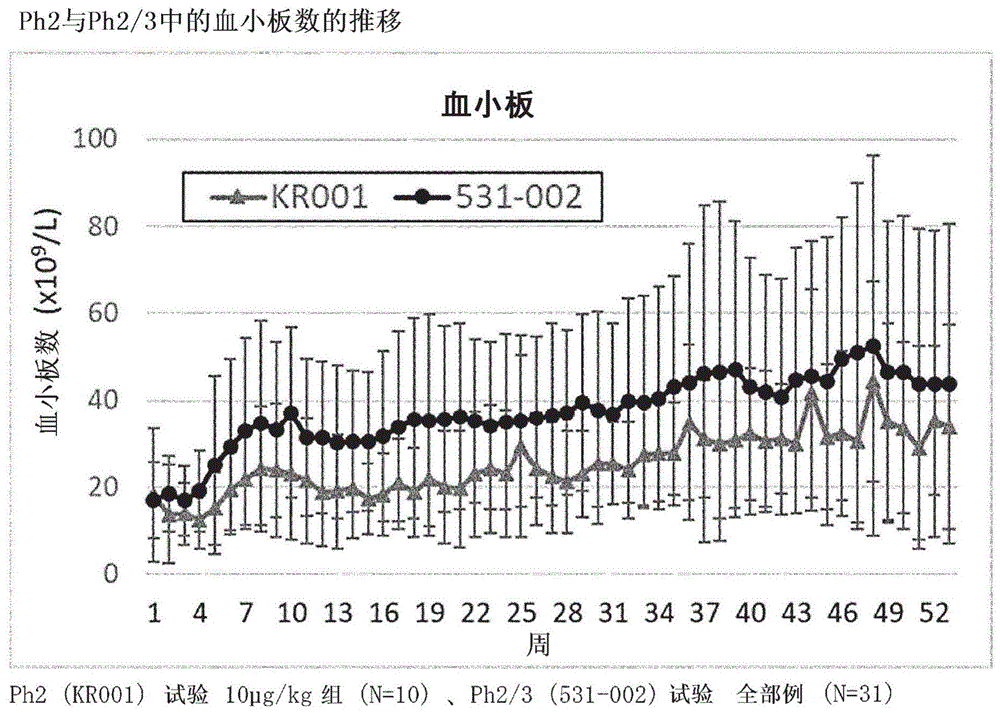
[相关申请]本说明书包含作为本申请的优先权基础的日本特愿2018-202097号(2018年10月26日提交)的说明书中记载的内容。[
技术领域:
]本发明涉及以罗米司亭作为有效成分的用于治疗再生障碍性贫血的药物组合物。
背景技术:
:再生障碍性贫血(aplasticanemia,aa)是以外周血中的所有血细胞的减少(全血细胞减少)和骨髓的细胞密度的降低(低形成)为特征的疾病。作为aa的自觉症状,可以观察到劳作时的气短、心悸、眩晕等贫血症状、感染引起的发热以及皮下出血斑、牙龈出血、鼻出血等出血倾向。作为他觉所见,可以观察到面色苍白、贫血样眼睑结膜、皮下出血、牙龈出血等。aa有时会由于向骨髓增生异常综合征(mds)或急性髓系白血病(aml)的转变、出血倾向或感染症而导致死亡。在日本于1972年被厚生劳动省指定为指定难病。aa的治疗有血小板或红细胞的输血、粒细胞集落刺激因子(g-csf)等造血因子的给药等支持疗法;以及作为以造血功能恢复为目标的治疗的免疫抑制疗法、蛋白同化类固醇疗法、造血干细胞移植。aa的预后和治疗方针根据重症度有很大不同,因此按照重症度给出治疗方针。在日本的治疗方针中,对于1~2a期(轻症~不需要输血的中等症)的aa患者(排除血小板数100000/μl以上、仅观察到贫血和中性粒细胞数减少的患者),推荐用环孢素(cyclosporina;csa)开始治疗,并考察其效果。由于利用环孢素的治疗反应最迟在8周以内显现,因此,在治疗后8周以内未观察到血小板数或网织红细胞数的上升的情况下,根据血细胞减少的加剧的有无、输血的必要性、自觉症状的有无等选择抗人胸腺细胞免疫球蛋白(atg)、艾曲波帕(eltrombopag:epag)的联用等适合各情况的治疗方法。对于2b~5期(需要输血的中等症~最重症)的aa患者,在小于40岁的有hla相合同胞供体的患者的情况下,造血干细胞移植被认为是主要的治疗方法。对于不适合移植的患者和40岁以上的患者,主要通过atg、csa等的免疫抑制疗法进行治疗,根据需要考虑epag的联用。但是,造血干细胞移植的情况下,在10~20%的患者中发现移植相关死亡,免疫抑制疗法的情况下,尽管治疗已经奏效,但约5%~约10%的长期存活患者向骨髓增生异常综合征(mds)或急性髓系白血病(aml)转变。免疫抑制疗法的奏效率为约33%~约57%,对于免疫抑制疗法无反应或不适用的患者,通过以输血或造血因子的给药为中心的支持疗法来谋求寿命的延续。在贫血、血小板减少的程度强的情况下,在确认到与之相伴的中等症以上的临床症状时实施输血,但为了避免未知的感染症、由抗hla抗体的产生引起的血小板输血无反应的出现、造血干细胞移植时的排斥的风险,输血需要限制在最低限度。对于重症感染症的风险高的中性粒细胞数500/μl以下的患者,给药g-csf,但其效果是暂时的。对于免疫抑制疗法无反应的重症aa患者,可以期待通过联用epag来提高治疗效果,但根据atg未治疗的日本人aa患者中的epag的临床试验数据,存在即使使用epag也未奏效的患者。另外,在实际临床中,还可以设想到具有肝损伤的患者、由于是经口给药制剂而难以维持服药依从性的高龄患者等担心epag的给药的患者。这样,存在即使通过利用epag以造血功能的恢复为目标的药物疗法也无法期待效果的患者,需要安全且有效性更高的治疗方法。罗米司亭是与内源性血小板生成素(tpo)受体c-mpl结合而使血小板产生亢进的血小板造血刺激因子制剂(专利文献1)。罗米司亭于2008年7月在澳洲被批准为“成人慢性免疫性(特发性)血小板减少性紫癜患者(itp)的血小板减少症”的治疗药,之后在60个以上的国家被批准,以romiplate(注册商标)等销售名称进行制造销售。c-mpl不仅在巨核细胞系祖细胞中表达,在骨髓中的未分化程度更高的造血干细胞/祖细胞中也表达,启示了tpo通过使c-mpl活化而促进多系统的血细胞产生。因此,罗米司亭对aa的效果受到期待,以成人aa患者为对象开始了临床开发。自2014年起开始了以免疫抑制疗法无反应的aa患者为对象的罗米司亭的ii期临床(ph2)试验(非专利文献1),在2016年开始了ii/iii期临床(ph2/3)试验(非专利文献2)。在这些临床试验中,每周一次皮下给药罗米司亭,以血小板、红细胞、中性粒细胞反应、从血小板输血的脱离等为指标来验证药效,表明初次给药量为10μg/kg时药效最强。现有技术文献专利文献专利文献1:wo2000/024770非专利文献非专利文献1:leeetal.,“efficacyandsafetyofromiplostiminpatientswithaplasticanemiarefractorytoimmunosuppressivetherapy:1-yearinterimanalysisofphase2clinicaltrial”blood(2016)128:3910非专利文献2:leeetal.,“hematologicresponsetoromiplostimtreatmentisassociatedwithstimulationofprimitivestem/progenitorcellsandstromalcellsinpatientswithaplasticanemiarefractorytoimmunosuppressivetherapy:a2-yearinterimexploratoryanalysisofaphase2clinicaltrial”blood(2017)130:1167技术实现要素:发明所要解决的问题本发明的课题提供使用罗米司亭的再生障碍性贫血的有效的治疗方法。用于解决问题的方法本发明人进行了深入研究,结果发现,通过以特定的用法和用量给药罗米司亭,在再生障碍性贫血的治疗中,能够得到高有效性和安全性,从而完成了本发明。即,本发明涉及下述(1)~(8)。(1)一种药物组合物,其是以罗米司亭作为有效成分的用于治疗再生障碍性贫血的药物组合物,其特征在于,每周一次皮下给药,从给药开始起4周内以罗米司亭计按10μg/kg/周进行给药,第5周以后以罗米司亭计按多于10μg/kg/周且最大20μg/kg/周进行给药。(2)如(1)所述的药物组合物,其特征在于,给药量变更后持续相同的给药量4周以上。(3)如(1)所述的药物组合物,其特征在于,从5周至8周以罗米司亭计按15μg/kg/周进行给药,9周以后以罗米司亭计按最大20μg/kg/周进行给药,给药量变更后持续相同的给药量4周以上。(4)如(1)所述的药物组合物,其特征在于,从5周至8周以罗米司亭计按15μg/kg/周进行给药,从9周至12周以罗米司亭计按20μg/kg/周进行给药,13周以后以罗米司亭计按5~20μg/kg/周进行给药,给药量变更后持续相同的给药量4周以上。(5)如(1)所述的药物组合物,其特征在于,5周以后以罗米司亭计按15μg/kg/周或20μg/kg/周进行给药,给药量变更后持续相同的给药量4周以上。(6)如(1)~(4)中任一项所述的药物组合物,其特征在于,第5周以后的增量幅度以罗米司亭计为5μg/kg。(7)一种药物组合物,其是以罗米司亭作为有效成分的用于治疗再生障碍性贫血的药物组合物,其特征在于,每周一次皮下给药,从给药开始起4周内以罗米司亭计按10μg/kg/周进行给药,第5周以后的增量幅度以罗米司亭计为5μg/kg。(8)如(7)所述的药物组合物,其特征在于,给药量变更后持续相同的给药量4周以上。发明效果根据本发明,在免疫抑制剂未奏效的再生障碍性贫血患者的罗米司亭的治疗中,能够实现高药效。附图说明图1示出ph2和ph2/3中的血小板数的推移。图中,下方的浅色的线表示ph2(kr001)试验10μg/kg开始组(n=10),上方的深色的线表示ph2/3(531-002)试验全部例(n=31)的平均值。误差条表示标准偏差。横轴表示从给药开始起的周数,纵轴表示血小板数。图2示出ph2和ph2/3中的血红蛋白值的推移。图中,下方的浅色的线表示ph2(kr001)试验10μg/kg开始组(n=10),上方的深色的线表示ph2/3(531-002)试验全部例(n=31)的平均值。误差条表示标准偏差。横轴表示从给药开始起的周数,纵轴表示血红蛋白值。图3示出ph2和ph2/3中的中性粒细胞值的推移。图中,下方的浅色的线表示ph2(kr001)试验10μg/kg开始组(n=10),上方的深色的线表示ph2/3(531-002)试验全部例(n=31)的平均值。误差条表示标准偏差。横轴表示从给药开始起的周数,纵轴表示中性粒细胞数。具体实施方式“罗米司亭”罗米司亭是分子量为约59kda的基因重组融合蛋白,是由两分子由269个氨基酸残基(序列号1)构成的亚基构成的二聚体。单体的269个氨基酸中的第2~228位由包含人igg1的fc区域的肽构成,第229~269位由包含人血小板生成素受体(c-mpl)结合序列的肽构成。罗米司亭通过包含两处c-mpl结合区域的肽链与人igg1的fc区域的c-末端结合而成的单链经由二硫键进行结合而形成二聚体。c2634h4086n722o790s18mw:59085罗米司亭具有血小板生成活性和/或巨核细胞生成活性。罗米司亭通过与内源性血小板生成素(tpo)的受体c-mpl结合、促进血小板产生而作为血小板造血刺激因子制剂发挥作用。tpo为人的巨核细胞/血小板造血刺激因子,在1994年进行了基因克隆。罗米司亭被认为通过与c-mpl结合而使其活化,促进从骨髓祖细胞到巨核细胞的过程中的细胞的增殖和分化,结果使血小板(以下也记为plt)增加。本发明中,罗米司亭的制造方法只要作为药物可被接受,则没有特别限定。“再生障碍性贫血”再生障碍性贫血(aplasticanemia,aa)是以外周血中的全部血细胞减少(全血细胞减少)和骨髓的细胞密度降低(低形成)为特征的疾病。实际中,通过排除具有同样特征的、概念更明确的其他疾病而诊断为aa,疾病的本质可以说是“尽管不存在显示出骨髓毒性的药剂的影响,但造血干细胞持续性减少的状态”。aa的诊断需要观察到贫血、出血倾向、偶尔发热作为临床所见,并且满足血红蛋白(hb)浓度小于10g/dl、中性粒细胞小于1500/μl、血小板小于100000/μl这3个项目中的至少2个。此外,在能够否定导致血细胞减少、骨髓低形成和其他全血细胞减少的疾病的情况下诊断为aa,但有时难以与mds相鉴别。aa根据成因分为先天性和后天性。先天性aa中频率最高的是范可尼(fanconi)贫血,其为常染色体隐性的遗传性疾病,其特征在于,除了骨髓低形成以外,还有骨骼系统畸形、身材矮小、性腺功能缺陷等畸形。另外,后天性aa包括特发性(原发性)、由各种药剂、放射线暴露、苯等化学物质引起的继发性、以及肝炎后发病或伴有阵发性夜间血红蛋白尿症的特殊型。在日本,后天性aa中的大部分为特发性(原发性)。aa的治疗包括血小板或红细胞的输血、g-csf等造血因子的给药等支持疗法和作为以造血功能的恢复为目标的治疗的免疫抑制疗法、蛋白同化类固醇疗法、造血干细胞移植。aa的预后和治疗方针根据重症度有很大不同,因此按照重症度给出治疗方针。如前所述,对于1~2a期(轻症~不需要输血的中等症)的aa患者,推荐用csa治疗,并适当联用atg、epag。对于2b~5期(需要输血的中等症~最重症)的aa患者,考虑造血干细胞移植、或者免疫抑制疗法或免疫抑制疗法与epag的联用。对于免疫抑制疗法无反应或不适用的患者,采用以输血、造血因子为中心的支持疗法。“本发明的药物组合物”本发明的“以罗米司亭作为有效成分的用于治疗再生障碍性贫血的药物组合物”(以下称为“本发明的药物组合物”)通过静注(也称为经静脉给药或静脉注射)或点滴静注(也称为点滴静脉注射或点滴)皮下给药(皮下注射)于aa患者。本发明的药物组合物包含药理学上可接受的一种或其以上的载体、添加剂或ph调节剂等。作为添加剂,可以列举例如等渗剂、缓冲剂、助溶剂和防腐剂等。作为等渗剂,没有特别限定,可以列举例如氯化钠、氯化钙、氯化钾、氯化镁、果糖、葡萄糖和d-甘露醇。作为缓冲剂,可以列举例如包含磷酸二氢钾、磷酸氢二钾、磷酸三钠、磷酸二氢钠和磷酸氢二钠、柠檬酸钠、柠檬酸钠水合物的组合物。作为助溶剂,可以列举例如乙醇、乙二胺、癸酸、l-谷氨酸、l-赖氨酸、氧化钙、氧化镁、山梨糖醇酐倍半油酸酯、d-山梨醇、烟酰胺、丙二醇、聚山梨醇酯80和聚桂醇(9e.o.)等。作为防腐剂,可以列举例如苯酚、依地酸钠、苯扎氯铵、氯甲酚、氯丁醇、水杨酸钠、对羟基苯甲酸乙酯和对羟基苯甲酸丁酯等。作为ph调节剂,可以列举例如盐酸、稀盐酸、甘氨酸、琥珀酸、磷酸、磷酸盐、乙酸、酒石酸和葡甲胺等。本发明的药物组合物的形态没有特别限定,可以是用于皮下给药而预先制备的形态,也可以是在使用时稀释或将冷冻干燥的罗米司亭溶解于水等注射用溶剂而制备的形态。本发明的药物组合物填充在玻璃容器和塑料容器等中来提供。容器的形状没有特别限定,可以列举例如管形瓶、注射器、袋和瓶等。作为本发明的药物组合物的优选的一例,可以列举通过按照常规方法将罗米司亭与药理学上可接受的添加物一起冷冻干燥而得到的粉末状制剂。作为这样的药物组合物的具体例,可以列举romiplate(注册商标)。romiplate(注册商标)是在罗米司亭的冷冻干燥物中包含作为添加物的d-甘露醇、精制白糖、l-组氨酸、聚山梨醇酯20、稀盐酸,在给药前适当溶解于注射用水中来使用。“本发明的药物组合物的用法、用量”本发明的药物组合物从给药开始起4周内以罗米司亭计按10μg/kg/周的固定用量每周一次皮下给药,第5周以后根据患者的症状适当增减。第一实施方式中,本发明的药物组合物从给药开始起4周内以罗米司亭计按10μg/kg/周进行给药,第5周以后以罗米司亭计按多于10μg/kg/周且最大20μg/kg/周进行给药。第二实施方式中,本发明的药物组合物从给药开始起4周内以罗米司亭计按10μg/kg/周进行给药,从5周至8周以罗米司亭计按15μg/kg/周进行给药,9周以后以罗米司亭计按最大20μg/kg/周进行给药,给药量变更后持续相同的给药量4周以上。第三实施方式中,本发明的药物组合物从给药开始起4周内以罗米司亭计按10μg/kg/周进行给药,从5周至8周以罗米司亭计按15μg/kg/周进行给药,从9周至12周以罗米司亭计按20μg/kg/周进行给药,给药量变更后持续相同的给药量4周以上。第四实施方式中,本发明的药物组合物从给药开始起4周内以罗米司亭计按10μg/kg/周进行给药,5周以后以罗米司亭计按15或20μg/kg/周进行给药,给药量变更后持续相同的给药量4周以上。第五实施方式中,本发明的药物组合物从给药开始起4周内以罗米司亭计按10μg/kg/周进行给药,第5周以后按照增量幅度以罗米司亭计为5μg/kg/周进行给药。优选给药量变更后持续相同的给药量4周以上。优选给药量变更后持续相同的给药量4周以上。优选第5周以后的增量幅度以罗米司亭计为5μg/kg/周。为了安全地进行给药,本发明的药物组合物优选在使用开始时和用量调整时每周1次测定血小板数。即使在维持用量的情况下,也优选以4周1次为基准测定血小板数。每1次的给药量可以在以罗米司亭计不超过5μg/kg的范围内适当增减。给药量的增量例如在即使连续4周给药同一用量也未确认到血小板反应(血小板数增加20000/μl以上时、或血小板数为10000/μl以上且从基线开始增加100%以上时、或连续8周不依赖血小板输血)、判断安全性没有问题的情况下进行。用量的调整中,优选参考下表设定为治疗上所需的最低限度的用量。[表1]在血细胞系统的改善(例如,不依赖输血的情况下的血小板数超过50000/μl、不依赖输血的情况下的血红蛋白浓度超过10g/dl、并且中性粒细胞数超过1000/μl)持续8周以上的情况下,本发明的药物组合物优选在以罗米司亭计不超过5μg/kg的范围内减量。例如,在以减量后的给药量维持4周3种血细胞系统的改善的情况下,进一步在以罗米司亭计不超过5μg/kg的范围内减量,以后每4周考虑减量。另外,在给药量以罗米司亭计低于5μg/kg的状态下维持4周3种血细胞系统的改善的情况下,优选停药。在停药中确认到3种血细胞中的任意一种恶化的情况下,可以以停药前的给药量重新开始。在即使以20μg/kg/周作为最高给药量连续给药8周也未确认到血小板反应的情况下,进行中止给药等适当的处置。对于本发明的用法、用量而言,用量固定期短(可在早期增量)、增量幅度大(可一口气增量),能够在早期达到最大给药量。通过按照本发明的用法、用量给药罗米司亭,能够获得高药效(血小板、血红蛋白值和/或中性粒细胞值的上升、或者3种血细胞反应),该效果在达到最大给药量后也持续。因此,根据本发明,对于免疫抑制疗法无反应或免疫抑制疗法不适用的aa患者,也可实现优良的改善效果。实施例通过以下的实施例对本发明具体地进行说明,但实施例只不过是本发明的单纯例示,并不对本发明的范围进行限定。在以下的实施例中,作为罗米司亭制剂,使用romiplate(注册商标),但这是包含罗米司亭作为有效成分的药物组合物的一例。实施例1ii期临床(ph2)试验以对免疫抑制疗法无反应的再生障碍性贫血的患者(以下也称为受试者)为对象,按照以下的规程实施随机开放标签平行组间对比用量设定试验(ph2试验)。给药期间■用量固定期(初期用量评价期):第1~8周罗米司亭以1μg/kg、3μg/kg、6μg/kg、10μg/kg中的任一用量每周1次、给药8周。除了满足以下3)的停药标准的情况以外,在此期间维持初次给药量,不进行用量调整。■继续给药期:第9~52周继续给药期的开始用量基于用量固定期(初期用量评价期)的有效性和安全性数据按各患者来决定。在第9周未获得血小板反应的情况下,基于给药量的调整表(继续给药期)增加1个等级用量。在由于血小板输血而无法进行血小板测定的情况下,视为该周未观察到血小板反应。用法、用量的调整方法(第9~52周)1)用量的增量在继续给药期,可以参考给药量的调整表(继续给药期),进行1个等级增量。增量后,在即使给药4周罗米司亭也未获得血小板反应的情况下,可以将最高用量设为20μg/kg,进一步每次1个等级地增量。继续4周给药该用量后,由医生基于各患者的安全性和药效数据决定增量的必要性和时机。2)用量的调整在患者被观察到血小板反应的情况下,参考各患者的有效性和安全性数据,根据医生的判断,按照“给药量的调整表(继续给药期)”(表2),将用量每次1个等级地增量或减量,调整为适当的用量,以使血小板反应能够维持。最高用量设定为20μg/kg。[表2]给药量的调整表(继续给药期)罗米司亭的用量1μg/kg3μg/kg6μg/kg10μg/kg13μg/kg16μg/kg20μg/kg3)停药和重新开始的标准在血小板数超过400×109/l的情况下停药。在血小板数低于200×109/l的情况下,按照给药量的调整表(表2),以比停药前的用量进行1个等级减量后的用量重新开始给药。在该用量下血小板数达到50×109/l以下的情况下,使给药量为停药时的用量。在血小板数超过200×109/l的情况下,按照给药量的调整表(表2),进行1个等级减量。在停药时的用量为1μg/kg的情况下,将重新开始给药时的用量设定为1μg/kg。在由于上述以外的原因产生安全性的担忧的情况下,医生可以随时减少用量。3种血细胞反应的标准主要评价项目为在第9周显示出血小板反应的受试者的比例,主要的次要评价项目设定为显示出血小板反应的受试者的比例、到显示出血小板反应为止的时间、脱离血小板输血的受试者的比例、显示出红细胞反应和/或中性粒细胞反应的受试者的比例。需要说明的是,这些评价指标如下定义。显示出3种血细胞反应或3种血细胞反应阳性是指血小板、红细胞、中性粒细胞全部显示出反应。评价指标的定义◆血小板反应:符合以下中的任意一者时■血小板数比基线(罗米司亭给药开始前的值)增加20×109/l以上■血小板数为10×109/l以上,并且比基线增加100%以上但是,将血小板输血后7天以内的受试者的评价结果作为“无反应”。◆红细胞反应:符合以下中的任意一者时■在罗米司亭给药前血红蛋白浓度低于9.0g/dl的受试者中,血红蛋白浓度在无红细胞输血的情况下比基线增加1.5g/dl以上■与罗米司亭给药前8周的红细胞输血量相比,输血量持续8周减少4单位以上但是,将红细胞输血后28天以内的受试者的评价结果作为“无反应”。◆中性粒细胞反应:符合以下中的任意一者时■在罗米司亭给药前的中性粒细胞数低于0.5×109/l的受试者中,中性粒细胞数比基线增加100%以上■在罗米司亭给药前的中性粒细胞数低于1.0×109/l的受试者中,中性粒细胞数比基线增加0.5×109/l以上但是,将g-csf给药后7天以内的受试者的评价结果作为“无反应”。◆脱离输血在罗米司亭给药前8周实施了血小板输血或红细胞输血作为预治疗的受试者中,连续8周以上未实施血小板输血或红细胞输血时结果将ph2试验的结果与实施例2的ph2/3试验的结果合并示于表4和图1~图3中。以1、3、6、10μg/kg中的任一用量开始每周一次的皮下给药,在到第8周为止的用量固定期(初期用量评价期)未见用量调整(增量或减量)。作为有效性的主要评价项目的在第9周显示出血小板反应的受试者的比例随着给药量的增加而上升,在1和3μg/kg组中为0%、在6μg/kg组中为33.3%、在10μg/kg组中为70.0%。另外,在初期用量评价期显示出红细胞反应和/或中性粒细胞反应的受试者的比例也随着给药量的增加而上升,在1μg/kg组中为14.3%、在3μg/kg组中为57.1%、在6μg/kg组中为55.6%、在10μg/kg组中为70.0%。根据以上的结果,将可知在初期用量评价期显示出显著的血小板反应、红细胞反应和/或中性粒细胞反应的10μg/kg作为后述的ii/iii期临床(ph2/3)试验的治疗开始用量。实施例2ii/iii期临床(ph2/3)试验以对免疫抑制疗法无反应或免疫抑制疗法不适用的再生障碍性贫血的患者为对象,按照以下的规程实施国际联合非盲个体内用量调整ii/iii期临床试验。给药期间(第1~52周)按照以下方法,每周1次皮下给药罗米司亭。■用量固定期(第1~4周)给药开始时的用量设定为10μg/kg,第1~4周之间设定为固定用量。■继续给药期(第5~52周)第5周以后,可以按照以下的用量调整方法调整用量。用量调整方法1)用量的增量在连续4周未确认到血小板反应的情况下,按照用量的调整表(表3),将用量每次1个等级地增量。但是,即使在未确认到血小板反应的情况下,但在担心不良事件的出现或恶化等时,也可以根据医生的判断维持治验药的用量。另外,即使在确认到血小板反应的情况下,但在医生判断为必要时,也可以每4周将用量每次1个等级地增量。[表3]用量的调整表罗米司亭的用量5μg/kg10μg/kg15μg/kg20μg/kg2)用量的减量和停药给药量为10~20μg/kg时,连续8周以上给药相同的用量,在此期间中在整个8周内下述3种血细胞的值全部得以维持、并且未接受输血的情况下,按照用量的调整表(表3)进行1个等级减量。进一步,连续4周给药减量后的用量,在此期间中下述3种血细胞的值得以维持、并且未接受输血的情况下,按照用量的调整表(表3)进一步进行1个等级减量。另外,给药量为5μg/kg时,连续4周以上给药相同的用量,在此期间中在整个4周内下述3种血细胞的值全部满足、并且未接受输血的情况下,将罗米司亭停药。但是,在延长给药期间,在医生判断为由于减量或停药而无法维持下述3种血细胞的值的情况下,可以延缓减量或停药。■血小板数:>50×109/l■血红蛋白浓度:>10.0g/dl■中性粒细胞数:>1×109/l3)再增量和重新开始给药的基准在逐渐减量的过程中,在血小板数、血红蛋白浓度或中性粒细胞数达到下述值中的任意一者的情况下,中断逐渐减量,按照用量的调整表(表3)进行1个等级增量。停药中,在血小板数、血红蛋白浓度或中性粒细胞数达到下述值中的任意一者的情况下,以5μg/kg重新开始给药。■血小板数:<30×109/l■血红蛋白浓度:<9.0g/dl■中性粒细胞数:<0.5×109/l4)用量维持的基准在逐渐减量的过程中,在不满足逐渐减量或再增量的基准的情况下,维持用量,继续给药。3种血细胞反应的标准◆血小板反应:满足以下中的任意一者时■血小板比基线增加20×109/l以上■血小板为10×109/l以上,并且比基线增加100%以上■在初次给药前8周实施了血小板输血作为预治疗的受试者中,连续8周未实施血小板输血◆红细胞反应:满足以下中的任意一者时■在基线的血红蛋白浓度低于9.0g/dl的受试者中,血红蛋白浓度在无红细胞输血的情况下增加1.5g/dl以上■在初次给药前8周实施了红细胞输血作为预治疗的受试者中,在连续8周的期间内输血量累积减少800ml以上◆中性粒细胞反应:满足以下中的任意一者时■在基线的中性粒细胞数少于0.5×109/l的受试者中,中性粒细胞数比基线增加100%以上时■在基线的中性粒细胞数少于1×109/l的受试者中,中性粒细胞数比基线增加0.5×109/l以上显示出3种血细胞反应或3种血细胞反应阳性是指血小板、红细胞、中性粒细胞全部显示出反应。◆脱离输血在罗米司亭给药前8周实施了血小板输血或红细胞输血作为预治疗的患者中,连续8周以上未实施血小板输血或红细胞输血时结果将ph2/3试验的结果与实施例1的ph2试验的结果合并示于表4和图1~图3中。[表4]ph2(10μg/kg组)和ph2/3全部例中的显示出3种血细胞反应的患者的比例27周53周ph2(10μg/kg组)0%(0/10名)10.0%(1/10名)ph2/325.8%(8/31名)38.7%(12/31名)在第27周的时刻显示出血液学反应(血小板反应、红细胞反应和中性粒细胞反应中的任意一者)的受试者的比例在整体中为83.9%。由本试验的结果可知,通过对包含atg的免疫抑制疗法无反应或免疫抑制疗法不适用的aa患者以10μg/kg每周1次开始皮下给药罗米司亭,然后以血小板反应和血小板数以及不良事件为指标,将罗米司亭的用量在5~20μg/kg适当调整,由此可以得到显著的血液学反应(血小板反应、红细胞反应和/或中性粒细胞反应)。考察在ph2/3试验中,与ph2试验相比,用量的增量幅度大(5μg/kgvs.3~4μg/kg)、初次给药量固定期间短(4周vs.8周)。另外,达到最大给药量20μg/kg为止的期间也短(最短为9周vs.17周)。3种血细胞反应阳性的患者的比例在第27周和第53周均是ph2/3试验(全部例31名)高于ph2试验中的初次给药量10μg/kg开始组10名(以下也称为ph2(10μg/kg组)),从第27周到第53周进一步增加。认为ph2与ph2/3中的药效差是由用量固定期的期间和用量调整方法的差异产生的。可知按照ph2/3试验的给药方法,通过从给药开始的10μg/kg起在短时间增量到20μg/kg,显示出比已知给药方法更强的药效,进而在1年后也维持其药效。另外,ph2(10μg/kg组)在能够进行20μg/kg给药的17周以后,也长时间确认到与ph2/3组的药效差。从图1~图3的血小板、血红蛋白值、中性粒细胞值的推移来看,持续至第53周为止,血小板数(图1)、血红蛋白值(图2)、中性粒细胞数(图3)均是ph2/3组高于ph2(10μg/kg组)。按照ph2/3试验的用法、用量,通过将用量固定期(10μg/kg)设定为4周、然后以5μg/kg/周的增量幅度进行调整,能够在早期达到最大给药量。根据该用法、用量,能够实现高药效(血小板、血红蛋白值、中性粒细胞值的上升),其效果在达到最大给药量后仍持续。其结果是,在免疫抑制疗法无反应或免疫抑制疗法不适用的aa患者中,也可以期待优良的改善效果。产业上的可利用性根据本发明,在利用罗米司亭的再生障碍性贫血的治疗中,能够实现高药效,对于利用免疫抑制疗法等现有治疗方法无法获得充分效果的再生障碍性贫血患者也能够提供有效的治疗。本说明书中引用的全部发行物、专利和专利申请直接以参考的形式并入本说明书中。序列表自由文本序列号1:血小板生成素融合蛋白类似物序列表<110>协和麒麟株式会社(kyowakirinco.,ltd.)<120>用于治疗再生障碍性贫血的药物组合物(pharmaceuticalcompositionfortreatingaplasticanemia)<130>pk53-9011wo<150>jp2018-202097<151>2018-10-26<160>1<170>patentinversion3.5<210>1<211>269<212>prt<213>人工序列(artificialsequence)<220><223>血小板生成素融合蛋白类似物(fusionproteinanalogofthrombopoietin)<400>1metasplysthrhisthrcysproprocysproalaprogluleuleu151015glyglyproservalpheleupheproprolysprolysaspthrleu202530metileserargthrprogluvalthrcysvalvalvalaspvalser354045hisgluaspprogluvallyspheasntrptyrvalaspglyvalglu505560valhisasnalalysthrlysproargglugluglntyrasnserthr65707580tyrargvalvalservalleuthrvalleuhisglnasptrpleuasn859095glylysglutyrlyscyslysvalserasnlysalaleuproalapro100105110ileglulysthrileserlysalalysglyglnproarggluprogln115120125valtyrthrleuproproserargaspgluleuthrlysasnglnval130135140serleuthrcysleuvallysglyphetyrproseraspilealaval145150155160glutrpgluserasnglyglnprogluasnasntyrlysthrthrpro165170175provalleuaspseraspglyserphepheleutyrserlysleuthr180185190valasplysserargtrpglnglnglyasnvalphesercysserval195200205methisglualaleuhisasnhistyrthrglnlysserleuserleu210215220serproglylysglyglyglyglyglyilegluglyprothrleuarg225230235240glntrpleualaalaargalaglyglyglyglyglyglyglyglyile245250255gluglyprothrleuargglntrpleualaalaargala260265当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1