FGF-2衍生多肽在制备促进软骨修复和/或治疗骨关节炎药物中的用途的制作方法
本发明属于生物医学
技术领域:
,具体涉及fgf-2衍生多肽在制备促进软骨修复和/或治疗骨关节炎药物中的用途及含有其的药物。
背景技术:
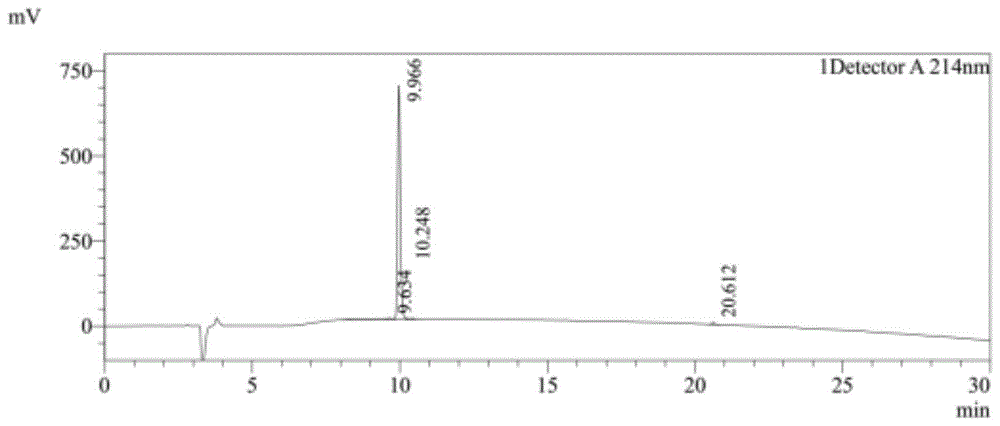
:骨关节炎(osteoarthritis,oa)是一种常见的关节疾病,表现为关节疼痛、僵硬,软骨损伤是导致骨关节炎的主要成因。本病在中年以后多发,女性多于男性,40岁人群的患病率为10%-17%,60岁以上为50%,而在75岁以上人群则高达80%。该病致残率可高达53%。而随着人口的日益老龄化,骨关节炎将成为影响人们生活质量的重要问题,骨关节炎药物市场需求将不断扩大。目前临床上对于骨关节炎的治疗药物分为特异性治疗药物与非特异性治疗药物。非特异性治疗药物以镇痛和控制症状为主,但对软骨没有保护作用,如非甾体抗炎药等。特异性治疗药物可保护关节软骨,延缓骨关节炎进展,如氨基葡萄糖、硫酸软骨素等,但一般起效较慢,需治疗数月才见效,而且对受损软骨的再生没有作用。因此开发一种安全性好、疗效突出的新型骨关节炎治疗药物成为医学界的一大目标。如上文所述,软骨损伤是导致骨关节炎的主要成因,关节软骨是由丰富的细胞外基质(ecm)和嵌于其中的少数软骨细胞所组成。软骨细胞的代谢受到许多细胞因子的调节,如成纤维细胞生长因子2(fibroblastgrowthfactor-2,fgf-2)等。fgf-2是fgf家族的一员,是一种强有力的促分裂素,对多种细胞具有促有丝分裂作用,能促进软骨细胞基质的分化及软骨细胞的增殖及成熟,促进软骨基质合成,增加蛋白多糖及ⅱ型胶原的合成(参见非专利文献1)。fgf-2对软骨代谢的作用目前仍存在争议(参见非专利文献2)。在hmsc分化时期给予fgf-2,可促进hmsc向软骨细胞分化(参见非专利文献3、4)。同时,fgf-2可选择性地激活fgfr1,通过上调基质金属蛋白酶(mmps)而抑制细胞外基质(ecm)和蛋白多糖合成,从而导致oa的发生(参见非专利文献5)。本发明公开了两种来源于fgf-2的肽(分别如seqidno:1和2所示),其具有促进软骨再生和修复,治疗骨关节的作用。有文献报道显示,这两种肽具有增强成骨细胞分化和新骨形成(参见非专利文献6),但尚未见文献报道其软骨再生活性。非专利文献1:bradhamdm等人.invivocartilageformationfromgrowthfactormodulatedarticularchondrocytes.clinorthoprelatres,1998,(352):239-249非专利文献2:ornitzdm,mariepj.fibroblastgrowthfactorsignalinginskeletaldevelopmentanddisease〔j〕.genesdev,2015;29(14):1463-86.非专利文献3:corread,somozara,linp,etal.sequentialexposuretofibroblastgrowthfactors(fgf)2,9and18enhanceshmscchondrogenicdifferentiation〔j〕.osteoarthritiscartilage,2015;23(3):443-53.非专利文献4:handorfam,liwj.fibroblastgrowthfactor-2primeshumanmesenchymalstemcellsforenhancedchondrogenesis〔j〕.plosone,2011;6(7):3007-24.非专利文献5:nummenmaae,hmlinenm,moilanent,etal.effectsoffgf-2andfgfreceptorantagonistsonmmpenzymes,aggrecan,andtypeiicollageninprimaryhumanoachondrocytes.〔j〕.scandjrheumatol,2015;44(4):321-30.非专利文献6:leejy等人effectofimmobilizedcell-bindingpeptidesonchitosanmembranesforosteoblasticdifferentiationofmesenchymalstemcells.biotechnolapplbiochem.2009jan;52(pt1):69-77.doi:10.1042/ba20070169。技术实现要素:基于此,针对上述技术问题,本发明旨在以fgf-2的氨基酸序列为来源,开发出一种稳定的可以用于修复软骨和/或治疗骨关节炎的新型肽,分别命名为pdg6和ked7。本发明的目的通过以下技术方案来实现:本发明涉及两种用于修复软骨和/或治疗骨关节炎的肽,称为肽pdg6和ked7,其氨基酸序列分别如seqidno:1和2所示。这两种肽是来源于fgf-2的多肽片段。本发明其中一个目的是要求保护fgf-2衍生多肽在制备促进软骨修复和/或治疗骨关节炎药物中的用途。优选地,当所述fgf-2衍生多肽制备成药物时,其为药学上可接受的盐形式,所述盐为其醋酸盐、盐酸盐或磷酸盐。优选地,当所述盐为醋酸盐时,其生物相容性最好。优选地,所述fgf-2衍生多肽的羧基端可进行酰胺化或羰基化修饰。更优选地,所述fgf-2衍生多肽的羧基端可进行酰胺化修饰。优选地,所述药物还包括其它治疗骨关节炎的药物。优选地,所述其它治疗骨关节炎的药物为透明质酸或非甾体抗炎药,与上述两种药联用效果最好。优选地,所述fgf-2衍生多肽用于促进修复软骨和/或治疗骨关节炎的有效剂量为1~5mg。本发明其中一个目的是提供一种融合蛋白,所述融合蛋白由如上所述fgf-2衍生多肽与免疫球蛋白恒定区(fc)或人血清白蛋白(hsa)融合形成。该融合蛋白采用现有常规的融合技术制得。本发明其中一个目的是提供一种促进软骨修复和/或治疗骨关节炎药物,所述药物含有治疗有效剂量的如上所述的fgf-2衍生多肽或如权利要求8所述的融合蛋白,和药学上可接受的载体。优选地,所述药学上可接受的载体为生理盐水溶液或透明质酸凝胶;所述药物的给药方式是注射给药。更优选地,所述注射给药包括膝关节腔注射或皮下注射。本发明的发明人经体外试验证实,肽pdg6和ked7能够促进间充质干细胞向软骨细胞的分化;显著促进软骨细胞的增殖及ii型胶原蛋白的表达;在斑马鱼软骨损伤模型中表现出优异的促进受损软骨再生的作用;在大鼠骨关节炎(oa)模型中显著降低oa评分。这说明,肽pdg6和ked7能够作为促进软骨修复和治疗骨关节炎的药物。与现有技术相比,本发明具有以下有益效果:本发明的肽pdg6和ked7来源于fgf-2,能够显著促进软骨再生,同时具有易于合成、免疫原性低等优点,因此本发明的多肽在软骨损伤和骨关节炎治疗中具有广阔的应用前景。附图说明图1a、b分别为肽pdg6和ked7固相合成的hplc检测图谱;图2为肽pdg6和ked7对ⅱ型胶原(col2a1)mrna表达的作用结果图;图3为肽pdg6和ked7对蛋白多糖(acan)mrna表达的作用结果图;图4为肽pdg6和ked7对大鼠软骨细胞增殖的作用结果图;图5为肽pdg6和ked7处理软骨细胞的col2a1免疫组化结果图;图6为肽pdg6和ked7对斑马鱼受损软骨的修复作用结果图;图7为肽pdg6和ked7对斑马鱼受损软骨的修复作用的照片;其中a)为正常对照组;b)为模型对照组;c)为阳性对照组;d)为pdg6低剂量组;e)为pdg6中剂量组;f)为pdg6高剂量组;g)为ked7低剂量组;h)为ked7中剂量组;i)为ked7高剂量组;图8为肽pdg6和ked7治疗大鼠oa模型的病理评分结果。具体实施方式以下通过实施例形式的具体实施方法,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例一、肽pdg6和ked7的固相合成pdg6(seqidno:1)和ked7肽(seqidno:2)采用常规固相工艺合成,合成的肽纯度>95%,两种多肽的hplc检测图谱分别如图1a和图1b所示,合成500mg。实施例二、肽pdg6和ked7体外对间充质干细胞分化的作用1.1人间充质干细胞的培养和传代:将人骨髓间质干细胞(bmscs,购自广州赛业生物科技有限公司)复苏,加入完全培养基,置于37℃、5%co2、饱和湿度的培养箱中培养。复苏后的第二天,给复苏的细胞换用新鲜的完全培养基,每两天给细胞换新鲜的完全培养基直到细胞达80%-90%的汇合度,然后进行传代培养。1.2成软骨诱导:将肽pdg6和ked7用磷酸缓冲液(pbs)溶解。用含不同浓度的pdg6或ked7肽(0.1μm、1μm和10μm)的完全成软骨培养基重悬细胞,使得bmscs的浓度为每毫升5.0×105个细胞,并以pbs为阴性对照,1μm人胰岛素生长因子1(igf-1)为阳性对照。处理的bmscs置于37℃,5%co2饱和湿度条件下孵育。每2-3天更换培养基,每管加入0.5ml新鲜完全成软骨培养基。1.3qpcr检测:收集细胞,trizol法提取总rna,逆转录得cdna,反应条件为:30℃保温10分钟;42℃保温60分钟;85℃保温10分钟。以cdna为模板,利用下列引物,对ii型胶原(col2a1)和蛋白聚糖(aggrecan,acan)进行定量pcr,反应条件为:50℃2分钟;95℃2分钟;95℃15秒,60℃32秒读板,40个循环。col2a1-f1caagaacagcattgcctatccol2a1-r1ataacagtcttgccccacttacan-f1tgggtctggagtagaagtatcaacan-r1gttagcttcgtggaatgcaβ-actin-f1tggatcagcaagcaggagtaβ-actin-r1tcggccacattgtgaacttt2.结果2.1肽pdg6和ked7对col2a1和acan基因表达的诱导作用0.1、1和10μm的肽pdg6和ked7均可显著促进col2a1、acan的mrna表达量增加,并表现出明显的量效关系和时效关系(见图2、图3),说明肽pdg6和ked7可促进间充质干细胞向软骨细胞的分化。实施例三、肽pdg6和ked7对软骨细胞增殖的作用1.1软骨细胞培养:无菌条件下切取2月龄新西兰大白兔关节软骨,剪成1mm大小,37℃下分别以2mg/ml透明质酸酶消化45分钟、2mg/ml胰蛋白酶消化45分钟、4mg/ml的ⅱ型胶原酶消化3小时,冲洗离心(1500r/分钟)5分钟,将沉淀物置入含15%胎牛血清dmem培养基中进行培养。1.2软骨细胞的鉴定:取少量原代软骨细胞涂片后用i型胶原抗体sabc免疫检测,染成棕黄色,说明分泌i型胶原,证实为软骨细胞。1.3mts法测软骨细胞增殖:软骨细胞按照2×104个/孔接种于96孔板,加入不同浓度的肽pdg6和ked7(0.1、1和10μm),并以pbs为阴性对照组,igf-1(1μm)为阳性对照组,37℃、5%co2的饱和水汽二氧化碳培养箱中培养5天。每孔加20μlmts混合液,继续培养3-4小时显色。检测前摇晃培养板10秒钟,混匀颜色。在酶联检测仪上,波长570nm处检测各孔的光吸收值(od)。1.4免疫组化测col2a1:软骨细胞以3.5×105/ml接种于放置有盖玻片的6孔培养板中,加入不同浓度的肽pdg6和ked7,并以pbs为阴性对照组,igf-1(1μm)为阳性对照组。37℃、5%co2的饱和水汽二氧化碳培养箱中培养5天。处理的软骨细胞以4%多聚甲醛固定24~36小时,切成合适大小材料,进行石蜡包埋。蜡块切成5μm厚的切片,经二甲苯脱蜡后,pbs洗3次,每次5分钟。于微波炉中高火加热至沸腾,低火维持沸腾继续加热8分钟(柠檬酸抗原修复液),待水温自然降至室温。pbs洗3次,每次5分钟;10%山羊血清室温封闭30分钟;一抗4℃孵育过夜,pbs洗3次,每次5分钟;二抗室温孵育30分钟,pbs洗3次,每次5分钟;dab显色,pbs洗3次,每次5分钟;苏木素复染,水洗去多余染液,分化数秒。水洗,返蓝。50%、75%、85%、95%和100%乙醇梯度脱水各1次,二甲苯透明2次,每次5分钟。中性树胶封片。2.结果2.1肽pdg6和ked7对软骨细胞增殖的促进作用不同浓度的肽pdg6和ked7处理5天后,与pbs组相比,0.1、1和10μm的pdg6和ked7显著促进软骨细胞的增殖,且量效关系明显(见图4)。2.2肽pdg6和ked7对col2a1表达的促进作用与pbs处理组相比,0.1、1和10μm的肽pdg6和ked7处理组的col2a1免疫组化染色明显增加,表明col2a1蛋白表达量显著提高,1μm时达到最高(见图5)。综合以上结果,说明肽pdg6和ked7在体外可以促进软骨细胞增殖及ii型胶原蛋白的表达。实施例四、肽pdg6和ked7对斑马鱼软骨损伤模型的修复作用随机选取受精后2天的转基因软骨荧光斑马鱼于六孔板中,每孔(即每浓度组)30尾斑马鱼,水溶给予地塞米松建立斑马鱼软骨损伤模型。模型斑马鱼分别静脉注射给予生理盐水溶解的肽pdg6和ked7,剂量为20、100、500ng/尾,水溶给予阳性对照药硫酸软骨素1000μg/ml浓度,同时设置正常对照组(给予生理盐水)和模型对照组(给予生理盐水),每孔容量为3ml,28℃培养箱孵育72小时。实验结束后,每组随机选取10尾斑马鱼在显微镜下观察、拍照并保存图片,用尼康nis-elementsd3.10高级图像处理软件,测定斑马鱼软骨荧光强度、斑马鱼角舌骨和meckel’s软骨的长度和角度。软骨再生作用计算公式如下:用t检验进行统计学分析,统计学处理结果用表示,p<0.05表明具有显著性差异。结果:与模型对照组相比,中、高剂量(分别为100、500ng/尾)的肽pdg6和ked7处理,均显示出明显的软骨修复作用,表现为肽pdg6和ked7中、高剂量组的斑马鱼的荧光明显强于模型对照组(**代表p<0.01),且量效关系明显(见图6、图7),提示肽pdg6和ked7有促进受损软骨再生的作用。表1肽pdg6和ked7对斑马鱼软骨损伤的治疗作用正常对照组899032±37936模型对照组573260±51879pdg6低剂量组638424±42568pdg6中剂量组746891±32442**pdg6高剂量组863569±62836**ked7低剂量组662738±53276ked7中剂量组726549±56729**ked7高剂量组824633±63792**阳性对照组878931±69391注:**代表与模型对照相比,差异具有统计学意义(p<0.01)。实施例五、肽pdg6和ked7对大鼠骨关节炎(oa)模型的作用1.1建模:采用手术切断前交叉韧带(aclt)联合半月板切除(mmt)的方法,建立大鼠oa模型,具体操作如下:sd大鼠肌注一定剂量的抗生素(庆大霉素,20mg/kg),皮下注射阿托品(0.05mg/kg),1.5~3.0%异氟烷用于维持手术中麻醉。动物麻醉后,对一侧(右侧)膝关节进行备毛,并用碘伏清洁消毒,做好手术准备。股骨-胫骨关节内侧将被切开,通过钝性分离显露内侧半月板,并在半月板最窄的处进行全厚度切割,同时切断前交叉韧带,完成后关节复位,缝合膝关节肌肉、韧带及皮肤,并对术部消毒。所有动物术后连续3天给予一定量的镇痛剂痛立定(4%托芬那酸,0.1mg/kg,i.m.),每日一次。所有动物手术结束后给予一定量的抗生素(庆大霉素,20mg/kg,i.m.)。麻醉恢复期动物允许自由的活动及完全负重,动物实验人员在麻醉恢复期须密切监控所有动物。1.2治疗:手术后两周,成模动物随机分为正常对照组、模型对照组、肽pdg6低、中、高剂量组、肽ked7低、中、高剂量组,分别给予生理盐水、生理盐水、0.2mg、1mg、5mg的肽pdg6和0.2mg、1mg、5mg的肽ked7,给药方式为右后肢膝关节腔注射,给药体积为50μl。1.3检测:给药治疗28天后,动物安乐死,取所有组右膝关节及模型组左膝关节,10%nbf固定48小时以上,甲酸脱钙,石蜡包埋,冠状面切片,h&e和safranin-o染色;由专业病理师对切片进行退行性改变评分(软骨退变,骨赘,软骨钙化和软骨下骨损伤的数量和程度,滑膜炎症的数量),评分标准参考osteoarthritisresearchsocietyinternational(oarsi)scoringsystem。1.4统计分析:利用graphpadprism(graphpadsoftware,inc.,lajolla,ca,usa)或paswstatistics18.0(spssinc.)进行数据分析。当p<0.05认为有显著性差异.1.5结果:与模型对照组相比,肽pdg6和ked7各治疗组oa评分均下降,且量效关系明显,其中中、高剂量组有统计学意义,提示肽pdg6和ked7对大鼠oa模型有治疗作用。表2pdg6和ked7大鼠oa的治疗作用(oarsi评分)注:**代表与模型对照相比,差异具有统计学意义(p<0.01)。上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所述
技术领域:
中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。sequencelisting<110>广州领晟医疗科技有限公司<120>fgf-2衍生多肽在制备促进软骨修复和/或治疗骨关节炎药物中的用途<160>2<170>patentinversion3.3<210>1<211>6<212>prt<213>人工序列<400>1proaspglyargvalasp15<210>2<211>7<212>prt<213>人工序列<400>2lysgluaspglyargleuleu15当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1