一种核酸跨膜运输载体及其制备方法与流程
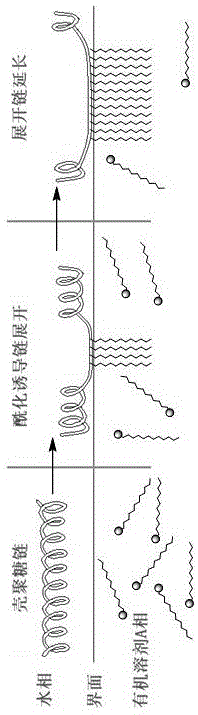
本发明涉及核酸类药物传递体的领域。具体地,本发明提供了具有“氨基糖区域”以及“糖酯区域”的脂肪酸改性壳聚糖的制备方法,以及有利于核酸的体内递送的组合物的组成。此外,本发明提供了制备此类组合物的方法以及测定此类组合物在生理环境中的稳定性的方法,可用于多种疾病的治疗。
背景技术:
:治疗性核酸包括例如小干扰rna(sirna)、微rna(mirna)、反义寡核苷酸、核酶、质粒和免疫刺激性核酸。此类核酸通过多种机制起作用。rnai的治疗性应用极其广泛,因为sirna和mirna构建体可用针对靶蛋白质的任何核酸序列合成。迄今为止,sirna构建体在体外和体内模型中都已显示出特异性下调靶蛋白质的能力。然而,目前治疗性核酸的临床应用还面临的两个问题:首先,容易被血浆中的核酸酶水解;其次,进入细胞内部的能力有限。针对核酸酶水解的问题,目前通常的办法是通过化学修饰的方式来掩盖核酸的酶切部位(例如硫代磷酸酯基团修饰)。例如,研究人员使用硫代磷酸酯、甲基膦酸酯或氨基磷酸酯键合核苷酸间的磷酸二酯键;uhlmanne等人对核苷酸的碱基(例如,5-丙炔基-嘧啶)或糖(例如,2'-修饰的糖)进行修饰(antisense:chemicalmodifications.encyclopediaofcancer,第x卷,pp64-81academicpressinc.(1997));另外,研究人员还利用2'-5'糖苷键来提高核酸的稳定性(us5532130)。然而,这些化学修饰在使治疗性核酸免受核酸酶水解的同时降低了该治疗性核酸的活性。其次,治疗性核酸向细胞内传递可通过使用载体系统(例如聚合物、阳离子脂质)或通过化学修饰构建体(例如通过与胆固醇分子共价结合)来进行促进。为了尝试提高功效,研究者也已利用基于脂质的载体系统递送化学修饰的或未修饰的治疗性核酸。目前阴离子(常规的)脂质体、ph敏感性脂质体、免疫脂质体、膜融合脂质体(fusogenicliposome)和阳离子脂质/反义聚集体已经得到了一定的应用。尽管取得最新的进展,但本领域内仍然存在对适合于常规治疗用途的改进的组合物的需要。首先,待发明的组合物要具有更好的生物相容性以降低额外的免疫反应的发生;其次,该组合物可以以较高效率封装核酸,具有高的包封率,保护封装的核酸在血清中免受降解和清除,适合于全身性递送,并且提供封装的核酸的细胞内递送;再次,该组合物应具有合理的价格区间,从而能够惠及到更多的受众。有鉴于此,特提出本发明,本发明提供了符合上述要求的新型组合物、制备所述组合物的方法以及使用所述组合物将核酸引入细胞的方法。技术实现要素:针对现有技术中存在的问题,本发明提供一种核酸跨膜运输载体及其制备方法,其组合物为脂肪酸改性壳聚糖、胆固醇和核酸类物质。由于壳聚糖分子上含有大量的氨基,利用界面反应在壳聚糖结构单元上引入长链疏水基团;从而使改性后的壳聚糖同时具有亲水基团(氨基糖区域)和双亲性基团(糖酯区域);脂肪酸改性壳聚糖中氨基糖区域氨基的pka在6.5以下,能够为核酸类物质提供亲和性高的结合区域;而脂肪酸改性壳聚糖中的糖酯区域趋向于形成棒状胶团或层状胶团结构,从而使核酸类物质得到物理保护。而散的多股螺旋结构在接近细胞膜时则容易发生翻转,从而易于插入细胞膜,为核酸类物质的跨膜运输提供动力。为解决上述技术问题,本发明采用以下技术方案:一种核酸跨膜运输载体,所述的核酸跨膜运输载体由原料和负载药物组成,所述原料包括脂肪酸改性壳聚糖和胆固醇,所述负载药物为核酸类物质;所述脂肪酸改性壳聚糖由“糖酯区域”和“氨基糖区域”构成,如下:所述的核酸跨膜运输载体的制备方法,包括如下步骤:1)脂肪酸改性壳聚糖的制备:所述脂肪酸改性壳聚糖由壳聚糖与脂肪酸在酸性水溶液以及有机溶剂a组成的混合液中,活化剂以及缚酸剂的存在下反应得到;2)核酸跨膜运输载体的制备:所述的核酸跨膜运输载体由脂肪酸改性壳聚糖、胆固醇以及待包封的核酸类物质,利用挤出法获得。具体包括如下步骤:(1)将壳聚糖溶于乙酸溶液中,然后加入溶有缚酸剂、活化剂和脂肪酸的有机溶剂a,搅拌反应3小时,有机相旋转蒸发至干,洗涤、冷冻干燥至恒重,得到淡黄色脂肪酸改性壳聚糖;本发明采用界面反应的方式进行,酰化反应优先发生于水与有机溶剂a的界面上的壳聚糖上的氨基基团,生成的脂肪酸改性壳聚糖分布于界面周围,能够使得周边的氨基更容易发生酰化反应,使得发生脂肪酸改性的壳聚糖区间非常集中。(2)将步骤(1)得到的脂肪酸改性壳聚糖以及适量胆固醇溶于有机溶剂b,加入待包封的核酸类物质溶液,乳化得到w/o初乳,将w/o初乳加入到10倍体积的水中混合,乳化得到w/o/w乳液,利用旋转蒸发去除有机溶剂,利用挤出法制备得到核酸跨膜运输载体。进一步,所述步骤(1)中的有机溶剂a为二氯甲烷、氯仿、乙酸乙酯、乙酸甲酯中的一种。进一步,所述步骤(1)中的壳聚糖分子量为10000-100000。进一步,所述步骤(1)中的脂肪酸为棕榈酸、硬脂酸、油酸、亚油酸、α-亚麻酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸中的一种或几种的混合物;所述活化剂为甲酰氯、乙酰氯、氯化亚砜、光气、三光气、dcc中的一种;所述的缚酸剂为三乙胺、三甲胺、氢氧化钠、氢氧化钾中的一种。进一步,所述步骤(1)中的壳聚糖、脂肪酸、活化剂以及缚酸剂的摩尔比为:(0.1~1.0):1.0:1.5:2.0,优选为0.2~0.8:1.0:1.5:2.0。进一步,所述步骤(2)中的有机溶剂b为甲醇、乙醇、丙酮、丁酮中的一种。进一步,所述步骤(2)中的脂肪酸改性壳聚糖、胆固醇以及核酸类物质的质量比为:(2.0~10.0):(0.1~1.0):1,优选为(4.0~8.0):(0.2~0.5):1。进一步,所述步骤(2)中的核酸类物质为sirna、反义寡核苷酸、微rna、antagomir、微rna抑制剂、免疫刺激性核酸或u1接头。根据本发明,典型的制备方法包括如下步骤:a、精密称取一定量壳聚糖,溶于1%的乙酸溶液中,转移至三口烧瓶中,置于低温冷机中,低速搅拌的条件下,低温下缓慢滴加溶有缚酸剂、活化剂和脂肪酸的有机溶剂a,全部滴加完毕,搅拌反应3小时。后处理条件如下:首先分出水相,水相用适量溶剂a洗涤两次,合并有机相,旋转蒸发至干,用适量水洗涤多次,过滤并冷冻干燥至恒重,即得到淡黄色脂肪酸改性壳聚糖。b、将步骤a得到的脂肪酸改性壳聚糖以及适量胆固醇溶于有机溶剂b,加入待包封的核酸类物质溶液,乳化得到w/o初乳,将初乳加入到10倍体积的水中混合,乳化得到w/o/w乳液。利用旋转蒸发去除有机溶剂,利用挤出法制备得到核酸跨膜运输载体。本发明的有益效果:1)对于核酸载体的合成设计以脂肪酸和壳聚糖为主要原料,无毒无害、生物相容性好,且可以生物降解,具有非常高的环境友好性;2)利用界面反应在壳聚糖结构单元上引入长链疏水基团;从而使改性后的壳聚糖同时具有亲水基团(氨基糖区域)和双亲性基团(糖酯区域);3)脂肪酸改性壳聚糖中氨基糖区域氨基的pka在6.5以下,能够为核酸类物质提供亲和性高的结合区域;4)脂肪酸改性壳聚糖中的糖酯区域趋向于形成棒状胶团或层状胶团结构,从而使核酸类物质得到物理保护;5)棒状胶团或层状胶团结构在接近细胞膜时则容易发生翻转,从而易于插入细胞膜,为核酸类物质的跨膜运输提供动力。附图说明图1是本发明实施例1脂肪酸改性壳聚糖形成氨基糖区域以及糖酯区域示意图。图2是本发明实施例1壳聚糖(a)与脂肪酸改性壳聚糖(b)的红外光谱比较。图3是本发明实施例1脂肪酸改性壳聚糖、胆固醇与核酸类物质形成棒状以及层状胶团结构的核酸跨膜运输载体示意图。具体实施方式下文将结合具体实施例对本发明的制备方法做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,均可从商业途径得到。下面参照图1对本发明的实施方案进行详细的解释。图1表现了壳聚糖发生界面酰化反应的历程。壳聚糖链首先以卷曲、盘绕等形式存在于水溶液中(图中为壳聚糖分子中较为规则的部分释义,其中空间存在形式经历的反应历程也与此类似,故未全部列出)。由于脂肪酸及活化剂存在于有机溶剂a相中,因此,靠近界面的壳聚糖以及脂肪酸率先发生酰化反应(产物形式见图1中间部分)。而酰化反应生成的产物容易固定于界面,从而诱导壳聚糖链展开而有利于酰化反应继续进行。并优先发生于已酰化位置附近。因此,能够在局部形成“糖酯区域”。实施例11)脂肪酸改性壳聚糖的制备精密称取一定量壳聚糖,溶于10ml1%的乙酸溶液中,转移至三口烧瓶中,置于低温冷机中,低速搅拌的条件下,25℃下同时缓慢滴加溶有一定量三乙胺的二氯甲烷溶液以及溶有硬脂酸和氯化亚砜的二氯甲烷溶液,全部滴加完毕,搅拌反应3小时。后处理条件如下:首先分出水相,水相用100ml二氯甲烷洗涤两次,合并有机相,旋转蒸发至干,用100ml水洗涤多次,过滤并冷冻干燥至恒重,即得到淡黄色脂肪酸改性壳聚糖。2)核酸跨膜运输载体的制备将步骤1)得到的脂肪酸改性壳聚糖以及适量胆固醇溶于有机溶剂b,加入待包封的核酸类物质溶液,乳化得到w/o初乳,将初乳加入到10倍体积的水中混合,乳化得到w/o/w乳液。利用旋转蒸发去除有机溶剂,利用挤出法制备得到核酸跨膜运输载体。示例性基于核酸的试剂包括dsrna、反义寡核苷酸、核酶、微rna、免疫刺激性寡核苷酸或三螺旋形成的寡核苷酸。为了示例,特选用如下sirna作为案例进行说明。sirnatargetgenesensestrandantisensestrand16c_gfp22-mergfpggcaucaaagccaacuucaaaauugaaguuggcuuugaugccgutomegfp22-meregfpggcaucaaggugaacuucaaaauugaaguucaccuugaugccgunb_mgchehmgchehaucauggaauuggaggcaaaaguuugccuccaauuccaugaucanb_mgcheimgcheigggccgugugaguugcagugaucugcaucucucacggucccca3)包封率测定包封率利用测定法来测定。是用于定量溶液中的寡核苷酸和单链dna的超灵敏突光核酸染色剂。用于检测核酸跨膜运输载体在血清中的稳定性。同时,在血清中检测到的寡核苷酸和单链dna的量也与包封率定量相关。如果包封率很高,则表明载体处理较完全的封装状态,载体在体内施用后不会快速分解成它们的组成部分。实施例1-8和对比例1-4实施例1-8和对比例1-4的工艺步骤参照以上反应过程进行,区别仅在于壳聚糖的分子量、脂肪酸的种类、跨膜运输载体的物料比例以及不同负载的核酸类型的不同,具体如表1所示:表1各核酸跨膜运输载体的包封率见表2。表2壳聚糖(分子量)胆固醇核酸摩尔比包封率(%)实施例110000-50000胆固醇16c_gfp22-mer10.0:0.2:1.094.3实施例250000-100000胆固醇16c_gfp22-mer5.0:0.2:1.093.5实施例310000-50000胆固醇tomegfp22-mer10.0:0.2:1.096.2实施例450000-100000胆固醇tomegfp22-mer5.0:0.2:1.095.8实施例510000-50000胆固醇nb_mgcheh10.0:0.2:1.093.7实施例650000-100000胆固醇nb_mgcheh5.0:0.2:1.094.0实施例710000-50000胆固醇nb_mgchei10.0:0.2:1.095.1实施例850000-100000胆固醇nb_mgchei5.0:0.2:1.094.7对比例12000-10000胆固醇16c_gfp22-mer50.0:0.2:1.038.2对比例22000-10000胆固醇tomegfp22-mer50.0:0.2:1.044.1对比例3100000-200000胆固醇nb_mgcheh2.5:0.2:1.075.5对比例4100000-200000胆固醇nb_mgchei2.5:0.2:1.074.9从上述数据可以看到,适合的分子量范围是能否形成包埋型载体的关键因素。如果壳聚糖的分子量过小,则相同的反应条件下,脂肪酸改性后的壳聚糖无法形成显著的棒状胶团结构或层状胶团结构,从而无法对待包埋的核酸类物质形成很好的保护,从而导致较低的包封率;而如果选用的壳聚糖分子量过大,则导致壳聚糖的改性区域过于集中,而能够负载核酸类物质的区域异常臃肿,从而影响了包埋的效率,导致了相对低的包封率。从未改性的壳聚糖的红外光谱可以看到,3200cm-1~3500cm-1处具有一个较大的宽峰,从归属上来看,应为o-h的伸缩振动吸收峰存在的区间以及n-h的伸缩振动吸收峰存在的区间,因此考虑是两种伸缩振动吸收峰重叠而成;宽峰的强度有所降低,表明发生反应的壳聚糖中的部分氨基或羟基发生了反应。1735cm-1处出现强吸收,这是羧酸上羰基的谱带,胺基谱带1658、1553cm-1明显增强,并且能够观测到酰胺ⅱ谱带的倍频3090cm-1谱带,这些都表明反应主要发生在n上,而1409cm-1吸收的增加则说明体系中的ch2基团增加了。脂肪酸改性壳聚糖中的糖酯区域趋向于形成棒状胶团(图3左)或层状胶团结构(图3右),形成聚集区域以及暴露于水相的区域,聚集区域主要由亲脂性的长碳链构成,而暴露于水相的区域则能够为核酸类物质提供良好的微环境,从而使核酸类物质得到物理保护。另外,在遇到细胞膜结构时,以上两种结构会发生翻转,并将负载的核酸类物质转入细胞内。以上显示和描述了本发明的基本原理和主要特征以及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种基于CRISPR‑Cas9系统的基因编辑载体及其应用的制造方法与工艺
- 一种基于CRISPR/Cas9技术制备水稻OsPIL15突变体的方法及应用与流程
- 检测黄曲霉毒素M1的核酸适配体、传感器、试剂盒及应用的制造方法与工艺
- 一组肌酸激酶同工酶核酸适配体及其应用的制造方法与工艺
- 用于抑制KRAS靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制EIF4E靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制VEGFA靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 一种新型向导RNA表达盒及在CRISPR/Cas系统中的应用的制造方法与工艺
- 一种具备双单链末端PCR产物的获得方法及其检测方法与流程
- 一种通过生物技术扩增脱氧胸苷三磷酸的方法与流程