一种盐酸齐拉西酮药物组合物及其制备方法与流程
本发明属于药物组合物
技术领域:
,尤其涉及一种盐酸齐拉西酮药物组合物及其制备方法。
背景技术:
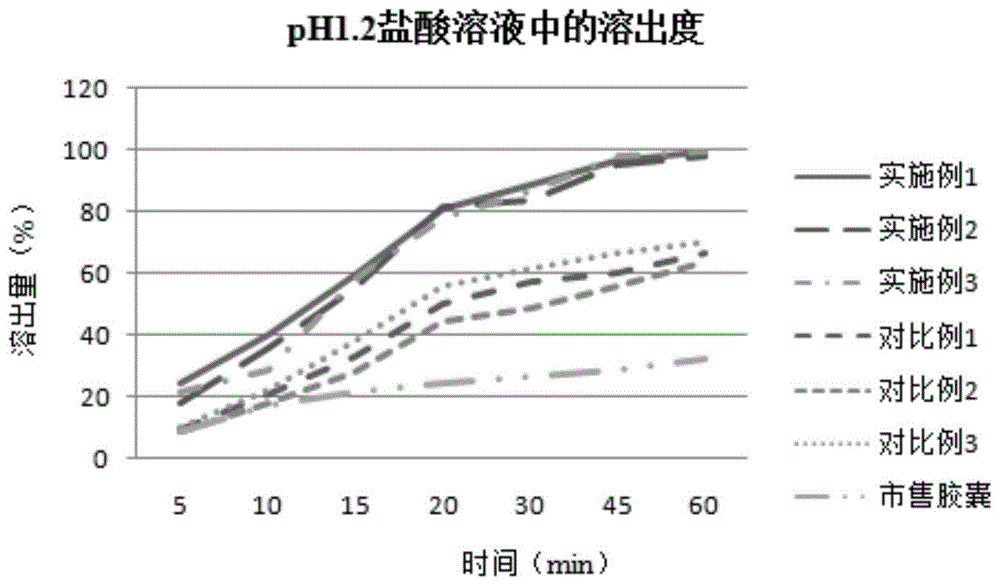
:在世界范围内,约有1%的人被精神分裂症所困扰,盐酸齐拉西酮为美国辉瑞公司开发的第二代非典型广谱抗精神病药临床上用于治疗精神分裂症、双向情感障碍躁狂发作和精神分裂症患者的急性期激越症状。本品耐受性好,很少引起锥体外系不良反应。盐酸齐拉西酮的化学名称为5-[2-[4-(1,2-苯并异噻唑-3-基)-1-哌嗪基]乙基]-6-氯-1,3-二氢-2h-吲哚-2-酮盐酸一水合物,为白色至淡粉红色粉末,在水中的溶解度约为0.3μg/ml,为不溶性药物,且其溶解度具有明显的ph依赖性。在生物药剂学分类系统中属于ⅱ类,低溶解度导致其口服生物利用度低,其市售制剂空腹口服生物利用度约为30%,在与超过500kcal热量的食物同时服用的前提下,该药生物利用度为60%,空腹与饱腹对药物的吸收以及疗效影响很大。而服用盐酸齐拉西酮的患者,服药顺应性较差,很难控制患者是空腹还是饱腹后服药,难以确保药物的良好吸收,导致该药物疗效下降,给患者及其家属带来巨大的精神压力和经济损失。因此,为满足市场的需求以及提高该药物患者服药的顺应性,提高药物的安全性和有效性,开发出能够解决该药物溶解性差的一种简单、稳定、易于工业化生产的盐酸齐拉西酮药物组合物及其制备方法,是该药物亟待解决的新课题之一。技术实现要素:为解决现有技术中的以上问题,本发明提供一种盐酸齐拉西酮药物组合物及其制备方法,本发明提供了新的盐酸齐拉西酮的药物组成成分,并采用盐酸齐拉西酮与辅料分开溶解再混合的方法制备药物组合物,明显改善了盐酸齐拉西酮药物组合物在不同ph介质中的溶解度和体外溶出度,显著提高了药物的有效性和安全性。具体的,本发明的技术方案如下所述:一种盐酸齐拉西酮药物组合物,各组分按照质量分数计,包括盐酸齐拉西酮10~100份,谷氨酸0.1~1份,醋酸钠1~10份,乳糖5~10份,羟丙甲纤维素5~10份。优选地,所述盐酸齐拉西酮与谷氨酸的质量比为1:(0.01~0.1)。优选地,所述谷氨酸与醋酸钠的质量比为1:(10~20)。优选地,所述乳糖与羟丙甲纤维素的质量比为1:1。作为本发明的另一个目的,还提供了所述药物组合物的制备方法,包括如下步骤:第一步、按照配方量,将盐酸齐拉西酮加入溶剂中,加热至40~60℃并不断搅拌使药物成悬浮状态,制成悬浮液a;将其余组分加入适量溶剂中至溶解,制成溶液b;第二步、在搅拌下将溶液b缓慢加入到溶液a中,期间继续加热保持40~60℃温度,继续搅拌至药物完全溶解,制得透明或微红的混合溶液c;第三步、将混合溶液c于40~60℃真空旋转蒸干,得物料d;第四步、将物料d放置于真空干燥箱中于40~60℃真空干燥12~24h,粉碎过筛即得盐酸齐拉西酮药物颗粒;第五步、将第四步制得的盐酸齐拉西酮药物颗粒制备成药物组合物。第四步制得的盐酸齐拉西酮药物颗粒采用常规制剂方法制备成片剂或者胶囊剂,具体可采用的方法为,通过直接压片、或通过干法制粒或湿法制粒经压片制得片剂;采用颗粒直接灌装胶囊或采用干法或湿法制粒后灌装胶囊制得胶囊剂。优选地,第一步中所述溶剂为水或乙醇。盐酸齐拉西酮在水中和乙醇中的溶解度均不佳,本发明采用加热至40~60℃的方法使盐酸齐拉西酮在水或乙醇中成悬浮状态,制成悬浮液a。在本发明提供的实施例中,将第四步制得的盐酸齐拉西酮药物颗粒与原料药在ph1.2盐酸溶液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液和水中对比了溶解度,结果可见,采用本发明的方法制备的药物颗粒与原料药相比溶解度具有很大程度的提高;且溶解度几乎不受ph的影响。在本发明提供的实施例中,还对本发明提供的药物颗粒灌入胶囊壳内与市售胶囊进行溶出度试验,结果本发明提供的胶囊剂在上述四种溶出介质中均均有很好的溶出度,且45min时溶出度均超过90%。稳定性试验证实本发明提供的制剂在加速6个月内稳定,未出现转晶、药物析出等影响药物溶出的行为,有关物质(杂质)含量均显示药物具有好的稳定性。与现有技术相比,本发明具有如下有益效果:(1)本发明提供了一种具有优异溶解度的盐酸齐拉西酮药物组合物,本发明制备的盐酸齐拉西酮药物颗粒在ph1.2盐酸溶液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液和水中的溶解度分别达到了327μg/ml、342μg/ml、330μg/ml和338μg/ml,溶解度几乎不受ph的影响,从而大大提高了盐酸齐拉西酮的溶出性能。(2)本发明的盐酸齐拉西酮药物组合物,经影响因素实验,其溶解度未见明显变化,与原料药比,药物稳定性更好。(3)本发明所涉及的处方成分是医药领域经常使用的,廉价易得,安全性高;本发明设计的工艺过程操作简便,适合工业化生产。(4)本发明提供的制备方法,第一步采用水作为溶剂,避免了其他制备方法中加入甲醇等有机溶剂促进溶解的过程,无残留溶剂问题,制得的药物组合物安全性高;溶出度试验提示本发明提供的药物组合物生物利用度高。附图说明构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。图1为盐酸齐拉西酮胶囊在ph1.2盐酸溶液中的溶出度测定结果;图2为盐酸齐拉西酮胶囊在ph4.5醋酸盐缓冲液中的溶出度测定结果;图3为盐酸齐拉西酮胶囊在ph6.8磷酸盐缓冲液中的溶出度测定结果;图4为盐酸齐拉西酮胶囊在水中的溶出度测定结果;图5为实施例1-3粉末x-射线衍射图谱。具体实施方式应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属
技术领域:
的普通技术人员通常理解的相同含义。需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。常用的解决难溶性药物水溶性差的制剂技术有纳米结晶、微粉化和反溶剂法制备固体分散体等。纳米结晶技术虽然能显著地提高盐酸齐拉西酮的水溶性进而提高生物利用度,但是其稳定性差,容易重结晶,产品的保存时间短;微粉化技术增加了药物表面自由能,使得微粉之间发生自发集聚,性质不稳定可靠;传统的制备固体分散体方法有溶剂法、熔融法、喷雾干燥法等,但这些传统的方法制备工艺复杂,限制条件多,具有存在溶剂残留以及残留溶剂难以去除等缺点。本发明采用水或乙醇作为溶剂,安全性高,克服了残留溶剂的缺陷,避免了去除残留溶剂的步骤。本发明提供了一种盐酸齐拉西酮的组合物,以及新的制备方法,将活性成分与辅料(赋形剂)分别用水或乙醇分别制备成悬浮液或溶液后,再混合,经旋转蒸干和真空干燥后制得组合物颗粒,再制备成片剂或胶囊剂等剂型。实施例1:一种盐酸齐拉西酮药物组合物,其处方组成及制备工艺如下:组分用量(g)盐酸齐拉西酮10谷氨酸0.1醋酸钠1乳糖5羟丙甲纤维素5制备方法:按照配方量,将盐酸齐拉西酮加入水中,加热至45℃,搅拌转速150rpm,使药物成悬浮态,制成药物悬浮液a,将其余组分加入适量水中至溶解,制成溶液b。在搅拌的情况下将溶液b缓慢加入到溶液a中,继续搅拌30min,使盐酸齐拉西酮溶解,制得微红色混合溶液c。将混合溶液c于45℃真空旋转蒸干,得物料d。将物料d放置于真空干燥箱中于40℃真空干燥24h,粉碎过60目筛即得盐酸齐拉西酮药物颗粒。再将制得的盐酸齐拉西酮药物颗粒制备成片剂或者胶囊剂的药物组合物,具体可采用的方法为,通过直接压片、或通过干法制粒或湿法制粒经压片制得片剂;采用颗粒直接灌装胶囊或采用干法或湿法制粒后灌装胶囊制得胶囊剂。实施例2:一种盐酸齐拉西酮药物组合物组分用量(g)盐酸齐拉西酮10谷氨酸0.5醋酸钠5乳糖8羟丙甲纤维素8制备方法参考实施例1。实施例3:一种盐酸齐拉西酮药物组合物组分用量(g)盐酸齐拉西酮10谷氨酸1醋酸钠10乳糖10羟丙甲纤维素10制备方法参考实施例1。对比例1:一种盐酸齐拉西酮药物组合物,与实施例1的区别在于醋酸钠用量为20g,其余参数及操作如实施例1所示。对比例2:一种盐酸齐拉西酮药物组合物,与实施例2的区别在于谷氨酸的用量为2g,其余参数及操作如实施例2所示。对比例3:一种盐酸齐拉西酮药物组合物,与实施例3的区别在于,制备方法不同,仅通过称取实施例3的处方量进行物理混合,过60目筛即得。试验例一、溶解性实验实验方法与条件:分别以实施例1~3、对比例1~3制得的盐酸齐拉西酮药物颗粒、以及原料药作为供试品,称取过量供试品置于5ml带盖试管中,分别加ph1.2盐酸溶液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液和水约3ml涡轮混匀后,放入37±0.5℃的恒温摇床中,300rpm震摇12h至溶解平衡。然后取出样品5000rpm离心10min,取上清。用甲醇稀释到适宜倍数后参照《中国药典》2015版二部正文品种第一部分盐酸齐拉西酮项下含量测定方法,采用高效液相色谱法进行溶解度测定,溶解度试验结果如表1所示。表1溶解度试验结果由表1可知,与对比例1~3和原料药相比,实施例1~3在ph1.2盐酸溶液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液和水中的溶解度得到了很大程度上的提高。原料药和对比例均表现出较明显的ph依赖性,在ph4.5醋酸盐缓冲液中的溶解度高于其他溶液2倍以上,而实施例中药物的溶解度几乎不受ph的影响。试验例二、溶出度实验1、试验材料:市售盐酸齐拉西酮胶囊,规格为20mg(辉瑞制药有限公司);实施例1~3和对比例1~3制备胶囊。为了消除胶囊壳带来的影响,将市售胶囊内容物取出清理干净,将实施例1~3和对比例1~3制备的药物颗粒按照含活性成分20mg,灌入市售胶囊壳内作为测试品。2、试验方法:按照《中国药典》2015版第四部通则0931第一法,分别取市售胶囊,实施例1~3和对比例1~3制备的盐酸齐拉西酮药物组合物胶囊,对溶出度进行测定,具体方法如下:溶出介质分别为ph1.2盐酸溶液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液和水,体积为900ml,分别于5min、10min、15min、20min、30min、45min和60min时取样5ml,用0.45μm水相滤膜滤过,取续滤液作为供试品溶液,所得样品照高效液相色谱法进行测定,计算每粒胶囊每个时间点的累积平均溶出量,绘制溶出曲线,每个处方测定6粒的量,结果取平均值,结果如表2~5所示。表2盐酸齐拉西酮胶囊在ph1.2盐酸溶液中的溶出度测定结果表3盐酸齐拉西酮胶囊在ph4.5醋酸盐缓冲液中的溶出度测定结果表4盐酸齐拉西酮胶囊在ph6.8磷酸盐缓冲液中的溶出度测定结果表5盐酸齐拉西酮胶囊在水中的溶出度测定结果由表2~5可知:1、市售盐酸齐拉西酮胶囊对比例1~3在四种介质中的溶出结果均不同,溶出曲线表现出ph依赖型,而实施例1~3制备的胶囊在上述四种溶出介质中具有很好的溶出度,45min时溶出度均超过90%。2、与实施例1~3相比,对比例1~3制备的盐酸齐拉西酮胶囊,溶出度明显降低,说明谷氨酸与醋酸钠的质量比例、盐酸齐拉西酮与谷氨酸的质量比例以及本制备方法具有至关重要的作用。试验例三、稳定性实验1、试验材料:市售盐酸齐拉西酮胶囊,规格为20mg(辉瑞制药有限公司)。实施例1~3成品胶囊,为了消除胶囊壳带来的影响,将市售胶囊内容物取出清理干净,将实施例1~3制备的成品按照含活性成分20mg,灌入市售胶囊壳内作为测试品。2、试验方法:按照《中国药典》2015版第四部通则9001进行加速试验,分别于1个月、2个月、3个月和6个月取样,分别测定溶出度以及有关物质,与0个月的比较,有关物质测试方法以及色谱测试条件参照《中国药典》2015版二部正文品种第一部分盐酸齐拉西酮胶囊项下有关物质测定方法。表6盐酸齐拉西酮胶囊加速试验在ph6.8磷酸盐缓冲液中45min溶出度测定结果实施例1实施例2实施例3市售胶囊0个月96.1%92.6%95.6%21.3%加速1个月97.3%93.5%97.8%20.4%加速2个月96.8%92.1%97.3%22.3%加速3个月97.8%91.4%96.7%21.6%加速6个月97.0%94.5%96.9%22.0%从表6可知,实施例1~3制备的该药物组合物胶囊,在加速6个月后,其在ph6.8磷酸盐缓冲液中45min时溶出度均超过90%以上,说明加速试验6个月该组合物中的药物较稳定,经粉末-x射线衍射分析,如图5图谱显示,未出现转晶、药物析出等影响药物溶出的行为。表7盐酸齐拉西酮胶囊有关物质含量测定结果实施例1实施例2实施例3市售胶囊0个月0.15%0.12%0.18%0.09%加速1个月0.16%0.12%0.20%0.13%加速2个月0.18%0.15%0.20%0.16%加速3个月0.20%0.17%0.22%0.21%加速6个月0.22%0.21%0.23%0.25%从表7加速试验有关物质含量测定结果可知,加速试验6月时,实施例1~3和市售胶囊的有关物质含量与0个月比,分别增加了1.47、1.75、1.28和2.78倍。说明实施例能够明显降低盐酸齐拉西酮的降解速度,提高其稳定性。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1