一种艾纳香叶细胞水和艾纳香油的提取方法和应用与流程
1.本发明涉及农产品处理技术领域,特别是涉及一种艾纳香叶细胞水和艾纳香油的提取方法和应用。
背景技术:
2.艾纳香[blumea balsamifera(l.)dc],是菊科植物艾纳香属多年生木质草本植物或亚灌木植物。产于贵州、广西、广东、海南等地,是我国黎族、壮族、苗族等少数民族的重要药材。艾纳香含有挥发油,主要成分为左旋龙脑,具有较强抑菌活性、促渗透作用和抗氧化活性,以及消肿止痛、通畅鼻窍、祛风除湿、温中活血等功能;研究发现艾纳香对大肠杆菌和白色念珠菌具有抑制作用。其提取物“艾粉”、“艾片”和“艾纳香油”是重要的中成药原料药;艾纳香油因其独特的香气以及较好的生物活性,也被广范应用于化工、香料、香精等领域。
[0003]
艾粉的传统提取工艺为水蒸气蒸馏法,整个过程操作复杂,艾纳香叶不能全部提取利用,提取率低,而且需要通过从壁上将艾粉刮下来收集艾粉,损失大且消耗大量人工。艾片和艾纳香油为将艾粉加热升华制备的后加工产品,整个升华过程对设备要求高,升华时间长,品质难以控制。此外,由于艾粉、艾片、艾纳香油特殊气味及溶解性问题,很难应用于护肤品等领域。对于艾纳香叶的提取,除上述的水蒸气蒸馏法,还有溶剂萃取法,但由于其需加入其他溶剂而限制了提取物的保存和使用。
[0004]
酶解法也常用于植物细胞液的提取中。中国专利申请cn109730948a公开了一种采用超声低温旋蒸法和酶法相结合制备牡丹鲜花细胞水的方法:首先通过压榨法得到榨汁和残渣1,再将残渣1旋蒸得到细胞水1和残渣2,最后将残渣2进行酶解后再旋蒸得到细胞水2。将榨汁、细胞水1和细胞水2混合后得到高收率牡丹花细胞水。该方法具有较高的提取效率,但是具有如下缺陷:(1)采用压榨法,后与真空提取法得到的液体混合,这样会带入多糖、色素和刺激气味,导致防腐和脱色问题;(2)工艺后期配合其他植物一起蒸馏,解决防腐问题,但是容易改变原有的牡丹花细胞水成分和气味,后期生产也无法控制品质。
[0005]
植物细胞中富含黄酮类物质,黄酮容易被氧化而变黄,导致精油品质下降。现有技术中,主要是通过后处理去除黄酮和多糖。
技术实现要素:
[0006]
本发明的目的在于,提供一种艾纳香叶细胞水和艾纳香油的提取方法,不仅提取速度快,而且能够控制艾纳香叶细胞水和艾纳香油的化学组成。
[0007]
本发明是通过以下技术方案实现的:
[0008]
一种艾纳香叶细胞水和艾纳香油的提取方法,包括以下步骤:不加入溶剂,将艾纳香叶在温度30℃~65℃、压力-60kpa~-101kpa下初步提取,提取过程中艾纳香叶细胞水和艾纳香油形成蒸气,通过冷凝收集液体,提取1.5~2.5小时,得到初提液体和初提艾纳香叶残渣,在初提液体中加入初始艾纳香叶总重量为基准的0.2~0.4%的纤维素酶和0~0.1%的果胶酶,再将初提液体加入初提艾纳香叶残渣中,在30℃~50℃、压力-60kpa~-101kpa
条件下再次提取3~6小时,提取结束后将收集到的液体静置分层得到艾纳香叶细胞水和艾纳香油。
[0009]
初步提取时间是关键参数之一,如果时间太短,提取出的艾纳香叶细胞水过少,加入酶后细胞水很难浸润艾纳香叶表面,导致酶解不能正常进行。如果初步提取时间过长,细胞水和精油流出过多,降低了后续提取效率,也增加了酶解时间,带来过度酶解的风险。本发明通过在初提液体中加入一定量的酶,再次投入容器中对残渣进行提取,具有如下有益优点。第一、初提液体表面张力低,渗透性好;第二、初提液体ph为3~7,无需额外调节ph,有利于提高酶活性;第三、酶解能够加速破壁;第四、低温真空技术提取。通过四种效应的协同,能够在较低温度(35~50℃)下控制酶解速度,加快细胞液流出速度。再次提取步骤中的前1小时左右会蒸除掉倒回容器内的初提液体,加快酶解速度,缩短酶解的时长(此时初提液体的多少就至关重要,多了会延长酶解时间,少了会缩短酶解时间),避免了传统酶解法需要加入大量的水稀释细胞液以及酶解过度带来的刺激气味。
[0010]
关于初提液体的渗透性,通过实验发现,当采用细胞液作为溶剂法的溶剂提取艾纳香叶残渣时,能够带出大量的黄酮和多糖等大分子物质以及易挥发活性成分。相比采用纯水作为溶剂,细胞水作为溶剂,黄酮和多糖等活性成分得率要高很多。
[0011]
优选的,所述的初步提取温度为35℃~50℃、压力-80kpa~-101kpa条件。在优选的条件范围内,植物细胞内水分达到沸腾状态,提取速度快,同时提取温度接近室温,能够保留挥发出来的细胞水活性,使分离出的初提液体具有很好的渗透性。
[0012]
优选的,纤维素酶的加入量为0.25~0.35%,果胶酶加入量为0.01~0.06%。酶是大分子蛋白质,在上述加入量范围下,能够吸附在艾纳香叶细胞表面,难以在低温真空条件挥发出来,无需进行后续处理。
[0013]
并且,本发明的方法不会提取出黄酮和多糖等大分子物质,进一步提升细胞水和精油的稳定性。
[0014]
可将艾纳香叶切割成宽度为1mm~10mm后再进行提取,同时在提取过程中进行搅拌,搅拌速度为1~150转/分钟;能够加快提取速度,且有利于充分提取出细胞水和精油。
[0015]
收集过程中进行冷凝,温度为-10~8℃。
[0016]
本发明采用新鲜的艾纳香叶,即新采摘的、饱含水分、无霉变、无腐烂的艾纳香叶;一般的,新鲜的叶子绿色饱满,不枯黄、未经烤干或晒干。
[0017]
优选的,所述艾纳香叶选用艾纳香老叶,艾纳香老叶中的活性成分含量比嫩叶中的高。老叶即成熟的叶子,艾纳香老叶长有15~24cm,宽有4~10cm。一般的,艾纳香嫩叶为嫩绿色,叶质柔软;艾纳香老叶为深绿色,叶质较硬。
[0018]
通过本发明的提取方法得到的艾纳香叶细胞水和艾纳香油,纯天然,没有其他溶剂与添加剂、不含重金属,气味柔和,可应用于护肤品、食品、保健品。
[0019]
本发明相比于现有技术,具有如下有益效果:
[0020]
本发明通过低温真空提取技术,先提取一定量的细胞液,然后利用初提液体的高渗透性,加入酶后再次提取艾纳香叶残渣。能够加速细胞水和精油的提取效率,避免了传统酶解法带来的酶解过度问题,相比于低温真空提取技术能够得到更多的细胞液(特别是精油更多),而且含有的易挥发活性成分更多。
[0021]
通过本发明方法得到的艾纳香叶细胞水,无色透明,纯度高,含有60多种挥发性活
性成分,气味柔和,对人体安全性高,具有一定的抑菌效果,能够应用于护肤品、食品、保健品等领域。并且通过本发明得到的艾纳香油,不含有多糖和黄酮,稳定性好。
附图说明
[0022]
图1为实施例1的艾纳香叶细胞水安全性测试数据。
具体实施方式
[0023]
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
[0024]
实施例和对比例所用艾纳香叶为新鲜、无霉变的艾纳香老叶。洗净沥干水后用切割刀切成宽度为4~5mm,进行提取实验。
[0025]
实施例1:
[0026]
将50kg艾纳香叶投入150l低温真空提取设备,不加入任何溶剂,在45℃,压力-90kpa、60转/分搅拌下初步提取,艾纳香叶细胞水和艾纳香油形成蒸气,冷凝收集(冷凝温度-5℃),提取2小时,分离后得到初提液体和初提残渣,在初提液体中加入175g纤维素酶和20g果胶酶,再将初提液体加入初提残渣中,在45℃、压力-90kpa、60转/分搅拌条件下再次提取艾纳香叶细胞水和艾纳香油,6小时提取结束,收集到的液体静置分层得到37.3kg艾纳香叶细胞水和7g艾纳香油。细胞水无色澄清透明,气味芳香柔和。
[0027]
实施例2:
[0028]
将50kg艾纳香叶投入150l低温真空提取设备,不加入任何溶剂,在30℃,压力-101kpa、45转/分搅拌下初步提取,艾纳香叶细胞水和艾纳香油形成蒸气,冷凝收集(冷凝温度-5℃),提取2.5小时,分离后得到初提液体和初提残渣,在初提液体中加入120g纤维素酶和30g果胶酶,再将初提液体加入初提残渣中,在35℃、压力-101kpa、45转/分搅拌条件下再次提取艾纳香叶细胞水和艾纳香油,3.5小时提取结束,收集到的液体静置分层得到35.5kg艾纳香叶细胞水和6.4g艾纳香油。细胞水无色澄清透明,气味芳香柔和。
[0029]
实施例3:
[0030]
将50kg艾纳香叶投入150l低温真空提取设备,不加入任何溶剂,在65℃,压力-60kpa、120转/分搅拌下初步提取,艾纳香叶细胞水和艾纳香油形成蒸气,冷凝收集(冷凝温度-5℃),提取1.5小时,分离后得到初提液体和初提残渣,在初提液体中加入150g纤维素酶和15g果胶酶,再将初提液体加入初提残渣中,在40℃、压力-90kpa、120转/分搅拌条件下再次提取艾纳香叶细胞水和艾纳香油,5小时提取结束,收集到的液体静置分层得到36.1kg的艾纳香细胞水和6.4g的艾纳香油。细胞水无色澄清透明,气味芳香柔和。
[0031]
实施例4:
[0032]
将50kg艾纳香叶投入150l低温真空提取设备,不加入任何溶剂,在50℃,压力-90kpa、60转/分搅拌下初步提取,艾纳香叶细胞水和艾纳香油形成蒸气,冷凝收集(冷凝温度-5℃),提取1.8小时,分离后得到初提液体和初提残渣,在初提液体中加入200g纤维素酶和15g果胶酶,再将初提液体加入初提残渣中,在45℃、压力-90kpa、60转/分搅拌条件下再
次提取艾纳香叶细胞水和艾纳香油,6小时提取结束,收集到的液体静置分层得到36.9kg艾纳香叶细胞水和6.7g的艾纳香油。细胞水无色澄清透明,气味芳香柔和。
[0033]
实施例5:
[0034]
将50kg艾纳香叶投入150l低温真空提取设备,不加入任何溶剂,在40℃,压力-101kpa、45转/分搅拌下初步提取,艾纳香叶细胞水和艾纳香油形成蒸气,冷凝收集(冷凝温度-5℃),提取2小时,分离后得到初提液体和初提残渣,在初提液体中加入120g纤维素酶和40g果胶酶,再将初提液体加入初提残渣中,在50℃、压力-90kpa、45转/分搅拌条件下再次提取艾纳香叶细胞水和艾纳香油,5.5小时提取结束,收集到的液体静置分层得到36.4kg艾纳香叶细胞水和6.1g的艾纳香油。细胞水无色澄清透明,气味芳香柔和。
[0035]
对比例1:
[0036]
将50kg艾纳香叶投入150l低温真空提取设备,不加入任何溶剂,在45℃,压力-90kpa、60转/分搅拌下提取,艾纳香叶细胞水和艾纳香油形成蒸气,冷凝收集(冷凝温度-5℃),提取8小时,分离掉残渣后静置分层得到25.7kg的艾纳香叶细胞水和2.9g的艾纳香油。细胞水无色澄清透明,香味较淡。
[0037]
对比例2:
[0038]
将50kg艾纳香叶投入150l低温真空提取设备,加入175g纤维素酶和20g果胶酶与5kg水,在50℃下搅拌45分钟,后在45℃,压力-90kpa、60转/分搅拌下提取,艾纳香叶细胞水和艾纳香油形成蒸气,冷凝收集(冷凝温度-5℃),提取8小时,分离掉残渣后静置分层得到37.1kg艾纳香叶细胞水和2.3g艾纳香油。细胞水无色澄清透明,但具有明显的刺激性气味。
[0039]
对比例3:
[0040]
将50kg艾纳香叶用切割刀切成宽度为4~5mm,投入150l提取设备,加入175g纤维素酶和20g果胶酶与5kg水,在45℃、常压、60转/分搅拌下提取艾纳香叶细胞水和艾纳香油,提取6小时,分离掉残渣(两次过滤,第一次为离心、第二次为0.22微米滤芯过滤)后静置得到38.3kg艾纳香叶细胞水,未得到艾纳香油。细胞水为浅黄色,有悬浮物,并且刺激性气味较重。
[0041]
各项性能测试方法:
[0042]
1、艾纳香叶细胞水和艾纳香油的挥发性活性成分分析:在80℃进样温度下进行顶空气质检测。
[0043]
(1)仪器信息:agilent 7980a gc;ms:5975c;50/30μm car/pdms/dvb萃取纤维头,美国supelco公司。
[0044]
(2)gc-ms条件:
[0045]
色谱柱为hp-innowax毛细管柱子(30m
×
0.25mm
×
0.25μm);载气为he,流速1ml/min,分离比5:1;进样温度为250℃;升温程序为起始温度为40℃,保持5min,以8℃/min,升至250℃,保持5min。
[0046]
质谱条件:ei电离源,能量70ev;离子源温度230℃,四极杆温度150℃,接口温度250℃,扫描范围30-400m/z。
[0047]
(3)样品前处理:将5ml样品、1g nacl置于20ml顶空瓶中,拧紧瓶盖。于搅拌模式80℃下平衡5min后,用固相微萃取针80℃下萃取5min,然后于进样口解析5min。
[0048]
表1:实施例1的艾纳香叶细胞水的挥发性活性成分分析结果(仅保留匹配度高含
量相对较高的成分)
[0049]
[0050]
[0051]
[0052][0053]
表2:实施例1的艾纳香油的挥发性活性成分分析结果(仅保留匹配度高含量相对较高的成分)
[0054]
[0055]
[0056][0057]
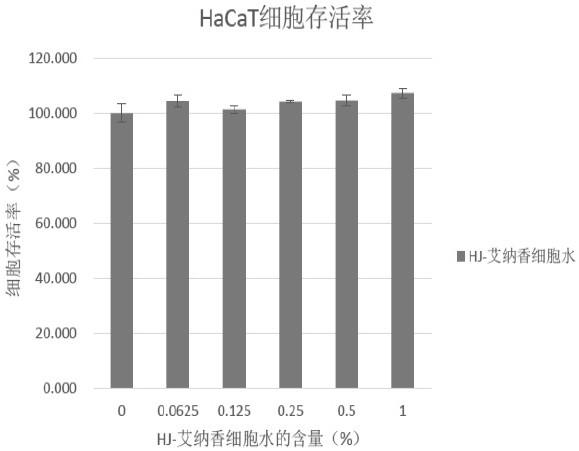
2、艾纳香叶细胞水安全性测试:hacat细胞为人永生表皮细胞系,对hacat细胞的细胞毒性,可作为对皮肤安全性的参考数据。正常细胞代谢旺盛,其线粒体内的琥珀酸脱氢酶,可将四唑盐类物质还原为带颜色的结晶状物质,沉积在细胞周围,该变化可通过酶标仪读取od值,通过od值与空白对照组的比较,可以得知细胞的相对生长情况。实施例1的艾纳香叶细胞水的测试结果见图1。
[0058]
由图1数据得出,艾纳香叶细胞水对人体表皮细胞基本无毒性。
[0059]
3、艾纳香叶细胞水防腐挑战测试:将艾纳香叶细胞水,添加到喷雾配方中(如表3)。接种一定数量的细菌和真菌,间隔0天、7天、14天、21天、28天按照美国药典usp32<51>微生物防腐功效测试的检测方法检测微生物数量变化情况。同时做空白对照,将艾纳香叶细胞水替换成去离子水。实施例1艾纳香叶细胞水的测试结果见表4。
[0060]
表3:艾纳香叶细胞水喷雾防腐挑战测试喷雾配方:
[0061]
原料含量丁二醇2.4%甜菜碱0.04%甘草酸二钾0.05%可溶性蛋白多糖0.05%蜂王浆提取物0.05%艾纳香叶细胞水余量柠檬酸调节ph=6-7
[0062]
表4:实施例1艾纳香叶细胞水防腐挑战测试数据
[0063][0064][0065]
由表4数据可知,经过28天水剂配方的喷雾的防腐挑战测试,实施例1中的艾纳香叶细胞水不需添加其他防腐剂通过了防腐挑战测试。
[0066]
4、黄酮和多糖含量的测试方法:总多糖含量检测方法:苯酚-硫酸法是利用多糖在
硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后醛衍生物与苯酚生成橙黄色化合物,就可以比色法测定。
[0067]
首先制作标准曲线,准确称取葡萄糖50mg于500ml容量瓶中定容,分别吸取0.2ml、0.4ml、0.6ml、0.8ml、1.0ml、1.2ml及1.8ml标准葡萄糖溶液置于各试管中,分别用蒸馏水补至2.0ml,依次加入6%的苯酚溶液1.0ml及浓硫酸5.0ml,摇匀冷却,室温放置20分钟以后于490nm测吸光度,以2.0ml蒸馏水按同样操作为空白,重复三次。横坐标为多糖含量,纵坐标为吸光度值,绘制标准曲线。
[0068]
分别取艾纳香叶细胞水,配置一定浓度,按照上述操作方法测490nm处吸光度值,根据标准曲线即得相应的糖含量。
[0069]
总黄酮含量检测方法:黄酮母核中含有碱性氧原子,一般又多带酚羟基,能和铝离子产生黄色络合物,又加入亚硝酸钠和氢氧化钠,使在碱性溶液中呈红色,溶液在510nm处有最大吸收,显色反应在60min内稳定。用芦丁作为对照品,用硝酸铝作为黄酮类比色测定的显色剂,吸光度与芦丁的浓度呈线形关系,采用分光光度法对总黄酮进行了含量测定。
[0070]
准确吸取0,0.4,0.8,1.2,1.6,2.0ml芦丁标准溶液,放入10毫升容量瓶内(写明标记),分别加入2.0、1.6、1.2、0.8、0.4、0ml的60%乙醇溶液;再加入5%亚硝酸钠溶液0.5ml摇匀,放置6min;加入10%硝酸铝溶液0.5ml,放置6min后;加入4%氢氧化钠溶液4.0ml,加60%乙醇定容,摇匀后,放置15min;(扫描找到最大吸收)在510nm处测定吸光度。用0.0ml作为空白,用芦丁含量的浓度作为横坐标,纵坐标作为一定浓度下所对应的吸光度,作标准曲线。
[0071]
吸取艾纳香叶细胞水样品(根据样品的吸光度调整)1.0ml,放入10毫升容量瓶内(写明标记),用60%乙醇加到2.0ml;加入5%亚硝酸钠溶液0.5ml摇匀,放置6min;加入10%硝酸铝,溶液0.5ml,放置6min后;加入4%氢氧化钠溶液4.0ml,摇匀后,加60%乙醇定容,放置15min;在510nm处测定吸光度。根据标准曲线计算总黄酮的含量。
[0072][0073]
a为标准曲线中的含量。
[0074]
实施例和对比例工艺结果分析:
[0075]
表5:实施例1和对比例1~3的艾纳香叶细胞水主要挥发性活性成分表
[0076][0077]
表6:实施例1和对比例1~2的艾纳香油主要挥发性活性成分表
[0078][0079]
综合分析实施例和对比例可知,本发明通过将提取出的初提细胞液加入一定量的纤维素酶和果胶酶后倒入初提残渣中,酶解作用下能加速破壁使植物细胞液的流出,同时利用初提细胞液具有很好的渗透性,能够渗透入植物细胞中带出更多物质,得到富含挥发性活性成分的艾纳香叶提取液。
[0080]
具体的,由对比例1可知,仅采用低温真空提取技术,提取到的细胞液重量低,而且挥发性活性成分含量较少。由对比例2可知,先加入一定量的酶与水进行酶解再采用真空提取技术提取,但是由于水的渗透性差,并且额外加入了5kg的水,导致了得到的艾纳香油量少,细胞水气味清淡等缺陷。由对比例3可知,由现有技术的酶提取法,无法得到艾纳香油,只能得到艾纳香叶细胞水;而且其中含有大量的多糖和黄酮以及其它杂质,提取液浓度低,价值不高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1