人羊膜间充质干细胞在制备骨再生产品中的用途的制作方法
本发明涉及生物技术领域,具体涉及人羊膜间充质干细胞在制备骨再生产品中的用途。
背景技术:
目前临床骨缺损修复的研究倾向于运用无机或有机支架材料替代自体骨移植,或蛋白类活性因子刺激机体骨再生。常用支架材料虽具有一定的骨引导性,但缺乏骨免疫调控功能;蛋白类活性因子常常会刺激免疫反应而影响骨再生。
胎盘通常在孕妇分娩后作为医疗废物被遗弃,来源充足、易于获取,而且获取不违背伦理学原则。由于胎盘组织在母体/胎儿免疫耐受中具有关键性的作用,胎盘组织中含有羊膜间充质干细胞(hamscs)。目前尚未见应用hamscs来进血管化骨再生的报道。
技术实现要素:
为了解决现有技术中所存在的问题,本发明的目的在于,提供人羊膜间充质干细胞在制备骨再生产品中的用途。
本发明是通过以下技术方案实现的:
本发明第一方面,提供人羊膜间充质干细胞用于制备骨再生产品的用途。
本发明第二方面,提供一种骨再生产品,包括有效剂量的人羊膜间充质干细胞。
本发明第三方面,提供前述骨再生生物材料复合物的制备方法,至少包括如下步骤:
(1)将人羊膜间充质干细胞悬液与可降解的水凝胶材料混合。
(2)将步骤(1)获得的混合物与支架材料混合,获得骨再生生物材料复合物。
与现有技术相比,本发明的有益效果为:
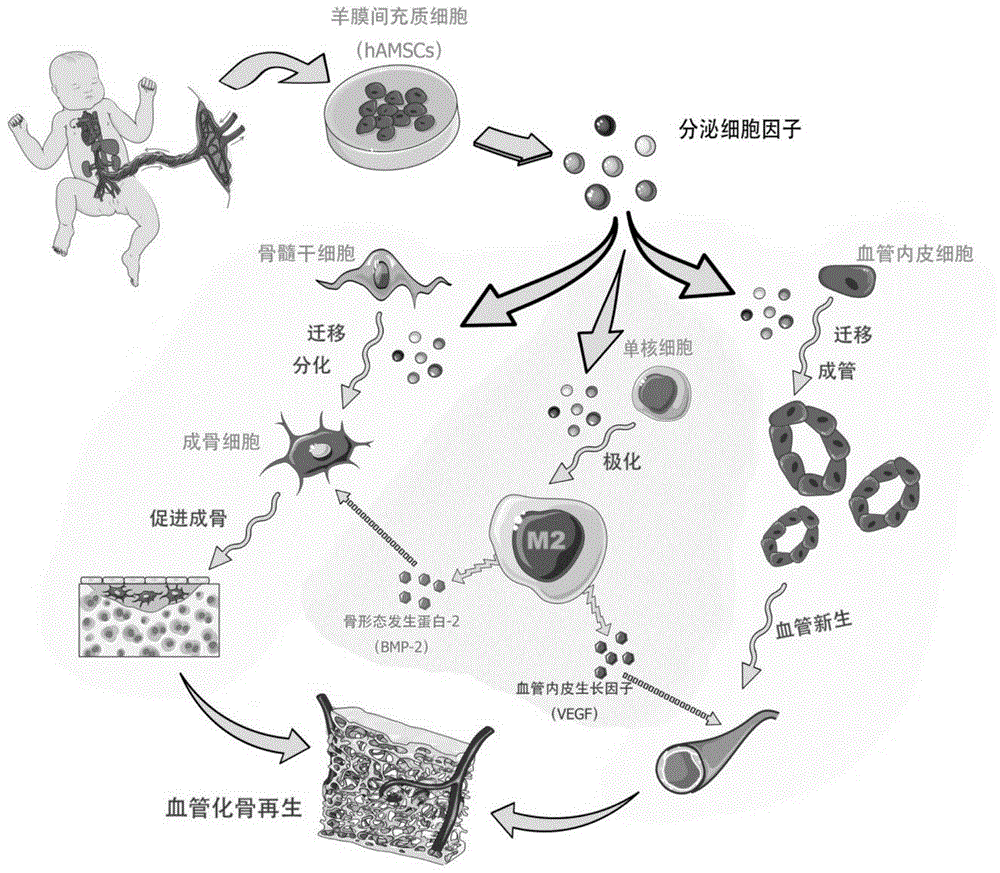
hamscs作为一种成体干细胞,具有来源广、低免疫原性、增殖快等特点,具有临床推广应用的优势,本发明基于对人羊膜间充质干细胞(hamscs)作用机制的新发现,开拓了hamscs的新用途。在骨缺损处应用hamscs,可以利用其免疫调节作用优化骨缺损微环境,刺激内源性骨再生,弥补单纯使用支架材料缺乏骨诱导性的缺陷,也避免使用单一蛋白类活性因子刺激局部免疫反应而影响骨再生效果。动物颅骨缺损模型中未见明显炎症反应,同时促血管化骨再生的m2巨噬细胞聚集,分泌促血管新生和成骨活性因子。本发明不需专门、复杂和昂贵的设备,操作流程简单,有利于推广使用。
附图说明
图1:hamscs骨缺损微环境调控示意图。
图2:hamscs对raw264.7的诱导作用。(a1-a4)m0巨噬细胞表面inos(m1巨噬细胞表面标志物)和mmr(m2巨噬细胞表面标志物)染色呈阴性;(b1-b4)m1巨噬细胞表面inos呈阳性,mmr染色呈阴性;(c1-c4)m2巨噬细胞表面inos呈阴性,mmr染色呈阳性;(d1-d4)hamscs与raw264.7共培养72h后,inos呈阴性,mmr染色呈阳性。
图3:兔颅骨缺损模型中移植hamscs后2w标本inos和mmr特异性染色结果。(a)对照组;(b)hamsc组;(c)bio-oss组;(d)hamsc/bio-oss组;(e)inos阳性面积统计;(f)mmr阳性面积统计。(*,p<0.05;**,p<0.01)
图4:兔颅骨缺损模型中移植hamscs后2w标本vegf和bmp2特异性染色结果。(a)对照组;(b)hamsc组;(c)bio-oss组;(d)hamsc/bio-oss组;(e)vegf阳性面积统计;(f)bmp2阳性面积统计。(*,p<0.05;**,p<0.01)
图5:兔颅骨缺损模型中移植hamscs后2w标本cd31和alp特异性染色结果。(a)对照组;(b)hamsc组;(c)bio-oss组;(d)hamsc/bio-oss组;(e)alp阳性面积统计;(f)cd31阳性面积统计。(*,p<0.05;**,p<0.01)
图6:兔颅骨缺损模型中移植hamscs后12w标本中的成骨结果。(a)对照组;(b)hamsc组;(c)bio-oss组;(d)hamsc/bio-oss组;(e)相对新骨面积统计。(*,p<0.05;**,p<0.01)
具体实施方式
来源于胎盘组织的羊膜间充质干细胞(hamscs)具有较好的免疫调节功能。hamscs可以分泌多种具有免疫调控的细胞因子,如:巨噬细胞抑制因子(mif)、白介素8(il-8)、白介素6(il-6)、c-反应蛋白(crp)等。这些蛋白对巨噬细胞、中性粒细胞、自然杀伤细胞(nk细胞)都具有抑制作用。因此,在骨缺损处应用hamscs,可以利用其免疫调节作用优化骨缺损微环境,刺激内源性骨再生,弥补单纯使用支架材料缺乏骨诱导性的缺陷,也避免使用单一蛋白类活性因子刺激局部免疫反应而影响骨再生效果。
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。
本发明一实施例为人羊膜间充质干细胞用于制备骨再生产品的用途。
进一步的,所述人羊膜间充质干细胞为所述骨再生产品的唯一有效成分或有效成分之一。
所述骨再生产品主要针对的对象为哺乳动物,所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或人。
所述对象可以是骨缺损的个体。
所述骨再生产品至少具有以下功用之一:
1)诱导单核细胞向m2巨噬细胞极化;
2)调控骨再生微环境;
3)促进骨再生。
在一种实施方式中,所述骨再生产品为骨再生生物材料复合物。
所述骨再生产品产品中负载的人羊膜间充质干细胞密度为:5×106-107/ml。
进一步的,所述骨再生产品中还包括支架材料。
在一种实施方式中,所述支架材料选自骨填充材料。例如bio-oss。
在一种实施方式中,所述骨填充材料的粒径为0.25-1mm。
本发明一实施例提供一种骨再生产品,包括有效剂量的人羊膜间充质干细胞。
可选的,所述骨再生产品选自骨再生生物材料复合物。
所述骨再生产品产品中负载的人羊膜间充质干细胞密度为:5×106-107/ml。
进一步的,所述骨再生产品中还包括支架材料。
在一种实施方式中,所述支架材料选自骨填充材料。例如bio-oss。
前述骨再生生物材料复合物的制备方法,至少包括如下步骤:
(1)将人羊膜间充质干细胞悬液与可降解的水凝胶材料混合。
(2)将步骤(1)获得的混合物与支架材料混合,获得骨再生生物材料复合物。
所述骨再生产品产品中负载的人羊膜间充质干细胞密度为:5×106-107/ml。
在一种实施方式中,所述支架材料选自骨填充材料。例如bio-oss。
实施例1羊膜间充质干细胞(hamscs)对单核巨噬细胞(raw264.7)的诱导作用
步骤一、hamscs的分离与培养
获取无传染性疾病剖宫产新鲜胎盘组织后,迅速置于冰盒内,密封保存。尽快返回实验室。将冷藏保存的胎盘组织置于已经紫外消毒后的生物安全柜中,仔细辨别、分离胎盘表面羊膜层,分离后的羊膜置于α-mem完全培养基中暂存。在含有双倍青霉素-链霉素溶液的pbs中去除羊膜表面血凝块、蜕膜。将清洁的羊膜组织转移至新鲜pbs溶液中,剪碎至大小约为2mm×2mm的小组织块。将剪碎的羊膜组织转移至浓度为2.4u/ml中性蛋白酶/pbs溶液中,37℃消化10min。消化后的羊膜组织在α-mem完全培养基中静置10min。静置后羊膜组织再次转移至浓度为1mg/ml胶原酶d、20μg/mldna酶的α-mem完全培养液溶液中,37℃消化2.5-3h。消化完成后的,含有羊膜组织的α-mem完全培养液经100μm的细胞筛过滤,去除未完全降解的羊膜组织。过滤后,含有hamsc的液体部分转移至15ml离心管中,200×g离心10min。以α-mem完全培养基重悬离心后的细胞团。接种至培养皿中,并放于5%co2、37℃细胞培养箱中进行培养。24-48h后,根据细胞贴壁情况,予以换液。以α-mem培养液+5%(v/v)人血小板裂解液(hpl)+1%(v/v)青霉素-链霉素溶液+2u/ml肝素溶液配制成的完全培养液,5%co2、37℃培养。每3天换液1次。待细胞回合度达90%时,1:4传代。细胞传代至第5代后废弃。
步骤二、raw264.7购买及培养
自中科院上海细胞所购买单核巨噬细胞系raw264.7,以rpmi-1640培养液+2.5%胎牛血清配制完全培养液,5%co2、37℃培养。每3天换液1次。待细胞汇合度90%以上消化、传代备用。
步骤三、hamscs与raw264.7共培养并行免疫荧光染色
hamscs和raw264.7消化后,按细胞数hamsc:raw264.7=1:5,将两种细胞混合后接种于培养皿内。共培养3d后,4%多聚甲醛固定,行免疫荧光染色。inos(1:100,abcam),mmr(1:100,r&dsystem),细胞核经dapi染色后,共聚焦显微镜拍摄。结果如图2所示,结果显示hamscs在与单核巨噬细胞系(raw264.7)共培养72h,即可观察到hamscs诱导m0巨噬细胞向m2巨噬细胞方向极化。
实施例2hamscs在体内促进单核巨噬细胞m2极化后间接诱导血管化再生
步骤一、各组材料制备
根据实施例1的结果,我们将具有良好旁分泌性能的hamscs引入纤维蛋白凝胶;优选了纤维蛋白凝胶溶液终浓度为:5mg/ml,以浓度为50u/ml凝血酶催化。每100μl纤维蛋白凝胶溶液由5-10μl凝血酶在37℃条件下静止10-15min催化成胶,其中hamscs负载量为5×106-107/ml,记为hamsc组。以纤维蛋白凝胶组为control组。以bio-oss骨粉(粒径0.25-1mm)的为bio-oss组。以含有hamsc和bio-oss复合材料的为hamsc/bio-oss组(在1cm的模具中滴加150μl含有hamscs的纤维蛋白凝胶溶液,再加入bio-oss骨粉(粒径0.25-1mm),待纤维蛋白凝胶凝固,得到hamsc/bio-oss组,手术备用)。
步骤二、兔颅骨缺损的制备
取4-6月龄新西兰白兔,称重,以30mg/kg浓度为3%戊巴比妥钠溶液进行麻醉。待角膜反射消失后,剃毛,75%酒精消毒颅顶手术区,沿颅中缝作矢状切口至骨膜,骨膜剥离子分开骨膜,沿颅中缝两侧制备约10mm直径圆形骨缺损。
步骤三、负载hamscs纤维蛋白凝胶和bio-oss骨粉植入
纱布止血,将预先成胶的两组纤维蛋白凝胶(hamsc组和control组)及bio-oss组、hamsc/bio-oss组分别植入缺损区,表面盖胶原膜,将骨膜拉拢,再缝合骨膜皮肤。再次消毒术区,观察兔呼吸与神态,确认其状态平稳,做好标记后放回兔笼。每组每时间点样本量n=3。
步骤四、负载hamscs植入兔颅骨缺损区域后促进m2极化和血管化的作用
术后2w,兔安乐死,取颅骨标本固定于福尔马林固定液中,脱钙后,经石蜡包埋,切片,对标本行inos、mmr、vegf、bmp2、alp、cd31免疫荧光染色。结果如图3、4、5的e、f所见,显示:在hamscs组中存在大量阳性染色,具有统计学差异。如图3的a-d所示,hamscs移植于兔颅骨缺损2w,可观察到缺损处大量m2标志物(mmr)阳性表达;如图4的a-d所示,m2阳性的细胞可阳性表达促血管新生的vegf和促骨再生的bmp2。如图5的a-d所示,hamscs移植后骨缺损区域内血管新生和成骨的标志物cd31、alp表达上调。表明hamscs移植后在hamsc和hamsc/bio-oss组中,都具有良好m2诱导作用和促血管化作用。
步骤五、兔颅骨缺损的修复效果评估
术后12w,兔安乐死,取颅骨标本固定于福尔马林固定液中;脱钙后,经石蜡包埋,切片。实验结果见图6,12w时,hamsc组中骨缺损区域已基本被新骨组织覆盖,而control组和bio-oss组的骨缺损区域中心仍有较大面积尚未被骨组织覆盖。图6(e)统计可知,含有hamscs的实验组新生骨量显著高于对照组。hamscs移植于兔缺损12w后,hamsc组和hamsc/bio-oss组成骨效果明显高于对照组和bio-oss组。(黑色虚线标记含有新生骨的区域)。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!