一种药食两用的中药制剂及其应用的制作方法
本发明涉及中药技术领域,尤其涉及一种药食两用的中药制剂及其在制备防治冠状病毒感染的保健食品、消杀产品或中药复方中的应用。
背景技术:
病毒是多种流行性疾病的主要发病因素,在人类历史上已经引发了多次大流行性的疾病,例如西班牙大流感、疯牛病、非典型性肺炎、主要在家禽之间传播的禽流感、中东呼吸综合征以及在全球爆发的新型冠状病毒肺炎(covid-19)。其中,covid-19目前尚无特效药,西医抗新冠病毒药物的安全性和有效性均在考察和试验中,而中国多地用中医药治疗新型冠状病毒感染的临床治愈率较高,且治疗经济性较好。中草药在治疗sars、mers疾病的优势表现在早期干预、阻断疾病病程、减轻症状、缩短治疗时间、减轻并发症以及大剂量激素等引起的毒副作用等。总之,中药在新型冠状病毒肺炎治疗方面显示出良好临床疗效和巨大潜力。
冠状病毒基因组编码棘突蛋白(spikeprotein,s)、包膜蛋白(envelopeprotein,e)、膜蛋白(membraneprotein,m)和核蛋白(nuceloprotein,n),其中棘突蛋白(spike)是冠状病毒非常重要的表面蛋白,与病毒的传染能力密切相关,包含两个亚基,s1和s2。s1包含受体结合域(rbd),负责细胞识别受体,是s2包含膜融合过程中的必需元件。n蛋白在冠状病毒中含量丰富,是一种高度免疫原性蛋白,参与基因组复制和细胞信号通路调节,常被作为冠状病毒诊断的检测工具。ace2全称为血管紧张素转化酶2,是人体内一种参与血压调节的蛋白,同时与冠状病毒侵染人体细胞有关,在肺、心脏、肾脏和肠道广泛存在。nl63-cov、sars-cov、sars-cov-2等冠状病毒的s蛋白中的rbd区域与细胞表面受体ace2结合附着于宿主细胞,然后被酸依赖的蛋白酶进行两次切割,随后融合肽插入宿主细胞膜并与之融合,将核酸分子释放进入胞内,完成侵染过程。因此s蛋白与受体蛋白相互作用的强弱是决定冠状病毒感染宿主能力强弱的主要因素。
基于此,本发明从冠状病毒s蛋白与人受体蛋白ace2结合的原理出发配制中药组合物,抑制冠状病毒的侵染,达到冠状病毒的日常或医用防治目的,也为中药材在抗病毒中的应用提供理论基础,扩展中药的应用领域和潜力,为中医药更好用于临床提供参考。
技术实现要素:
本发明的目的之一在于提供一种药食两用的中药制剂,选择特定的中草药,其药效成分能阻挡冠状病毒的s蛋白受体结合区域与人受体蛋白ace2的结合,有效抑制病毒进入细胞内导致的感染,也能抑制病毒核酸的复制,阻止已感染病毒的扩增;且本发明的中药制剂对人体无毒副作用,可用于日常或医用提高身体免疫力、防治冠状病毒。
本发明的目的之二在于提供一种上述药食两用的中药制剂在制备防治冠状病毒感染的保健食品、消杀产品或中药复方中的应用,可以达到冠状病毒的日常或医用防治目的,也为中药材在抗病毒中的应用提供理论基础,扩展中药的应用领域和潜力,为中医药更好用于临床提供参考。
本发明的目的之一通过以下技术方案实现:
一种药食两用的中药制剂,包括人参、甘草、鱼腥草、陈皮、黄芪、化橘红中的任意一种或多种的组合;所述药食两用的中药制剂的药效成分能与冠状病毒的s蛋白受体结合区域或人受体蛋白ace2结合。
进一步地,所述药效成分包括人参皂苷rg1、甘草酸、异槲皮素、芦丁、槲皮素、橙皮苷、橙皮素单葡萄糖苷、橙皮素、新橙皮苷、黄芪甲苷、柚皮苷、柚皮素单葡萄糖苷、柚皮素、芹菜素中的任意一种或多种。
优选地,所述药食两用的中药制剂,包括人参、甘草、鱼腥草、陈皮、黄芪和化橘红的组合。
进一步地,所述药食两用的中药制剂,包括按重量比计的如下组分:人参10-20份、甘草5-20份、鱼腥草20-40份、陈皮20-30份、黄芪30-40份、化橘红40-60份。
优选地,所述药食两用的中药制剂,包括按重量比计的如下组分:人参10份、甘草15份、鱼腥草30份、陈皮25份、黄芪35份、化橘红50份。
进一步地,所述药食两用的中药制剂,剂型为口服剂型或非肠道给药剂型。
优选地,所述口服剂型为胶囊剂、片剂、颗粒剂、丸剂、口服液、袋泡剂中的任意一种。
实现本发明的第二个目的可以通过采取如下技术方案达到:
一种药食两用的中药制剂在制备防治冠状病毒感染的保健食品、消杀产品或中药复方中的应用。
进一步地,所述冠状病毒包括nl63-cov、mers、sars-cov、sars-cov-2。
相比现有技术,本发明的有益效果在于:
1、本发明药食两用中药制剂的有效成分具有与冠状病毒s蛋白或人受体蛋白ace2结合的性能,可以抑制冠状病毒s蛋白受体结合区域(rbd)(以下检测s-rbd蛋白)与人受体蛋白ace2结合,有效抑制病毒进入细胞内导致的感染,达到预防冠状病毒感染的目的。同时,本发明药食两用中药制剂也能抑制病毒核酸的复制,阻止已感染病毒的扩增,对已感染病毒的细胞也起到较好的抗病毒作用。这为中药材在抗病毒领域中的应用提供了理论基础,扩展了中药的应用领域和潜力,为中医药更好用于临床提供了参考。
2、本申请的中药制剂各中药组分均具有防治冠状病毒的功效,将各中药组份进行组合后还具有协同增效的作用,防治效果更明显,疗效确切、机理明确,具有较好的应用前景。
3、本发明先通过模拟冠状病毒入侵人体呼吸道细胞的分子机理过程,实现高效筛选具有冠状病毒防治功效的中药材方剂和中药材中的稀有活性成分;然后以sars-cov-2病毒感染veroe6细胞株作为实验模型进行体外细胞实验,证实了本发明的中药材成分能在体外细胞模型中有效抑制病毒进入细胞内部,抑制病毒的核酸复制,达到防止冠状病毒的目的,这也为进一步开发防治冠状病毒、特别是sars-cov-2病毒的方法奠定了基础,具有重要的开发价值和推广意义。
附图说明
图1为实施例1中药制剂与sars-cov-2病毒s-rbd蛋白结合的传感图;
图2为实施例1中药制剂与人受体蛋白ace2结合的传感图;
图3为实施例2中药制剂和人受体蛋白ace2竞争性结合sars-cov-2病毒s-rbd蛋白的传感图;
图4为人参提取液与sars-cov-2病毒s-rbd蛋白结合的传感图;
图5为甘草提取液与sars-cov-2病毒s-rbd蛋白结合的传感图;
图6为鱼腥草提取液与sars-cov-2病毒s-rbd蛋白结合的传感图;
图7为陈皮提取液与sars-cov-2病毒s-rbd蛋白结合的传感图;
图8为人参提取液与人受体蛋白ace2结合的传感图;
图9为甘草提取液与人受体蛋白ace2结合的传感图;
图10为鱼腥草提取液与人受体蛋白ace2结合的传感图;
图11为黄芪提取液与人受体蛋白ace2结合的传感图;
图12为化橘红提取液与人受体蛋白ace2结合的传感图;
图13为陈皮提取液与人受体蛋白ace2结合的传感图。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
一种药食两用的中药制剂,包括人参、甘草、鱼腥草、陈皮、黄芪、化橘红中的任意一种或多种的组合;药食两用的中药制剂的药效成分能与冠状病毒的s蛋白受体结合区域或人受体蛋白ace2结合。
本发明药食两用的中药制剂的药效成分包括人参皂苷rg1、甘草酸、异槲皮素、芦丁、槲皮素、橙皮苷、橙皮素单葡萄糖苷、橙皮素、新橙皮苷、黄芪甲苷、柚皮苷、柚皮素单葡萄糖苷、柚皮素、芹菜素中的任意一种或多种。
其中,人参的药效成分为人参皂苷rg1,甘草的药效成分为甘草酸,鱼腥草的药效成分为异槲皮素、芦丁、槲皮素,陈皮的药效成分为橙皮苷、橙皮素单葡萄糖苷、橙皮素、新橙皮苷,黄芪的药效成分为黄芪甲苷,化橘红的药效成分为柚皮苷、柚皮素单葡萄糖苷、柚皮素、芹菜素。
作为进一步的优选方案,上述药食两用的中药制剂包括人参、甘草、鱼腥草、陈皮、黄芪和化橘红的组合。具体来说,包括按重量比计的如下组分:人参10-20份、甘草5-20份、鱼腥草20-40份、陈皮20-30份、黄芪30-40份、化橘红40-60份。
按药剂学方法,可以将本发明的药食两用中药制剂加入常规辅料按照常规方法制备成多种临床剂型,包括口服剂型或非肠道给药的剂型,其中口服剂型可以为胶囊剂、片剂、颗粒剂、丸剂、口服液或袋泡剂中的任意一种。
也可向本发明的药食两用中药制剂中加入常规的保健食品赋形剂,如溶剂、崩解剂、矫昧剂、防腐剂、着色剂等。
一种药食两用的中药制剂在制备防治冠状病毒感染的保健食品、消杀产品或中药复方中的应用。对人体无毒副作用,可以达到冠状病毒的日常或医用防治目的,在医药和食品领域均具有良好的应用前景,也为中药材在抗病毒中的应用提供理论基础,扩展中药的应用领域和潜力,为中医药更好用于临床提供参考;同时为加快开发防治sars-cov-2病毒的方法奠定了基础。
其中,对应的冠状病毒包括nl63-cov、mers、sars-cov、sars-cov-2。
本发明药食两用中药制剂的及其有效成分是通过表面等离子共振技术(spr)筛选出来的。spr技术工作原理为:将配体(抗体、蛋白等分子)偶联在芯片表面,然后将待测样品(中药材药效成分)流过芯片表面,若样品中有能够与芯片表面的生物分子相互作用的分子,会引起金膜表面折射率变化,最终导致spr角变化,通过监测spr的角度变化,获得被分析物的浓度、亲和力、动力学常数和特异性等。
实施例1
药食两用中药制剂与sars-cov-2病毒s-rbd蛋白、人受体ace2蛋白的作用分析
(1)中药提取液的制备
一种药食两用中药制剂,包括按重量比计的如下组分:人参10份、甘草15份、鱼腥草30份、陈皮25份、黄芪35份、化橘红50份。
将本实施例中药制剂按照常规方法提取后,获得中药提取液,通过本领域常用的方法检测提取液中药效化合物的总含量。其中,药效化合物包括人参皂苷rg1、甘草酸、异槲皮素、芦丁、槲皮素、橙皮苷、橙皮素单葡萄糖苷、橙皮素、新橙皮苷、黄芪甲苷、柚皮苷、柚皮素单葡萄糖苷、柚皮素和芹菜素。
(2)spr芯片表面预处理
利用共价结合将sars-cov-2病毒s-rbd蛋白、人ace2蛋白分别偶联在酯化的芯片表面。选择氨基共价偶联,具体包括以下步骤:
第一步,芯片活化:ph4.5-5条件下使用交联剂edc/nhs使芯片表面酯化;
第二步,配体偶联:将蛋白纯度在90%以上的sars-cov-2病毒s-rbd蛋白、人ace2蛋白偶联到芯片表面;
第三步,封闭:用1mph8.5乙醇胺盐酸盐封闭芯片上多余的有活性的羧基。
对照表面的设计:spr芯片分1、2、3、4四个flowcell通道,一般1、2通道配对使用(1通道作为参比),3、4通道配对使用(3通道作为参比),参比通道对照表面可设计成空白表面、活化-封闭无配体固定的表面或偶联了伪装配体的表面。本实施例的参比通道对照表面选择活化-封闭无配体固定的方式来做削减对照,当对进样过程进行分析时,对照表面的削减可用来消除因样品溶解缓冲液与仪器运行缓冲液成分不同所造成的容积差及一些非特异性结合信号。
(3)进样
将步骤(1)提取、分析得到的中药提取液分成7份,用运行缓冲液(50mm磷酸盐,100mm氯化钠,0.01%tween-20,ph7.4)分别稀释至200μm、100μm、50μm、25μm、12.5μm、6.25μm、3.125μm,作为进样样本,进样。进样时间为200s,进样流速30μl/min,蛋白解离时间为3min。
(4)芯片再生
将芯片上的残留蛋白用再生缓冲液(10mmhepes,150mmnacl,0.01%tween20,ph7.4)洗脱下来,时间为100s,流速设为30μl/min。
(5)数据分析
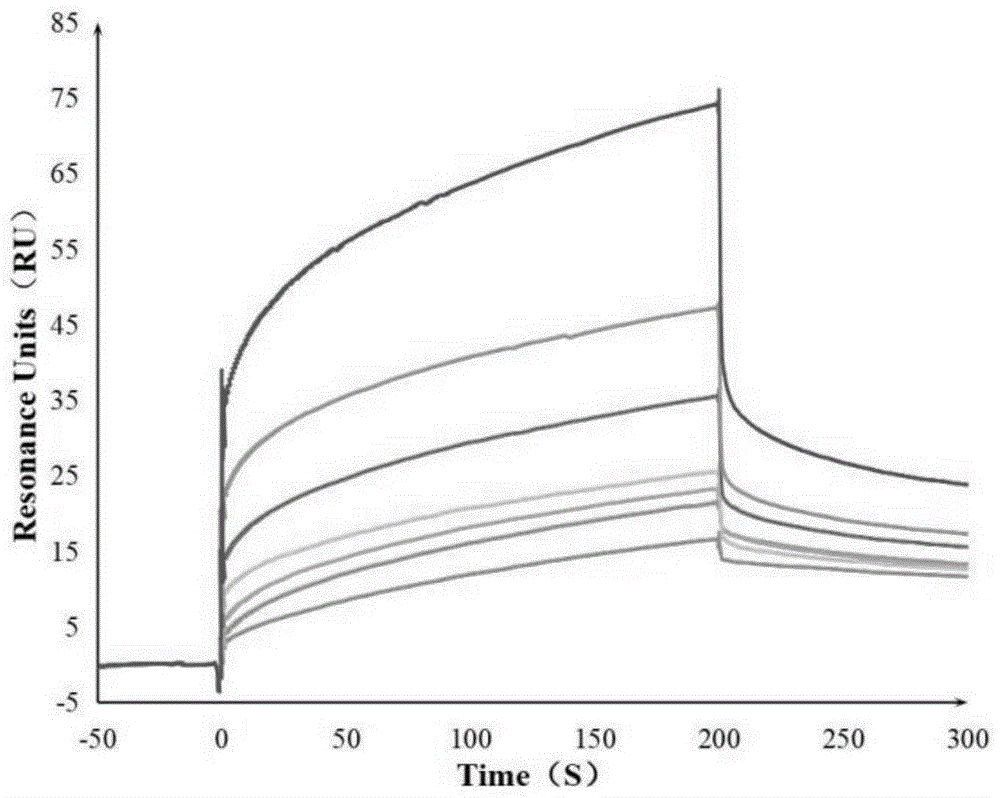
采用biacoret200评价软件(version3.1)分析生成传感图,如图1-2所示。
图1为本实施例中药制剂与sars-cov-2病毒s-rbd蛋白结合的传感图,图2为本实施例中药制剂与人ace2蛋白结合的传感图,图中曲线对应的进样样本浓度自上至下依次为200μm、100μm、50μm、25μm、12.5μm、6.25μm、3.125μm。通过全局拟合,即采用相同的动力学参数对不同分析物浓度产生的spr响应曲线进行同步拟合,可以获得更加准确的拟合结果。本实施例中药制剂的药效成分能较好的与sars-cov-2病毒s-rbd蛋白结合,同时与人受体蛋白ace2也具有较强的结合能力。因此,本实施例的药食两用中药制剂能用来制备防治病毒药物或者保健食品,在医药和食品领域均具有良好的应用前景。
实施例2
药食两用中药制剂、人受体ace2蛋白竞争性结合sars-cov-2病毒s-rbd蛋白的作用分析
(1)本实施例药食两用中药制剂的配方及中药提取液制备方法与实施例1相同,此处不再详述。
(2)spr芯片表面预处理
利用共价结合将sars-cov-2病毒s-rbd蛋白偶联在酯化的芯片表面。选择氨基共价偶联,具体包括以下步骤:
第一步,芯片活化:ph4.5-5条件下使用交联剂edc/nhs使芯片表面酯化;
第二步,配体偶联:将蛋白纯度在90%以上的sars-cov-2病毒s-rbd蛋白偶联到芯片表面;
第三步,封闭:用1mph8.5乙醇胺盐酸盐封闭芯片上多余的有活性的羧基。
对照表面的设计:方法与实施例1相同,此处不再详述。
(3)进样
将步骤(1)提取、分析得到的中药提取液分成7份,用运行缓冲液(50mm磷酸盐,100mm氯化钠,0.01%tween-20,ph7.4)分别稀释至50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm、0.78125μm,然后向上述7份稀释后的样本中分别加入终浓度4.75μg/ml的ace2蛋白,混合均匀获得进样样本;设置仅含有终浓度4.75μg/ml的ace2蛋白溶液作为对照样本,然后进样。进样时间为200s,进样流速30μl/min,蛋白解离时间为3min。
(4)芯片再生
方法与实施例1相同,此处不再详述。
(5)数据分析
采用biacoret200评价软件(version3.1)分析生成传感图,如图3所示。
图3为本实施例中药制剂和人受体蛋白ace2竞争性结合sars-cov-2病毒s-rbd蛋白的传感图,图中曲线自上至下依次对应的为对照样本、12.5μm进样样本、25μm进样样本、50μm进样样本。通过全局拟合,即采用相同的动力学参数对不同分析物浓度产生的spr响应曲线进行同步拟合,可以获得更加准确的拟合结果。本实施例中药制剂的药效成分在一定浓度范围内具有与人受体ace2蛋白竞争性结合sars-cov-2病毒s-rbd蛋白的作用,经计算药效成分浓度为50μm时,对人受体ace2蛋白与sars-cov-2病毒s-rbd蛋白结合的抑制率为42.8%。因此,本实施例中药制剂可以中和sars-cov-2病毒s-rbd蛋白和人受体蛋白ace2结合,具有较好的防治sars-cov-2病毒感染的作用,能用来制备抗病毒药物或者保健食品,在医药和食品领域均具有良好的应用前景。
实施例3
药食两用中药制剂的组分与sars-cov-2病毒s-rbd蛋白的作用分析
(1)单组分中药提取液的制备
将本实施例中药制剂的各组分按照常规方法(与实施例1方法相同)分别提取后,获得单组分中药提取液,再通过本领域常用的方法分别检测单组分中药提取液中药效化合物的总含量。其中,单组分中药的药效成分如下:
人参,药效成分为人参皂苷rg1;
甘草,药效成分为甘草酸;
鱼腥草,药效成分为异槲皮素、芦丁、槲皮素;
陈皮,药效成分为橙皮苷、橙皮素单葡萄糖苷、橙皮素、新橙皮苷;
黄芪,药效成分为黄芪甲苷;
化橘红,药效成分为柚皮苷、柚皮素单葡萄糖苷、柚皮素、芹菜素。
(2)spr芯片表面预处理
利用共价结合将sars-cov-2病毒s-rbd蛋白偶联在酯化的芯片表面。选择氨基共价偶联,具体包括以下步骤:
第一步,芯片活化:ph4.5-5条件下使用交联剂edc/nhs使芯片表面酯化;
第二步,配体偶联:将蛋白纯度在90%以上的sars-cov-2病毒s-rbd蛋白偶联到芯片表面;
第三步,封闭:用1mph8.5乙醇胺盐酸盐封闭芯片上多余的有活性的羧基。
对照表面的设计:方法与实施例1相同,此处不再详述。
(3)进样
1)进样样本制备:将步骤(1)得到的单组分中药提取液用运行缓冲液(50mm磷酸盐,100mm氯化钠,0.01%tween-20,ph7.4)进行稀释,具体为:
人参提取液的药效成分终浓度依次为:50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm、0.78125μm;
甘草提取液的药效成分终浓度依次为:50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm、0.78125μm;
鱼腥草提取液的药效成分终浓度依次为:100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm;
陈皮提取液的药效成分终浓度依次为:100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm;
化橘红提取液的药效成分终浓度依次为:100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm;
黄芪提取液的药效成分终浓度依次为:25μm、12.5μm、6.25μm、3.125μm、1.5625μm。
2)进样
将1)制备好的进样样本进行进样,设置进样时间为1.5min,进样流速30μl/min,蛋白解离时间为1min。
(4)芯片再生
将芯片上的残留蛋白用再生缓冲液(10mmhepes,150mmnacl,0.01%tween20,ph7.4)洗脱下来,时间为30s,流速设为30μl/min。
(5)数据分析
采用biacoret200评价软件(version3.1)分析生成传感图,如图4-7所示。
图4-7依次为人参提取液、甘草提取液、鱼腥草提取液、陈皮提取液与sars-cov-2病毒s-rbd蛋白结合的传感图。其中,图4和图5中,曲线对应的样本浓度自上至下依次为50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm、0.78125μm;图6和图7中,曲线对应的样本浓度自上至下依次为100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm。
通过全局拟合,即采用相同的动力学参数对不同分析物浓度产生的spr响应曲线进行同步拟合,可以获得更加准确的拟合结果。将数据用分析软件进行拟合处理,计算出上述四种单组分中药提取液与sars-cov-2病毒s-rbd蛋白相互作用的亲和力常数kd:人参提取液与sars-cov-2病毒s-rbd蛋白作用的kd值为5.24×10-6mol/l;甘草提取液与sars-cov-2病毒s-rbd蛋白作用的kd值为7.01×10-6mol/l;鱼腥草提取液与sars-cov-2病毒s-rbd蛋白作用的kd值为4.54×10-6mol/l;陈皮提取液与sars-cov-2病毒s-rbd蛋白作用的kd值为1.853×10-6mol/l。上述四种中药材的药效成分与sars-cov-2病毒s-rbd蛋白作用的亲和力自大至小依次是陈皮、鱼腥草、人参、甘草;而该浓度下,化橘红和黄芪提取液单独作用时与s-rbd蛋白无结合作用。
根据spr技术得到的传感图和kd值,本发明中的四种中药材提取液单独作用时具有和sars-cov-2病毒s-rbd蛋白结合的能力,因此可以抑制sars-cov-2病毒s-rbd蛋白和人受体蛋白ace2结合,进而抵抗sars-cov-2病毒的感染,能用来制备抗病毒药物或者保健食品。
实施例4
药食两用中药制剂的组分与人受体蛋白ace2的作用分析
本实施例中,除spr芯片表面预处理步骤外,其余步骤和方法与实施例3相同,此处不再详述。
本实施例的spr芯片表面预处理包括:
利用共价结合将人受体蛋白ace2偶联在酯化的芯片表面。选择氨基共价偶联,具体包括以下步骤:第一步,芯片活化:ph4.5-5条件下使用交联剂edc/nhs使芯片表面酯化;第二步,配体偶联:将蛋白纯度在90%以上的人受体蛋白ace2偶联到芯片表面;第三步,封闭:用1mph8.5乙醇胺盐酸盐封闭芯片上多余的有活性的羧基。
对照表面的设计方法与实施例3相同,此处不再详述。
采用biacoret200评价软件(version3.1)分析生成传感图,如图8-13所示。
图8-13依次为人参提取液、甘草提取液、鱼腥草提取液、黄芪提取液、化橘红提取液、陈皮提取液与人受体蛋白ace2结合的传感图。其中,图8和图9中,曲线对应的样本浓度自上至下依次为50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm、0.78125μm;图10中,曲线对应的样本浓度自上至下依次为100μm、50μm、25μm、12.5μm、6.25μm、3.125μm;图11中,曲线对应的样本浓度自上至下依次为25μm、12.5μm、6.25μm、3.125μm、1.5625μm;图12和图13中,曲线对应的样本浓度自上至下依次为100μm、50μm、25μm、12.5μm、6.25μm、3.125μm、1.5625μm。
通过全局拟合,即采用相同的动力学参数对不同分析物浓度产生的spr响应曲线进行同步拟合,可以获得更加准确的拟合结果。将数据用分析软件进行拟合处理,计算出六种中药材成分与人受体蛋白ace2相互作用的亲和力常数kd:人参提取液与人受体蛋白ace2作用的kd值为3.74×10-6mol/l;甘草提取液与人受体蛋白ace2作用的kd值为4.48×10-6mol/l;陈皮提取液与人受体蛋白ace2作用的kd值为2.446×10-5mol/l;鱼腥草提取液与人受体蛋白ace2作用的kd值为6.68×10-5mol/l;黄芪提取液与人受体蛋白ace2作用的kd值为3.69×10-7mol/l;化橘红提取液与人受体蛋白ace2作用的kd值为5.27×10-6mol/l。上述六种中药材成分与人受体蛋白ace2作用的亲和力自大至小依次是黄芪、人参、甘草、化橘红、陈皮、鱼腥草。
根据spr技术得到的传感图和kd值,本实施例的六种中药材单独作用均具有和人受体蛋白ace2结合的能力,因此可以抑制sars-cov-2病毒s-rbd蛋白和人受体蛋白ace2结合,进而抵抗冠状病毒的感染,能用来制备抗病毒药物或者保健食品。
实施例5
药食两用中药制剂对sars-cov-2病毒的抑制作用
(1)药食两用中药制剂的配制,分为a-j10组,分别为:
a组:人参提取液;b组:甘草提取液;c组:鱼腥草提取液;d组:陈皮提取液;e组:黄芪提取液;f组:化橘红提取液;g组:组合物1提取液;h组:组合物2提取液;i组:组合物3提取液;j组:组合物4提取液。
其中,组合物1包括按重量比计的:人参10重量份、甘草15重量份、鱼腥草30重量份、陈皮25重量份、黄芪35重量份、化橘红50重量份;组合物2包括按重量比计的:甘草15重量份、鱼腥草30重量份、陈皮25重量份、黄芪35重量份、化橘红50重量份;组合物3包括按重量比计的:甘草15重量份、鱼腥草30重量份、陈皮25重量份、化橘红50重量份;组合物4包括按重量比计的:人参10重量份、甘草15重量份、鱼腥草30重量份、陈皮25重量份。
将a-j10组的提取液中药效成分的浓度稀释至50ppm-500ppm。
(2)将veroe6细胞按每孔2×105种植于96孔细胞培养板,待细胞贴壁生长均匀后,换成2%fbs细胞培养基。
(3)向步骤(1)配制的不同浓度的a-j组提取液中分别加入sars-cov-2病毒孵育2h,然后加入到步骤(2)得到的veroe6细胞中进行感染、培养;
对照组为:向veroe6细胞液中加入sars-cov-2病毒进行感染、培养。
(4)48h后,收集细胞培养上清液,检测上清液的抗原量,以对照组的抗原量为100%,计算各组清除病毒量50%(ec50)所需的浓度,结果如表1所示。
实施例6
药食两用中药制剂提升细胞免疫sars-cov-2病毒能力的作用
(1)药食两用中药制剂的配制,分为a-j10组,与实施例5相同。
(2)将veroe6细胞按每孔2×105种植于96孔细胞培养板,待细胞贴壁生长均匀后,换成2%fbs细胞培养基。
(3)分别向细胞培养液中加入200ppm的a-j组提取液,预处理细胞2h后,再加入sars-cov-2病毒进行感染、培养;
对照组为:向细胞培养液中直接加入sars-cov-2病毒进行感染、培养,不进行预处理。
(4)48h后,收集细胞培养上清,检测上清液抗原量,以对照组的抗原量为100%,计算经不同组提取液处理后的细胞上清液中的抗原量,得到抑制率。如表1所示。
实施例7
药食两用中药制剂对已感染sars-cov-2病毒的细胞的作用
(1)药食两用中药制剂的配制,分为a-j10组,与实施例5相同。
(2)将veroe6细胞按每孔2×105种植于96孔细胞培养板,待细胞贴壁生长均匀后,换成2%fbs细胞培养基。
(3)向细胞培养液中加入sars-cov-2病毒,孵育1h后,移除培养基上清,得到感染sars-cov-2病毒的细胞;向感染sars-cov-2病毒的细胞中分别加入200ppm的a-j组提取液,进行孵育;
对照组为:感染sars-cov-2病毒的细胞培养液,不加入任何提取液,孵育。
(4)48h后,收集细胞培养上清,检测上清液抗原量,以对照组的抗原量为100%,计算经不同组提取液处理后的细胞上清液中的抗原量,得到抑制率。如表1所示。
表1药食两用中药制剂抗sars-cov-2病毒的实验结果
由表1可以看出,本申请中药制剂的组分单独作用时具有较好的抑制sars-cov-2的效果,且各单组分药材之间的抑制效果差异不大。将中药组分进行组合后,各组分协同增效,抑制率明显提高,所需浓度也对应下降。因此,本发明的药食两用中药制剂能在一定程度上保护细胞免受新型冠状病毒(sars-cov-2)的感染,并对已感染新型冠状病毒的细胞具有一定的抗病毒作用,起到辅助抗病毒及缓解症状的协同作用,是一种理想的新型冠状病毒抑制剂。本发明的中药制剂及其应用有利于推动中药材对新型冠状病毒及其它病毒的疗效评价,对疾病的早期预防、减少病毒感染危害、保障人民身体健康等方面具有重要意义。
上述实施方式仅为本发明专利的优选实施方式,不能以此来限定本发明专利保护的范围,本领域的技术人员在本发明专利的基础上所做的任何非实质性的变化及替换均属于本发明专利所要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!