一种木瓜总三萜水凝胶的制备方法及其应用与流程
本发明属于皮肤修复
技术领域:
,具体涉及木瓜总三萜水凝胶的制备工艺及其应用。
背景技术:
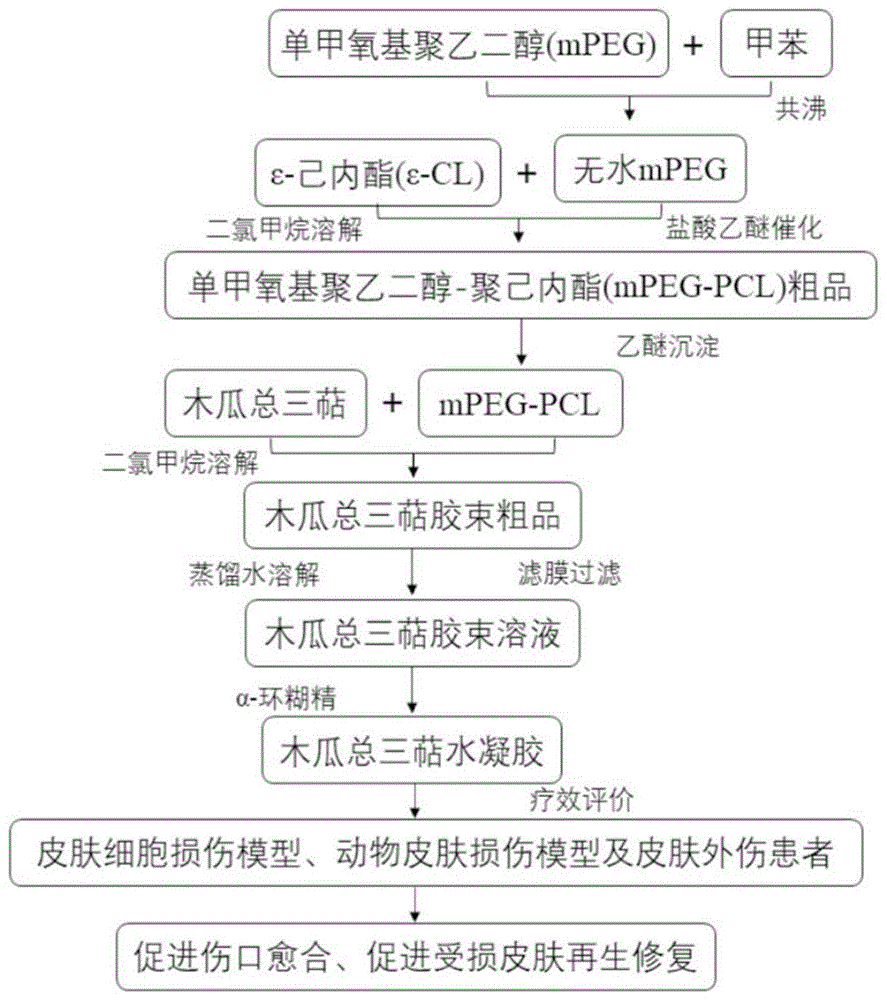
:皮肤是人体最大的器官,具有代谢、吸收、防护、体温调节、分泌和感觉等多项重要功能,同时受到外界化学、物理等因素刺激时容易造成损伤。皮肤发生急性创伤后的愈合过程十分容易造成瘢痕和创面收缩,影响正常的皮肤功能、美观和心理,因此皮肤损伤后的再生和功能修复成为临床医师关注的焦点问题。尤其是皮肤全层缺损患者,主要通过临近皮肤上皮细胞迁移和残存的皮肤附件的干细胞再生使伤口愈合,若患者皮肤缺损面积过大或全层皮损伤/缺损时,不能完全再生,创面形成瘢痕、延迟愈合或者不愈合,使患者发生严重功能障碍,患者承受痛苦较大。因此促进皮肤创面愈合和减少瘢痕生成显得尤为重要。目前,用于皮肤创面愈合治疗的方法主要是基因工程的应用、生物工程材料的使用、纳米技术的应用、营养辅助治疗等,但存在疗效个体差异大、价格高、病人依从性差、愈合后易出现瘢痕等诸多不足,中药治疗皮肤病历史悠久,经验丰富,开创了许多不同的用药剂型,近年来随着科学的发展,中药药物提取用于治疗皮肤病也收到了很好的疗效。木瓜为蔷薇科植物贴梗海棠chaenomelesspeciosa(sweet)nakai的干燥近成熟果实,又名皱皮木瓜、铁脚梨、贴梗海棠、宣木瓜、酸木瓜、空儿木瓜、木瓜实等。木瓜有“百益之果”之称,是一种非常重要的观赏和食用的植物,被列为卫生部2003年首批认定的药食两用的食品之一。其被用作一种可食用的果实,又被应用于美容化妆品和保健品领域。木瓜总三萜是皱皮木瓜中的重要活性成分,其主要成分包括齐墩果酸、熊果酸、白桦脂酸、3-o-乙酰熊果酸、3-o-乙酰坡模醇酸、山楂酸、委陵菜酸和speciosaperoxide。木瓜总三萜在鲜果中含量在0.32%以上,富集后的木瓜三萜总含量为90.02%。具体方法在我们已获授权的专利:一种皱皮木瓜提取物、提取方法及其应用(专利号:zl201510660595.8)有详细的介绍。技术实现要素:本发明发明人经过广泛深入的研究,将从土家药物皱皮木瓜中提取得到的木瓜总三萜制备成木瓜总三萜水凝胶,并且经过研究发现木瓜总三萜木瓜总三萜可有效促进人真皮成纤维细胞和血管内皮细胞增殖、迁移,对受损的皮肤创面具有较好的促进皮肤修复、伤口愈合和减少瘢痕生成,未见有明显的毒副作用。目前还未见有与本发明制备的木瓜总三萜水凝胶的制备方法及促进受损皮肤创面愈合的相关报道。本发明的一个目的是提供一种将木瓜总三萜制备成木瓜总三萜水凝胶的制备方法。本发明方法包括单甲氧基聚乙二醇-聚己内酯(mpeg-pcl)的合成、木瓜总三萜胶束的制备和木瓜总三萜水凝胶的制备。本发明具体地是通过以下技术方案实现的:a)将mpeg和甲苯在三颈烧瓶中加热共沸,回收甲苯,得到无水mpeg;b)将a)步得到的无水mpeg加入二氯甲烷溶解后,依次加入ε-己内酯(ε-cl)和2.0mol/l盐酸乙醚,在25℃下反应,然后回收二氯甲烷和乙醚,得到mpeg-pcl粗品;c)将b)步得到的mpeg-pcl粗品在乙醚中沉淀,过滤,得到纯化的白色至类白色星型mpeg-pcl结晶。d)将c)步得到的mpeg-pcl和木瓜总三萜混合均匀,加入二氯甲烷,并搅拌至透明溶液后,回收溶液中的二氯甲烷,得淡褐色木瓜总三萜粗胶束。e)将d)步得到的淡褐色木瓜总三萜粗胶束加入蒸馏水,加热,混合均匀后,用滤膜过滤,除去未包封的木瓜总三萜等沉淀物,即得木瓜总三萜胶束溶液,或经冷冻干燥后即得木瓜总三萜胶束。f)将e)步得到的木瓜总三萜胶束溶液或木瓜总三萜胶束用蒸馏水溶解后加入一定浓度的α-环糊精(α-cd)混合均匀,即得木瓜总三萜水凝胶。在本发明在mpeg-pcl合成具体的实施方案中:①mpeg除水过程时,按照mpeg:甲苯为1:2~10(g:ml)质量体积比溶解于三颈烧瓶中;在100~160℃条件下,加热共沸1~5小时,然后回收甲苯;再重复上述操作一次,回收甲苯至无甲苯味,得到无水mpeg。②将无水mpeg和二氯甲烷按照1:2~10(m:v)的质量体积比在旋蒸瓶中溶解后,按mpeg:ε-cl为1:1~5(m:m)质量比加入ε-cl混合均匀;然后加入体积比为1:0.1~0.5(v:v)的2.0mol/l盐酸乙醚,混合均匀后,在25℃下搅拌12~36小时,然后回收二氯甲烷和乙醚,得到mpeg-pcl粗品。③将mpeg-pcl粗品按照1:2~10(m:v)的质量体积比加入乙醚洗涤、沉淀,然后过滤,得到纯化的白色至类白色星型mpeg-pcl结晶。本合成工艺简单易行、快捷;本工艺得到的mpeg-pcl收率及纯度都比较高(纯度达99.5%);而且回收产物和催化剂可重复利用,降低了生产成本,同时减少了对环境的污染;总之,该合成工艺非常适合医药企业规模化合成mpeg-pcl。在本发明在木瓜总三萜胶束具体的实施方案中包括如下两种:①将mpeg-pcl和木瓜总三萜按照1:0.05~0.5质量比(m:m)均匀混合,然后加入二氯甲烷[混合物:二氯甲烷质量体积比1:25~100(m:v)]不断搅拌至透明溶液后,用旋转蒸发法回收溶液中的二氯甲烷,得淡褐色木瓜总三萜粗胶束。②将得到的淡褐色木瓜总三萜粗胶束按照1:25~100质量体积比(m:v)加入蒸馏水加热至60℃后,用涡旋仪混合均匀得木瓜总三萜胶束溶液,然后用至少0.22μm滤膜过滤,除去未包封的木瓜总三萜等沉淀物,即得木瓜总三萜胶束溶液,或经冷冻干燥后即得木瓜总三萜胶束。在本发明在木瓜总三萜水凝胶具体的实施方案中:将木瓜总三萜胶束溶液按1:0.25~1(v/v)体积比加入浓度为15~25%的α-环糊精(α-cd)溶液,在25℃下用涡旋仪混合均匀得皱皮木瓜总三萜水凝胶;或将所得的木瓜总三萜胶束按照1:25~100质量体积比(m:v)加入蒸馏水,加热至60℃均匀混合、冷却至25℃后按1:0.1~0.5(v:v)体积比加入浓度为15~25%的α-cd溶液,用涡旋仪混合均匀得木瓜总三萜水凝胶。本制备方法制备得到的皱皮木瓜总三萜水凝胶具有良好的生物相容性、无毒性、抵抗原性和良好的生物降解性,可有效的避开药物肝脏的首过效应,且可以实现定向给药、作用持久,因而更具应用开发前景。本发明的有益效果本发明制备得到的木瓜总三萜水凝胶在人真皮成纤维细胞、血管内皮细胞损伤模型具有较好的促进增殖、抑制细胞凋亡和促进细胞迁移作用;对手术切割致大鼠皮肤损伤模型和皮肤外伤患者具有良好的治疗作用,可显著促进皮肤创面愈合、缩短伤口愈合时间,促进受损皮肤再生修复、减少瘢痕生成。附图说明图1为木瓜总三萜水凝胶的制备工艺及应用技术路线图。图2木瓜总三萜水凝胶对uvb损伤的hdf细胞增殖的影响(mtt检测分析)(与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图3木瓜总三萜水凝胶对uvb损伤的hdf细胞增殖的影响(平板克隆形成实验)(a:细胞克隆图片,b:克隆形成个数;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图4木瓜总三萜水凝胶对uvb损伤的hdf细胞凋亡的影响(a:细胞凋亡图片,b:细胞凋亡数;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图5木瓜总三萜水凝胶对uvb损伤的hdf细胞迁移的影响(划痕实验)(a:细胞迁移图片,b:迁移面积;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图6木瓜总三萜水凝胶对uvb损伤的hdf细胞迁移的影响(transwell实验)(a:细胞迁移图片,b:迁移细胞数;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图7木瓜总三萜水凝胶对uvb损伤的huvecs细胞增殖的影响(mtt检测分析)(与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图8木瓜总三萜水凝胶对uvb损伤的huvecs细胞增殖的影响(平板克隆形成实验)(a:细胞克隆图片,b:克隆形成个数;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图9木瓜总三萜水凝胶对uvb损伤的huvecs细胞凋亡的影响(a:细胞凋亡图片,b:细胞凋亡数;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图10木瓜总三萜水凝胶对uvb损伤的huvecs细胞迁移的影响(划痕实验)(a:细胞迁移图片,b:迁移面积;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图11木瓜总三萜水凝胶对uvb损伤的huvecs细胞迁移的影响(transwell实验)(a:细胞迁移图片,b:迁移细胞数;与正常组比较:#p<0.05,##p<0.01;与uvb组比较:*p<0.05,**p<0.01;与空白水凝胶组比较:†p<0.05,††p<0.01;n=4)。图12木瓜总三萜水凝胶对皮肤损伤模型大鼠创面的影响。图13木瓜总三萜水凝胶对皮肤损伤模型大鼠创面愈合时间的影响(与空白水凝胶组比较:*p<0.05,**p<0.01;与疤痕灵组比较:†p<0.05,††p<0.01;n=10)。图14木瓜总三萜水凝胶对皮肤损伤模型大鼠大鼠创面愈合速率的影响(与空白水凝胶组比较:*p<0.05,**p<0.01;与疤痕灵组比较:†p<0.05,††p<0.01;n=10)。图15木瓜总三萜水凝胶对皮肤损伤模型大鼠皮肤病理形态的影响。具体实施方式下面结合实施例对本发明做进一步的说明,以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以上实施例所做的任何简单修改或等同变化,均落在本发明的保护范围内。实施例1木瓜总三萜水凝胶的制备(1)单甲氧基聚乙二醇(mpeg)除水称取10.0g单甲氧基聚乙二醇(mpeg)置于三颈烧瓶中,按照1:4(g:ml)质量体积比加入40ml甲苯,在120℃条件下加热共沸2小时,然后回收甲苯;再重复上述操作一次,回收甲苯至无甲苯味,得白色无水mpeg粉末,称重得粉末8.25g。(2)单甲氧基聚乙二醇-聚己内酯(mpeg-pcl)的合成将上述(1)所得的白色无水mpeg粉末放入旋蒸瓶中,按照1:5(g:ml)质量体积比加入41.25ml二氯甲烷溶解后,加入1:2(g:g)的质量比ε-己内酯(ε-cl)16.50g混合均匀后,然后加入1:0.25(v:v)的体积比的2.0mol/l盐酸乙醚12.5ml在25℃下搅拌24小时,然后回收二氯甲烷和乙醚,得到mpeg-pcl粗品24.62g。(3)mpeg-pcl的精致将上述(2)所得的mpeg-pcl粗品按照1:5(g:ml)的质量体积比加入123.75ml乙醚洗涤、沉淀,然后过滤,得到纯化的白色至类白色星型mpeg-pcl结晶,称重得晶体18.47g(见图1)。(4)木瓜总三萜胶束的制备将上述(3)所得的18.47gmpeg-pcl晶体按照1:0.25的质量比同木瓜总三萜4.62g在旋蒸瓶中均匀混合,然后加入1:50质量体积比(g:ml)的二氯甲烷不断搅拌至透明溶液,用旋转蒸发法回收溶液中的二氯甲烷,得淡褐色木瓜总三萜粗胶束23.05g。(5)木瓜总三萜胶束的精致将上述(4)所得的23.05g淡褐色木瓜总三萜粗胶束按1:50质量体积比(g/ml)加入蒸馏水加热至60℃后,用涡旋仪混合均匀得皱皮木瓜总三萜胶束溶液,用0.22μm滤膜过滤,除去皱皮木瓜总三萜等沉淀物,即得皱皮木瓜总三萜胶束溶液1105ml,或经冷冻干燥后即得皱皮木瓜总三萜胶束22.10g(见图1)。(6)木瓜总三萜水凝胶的制备将上述(5)所得的木瓜总三萜胶束溶液按1:0.2体积比(v/v)加入α-环糊精(α-cd)221ml,用涡旋仪混合均匀得皱皮木瓜总三萜水凝胶;或将所得的木瓜总三萜胶束按照按1:50质量体积比(g/ml)加入蒸馏水1105ml,在加热至60℃均匀混合、冷却后按1:0.2体积比(v/v)加入α-环糊精(α-cd)221ml,用涡旋仪混合均匀得皱皮木瓜总三萜水凝胶(见图1)。下面结合具体的实验例,具体说明本发明实施例1得到的木瓜总三萜水凝胶对皮肤细胞损伤具有较好的促进增殖、抑制细胞凋亡和促进细胞迁移作用;对动物皮肤损伤模型及皮肤外伤患者可显著促进促进皮肤创面愈合、缩短伤口愈合时间,促进受损皮肤再生修复、减少瘢痕生成。实验例2下面结合具体的实验例,具体说明本发明实施例1得到的木瓜总三萜水凝胶促进uvb损伤的人皮肤成纤维细胞(hdf)细胞增殖、细胞迁移、抑制细胞凋亡作用。试验方法1)实验细胞细胞株本次实验采用人皮肤成纤维细胞(hdf)购买自赛默飞世尔科技(中国)有限公司,培养于含10%胎牛血清的dmem培养液中,于37℃、5%co2培养箱中生长,实验时取对数生长期细胞。2)方法(1)细胞培养培养正常hdf细胞,培养液为含10%进口胎牛血清的dmem培养液,恒温37℃,5%co2,相对饱和湿度条件,无菌培养。每日观察细胞生长情况,单层细胞贴壁达80%左右时进行传代。传代时弃上清,pbs清洗细胞2-3次,弃pbs,加入2ml0.25%胰蛋白酶进行消化3min,加入含血清培养液终止消化,将贴壁细胞轻轻吹下,成为细胞悬液,1400rpm离心4min,弃上清,加入新鲜培养液将离心细胞吹打成单细胞悬液,传代比例为1:3,传入培养瓶继续培养。实验时取对数生长期细胞。(2)中波紫外线(uvb)损伤的hdf细胞模型的建立及分组将hdf细胞培养在含10%进口胎牛血清的dmem培养液中,当细胞长至对数生长期时,将细胞浓度为1×105个/ml的单细胞悬液接种于96孔板,培养24h后,进行紫外线照射,照射强度为0.4mw/cm2,照射时间为250s,最终总照射剂量为100mj/cm2(照射剂量=照射强度×照射时间)。将uvb损伤的hdf细胞分别随机分为uvb组、空白水凝胶组、木瓜总三萜水凝胶[2.5、5、10、20、40、80μg(含木瓜总三萜)/ml]组和uvb组、空白水凝胶组、木瓜总三萜水凝胶[5、10和20μg(含木瓜总三萜)/ml]组,另设未经uvb照射的hdf细胞作为正常组。实验前用二甲基亚砜(dmso)将木瓜总三萜水凝胶配成100mg/ml的溶液,经0.22μm滤膜过滤后4℃保存备用。(3)mtt检测木瓜总三萜水凝胶对uvb损伤的hdf细胞增殖的影响hdf细胞的培养方法和分组见(2)。将各给药加入相应的浓度的木瓜总三萜水凝胶后,分别培养24h和48h后每孔加入mtt溶液(5mg/ml)20μl,培养4h后吸尽培养液,加入150μldmso,490nm波长测定od值。(4)平板克隆形成实验检测木瓜总三萜水凝胶对uvb损伤的hdf细胞增殖的影响实验分正常组,uvb组、空白水凝胶组、木瓜总三萜水凝胶5μg(含木瓜总三萜)/ml组、木瓜总三萜水凝胶10μg(含木瓜总三萜)/ml组、木瓜总三萜水凝胶20μg(含木瓜总三萜)/ml组。hdf单细胞悬液以300个每孔接种于6孔板中,培养24h细胞贴壁后,木瓜总三萜水凝胶各剂量组加入木瓜总三萜水凝胶(5、10和20μg/ml),每孔中培养液为3ml,每隔三天换液,换液的同时加入相应浓度木瓜总三萜,5%co2,恒温37℃,相对饱和湿度条件下培养2周左右,除正常组外,各组进行紫外线照射,照射强度为0.4mw/cm2,照射时间为250s,最终总照射剂量为100mj/cm2,继续培养24h,然后结晶紫染色,计算克隆形成个数。(5)hoechst33258染色检测木瓜总三萜水凝胶对uvb损伤的hdf细胞凋亡的影响5×105个/ml的hdf单细胞悬液1ml接种于六孔板中,待细胞贴壁后加入药物处理,细胞分组见(2)。除正常组外,各组进行紫外线照射,照射强度为0.4mw/cm2,照射时间为250s,最终总照射剂量为100mj/cm2,将各给药加入相应的浓度的木瓜总三萜水凝胶(5、10和20μg/ml)培养24h后,弃去孔中培养液,加入0.5ml4%多聚甲醛固定液,固定10min;pbs洗涤2遍后再加入1mlhoechst33258染色液,摇床轻晃,染色5分钟;用pbs洗涤2遍,吸尽液体。荧光显微镜下检测拍照。(6)划痕实验检测木瓜总三萜水凝胶对hdf迁移增殖的影响取处于对数生长期的hdf细胞以15×105个/ml接种于6孔板,使用无菌的200μl枪头垂直在6孔板中划3条划痕,然后用pbs清洗,再按照(2)中分组对细胞进行相应浓度的木瓜总三萜水凝胶(5、10和20μg/ml)处理,培养24h后观察划痕宽度的变化,并使用相应图像处理软件分析划痕宽度。(7)transwell实验检测木瓜总三萜水凝胶对hdf迁移增殖的影响待细胞呈对数期生长,对其进行常规消化离心,用无血清dmem培养基重悬细胞,配成5×105个/ml细胞悬液,每个上室加入100μl细胞悬液;正常组下室中加入含10%fbs培养基,模型组加入无血清培养基,给药组加入含相应浓度木瓜总三萜水凝胶(5、10和20μg/ml)的无血清培养基;37℃培养箱中,孵育24h;取出上室用pbs洗2遍,用棉球擦去上室底部膜表面细胞,加入结晶紫(0.1%)染色10min,pbs洗去多余染料,显微镜下观察,照相记录,软件统计细胞个数。(8)统计学分析统计每组数据,均以均数±标准差(±s)表示。数据分析在spss21.0统计软件包上进行,以单因素方差分析(one-wayanova)进行多组间差异的比较,以dunnett-t检验比较两组间均数的差异,p<0.05说明差异具有统计学意义。每实验重复4次。试验结果1)木瓜总三萜水凝胶对uvb损伤的hdf细胞增殖的影响mtt结果显示,uvb照射对hdf细胞有明显的抑制增殖作用,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(2.5、5、10和20μg/ml)处理后,对uvb损伤的hdf细胞具有明显的促进增殖作用,40和80μg/ml木瓜总三萜水凝胶抑制了hdf细胞的增殖。提示低浓度木瓜总三萜水凝胶可促进hdf细胞增殖,高浓度木瓜总三萜水凝胶可抑制其增殖活性。根据现有研究,确定了木瓜总三萜水凝胶的适宜浓度(20μg/ml以下)和处理时间(24h),以供进一步的体外研究(见图2)。平板克隆形成实验结果显示,uvb照射可明显抑制hdf细胞克隆数,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(5、10和20μg/ml)处理后,可明显增加uvb损伤的hdf细胞克隆数,与uvb组和空白水凝胶组比较均具有显著性差异(p<0.05或p<0.01);空白水凝胶组对uvb损伤的hdf细胞克隆数没有明显影响(见图3)。2)木瓜总三萜水凝胶对uvb损伤的hdf细胞凋亡的影响hoechst33258染色结果显示,正常对照组细胞呈现弱蓝色荧光,形态均一完整,染色质分布均匀。uvb损伤模型组和空白水凝胶组中可见较多强蓝色荧光染色细胞,可观察到典型的调亡小体,染色质浓缩,核碎裂成大小不等的圆形小体等表示细胞凋亡的现象;其细胞凋亡数目明显增多,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(5、10μ和20μg/ml)处理后该种现象减弱并且随着木瓜总三萜水凝胶剂量的增大,正常形态的细胞增多,其凋亡特征越不明显,其细胞凋亡数目明显减少,与uvb组和空白水凝胶组比较均具有显著性差异(p<0.05或p<0.01);空白水凝胶组对uvb损伤的hdf细胞凋亡数目未见明显改善(见图4)。3)木瓜总三萜水凝胶对uvb损伤的hdf细胞迁移的影响划痕实验结果显示:uvb照射明显抑制了细胞的迁移能力,细胞愈合能力显著下降,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(5和20μg/ml)处理后能明显促进uvb损伤的hdf细胞迁移,划痕周边的细胞迁移至中央划痕区的距离明显减小,愈合能力明显升高,与uvb组和空白水凝胶组比较均具有显著性差异(p<0.01);空白水凝胶组未见有促进uvb损伤的hdf细胞迁移作用(见图5)。transwell实验结果表明:uvb照射损伤的hdf细胞穿透上室膜的能力明显降低,导致穿透膜的细胞数目明显减少,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(5和20μg/ml)处理后可明显促进uvb损伤的hdf细胞的穿膜能力,使得穿透膜的细胞数目明显增加,与uvb组和空白水凝胶组比较均具有显著性差异(p<0.01);空白水凝胶组未见有增强uvb损伤的hdf细胞的穿膜能力(见图6)。试验结论由木瓜总三萜水凝胶对uvb损伤的hdf细胞影响实验可知,木瓜总三萜水凝胶可显著促进uvb损伤的hdf细胞增殖、抑制其细胞凋亡、促进其细胞迁移。实验结果显示木瓜总三萜水凝胶对uvb损伤的hdf细胞具有较好的保护作用。实验例3下面结合具体的实验例,具体说明本发明实施例1得到的木瓜总三萜水凝胶促进uvb损伤的人脐静脉内皮细胞(huvecs)细胞增殖、细胞迁移、抑制细胞凋亡作用。试验方法1)实验细胞细胞株本次实验采用人脐静脉内皮细胞(huvecs)购买北京中国医学科学院基础医学研究所,培养于含10%胎牛血清的dmem培养液中,于37℃、5%co2培养箱中生长,实验时取对数生长期细胞。2)方法(1)细胞培养培养正常huvecs细胞,培养液为含10%进口胎牛血清的dmem培养液,恒温37℃,5%co2,相对饱和湿度条件,无菌培养。每日观察细胞生长情况,单层细胞贴壁达80%左右时进行传代。传代时弃上清,pbs清洗细胞2-3次,弃pbs,加入2ml0.25%胰蛋白酶进行消化3min,加入含血清培养液终止消化,将贴壁细胞轻轻吹下,成为细胞悬液,1400rpm离心4min,弃上清,加入新鲜培养液将离心细胞吹打成单细胞悬液,传代比例为1:3,传入培养瓶继续培养。实验时取对数生长期细胞。(2)中波紫外线(uvb)损伤的huvecs细胞模型的建立及分组将huvecs细胞培养在含10%进口胎牛血清的dmem培养液中,当细胞长至对数生长期时,将细胞浓度为1×105个/ml的单细胞悬液接种于96孔板,培养24h后,进行紫外线照射,照射强度为0.4mw/cm2,照射时间为250s,最终总照射剂量为100mj/cm2(照射剂量=照射强度×照射时间)。将uvb损伤的huvecs细胞分别随机分为uvb组、空白水凝胶组、木瓜总三萜水凝胶[2、4、8、16、32、64μg(含木瓜总三萜)/ml]组和uvb组、空白水凝胶组、木瓜总三萜水凝胶[4、8和16μg(含木瓜总三萜)/ml]组,另设未经uvb照射的huvecs细胞作为正常组。实验前用二甲基亚砜(dmso)将木瓜总三萜水凝胶配成100mg/ml的溶液,经0.22μm滤膜过滤后4℃保存备用。(3)mtt检测木瓜总三萜水凝胶对uvb损伤的huvecs细胞增殖的影响huvecs细胞的培养方法和分组见(2)。将各给药加入相应的浓度的木瓜总三萜水凝胶后,分别培养24h和48h后每孔加入mtt溶液(5mg/ml)20μl,培养4h后吸尽培养液,加入150μldmso,490nm波长测定od值。(4)平板克隆形成实验检测木瓜总三萜水凝胶对uvb损伤的huvecs细胞增殖的影响实验分正常组,uvb组、空白水凝胶组、木瓜总三萜水凝胶4μg(含木瓜总三萜)/ml组、木瓜总三萜水凝胶8μg(含木瓜总三萜)/ml组、木瓜总三萜水凝胶16μg(含木瓜总三萜)/ml组,每组3个复孔。huvecs单细胞悬液以300个每孔接种于6孔板中,培养24h细胞贴壁后,木瓜总三萜水凝胶各剂量组加入木瓜总三萜水凝胶(4、8和16μg/ml),每孔中培养液为3ml,每隔三天换液,换液的同时加入相应浓度木瓜总三萜水凝胶,5%co2,恒温37℃,相对饱和湿度条件下培养2周左右,除正常组外,各组进行紫外线照射,照射强度为0.4mw/cm2,照射时间为250s,最终总照射剂量为100mj/cm2,继续培养24h,然后结晶紫染色,计算克隆形成个数。(5)hoechst33258染色检测木瓜总三萜水凝胶对uvb损伤的huvecs细胞凋亡的影响5×105个/ml的huvecs单细胞悬液1ml接种于六孔板中,待细胞贴壁后加入药物处理,细胞分组见(2)。除正常组外,各组进行紫外线照射,照射强度为0.4mw/cm2,照射时间为250s,最终总照射剂量为100mj/cm2,将各给药加入相应的浓度的木瓜总三萜水凝胶(4、8和16μg/ml)培养24h后,弃去孔中培养液,加入0.5ml4%多聚甲醛固定液,固定10min;pbs洗涤2遍后再加入1mlhoechst33258染色液,摇床轻晃,染色5分钟;用pbs洗涤2遍,吸尽液体。荧光显微镜下检测拍照。(6)划痕实验检测木瓜总三萜水凝胶对huvecs迁移增殖的影响取处于对数生长期的huvecs细胞以15×105个/ml接种于6孔板,使用无菌的200μl枪头垂直在6孔板中划3条划痕,然后用pbs清洗,再按照(2)中分组对细胞进行相应浓度的木瓜总三萜水凝胶(4、8和16μg/ml)处理,培养24h后观察划痕宽度的变化,并使用相应图像处理软件分析划痕宽度。(7)transwell实验检测木瓜总三萜水凝胶对huvecs迁移增殖的影响待细胞呈对数期生长,对其进行常规消化离心,用无血清dmem培养基重悬细胞,配成5×105个/ml细胞悬液,每个上室加入100μl细胞悬液;正常组下室中加入含10%fbs培养基,模型组加入无血清培养基,给药组加入含相应浓度木瓜总三萜水凝胶(4、8和16μg/ml)的无血清培养基;37℃培养箱中,孵育24h;取出上室用pbs洗2遍,用棉球擦去上室底部膜表面细胞,加入结晶紫(0.1%)染色10min,pbs洗去多余染料,显微镜下观察,照相记录,软件统计细胞个数。(8)统计学分析统计每组数据,均以均数±标准差(±s)表示。数据分析在spss21.0统计软件包上进行,以单因素方差分析(one-wayanova)进行多组间差异的比较,以dunnett-t检验比较两组间均数的差异,p<0.05说明差异具有统计学意义。每实验重复4次。试验结果1)木瓜总三萜水凝胶对uvb损伤的huvecs细胞增殖的影响mtt结果显示,uvb照射对huvecs细胞有明显的抑制增殖作用,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(2、4、8和16μg/ml)处理后,对uvb损伤的huvecs细胞具有明显的促进增殖作用,32和64μg/ml木瓜总三萜水凝胶抑制了huvecs细胞的增殖。提示低浓度木瓜总三萜水凝胶可促进huvecs细胞增殖,高浓度木瓜总三萜水凝胶可抑制其增殖活性。根据现有研究,确定了木瓜总三萜水凝胶的适宜浓度(16μg/ml以下)和处理时间(24h),以供进一步的体外研究(见图7)。平板克隆形成实验结果显示,uvb照射可明显抑制huvecs细胞克隆数,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(4和16μg/ml)处理后,可明显增加uvb损伤的huvecs细胞克隆数,与uvb组和空白水凝胶组比较均具有显著性差异(p<0.05或p<0.01);空白水凝胶组对uvb损伤的huvecs细胞克隆数没有明显影响(见图8)。2)木瓜总三萜水凝胶对uvb损伤的huvecs细胞凋亡的影响hoechst33258染色结果显示,正常对照组细胞呈现弱蓝色荧光,形态均一完整,染色质分布均匀。uvb损伤模型组和空白水凝胶组中可见较多强蓝色荧光染色细胞,可观察到典型的调亡小体,染色质浓缩,核碎裂成大小不等的圆形小体等表示细胞凋亡的现象;其细胞凋亡数目明显增多,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(4和16μg/ml)处理后该种现象减弱并且随着木瓜总三萜水凝胶剂量的增大,正常形态的细胞增多,其凋亡特征越不明显,其细胞凋亡数目明显减少,与uvb组和空白水凝胶组比较均具有显著性差异(p<0.05或p<0.01);空白水凝胶组对uvb损伤的huvecs细胞凋亡数目未见明显改善(见图9)。3)木瓜总三萜水凝胶对uvb损伤的huvecs细胞迁移的影响划痕实验结果显示:uvb照射明显抑制了细胞的迁移能力,细胞愈合能力显著下降,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(4和16μg/ml)处理后能明显促进uvb损伤的huvecs细胞迁移,划痕周边的细胞迁移至中央划痕区的距离明显减小,愈合能力明显升高,与uvb组和空白水凝胶组比较均具有显著性差异,且呈现明显的时效和量效关系(p<0.05或p<0.01);空白水凝胶组未见有促进uvb损伤的huvecs细胞迁移作用(见图10)。transwell实验结果表明:uvb照射损伤的huvecs细胞穿透上室膜的能力明显降低,导致穿透膜的细胞数目明显减少,与正常组比较具有显著性差异(p<0.01);用木瓜总三萜水凝胶(4和16μg/ml)处理后可明显促进uvb损伤的huvecs细胞的穿膜能力,使得穿透膜的细胞数目明显增加,与uvb组和空白水凝胶组比较均具有显著性差异(p<0.05或p<0.01);空白水凝胶组未见有增强uvb损伤的huvecs细胞的穿膜能力(见图11)。试验结论由木瓜总三萜水凝胶对uvb损伤的huvecs细胞影响实验可知,木瓜总三萜水凝胶可显著促进uvb损伤的huvecs细胞增殖、抑制其细胞凋亡、促进其细胞迁移。实验结果显示木瓜总三萜水凝胶对uvb损伤的huvecs细胞具有较好的保护作用。实验例4下面结合具体的实验例,具体说明本发明实施例1得到的木瓜总三萜水凝胶对手术切割致大鼠皮肤损伤具有明显的治疗作用。试验方法1)实验动物动物及饲料均购自三峡大学实验动物中心,spf级spraguedawley(sd)大鼠50只,体重180~220g,雌雄各半,实验动物质量合格证号:scxk(鄂)2017-0061。动物饲养于普通级动物室干燥、通风、安静的环境,5只/笼。动物实验遵循三峡大学实验动物伦理委员会指导原则,并在其监督下开展实验研究。2)方法(1)皮肤损伤大鼠模型的制作用手术切割方法造模。在造模前两天在大鼠背部脊柱两侧用8%硫化钠脱毛备皮。术前腹腔注射20%氨基甲酸乙酯(1.5g/kg)麻醉,取大鼠俯卧位,暴露背部,铺无菌巾,术区常规碘伏消毒后,在距耳后4.0cm、脊柱正中两侧旁开1.0cm处用直径为1.2cm的角膜环钻做全层皮肤缺损创面,左右各1个,止血并用生理盐水冲洗伤口。在做创面的过程中,尽量做到打孔位置、大小、深度一致,尽量只取全层皮,少伤及皮下筋膜,尽量不伤及深层的血管以及神经,减小造模个体差异。(2)皮肤损伤模型大鼠分组及给药将成功制作皮肤损伤模型大鼠随机分为皮肤损伤空白水凝胶组、木瓜总三萜水凝胶组(1.2、2.4和3.6g/kg)和疤痕灵阳性药组(1.0g/kg)。药物涂敷组在其伤口缺损处分别涂敷相应木瓜总三萜水凝胶和疤痕灵后,在伤口周缘缝合包扎涂抹凡士林的无菌纱布,使其完全遮盖水凝胶及伤口,防止水凝胶脱落和伤口感染;空白水凝胶组则用空白水凝胶涂敷,其他处理方法同药物处理组。造模当天记作第0天。每天早晚1次,连续4周。(3)一般状况观察观察实验期间大鼠的进食量、精神状况、伤口有无感染等。(4)伤口愈合图像收集在造模的第0天开始,每隔3天用相机给伤口拍照。每次拍照前麻醉大鼠,然后修剪创面及其周缘长出的毛发,在伤口距离相等的位置放置直尺,用相同的焦距及距离拍照,记录对应大鼠编号的创面左右,并每天观察创面愈合情况。用imagej软件图像分析软件计算伤口面积,伤口创面愈合率=(建模后伤口面积-现在剩余伤口面积)/建模后伤口面积×100%,以伤口创面愈合率>90%为愈合标准。(5)皮肤组织形态学分析分别在在第3、11、21天每次随机选取一组大鼠,麻醉后剔除伤口周缘毛发,离伤口周缘1cm处取包含全层皮肤及皮下组织的标本,然后处死动物。用4%多聚甲醛中固定组织标本、乙醇梯度脱水、石蜡包埋后,切片,he染色后光镜下观察。(6)统计学分析实验结果用均数±标准差(±s)表示,数据分析在spss21.0统计软件包上进行,以单因素方差分析进行多组间差异比较,以dunnett-t检验比较两组间差异;p<0.05认为有统计学差异。试验结果1)大鼠的一般情况实验大鼠在术后略有下降,后缓慢增长,饲养期间大鼠活动正常,术后伤口无明显感染以及化脓情况出现。2)木瓜总三萜水凝胶对皮肤损伤模型大鼠创面的影响术后第3天,木瓜总三萜水凝胶组和疤痕灵阳性药组创面渗出液明显减少,创面均被血痂皮覆盖,伤口开始收缩变小,伤口周围干燥,肿胀范围小,并且随着时间的延长,各组伤口创面减少速度明显快于空白水凝胶组,而木瓜总三萜水凝胶(1.2、2.4和3.6g/kg)组促进伤口愈合效果更明显,随着木瓜总三萜水凝胶(1.2和2.4g/kg)剂量的增加,其疗效愈加明显;但当木瓜总三萜水凝胶剂量增加为3.6g/kg时,疗效并没有显著增加,与空白水凝胶组和疤痕灵组比较均具有显著性差异(p<0.05或p<0.01)。在手术后第9天,木瓜总三萜水凝胶2.4g/kg组伤口达到愈合标准,其余组未达到愈合标准。在手术后第28天,各组创面均已愈合,木瓜总三萜水凝胶(1.2、2.4和3.6g/kg)组创面与周边皮肤差别不明显,无明显瘢痕凸起,伤口愈合区域有大量新生毛发长出;其他组伤口周缘清晰,可见瘢痕组织形成,无明显毛发生长,其中以木瓜总三萜水凝胶2.4g/kg组的疗效最为显著(见图12)。以上结果表明,木瓜总三萜水凝胶能给创面保湿,在创面形成保护层,防止皮肤缺损部位与外界的大面积接触,减少创面感染的机率,创造创面愈合更好的条件以促进皮肤创面愈合、缩短伤口愈合时间,促进受损皮肤再生修复、减少瘢痕生成。3)木瓜总三萜水凝胶对皮肤损伤模型大鼠创面愈合时间的影响每天观察各组伤口愈合情况,每隔三天伤口拍照。拍照后用imagej软件图像分析软件进行残余伤口面积计算,以愈合创面面积>90%为愈合标准。结果显示,空白水凝胶组创面愈合的平均天数为17.94±0.90天;疤痕灵组创面愈合的平均天数为15.76±0.84;木瓜总三萜水凝胶(1.2、2.4和3.6g/kg)组创面愈合的平均天数分别为16.56±0.77、8.91±0.61和8.98±0.94天,随着木瓜总三萜水凝胶(1.2和2.4g/kg)剂量的增加,其促进皮肤损伤大鼠创面愈合时间显著缩短,但当木瓜总三萜水凝胶剂量增加为3.6g/kg时,其促进皮肤损伤大鼠创面愈合时间并没有明显缩短,与空白水凝胶组和疤痕灵组比较均具有显著性差异(p<0.05或p<0.01)。实验结果表明木瓜总三萜水凝胶能缩短创面愈合天数(见图13)。4)木瓜总三萜水凝胶对皮肤损伤模型大鼠创面愈合速率的影响木瓜总三萜水凝胶(1.2、2.4和3.6g/kg)组在手术后3、7、11天伤口创面面积均有不同程度减小,随着木瓜总三萜水凝胶(1.2和2.4g/kg)剂量的增加,其促进皮肤损伤大鼠创面愈合速率明显增加,但当木瓜总三萜水凝胶剂量增加为3.6g/kg时,其促进皮肤损伤大鼠创面愈合速率没有明显增加,与空白水凝胶组和疤痕灵组比较均具有显著性差异(p<0.05或p<0.01)。实验结果表明,木瓜总三萜水凝胶能提高大鼠创面愈合速率,使创面愈合时间缩短(见图14)。5)木瓜总三萜水凝胶对皮肤损伤模型大鼠皮肤病理形态的影响术后第3天he染色分析:各组创面均有大量的肉芽组织形成并向伤口内生长,创面区域可见大量的毛细血管生成,大量的巨噬细胞和中性粒细胞浸润,胶原纤维生成,但尚无完整表皮覆盖创面,木瓜总三萜水凝胶组炎性反应相对于其他组轻,毛细血管及胶原纤维生成较空白水凝胶组和疤痕灵组多。随着木瓜总三萜水凝胶(1.2和2.4g/kg)剂量的增加,其对皮肤损伤大鼠皮肤病理形态学的改善效果愈加明显,但当木瓜总三萜水凝胶剂量增加为3.6g/kg时,其对皮肤损伤大鼠皮肤病理形态学的改善效果并没有明显愈加。术后第11天he染色分析:各组肉芽组织较术后第3天更加致密,空白水凝胶组创面仍可见炎性细胞浸润,胶原纤维排列紊乱;疤痕灵组组创面炎性细胞浸润较其他组减少,胶原纤维相对杂乱,肉芽组织向瘢痕组织转变;木瓜总三萜水凝胶组创面有完整的表皮覆盖创面,创面有少量炎性细胞,胶原纤维排列更加整齐、规则。随着木瓜总三萜水凝胶(1.2和2.4g/kg)剂量的增加,其对皮肤损伤大鼠皮肤病理形态学的改善效果愈加明显,但当木瓜总三萜水凝胶剂量增加为3.6g/kg时,其对皮肤损伤大鼠皮肤病理形态学的改善效果并没有明显愈加。术后第21天he染色分析:各组创面均有完整的表皮覆盖创面,增厚的再生表皮与真皮层有明显的界限,胶原纤维较之前排列整齐,炎症细胞不明显,未见明显新生皮脂腺形成;但是木瓜总三萜水凝胶组创面再生表皮形态更接近正常的表皮,有新生的毛囊形成,其数量和密度较正常皮肤低。由此表明,木瓜总三萜水凝胶可以减轻伤口的炎症反应,促进肉芽组织的生成,毛细血管的生成,促进受损皮肤再生修复、减少瘢痕生成。随着木瓜总三萜水凝胶(1.2和2.4g/kg)剂量的增加,其对皮肤损伤大鼠皮肤病理形态学的改善效果愈加明显,但当木瓜总三萜水凝胶剂量增加为3.6g/kg时,其对皮肤损伤大鼠皮肤病理形态学的改善效果并没有明显愈加(见图15)。试验结论由木瓜总三萜水凝胶对手术切割致大鼠皮肤损伤影响实验可知,木瓜总三萜水凝胶可显著缩短创面愈合时间、提高创面愈合速率,减轻伤口的炎症反应,促进肉芽组织的生成,毛细血管的生成,促进受损皮肤再生修复、减少瘢痕生成。实验例5下面结合具体的实验例,具体说明本发明实施例1得到的木瓜总三萜水凝胶对皮肤外伤患者的皮肤损伤具有明显的治疗作用。试验方法1)临床资料本组82例患者均来自三峡大学中医临床医学院,其中男40例,女40例,年龄为,l6~57岁,平均年龄为36岁;所有患者均在伤后15min~2h就诊。创伤部位:上臂创伤者13例,前臂创伤者26例,小腿创伤者28例,大腿创伤者14例,均为皮下组织以上的小面积浅层皮肤组织缺损;创面面积为1.5cm×5.0cm~5.0cm×13.0cm。2)方法(1)分组方法将82例患者按照随机数表法分为木瓜总三萜水凝胶组和疤痕灵膏组;木瓜总三萜水凝胶组41例,疤痕灵膏组41例,分别采取相应疗法治疗。(2)治疗方法入院后所有患者均进行一期清创,清除创面坏死、污染的组织,然后用生理盐水冲洗创面后再用无菌干纱布蘸干水分,并探查创面深度及周围组织受损情况。清创后根据创面情况采用不同方法治疗。木瓜总三萜水凝胶组和疤痕灵组分别在创面外涂木瓜总三萜水凝胶和疤痕灵,厚度约1.0mm,暴露创面,每日换药2次,直至创面愈合。换药前将,原有药物及液化物蘸净后再涂新的药膏,换药时遵循创面不疼痛、不出血、不损伤正常组织的“三不原则”。(3)疗效评价观察指标:观察两组患者创面愈合时问及创面感染情况,并于随访8~21个月后观察瘢痕增生情况。疗效判定标准:优:创面完全愈合,临床症状完全消失;良:创面愈合面积>50%,临床症状完全消失;可:创面愈合面积为20%~50%,渗出物减少,临床症状改善;差:创面无变化或扩大,临床症状未见改善。(6)统计学分析实验结果用均数±标准差(±s)表示,数据分析在spss21.0统计软件包上进行,以单因素方差分析进行多组间差异比较,以dunnett-t检验比较两组间差异;p<0.05认为有统计学差异。试验结果1)两组患者临床疗效比较木瓜总三萜水凝胶组患者创面疗效优良率为92.68%,没有疗效差的患者出现;疤痕灵组患者创面疗效优良率为70.73%,有3例疗效差的患者出现。木瓜总三萜水凝胶组优良率明显优于疤痕灵组,与疤痕灵组比较具有显著性差异(p<0.01)(见表1)。表1两组患者临床疗效比较与疤痕灵组比较:*p<0.05,**p<0.01.2)两组患者创面愈合时间比较木瓜总三萜水凝胶组患者的创面平均愈合时间为11.10±1.13d,疤痕灵组患者的创面平均愈合时间为15.62±1.34d。木瓜总三萜水凝胶组平均愈合时间明显短于疤痕灵组,与疤痕灵组比较具有显著性差异(p<0.01)(见表2)。表2两组患者临床疗效比较组别病例数(n)愈合时间(天)平均愈合时间(天)感染病例数(n)木瓜总三萜水凝胶组419~1311.10±1.13**0疤痕灵组4113~1715.62±1.343与疤痕灵组比较:*p<0.05,**p<0.01.3)两组患者创面感染情况比较疤痕灵治疗组有3例患者出现了不同程度感染,木瓜总三萜水凝胶治疗组患者的创面无感染情况出现,与疤痕灵组比较具有显著性差异(p<0.01)(见表2)。试验结论木瓜总三萜水凝胶可有效促进创面表皮愈合速度,皮肤组织弹性升高,减少瘢痕生成,提高创面愈合质量。综上所述,木瓜总三萜水凝胶对皮肤细胞损伤具有较好的促进增殖、抑制细胞凋亡和促进细胞迁移作用;对动物皮肤损伤模型及皮肤外伤患者可显著促进皮肤创面愈合、缩短伤口愈合时间,促进受损皮肤再生修复、减少瘢痕生成。与当前的临床上使用的治疗皮肤损伤的药物相比,具有效果好,但毒副作用小、天然无刺激的优势。上述实施例和实验例对本发明对本发明做了具体说明。任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以上实施例所做的任何简单修改或等同变化,均落在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1