一种普瑞巴林缓释制剂的制作方法
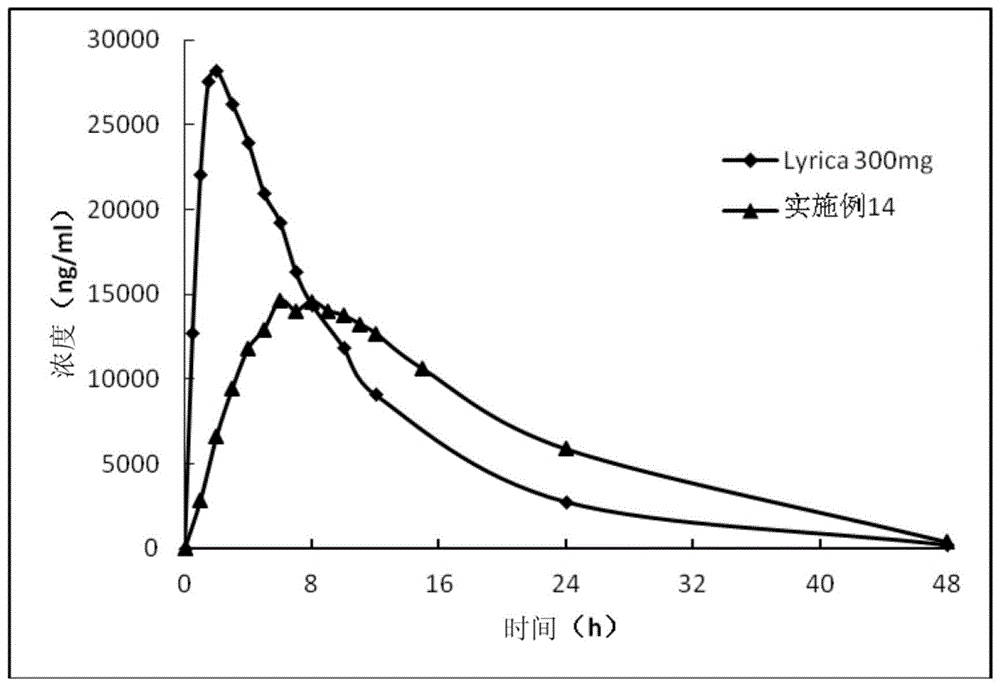
本申请是申请号为201580008159.0,申请日为2015年9月24日,发明名称为“一种普瑞巴林缓释制剂”的中国专利申请的分案申请。本发明属于药物制剂领域,具体涉及一种普瑞巴林缓释制剂,它为病人提供了时间和空间上控释的药物,以得到有效的治疗效果。
背景技术:
:普瑞巴林(pregabalin),化学名称为(s)-(+)-3-氨甲基-5-甲基己酸,是一种新型钙离子通道调节剂(非γ-丁酸(gaba)受体激动剂或拮抗剂),能阻断电压依赖性钙通道,减少神经递质的释放,临床主要用于治疗外周神经痛以及辅助性治疗局限性部分癫痫发作。目前上市的普瑞巴林剂型为速释剂型(ir),多为片剂和胶囊剂,规格有25,50,75,100,150,200和300mg/粒(或片),服用方法为每日2-3次。开发成每日一次的缓释制剂可改善患者的服药依从性,降低或防止出现与剂量有关的不良反应(通过降低峰血药浓度cmax),并提高疗效(通过增加有效血药浓度维持的时间)。然而,在开发每日给药一次的普瑞巴林剂型时存在一些问题。因为普瑞巴林是通过l-氨基酸输送系统进行吸收,其并不显示均匀的胃肠道吸收。临床研究表明,普瑞巴林在小肠和升结肠吸收良好,但是超过结肠肝曲以后,其吸收非常差。这表示普瑞巴林的平均吸收窗为6小时或更短,如果开发成普通缓释制剂,当其约6小时后转移至结肠肝曲,这些药物将被浪费,不能发挥任何作用。很显然,对于这样有吸收窗药物,应当设计出不仅能以控制的速率释放药物,并且能在很长的时间让药物保持在胃肠道上部的有效的缓释制剂。天然化合物以其良好的生物相容性和生物可降解性越来越受到人们的重视,应用于医药卫生制品到食品添加剂的各个领域。海藻酸是存在于褐藻或细菌中的一种天然高分子,由β-d-甘露醇醛酸和α-l-古洛糖醛酸组成,我国天然海洋资源丰富,海藻酸盐的产量居于世界前列,其所具有的羧基使其能够相应不同的化学微环境,广泛用于药物科学领域。海藻酸盐能在ph值较低时(即胃液环境下)形成凝胶层,利用海藻酸盐这种溶胀胶凝的特性,可以延长药物在胃中的滞留时间,从而增大某些药物的吸收窗,提高药物生物利用度。水溶性海藻酸盐与钙盐同时存在于片剂中,口服后遇胃液可以迅速形成具有良好强度的酸不溶性海藻酸钙的凝胶骨架,其中所含药物缓慢释放。同时,胃滞留型给药系统通过将药物滞留在胃中,也可以延长其在整个胃肠道的转运时间,从而改善某些药物的生物利用度。专利cn101330907a公开了一种用于每日口服一次的含普瑞巴林、基质形成剂和溶胀剂的缓释剂型,该剂型通过溶胀后尺寸变化引起胃滞留。但是,该制剂存在着一定的突释效应,不利于控制药物缓慢平稳的释放;且该制剂快速溶胀后的尺寸并未显著大于人体幽门的直径,根据患者各自的肠胃条件,不能排除穿过幽门的可能性,由此导致未能出现缓释模式。此外,还存在剂型的基质刚性在24小时后显著降低的缺点。专利cn103702664a涉及一种具有两相控释系统的普瑞巴林缓释片,但由于其制备过程使用了湿法制粒工艺,不易放大,放大后产品的一致性也存在着一定的风险。专利cn103585098a公开了一种含有普瑞巴林的控释制剂及其制备方法。然而,由于所述剂型不是胃滞留型,可能会产生其不仅在小肠上段(普瑞巴林的主要吸收部位)释放普瑞巴林,而且在其他部位(如小肠下段)释放普瑞巴林。技术实现要素:本发明的目的在于提供一种以海藻酸盐作为凝胶骨架的普瑞巴林缓释制剂,通过延长在胃中的滞留时间,从而实现药物更持久的释放和吸收,提高药物的生物利用度。本发明提供的缓释片包括活性药物成分和赋形剂。活性药物成分包括普瑞巴林或普瑞巴林的药学上可接受的配合物、盐、溶剂化物或水合物,赋形剂包括凝胶骨架材料和溶胀材料。凝胶骨架材料包括海藻酸盐,溶胀材料包括聚氧乙烯。用于本发明的海藻酸盐可以是海藻酸钠、海藻酸钾、海藻酸铵中的一种或多种混合,海藻酸盐的平均分子量可以是1×104至2×105,优选为7×104至15×104。基于缓释片的总重量,凝胶骨架材料的含量为约5%重量至45%重量,优选的是约20%重量至40%重量。对于经口服的固体剂型,凝胶骨架材料可提供结构完整性并有助于控制或延长药物释放的速率及其他功用。海藻酸盐能在ph值较低时(即胃液环境下)形成凝胶层,利用海藻酸盐这种溶胀胶凝的特性,可以延长药物在胃中的滞留时间,从而增大某些药物的吸收窗,提高药物生物利用度。溶胀材料可从胃液吸水,溶胀到其原始体积的数倍,从而由于尺寸排斥,导致缓释片的胃内滞留,且还可以通过形成亲水胶体而影响药物释放速率。溶胀材料可溶于水或不溶于水。基于缓释片的总重量,溶胀材料的含量为约10%至75%,优选30至60%,更优选35%至60%。本发明的溶胀材料包括聚氧化乙烯,也被称为聚环氧乙烷和聚氧乙烯。聚氧化乙烯的分子量可以是1×105至1×107,优选为1×106至1×107。在本发明一个优选的实施方案中,凝胶骨架材料除海藻酸盐外,还含有钙盐。水溶性海藻酸盐与钙离子作用,可以迅速形成具有良好凝胶强度的热不可逆凝胶基质。用于本发明的钙盐可以是磷酸氢钙,磷酸二氢钙,磷酸钙,硫酸氢钙,亚硫酸氢钙,硫酸钙,碳酸氢钙,碳酸钙,氯化钙中的一种或多种混合。在凝胶骨架材料中,海藻酸盐与钙盐的重量比是1:1到10:1,优选2:1至5:1。在本发明优选的实施方案中,凝胶骨架材料由海藻酸盐和钙盐组成。在本发明一个优选的实施方案中,溶胀材料除了聚氧化乙烯外,还可包括交联聚乙烯吡咯烷酮,也被称为交聚维酮。交联聚乙烯吡咯烷酮的分子量可以是约1×103至1×107,优选约1×104至1×105。当聚氧化乙烯与交联聚乙烯吡咯烷酮并用时,缓释制剂通常包含占总重约25%至55%的聚氧化乙烯,和5%至20%的交联聚乙烯吡咯烷酮,优选30%至50%重量的聚氧化乙烯和5%重量至10%的交联聚乙烯吡咯烷酮。本发明的缓释制剂可包含一种或多种润滑剂,有助于组分混合和压片。基于缓释制剂的总重量,润滑剂的含量为约0.5%重量至2%重量。滑剂包括滑石、硬脂酸镁、硬脂酸锌、;山嵛酸甘油酯、月桂基硫酸钠、氢化植物油、胶体二氧化硅等。本发明的缓释制剂可包括其它赋形剂,如稀释剂,其含量占缓释片重量的约0%至20%。在组分混合和压片期间,稀释剂可改善药物组合物的流动性且可增强片剂的压缩强度或硬度。稀释剂包括乳糖、甘露醇、淀粉、预胶化淀粉、微晶纤维素等。在本发明优选的实施方案中,所述的缓释制剂为片剂。根据本发明,将药物与凝胶骨架材料、溶胀材料、润滑剂及其他赋形剂干混来制备药物组合物,药物组合物被直接压成片剂。或者,为了改善产品的均一性,可分阶段合并并且混合组分。例如,药物可以首先与一种或多种凝胶骨架材料干混,而随后与其他赋形剂,诸如溶胀材料,稀释剂,润滑剂等,在一个或多个混合操作中混合。如果需要,在混合前,通过过筛或粉碎或两者,控制一种或多种组分的粒径。可用常规的包衣机对压制的片剂进行包衣。本发明的缓释制剂在进行体外溶出实验时,1小时内活性成分(即普瑞巴林)的释放量低于15%,4至8小时的释放量(累计溶出率)为50%至70%,,16小时的释放量(累计溶出率)超过80%。根据本发明的缓释片在口服时可以有效控制普瑞巴林的释放,同时显示出受控的且延长的释放曲线,不显示其原来的突然释放效应。本发明的缓释制剂一旦接触存在于人类的胃液中的水时,可以溶胀或膨胀至13mm或更大。并且,制剂在接触水后的形状及刚性均保持良好,由此显示出更为优异的胃滞留性。通过尺寸排斥法、进餐服药、睡前服药或是这些方法的组合可使缓释片滞留在胃内数小时。本发明的缓释片在患者胃内的滞留时间通常在约3小时至11小时,约6小时至14小时或约8小时至14小时,由此最大化普瑞巴林在小肠上段的吸收。本发明的缓释制剂,达到最高血药浓度的时间(tmax)可以是口服后的8至12小时。在本发明的缓释制剂中,普瑞巴林的释放受控于凝胶骨架材料和溶胀材料。通过改变凝胶骨架材料和溶胀材料的量来控制释放时间和胃滞留特性。因此,通过控制具有有限吸收窗的普瑞巴林释放基质,本发明的缓释制剂可以一日给药一次。附图说明图1显示了根据本发明(实施例14)制备的缓释片,与市售的胶囊速释片相比,平均血药浓度对时间所作的图。具体实施方式通过以下实施例和实验例进一步详细说明本发明。这些实施例和实验例仅用于说明性目的,而并不用于限制本发明的范围。实施例1至20根据表1至表3所示的成分和量来制备缓释片。表1至表3的量表示每一药片中每种成分的重量(mg)。对于各实施例,将除硬脂酸镁以外的所有片剂组分在物料混合器中混合约15分钟后,与过20目筛的硬脂酸镁继续混合5分钟以获得最终的共混物,随后用压片机压制成重量为1.125g或1克的药片。表1表2表3比较例1根据专利cn101330907a制备比较例。如表4所示,将普瑞巴林(300g)、kollidonsr(250g)、plasdonexl(280g)、polyoxn60knf(225g)和carbopol71g(56.5g)混合15分钟。将硬脂酸镁(11.5g)与上述混合物额外混合5分钟,随后进行压制以获得药片。表4实验例1:体外溶出试验根据中国药典2010版二部附录溶出度测定第二法(桨法),对实施例1至21及比较例1中制备的药片进行溶出试验。使用1000ml的0.06nhcl溶液作为溶出介质,并在37±0.5℃下以50rpm的桨速进行溶出试验。分别在0.5、1、2、4、8、12、16、20、24小时从溶出介质中取出小份试样。用hplc(在210nm)对每份试样进行检测,以计算溶出率。结果显示于表5至表7中。如5至表7所示,根据本发明制备的普瑞巴林制剂显示出优异的缓释溶出模式。通过调节缓释制剂的各组成及比例,制得的普瑞巴林缓释制剂1小时基本无突释效应,8小时溶出量为50%至70%,16小时的释放量超过80%。比较例1中制备的药片1小时累计溶出率约20%,显示出一定的突释效应,而根据本发明制备的片剂显著消弱了这种突释效应,使普瑞巴林以更加平缓的方式释药,增加了用药的安全性。表5表6表7实验例2:溶胀尺寸的测量根据中国药典2010版二部附录溶出度测定第二法(桨法),对上述实施例及比较例中制备的药片进行溶出试验。使用1000ml的0.06nhcl溶液作为溶出介质,并在37±0.5℃下以50rpm的桨速进行溶出试验。在开始溶出试验后的1、2、6、8、24小时从溶出介质中取出药品试样,并测量其尺寸。结果如表8和表9所示。根据本发明制备的药片1h膨胀后的剂型尺寸已达13mm以上(该“尺寸”对应于剂型的具有最小面积的横截面的最长线性尺寸),这种尺寸通过机械阻滞,可有效延缓该缓释片在胃部的停留时间。比较例1中制备的药片1h膨胀后的剂型尺寸仅为11.4mm,根据患者的胃肠条件,不能排除穿过幽门的可能性。表8时间(h)实施例1实施例7比较例1019.6×10.0×8.519.6×10.0×8.519.4×9.7×8.8122.5×13.0×11.523.4×13.7×12.420.5×11.4×9.9223.4×13.7×12.824.8×14.3×13.021.1×12.2×11.4625.0×14.6×14.325.9×14.8×14.422.7×13.3×12.5826.2×15.0×14.626.8×15.6×14.923.1×13.5×12.62426.9×15.8×15.327.6×16.2×15.623.7×14.0×12.8表9时间(h)实施例14实施例17实施例20019.6×10.0×8.519.5×10.3×7.819.5×10.3×7.9123.4×13.6×12.023.4×13.3×11.623.0×13.8×11.8223.8×14.5×13.024.3×13.7×13.024.2×13.5×13.0625.7×14.8×14.025.1×14.5×13.725.0×14.3×13.6826.4×15.3×14.525.8×14.8×14.025.9×14.6×13.92427.0×16.2×15.127.1×14.9×14.027.0×15.0×14.0实验例3:药片尺寸和含水量变化的比较根据中国药典2010版二部附录溶出度测定第二法(桨法),对实施例6、7和比较例1中制备的药片进行溶出试验。使用1000ml的0.06nhcl溶液作为溶出介质,并在37±0.5℃下以50rpm的桨速进行溶出试验。在开始溶出试验后的1、2、6、8、24小时从溶出介质中取出药品试样,测量其尺寸,并通过测量其含水量获得每一药片的重量变化。结果显示与表10中。如表10所示,相比于比较例1的药片,实施例1和7中制备的药片显示出在尺寸变化和含水量方面更优异的性质。这些结果表明,本发明的药片可以更有效的增长胃滞留时间,从而实现药物更持久的释放和吸收,提高药物的生物利用度。表10实验例4:药品刚性的比较根据中国药典2010版二部附录溶出度测定第二法(桨法),对实施例7和比较例1中制备的药片进行溶出试验。使用1000ml的0.06nhcl溶液作为溶出介质,并在37±0.5℃下以50rpm的桨速进行溶出试验。在开始溶出试验后的1、2、6、8、24小时从溶出介质中取出药品试样,并在以下设定条件下使用ta-plus质构仪测定其刚性:5kg负载单元;p/0.5圆柱形探头;1.0g触发力;1.0毫米/秒测试速度;15毫米距离。结果显示于表11中。如表11所示,相比于比较例1中的药片,根据本发明制备的药片(实施例1和实施例7)刚性更为优良,溶胀8h及24h后仍显示出良好的刚性。其优异的刚性,显示了其良好的胃滞留特性,同时有效控制药物释放。表11实验例5:根据桨速的溶出率的测量根据中国药典2010版二部附录溶出度测定第二法(桨法),对实施例1、7和比较例1中制备的药片进行溶出试验。使用1000ml的0.06nhcl溶液作为溶出介质,并在37±0.5℃下以50rpm和100rpm的桨速进行溶出试验。分别在0.5、1、2、4和8小时从溶出介质中取出小份试样。用hplc(在210nm)对每份试样进行检测,以计算溶出率。结果显示于表12中。表12在50rpm和200rpm下的溶出率如表12所示,当桨速提高时,实施例1和实施例7的药片显示出比较小的溶出率差异。相比之下,当桨速提高时,比较例1的药片的溶出率,尤其是初始溶出率显著增大。这些结果表明,本发明的药片受到桨板旋转速度的影响更小;由此,本发明的药片受胃肠动力的影响更小,从而使个体差异最小化。实验例6:药代动力学研究使用比格犬对实施例14中制备的药品进行药代动力学研究。使用市售胶囊300mg(辉瑞制药有限公司)作为参比制剂。采用液相色谱-串联质谱法测定血浆中普瑞巴林的浓度。血药浓度曲线如图1所示;药动学参数如表13所示。表13与参比制剂的速释片相比,实施例14的缓释片显示出延迟的吸收。实施例14中原形药物普瑞巴林在犬体内的血浆浓度平均达峰时间tmax为10.5h,明显晚于参比制剂给药组(1.9h),峰浓度cmax约为参比制剂给药后的60%,相对生物利用度为99.2%。由于普瑞巴林是在小肠上段吸收,本发明的缓释片可以在胃中停留更长的时间,同时有效的控制普瑞巴林的释放。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1