一种杨梅素解毒剂及其制备方法和应用与流程
本发明属于医药技术领域,涉及一种以天然化合物为主要成分的解毒剂,具体是一种杨梅素解毒剂及其制备方法和应用。
背景技术:
药物引起的肝毒性和肾脏毒性是指服用药物后药物或其代谢物对肝脏和肾脏造成的损害。肝肾毒性是肿瘤患者服用化疗药物后最常见的副作用,是药物疗效发挥的主要阻碍因素。
常见的引起肝脏毒性的药物有甲氨喋呤,氟尿嘧啶,环磷酰胺等。这些药物造成的肝损伤的临床表现为:肝脏纤维化,肝细胞损害或者坏死,患者体内的血清转氨酶升高。常见的引起肾脏毒性的药物有顺铂,丝裂霉素,亚硝脲类药物等。这些药物造成的肝损伤的临床表现为:肾衰竭,高尿酸血症,肾小管损伤,蛋白尿,肾小球系膜损害。临床上虽然有很多针对抗癌药物解毒的药物,但是这些药物往往是出现毒害后的补救措施,很多不能完全逆转造成的损害,使用时,也必须停止抗癌药物的使用,使治疗效果大打折扣。
杨梅素,又名杨梅树皮素、杨梅黄酮,为3,5,7,3’,4’,5’-六羟基黄酮,广泛存在于杨梅科、葡萄科、豆科等天然植物中医学研究表明,杨梅素具有降血脂、抗肿瘤、抗炎、利胆、抗氧化等作用。然而杨梅素不稳定,口服吸收利用率低,成药难。
前期的体内研究结果表明,杨梅素乳液能有效预防和逆转常见抗癌药物引起的肝脏和肾脏的损伤,其稳定性良好。但杨梅素乳液起到肝肾毒性保护组建偶用的机制尚不清楚,目前尚无特性优良的肝肾毒性保护剂。杨梅素乳液作为一种成本低廉,毒性小,获取容易的化合物,使用它对抗化疗药物引起的肝肾毒性是一种新颖治疗方式。
技术实现要素:
本发明的目的在于提供一种杨梅素解毒剂,通过将杨梅素与注射用卵磷脂、注射用大豆油、亚硫酸钠、甘油和吐温进行配比混合,得到杨梅素乳液制剂,解决了现有的杨梅素不稳定,口服吸收利用率低,成药难的问题。
为解决上述技术问题,本发明是通过以下技术方案实现的:
本发明为一种杨梅素解毒剂,该杨梅素解毒剂的组成为:杨梅素0.8%-8%、注射用卵磷脂1%-3%、注射用大豆油5%-35%、亚硫酸钠0.1%-0.3%、甘油15%-20%、吐温-805%-9%和注射用水,加至100%质量配比。
进一步地,所述杨梅素的含量为:1-5%。
进一步地,其制备方法包括如下步骤:(1)油相的制备:分别向注射用大豆油中加入注射用卵磷脂、吐温-80,搅拌使其溶解,作为油相;(2)初乳的制备:将杨梅素以及亚硫酸钠加入水中,搅拌使之溶解,再将(1)中制备的油相加入水中,高速剪切分散,形成初乳;(3)高压匀化:调节步骤(2)制得初乳的ph为7.0-7.5,高压匀化,得精乳;(4)无菌过滤:精乳经0.22μm微孔滤膜过滤除菌,无菌灌装,再经冷冻干燥,即得。
进一步地,所述初乳的ph为7.2。
进一步地,所述高速剪切分散所采用的转速为15000/min,分散时间为30min。
进一步地,其应用于制备治疗抗癌药物肝肾毒性的解毒药物。
本发明的杨梅素解毒剂主要是应用于易于引起肝毒性和肾毒性化疗药物的解救。本发明的发明人团队前期针对杨梅素乳液对常见化疗药物引起的肾脏和肝脏毒性的保护作用开展了相关的研究,也对杨梅素乳液的稳定性进行了考察。结果表明:杨梅素乳液能有效缓解化疗药物引起的肝脏和肾脏的毒性,且杨梅素乳液的稳定性良好。实验过程如下:
1实验材料
1.1动物
雄性balb/c小鼠110只,6~7周龄,清洁级,体重(20±5)g,安徽医科大学实验动物中心。饲养于温度22~24℃、湿度40%~60%的屏障环境,饲养期间动物自由摄食饮水,照明条件为12小时明/12小时暗。
1.2药物
杨梅素,宝鸡市辰光生物科技有限公司(myricetin:cas:529-44-2;分子量:318.237;分子式:c15h10o8);注射用甲氨喋呤,注射用环磷酰胺(肝毒性造模药物,购自于辉瑞制药有限公司);注射用顺铂,丝裂霉素(肾毒性造模药物,购自于浙江海正药业)。
1.3主要试剂与仪器
天冬氨酸氨基转移酶(ast)、丙氨酸氨基转移酶(alt),南京建成生物工程研究所;尿素氮(bun)检测试剂盒,上海沪震实业有限公司。肌酐(cre)检测试剂盒,上海纪宁实业有限公司。小鼠四型胶原(iv-c)elisa检测试剂盒,上海将来实业股份有限公司。组织匀浆机(上海测博,型号cs-10);酶标仪(型号:hbs-1096c,南京德铁实验设备有限公司);分析天平(梅特勒托利多,型号:gl4857);高速冷冻离心机(型号:kh20r,湖南凯达科学仪器有限公司)。
2实验方法
2.1分组和给药
适应性饲养3d后,110只小鼠按体重量随机分为正常组、肝毒模型组1(甲氨喋呤20mg/kg)、肝毒模型组2(环磷酰胺40mg/kg),肾毒模型组3(顺铂25mg/kg)、肾毒模型组4(丝裂霉素40mg/kg)和杨梅素干预组1、2、3、4组(5%杨梅素乳液,剂量20mlmg/kg),每组10只。
各组小鼠均灌胃给药,正常组和模型组给予等量生理盐水。给药体积为0.02ml/g,每日1次,连续7d。另设杨梅素直接给药组1和2(杨梅素5%水溶液,剂量20mlmg/kg),于肝毒性和肾毒性造模实验中分别给予相同剂量的甲氨喋呤和顺铂(每组10只动物)。
2.2造模
小鼠每日上午,除正常组外,其他各组小鼠尾静脉注射给予上述药物制备肝损伤和肾损伤模型,正常组给予等量生理盐水,杨梅素干预组1,2分别给予甲氨喋呤和环磷酰胺的1小时后,尾静脉注射给予杨梅素乳液,杨梅素干预组3,4分别给予顺铂和丝裂霉素的1小时后,尾静脉注射给予杨梅素乳液,各组连续给药7天,第7日给药后禁食不禁水,3h后称重,采集血液、肝脏、肾脏进行相关检测。其中杨梅素直接给药1,2组于肝毒性和肾毒性造模实验中分别给予相同剂量的甲氨喋呤和顺铂后,尾静脉注射给予杨梅素水溶液。
2.3指标测定
2.3.1生化指标检测
小鼠麻醉状态下摘眼球取血,4500r/min离心15min,分离血清,按试剂盒说明书测定血清alt、ast,cre和bun含量。剪下小鼠肝右叶相同部位组织,4℃生理盐水制备成15%肝匀浆,3500r/min离心20min,取上清液,按照试剂盒说明书测定肝组织iv型胶原(iv-c)含量。
3统计学方法
采用spss17.0统计软件进行分析。计量资料以x±s表示,组间比较用方差分析。p<0.05表示差异有统计学意义。
4结果
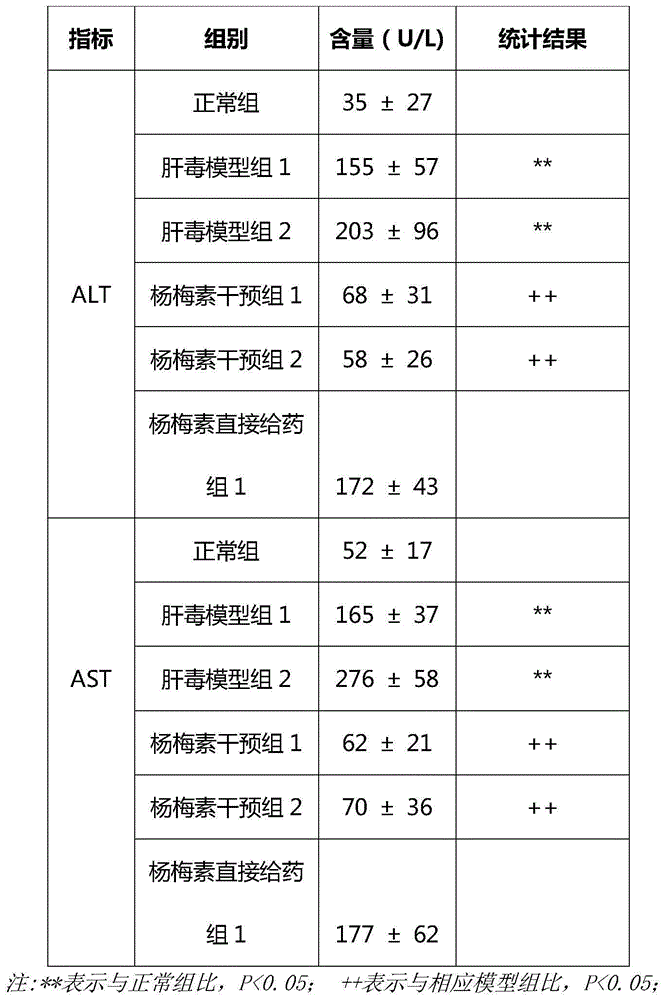
4.1杨梅素对模型小鼠血清丙氨酸氨基转移酶、天冬氨酸氨基转移酶的影响
图1显示,与正常组比较,各模型组小鼠血清alt、ast含量显著升高(p<0.01),与模型组比较,杨梅素干预组能显著降低alt、ast含量(p<0.01)。见下表1。说明杨梅素乳液具有护肝作用。其中杨梅素直接给药组的指标和模型组比没有显著差异,说明杨梅素直接给药组无效。
4.2杨梅素对模型小鼠血清肌酐(cre)和尿素氮(bun)的影响
图2显示,与正常组比较,各模型组小鼠血清cre、bun含量显著升高(p<0.01),与模型组比较,杨梅素干预组能显著降低cre、bun含量(p<0.01)。见下表2。说明杨梅素乳液具有保肾作用。其中杨梅素直接给药组的指标和模型组比没有显著差异,说明杨梅素直接给药组无效。
4.3杨梅素对模型肝脏中iv型胶原含量的影响
图3显示,与正常组比较,各模型组小鼠肝脏中4型胶原含量显著升高(p<0.01),与模型组比较,杨梅素干预组能显著降低肝脏中4型胶原含量(p<0.01)。见下表3。说明杨梅素乳液能逆转药物引起的纤维化,具有护肝作用。
4.4杨梅素乳液的稳定性
图4显示,杨梅素乳液的稳定性良好,放置两个月后杨梅素含量仅下降0.1%。
本发明涉及的药物是基于上述实验进行开发,相对于现有技术,本发明具有如下有益效果:
1、本发明选用杨梅素作为主要成分,成本低廉,毒性小,能有效缓解使用上述抗癌药物后引起的肝脏和肾脏毒性。
2、本发明的杨梅素解毒剂由于采用了特定的组分或特定制备方法,获得的药物为注射液剂型,具有良好的化学稳定性、药效佳。
当然,实施本发明的任一产品并不一定需要同时达到以上所述的所有优点。
附图说明:
图1是杨梅素乳液对模型小鼠血清丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)的影响结果的统计图;
图2是杨梅素乳液对模型小鼠血清肌酐(cre)和尿素氮(bun)的影响结果的统计图;
图3是杨梅素乳液对模型小鼠肝组织型iv型胶原(iv-c)含量的影响结果的统计图;
图4是杨梅素乳液中杨梅素含量变化的统计图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1:
采用如下配比的组分制备本发明的杨梅素解毒剂:杨梅素3%,注射用卵磷脂3%,注射用大豆油5%,亚硫酸钠0.1%,甘油20%,吐温-809%,注射用水加至100%质量配比;
(1)油相的制备:分别向注射用大豆油中加入注射用卵磷脂、吐温-80,搅拌使其溶解,作为油相;
(2)初乳的制备:将杨梅素以及亚硫酸钠加入水中,搅拌使之溶解,再将(1)中制备的油相加入水中,高速剪切分散(转速:15000/min、分散时间:30min),形成初乳;
(3)高压匀化:调节步骤(2)制得初乳的ph7.2,高压匀化,得精乳;
(4)无菌过滤:精乳经0.22μm微孔滤膜过滤除菌,无菌灌装,再经冷冻干燥,即得。
实施例2:
采用如下配比的组分制备本发明的杨梅素解毒剂:杨梅素1%,注射用卵磷脂1%,注射用大豆油35%,亚硫酸钠0.2%,甘油15%,吐温-805%,注射用水加至100%质量配比;
(1)油相的制备:分别向注射用大豆油中加入注射用卵磷脂、吐温-80,搅拌使其溶解,作为油相;
(2)初乳的制备:将杨梅素以及亚硫酸钠加入水中,搅拌使之溶解,再将(1)中制备的油相加入水中,高速剪切分散(转速:15000/min、分散时间:30min),形成初乳;
(3)高压匀化:调节步骤(2)制得初乳的ph为7.2,高压匀化,得精乳;
(4)无菌过滤:精乳经0.22μm微孔滤膜过滤除菌,无菌灌装,再经冷冻干燥,即得。
实施例3:
采用如下配比的组分制备本发明的杨梅素解毒剂:杨梅素2%,注射用卵磷脂2%,注射用大豆油25%,亚硫酸钠0.3%,甘油18%,吐温-806%,注射用水加至100%质量配比;
(1)油相的制备:分别向注射用大豆油中加入注射用卵磷脂、吐温-80,搅拌使其溶解,作为油相;
(2)初乳的制备:将杨梅素以及亚硫酸钠加入水中,搅拌使之溶解,再将(1)中制备的油相加入水中,高速剪切分散(转速:15000/min、分散时间:30min),形成初乳;
(3)高压匀化:调节步骤(2)制得初乳的ph为7.0,高压匀化,得精乳;
(4)无菌过滤:精乳经0.22μm微孔滤膜过滤除菌,无菌灌装,再经冷冻干燥,即得。
实施例4:
采用如下配比的组分制备本发明的杨梅素解毒剂:杨梅素5%,注射用卵磷脂2.5%,注射用大豆油15%,亚硫酸钠0.3%,甘油20%,吐温-808%,注射用水加至100%质量配比;
(1)油相的制备:分别向注射用大豆油中加入注射用卵磷脂、吐温-80,搅拌使其溶解,作为油相;
(2)初乳的制备:将杨梅素以及亚硫酸钠加入水中,搅拌使之溶解,再将(1)中制备的油相加入水中,高速剪切分散(转速:15000/min、分散时间:30min),形成初乳;
(3)高压匀化:调节步骤(2)制得初乳的ph为7.3,高压匀化,得精乳;
(4)无菌过滤:精乳经0.22μm微孔滤膜过滤除菌,无菌灌装,再经冷冻干燥,即得。
实施例5:
采用如下配比的组分制备本发明的杨梅素解毒剂:杨梅素6%,注射用卵磷脂3%,注射用大豆油20%,亚硫酸钠0.1%,甘油15%,吐温-807%,注射用水加至100%质量配比;
(1)油相的制备:分别向注射用大豆油中加入注射用卵磷脂、吐温-80,搅拌使其溶解,作为油相;
(2)初乳的制备:将杨梅素以及亚硫酸钠加入水中,搅拌使之溶解,再将(1)中制备的油相加入水中,高速剪切分散(转速:15000/min、分散时间:30min),形成初乳;
(3)高压匀化:调节步骤(2)制得初乳的ph为7.5,高压匀化,得精乳;
(4)无菌过滤:精乳经0.22μm微孔滤膜过滤除菌,无菌灌装,再经冷冻干燥,即得。
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 还没有人留言评论。精彩留言会获得点赞!