一种用于肺动脉高压治疗的联合递送系统及其制备方法与流程
本发明属于药物制剂领域,特别涉及一种用于肺动脉高压治疗的抗炎纳米晶/生物药物复合物的处方构成与制备方法。
背景技术:
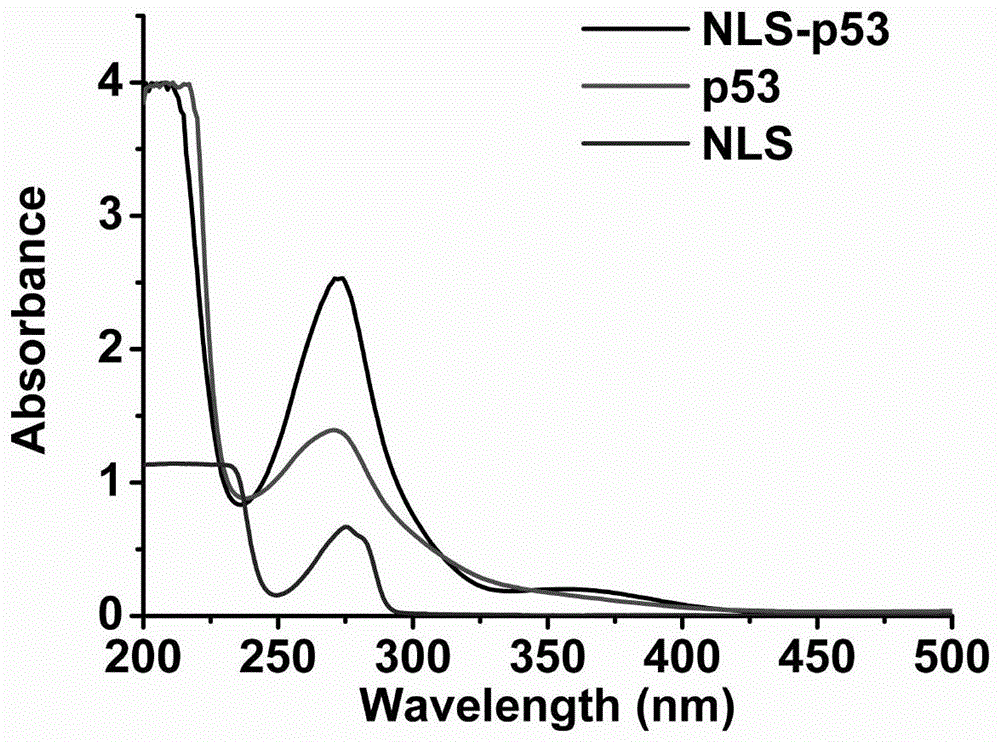
:肺动脉高压(pulmonaryarterialhypertension,pah)是一种肺血管血液动力学异常的高度炎症型疾病,被喻为心血管疾病中的“癌症”。肺动脉血管的重构是pah的重要病理基础,主要由肺血管平滑肌细胞(smcs)的过快增殖与肺血管上皮细胞层的间叶化等引起。显然,抑制炎症反应与促进smcs凋亡是治疗pah的潜在有效策略。因此,联合递送抗炎药物与促凋亡剂有望治疗pah。已公开专利(cn201710659662.3a)提供了一种抗肿瘤紫杉醇纳米晶递送基因药物的基因递送体系,主要涉及利用紫杉醇纳米晶实现基因药物let-7a的递送,治疗肿瘤。同时该体系无外层材料的包裹,缺乏稳定性与细胞特异性,无法有效靶向病灶;并且带明显正电荷,对机体有潜在毒性。已公开专利(cn201810364308.2a)虽然提及了利用黄芩素纳米晶递送mirna,该专利依然未解决专利(cn201710659662.3a)存在的问题,且在所有实施例均采用了mir105,也未提及任何治疗功效。本发明专利在处方构成、治疗功效等方面与公开专利明显不同。核酸递送目前主要存在以下几个问题:1)核酸的巨大的分子量和负电荷使得其难以透过生物膜;2)核酸容易被血浆和组织中的核酸酶降解,被肝脏和肾脏快速清除;3)普通载体进行胞内递送时,往往会进入内涵体-溶酶体系统,导致绝大多数核酸被降解,有文献报道称只有1-2%的核酸能实现内涵体-溶酶体逃逸(nat.biotechnol.2013,31,638),胞内递送效率极低。技术实现要素:本发明的目的之一在于构建一种用于pah治疗的药物共递送体系。本发明将阳离子化材料与抗炎药物纳米晶用于生物药物或大分子药物递送。本发明的目的之二在于阐述抗炎药物纳米晶在生物药物或大分子药物中递送的作用,在核靶向多肽(nls)的作用下,将生物药物pdna如p53、基因编辑系统等递送至细胞核。其中核靶向多肽包括但不局限于simianvirus40(sv40)(genbank登录号为j02400.1),pep-7(sdlwemmmvslacqy,见seqidno.1),pvec(lliilrrrirkqahahsk,见seqidno.2),八肽nls(cpkkkrkv,见seqidno.3)以及13肽nls(cgggpkkkrkved,见seqidno.4)。将通过具体的抗炎药物如黄芩素纳米晶,生物药物p53、anti-mir138/155、caspase3等,靶向材料葡萄糖醛酸等具体阐述本发明,但并不因此将发明限制在所列举实施例中。技术方案一种用于肺动脉高压治疗的联合递送系统,其特征在于其包括黄芩素纳米晶、生物药物复合物或大分子药物、葡萄糖醛酸。所述的递送系统,其特征在于生物药物或大分子药物包括质粒dna,基因编辑系统,rna,活性蛋白。所述的递送系统,其特征在于:生物药物或大分子药物包括p53,anti-mir138/155,caspase-3。所述的所述的递送系统,其特征在于:所述的生物药物复合物为有核靶向多肽修饰形成的核靶向-生物药复合物。所述的递送系统,其特征在于所述核靶向多肽包括simianvirus40,pep-7,pvec,nls以及nls。所述的递送系统,其特征在于:黄芩素纳米晶与生物药物质量比为2:1~32:1;黄芩素纳米晶/生物药物/葡萄糖醛酸质量比为32:1:0,32:1:1,32:1:2,32:1:4,32:1:8。具体制备方法如下:1)以β-乳球蛋白(β-lg)为例,采用酰化反应合成纳米晶稳定剂(clg)将300mgβ-lg溶解于2ml蒸馏水中,加入250ml乙二胺溶液(ph4.75),混合后,加入70mgedc,搅拌2h。之后加入200μl醋酸盐缓冲液(ph4.75)中止反应。将反应液转移至透析袋中,聚乙二醇20000溶液中透析四小时后,转移至蒸馏水中透析3天,将溶液冻干,得clg。采用超声沉淀法制备黄芩素纳米晶。2)nls-p53的合成。将6-(马来酰亚胺基)己酸琥珀酰亚胺酯10mg溶解于10ml二氯甲烷中,避光搅拌溶解,将2-(4-氨基苯)乙胺5mg加入其中反应24h,反应两天后旋干。在所得产物中加入30mg亚硝酸钠与4ml0.5m盐酸,冰水浴反应2h,之后向其中加入2μgp53,与10ml硼酸缓冲液,反应12h后,加入2mgnls(氨基酸序列为nh2-pkkkrkvedpyc),继续反应12h。全程避光反应。反应结束后超滤离心取上清,转速为3000rpm/10min,超滤管截留分子量为3500。硼酸盐缓冲液配制方法:6.18g硼酸加入980ml水溶解后,用氢氧化钠调节ph至9.0,补加水至1000ml。3)黄芩素纳米晶/nls-p53复合物的制备。在超净台中,用无菌无酶水将nls-p53稀释到不同浓度,使得clg与nls-p53质量比为2:1~32:1,二者等体积混匀孵育,室温孵育30min后得到黄芩素纳米晶/nls-p53复合物。4)葡萄糖醛酸(ga)包裹的黄芩素纳米晶/nls-p53复合物的制备。将clg/nls-p53/ga按照一定质量比混合,室温孵育30min后,得到ga包裹的抗炎药物纳米晶与nls-p53复合物。黄芩素纳米晶/anti-mir138或anti-mir155复合物的制备。在超净台中,用无菌无酶水将anti-mir138稀释到不同浓度,使得clg与anti-mir138质量比为4:1~64:1,二者等体积混匀孵育,室温孵育30min后得到黄芩素纳米晶/anti-mir138或anti-mir155复合物。ga包裹的黄芩素纳米晶/anti-mir138或anti-mir155复合物的制备。将clg/anti-mirna/ga按照一定质量比混合,室温孵育30min后,得到ga包裹的黄芩素纳米晶/anti-mir138或anti-mir155复合物。黄芩素纳米晶/caspase3复合物的制备将caspase3稀释到不同浓度,使得clg与caspase3质量比为2:1~64:1,二者等体积混匀孵育,得到黄芩素纳米晶/caspase3复合物。ga包裹的黄芩素纳米晶/caspase3复合物的制备将clg/caspase3/ga按照一定质量比混合,室温孵育30min后,得到ga包裹的黄芩素纳米晶/caspase3复合物。本发明构建示意图见图21。采用动态光散射纳米粒径仪、透射电镜等对制得的制剂进行表征。采用琼脂糖凝胶电泳对黄芩素纳米晶/生物药物复合物的形成进行表征。本发明的纳米晶以及纳米晶/生物药物复合物制备方法简单,制剂稳定。本发明通过核靶向多肽的运用将质粒有效递送至细胞核中发挥作用,采用的靶向多肽必须对核孔复合体具有良好的靶向性;为了实现高效的胞浆递送与长循环作用,所得体系的粒径应小于300nm;体系应具有一定的正电荷,以易于细胞摄取。作用原理:而本专利采用的是抗炎黄芩素晶体,生物药物以质粒dna(p53)-核靶向多肽复合物、rna或活性蛋白为主,且外层包裹了葡萄糖醛酸(ga),能有效靶向smcs的葡萄糖转运体-1(glucosetransport-1,glut-1)受体受体,不仅提高了对靶细胞smcs与病灶靶向性,也降低了正电荷,降低了毒性。因此,与已公开专利相比,本体系在构成与疾病治疗优势等方面存在根本的不同,优势明显。ga靶向原理:通过靶向葡萄糖转运体-1(glucosetransport-1,glut-1)受体,ga的包裹提高了体系对平滑肌细胞的靶向性;同时ga能遮蔽体系的部分正电荷,不仅提高了体系的稳定性,也降低了细胞毒性。有益效果1、本发明拟提供一种抗炎药物纳米晶/生物药物/靶向材料复合体系,以靶向治疗pah。通过以抗炎黄芩素晶体为“载体”靶向递送促凋亡生物药物如质粒dna(p53)-核靶向多肽(nls)复合物,anti-mir138,caspase3等。2、与传统共递送体系相比,本发明体系具有明显的优势,载药量是其10倍以上。因此,能减少给药次数,降低给药剂量,提高疗效,提高病人用药依从性。第二,该抗炎晶体能在胞内缓慢释放,增强与生物药物的协同作用。3、该共递送系统稳定性好,药物不易析出。有机溶剂使用少,毒性低。具体优点总结如下:1)共递送系统具有很好的肺定位与靶向作用。2)共递送系统入胞后能缓慢释放小分子药物。3)共递送系统能高效的将生物药物递送入核。4)共递送体系中小分子药物与生物药物之间有很好的协同作用。5)共递送系统能有效治疗肺动脉高压。附图说明图1为本发明实施例1中nls-p53的合成验证图。图2为本发明实施例2中黄芩素纳米晶的透射电镜图。图3为本发明实施例3中纳米晶/nls-p53复合物的粒径图。图4为实施例3中纳米晶/nls-p53复合物电位图。图5为本发明实施例3中纳米晶/nls-p53复合物的琼脂糖凝胶电泳图。图6为本发明实施例4中ga包裹的纳米晶/nls-p53复合物的粒径图。图7为本发明实施例4中ga包裹的纳米晶/nls-p53复合物的电位图。图8为本发明实施例4中ga包裹的纳米晶/nls-p53复合物透射电镜图。图9为本发明实施例5中纳米晶/anti-mir138复合物的粒径图。图10为本发明实施例5中纳米晶/anti-mir138复合物电位图。图11为本发明实施例5中纳米晶/anti-mir138复合物的琼脂糖凝胶电泳图。图12为本发明实施例6中ga包裹的纳米晶/anti-mir138复合物粒径图。图13为本发明实施例6中ga包裹的纳米晶/anti-mir138电位图。图14为本发明实施例6中ga包裹的纳米晶/anti-mir138复合物透射电镜图。图15为本发明实施例7中纳米晶/caspase3复合物的粒径图。图16为本发明实施例7中纳米晶/caspase3复合物电位图。图17为本发明实施例7中纳米晶/caspase3复合物的琼脂糖凝胶电泳图。图18为本发明实施例8中ga包裹的纳米晶/caspase3复合物粒径图。图19为本发明实施例8中ga包裹的纳米晶/caspase3电位图。图20为本发明实施例8中纳米晶/caspase3复合物透射电镜图。图21为本发明实施例1-8中制备示意图图22为本发明实施例9中药理效果图(抗炎作用,ga包裹的纳米晶/anti-mir138复合物):结果表明,与肺血管平滑肌细胞共孵育后,体系能有效抑制炎症因子il-12的释放。图23为实施例10中ga靶向性细胞摄取图(ga包裹的纳米晶/anti-mir138复合物)。图24为实施例11中治疗肺动脉高压效果图(ga包裹的纳米晶/nls-p53复合物)。图25为实施例12中治疗肺动脉高压效果图(ga包裹的纳米晶/anti-mir138复合物)。具体实施方式下面通过实施例进一步说明本发明,但并不因此将发明局限在所述的实施例中。实施例1nls-p53的合成将6-(马来酰亚胺基)己酸琥珀酰亚胺酯10mg溶解于10ml二氯甲烷中,避光搅拌溶解,将2-(4-氨基苯)乙胺5mg加入其中反应24h,反应两天后旋干。在所得产物中加入30mg亚硝酸钠与4ml0.5m盐酸,冰水浴反应2h,之后向其中加入2μgp53,与10ml硼酸缓冲液,反应12h后,加入2mgnls(氨基酸序列为nh2-pkkkrkvedpyc),继续反应12h。全程避光反应。反应结束后超滤离心取上清,转速为3000rpm/10min,超滤管截留分子量为3500。硼酸盐缓冲液配制方法:6.18g硼酸加入980ml水溶解后,用氢氧化钠调节ph至9.0,补加水至1000ml。将nls、p53、nls-p53分别以去离子水稀释至1mg/ml,0.2μg/ml,1mg/ml后,通过考察在200nm-500nm处紫外吸收,验证nls-p53合成。合成验证结果见图1,通过紫外验证了nls-p53的合成。实施例2黄芩素纳米晶制备工艺:将黄芩素20mg溶解于1ml二甲亚砜中,将阳离子化蛋白(clg)10mg溶解于10ml水中,二者混匀后,在冰水浴条件下,细胞破碎仪330w超声,10min,制得黄芩素纳米晶。采用透射电镜(tem)观察黄芩素纳米晶的外观形态,具体操作如下:用镊子夹取专用铜网于桌面上,移液枪吸取20μl黄芩素纳米晶滴在铜网表面,静置10min后,用滤纸吸走多余液体,待铜网表面液体完全干燥后,取20μl2%磷钨酸滴至铜网表面,染色1min,干燥后进行tem观察并拍照。形态表征见图2,构建的纳米晶为棒状体系,粒径约为50-300nm,优选150nm。实施例3:黄芩素纳米晶/nls-p53复合物。选用实施例2中制得的黄芩素纳米晶,将nls-p53用无菌无酶水稀释,将实施例2中制得的纳米晶溶液与nls-p53溶液等体积混合,使得clg:nls-p53质量比为2:1~32:1,室温孵育三十分钟,得到黄芩素纳米晶体/nls-p53复合物。采用用动态光散射纳米粒径仪测定制得的黄芩素纳米晶/nls-p53粒径、电位和多分散系数(pdi)等。具体步骤如下:将黄芩素纳米晶加入到动态光散射纳米粒径仪后,采用粒径和电位分析仪测定平均粒径、pdi和zeta电位,测定温度为25℃。粒径与电位结果见图3、图4,纳米晶/nls-p53复合物粒径为50-300nm,优选150nm,电位为正电荷。琼脂糖凝胶电泳验证纳米晶/nls-p53复合物的形成:称取tris54g,edta·2na3.72g,硼酸27.5g溶解于800ml水中,搅拌均匀后,调节至ph为8.0,加水定容至1000ml。取该溶液200ml,加800ml水得到电泳缓冲液。取1.05g琼脂糖,加入电泳缓冲液150ml,完全溶解后加入溴化乙锭至浓度为0.5μg/ml,倒入电泳槽中,室温凝固,得0.7%琼脂糖凝胶。将实施例3中制得的复合物用无菌水稀释,取稀释的复合物10μl,涡旋混合,室温孵育30min后,每个样品加入2μl的6×上样缓冲液后混匀后上样,在110v下电泳15分钟后,用凝胶电泳仪成像。实验结果见图5,黄芩素纳米晶与nls-p53在质量比大于或等于32:1时,条带消失,说明形成纳米晶/nls-p53复合物。实施例4葡萄糖醛酸(ga)包裹的纳米晶/nls-p53复合物在超净台中,用无菌无酶水将葡萄糖醛酸(ga)稀释到不同浓度,与实施例3中得到的黄芩素纳米晶/nls-p53复合物混合,使得clg/pdna/葡萄糖醛酸(ga)质量比为32:1:0,32:1:1,32:1:2,32:1:4,32:1:8,等体积混匀室温孵育,得到ga包裹的黄芩素纳米晶/nls-p53复合物。采用用动态光散射纳米粒径仪测定制得的ga包裹的纳米晶/nls-p53复合物粒径、电位和多分散系数(pdi)等。具体步骤如下:将制剂加入到动态光散射纳米粒径仪后,采用粒径和电位分析仪测定平均粒径、pdi和zeta电位,测定温度为25℃。粒径分布与电位结果见图6、图7,ga包裹的纳米晶/nls-p53复合物粒径为50-300nm,优选150nm,电位为正电荷。采用透射电镜(tem)观察ga包裹的纳米晶/nls-p53的外观形态,具体操作如下:用镊子夹取专用铜网于桌面上,移液枪吸取20μl制剂滴在铜网表面,静置10min后,用滤纸吸走多余液体,待铜网表面液体完全干燥后,取20μl2%磷钨酸滴至铜网表面,染色1min,干燥后进行tem观察并拍照。形态表征结果见图8,结果表明,制得的ga包裹的纳米晶/nls-p53为棒状体系,为50-300nm,优选150nm。包封率与载药量:将黄芩素纳米晶与ga包裹的纳米晶/nls-p53复合物0.5ml与甲醇9.5ml混合后,超声破坏20min,以5000g/10min离心取上清,紫外测得制剂中黄芩素含量。根据包封率=装载的黄芩素/投入黄芩素总量*100%。载药量=装载的黄芩素/(黄芩素+制剂质量总和)*100%。计算得制剂包封率与载药量。ga包裹的纳米晶/nls-p53复合物包封率约98%,载药量约42%。实施例5纳米晶/anti-mir138复合物将实施例2中制得的纳米晶与anti-mir138按clg:anti-mi138质量比为4:1~64:1等体积混合,室温孵育30min,得到黄芩素纳米晶/anti-mir138复合物。采用用动态光散射纳米粒径仪测定制得的纳米晶/anti-mir138复合物粒径、电位和多分散系数(pdi)等。具体步骤如下:将制剂加入到动态光散射纳米粒径仪后,采用粒径和电位分析仪测定平均粒径、pdi和zeta电位,测定温度为25℃。粒径分布与电位结果见图9、图10,复合物粒径为50-300nm,优选175nm,电位为正电荷。取tris54g,硼酸27.5g,edta3.72g加水溶解后,调节ph至8.0,加水定容至1000ml。取该溶液200ml,加800ml水得到电泳缓冲液。取1.8g琼脂糖糖溶解于90ml电泳缓冲液中,微波炉加热至沸腾,倒入电泳槽中,插入梳齿,固化40min。拔出梳齿,将8μl纳米晶/anti-mir138复合物与2μl5×上样缓冲液混合后加入孔内,以游离anti-mir138作为对照,110v电泳20min后,用凝胶电泳仪拍照。凝胶电泳仪成像实验结果见图11,黄芩素纳米晶与anti-mir138在质量比大于或等于32:1时,条带消失,说明形成纳米晶/anti-mir138复合物。实施例6ga包裹的纳米晶/anti-mir138复合物在超净台中,用无菌无酶水将ga稀释到不同浓度,与实施例5中得到的黄芩素纳米晶/anti-mir138复合物混合,使得clg/anti-mir138/ga质量比为32:1:0,32:1:1,32:1:2,32:1:4,32:1:8等体积混匀室温孵育,得到ga包裹的纳米晶/anti-mir138复合物。粒径分布与电位结果见图12、图13,ga包裹的纳米晶/anti-mir138复合物约为50-300nm,优选180nm,电位为正电荷。采用透射电镜(tem)观察ga包裹的纳米晶/anti-mir138的外观形态,具体操作如下:用镊子夹取专用铜网于桌面上,移液枪吸取20μl制剂滴在铜网表面,静置10min后,用滤纸吸走多余液体,待铜网表面液体完全干燥后,取20μl2%磷钨酸滴至铜网表面,染色1min,干燥后进行tem观察并拍照。形态表征结果见图14,ga包裹的纳米晶/anti-mir138复合物为棒状体系。包封率与载药量:将ga包裹的纳米晶/anti-mir138复合物0.5ml与甲醇9.5ml混合后,超声破坏20min,以5000g/10min离心取上清,紫外测得制剂中黄芩素含量。根据包封率=装载的黄芩素/投入黄芩素总量×100%。载药量=装载的黄芩素/(黄芩素+clg质量总和)×100%。计算得制剂包封率与载药量。ga包裹的纳米晶/anti-mir138复合物包封率约95%,载药量约63%。实施例7黄芩素纳米晶/caspase3复合物将实施例2中制得的纳米晶与caspase3按clg:caspase3质量比为2:1~64:1等体积混合,室温孵育30min,得到黄芩素纳米晶/caspase3复合物。采用用动态光散射纳米粒径仪测定制得的纳米晶/caspase3复合物粒径、电位和多分散系数(pdi)等。具体步骤如下:将制剂加入到动态光散射纳米粒径仪后,采用粒径和电位分析仪测定平均粒径、pdi和zeta电位,测定温度为25℃。粒径与电位结果见图15、图16,纳米晶/caspase3复合物粒径约为50-300nm,优选200nm,,电位为正电荷。凝胶电泳考察:制备clg与caspase3质量比为1,2,4,8,16,32的黄芩素纳米晶/caspase3的复合物,以游离caspase3为参照,采用非变性page电泳分析。配制5%丙烯酰胺/二丙烯酰胺的浓缩胶(0.25mtris-hcl,ph6.8)和10%丙烯酰胺/二丙烯酰胺的分离胶(0.75mtris-hcl,ph8.8),将8μl制剂与2μl5×loadingbuffer混合后上样,caspase3的每孔上样量为1μg,以80mv电泳,当条带到达分离胶时,以120mv继续分离1h。结束后将条带转移至考马斯亮蓝染色液中过夜摇晃,之后脱色液(甲醇:冰醋酸:水为1:1:8)中脱色2h。凝胶电泳仪成像实验结果见图17,黄芩素纳米晶与caspase3在质量比大于或等于32:1时,条带消失,说明形成纳米晶/caspase3复合物。实施例8ga包裹黄芩素纳米晶/caspase3复合物在超净台中,用无菌无酶水将ga稀释到不同浓度,与实施例7中得到的黄芩素纳米晶/caspase3复合物混合,使得clg/caspase3/ga质量比为32:1:0,32:1:1,32:1:2,32:1:4,等体积混匀室温孵育,得到ga包裹的纳米晶/caspase3复合物。采用用动态光散射纳米粒径仪测定制得的ga包裹的纳米晶/caspase3复合物粒径、电位和多分散系数(pdi)等。具体步骤如下:将制剂加入到动态光散射纳米粒径仪后,采用粒径和电位分析仪测定平均粒径、pdi和zeta电位,测定温度为25℃。粒径分布与电位结果见图18、图19,ga包裹的纳米晶/caspase3复合物为50-300nm,优选220nm,电位为正电荷。采用透射电镜(tem)观察ga包裹的纳米晶/caspase3的外观形态,具体操作如下:用镊子夹取专用铜网于桌面上,移液枪吸取20μl制剂滴在铜网表面,静置10min后,用滤纸吸走多余液体,待铜网表面液体完全干燥后,取20μl2%磷钨酸滴至铜网表面,染色1min,干燥后进行tem观察并拍照。形态表征结果见图20,ga包裹的纳米晶/caspase3为棒状体系。包封率与载药量:将ga包裹的纳米晶/caspase3复合物0.5ml与甲醇9.5ml混合后,超声破坏20min,以5000g/10min离心取上清,紫外测得制剂中黄芩素含量。根据包封率=装载的黄芩素/投入黄芩素总量×100%。载药量=装载的黄芩素/(黄芩素+clg质量总和)×100%。计算得制剂包封率与载药量。包封率与载药量结果见表1,纳米晶/caspase3复合物中黄芩素包封率约97%,载药量约为64%。表1为本发明实施例2/4/6/8中纳米晶与ga包裹的纳米晶/复合物粒径、电位、包封率与载药量包封率(%)载药量(%)粒径(nm)pdi电位(mv)黄芩素纳米晶99661350.10223.4ga包裹的纳米晶/nls-p53复合物98.9421520.194.54ga包裹的纳米晶/anti-mir138复合物95631810.112.15ga包裹的纳米晶/caspase-3复合物97642280.1828.81实施例9黄芩素混悬液本实施例旨在说明不按本发明制备方法,获得体系不符合要求将黄芩素原料与大分子药物简单物理混合后,大分子药物易降解,稳定性差,不能发挥药效。将20mg黄芩素溶解于1mldmso中,将其加入1mg/ml的clg水溶液中,再直接加入大分子药物混合。黄芩素颗粒发生了快速沉降,更无法与大分子药物形成复合物。实施例10将从大鼠肺动脉模型中取得的肺动脉平滑肌细胞以2×105cells/ml铺板种于12孔板中,待其贴壁后,以培养液稀释游离药物,纳米晶,纳米晶/anti-mir138复合物以及ga包裹的纳米晶/anti-mir138复合物,孵箱孵育12h后,用elisa试剂盒检测细胞上清液中炎症因子il-12的表达。结果见图22,与游离药物相比,纳米晶复合物体系有效降低了炎症因子的表达。实施例11将从大鼠肺动脉模型中取得的肺动脉平滑肌细胞以2×105cells/ml铺板种于12孔板中,待其贴壁后,以培养液稀释cy5标记的游离anti-mir138,纳米晶/cy5标记的anti-mir138复合物以及ga包裹的纳米晶/cy5标记的anti-mir138复合物,使得cy5标记的anti-mir138最终浓度为100nm,孵箱孵育4h后,将细胞洗脱后,流式细胞仪检测荧光强度。结果见图23,与游离药物相比,ga包裹的纳米晶复合物细胞摄取更高,表明ga包裹的纳米晶复合物对高表达glut-1的肺动脉平滑肌有靶向作用。实施例12雄性sd大鼠皮下注射秋水仙碱三周后,肺动脉高压大鼠模型构建完成。尾静脉给药实施例2-4中制备的游离药物nls-p53,纳米晶,纳米晶复合物,ga包裹的纳米晶复合物。给药间隔为三天,共给药四次。给药结束后,麻醉大鼠,通过心电监护仪检测给药结束后大鼠肺动脉高压的改变。结果见图24,与模型组相比,ga包裹的纳米晶复合物降低肺动脉压力明显,治疗效果显著。实施例13雄性sd大鼠皮下注射秋水仙碱三周后,肺动脉高压大鼠模型构建完成。尾静脉给药实施例5-6中制备的游离药物anti-mir138,纳米晶,纳米晶复合物,ga包裹的纳米晶复合物。给药间隔为三天,共给药四次。给药结束后,麻醉大鼠,通过心电监护仪检测给药结束后大鼠肺动脉高压的改变。结果见图25,与模型组相比,ga包裹的纳米晶复合物降低肺动脉压力明显,治疗效果显著。对于肺动脉高压模型大鼠有很好的治疗效果。序列表<110>中国药科大学<120>一种用于肺动脉高压治疗的联合递送系统及其制备方法<160>4<170>siposequencelisting1.0<210>1<211>15<212>prt<213>pep-7(2ambystomalateralexambystomajeffersonianum)<400>1seraspleutrpglumetmetmetvalserleualacysglntyr151015<210>2<211>18<212>prt<213>pvec(2ambystomalateralexambystomajeffersonianum)<400>2leuleuileileleuargargargilearglysglnalahisalahis151015serlys<210>3<211>8<212>prt<213>nls(2ambystomalateralexambystomajeffersonianum)<400>3cysprolyslyslysarglysval15<210>4<211>13<212>prt<213>nls(2ambystomalateralexambystomajeffersonianum)<400>4cysglyglyglyprolyslyslysarglysvalgluasp1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1