一种兰索拉唑冻干制剂及其制备方法与流程
[0001]
本发明属于医药技术领域,涉及一种兰索拉唑冻干制剂及其制备方法。
背景技术:
[0002]
兰索拉唑(lansoprazole)化学名称为2-[[[3-甲基-4-(2,2,2-三氟乙氧基)-2-吡啶基]甲基]亚硫酰基]-1h-苯并咪唑,属于质子泵抑制剂;其可抑制胃酸分泌,可用于治疗短期的胃和十二指肠溃疡、糜烂性食道炎、zolinger-ellison综合征和胃食管返流疾病等,也可用于幽门螺杆菌感染和非甾体抗炎药引起的胃溃疡。
[0003]
兰索拉唑处于胃粘膜壁细胞的酸性环境后,转变为有活性的代谢物;这种代谢物与存在于酸生成部位的h
+
,k
+-atp酶的巯基结合,通过抑制h
+
,k
+-atp酶的活性而抑制胃酸分泌。兰索拉唑抑制胃酸分泌作用呈剂量依赖性,药后24h内对基础和刺激引起的胃酸分泌均有抑制作用。健康成人1次30mg,一日2次静脉给药,可见持续的胃酸分泌抑制作用。
[0004]
现有的兰索拉唑冻干制剂的生产流程为:药液配制-灌装半加塞-冷冻干燥、压塞-轧盖-目检-包装。在药液配制中,先向浓配罐内放入约配制总体积80%的注射用水(注射用水冷却至60℃以下),加入处方量的甘露醇和氢氧化钠,搅拌溶解后,再加入处方量的兰索拉唑,搅拌至溶解,取样测定溶液ph值(ph应为11.0-12.5);在溶液中加入预先配制好的活性炭混悬液,搅拌20分钟后,经1.0μm孔径钛滤器脱炭压至稀配罐,加冷却的注射用水(温度20℃以下)至总量,开启搅拌器,持续搅拌15分钟;使用孔径0.22μm的除菌滤膜过滤后,完成药液配制。在冷冻干燥中,将配制好的药液按2ml装10ml西林瓶灌装药液,置冷冻干燥机制品室板层,预冻2小时至-32℃保温5小时,开启捕水器制冷开关,于保温结束后,开启真空泵,当真空泵读数降至20pa以下时,逐渐升高板层温度至-10℃,保温14小时,继续升高板层温度至0℃并保温5小时以上,当制品温度与板层温度接近时,继续升高板层温度至25℃并保温2.5小时以上,当制品温度与板层温度再次接近时结束冻干,真空落盖、压塞、包装。
[0005]
目前的工艺仍存在以下问题:兰索拉唑不溶于水,由于兰索拉唑冻干制剂在生产过程中,需要在碱性环境下溶解,再经过灌装到冷冻干燥结束前,兰索拉唑处于非干燥状态,产品质量不稳定;药液在冷冻干燥过程中不易成型,外观剂型松散,有萎缩现象;同时在冷冻干燥过程中冻干时间超过24小时,冻干时间越长,兰索拉唑处于非干燥状态时间越长,产品质量越不稳定;同时冻干时间越长,能耗越大,生产成本越高。
[0006]
因此,希望能通过改进兰索拉唑冻干制剂的制备方法来提高产品质量和实现节能降耗。
技术实现要素:
[0007]
本发明的目的在于提供一种兰索拉唑冻干制剂及其制备方法,本发明提供的兰索拉唑冻干制剂中的有效成分含量较高,同时兰索拉唑的稳定性好;相较于目前现有技术中24h以上的冻干时间,本发明提供的制备方法将冻干时间缩短至14-20h之间,降低了30%左右的能耗的同时提高了生产产能,极大地节约了成本。
[0008]
为达到此目的,本发明采用以下技术方案:
[0009]
第一方面,本发明提供了一种兰索拉唑冻干制剂,所述兰索拉唑冻干制剂中包括兰索拉唑、无机碱和赋形剂,优选由兰索拉唑、无机碱和赋形剂组成;
[0010]
其中,所述兰索拉唑、无机碱和赋形剂的质量比为1:(0.02-0.4):(0.6-6)。
[0011]
本发明提供的兰索拉唑冻干制剂在仅包括三种组分的前提下,具有较优的稳定性,同时其杂质较少,有效成分含量较高。
[0012]
本发明所述0.02-0.4可以是0.05、0.1、0.15、0.2、0.25、0.3、0.35等,所述0.6-6可以是1、1.5、2、2.5、3、3.5、4、4.5、5、5.5等。
[0013]
本发明所述无机碱选自氢氧化钠。
[0014]
本发明所述赋形剂选自甘露醇和/或葡甲胺。
[0015]
作为本发明的一种优选技术方案,按重量份计,所述兰索拉唑冻干制剂中包括如下组分:
[0016]
兰索拉唑100-500份、无机碱10-40份和赋形剂300-600份。
[0017]
作为本发明的一种优选技术方案,按重量份计,所述兰索拉唑冻干制剂由如下组分组成:兰索拉唑100-500份、无机碱10-40份和赋形剂300-600份。
[0018]
所述兰索拉唑100-500份可以是150份、200份、250份、300份、350份、400份、450份等,所述无机碱10-40份可以是15份、20份、25份、30份、35份等,所述赋形剂300-600份可以是350份、400份、450份、500份、500份、550份等。
[0019]
作为本发明的一种优选技术方案,按重量份计,所述兰索拉唑冻干制剂由如下组分组成:兰索拉唑150-200份、无机碱10-20份和赋形剂300-500份。
[0020]
为了进一步提升兰索拉唑冻干制剂中的有效成分含量及其稳定性,所述兰索拉唑冻干制剂由如下组分组成:兰索拉唑200份、无机碱20份和赋形剂300份。
[0021]
第二方面,本发明提供了第一方面所述的兰索拉唑冻干制剂的制备方法,所述制备方法包括如下步骤:将包括配方量的兰索拉唑、无机碱和赋形剂加注射用水配制成药液,冷冻干燥,得到所述兰索拉唑冻干制剂;
[0022]
为了降低能耗,并且增加兰索拉唑冻干制剂的稳定性,对冷冻干燥的条件进行了优化,优选所述冷冻干燥包括预冻、一次干燥和二次干燥,更优选所述冷冻干燥的总时间为14-20h,例如15h、16h、17h、18h、19h等。
[0023]
本发明所述预冻的温度为-30℃以下,例如-32℃、-35℃、-38℃、-40℃等,时间为2-3h,例如2.2h、2.4h、2.6h、2.8h等。
[0024]
本发明所述一次干燥的真空度为10pa以下,例如9pa、8pa、7pa、6pa、5pa等,温度为8-12℃,例如9℃、10℃、11℃等,时间为5-8h,例如6h、7h等。
[0025]
优选地,所述一次干燥的具体步骤为:预冻完成后,开启真空泵使真空度保持10pa以下,同时在1h内升温至8-12℃,并保温5-8h,完成一次干燥。
[0026]
本发明所述二次干燥为在22-26℃(例如24℃、25℃等)下保温1-2h(例如1.2h、1.4h、1.6h、1.8h等)后升温至28-32℃(例如29℃、30℃、31℃等)保温2-3h(例如2.2h、2.4h、2.6h、2.8h等)。
[0027]
优选地,所述二次干燥的具体步骤为:一次干燥完成后,控制真空度为10-15pa,在1h内升温至22-26℃并保温1-2h后,然后在1h内升温至28-32℃并保温2-3h,完成二次干燥。
[0028]
本发明通过缩短冻干时间可使兰索拉唑尽快脱离非干燥状态,本发明采用的冻干工艺,将冻干时间由24h以上缩短至14-20h,从而使兰索拉唑的稳定性进一步得到保证。
[0029]
本发明通过控制一次干燥和二次干燥的真空度,可以确保配置好的药液在更短的时间内干燥完全。
[0030]
同时,本发明缩短了冻干时间,降低能耗30%左右的同时在不增加硬件投入的情况下,可提高生产产能约30%,极大地降低了生产成本。
[0031]
本发明所述药液的配制方法包括:先将配方量的兰索拉唑在无机碱水溶液中溶解,再与赋形剂混合溶解,然后加入活性炭悬浮液混合,最后进行过滤,得到药液。
[0032]
本发明先将兰索拉唑溶解于无机碱水溶液中,然后再加入赋形剂,此种添加方式可以减少可见异物的含量,提高最后的冻干制剂的质量。
[0033]
作为本发明的一种具体实施方式,所述药液的具体配置方法为:
[0034]
(1)将配方量的氢氧化钠利用注射用水配制成氢氧化钠溶液,加入配方量的兰索拉唑搅拌至溶解,然后加入冷却后注射用水至总量的25-35%并充氮搅拌;
[0035]
(2)向上述溶液中加入配方量的甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的45-55%;
[0036]
(3)将活性炭悬浮液与步骤(2)的药液搅拌混合、脱炭,然后加入冷却后注射用水至总量的100%并搅拌,最后使用除菌滤膜过滤后,完成药液配制。
[0037]
在药液配制过程中,保持药液的ph值为11.5-12.8,例如11.6、11.8、12.0、12.2、12.5、12.6等。
[0038]
作为本发明所述制备方法的一种具体实施方案,包括如下步骤:
[0039]
(1)将配方量的氢氧化钠利用注射用水配制成0.5~1.5mol/l的氢氧化钠溶液,加入配方量的兰索拉唑搅拌至溶解,然后加入冷却后的注射用水至总量的25-35%并充氮搅拌;
[0040]
(2)向上述溶液中加入配方量的甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的45-55%;
[0041]
(3)将活性炭悬浮液与步骤(2)的药液搅拌混合,并利用钛滤器脱炭,然后加入冷却后注射用水至总量的100%并搅拌,最后使用除菌滤膜过滤后,完成药液配制;
[0042]
(4)将药液分装,等待冷冻干燥;
[0043]
(5)将冷凝器温度预降至-40℃以下,然后放入分装好的药液,并保持温度为-30℃以下2-3h进行预冻;
[0044]
(6)预冻完成后,开启真空泵使真空度保持10pa以下,同时在1h内升温至8-12℃,并保温5-8h,完成一次干燥;
[0045]
(7)一次干燥完成后,控制真空度为10-15pa,在1h内升温至22-26℃并保温1-2h后,然后在1h内升温至28-32℃并保温2-3h,完成二次干燥,然后液压加塞,得到所述兰索拉唑冻干制剂。
[0046]
相对于现有技术,本发明具有以下有益效果:
[0047]
(1)本发明提供的兰索拉唑冻干制剂中的有效成分含量较高,同时兰索拉唑的稳定性好;
[0048]
(2)本发明提供的制备方法将冻干时间缩短至14-20h之间,降低了30%左右的能
耗的同时提高了生产产能,极大地节约了成本。
具体实施方式
[0049]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0050]
实施例1
[0051]
本实施例提供了一种20000ml的兰索拉唑冻干制剂,制备方法如下:
[0052]
(1)称取10g氢氧化钠,加入适量注射用水制成1.0mol/l的氢氧化钠溶液,然后向氢氧化钠溶液中加入150g兰索拉唑,搅拌至溶解,向上述溶液中缓慢加入冷却后注射用水至总量的30%,充氮搅拌;
[0053]
(2)向上述溶液中加入500g甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的50%;
[0054]
(3)将0.1%含量的活性炭悬浮液(用量为500ml)与步骤(2)的药液搅拌混合15min,将得到的浓配液利用1.0μm孔径钛滤器脱炭并压至稀配罐,加入冷却后注射用水至总量的100%并搅拌15min,最后使用0.22μm的除菌滤膜过滤后,完成20000ml药液配制;
[0055]
在步骤(1)-(3)中随时监测溶液ph值为11.5-12.8范围内,如有必要添加1mol/l的氢氧化钠溶液调节ph值。
[0056]
(4)药液检验合格后,按每瓶2ml分装于10ml管制瓶中,管制瓶置于冷冻干燥机制品室板层中进行冷冻干燥;
[0057]
(5)将冷凝器温度预降至-45℃以下,然后放入分装好的药液,在1h内将板层温度降温至-35℃并保温2h进行预冻;
[0058]
(6)预冻完成后,开启真空泵使真空度保持10pa以下,1h内升温至10℃,并保温5h,完成一次干燥;
[0059]
(7)一次干燥完成后,控制真空度为12pa,在1h内升温至25℃并保温1h后,然后在1h内升温至30℃并保温2h,完成二次干燥,然后液压加塞,得到兰索拉唑冻干制剂。
[0060]
实施例2
[0061]
本实施例提供了一种20000ml的兰索拉唑冻干制剂,制备方法如下:
[0062]
(1)称取15g氢氧化钠,加入适量注射用水制成1.0mol/l的氢氧化钠溶液,然后向氢氧化钠溶液中加入150g兰索拉唑,搅拌至溶解,向上述溶液中缓慢加入冷却后注射用水至总量的30%,充氮搅拌;
[0063]
(2)向上述溶液中加入350g甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的50%;
[0064]
(3)将活性炭悬浮液(用量为500ml)与步骤(2)的药液搅拌混合15min,将得到的浓配液利用1.0μm孔径钛滤器脱炭并压至稀配罐,加入冷却后注射用水至总量的100%并搅拌15min,最后使用0.22μm的除菌滤膜过滤后,完成20000ml药液配制;
[0065]
在步骤(1)-(3)中随时监测溶液ph值为11.5-12.8范围内,如有必要添加1mol/l的氢氧化钠溶液调节ph值。
[0066]
(4)药液检验合格后,按每瓶2ml分装于10ml管制瓶中,管制瓶置于冷冻干燥机制品室板层中进行冷冻干燥;
[0067]
(5)将冷凝器温度预降至-42℃以下,然后放入分装好的药液,在1h内将板层温度降温至-32℃并保温2h进行预冻;
[0068]
(6)预冻完成后,开启真空泵使真空度保持10pa以下,1h内升温至10℃,并保温6h,完成一次干燥;
[0069]
(7)一次干燥完成后,控制真空度为15pa,在1h内升温至25℃并保温1h后,然后在1h内升温至30℃并保温3h,完成二次干燥,然后液压加塞,得到兰索拉唑冻干制剂。
[0070]
实施例3
[0071]
本实施例提供了一种20000ml的兰索拉唑冻干制剂,制备方法如下:
[0072]
(1)称取20g氢氧化钠,加入适量注射用水制成1.0mol/l的氢氧化钠溶液,然后向氢氧化钠溶液中加入200g兰索拉唑,搅拌至溶解,向上述溶液中缓慢加入冷却后注射用水至总量的30%,充氮搅拌;
[0073]
(2)向上述溶液中加入300g甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的50%;
[0074]
(3)将活性炭悬浮液(用量为500ml)与步骤(2)的药液搅拌混合15min,将得到的浓配液利用1.0μm孔径钛滤器脱炭并压至稀配罐,加入冷却后注射用水至总量的100%并搅拌15min,最后使用0.22μm的除菌滤膜过滤后,完成20000ml药液配制;
[0075]
在步骤(1)-(3)中随时监测溶液ph值为11.5-12.8范围内,如有必要添加1mol/l的氢氧化钠溶液调节ph值。
[0076]
(4)药液检验合格后,按每瓶2ml分装于10ml管制瓶中,管制瓶置于冷冻干燥机制品室板层中进行冷冻干燥;
[0077]
(5)将冷凝器温度预降至-50℃以下,然后放入分装好的药液,在1h内将板层温度降温至-40℃并保温3h进行预冻;
[0078]
(6)预冻完成后,开启真空泵使真空度保持10pa以下,1h内升温至10℃,并保温5h,完成一次干燥;
[0079]
(7)一次干燥完成后,控制真空度为10pa,在1h内升温至25℃并保温2h后,然后在1h内升温至30℃并保温3h,完成二次干燥,然后液压加塞,得到兰索拉唑冻干制剂。
[0080]
实施例4
[0081]
本实施例提供了一种20000ml的兰索拉唑冻干制剂,制备方法如下:
[0082]
(1)称取30g氢氧化钠,加入适量注射用水制成1.0mol/l的氢氧化钠溶液,然后向氢氧化钠溶液中加入100g兰索拉唑,搅拌至溶解,向上述溶液中缓慢加入冷却后注射用水至总量的30%,充氮搅拌;
[0083]
(2)向上述溶液中加入600g甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的50%;
[0084]
(3)将活性炭悬浮液(用量为500ml)与步骤(2)的药液搅拌混合15min,将得到的浓配液利用1.0μm孔径钛滤器脱炭并压至稀配罐,加入冷却后注射用水至总量的100%并搅拌15min,最后使用0.22μm的除菌滤膜过滤后,完成20000ml药液配制;
[0085]
在步骤(1)-(3)中随时监测溶液ph值为11.5-12.8范围内,如有必要添加1mol/l的氢氧化钠溶液调节ph值。
[0086]
(4)药液检验合格后,按每瓶2ml分装于10ml管制瓶中,管制瓶置于冷冻干燥机制
品室板层中进行冷冻干燥;
[0087]
(5)将冷凝器温度预降至-40℃以下,然后放入分装好的药液,在1h内将板层温度降温至-30℃并保温3h进行预冻;
[0088]
(6)预冻完成后,开启真空泵使真空度保持10pa以下,1h内升温至10℃,并保温8h,完成一次干燥;
[0089]
(7)一次干燥完成后,控制真空度为15pa,在1h内升温至25℃并保温2h后,然后在1h内升温至30℃并保温3h,完成二次干燥,然后液压加塞,得到兰索拉唑冻干制剂。
[0090]
实施例5
[0091]
本实施例提供了一种20000ml的兰索拉唑冻干制剂,制备方法如下:
[0092]
(1)称取40g氢氧化钠,加入适量注射用水制成1.0mol/l的氢氧化钠溶液,然后向氢氧化钠溶液中加入300g兰索拉唑,搅拌至溶解,向上述溶液中缓慢加入冷却后注射用水至总量的30%,充氮搅拌;
[0093]
(2)向上述溶液中加入300g甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的50%;
[0094]
(3)将活性炭悬浮液(用量为500ml)与步骤(2)的药液搅拌混合15min,将得到的浓配液利用1.0μm孔径钛滤器脱炭并压至稀配罐,加入冷却后注射用水至总量的100%并搅拌15min,最后使用0.22μm的除菌滤膜过滤后,完成20000ml药液配制;
[0095]
在步骤(1)-(3)中随时监测溶液ph值为11.5-12.8范围内,如有必要添加1mol/l的氢氧化钠溶液调节ph值。
[0096]
(4)药液检验合格后,按每瓶2ml分装于10ml管制瓶中,管制瓶置于冷冻干燥机制品室板层中进行冷冻干燥;
[0097]
(5)将冷凝器温度预降至-45℃以下,然后放入分装好的药液,在1h内将板层温度降温至-35℃并保温2h进行预冻;
[0098]
(6)预冻完成后,开启真空泵使真空度保持10pa以下,1h内升温至10℃,并保温5h,完成一次干燥;
[0099]
(7)一次干燥完成后,控制真空度为15pa,在1h内升温至25℃并保温2h后,然后在1h内升温至30℃并保温2h,完成二次干燥,然后液压加塞,得到兰索拉唑冻干制剂。
[0100]
实施例6
[0101]
本实施例提供了一种20000ml的兰索拉唑冻干制剂,制备方法如下:
[0102]
(1)称取10g氢氧化钠,加入适量注射用水制成1.0mol/l的氢氧化钠溶液,然后向氢氧化钠溶液中加入150g兰索拉唑,搅拌至溶解,向上述溶液中缓慢加入冷却后注射用水至总量的30%,充氮搅拌;
[0103]
(2)向上述溶液中加入400g甘露醇并搅拌溶解,然后加入冷却后注射用水至总量的50%;
[0104]
(3)将活性炭悬浮液(用量为500ml)与步骤(2)的药液搅拌混合15min,将得到的浓配液利用1.0μm孔径钛滤器脱炭并压至稀配罐,加入冷却后注射用水至总量的100%并搅拌15min,最后使用0.22μm的除菌滤膜过滤后,完成20000ml药液配制;
[0105]
在步骤(1)-(3)中随时监测溶液ph值为11.5-12.8范围内,如有必要添加1mol/l的氢氧化钠溶液调节ph值。
[0106]
(4)药液检验合格后,按每瓶2ml分装于10ml管制瓶中,管制瓶置于冷冻干燥机制品室板层中进行冷冻干燥;
[0107]
(5)将冷凝器温度预降至-45℃以下,然后放入分装好的药液,在1h内将板层温度降温至-30℃并保温2h进行预冻;
[0108]
(6)预冻完成后,开启真空泵使真空度保持10pa以下,1h内升温至10℃,并保温7h,完成一次干燥;
[0109]
(7)一次干燥完成后,控制真空度为15pa,在1h内升温至25℃并保温1h后,然后在1h内升温至30℃并保温2h,完成二次干燥,然后液压加塞,得到兰索拉唑冻干制剂。
[0110]
实施例7
[0111]
本实施例提供了一种20000ml兰索拉唑冻干制剂,与实施例1相比,区别仅在于:步骤(7)真空度为10pa以下。
[0112]
实施例8
[0113]
本实施例提供了一种20000ml兰索拉唑冻干制剂,与实施例1相比,区别仅在于:步骤(1)-(3)替换为对比例1提供的步骤(1)-(2)。
[0114]
对比例1
[0115]
本对比例提供了一种20000ml兰索拉唑冻干制剂,制备方法如下:
[0116]
(1)向浓配罐内放入约配制总体积80%的注射用水(注射用水冷却至60℃以下),加入500g甘露醇和10g氢氧化钠,搅拌溶解后,再加入150g兰索拉唑,搅拌至溶解,取样测定溶液ph值,应为11.0-12.5,如ph值不在此范围内,可用1mol/l naoh溶液调节ph值为11.0-12.5。
[0117]
(2)在溶液中加入预先配制好的活性炭混悬液,搅拌20min后,经1.0μm孔径钛滤器脱炭压至稀配罐,加冷却的注射用水(温度20℃以下)至总量20000ml,开启搅拌器,持续搅拌15min,使用孔径0.22μm的除菌滤膜过滤后,完成药液配制;
[0118]
(3)配制好的药液按2ml装10ml西林瓶灌装药液,置冷冻干燥机制品室板层,预冻2h至-32℃保温5h,开启捕水器制冷开关,于保温结束后,开启真空泵,当真空泵读数降至20pa以下时,逐渐升高板层温度至-10℃,保温14h,继续升高板层温度至0℃并保温5h以上,当制品温度与板层温度接近时,继续升高板层温度至25℃并保温2.5h以上,当制品温度与板层温度再次接近时结束冻干,真空落盖,然后压塞,得到兰索拉唑冻干制剂。
[0119]
对比例2
[0120]
本对比例提供了一种20000ml兰索拉唑冻干制剂,与实施例1相比,区别仅在于:兰索拉唑的添加量为600g,甘露醇的添加量为200g。
[0121]
对比例3
[0122]
本对比例提供了一种20000ml兰索拉唑冻干制剂,与实施例1相比,区别仅在于:兰索拉唑的添加量为90g,甘露醇的添加量为650g。
[0123]
性能测试1
[0124]
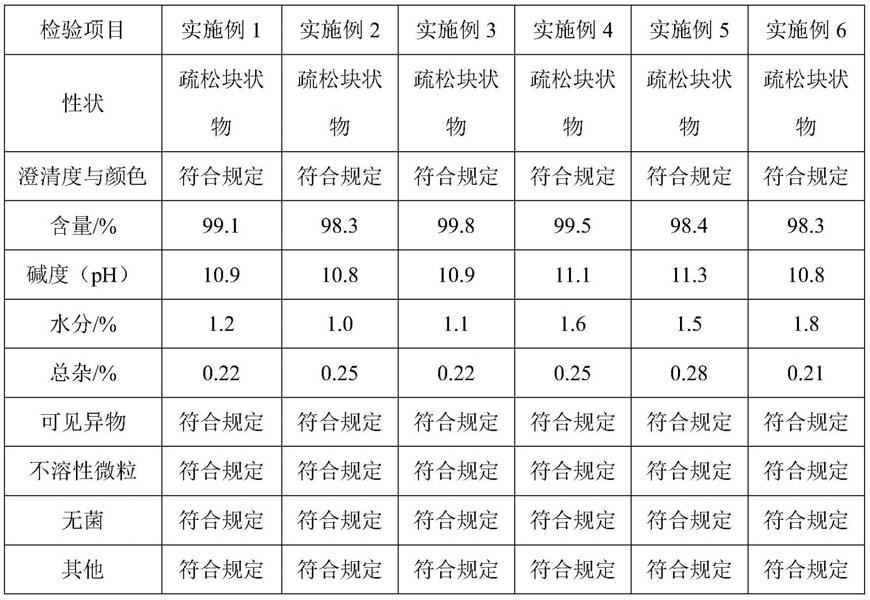
对实施例1-8和对比例1-3提供的兰索拉唑冻干制剂按照国家药品标准进行性能测试,测试结果见表1和表2:
[0125]
表1
[0126][0127]
表2
[0128][0129]
注:在标准规定中,性状应为白色或类白色疏松块状物,含量应为标示量的95.0-105.0%,碱度为ph 10.6~11.3,水分≤3.0%,总杂≤0.6%,其余应“符合规定”。
[0130]
由实施例和性能测试可知,本发明提供的兰索拉唑冻干制剂中活性成分含量较高,在98%以上,并且其余各项指标均符合药品标准中的规定。
[0131]
由实施例1和实施例7的对比可知,采用本发明的冷冻干燥的方法最后得到兰索拉
唑冻干制剂具有较优的效果;由实施例1和实施例8的对比可知,采用本发明提供的配制药液的方法可以减少可见异物。由实施例1和对比例1的对比可知,本发明提供的制备方法可以缩短冻干时间,降低能耗,提高生产产能;由实施例1和对比例2-3的对比可知,本发明提供的兰索拉唑冻干制剂中的各组分需要在本发明的限定范围内。
[0132]
性能测试2
[0133]
对实施例4-6和对比例1提供的兰索拉唑冻干制剂进行6个月加速试验,测试结果见表3:
[0134]
表3
[0135][0136][0137]
由实施例和性能测试可知,本发明提供的制备方法得到的兰索拉唑冻干制剂的储存稳定性较好。
[0138]
申请人声明,本发明通过上述实施例来说明本发明的兰索拉唑冻干制剂及其制备方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1