作为转染试剂的羧化多胺衍生物的制作方法
12987中)抵制聚集,但另一方面其与生物活性对抗且必须为可逆的,如rozema的发表文献中所示。
[0011]
从许多不同的策略以及从大量的报告中显而易见的是,新型转染剂的开发是深入研究的课题。它们的应用具有重大的商业意义;转染试剂在2011年具有约200mio usd的市场容量(frost&sullivan,global transfection markets(全球转染市场),n6f0-01)。
[0012]
转染剂的开发和改良中的两个最重要标准是(i)高信噪比以及(ii)穿过大量不同细胞类型的有效转染。信噪比描述了转染复合物与单独转染剂或者与包含不相关核酸的转染复合物相比的效果。
[0013]
因此本发明的一个目的是提供一种用于将聚阴离子转染至细胞中的转染剂以及一种转染细胞的方法。另一个目的是提供一种在标准(a)和/或(b)方面优于市售材料的转染剂。鉴于先前所用的大量和多样化的方法,尚未发现已教导此发明的具体原理。
[0014]
发明概述
[0015]
上述目的通过以下方式实现:
[0016]
(1)多胺衍生物用于将聚阴离子转染至细胞中的用途,所述多胺包含:
[0017]
多胺部分,所述多胺部分包含多个氨基;
[0018]
多个羧化取代基,所述羧化取代基包含经由疏水连接体与所述多胺部分的氨基结合的羧基;以及
[0019]
多个疏水取代基,所述疏水取代基与所述多胺部分的氨基结合;
[0020]
所述疏水连接体具有3至20的logp,该logp是对通过将所述连接体与所述多胺的羧基以及氨基结合的键替换为与氢原子结合的键从所述连接体获得的化合物测定的;以及
[0021]
所述疏水取代基具有1.5至20的logp,该logp是对通过将所述疏水取代基与所述多胺部分的氨基结合的键替换为与氢原子结合的键从所述疏水取代基获得的化合物测定的。
[0022]
(2)多胺衍生物用于将聚阴离子转染至细胞中的用途,所述多胺包含:
[0023]
多胺部分,所述多胺部分包含多个氨基;
[0024]
多个羧化取代基,所述羧化取代基包含经由疏水连接体与所述多胺部分的氨基结合的羧基,其中每个所述羧化取代基包含6至40个碳原子,优选6至20个碳原子,更优选8至18个碳原子,并且每个所述疏水连接体可包含1至3个选自o、n及s的杂原子;以及
[0025]
多个疏水取代基,所述疏水取代基与所述多胺部分的氨基结合,其中每个所述疏水取代基包含至少2个碳原子,优选6至40个碳原子,并且在所述疏水取代基具有至少6个碳原子的情况下可包含1至3个选自o、n及s的杂原子。
[0026]
(3)根据第1项或第2项的用途,其中所述多胺衍生物的每个所述羧化取代基包含下列基团中的任何一个或多个作为所述疏水连接体:亚烷基、亚烯基、亚炔基、亚环烷基、亚环烯基、亚芳基以及它们的组合;和/或
[0027]
所述多胺衍生物的每个所述疏水取代基包含下列基团中的任何一个或多个:烷基、烯基、炔基、环烷基、环烯基、芳基以及它们的组合。
[0028]
(4)如第1项或第2项所限定的多胺衍生物。
[0029]
(5)多亚烷基亚胺(polyalkylenimine)衍生物,其具有一个或多个羧基烷基取代基以及一个或多个疏水取代基,所述羧基烷基取代基包含6至40个碳原子,所述疏水取代基
选自具有至少2个碳原子、优选6至40个碳原子的烃取代基,其中每个所述疏水取代基可为烷基或者可包含烷基和/或每个所述疏水取代基可为芳基或者可包含芳基。
[0030]
(6)根据第5项的多亚烷基亚胺衍生物,其中所述多亚烷基亚胺衍生物中的羧基烷基取代基和疏水取代基具有10:1至0.1:1的摩尔比(c/a比),优选这些基团的c/a比为3:1至0.33:1。
[0031]
(7)根据第4项至第6项中任一项的多胺衍生物或多亚烷基亚胺衍生物,其中所述羧化取代基全部相同且所述疏水取代基全部相同,并且一个所述羧化取代基中的碳原子加上一个所述疏水取代基中的碳原子的总数为10至30,优选为15至25。
[0032]
(8)核酸或蛋白质与本发明的多胺衍生物的复合物。
[0033]
(9)一种试剂盒,包括:
[0034]
(i)如本文所限定的多胺衍生物,
[0035]
(ii)ph介于4至8之间的缓冲溶液,以及
[0036]
(iii)任选地使用说明手册。
[0037]
(10)一种利用核酸或蛋白质转染细胞的方法,包括将所述核酸或蛋白质与如本文所限定的多胺衍生物例如在含水缓冲液中混合,以及利用在先前步骤中得到的混合物处理所述细胞。
[0038]
(11)一种包含多个区室的容器,所述区室含有包含转染剂的冻干组合物,所述转染剂可为如第1项至第7项中任一项所限定的多胺衍生物或者可包含如第1项至第7项中任一项所限定的多胺衍生物。
[0039]
本发明还提供:
[0040]
(12)羧基烷基-烷基-多胺用于将聚阴离子转染至细胞中的用途。
[0041]
(13)根据第12项的用途,其中所述羧基烷基-烷基-多胺的多胺部分选自由多亚烷基亚胺、聚烯丙基胺、聚乙烯胺、聚赖氨酸以及聚鸟氨酸组成的组,其中所述多亚烷基亚胺优选为聚亚乙基亚胺、聚亚丙基亚胺(polypropylenimines)、聚亚丁基亚胺(polybutylenimines)或寡精胺(oligospermines)或者其同系物,并且其中所述多胺部分包含12至100000个氮原子,更优选20至5000个氮原子。
[0042]
(14)根据第12项或第13项中任一项的用途,其中羧基烷基部分为具有4至40个碳原子、优选6至20个碳原子、更优选8至16个碳原子的脂肪族羧基烷基部分。
[0043]
(15)根据第12项至第14项中任一项的用途,其中烷基部分为具有至少2个碳原子、优选6至40个碳原子的脂肪族烷基部分。
[0044]
(16)根据第12项至第15项中任一项的用途,其中所述羧基烷基-烷基-多胺的所有羧基烷基部分均相同且所有烷基部分均相同,并且羧基烷基部分和烷基部分中的碳原子的总数为10至30个,优选为15至25个。
[0045]
(17)根据第12项至第16项中任一项的用途,其中所述羧基烷基-烷基-多胺为包含下式(6)所示结构单元的直链的羧基烷基-烷基-多亚烷基亚胺
[0046]-[ch
2-nr
6-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(6)
[0047]
其中
[0048]
x为1至10的整数,其中在不同的(ch2)
x
基团之间,x的值可相同或不同,
[0049]
r6为氢、c
r
h
2r+1
或c
s-1
h
2s-2
cooh
[0050]
r为2至40的整数,
[0051]
s为4至40的整数;
[0052]
或者
[0053]
其中所述羧基烷基-烷基-多胺为包含式(7)、式(8)和式(9)中每一个所示的结构单元的支链的羧基烷基-烷基-多亚烷基亚胺:
[0054]-[ch
2-nr
6-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(7)
[0055]-[ch
2-nr
7-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(8)
[0056]-(ch2)
y-nr
62
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(9)
[0057]
其中
[0058]
r6、x、r以及s如上所定义,以及
[0059]
r7包含一个或多个选自式(7)、式(8)和式(9)的单元;
[0060]
y为1至10的整数,优选为2至10的整数,其中在多次出现的(ch2)
y
基团之间,y的值可相同或不同;
[0061]
以及其中每分子所述直链的羧基烷基-烷基-多亚烷基亚胺或所述支链的羧基烷基-烷基-多亚烷基亚胺的氮原子数目为12至100000。
[0062]
(18)根据第12项至第17项中任一项的用途,其中在所述羧基烷基-烷基-多胺中羧基烷基部分与烷基部分的摩尔比在6:1至0.33:1的范围内,优选在2:1至0.5:1的范围内。
[0063]
(19)根据第12项至第18项中任一项的用途,其中所述多胺的至少10mol%、优选25至80mol%、更优选30至60mol%的氨基被所述羧基烷基和所述烷基取代(取代度)。
[0064]
(20)根据第12项至第19项中任一项的用途,其中聚阴离子为核酸。
[0065]
(21)根据第5项的多亚烷基亚胺衍生物,其为羧基烷基-烷基-多胺,其中所述羧基烷基-烷基-多胺具有一种类型的羧基烷基部分以及一种类型的烷基部分,该类型的羧基烷基部分和该类型的烷基部分中的碳原子的总数为10至30,优选为15至25。
[0066]
(22)根据第21项的多亚烷基亚胺衍生物,其中所述多亚烷基亚胺衍生物为支链的聚亚乙基亚胺,其中进一步地所述羧基烷基部分具有8至16个碳原子以及其中所述烷基部分具有8至10个、优选约9个碳原子。
[0067]
(23)核酸与如前述第12项至第22项中任一项所限定的羧基烷基-烷基-多胺的复合物。
[0068]
(24)一种试剂盒,包括:
[0069]
(i)如第12项至第19项或者第21项至第22项中任一项所限定的羧基烷基-烷基-多胺,
[0070]
(ii)ph值介于4至8之间以及离子强度为0.2mol/l或更低、优选为0.1mol/l或更低的缓冲溶液,以及
[0071]
(iii)任选地,使用说明手册。
[0072]
(25)第24项的试剂盒,其中所述多胺以溶液的形式提供,以及其中溶剂为选自乙醇、丙醇、1,2-二羟基丙烷或异丙醇的组的低级醇,或者为包含水以及33至100%的此类低级醇的混合物。
[0073]
(26)第24项的试剂盒,其中以干的形式提供所述多胺。
[0074]
(27)第24项或第26项的试剂盒,其中以冻干的形式提供所述多胺。
[0075]
(28)第24项至第27项中任一项的试剂盒,其中所述多胺被放置在多孔板中。
[0076]
(29)如第28项所述的试剂盒,其中所述多孔板的孔包含不同量的所述多胺,优选在相邻的孔中包含梯度的所述多胺或者其中某些孔是空的。
[0077]
(30)一种利用聚阴离子转染细胞的方法,包括:将所述聚阴离子与如第12项至第22项中任一项所限定的羧基烷基-烷基-多胺在水中或含水缓冲液中混合,以及利用在先前步骤中得到的混合物处理所述细胞。
[0078]
利用包含经由疏水连接体与多胺结合的羧基的羧化取代基以及利用疏水取代基对多胺进行化学改性。本发明所用的改性的多胺在整个说明书中表示为羧化的、疏水化的多胺或者改性的多胺或者多胺衍生物。在一个实施方式中,利用羧基烷基取代基和烷基取代基对多胺进行化学改性。这些改性的多胺在本文中表示为羧基烷基-烷基-多胺。令人惊讶地发现,两种改性的组合优于任何单一改性,因为实现了高信噪比和更有效的转染。新型试剂对许多细胞类型具有这些结果,并且也优于市售的材料以及现有技术中记载的那些材料。
[0079]
发明详述
[0080]
本发明的多胺衍生物在多胺上具有羧化取代基和疏水取代基,其中这些取代基可各自独立地包括一个、两个或三个选自氧、氮或硫的杂原子。本发明的羧基烷基-烷基-多胺是在多胺上具有羧基烷基取代基作为所述羧化取代基以及具有烷基取代基作为所述疏水取代基的多胺衍生物。
[0081]
本发明的多胺衍生物可通过本领域已知的方法获得。一种可能的方法是多胺与卤代羧酸以及卤代疏水化合物的衍生化,所述卤代羧酸在卤素被多胺的氨基亲核取代时形成所述羧化取代基,所述卤代疏水化合物在卤素被多胺的氨基亲核取代时形成所述疏水取代基。本发明的羧基烷基-烷基-多胺可类似地获得。一种可能的方法是多胺与卤代链烷酸以及与卤代烷烃通过亲核取代的烷基化。卤素或卤代取代基可为氯、溴或碘原子,优选地,其为溴。下面给出关于多胺衍生物和羧基烷基-烷基-多胺的制备的更多细节。
[0082]
多胺
[0083]
可用作生产本发明的多胺衍生物的起始材料的多胺为具有形成多个氨基的多个氮原子的聚合物。通过质子化作用,这些氮原子可在水溶液中带电荷。大多数脂肪族胺具有大于8或9的pk,这意味着它们基本上或者完全地在ph值为7.4左右(生理ph)或者更低ph值的水溶液中带电荷。
[0084]
pk低于6的胺部分例如吡啶或苯胺是不太优选的多胺的氨基。可容易地得到各种胺的pk值,因为它们经常在各自的英语维基百科(english wikipedia,网址为en.wikipedia.org)的文章中被提及或者它们可利用软件例如acd/pka数据库(advanced chemistry development,ontario,加拿大)计算得出。
[0085]
多胺的多个氮原子可为伯氨基、仲氨基、叔氨基和/或季氨基,它们也可为环体系的一部分。伯氨基、仲氨基、叔氨基和/或季氨基可出现于同一多胺分子中。伯氨基、仲氨基、叔氨基是优选的,这是由于它们可进行如上所述的烷基化。多胺可进一步包括端基(末端基团),该端基也可为氨基;然而,此类端基也可为用于制造多胺的聚合反应的引发剂或者终止基团。
[0086]
就某些直链多胺而言,内部氨基可为仲氨基;此类多胺的实例为多亚烷基亚胺。在
其它直链多胺中,氨基不是聚合物主链的一部分,而是侧链的一部分或者氨基自身形成侧链。就支链多胺而言,形成分支点的内部氨基通常为叔氨基,而不形成分支点的内部氨基通常为仲氨基。此类聚合物的分支通常被伯氨基终止。
[0087]
在下文中,描述了可用于制造本发明的多胺衍生物、特别是羧基烷基-烷基-多胺的多胺。在此之后,描述了本发明的多胺衍生物和羧基烷基-烷基-多胺。
[0088]
在第一通用实施方式中,可用于制备本发明的多胺衍生物和羧基烷基-烷基-多胺的多胺的多个氮原子为多胺的聚合物主链的一部分。多胺可为在聚合物链中具有多个氮原子的直链多胺。此类多胺可为包含多个式(1)所示单元的多亚烷基亚胺:
[0089]
(1)-[ch
2-nr
1-(ch2)
x
]-,
[0090]
其中x为1至10的整数以及r1为氢。在一个实施方式中,x可为1至5的整数,优选为1或2或3。在同一多胺分子的不同(ch2)
x
基团之间,x的值可相同或不同。例如,沿着多胺的聚合物链,x可在二个或三个不同的x值之间变化,如在x的值为2和3之间、为2和4之间或者为2和5之间。在式(1)所示的多胺中,聚合物链中基本上所有的氨基都为仲氨基。
[0091]
如果m为多亚烷基亚胺中式(1)所示的重复单元的数量,m可为12至100000、优选12至20000、更优选20至10000、最优选20至5000的整数。
[0092]
通过烷基化特别是通过亲核取代成为所述多胺衍生物的多胺部分的多胺的实例为多亚烷基亚胺,优选聚亚乙基亚胺、聚亚丙基亚胺、聚亚丁基亚胺或寡精胺或它们的同系物。多胺部分可包含每个多胺分子12至20000个氮原子,更优选20至10000个氮原子,或者如上对m所定义的。
[0093]
可选地,可通过烷基化特别是通过亲核取代成为所述多胺衍生物的多胺部分的多胺可为支链多胺,优选为支链的多亚烷基亚胺。此类支链的多亚烷基亚胺可通过具有下式(2)至(4)中每个的结构单元来定义:
[0094]-[ch
2-nr
1-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(2)
[0095]-[ch
2-nr
2-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(3)
[0096]-(ch2)
y-nr
32
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(4)
[0097]
其中
[0098]
r1和x如上所定义;
[0099]
r2包含式(2)、式(3)和/或式(4)的单元;
[0100]
r3表示氢;以及
[0101]
y为1至10的整数,其中在不同的(ch2)
y
基团之间,y的值可相同或不同。
[0102]
在支链的多亚烷基亚胺中,其主链可由包含仲氨基的式(2)所示的二价单元形成。另外,支链的多亚烷基亚胺特别是其主链包含至少1个式(3)所示的单元,该式(3)所示的单元包含作为分支点的与r2结合的叔氮。分支聚合物链包含至少一个、通常为多个的式(2)所示的单元,且可进一步包含一个或多个式(3)所示的单元,导致进一步的支化。因此,支链的多亚烷基亚胺可为树枝状大分子(dendrimer)或树枝化聚合物。在许多情况下,这些支链的多亚烷基亚胺以随机顺序包含结构成分(2)、(3)和(4),导致不规则的结构或者随机的多胺。式(4)所示的单价基团限定可存在于主链以及支链上的多亚烷基亚胺的端基。存在于多亚烷基亚胺中的式(2)、式(3)和式(4)中每个的多种结构中的x、r2以及r3可相同或不同。
[0103]
支链的多亚烷基亚胺中的支化度可为1至40%,优选为10至40%,更优选为15至
30%。本领域技术人员知道如何量化聚合物的支化,例如通过ph-滴定和量化不同区室的滴定曲线,或者通过1h-nmr测量。
[0104]
用于支链的多亚烷基亚胺中支化度的量度为伯氨基、仲氨基以及叔氨基的比例。当直链的多亚烷基亚胺仅仅具有仲氨基作为内部氨基时,支链的多亚烷基亚胺具有叔胺基如式(3)所示的叔氨基,该叔胺基的量随着增大支化度而增加。支链多胺中伯氨基的摩尔比可为1至40%,优选为15至30%。仲氨基的摩尔比可为15至85%,优选为30至70%。叔氨基的摩尔比可为1至40%,优选为15至30%。
[0105]
可成为所述多胺衍生物的多胺部分或所述羧基烷基-烷基-多胺的多胺部分的支链多胺的实例为支链的多亚烷基亚胺,优选为支链的聚亚乙基亚胺、支链的聚亚丙基亚胺、或支链的聚亚丁基亚胺。支链多胺如支链的多亚烷基亚胺可具有每多胺分子12至100000个氮原子,更优选20至20000个氮原子。在其它实施方式中,此类聚合物中氮原子的数量为每分子多胺20至5000个氮原子。
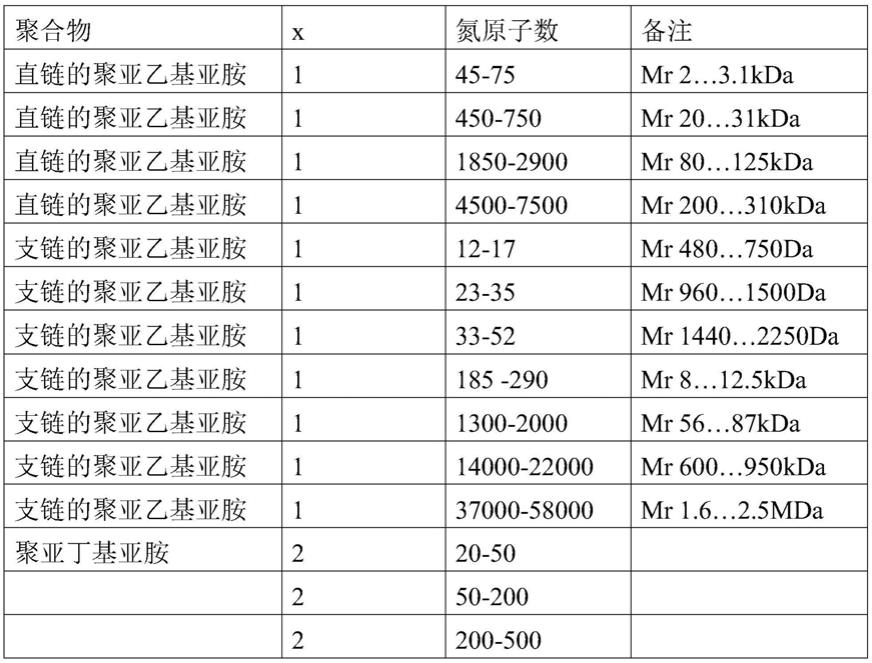
[0106]
在下面的表1中列出了用于生产本发明的多胺衍生物或羧基烷基-烷基-多胺的在中性ph值下的水介质中具有带电荷的主链的多胺的实例:
[0107]
表1:
[0108]
[0109][0110]
在表1中,mr表示用数均分子量(mn)表示的相对分子量。
[0111]
支链多胺的另一实例为具有cas号9002-98-6的下列结构的聚亚乙基亚胺:
[0112][0113]
n为使数均分子量mn约为10 000的整数。它可从sigma-aldrich商购获得,目录号为408727。其它支链多胺在实施例中列出。
[0114]
多胺也可形成多胺低聚物的多聚体装配物(multimeric assemblies)。多聚体装配物的实例记载于gosselin等人(2001)bioconj chem,12(6):989-994;lynn等人(2001)j am chem soc 123(33):8155-8156;等人的wo2007/020060、或者tanaka等人的wo2007/120479。
[0115]
在第二通用实施方式中,可用于制备本发明的多胺衍生物或羧基烷基-烷基-多胺的多胺的带电荷氮原子不是聚合物主链的一部分,而是存在于多胺的侧链中。在一些实施方式中,多胺可为聚乙烯的衍生物,例如聚烯丙基胺、聚乙烯胺、阳离子化聚丙烯酸酯或结构(5)所示的聚乙烯醚,
[0116]
(5)-[ch
2-chr4]
p-,
[0117]
其中
[0118]
r4选自-nh2、-ch
2-nh2、-o-ch
2-ch
2-nh2或-c(=o)o-r5,其中
[0119]
r5选自
–
ch
2-ch
2-nh2、
–
ch
2-ch
2-nh-ch3、-ch
2-ch
2-n-(ch3)2以及-ch
2-ch
2-n-(ch
2-ch3)2。
[0120]
变量p为表示聚合物大小的整数,并可在20至约50000之间变化。在优选的实施方式中,p在20至5000之间,在更优选的实施方式中,p在100至2000之间。
[0121]
在其它实施方式中,多胺为诸如聚赖氨酸、聚鸟氨酸、聚精氨酸等的多肽。这些多肽中的氨基酸残基的数量可为如上述对p所定义的。在又一些其它实施方式中,多胺可具有
糖主链,如壳聚糖。
[0122]
和第一通用实施方式一样,第二通用实施方式的聚合物也可为直链的、支链的或者为树枝状大分子类型,它们也可为多胺低聚物的多聚体装配物。
[0123]
在下面的表2中列出了用于第二普遍实施方式的具有带电荷的侧链的多胺的实例:
[0124]
表2
[0125][0126]
为了在转染中实现高性能,利用羧化取代基以及疏水取代基(例如利用羧基烷基和烷基取代基)对多胺如上面所述的那些多胺进行改性,以获得本发明的多胺衍生物。羧化取代基可包含至少6个碳原子。
[0127]
羧化取代基
[0128]
羧化取代基包含经由疏水连接体与多胺的氨基结合的羧基,所述疏水连接体可具有3至20、优选3至10以及更优选4至9的分配系数logp,该logp是对通过将所述连接体与多胺的羧基以及氨基结合的键替换为与氢原子结合的键由所述连接体获得的化合物测定的。测定logp的方法对本领域技术人员来说是已知的,并且包括通过实验测定水和1-辛醇之间的化合物分布,或者从诸如wikipedia(英文版本)的参考源获得这些值,或者利用诸如acd/labs7.0(advanced chemistry development,ontario,canada)的软件计算logp。
[0129]
羧化取代基可包含一个或两个羧基,优选一个羧基。每个羧化取代基包含6至40个碳原子,优选6至20个碳原子,以及更优选8至16个碳原子。所述羧化取代基的疏水连接体可包含1至3个、优选1个或2个选自o、n以及s的杂原子。优选地,杂原子选自o和s。在一个实施方式中,在疏水连接体中可包含1个或2个选自o、n以及s,优选选自o和s的杂原子。因此,羧化取代基可为羧基烃基基团,或者它们可为包含1至3个杂原子的羧基杂烃基基团,所述杂原子选自o、n以及s,优选选自o和s。在所述多胺衍生物分子的多个羧化取代基之中,可仅仅存在羧基烃基基团、仅仅存在羧基杂烃基基团,或者可存在羧基烃基基团以及羧基杂烃基基团。在一个实施方式中,多个羧化取代基全部为羧基烃基基团。在另一个实施方式中,多个羧化取代基全部为羧基杂烃基基团。
[0130]
当羧化取代基为羧基烃基基团时,所述羧基烃基基团的烃基部分可为饱和的脂肪族烃基部分、不饱和的脂肪族烃基部分、脂环族烃基部分、芳香族烃基部分、或者包含两个或多个来自上述清单基团的基团。
[0131]
羧基烃基基团的实例为羧基烷基基团、羧烯基基团、羧炔基基团、羧环烷基基团、
羧环烯基基团、羧基烷基环烷基基团、羧基环烷基烷基基团、羧基烷基环烷基烷基基团、羧芳基基团、羧基烷基芳基基团、羧芳基烷基基团以及羧基烷基芳基烷基基团。下文在疏水取代基的部分中也给出了与羧基基团结合的烃基基团的实例和定义。多个不同的此类烃基基团可进行结合。然而,上面给出的logp值和/或碳原子数量限定适用。
[0132]
可以利用氧、氮或硫替换羧化取代基的烃基部分的1、2或3个、优选1或2个碳原子,由此形成羧基杂烃基基团。可以理解,任何此类通过杂原子的形式取代将包括结合的氢原子的调整,以调整至交换的杂原子的化合价。在优选的实施方式中,疏水连接体中此类羧基杂烃基部分包含一个或多个选自-o-、-s-、-n(h)c(o)-、-c(o)o-、-oc(o)n(h)-、-c(o)-、-c(o)-n(h)-、-n(h)-c(o)-o-、-o-c(o)-或-s-s-的官能团。
[0133]
在本发明的一个方面,疏水连接体为亚烷基基团或包含亚烷基基团,如直链的或支链的亚烷基基团,或者连接体为亚环烷基基团或包含亚环烷基基团。亚烷基基团可为正亚烷基基团或异亚烷基基团。亚烷基基团的实例为亚丙基、亚丁基、亚戊基、亚己基、亚庚基、亚辛基、亚壬基、亚癸基、亚十一烷基、亚十二烷基、亚十四烷基或亚十六烷基。亚环烷基基团的实例为亚环戊基、亚环己基以及亚环庚基。烷基环烷基的实例为甲基亚环戊基、乙基亚环戊基、丙基亚环戊基、丁基亚环戊基、戊基亚环戊基、己基亚环戊基、甲基亚环己基、乙基亚环己基、丙基亚环己基、丁基亚环己基、戊基亚环己基以及己基亚环己基。这些中的一种或多种可在疏水连接体中组合。
[0134]
羧化取代基可为羧基烷基或羧基环烷基或者可包含羧基烷基或羧基环烷基,并包含6至20个。此类羧化取代基可选自由羧基-正烷基基团、支链的羧基烷基基团或环羧基烷基基团以及它们的结构或构象异构体所组成的组。在优选的实施方式中,羧基烷基为选自己酸、庚酸、辛酸、壬酸、葵酸、十一烷酸、十二烷酸、十四烷酸、十六烷酸、2-环己基乙酸、4-环己基丁酸、6-环己基己酸、2-(2’,3’或4’乙基环己基)-乙酸、或者4-(2’,3’或4’乙基环己基)-丁酸、或者6-(2’,3’或4’乙基环己基)-己酸的酸的酸根基团。
[0135]
在本发明的另一个方面,疏水连接体为亚芳基基团或者包含亚芳基基团并具有6至20个碳原子。形成所述亚芳基基团的芳基包括芳香族烃基基团(仅碳的芳基)和芳香族杂烃基基团(杂芳基)。前者的实例为苯基、萘基、蒽基以及菲基。含氮杂芳基优选应具有<5的pk值以避免在中性ph下额外的正电荷。此类含氮杂芳基的实例为吲哚基吡嗪基、哒嗪基、嘧啶基、噌啉基、酞嗪基和嘌呤基。形成羟基基团的含氧杂烃基基团优选具有pk>12以避免在中性ph下带有负电荷。
[0136]
烷基芳基基团的实例为甲基苯基(甲苯基)、乙基苯基、4-异丙基苯基和二甲苯基。芳基烷基(芳烷基)基团的实例为苯甲基、苯乙基和三苯甲基。烷基芳基烷基基团的实例为甲基苯甲基和4-异丙基苯甲基。
[0137]
羧基芳基烷基部分可例如为衍生自邻、间或对-甲基苯甲酸,或者邻-、间-或对-乙基苯甲酸的基团。羧基烷基芳基烷基部分可例如为邻-、间-或对-甲基苯乙酸。羧基烯基芳基烷基部分可例如为或者得自邻-、间-或对-甲基肉桂酸。
[0138]
在本发明的多胺衍生物上存在的多个羧化取代基如那些是或者包含羧基烷基基团的羧化取代基可相同或不同。为简单起见,它们可相同。羧化取代基的羧基基团可与疏水连接体的任何碳原子结合。优选地,羧基基团如下所示与碳原子结合:如果z为与结合多胺氮原子的碳原子结合的羧化取代基(如羧基烷基基团)中最长碳链的碳原子的数量,若将与
多胺氮结合的碳原子记为1位,则羧基基团在相距多胺氮多于z/2原子位置的位置与碳原子结合。如果z/2的值不是整数,上述规定导致该位置由>z/2的下一个整数来定义。在一个实施方式中,羧基基团与疏水连接体中相距已连接该疏水连接体(在羧基烷基基团的情况中为亚烷基链)的多胺氮原子最遥远(根据碳原子的数量)的碳原子结合。羧基基团可与羧化取代基(或羧基烷基基团)中相距多胺氮最远的碳原子结合,例如在直链的羧化取代基的情况中,羧基基团与羧化取代基(或羧基烷基基团)的末端(ω位)碳原子结合。
[0139]
倘若上文中给出的logp值得到满足,上文中给出的用于疏水连接体的可能基团可被取代。可选地,倘若如上所定义的碳原子数量和可能的杂原子的数量得到满足,上文中给出的用于疏水连接体的可能基团可被取代。
[0140]
疏水取代基
[0141]
疏水取代基可与多胺的氨基结合,并可具有1.5至20、优选2至15、更优选2.5至10的logp,该logp是对通过将所述疏水取代基与多胺的氨基结合的键替换为与氢原子结合的键由所述疏水取代基获得的化合物测定的。测定logp的方法对本领域技术人员来说是已知的,并且包括通过实验测定水和1-辛醇之间的化合物分布,或者从诸如wikipedia(英文版本)的参考源获得这些值,或者利用诸如acd/labs 7.0(advanced chemistry development,ontario,canada)的软件计算logp。
[0142]
疏水取代基包含2至40个碳原子,在一些方面包含3至40个碳原子,在优选的方面包含6至40个碳原子,以及在更优选的方面包含6至20个碳原子。在所述疏水取代基具有6个或更多个碳原子的情况下,疏水取代基可包含1至3个、优选1个或2个选自o、n和s的杂原子。优选地,杂原子选自o和s。因此,疏水取代基可为烃基基团或杂烃基基团,后者包含1至3个如前所述的杂原子。在所述多胺衍生物分子的多个疏水取代基之中,可只存在烃基基团,只存在杂烃基基团,或者可存在烃基基团以及杂烃基基团。在一个实施方式中,多个疏水取代基全部为烃基基团。在另一个实施方式中,多个疏水取代基全部为杂烃基基团。
[0143]
当疏水取代基为烃基基团时,它们可选自烷基基团、烯基基团、炔基基团、环烷基基团、环烯基基团、环烷基烷基基团、烷基环烷基基团、烷基环烷基烷基基团、芳基基团、烷基芳基基团、芳基烷基基团、和烷基芳基烷基基团以及包含上述清单中两个或多个基团的基团。在疏水取代基具有6个或更多个碳原子的情况下,可以利用氧、氮或硫,优选氧或硫,来替换所述烃基基团中的1、2或3个碳原子,由此形成杂烃基取代基。此类杂烃基取代基可包含选自-o-、-s-、-n(h)c(o)-、-c(o)o-、-oc(o)n(h)-、-c(o)-、-c(o)-n(h)-、-n(h)-c(o)-o-、-o-c(o)-或-s-s-的官能团。
[0144]
在本发明的一个方面,疏水取代基为烷基基团或者包含烷基基团,如直链的或支链的烷基基团、或者环烷基基团。烷基基团可为正烷基或异烷基基团。烷基基团的实例为丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十四烷基或十六烷基。环烷基基团的实例为环戊基、环己基和环庚基。
[0145]
烯基基团的实例为丙烯基、丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基、十一碳烯基、十二碳烯基、十四碳烯基和十六碳烯基。炔基基团的实例为丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基、十一碳炔基、十二碳炔基、十四碳炔基和十六碳炔基。
[0146]
环烯基基团的实例为环戊烯基、环己烯基和环庚烯基。
[0147]
环烷基烷基基团为其中环烷基基团联接至对应于烷基的亚烷基基团的基团。实例为环戊基甲基、环戊基乙基、环己基甲基、环己基乙基等。
[0148]
烷基环烷基基团为其中烷基基团联接至对应于环烷基基团的亚环烷基基团的基团。烷基环烷基基团的实例为甲基环戊基、乙基环戊基、丙基环戊基、丁基环戊基、戊基环戊基、己基环戊基、甲基环己基、乙基环己基、丙基环己基、丁基环己基、戊基环己基和己基环己基。
[0149]
烷基环烷基烷基基团为其中烷基基团联接至环烷基亚烷基基团的基团。
[0150]
在本发明的另一个方面,疏水取代基包含芳基基团并具有6至20个、优选7至15个碳原子。芳基基团包括芳香族烃基基团(仅碳的芳基)和芳香族杂烃基基团(杂芳基)。前者的实例为苯基、萘基和菲基。含氮杂芳基优选具有<5的pk值以避免在中性ph下带有额外的正电荷。此类含氮杂芳基的实例为吲哚基吡嗪基、哒嗪基、嘧啶基、噌啉基、酞嗪基和嘌呤基。形成羟基基团的含氧杂烃基基团优选具有pk>12以避免在中性ph下带有负电荷。
[0151]
烷基芳基基团的实例为甲基苯基(甲苯基)、乙基苯基、4-异丙基苯基、甲基吲哚基和二甲苯基。芳基烷基(芳烷基)基团的实例为苯甲基、苯乙基、吲哚基甲基和三苯甲基。烷基芳基烷基基团的实例为甲基苯甲基和4-异丙基苯甲基。
[0152]
多胺衍生物分子上的不同疏水取代基可相同或可不同。为简单起见,它们可相同。
[0153]
倘若对于取代的疏水取代基,如上所定义的碳原子数量和可能的杂原子的数量得到满足,上文中给出的用于疏水取代基的可能的基团可被取代。
[0154]
优选的多胺衍生物
[0155]
本发明的多胺衍生物可为包含下式(10)所示单元的直链的多亚烷基亚胺衍生物:
[0156]-[ch
2-nr
10-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀ
(10)
[0157]
其中
[0158]
x为1至10的整数,其中在不同的(ch2)
x
基团之间,x的值可相同或不同,
[0159]
r
10
为氢,
[0160]
羧化取代基,所述羧化取代基包含经由疏水连接体(如上所定义的)与r
10
所结合的氨基氮结合的羧基,或者
[0161]
如上所定义的疏水取代基,
[0162]
当所述多亚烷基亚胺分子中出现不同的r
10
时,其独立地选自上述基团。
[0163]
每分子所述直链的多亚烷基亚胺或多胺衍生物另一个多胺部分的氮原子数量可为12至100000,优选12至20000,更优选20至10000,以及最优选20至5000。多次出现的r
10
可相同或不同。
[0164]
上面通过聚合物链的重复单元定义的直链的多胺衍生物具有端基,所述端基通常在生产所涉及的多胺中形成。因此,本发明对于端基没有限制。在直链的聚亚乙基亚胺的情况下,可为羟乙基端基。端基的实例为下面所定义的r8的那些。
[0165]
可选地,本发明的多胺衍生物为支链的多亚烷基亚胺衍生物,所述支链的多亚烷基亚胺衍生物包含式(11)、式(12)和式(13)中每个所示的单元:
[0166]-[ch
2-nr
10-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(11)
[0167]-[ch
2-nr
11-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(12)以及
[0168]-(ch2)
y-nr
102
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(13)
[0169]
其中
[0170]
r
10
和x如上所定义;
[0171]
r
11
包含一个或多个选自式(11)、式(12)和式(13)的单元;
[0172]
y为1至10的整数,其中在不同的(ch2)
y
基团之间,y的值可相同或不同;以及
[0173]
其中每分子所述直链的或所述支链的多亚烷基亚胺的氮原子数目为12至100000。
[0174]
每分子所述支链的多亚烷基亚胺的氮原子数量可如上面对直链的多亚烷基亚胺所定义的。端基的实例为下面所定义的r8的那些。支链的多亚烷基亚胺中的支化度可为1至40%,优选为10至40%,更优选为15至30%。本领域技术人员知道如何量化聚合物的支化,例如通过ph-滴定和量化不同区室的滴定曲线,或者通过1h-nmr分析。
[0175]
多胺衍生物中羧化取代基和疏水取代基的组合可通过它们的摩尔比表征。发现如果羧化取代基和疏水取代基的摩尔比为10:1至0.1:1(c/a比),本发明的多胺衍生物(如聚亚乙基亚胺衍生物)表现最好。在优选的实施方式中,这些基团的c/a比为3:1至0.33:1。
[0176]
当接枝到多胺时,取代度(dos)为另一个相关的特征。dos定义为多胺的每个氨基中羧化取代基和疏水取代基的总数的摩尔百分比。dos为至少10%,优选25至80%,更优选30至60%。本领域技术人员知道如何测定多胺衍生物的dos。这可通过例如使用茚三酮反应测量聚合物上的残余氮原子来实现。另一种可能性是使用1h-nmr波谱法。
[0177]
在一些方面,利用每分子多胺衍生物中一种具体类型的羧化取代基和一种具体类型的疏水取代基的组合来实施本发明。在这些方面,一个羧化取代基的碳原子加上一个疏水取代基的碳原子的总数为10至30,优选地,该总数为15至25。
[0178]
在进一步的方面,在多胺类型、多胺分子量、羧化取代基的大小以及疏水取代基的大小之间进行具体组合。在此方面的一个优选实施方式中,多胺衍生物具有2至500kda(数均分子量)的直链的聚亚乙基亚胺基团,羧化取代基具有11至16个碳原子且为正烷基羧酸,以及疏水取代基具有3至12个碳原子且为烷基,优选为正烷基或烷基环己基。
[0179]
在其它优选的实施方式中,多胺衍生物具有0.5至200kda(数均分子量)的支链的聚亚乙基亚胺基团,羧化取代基具有11至16个碳原子且为正烷基羧酸,以及疏水取代基具有6至12个碳原子且为烷基,优选为正烷基或烷基环己基。
[0180]
在进一步优选的实施方式中,多胺衍生物具有2至500kda(数均分子量)的直链的聚亚乙基亚胺基团,羧化取代基具有11至16个碳原子且为正烷基羧酸,以及疏水取代基具有6至12个碳原子且为芳基,优选选自包含苯甲基、异丙基苯甲基、萘基或吲哚基部分的芳基。
[0181]
在其它优选的实施方式中,多胺衍生物具有0.5至200kda(数均分子量)的支链的聚亚乙基亚胺基团,羧化取代基具有11至16个碳原子且为正烷基羧酸基团,以及疏水取代基具有6至12个碳原子且为含芳基基团,优选选自包含苯甲基、异丙基苯甲基、萘基或吲哚基部分的基团。
[0182]
在又一些其它优选的实施方式中,多胺衍生物具有1至10kda(数均分子量)的直链的寡精胺或寡精胺同系物部分,羧化取代基具有11至16个碳原子且为正烷基羧酸基团,以及疏水取代基具有4至10个碳原子且为烷基,优选为正烷基。
[0183]
在一个实施方式中,本发明的多胺衍生物为羧基烷基-烷基多胺。烷基部分包含至少2个碳原子。在本发明的一些方面,烷基部分具有3至40个碳原子。在优选的方面,烷基部
分为具有6至40个碳原子的直链烷基,在更优选的方面,碳原子的数量为6至20。在多胺上存在的多个烷基可相同或不同。在本发明的其它方面,烷基部分也包含芳香环并具有6至40个碳原子。
[0184]
羧基烷基-烷基-多胺
[0185]
羧基烷基-烷基-多胺可为直链的羧基烷基-烷基-多亚烷基亚胺,所述直链的羧基烷基-烷基-多亚烷基亚胺包含式(6)所示的单元或者基本上由式(6)所示的单元组成:
[0186]-[ch
2-nr
6-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(6),
[0187]
其中x为1至10的整数,其中在不同的(ch2)
x
基团之间,x的值可相同或不同;r6为氢、式c
r
h
2r+1
所示的烷基基团或式c
s-1
h
2s-2
cooh所示的羧基烷基基团。在所述羧基烷基-烷基-多胺分子中出现不同的r6时,其独立地选自上述基团;r为2至40的整数以及s为4至40的整数。对于x的优选的实施方式是如下在式(1)的情况中所定义的。数字r优选为6至40,更优选为6至20。数字s优选为4至20,更优选为6至20,以及更加优选为8至16。
[0188]
每分子所述直链的羧基烷基-烷基-多亚烷基亚胺的氮原子数量可为12至100000,优选为12至20000,更优选为20至10000,以及最优选为20至5000。
[0189]
如上通过聚合物链重复单元定义的直链的羧基烷基-烷基-多胺具有一般如在生产所涉及的(underlying)多胺中形成的端基。因此,本发明对于端基没有限制。端基的实例为下面所定义的r8的那些。
[0190]
可选地,所述羧基烷基-烷基-多胺为支链的羧基烷基-烷基-多亚烷基亚胺。支链的羧基烷基-烷基-多亚烷基亚胺可包含式(7)、式(8)和式(9)中每种所示的结构单元:
[0191]-[ch
2-nr
6-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(7)
[0192]-[ch
2-nr
7-(ch2)
x
]
-ꢀꢀꢀꢀꢀꢀꢀ
(8)
[0193]-(ch)
y-nr
62
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(9)
[0194]
其中
[0195]
r6、x、r以及s如上所定义;
[0196]
r7包含一个或多个选自式(7)、式(8)和式(9)的结构;
[0197]
y为1至10的整数,优选为2至10的整数,更优选为2至6的整数,其中在不同出现的(ch2)
y
基团中,y的值可相同或不同。
[0198]
r7可为式(9)所示的基团或者r7包含一个或多个式(7)和/或式(8)所示的单元。r7包含一个或多个式(7)所示的单元以及一个或多个式(8)所示的单元也是可以的。由于羧基烷基-烷基-多亚烷基亚胺为聚合的,它的一个分子通常包含多个在结构上不同的基团r7。
[0199]
每分子所述支链的羧基烷基-烷基-多亚烷基亚胺的氮原子数量为12至100000,优选为20至20000,更优选为20至10000,以及最优选为20至5000。
[0200]
支链的多亚烷基亚胺中的支化度可为1至40%,优选为10至40%,更优选为15至30%。本领域技术人员知道如何量化聚合物的支化,例如通过ph-滴定和量化不同区室的滴定曲线。
[0201]
上述羧基烷基-烷基-多亚烷基亚胺中羧基烷基和烷基的摩尔比可如下所定义。取代度(dos)也可如下所定义。
[0202]
在一些方面,采用羧基烷基和烷基部分的具体组合来实施利用羧基烷基-烷基-多亚烷基亚胺的本发明。在优选的实施方式中,羧基烷基基团与脂肪族烷基基团组合,且两个
部分中碳原子的总数为10至30,在更优选的实施方式中,该总数为15至20。在这些实施方式中,一种类型的羧基烷基基团优选与一种类型的烷基基团组合。
[0203]
在进一步的方面,在多胺类型、多胺分子量、羧基烷基基团的长度以及烷基基团的长度之间进行具体组合。在此方面的一个更优选实施方式中,多胺为具有2至30kda(数均分子量)的直链的聚亚乙基亚胺,羧基烷基基团具有8至16个碳原子以及烷基具有6至16个碳原子。更加优选的是其中羧基烷基基团具有10至16个碳原子和烷基具有约9个碳原子的组合。在另一个优选的实施方式中,聚亚乙基亚胺为具有约10kda的支链的聚合物,羧基烷基基团具有8至16个碳原子以及烷基具有6至16个碳原子,更优选约9个碳原子。
[0204]
羧基烷基-烷基-多胺中羧基烷基和烷基基团的组合可通过它们的摩尔比表征。发现,如果羧基烷基部分和烷基部分的摩尔比为6:1至0.33:1(c/a比),本发明的羧基烷基-烷基-多胺(如羧基烷基-烷基-聚亚乙基亚胺)表现最好。在优选的实施方式中,这些基团的c/a比为3:1至0.8:1。在更优选的实施方式中,多胺为被c11羧基烷基基团和c9烷基基团取代的聚亚乙基亚胺,其中c/a比为2:1至0.5:1,更优选为约1。
[0205]
当接枝到聚合物时,取代度(dos)为另一个相关的特征。dos定义为多胺的每个氨基中羧基烷基部分和烷基部分总和的摩尔百分比。dos为至少10%,优选为25至80%,更优选为30至60%。本领域技术人员知道如何测定多胺衍生物的dos。这可通过测量聚合物上的残余氮原子来实现,例如使用茚三酮反应。另一种可能的方法是使用1h-nmr波谱。
[0206]
在一个特别优选的实施例中,多胺为被c11羧酸和c9烷基基团取代的聚亚乙基亚胺,其中c/a比为2:1至0.5:1,以及dos为35至45%。
[0207]
下表3列出了多胺衍生物的一些具体实施方式。缩写或符号名称的清单参见实施例11和15。
[0208]
表3
[0209]
[0210][0211]
贯穿本申请的整个说明书,以不带电荷的或非离子化的形式给出结构式。但是,对本领域技术人员来说这些结构的氮原子可为质子化的,特别是在水溶液中。因此,通过这些式中的任一个所定义的化合物也包含其中任一氮原子为带电荷状态的化合物或离子。
[0212]
多胺衍生物的制造
[0213]
可利用上述羧化取代基和疏水取代基对上述任一多胺进行改性来制备本发明的多胺衍生物。这些方法是本领域公知的并在实施例中进一步说明。例如,通过在碱性条件下利用卤代羧酸和卤代疏水化合物使多胺衍生化,羧化取代基和疏水取代基经由它们相应的卤代化合物引入。优选溴作为这些化合物中的卤素原子。在优选的实施方式中,这通过使用诸如溴代烷烃或溴代芳基化合物的α,ω-溴代羧酸和溴代化合物作为卤代化合物来实现。可利用卤代羧酸和卤代疏水化合物的混合物连续地或并行地进行这两种衍生化。适当地选择卤代羧酸和卤代疏水化合物的混合比例以达到待制备的多胺衍生物中羧基和疏水基团所期望的摩尔比。近似地,并行改性反应中卤代羧酸和卤代疏水化合物的摩尔混合比对应于多胺衍生物中羧化取代基和疏水取代基的摩尔比。可分析所得产物中羧化取代基和疏水部分的摩尔比,例如通过1h-nmr。可采用所实测的摩尔比与所期望的摩尔比之间的偏差来调整卤代羧酸和卤代疏水化合物的混合比例,从而获得被所期望摩尔比的这些取代基取代的改性多胺。对本领域技术人员显而易见的是,可达到所期望的取代度(dos)并且必要时以类似的方式通过使用适宜的卤代羧酸和卤代疏水化合物相对于多胺的量的摩尔量进行调整。反应通常在有机溶剂、优选极性有机溶剂如乙醇中进行。在其它实施方式中,通过酰化作用利用相应的二羧酸、它们的酸酐或氯化物或者通过michael-加成利用羧酸和卤代疏水化合物各自的不饱和衍生物,来实现羧化取代基和疏水取代基的引入。
[0214]
本发明的多胺衍生物不同于现有技术中记载的化合物。wakefield等人(2005)bioconj chem 16(5):1204-1208报道了来自氨基乙基-乙烯醚和具有1至4个碳原子的烷基的烷基-乙烯醚的共聚物。相对于本发明,wakefield的聚合物不包含羧基基团,因而聚合物上缺少了必要类型的官能团。本发明的多胺衍生物也不同于van vliet等人(2008)在chembiochem,2008,9,1960-1967中展示的改性聚亚乙基亚胺。在那里,利用十二烷基、苯甲基和甲基部分对聚亚乙基亚胺进行了系统地改性。同样,在van vliet中未应用本发明的必要的羧基烷基基团。除此之外,通过使用甲基碘,广泛形成了季铵化氨基。
[0215]
相对于wakefield或van vliet,wo08/074488和oskuee等人(2010)j gene med 12:729-738都没有提及使用额外的烷基基团。实际上,wo08/074488明确区分了羧基烷基基团的应用(其中的tee’s)和通过烷基化达到的仅疏水改性(a2文件的第60页)。另一方面,oskuee教导了羧基化的效果是通过减少表面电荷(一个不通过烷基化介导的特征)介导的。
[0216]
本发明的多胺衍生物作为转染剂的用途
[0217]
本发明的多胺衍生物如羧基烷基-烷基-多胺用于将聚阴离子转染至细胞中,因此,这些多胺衍生物在本文中也被称为本发明的转染剂。
[0218]
聚阴离子可选自肽、蛋白质和核酸的组。在一些实施方式中,聚阴离子为选自抗体的蛋白质。在具体实施方式中,抗体是igg型。在其它实施方式中,使用抗体片段,例如fab、fab’、二硫化物连接的f(ab’)2片段、或化学连接的f(ab’)2片段或scfv片段。在优选的实施方式中,聚阴离子为核酸。
[0219]
本文中所用的核酸为多核苷酸或寡核苷酸,包括但不限于dna或rna或者其衍生物或类似物。本文中所用的多核苷酸是指任何多核糖核苷酸或多脱氧核糖核苷酸,其可为未改性的rna或dna、或者为改性的rna或dna、或者为混合的dna/rna。多核苷酸可为单链的或双链的。双链多核苷酸的一个实例为质粒,单链多核苷酸的一个实例为mrna。本文中所用的寡核苷酸定义为具有两个或多个、通常多于三个、以及通常多于10个但少于100个核苷酸的
分子,其可为未改性的rna或dna、或者为混合的dna/rna、或者为改性的rna或dna,其中所述改性包括例如可见于lna(锁核酸)的环桥接、核苷的2’位的各种改性例如2’me,2’ome,2’moe,2’f等,或者其中使用除核糖以外的糖,如在2’fana核苷酸中使用阿拉伯糖、在解锁核酸或己糖醇结构中使用甘油。寡核苷酸的大小可取决于许多因素,包括寡核苷酸的最终用途。寡核苷酸的典型实例为sirna、反义抑制剂、mirna、dna酶、适体等。基本上,在其主链上携带负电荷的所有核酸都可与本发明的转染剂兼容使用,这包括各种主链改性的核酸,例如那些含有硫代磷酸酯键或二硫代磷酸酯键的核酸。相比之下,不带电荷的核酸如由甲基膦酸酯或肽-核酸(pna’s)构建的那些与本发明的转染剂不太兼容。
[0220]
为转染核酸或其它聚阴离子,通常制造核酸(或其它聚阴离子)和转染剂之间的复合物。形成转染试剂和聚阴离子之间的复合物是本领域技术人员公知的。通常,这可通过使包含转染剂的第一溶液与包含聚阴离子或核酸的第二溶液结合来实现。通常,由转染剂提供的正电荷的数量高于聚阴离子上的负电荷的数量。该比例在本领域中被称为n/p比,其中n表示转染剂上形式氮电荷的数量以及p表示核酸上磷酸基团的数量。在一些实施方式中,多胺衍生物和核酸联合使用的n/p比为2至20。在优选的实施方式中,该比例为5至15,以及在更优选的实施方式中n/p比为约10。
[0221]
在其它的实施方式中,n/p比为2至6,更优选为约4。依据n/p比,核酸和多胺衍生物之间的复合物可具有不同的电荷以及不同的颗粒尺寸。如通过zeta电位测量法测定的,n/p值为约10或更高的复合物具有中性或微正的表面电荷。如通过动态光散射测定的,此类复合物的颗粒尺寸为200至1000nm,在优选的实施方式中为250至500nm。
[0222]
如通过zeta电位测量法测定的,n/p为约6或更低的复合物具有中性或负的表面电荷。如通过动态光散射测定的,n/p为约6或更小的复合物的颗粒尺寸为50至500nm,在优选的实施方式中为100至200nm。
[0223]
粒子的颗粒尺寸和表面电荷是粒子在脊椎动物、哺乳动物或人类的体循环中分布的决定因素,这是本领域技术人员众所周知的。尺寸为150nm或之下的粒子能够从血流中到达肝实质,而大粒子被排除。相比之下,高达约500nm的更大粒子可到达肿瘤、炎症部位或脾中的基质细胞。
[0224]
通常进行本发明的转染剂和待转染的聚阴离子之间的复合物形成。聚阴离子如核酸之间的复合物形成涉及与转染剂的电荷相互作用。此相互作用在ph范围介于3至9之间的水溶液中实现,其中两个复合物搭档都是离子化的。在一些实施方式中用于复合物形成的ph为4至8,在优选的实施方式中所述ph为5至7。通过使用一种或多种缓冲物质调节复合物形成溶液的ph。原则上,可使用pk在上述范围内且对细胞无毒性的任何缓冲物质。在优选的实施方式中,使用基于乙酸盐、马来酸盐、琥珀酸盐、碳酸盐、磷酸盐、柠檬酸盐、甲基乙基磺酸盐(mes)、bis-tris、bis-tris-丙烷、三(羟甲基)氨基甲烷(tris-(hydroxymethyl)aminomethan)、两性离子缓冲剂(tricine)的缓冲剂或者诸如hepes、tes、mops、bes、mopso、aces、pipes、ada、hepps的good系列的缓冲剂。更优选的缓冲剂为乙酸盐、磷酸盐、柠檬酸盐或hepes。
[0225]
其中发生复合物形成的溶液可包含其它成分,如盐或糖,只要这些物质不与复合物形成对抗或者对细胞没有毒性。在优选的实施方式中,限制盐的量以使溶液的总离子强度低于0.2mol/l,在更优选的实施方式中离子强度低于0.1mol/l。被细胞良好耐受的盐为
氯化钠。对于寡核苷酸的结合,优选低于0.1mol/l的低离子强度,而对于利用多核苷酸如质粒或mrna的复合物形成,离子强度可更高一些。
[0226]
为避免向细胞添加转染复合物期间的渗透应力,可向复合物形成溶液中添加糖以调节渗透压。在一些实施方式中,限制糖的添加以使添加至细胞中的溶液的总渗透压为150至500mosm/l,在优选的实施方式中,渗透压为270至310mosm/l。在优选的实施方式中,使用葡萄糖,蔗糖或海藻糖调节转染混合物的渗透压。
[0227]
出乎意料地发现也可使用某些具有未知组成的某些介质制备转染混合物。在许多情况下,可利用细胞培养基如dmem、optimem(life technologies公司的商标)等来制备转染混合物。
[0228]
本发明的的转染剂可在水或缓冲溶液中具有有限的溶解度。溶解度为ph和本发明的多胺衍生物的伴随离子化的函数。作为一般规则,这些化合物在酸化的水中(例如在ph为7或更低的介质中)具有更好的溶解度。相比之下,多胺衍生物在9或更高的ph下易溶于醇类,例如乙醇、丙醇、1,2-二羟基丙烷或异丙醇(这些在本文中也被统称为“短链醇”)。依据ph,也可以使用短链醇与水的混合物作为溶剂,例如对于较少离子化形式的转染剂,使用含有33至100%的乙醇、丙醇、1,2-二羟基丙烷或异丙醇的混合物,或者对于较多离子化形式的转染剂,使用含有0至66%的所述醇类的混合物。在某些实施方式中,转染剂作为在低级醇如短链醇中包含20至200mm(基于转染剂中的氮原子)的转染剂的储备液来储存。然后可通过将储备液稀释到含水缓冲溶液中,生成转染剂的约0.1mm至5mm的工作浓度。通常,短链醇不需要从转染混合物中去除并被细胞耐受。
[0229]
在具体实施方式中,依照以下转染方案使用转染剂:
[0230]
1)以在33至100%乙醇、优选70%乙醇中的50mm溶液(基于氮含量)的形式提供多胺衍生物。
[0231]
2)制备包含10mm磷酸二氢钠和3mm氢氧化钠的转染缓冲剂。
[0232]
3)将改性的多胺在转染缓冲剂中稀释至1mm溶液。
[0233]
4)将sirna在转染缓冲剂中稀释至22μm sirna。由于sirna上磷酸基的平均数量为约45,磷的总浓度为约1mm。
[0234]
5)将多胺和sirna的工作溶液以10+1比例合并,使n/p比为10以及复合混合物(complexation mixture)中sirna的浓度为2μm。
[0235]
6)在每100μl培养细胞的培养基中添加高达20μl的(5)中制备的转染混合物。
[0236]
在可选的实施方式中,利用以下通用方案使用转染剂:
[0237]
1)以在33至100%、优选70%乙醇中的50mm溶液(基于单体重量)的形式提供多胺衍生物。
[0238]
2)制备包含10mm柠檬酸和19mm氢氧化钠的转染缓冲剂。
[0239]
3)将改性的多胺在转染缓冲剂中稀释至1.8mm溶液。
[0240]
4)将sirna在转染缓冲剂中稀释至4μm sirna。
[0241]
5)将多胺和sirna的工作溶液以1+1比例合并,使n/p比为约10以及复合(complexation)期间sirna的浓度为2μm。
[0242]
6)在每100μl培养细胞的培养基中添加高达20μl的(5)中制备的转染混合物。
[0243]
可使用以下通用方案3来制备具有小颗粒尺寸的转染剂:
[0244]
1)以在33至100%乙醇、优选70%乙醇中的56mm溶液(基于氮含量)的形式提供多胺衍生物。
[0245]
2)制备包含10mm磷酸二氢钠和3mm氢氧化钠的转染缓冲剂。
[0246]
3)将sirna在转染缓冲剂中稀释至18μm sirna。由于sirna上磷酸基的平均数量为约45,磷的总浓度为约0.75mm
[0247]
4)将sirna溶液以20+1比例直接添加至改性的多胺中,使n/p比为4以及复合混合物中sirna的浓度为17μm。
[0248]
5)将高达10μl的转染混合物添加至每100μl培养细胞的培养基中或者施用给动物。
[0249]
虽然经常进行从两种溶液制备转染复合物,但需要分别制备包含转染剂和核酸的溶液。为了使其在细胞培养中起作用,溶液需为清洁的或无菌的;它们也可具有有限的保质期。进一步的改进是使用干转染剂,该干转染剂在使用之前利用转染缓冲剂重构。为达到该目的,可将转染剂从其在短链醇的溶液中干燥。此方法的特别益处在于提供具有很长保质期的小的且限定为等分部分的转染剂。可利用转染缓冲剂将干转染剂再水化。在一些实施方式中,也可利用已经包含核酸的溶液将干转染剂再水化。
[0250]
在其它实施方式中,以冻干的形式提供转染剂。在此实施方式的优选方面,转染剂由溶液冻干,该溶液包含被调节到ph为5至7之间的缓冲体系以及进一步包含一定量的糖以得出重构时总渗透压为100至500mosm/l,例如270mm蔗糖或海藻糖或葡萄糖。在该实施方式中,核酸以稀的水溶液形式提供并直接用于冻干转染剂的重构,以便在单个步骤中发生水化和复合物形成。之后可将所得的转染混合物直接添加至待转染的细胞中。
[0251]
本发明的转染剂可以试剂盒的形式在市场上销售,该试剂盒任选地进一步包含用于控制反应的sirna。
[0252]
在第一实施方式中,试剂盒包含以下:
[0253]
a)在短链醇中的转染剂溶液,其中醇可为70%乙醇,且转染剂可具有约50mm的浓度(基于转染剂中的氮原子),
[0254]
b)ph值介于4至8之间且离子强度低于0.2、优选低于0.1的缓冲溶液,
[0255]
c)具有完整使用说明的手册,任选地具有简要使用说明的短手册。
[0256]
在第二实施方式中,此试剂盒包含以下:
[0257]
a)如第一个实施方式中所述的转染剂溶液,其中该溶液被分成等分部分。优先地,等分部分的数量为5至100,更优选的等分部分数量为6至20。进一步优选的是各等分部分包含10至1000nmol转染剂(基于单体),
[0258]
b)ph值介于4至8之间且离子强度低于0.2、优选低于0.1的缓冲溶液,
[0259]
c)具有完整使用说明的手册,任选地具有简要使用说明的短手册。
[0260]
在第三实施方式中,此试剂盒包含以下:
[0261]
a)如第一个实施方式中所述的转染剂溶液,其中该溶液被分成等分部分,以及其中这些等分部分排列在具有6至1576个孔,优选24、96或384个孔的微板中,以及其中各等分部分包含10至1000nmol转染剂,
[0262]
b)ph值介于4至8之间且离子强度低于0.2、优选低于0.1的缓冲溶液,
[0263]
c)具有完整使用说明的手册,任选地具有简要使用说明的短手册。
[0264]
在第四实施方式中,此试剂盒包含以下:
[0265]
a)被分成等分部分的干转染剂。优先地,等分部分的数量为5至100,更优选的等分部分数量为6至20。进一步优选的是各等分部分包含10至1000nmol转染剂(基于单体),
[0266]
b)ph值介于4至8之间且离子强度低于0.2、优选低于0.1的缓冲溶液,
[0267]
c)具有完整使用说明的手册,任选地具有简要使用说明的短手册。
[0268]
在第五实施方式中,此试剂盒包含以下:
[0269]
a)被分成等分部分的干转染剂,其中这些等分部分排列在具有6至1576个孔的微板中,优选微板具有24、96或384个孔,以及其中各等分部分包含10至1000nmol转染剂,
[0270]
b)ph值介于4至8之间且离子强度低于0.2、优选低于0.1的缓冲溶液,
[0271]
c)具有完整使用说明的手册,任选地具有简要使用说明的短手册。
[0272]
在第六实施方式中,此试剂盒包含以下:
[0273]
a)被分成等分部分的冻干转染剂。优先地,等分部分的数量为5至100,更优选的等分部分数量为6至20。进一步优选的是各等分部分包含10至1000nmol转染剂(基于单体),
[0274]
b)ph值介于4至8之间且离子强度低于0.2、优选低于0.1的缓冲溶液,
[0275]
c)具有完整使用说明的手册,任选地具有简要使用说明的短手册。
[0276]
在第七实施方式中,此试剂盒包含以下:
[0277]
a)被分成等分部分的冻干转染剂,其中这些等分部分排列在具有6至1576个孔,优选24、96或384个孔的微板中,以及其中各等分部分包含10至1000nmol转染剂
[0278]
b)ph值介于4至8之间且离子强度低于0.2、优选低于0.1的缓冲溶液,
[0279]
c)具有完整使用说明的手册,任选地具有简要使用说明的短手册。
[0280]
在第三、第五和第七实施方式的某些方面,此微板的所有孔都包含相同量的转染剂。在其它方面,孔包含不同量的转染剂。这样的设计可涉及转染剂在相邻孔中的梯度,这在用核酸优化n/p比的过程中非常有用。在其它方面,某些孔可为空的,例如,用于从复合混合物中生成一系列的稀释液。图1至图4进一步说明了此类例如在96孔板上具有排列量的转染剂的设计。
[0281]
在又一些实施方式中,形成并冻干本发明的多胺衍生物与一种或多种核酸的复合物并将其作为完整产品在市场上销售。相对于目前的商业化产品,该溶液提供更高的集成度。它还提供了在制造商的场地上使产品的质量控制包括其粒子形成集中化的机会。冻干复合物的其它优点在于它们的长期储存稳定性和不使用短链醇作为改性多胺的溶剂。
[0282]
多胺衍生物和一种或多种核酸之间的冻干复合物具有特别的用于体内应用包括动物研究或者用于治疗用途的优点。
[0283]
冻干复合物可利用包括在络合之后冻干和再水化步骤的上述通用方法1至3中的任一种方法来制造。
[0284]
在具体实施方式中,本发明的改性的多胺与一种或多种核酸之间的复合物依照以下方案4来制备:
[0285]
1)以在33至100%乙醇中的50mm溶液(基于氮含量)的形式提供改性的多胺
[0286]
2)制备包含10mm磷酸二氢钠和3mm氢氧化钠的转染缓冲剂。
[0287]
3)将改性的多胺在转染缓冲剂中稀释至1mm溶液。
[0288]
4)将sirna在转染缓冲剂中稀释至22μm sirna。由于sirna上磷酸基的平均数量为
约45,磷的总浓度为约1mm。
[0289]
5)将多胺和sirna的工作溶液以10+1比例合并,使n/p比为10以及复合混合物中sirna的浓度为2μm。
[0290]
6)将复合物任选地分割成等分部分、冻干、气密密封并储存。
[0291]
7)利用水将冻干复合物再水化。
[0292]
8)在每100μl培养细胞的培养基中添加高达20μl的再水化复合物或者将再水化复合物施用给动物或人类。
[0293]
在具体实施方式中,本发明的改性的多胺与一种或多种核酸之间的复合物依照以下方案5来制备:
[0294]
1)以在33至100%乙醇中的56mm溶液(基于氮含量)的形式提供改性的多胺。
[0295]
2)制备包含10mm磷酸二氢钠和3mm氢氧化钠的转染缓冲剂。
[0296]
3)将sirna在转染缓冲剂中稀释至18μm sirna。由于sirna上磷酸基的平均数量为约45,磷的总浓度为约0.75mm。
[0297]
4)将sirna溶液以20+1比例直接添加至改性的多胺中,使n/p比为4以及复合混合物中sirna的浓度为17μm。
[0298]
5)将复合物任选地分割成等分部分、冻干、气密密封并储存。
[0299]
6)利用水将冻干复合物再水化。
[0300]
7)在每100μl培养细胞的培养基中添加高达10μl的再水化复合物或者将再水化复合物施用给动物或人类。
[0301]
将复合的核酸施用于动物或人类是本领域技术人员公知的,以及复合的核酸可以具体适应症所需的剂量全身施用或者局部施用。所施用的核酸的量可在每kg体重0.1μg至100mg之间变化,并且可一次或多次或者以复杂的或间歇性的给药方案来施用,例如每日给药、隔日或者每周三次、每周一次或每月一次给药、或者这些方案的组合给药。
附图说明
[0302]
图1-图4:附图示出了转染剂在微板中排列的各种方案。示意性微板中的数量表示放置于每个孔中的转染剂的量,以nmol表示(基于氮原子)。附图以96孔板为例,并将转染剂放置在某些垂直行中。可以理解的是,从该通用结构可容易地衍生出相似的方案,例如,其中图案在水平上为有组织的、利用更多或更少的空孔、局部应用板等等。
[0303]
图1,放置于96孔板的某些孔中的转染剂的量,以nmol表示,均匀分布。
[0304]
图2,放置于96孔板的某些孔中的转染剂的量,以nmol表示,以简化n/p比的优化。
[0305]
图3,放置于微板的某些孔中的转染剂的量,以nmol表示,包括用于系列稀释转染复合物的空孔。
[0306]
图4,放置于微板的某些孔中的转染剂的量,以nmol表示,促进n/p比的简单优化和转染复合物的系列稀释。
实施例
[0307]
本发明现在通过下列实施例来作进一步说明,但不限于此。
[0308]
实施例1
–
多胺的改性
[0309]
平均分子质量为2kda或25kda的直链的pei(游离碱)分别得自polysciences,目录项24313和23966。10kda大小的支链的pei(游离碱)得自aldrich,目录项408727。将聚合物以250mono-mm的浓度溶解于无水乙醇中;即氮的浓度为250mm。将丙基溴、己基溴、壬基溴和十二烷基溴(全部得自sigma)以250mm的浓度溶解于无水乙醇中,以及将3-溴丙酸甲酯、6-溴己酸甲酯、8-溴辛酸乙酯、11-溴代十一酸甲酯或16-溴代十六酸甲酯以500mm的浓度溶解于无水乙醇中。以6m水溶液使用k2co3。
[0310]
对于100μmol多胺(基于单体)的改性,每个反应用移液管吸取以下溶液:
[0311]-400μl多胺溶液
[0312]-xμl的ω-溴代羧酸酯
[0313]-yμl的1-溴代烷烃
[0314]-高达650μl的乙醇(wthanol)
[0315]-33μl k2co3[0316]
将所有的混合物密封并在烘箱中于60℃下孵育7天。之后,加入250μl的2n naoh,将混合物再次密封并在60℃下再孵育2天。对于最初的测试,取用小等分部分的反应混合物并在75%乙醇/水中按1:100稀释。将42μl的各稀释样品转移至96孔板中并干燥。
[0317]
实施例2与sirna复合
[0318]
将改性的多胺在50μl缓冲剂ph4(10mm hac,10mm nah2po4,ph4用naoh调节)中水化20分钟。添加50μl的sirna(2μm在缓冲剂ph4中),2-3分钟之后利用10μl的160mm naoh使聚合物-sirna溶液处于ph7。
[0319]
实施例3
–
细胞的培养
[0320]
hela细胞在补充有10%fcs(sigma-aldrich)、1x pen/strep(paa lab gmbh)溶液的100μl rpmi1640培养基(paa lab gmbh)中培养(根据制造商的说明),并以4000个细胞/孔的密度接种于96孔-板中。利用countess cell计数器(invitrogen)测量活细胞的密度。在潮湿的培养箱中于37℃和5%co2下培养细胞。铺板24小时之后,为细胞提供新鲜的完全培养基并在当天转染。
[0321]
实施例4
–
细胞的转染
[0322]
通过转移每孔10μl根据实施例2所得到的材料,利用多胺-sirna-复合物对hela细胞进行转染。这种添加的结果是细胞培养基中plk-1sirna的浓度为100nm。在不改变培养基的情况下,将细胞在潮湿的培养箱中于37℃和5%co2下培养3天。
[0323]
实施例5
–
sirna的类型
[0324]
本文中所用的sirna靶向plk-1基因,其产物为细胞循环的重要组成部分。目标蛋白的下调导致有丝分裂阻滞和细胞凋亡。因而利用细胞活力检测,监测细胞的转染。本文中所用的靶向plk-1的sirna和不相关的对照sirna被haupenthal等人(2007)int j cancer,121,206-210发表。
[0325]
实施例6
–
活力检测
[0326]
3天后通过使用cell titer blue检测(ctb,promega)测试细胞的护理。将培养基丢弃并为细胞提供补充有ctb试剂(5:1,vol/vol)的新鲜完全培养基。在潮湿的培养箱中于37℃和5%co2下孵育90-100分钟之后,将样品转移至黑色荧光板,并通过荧光读数器在ex560nm/em590nm下测量样品的颜色变化。利用在相同培养板上生长的未处理的细胞将信
号归一化为100%,利用未接种细胞的孔将信号归一化为0%。
[0327]
实施例7
–
利用改性的多胺转染
[0328]
下列的表格示出了相对于未处理的培养物的活细胞的%作为细胞转染后plk-1下调的度量。在实验中,并行测试羧化的多胺、烷基化的多胺和联合改性的多胺。
[0329]
表4
–
使用羧化的聚亚乙基亚胺转染
[0330][0331][0332]1)pei聚合物的每个氮添加的ω-溴-羧酸甲基酯的当量值
[0333]
表5
–
使用烷基化的聚亚乙基亚胺转染
[0334][0335]2)pei聚合物的每个氮添加的ω-溴代烷烃的当量值
[0336]
表6
–
使用联合改性的聚亚乙基亚胺转染
[0337]
[0338]3)pei聚合物的每个氮添加的ω-溴-十一烷酸甲酯和1-溴代烷烃的合并当量,ω-溴代羧酸与溴代烷烃的比例为1.25:1
[0339]
在测定条件下,本文中所用的聚亚乙基亚胺基本上为无活性的转染剂,仅支链的pei表现出微弱的活性。某些利用烷基或羧基部分中任一个的单一改性得到提高的活性并将低于50%的细胞活力降低在表格中突出显示。利用羧基烷基和烷基部分两者的联合改性表现出对细胞大得多的活性,并且对于大范围的dos,该改进都是明显的。
[0340]
实施例8
–
对不同细胞类型的转染效率
[0341]
转染剂:如实施例1所记载,利用11-溴十一烷酸甲酯和壬基溴对5mmol支链的pei进行改性,所有其它的试剂按等比例缩放。取代度约为40%,改性剂之间的比例约为1。在10mm naoh、70%乙醇中,利用尺寸排阻色谱法从反应混合物中纯化改性的pei。
[0342]
复合:在包含30%乙醇和10mm naoh的溶液中提供纯化的转染剂。将聚合物在缓冲剂d(10mm柠檬酸盐,利用naoh调节至ph5.0)或缓冲剂f(10mm磷酸盐,利用naoh调节至ph6.5)中稀释至4mm的浓度。为得到为10的np-比,使150μl稀释的聚合物与150μl的10μm sirna溶液(plk1或阴性对照(scrambled control))在缓冲剂d或f中复合。在96孔-板中,在各自的缓冲剂中进行这些混合物的系列稀释,以在细胞上得到500nm至2nm的浓度。
[0343]
转染:通过从“复合板”将10μl/孔的量转移至细胞板(列1-10),利用聚合物-sirna-复合物对细胞进行转染。在不改变培养基的情况下,将细胞在潮湿的培养箱中于37℃和5%co2下培养3天。
[0344]
活力检测:3天后通过使用cell titer blue assay(ctb,promega)测试细胞的活力。将培养基丢弃并为细胞提供补充有ctb试剂(120μl,5:1,vol/vol)的新鲜完全培养基。对于nih3t3、jurkat和thp-1细胞,将ctb-培养基试剂直接添加至细胞培养基,而不需要丢弃。在潮湿的培养箱中于37℃和5%co2下孵育90-100分钟(对于nih3t3、jurkat和thp-1细胞为240min)之后,将样品转移至黑色荧光板,并通过荧光读数器在ex560nm/em590nm下测量样品的颜色变化。
[0345]
表7
–
细胞类型的列表
[0346]
名称类型物种生长来源hela子宫颈癌人类贴壁dsmzhepg2肝癌人类贴壁clsneuro 2a成神经细胞瘤小鼠贴壁cls
[0347]
以ec50衡量改性的多胺的性能,ec50是抑制50%的细胞生长所需的sirna浓度。同时,使用不相关的sirna进行相同的测试并同样计算ec50值。然后将信噪比定义为ec50(对照)和ec50(plk-1)之间的比例。
[0348]
表8
–
对于改性的多胺的转染和信噪比
[0349][0350]
数据证明非常有效地将sirna转染至不同细胞类型中,包括在悬浮液中生长的细胞。转染反应被细胞非常良好地耐受,带有极小的或几乎没有毒性信号,通过信噪比为3或者更高来表示。
[0351]
实施例9
–
商业试剂的转染效率和信噪比
[0352]
在如实施例8所记载的相同实验中,并行测试几种商业转染剂,此试验的结果列于表9中。
[0353]
商业转染剂:根据制造商的说明处理interferin(polyplus,法国)、ribocellin(biocellchallenge,德国)、transit-tko(mirus,us)、siport neofx(ambion/life technologies corp.)、dharmafect(dharmacon/thermo fisher)和lipofectamine rnaimax(invitrogen/life technologies corp.)并与plk1和scr sirna复合。在optimem i(gibco/life technologies)中进行系列稀释以得到细胞上的sirna浓度为100nm至2nm。
[0354]
表9
–
商业试剂的转染和信噪比
[0355][0356]
尽管在许多情况下特别是利用试剂dharmafect和rnaimax可实现转染,在整个测试过程中信噪比大幅度降低。
[0357]
实施例10
–
分析表征
[0358]
转染剂:如实施例1所记载,利用11-溴十一烷酸甲酯和壬基溴对5mmol支链的pei进行改性,所有其它的试剂按比例进行缩放。添加烷基化试剂以使取代度为约40%,改性剂之间的比例为约1。在10mm naoh、70%乙醇中,利用尺寸排阻色谱法从反应混合物中纯化改性的pei。
[0359]
分析:此时预估的pei浓度为约60mm(基于单体)。将1ml溶液与0.5ml的100mm甲氧基乙酸和25μl的2n naoh混合。混合物在真空下干燥,溶解于700μl cd3od中并通过1h nmr分析。信号:甲氧基乙酸4.0ppm;bpei主链2.4-2.7ppm,烷基部分的末端ch3 0.8ppm以及羧基烷基的末端ch2-cooh 2.1ppm。
[0360]
表10
–
1h nmr光谱的分析
[0361][0362]
实施例11:更多的多胺衍生物
[0363]
对下列多胺进行实施例1中所述的改性反应:
[0364]
表11:多胺
[0365][0366]
将聚合物以250mono-mm的浓度溶解于无水乙醇中;即氮的浓度为250mm。
[0367]
用于多胺改性的羧基化合物选自下表12,并以250mm的浓度溶解于无水乙醇中:
[0368]
表12:用于多胺改性的羧基化合物
[0369][0370]
用于多胺改性的疏水化合物选自下表13,并也以250mm的浓度溶解于无水乙醇中:
[0371]
表13:用于多胺改性的疏水化合物
[0372]
[0373][0374]
以6m水溶液使用k2co3。
[0375]
对于100μmol多胺(基于单体)的改性,每个反应用移液管吸取以下溶液:
[0376]-400μl多胺溶液
[0377]-xμl的ω-溴羧酸酯
[0378]-yμl的溴化烃
[0379]-高达650μl的无水乙醇
[0380]-33μl k2co3[0381]
选择x+y的合并量以使多胺的氨基的取代度为0至100%而,进一步选择x和y以相互补充并给出在0(仅疏水取代基)和仅使用羧基取代基(在下表中表示为c/a=99)之间的各种c/a比。
[0382]
将所有的混合物密封并在烘箱中于60℃下孵育7天。之后,加入250μl的2n naoh,将混合物再次密封并在60℃下再孵育2天。对于最初的测试,取用小的等分部分的反应混合物并在75%乙醇/水中按1:100稀释。将42μl的各稀释样品转移至96孔板中并干燥。
[0383]
实施例12:利用改性的多胺对sirna进行转染。
[0384]
除了使用缓冲剂f(10mm nah2po4、225mm蔗糖,ph7.2(利用naoh调节))进行sirna复合和转染之外,将得自实施例11的改性的多胺与靶向plk-1的sirna复合并如实施例2至6中所记载的测试它们的转染性能。
[0385]
对于其中疏水部分为脂肪族烷基或环烷基的改性的多胺,转染反应的结果记载在表14中,对于其中所述疏水基团为芳基或烷基芳基的改性的多胺,转染反应的结果记载在表15中。
[0386]
表14:利用其中亲脂性基团为烷基的某些多胺对sirna进行转染。较低的数量表示成功的细胞转染,并对于<=50的值进行突出显示。
[0387][0388]
表14的数据证明许多改性的多胺能够利用sirna转染细胞。疏水基团选自脂肪族烷基部分或环烷基部分,并且都导致形成活性载体,而不考虑其结构差异。
[0389]
活性载体由具有大范围的不同分子量和不同结构(直链的或支链的)的多胺形成。从数据中还显而易见的是,羧基和疏水组分协同作用,而单一改性对载体性能如果有贡献,也是具有极少的贡献。
[0390]
表15:利用其中疏水基团为芳基、烷基芳基或杂芳基的某些多胺转染sirna。
[0391][0392]
表15的数据证明许多改性的多胺能够利用sirna转染细胞。疏水基团选自芳基或烷基芳基部分,并且全都导致活性载体的形成,而不考虑其结构差异。
[0393]
活性载体由具有大范围的不同分子量和不同结构(直链的或支链的)的多胺形成。从数据中还显而易见的是,羧基和疏水组分协同作用,而单一改性对载体性能如果有贡献,也是具有极少的贡献。
[0394]
实施例13:质粒的转染
[0395]
细胞培养:hela细胞在100μl补充有10%fcs(sigma-aldrich)、1x pen/strep(paa lab gmbh)溶液的rpmi1640培养基(paa lab gmbh)中培养(根据制造商的说明),并以8000个细胞/孔的密度接种于96孔-板中。在潮湿的培养箱中于37℃和5%co2下培养细胞。铺板24小时之后,为细胞提供新鲜的完全培养基并在当天转染。
[0396]
复合:在96孔板中提供多胺,各孔包含在70%乙醇中的3mm聚合物,以在缓冲剂f(10mm nah2po4,225mm蔗糖,ph7.2(利用naoh调节))中0.011μg/μl储备溶液的形式提供质粒-dna(pcmv-luc)。通过混合将10μl多胺与90μl质粒-dna复合。复合后10-15分钟,将10μl混合物用于转染hela细胞,导致100ng的质粒-dna/孔。
[0397]
测定荧光素酶的表达:转染24小时后,制备细胞以用于定量检测荧光素酶。因此,将培养板平衡至室温约10分钟。丢弃培养基之后,利用pbs清洗细胞一次。利用100μl的1xbeetle lysis juice(pjk gmbh,德国)将细胞裂解并在5分钟后制备以用于发光测量。利用tecan荧光板读数器对荧光素酶的表达进行定量。
[0398]
实施例14:质粒的转染的结果
[0399]
将得自实施例11的改性的多胺与质粒复合并如实施例13中所记载测试它们的转染性能。
[0400]
对于其中亲脂性部分为脂肪族烷基或环烷基的改性的多胺,转染反应的结果记载在表16中,对于其中所述亲脂性基团为芳基或烷基芳基的改性的多胺,转染反应的结果记载在表17中,以及对于其中所述羧基部分包含芳基或烷基芳基的改性的多胺,转染反应的结果记载在表18中。
[0401]
表16:使用其中疏水基团为脂肪族烷基的某些多胺对hela细胞转染质粒时测量的发光。为清楚起见,省略低于100光单位的信号,超过5000光单位的信号加下划线。
[0402]
[0403]
[0404]
[0405][0406]
表16的数据证明许多羧化的、疏水化的多胺能够将质粒转染至细胞中。亲水基团选自脂肪族烷基部分或环烷基部分,并且都导致活性载体的形成,而不考虑其结构差异。
[0407]
活性载体由具有大范围的不同分子量、不同结构(直链的或支链的)和不同的化学组成(聚亚乙基亚胺、聚烯丙基胺、聚乙烯胺)的多胺形成。从数据中还显而易见的是,羧基和疏水组分协同作用,而单一改性对载体性能如果有贡献,也是具有极少的贡献。
[0408]
表17:利用其中疏水基团为芳基或烷基芳基的某些多胺转染质粒。为清楚起见,省略低于100光单位的信号,超过5000光单位的信号加下划线。
[0409]
[0410]
[0411][0412]
表17的数据证明许多羧化的、疏水化的多胺能够利用质粒转染细胞。疏水基团选自芳基或烷基芳基部分,并且全都导致活性载体的形成,而不考虑其结构差异。
[0413]
活性载体由具有大范围的不同分子量、不同结构(直链的或支链的)和不同的化学组成(聚亚乙基亚胺、聚烯丙基胺)的多胺形成。从数据中还显而易见的是,羧基和亲水组分协同作用,而单一改性对载体性能如果有贡献,也是具有极少的贡献。
[0414]
表18:利用其中羧基基团包含芳基或烷基芳基的某些多胺转染质粒。为清楚起见,省略低于100光单位的信号,超过5000光单位的信号加下划线。
[0415]
[0416][0417]
表18的数据证明许多羧化的、疏水化的多胺能够利用质粒转染细胞。羧基选自包含芳基或烷基芳基部分的羧酸,并且不管其结构差异如何,都导致活性载体的形成。
[0418]
活性载体由具有大范围的不同分子量或不同结构的聚合物形成。从数据中还显而易见的是,羧基和疏水组分协同作用,而单一改性对载体性能如果有贡献,也是具有极少的贡献。
[0419]
实施例15:合成各种羧化的、疏水化的寡精胺及其同系物
[0420]
从市售的1,4-二氨基丁烷(1)起始,三步合成得到重要中间体21。
[0421]
反应图式1:重要中间体21的合成路线
[0422][0423]
通过在步骤a中将丙烯腈加至1,4-二氨基丁烷(1)容易得到化合物2。在此之后,向分子中引入两个boc-保护基团,得到化合物3。之后在过量丁胺的存在下利用氢还原腈,以得到21。
[0424]
反应图式2:低聚反应
[0425]
为形成寡精胺,在标准烷基化条件下使21与1,4-二氯丁-2-炔(1,4-dichlorobut-2-in)反应以得到二聚物41、三聚物42和一系列更长的低聚物:
[0426][0427]
遗憾的是,n-ch
2-c≡c部分不稳定且易被裂解。因此,化合物41、42或更高的低聚物的三键被还原,随后去除boc-基团。
[0428]
使用1,5-二氨基戊烷或1,6-二氨基己烷作为起始物料1进行类似的反应,得到一系列寡精胺同系物或多亚烷基亚胺,其中变量x表示氮基团之间的间距在2和3、2和4、或2和5之间变动。
[0429]
除了形成寡精胺同系物之外,疏水取代基的尺寸在丁基(如该实施例中所述的)、乙基、己基和癸基之间系统地变化,得到在其亚烷基基团、其疏水取代基和其低聚度上有变化的不同多亚烷基亚胺的基质。
[0430]
利用sephadex g25将寡精胺及其同系物(该实施例的全部多亚烷基亚胺)进行脱盐,以及在快流速cm-琼脂糖凝胶(cm-sepharose fast flow)和快流速sp-琼脂糖凝胶(sp-sepharose fast flow)上利用离子交换色谱法纯化个体低聚物。根据寡精氨的聚合度将寡精胺从离子交换柱中洗脱出来,并利用罗马数字i至xii表示,由此较高的数字代表较长的低聚物。聚合度利用质谱分析进行测定,范围为三聚物至约二十聚物。
[0431]
在碱性条件下,利用二氯甲烷从缓冲剂中萃取含有分离的低聚物的馏分,在真空下干燥并以250mm氮的浓度溶解于无水乙醇中。
[0432]
在随后的步骤中,利用实施例11的通用方案,用0、10、15、20或25μmol的ω-溴代羧酸c3、c6、c8、c11和c16对50μmol各低聚物的样品进行衍生化。
[0433]
实施例16:利用羧基-烃-寡精胺对细胞进行转染
[0434]
使用实施例2至7中所记载的靶向plk-1的sirna、hela细胞以及细胞培养条件和检测法进行各种羧化的和疏水化的寡精胺及其各自同系物的转染试验。
[0435]
下表19为使用羧基-烃-寡精胺作为用于sirna的转染剂所得到的结果列表。
[0436]
表19:使用羧化的、疏水化的寡精胺在转染细胞毒性sirna时抑制hela细胞的细胞活力。数字x表示根据式(1)的亚烷基单元的振荡长度(oscillating length),用于低聚物的罗马数字表示低聚物的聚合度。表中的数字表明剩余的细胞活力,低数字表示有效的转染。
[0437][0438][0439]
表19的数据证明许多羧化的、疏水化的寡精胺能够转染细胞。活性载体由具有大范围的不同分子量和由于氮原子之间的间距变化而具有不同分子结构的寡精胺形成。从数据中还显而易见的是,羧基和疏水组分协同作用,因为烷基化的寡精胺在细胞转染中显示
极少的(如果有)贡献,而羧基部分的引入导致活性载体结构。
[0440]
实施例17:得自改性的多胺和核酸的中性和阴离子颗粒
[0441]
制备包含280mm蔗糖、10mm磷酸二氢钠和3mm氢氧化钠(ph6.5)或7mm氢氧化钠(ph7.2)的缓冲剂。在缓冲剂中制备得自实施例5的sirna储备溶液,以得到10倍于表20中所列的浓度。
[0442]
以在70%乙醇、10mm氢氧化钠中改性的多胺浓度为56mm(以mono-mm)的溶液的形式提供实施例8的改性的多胺;快速地将50μl所述的改性的多胺溶液与4.1ml任一缓冲剂混合。形成胶体,利用malvern zetasizer 3000hsa测定颗粒尺寸和分散相的zeta电位。
[0443]
快速地将900μl各种sirna溶液与改性的多胺在缓冲剂中的分散液混合,以得到列于表20中的n/p比,并再次记录尺寸和zeta电位。
[0444]
表20:具有各种n/p比的改性的多胺与sirna之间的复合物的尺寸和zeta电位。
[0445][0446]
一般观察结果:改性的多胺确实形成具有约500nm的尺寸和几乎中性zeta电位的颗粒。导致n/p比为12或更高的少量sirna的添加基本上没有改变颗粒的尺寸或表面电荷。然而,更大量sirna的添加导致形成具有大约相同尺寸的阴离子颗粒。中等量的sirna导致中间的zeta电位和聚集体的形成。系统行为可理解为具有相反电荷的两种聚电解质的相互作用,其中在如endert等人(2004)“nanocapsules from liposomal templates”,pp.238-248在carrier based drug delivery中,oxford university press所记载的电荷中和的条件下发生聚集。
[0447]
具体观察结果:在ph6.5下,朝着完全阴离子状态的电荷反转需要n/p为4,然而在ph7.2下相同过程在n/p 6下完成。该观察结果与pei主链胺在较低的ph值下的较强的离子化一致。
[0448]
实施例18:冻干转染剂
[0449]
以在70%乙醇、10mm氢氧化钠中氮浓度为56mm的溶液的形式提供实施例8的改性的多胺。将各种量的转染剂的澄清溶液快速地注入到利用naoh调节至ph 6.5的包含280mm
蔗糖和20mm磷酸钠的均匀相中,以使转染剂的最终浓度为0.15mm或0.03mm。对于含0.15mm或0.03mm氮的样品,平均颗粒尺寸和多分散性分别为389nm(pi为0.09)和332nm(pi为0.11)。
[0450]
将100μl的等分部分各自放置于96孔板中。将材料在-18℃下冷冻4小时,并转移至冷冻干燥器中。在0.12mbar的恒压下进行冻干持续20小时。从冻干室中取出之后,利用热封机快速地密封板。
[0451]
在第二天,破坏密封,利用水将样品再水化。冻干的产品快速并均匀地溶解。如上所述测定颗粒尺寸和多分散性。
[0452]
在开始再水化后15分钟之内,当在各孔放置15nmol转染剂时,得到的胶体转染剂具有423nm(pi 0.13)的平均颗粒尺寸。当在各孔放置3nmol转染剂时,得到的胶体转染剂具有356nm(pi 0.12)的平均颗粒尺寸
[0453]
要求其优先权的欧洲专利申请no.12 006 963.8(于2012年10月8日提交)的内容,包括全部的权利要求和整个说明书,以引用的方式并入本文中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1