可活化抗PDL1抗体和抗CTLA-4抗体在用于治疗癌症的新辅助联合疗法中的用途的制作方法
可活化抗pdl1抗体和抗ctla-4抗体在用于治疗癌症的新辅助联合疗法中的用途
1.相关申请的交叉引用
2.本技术要求2019年6月13日提交的序列号为62/860,953的美国临时专利申请的权益,所述申请以引用方式整体并入本文。
3.对序列表的引用
4.依据美国联邦法规(c.f.r.)第37章第1.821条,以计算机可读形式(cfr)通过efs-web作为文件名“sequencelisting.txt”以电子方式随函提交的“序列表”以引用方式并入本文。序列表的电子副本创建于2020年6月12日,并且磁盘容量为37.6千字节。
发明领域
5.本发明总体上涉及可活化抗pdl1抗体和抗ctla-4抗体在用于治疗癌症的新辅助联合疗法中的用途。
6.发明背景
7.基于抗体的疗法已经为若干种疾病提供了有效的治疗,但在一些情况下,广泛的靶标表达所致的毒性限制了这些疗法的治疗有效性。此外,基于抗体的治疗剂还表现出其他局限性,如施用后从循环中快速清除。
8.在小分子治疗剂领域,已经开发出提供活性化学实体的前药的策略。此类前药以相对无活性(或活性显著较低)的形式施用。一旦施用,前药在体内代谢成活性化合物。此类前药策略可使药物对其预期靶标的选择性增强以及减少副作用。
9.因此,在基于抗体的治疗剂领域中持续需要模拟小分子前药的期望特性的抗体。
技术实现要素:
10.在一方面,本发明提供了一种治疗患有实体瘤的受试者的癌症、减轻所述癌症的症状或延缓所述癌症的进展的方法,所述方法包括:
11.向所述受试者施用新辅助联合疗法,所述新辅助联合疗法包含:
12.(a)可活化抗pdl1抗体,其中所述可活化抗pdl1抗体包含:
13.(i)结合人pdl1的抗体或其抗原结合部分(ab),所述ab包含:
14.重链可变区(vh),所述vh包含:含有seq id no:125的氨基酸序列的互补决定区1(cdrh1)、含有seq id no:126的氨基酸序列的互补决定区2(cdrh2)和含有seq id no:127的氨基酸序列的互补决定区3(cdrh3),和
15.轻链可变区(vl),所述vl包含:含有seq id no:128的氨基酸序列的轻链互补决定区1(cdrl1)、含有seq id no:129的氨基酸序列的轻链互补决定区2(cdrl2)和含有seq id no:130的氨基酸序列的轻链互补决定区3(cdrl3);
16.(ii)直接或间接地连接至所述ab的可裂解部分(cm),其中所述cm是用作蛋白酶的底物的多肽;和
17.(iii)直接或间接地连接至所述cm的掩蔽部分(mm);以及
18.(b)抗ctla-4抗体。
19.在另一方面,本发明提供了一种治疗患有实体瘤的受试者的癌症、减轻所述癌症的症状或延缓所述癌症的进展的方法,所述方法包括向所述受试者施用新辅助联合疗法,所述新辅助联合疗法包含:
20.(a)800mg的固定剂量的可活化抗pdl1抗体,其中所述可活化抗pdl1抗体包含:
21.(i)结合人pdl1的抗体或其抗原结合部分(ab),所述ab包含:
22.重链可变区(vh),所述vh包含:含有seq id no:125的氨基酸序列的互补决定区1(cdrh1)、含有seq id no:126的氨基酸序列的互补决定区2(cdrh2)和含有seq id no:127的氨基酸序列的互补决定区3(cdrh3),和
23.轻链可变区(vl),所述vl包含:含有seq id no:128的氨基酸序列的轻链互补决定区1(cdrl1)、含有seq id no:129的氨基酸序列的轻链互补决定区2(cdrl2)和含有seq id no:130的氨基酸序列的轻链互补决定区3(cdrl3);
24.(ii)直接或间接地连接至所述ab的可裂解部分(cm),其中所述cm是用作蛋白酶的底物的多肽;和
25.(iii)直接或间接地连接至所述cm的掩蔽部分(mm);以及
26.(b)1mg/kg的剂量的抗ctla-4抗体。
27.在另一方面,本发明提供了一种治疗患有实体瘤的受试者的癌症、减轻所述癌症的症状或延缓所述癌症的进展的方法,所述方法包括向所述受试者施用新辅助联合疗法,所述新辅助联合疗法包含:
28.(a)800mg的固定剂量的可活化抗pdl1抗体,
29.其中所述可活化抗pdl1抗体包含含有seq id no:122的氨基酸序列的重链和含有选自由seq id no:123和seq id no:124组成的组的氨基酸序列的轻链,
30.其中所述可活化抗pdl1抗体包含结合人pdl1的抗体或其抗原结合部分(ab)、可裂解部分(cm)和掩蔽部分(mm);以及
31.(b)1mg/kg的剂量的抗ctla-4抗体。在一些实施方案中,轻链包含seq id no:123的氨基酸序列。在其他实施方案中,轻链包含seq id no:124的氨基酸序列。
32.在又另一方面,本发明提供了一种用于治疗癌症的可活化抗pdl1抗体,其中所述治疗包括向受试者静脉内施用所述可活化抗pdl1抗体与向所述受试者静脉内施用的抗ctla-4抗体的新辅助组合,
33.其中所述可活化抗pdl1抗体包含:
34.(i)结合人pdl1的抗体或其抗原结合部分(ab),所述ab包含:
35.重链可变区(vh),所述vh包含:含有seq id no:125的氨基酸序列的互补决定区1(cdrh1)、含有seq id no:126的氨基酸序列的互补决定区2(cdrh2)和含有seq id no:127的氨基酸序列的互补决定区3(cdrh3),和
36.轻链可变区(vl),所述vl包含:含有seq id no:128的氨基酸序列的轻链互补决定区1(cdrl1)、含有seq id no:129的氨基酸序列的轻链互补决定区2(cdrl2)和含有seq id no:130的氨基酸序列的轻链互补决定区3(cdrl3);
37.(ii)直接或间接地连接至所述ab的可裂解部分(cm),其中所述cm是用作蛋白酶的底物的多肽;和
38.(iii)直接或间接地连接至所述cm的掩蔽部分(mm);以及
39.(b)抗ctla-4抗体,
40.其中所述受试者患有实体瘤。
41.在某些方面,所述癌症是黑素瘤。在一些实施方案中,所述癌症是可切除的iii期黑素瘤。
附图说明
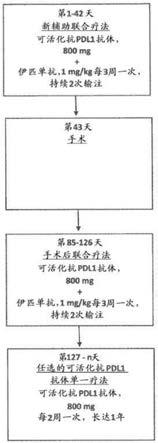
42.图1提供了实施例1中描述的新辅助联合疗法研究的示意图。在该研究中,可活化抗pdl1抗体和伊匹单抗的新辅助联合疗法分别以800mg的固定剂量和3mg/kg每3周(q3w)施用一次持续2次输注(第1-42天),接着在第43天手术切除肿瘤。手术切除肿瘤后六周(从第85天开始),可活化抗pdl1抗体和伊匹单抗的手术后联合疗法分别以800mg的固定剂量和1mg/kg每3周(q3w)施用一次持续2次输注(第85-126天)。从第127天开始,任选的可活化抗pdl1抗体单一疗法每2周以800mg的固定剂量施用,持续长达一年。
具体实施方式
43.本发明提供了通过向患有实体瘤的受试者施用包含可活化抗pdl1抗体和抗ctla-4抗体的新辅助联合疗法来治疗所述受试者的癌症、减轻癌症的症状和/或延缓癌症的进展的方法。受试者为哺乳动物,且通常为人。
44.在一个实施方案中,本发明提供了一种治疗患有实体瘤的受试者的癌症、减轻所述癌症的症状和/或延缓所述癌症的进展的方法,所述方法包括:
45.向所述受试者施用新辅助联合疗法,所述新辅助联合疗法包含:
46.(a)可活化抗pdl1抗体,其中所述可活化抗pdl1抗体包含:
47.(i)结合人pdl1的抗体或其抗原结合部分(ab),所述ab包含:
48.重链可变区(vh),所述vh包含:含有seq id no:125的氨基酸序列的互补决定区1(cdrh1)、含有seq id no:126的氨基酸序列的互补决定区2(cdrh2)和含有seq id no:127的氨基酸序列的互补决定区3(cdrh3),和
49.轻链可变区(vl),所述vl包含:含有seq id no:128的氨基酸序列的轻链互补决定区1(cdrl1)、含有seq id no:129的氨基酸序列的轻链互补决定区2(cdrl2)和含有seq id no:130的氨基酸序列的轻链互补决定区3(cdrl3);
50.(ii)直接或间接地连接至所述ab的可裂解部分(cm),其中所述cm是用作蛋白酶的底物的多肽;和
51.(iii)直接或间接地连接至所述cm的掩蔽部分(mm);以及
52.(b)抗ctla-4抗体。
53.如本文所用,当与术语“联合疗法”结合使用时,术语“新辅助”是指在患有实体瘤的受试者经历全部或部分实体瘤的手术切除之前向所述受试者施用的联合疗法。因此,新辅助联合疗法旨在增强手术程序的结果。在一些实施方案中,在手术切除全部或部分实体瘤之前向受试者施用新辅助联合疗法使肿瘤缩小,使得手术更有效并且/或者更容易执行。在一些实施方案中,向受试者施用新辅助联合疗法可使得实体瘤能够通过手术切除治疗,其中在没有新辅助联合疗法的情况下肿瘤将无法通过手术切除治疗。在一些实施方案中,
或“cdr”。重链和轻链中的每个重链可变区(vh)和轻链可变区(vl)分别包含三个cdr(cdr1、cdr2和cdr3)。每个结构域的氨基酸分配遵循kabat sequences of proteins of immunological interest的定义(national institutes of health,bethesda,md(1987和1991);chothia和lesk,j.mol.biol.196:901-917(1987);chothia等人,nature 342:878-883(1989),所述文献以引用方式整体并入本文)。
57.在具体实施方案中,可活化抗pdl1抗体的ab组分包含含有包含对应于seq id no:128(cdrl1)、129(cdrl2)和seq id no:130(cdrl3)的氨基酸序列的可变轻链cdr的轻链可变区(vl)和含有包含对应于seq id no:125(cdrh1)、seq id no:126(cdrh2)和seq id no:127(cdrh3)的氨基酸序列的可变重链cdr的重链可变区(vh)。如pct公布第wo 2016/149201号和第wo 2018/222949号中所述,已证明具有该特定cdr序列组的ab对人pdl1具有结合特异性,所述公布各自以引用方式并入本文。
58.在本发明的实践中采用的可活化抗pdl1抗体可具有ab,所述ab包含例如轻链和/或重链的一个或多个可变区(vl)、重链可变区(vh)或高变区、可变片段(fv)、fab'片段、f(ab')2片段、fab片段、单链抗体(scab)、单链可变区(scfv)、互补决定区(cdr)、结构域抗体(dab)、bhh或bnar类型的单结构域重链免疫球蛋白、单结构域轻链免疫球蛋白或已知会结合人pdl1的其他多肽。在一些实施方案中,ab包含含有两个fab区和一个fc区的免疫球蛋白。在某些实施方案中,可活化抗pdl1抗体是多价的,例如二价、三价等。通常,可活化抗pdl1抗体包含两条轻链(每条包含vl区)和两条重链(每条包含vh区)。在某些实施方案中,每条轻链包含直接或间接地(例如,通过接头)连接至vl的前结构域。在这些实施方案的一些实施方案中,两条轻链在氨基酸序列方面彼此相同,并且相似地,两条重链在氨基酸序列方面彼此相同。在这些实施方案的一些实施方案中,两条轻链在氨基酸序列方面彼此相同,而两条重链在氨基酸序列方面彼此不相同。在这些实施方案的一些实施方案中,两条轻链在氨基酸序列方面彼此不相同,而两条重链在氨基酸序列方面彼此相同。在这些实施方案的一些实施方案中,两条轻链在氨基酸序列方面彼此不相同,并且两条重链在氨基酸序列方面彼此不相同。在这些实施方案的一些实施方案中,两条轻链彼此相差一个或多个(例如,1、2、3、4、5、6、7、8、9、10、15、20、25、30或更多个)氨基酸残基,并且/或者两条重链彼此相差一个或多个(例如,1、2、3、4、5、6、7、8、9、10、15、20、25、30或更多个)氨基酸残基。在这些实施方案的一些实施方案中,两条轻链彼此相差一个或多个(例如,1、2、3、4、5、6、7、8、9、10、15、20、25、30或更多个)氨基酸残基同时具有相同的cdr序列,并且/或者两条重链彼此相差一个或多个(例如,1、2、3、4、5、6、7、8、9、10、15、20、25、30或更多个)氨基酸残基同时具有相同的cdr序列。在这些实施方案的一些实施方案中,两条轻链的氨基酸序列彼此至少80%相同(例如,至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%相同),并且/或者两条重链的氨基酸序列彼此至少80%相同(例如,至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%相同)。在这些实施方案的一些实施方案中,两条轻链的氨基酸序列彼此至少80%相同(例如,至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%相同)同时具有相同的cdr序列,并且/或者两条重链的氨基酸序列彼此至少80%相同(例如,至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%相同)同时具有相同的cdr序列。
59.如果ab与pdl1靶标的结合未被掩蔽或以其他方式抑制,则可活化抗pdl1抗体中前结构域的存在由此赋予降低的另外可由ab在非治疗位点的结合引起的毒性和/或不良副作用。
60.适用于本发明的实践中的掩蔽部分包括当在可活化抗pdl1抗体的结构中采用时,与对应亲本抗pdl1 ab对人pdl1的结合亲和力相比,用于降低可活化抗pdl1抗体对人pdl1的结合亲和力的那些。如本文所用,术语“亲本ab”是指没有前结构域的ab。在一些实施方案中,选择mm,使得当在体内或在体外测定(诸如pct公布第wo2016/149201号中描述的测定,所述公布以引用方式整体并入)中测量时,相对于对应亲本ab与人pdl1的结合,可活化抗pdl1抗体与人pdl1的结合亲和力降低至少50%、60%、70%、80%、90%、92%、93%、94%、95%、96%、97%、98%、99%以及甚至100%,持续至少2、4、6、8、12、28、24、30、36、48、60、72、84或96小时,或5、10、15、30、45、60、90、120、150或180天,或1、2、3、4、5、6、7、8、9、10、11或12个月或更长时间。
61.在一些实施方案中,选择mm,使得所得可活化抗pdl1抗体表现出的对人pdl1的结合亲和力比对应亲本ab对人pdl1的结合亲和力低至少5、10、25、50、100、250、500、1,000、2,500、5,000、10,000、50,000、100,000、500,000、1,000,000、5,000,000、10,000,000、50,000,000倍或更多倍,或5-10、10-100、10-1,000、10-10,000、10-100,000、10-1,000,000、10-10,000,000、100-1,000、100-10,000、100-100,000、100-1,000,000、100-10,000,000、1,000-10,000、1,000-100,000、1,000-1,000,000、1000-10,000,000、10,000-100,000、10,000-1,000,000、10,000-10,000,000、100,000-1,000,000或100,000-10,000,000倍。如本文所用,上文和下文阐述的所有数值范围旨在包括限定该范围的数值界限。
62.可使用多种已知技术中的任一种容易地鉴别适用于本文所用的可活化抗pdl1抗体中的掩蔽部分,所述已知技术包括pct公布第wo 2009/025846号中描述的那些,所述公布以引用方式整体并入本文。
63.通常,mm是长度为约2至40个氨基酸的多肽。在一些实施方案中,mm是长度为至多约40个氨基酸的多肽。在某些实施方案中,mm多肽的氨基酸序列与靶标人pdl1的氨基酸序列不同。在一些实施方案中,mm多肽序列与人pdl1氨基酸序列不超过50%相同。在一些实施方案中,mm多肽序列与靶标人pdl1的氨基酸序列不超过40%、30%、25%、20%、15%或10%相同。两个序列的同一性百分比是通过使用诸如gap或bestfit等程序使用默认空位权重测试多肽序列与参考多肽序列的最佳对齐来确定的。
64.示例性掩蔽部分包括包含以下氨基酸序列中的任一者的那些:ycevselfvlpwcmg(seq id no:1)、sclmhphyahdycyv(seq id no:2)、lcevlmllqhpwcmg(seq id no:3)、iacrhfmeqlpfchh(seq id no:4)、fgprcgeastcvpye(seq id no:5)、ilycdswgagcltrp(seq id no:6)、gialcpshfcqlpqt(seq id no:7)、dgprcfvsgecspig(seq id no:8)、lcykldyddrsychi(seq id no:9)、pchphpydarpycnv(seq id no:10)、pcywhpffayrycnt(seq id no:11)、vcyymdwlgrnwcss(seq id no:12)、lcdlfklrefpycmg(seq id no:13)、ylpchfvpigacnnk(seq id no:14)、ifchmgvvvpqcany(seq id no:15)、achphpydarpycnv(seq id no:16)、pchpapydarpycnv(seq id no:17)、pchphaydarpycnv(seq id no:18)、pchphpadarpycnv(seq id no:19)、pchphpyaarpycnv(seq id no:20)、pchphpydaapycnv(seq id no:21)、pchphpydarpacnv(seq id no:22)、pchphpydarpycav(seq id no:23)、
pchahpydarpycnv(seq id no:24)和pchphpydaraycnv(seq id no:25)。通常,可活化抗pdl1抗体包含含有氨基酸序列gialcpshfcqlpqt(seq id no:7)的mm。
65.在一些实施方案中,mm包含与选自由seq id no:1-25组成的组的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨基酸序列。
66.用于cm中的合适底物可使用多种已知技术中的任一种容易地鉴别,所述技术包括美国专利第7,666,817号、美国专利第8,563,269号、pct公布第wo 2014/026136号以及boulware等人“evolutionary optimization of peptide substrates for proteases that exhibit rapid hydrolysis kinetics,”biotechnol bioeng.106.3(2010):339-46中描述的那些。
67.在一些实施方案中,使cm裂解的蛋白酶在患病组织中具有活性,例如,上调,并且当可活化抗体暴露于所述蛋白酶时,所述蛋白酶使所述可活化抗体中的cm裂解。通常,疾病组织是肿瘤组织。在一些实施方案中,蛋白酶与pdl1共定位在组织中,并且当可活化抗体暴露于蛋白酶时,蛋白酶使可活化抗体中的cm裂解。在一些实施方案中,与非治疗位点的组织(例如健康组织)相比,蛋白酶在治疗位点或诊断位点的含pdl1靶标的组织中或附近以相对更高的水平存在,并且当可活化抗体暴露于蛋白酶时,蛋白酶使可活化抗体中的cm裂解。
68.适用于本文所用的可活化抗pdl1抗体中的例示性cm包括包含以下氨基酸序列中任一项的那些:lsgrsdnh(seq id no:26)、tgrgpswv(seq id no:27)、pltgrsgg(seq id no:28)、targpsfk(seq id no:29)、ntlsgrsenhsg(seq id no:30)、ntlsgrsgnhgs(seq id no:31)、tstsgrsanprg(seq id no:32)tsgrsanp、(seq id no:33)、vhmplgflgp(seq id no:34)、avgllapp(seq id no:35)、aqnllgmv(seq id no:36)、qnqalrma(seq id no:37)、laaplgll(seq id no:38)、stfpfgmf(seq id no:39)、issgllss(seq id no:40)、paglwldp(seq id no:41)、vagrsmrp(seq id no:42)、vvpegrrs(seq id no:43)、ilprspaf(seq id no:44)、mvlgrsll(seq id no:45)、qgraitfi(seq id no:46)、sprsi mla(seq id no:47)、smlrsmpl(seq id no:48)、issgllsgrsdnh(seq id no:49)、avgllappgglsgrsdnh(seq id no:50)、issgllssggsggslsgrsdnh(seq id no:51)、lsgrsgnh(seq id no:52)、sgrsanprg(seq id no:53)、lsgrsddh(seq id no:54)、lsgrsdih(seq id no:55)、lsgrsdqh(seq id no:56)、lsgrsdth(seq id no:57)、lsgrsdyh(seq id no:58)、lsgrsdnp(seq id no:59)、lsgrsanp(seq id no:60)、lsgrsani(seq id no:61)、lsgrsdni(seq id no:62)、miapvayr(seq id no:63)、rpspmway(seq id no:64)、watprpmr(seq id no:65)、frlldwqw(seq id no:66)、issgl(seq id no:67)、issglls(seq id no:68)、issgll(seq id no:69)、issgllsgrsanprg(seq id no:70)、avgllapptsgrsanprg(seq id no:71)、avgllappsgrsanprg(seq id no:72)、issgllsgrsddh(seq id no:73)、issgllsgrsdih(seq id no:74)、issgllsgrsdqh(seq id no:75)issgllsgrsdth(seq id no:76)、issgllsgrsdyh(seq id no:77)、issgllsgrsdnp(seq id no:78)、issgllsgrsanp(seq id no:79)issgllsgrsani(seq id no:80)、avgllappgglsgrsddh(seq id no:81)、avgllappgglsgrsdih(seq id no:82)、avgllappgglsgrsdqh(seq id no:83)、avgllappgglsgrsdth(seq id no:84)、avgllappgglsgrsdyh(seq id no:85)、avgllappgglsgrsdnp(seq id no:86)、avgllappgglsgrsanp(seq id no:87)、avgllappgglsgrsani(seq id no:88)、issgllsgrsdni(seq id no:89)、
avgllappgglsgrsdni(seq id no:90)、glsgrsdnhggavgllapp(seq id no:91)和glsgrsdnhggvhmplgflgp(seq id no:92)。在具体实施方案中,可活化抗pdl1抗体包含具有氨基酸序列issgllsgrsdnh(seq id no:49)的cm。
69.在本发明的实践中采用的可活化抗pdl1抗体可以多种结构构型存在。下文提供了可活化抗体的示例性式。应注意,尽管在下式中mm和cm被指示为不同的组分,但是在本文所公开的所有示例性实施方案(包括式)中,设想的是mm和cm的氨基酸序列可重叠,例如,使得cm完全或部分地包含在mm内。
70.可活化抗pdl1抗体的mm、cm和ab组分可如下式所指示排列(从n端到c端的顺序):
71.(mm)-(cm)-(ab)
72.(ab)-(cm)-(mm)
73.其中mm、cm和ab如先前所定义,并且其中每个
“‑”
独立地指直接或间接(即,通过如下文所述的接头)连接。
74.在许多实施方案中,可能需要将一个或多个接头插入可活化抗pdl1抗体构建体中,以便在mm-cm接点、cm-ab接点或两者中的一者或多者处赋予柔性。例如,在某些实施方案中,可活化抗pdl1抗体可包含下式中的一个(其中下式表示在n端到c端方向或c端到n端方向的氨基酸序列):
75.(mm)-l1-(cm)-(ab)
76.(mm)-(cm)-l2-(ab)
77.(mm)-l1-(cm)-l2-(ab)
78.其中mm、cm和ab如上文所定义;其中l1和l2可相同或不同,并且各自独立地可任选地存在或不存在。
79.适用于在本发明的实践中采用的可活化抗pdl1抗体中的接头可为多种长度中的任一种。合适的接头包括长度在以下范围内的那些接头:约1至约20个氨基酸、或约1至约19个氨基酸、或约1至约18个氨基酸、或约1至约17个氨基酸、或约1至约16个氨基酸、或约1至约15个氨基酸、或约2至约15个氨基酸、或约3至约15个氨基酸、或约3至约14个氨基酸、或约3至约13个氨基酸、或约3至约12个氨基酸。在一些实施方案中,可活化抗pdl1抗体包含一个或多个接头,所述接头各自独立地包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸残基。
80.通常,接头是包含一个或多个选自由gly、ser、ala和thr组成的组的氨基酸残基的柔性接头,并且通常,接头包含一个或多个选自由gly和ser组成的组的氨基酸残基。示例性柔性接头包括甘氨酸均聚物(g)n(其中n是至少为1的整数,或约1至约30范围内的整数,或约1至约25范围内的整数,或约1至约20范围内的整数,或约1至约15范围内的整数,或约1至约10范围内的整数);甘氨酸-丝氨酸共聚物,包括例如(gs)n(其中n是至少为1的整数,或约1至约30范围内的整数,或约1至约25范围内的整数,或约1至约20范围内的整数,或约1至约15范围内的整数,或约1至约10范围内的整数)、(gsggs)n(seq id no:93)(其中n是至少为1的整数,或约1至约30范围内的整数,或约1至约25范围内的整数,或约1至约20范围内的整数,或约1至约15范围内的整数,或约1至约10范围内的整数)、(gggs)n(seq id no:94)(其中n是至少为1的整数,或约1至约30范围内的整数,或约1至约25范围内的整数,或约1至约20范围内的整数,或约1至约15范围内的整数,或约1至约10范围内的整数);包含甘氨酸和
丝氨酸残基或由甘氨酸和丝氨酸残基组成的接头,诸如例如ggsg(seq id no:95)、ggsgg(seq id no:96)、gsgsg(seq id no:97、gsggg(seq id no:98)、gssggsggsgg(seq id no:99)、gssggsggsggs(seq id no:100)、gssggsggsggsgggs(seq id no:101)、gssggsggsg(seq id no:102)、gssggsggsgs(seq id no:103)、gggs(seq id no:104)、gssg(seq id no:106)、gggssggsggsgg(seq id no:107)、ggs等;包含甘氨酸、丝氨酸和苏氨酸残基或由甘氨酸、丝氨酸和苏氨酸残基组成的接头,例如gssgt(seq id no:105);甘氨酸-丙氨酸共聚物;丙氨酸-丝氨酸共聚物;以及本领域中已知的其他柔性接头。
81.在本发明的实践中采用的可活化抗pdl1抗体还可包含位于例如mm的氨基末端的间隔区。在一些实施方案中,间隔区直接连接至可活化抗pdl1抗体的mm,例如,按照从n端到c端间隔区-mm-cm-ab的结构排列,其中每个
“‑”
独立地指直接或间接(即,通过本文所述的任何接头)连接。例示性间隔区氨基酸序列可包含以下示例性氨基酸序列中的任一者或由其组成:qgqsgs(seq id no:108);gqsgs(seq id no:109);qsgs(seq id no:110);sgs;gs;s;qgqsgqg(seq id no:111);gqsgqg(seq id no:112);qsgqg(seq id no:113);sgqg(seq id no:114);gqg;qg;g;qgqsgq(seq id no:115);gqsgq(seq id no:116);qsgq(seq id no:117);sgq;gq;和q。
82.因此,在一些实施方案中,间隔区包含氨基酸序列qgqsgs(seq id no:108)或由其组成。在一些实施方案中,间隔区包含氨基酸序列gqsgs(seq id no:109)或由其组成。在一些实施方案中,间隔区包含氨基酸序列qsgs(seq id no:110)或由其组成。在一些实施方案中,间隔区包含氨基酸序列sgs或由其组成。在一些实施方案中,间隔区包含氨基酸序列gs或由其组成。在一些实施方案中,间隔区包含氨基酸残基s或由其组成。在一些实施方案中,间隔区包含氨基酸序列qgqsgqg(seq id no:111)或由其组成。在一些实施方案中,间隔区包含氨基酸序列gqsgqg(seq id no:112)或由其组成。在一些实施方案中,间隔区包含氨基酸序列qsgqg(seq id no:113)或由其组成。在一些实施方案中,间隔区包含氨基酸序列sgqg(seq id no:114)或由其组成。在一些实施方案中,间隔区包含氨基酸序列gqg或由其组成。在一些实施方案中,间隔区包含氨基酸序列qg或由其组成。在一些实施方案中,间隔区包含氨基酸残基g或由其组成。在一些实施方案中,间隔区包含氨基酸序列qgqsgq(seq id no:115)或由其组成。在一些实施方案中,间隔区包含氨基酸序列gqsgq(seq id no:116)或由其组成。在一些实施方案中,间隔区包含氨基酸序列qsgq(seq id no:117)或由其组成。在一些实施方案中,间隔区包含氨基酸序列sgq或由其组成。在一些实施方案中,间隔区包含氨基酸序列gq或由其组成。在一些实施方案中,间隔区包含氨基酸残基q或由其组成。在一些实施方案中,可活化抗pdl1抗体不包含间隔区序列。
83.在具体实施方案中,可活化抗pdl1抗体是pl07-2001-c5h9v2,其包含两条轻链和两条重链。每条轻链包含位于vl氨基酸序列n端的前结构域氨基酸序列(即,所述前结构域包含mm和cm)。pl07-2001-c5h9v2的每条轻链中的可变轻链(vl)氨基酸序列包含seq id no:119的氨基酸序列:
84.diqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqdngypstfgggtkveikr
85.(seq id no:119)
86.cdrl1、cdrl2和cdrl3均由下划线文本指示。
87.pl07-2001-c5h9v2的每条重链包含重链可变区(vh),其包含seq id no:118的氨基酸序列:
88.evqllesggglvqpggslrlscaasgftfssyamswvrqapgkglewvssiwrngivtvyadsvkgrftisrdnskntlylqmnslraedtavyycakwsaafdywgqgtlvtvss(seq id no:118)cdrh1、cdrh2和cdrh3由下划线文本指示。
89.因此,在一个实施方案中,在本发明的实践中采用的可活化抗pdl1抗体包含含有seq id no:119的氨基酸序列的vl和含有seq id no:118的氨基酸序列的vh。重链和轻链的vl和vh一起形成可活化抗pdl1抗体的ab。
90.pl07-2001-c5h9v2的每条轻链的氨基酸序列包括间隔区、mm、cm、vl和人κ恒定结构域,其如seq id no:124所示:
[0091][0092]
(seq id no:124)
[0093]
间隔区序列由下划线文本指示(对应于seq id no:108),mm序列由斜体文本指示(对应于seq id no:7),并且cm由粗体文本指示(对应于seq id no:49)。vl序列由下划线和斜体文本表示(对应于seq id no:119)。在mm序列的c端与cm序列的n端之间是第一接头序列(对应于seq id no:107)。在cm序列的c端与vl序列的n端之间是第二个接头序列ggs。
[0094]
pl07-2001-c5h9v2的每条重链序列包含seq id no:122的序列:
[0095]
evqllesggglvqpggslrlscaasgftfssyamswvrqapgkglewvssiwrngivtvyadsvkgrftisrdnskntlylqmnslraedtavyycakwsaafdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslg
[0096]
(seq id no:122)
[0097]
pl07-2001-c5h9v2的重链序列包含seq id no:118的vh和igg4 s229p的氨基酸序列。因此,在具体实施方案中,本发明的方法采用包含含有seq id no:124的氨基酸序列的轻链和含有seq id no:122的氨基酸序列的重链的可活化抗pdl1抗体,其中轻链包含mm、cm和vl(其中mm和cm位于前结构域内)。可活化抗pdl1抗体通常包含两条轻链和两条重链。
[0098]
因此适用于本发明的实践中的可活化抗pdl1抗体可包含轻链,所述轻链包含pl07-2001-c5h9v2中每条轻链的mm-l1-cm-l2-vl结构,由对应于seq id no:120的序列体现:
[0099]
gialcpshfcqlpqtgggssggsggsggissgllsgrsdnhggsdiqmtqspsslsasvgdrvtitcra
sqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqdngypstfgggtkveikr
[0100]
(seq id no:120)。
[0101]
在这些实施方案的一些实施方案中,轻链包含pl07-2001-c5h9v2的上述mm-l1-cm-l2-vl-人κ恒定结构域,如seq id no:123所示:
[0102]
gialcpshfcqlpqtgggssggsggsggissgllsgrsdnhggsdiqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqdngypstfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0103]
(seq id no:123)
[0104]
在这些实施方案中,每条重链通常包含含有seq id no:118的氨基酸序列的vh。
[0105]
相似地,合适的可活化抗pdl1抗体可包含pl07-2001-c5h9v2中每条轻链的间隔区-mm-l1-cm-l2结构,由对应于seq id no:121的序列体现:
[0106]
qgqsgsgialcpshfcqlpqtgggssggsggsggissgllsgrsdnhggsdiqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqdngypstfgggtkveikr
[0107]
(seq id no:121)
[0108]
在这些实施方案中,每条重链通常包含含有seq id no:118的氨基酸序列的vh。
[0109]
在上述方法的实践中采用的可活化抗pdl1抗体可包含本文所述的mm、cm和ab组分中的任一者。在特定实施方案中,mm包含seq id no:7的氨基酸序列。在这些和其他实施方案中,cm包含seq id no:49的氨基酸序列。在这些实施方案的一些实施方案中,ab包含含有seq id no:118的氨基酸序列的重链可变区(vh)和含有seq id no:119的氨基酸序列的轻链可变区(vl)。
[0110]
在一些实施方案中,可活化抗pdl1抗体包含轻链和重链,其中轻链包含mm、cm和vl,并且其中轻链包含seq id no:120的氨基酸序列,并且其中重链包含含有seq id no:118的氨基酸序列的vh。在另一个实施方案中,可活化抗pdl1抗体包含轻链和重链,其中轻链包含间隔区、mm、cm和vl,并且其中轻链包含seq id no:121的氨基酸序列,并且其中重链包含含有seq id no:118的氨基酸序列的vh。
[0111]
在一些实施方案中,(例如,在受试者经历实体瘤的全部或部分的手术切除之前)向受试者施用多个剂量的新辅助联合疗法(例如,可活化抗pdl1抗体和抗ctla-4抗体)。如本文所用,提及与本文所述的联合疗法相关的“剂量”旨在意指新辅助联合疗法的各组分的剂量。在一些实施方案中,可向受试者施用二、三、四、五、六、七、八、九或十个或更多个剂量的新辅助联合疗法。通常,每三周(21天)施用一个剂量的新辅助联合疗法。在一些实施方案中,每周一次施用一个剂量的新辅助联合疗法。在一些实施方案中,每两周一次施用一个剂量的新辅助联合疗法。在一些实施方案中,每四周一次施用一个剂量的新辅助联合疗法。在一些实施方案中,每5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27或28天施用一个剂量的新辅助联合疗法。在一些实施方案中,以恒定频率施用多个剂量的新辅助联合疗法(例如,可每3周一次施用两个或更多个剂量的新辅助联合疗法)。在一些实施方案中,以可变频率施用多个剂量的新辅助联合疗法(例如,新辅助联合疗法的前两
个剂量之间的时间段可为3周,而新辅助联合疗法的未来剂量可每周施用一次)。如本领域普通技术人员将理解的,可采用本文所述的新辅助联合疗法的其他恒定和可变给药周期。在这些实施方案的某些实施方案中,在手术切除全部或部分实体瘤之前,向受试者施用两个剂量的新辅助联合疗法。
[0112]
在这些实施方案的某些实施方案中,以240mg至2400mg范围内的固定剂量施用新辅助联合疗法的可活化抗pdl1抗体组分。在一些实施方案中,以800mg的固定剂量施用新辅助联合疗法的可活化抗pdl1抗体组分。在其他实施方案中,以0.3mg/kg至30mg/kg范围内的剂量向受试者施用新辅助联合疗法的可活化抗pdl1抗体组分。在某些实施方案中,以0.3mg/kg、1.0mg/kg、3.0mg/kg、10.0mg/kg或30.0mg/kg的剂量向受试者施用新辅助联合疗法的可活化抗pdl1抗体组分。在这些实施方案的某些实施方案中,以约240mg至约2400mg范围内的固定剂量施用新辅助联合疗法的可活化抗pdl1抗体组分。在一些实施方案中,以约800mg的固定剂量施用新辅助联合疗法的可活化抗pdl1抗体组分。在其他实施方案中,以约0.3mg/kg至约30mg/kg范围内的剂量向受试者施用新辅助联合疗法的可活化抗pdl1抗体组分。在某些实施方案中,以约0.3mg/kg、约1.0mg/kg、约3.0mg/kg、约10.0mg/kg或约30.0mg/kg的剂量向受试者施用新辅助联合疗法的可活化抗pdl1抗体组分。
[0113]
在一些实施方案中,以0.3mg/kg至30mg/kg范围内的剂量施用新辅助联合疗法的抗ctla-4组分。有时,以0.1mg/kg至20mg/kg范围内、或0.1mg/kg至15mg/kg范围内、或0.1mg/kg至10mg/kg范围内、或0.5mg/kg至10mg/kg范围内、或0.5mg/kg至5mg/kg范围内、或0.5mg/kg至3mg/kg范围内、或0.5mg/kg至2mg/kg范围内的剂量施用新辅助联合疗法的抗ctla-4组分。在某些实施方案中,以小于3mg/kg或小于2mg/kg的剂量施用新辅助联合疗法的抗ctla-4抗体组分。有时,以选自由以下组成的组的剂量施用新辅助联合疗法的抗ctla-4组分:1mg/kg和2mg/kg。通常,以1mg/kg的剂量施用新辅助联合疗法的抗ctla-4抗体组分。在一些实施方案中,以约0.3mg/kg至约30mg/kg范围内的剂量施用新辅助联合疗法的抗ctla-4组分。有时,以约0.1mg/kg至约20mg/kg范围内、或约0.1mg/kg至约15mg/kg范围内、或约0.1mg/kg至约10mg/kg范围内、或约0.5mg/kg至约10mg/kg范围内、或约0.5mg/kg至约5mg/kg范围内、或约0.5mg/kg至约3mg/kg范围内、或约0.5mg/kg至约2mg/kg范围内的剂量施用新辅助联合疗法的抗ctla-4组分。在某些实施方案中,以小于约3mg/kg或小于约2mg/kg的剂量施用新辅助联合疗法的抗ctla-4抗体组分。有时,以选自由以下组成的组的剂量施用新辅助联合疗法的抗ctla-4组分:约1mg/kg和约2mg/kg。通常,以约1mg/kg的剂量施用新辅助联合疗法的抗ctla-4抗体组分。
[0114]
在具体实施方案中,本发明提供了一种治疗患有实体瘤的受试者的癌症、减轻所述癌症的症状和/或延缓所述癌症的进展的方法,所述方法包括向所述受试者施用新辅助联合疗法,所述新辅助联合疗法包含:
[0115]
(a)800mg或约800mg的固定剂量的可活化抗pdl1抗体,其中所述可活化抗pdl1抗体包含:
[0116]
(i)结合人pdl1的抗体或其抗原结合部分(ab),所述ab包含:
[0117]
重链可变区(vh),所述vh包含:含有seq id no:125的氨基酸序列的互补决定区1(cdrh1)、含有seq id no:126的氨基酸序列的互补决定区2(cdrh2)和含有seq id no:127的氨基酸序列的互补决定区3(cdrh3),和
[0118]
轻链可变区(vl),所述vl包含:含有seq id no:128的氨基酸序列的轻链互补决定区1(cdrl1)、含有seq id no:129的氨基酸序列的轻链互补决定区2(cdrl2)和含有seq id no:130的氨基酸序列的轻链互补决定区3(cdrl3);
[0119]
(ii)直接或间接地连接至所述ab的可裂解部分(cm),其中所述cm是用作蛋白酶的底物的多肽;和
[0120]
(iii)直接或间接地连接至所述cm的掩蔽部分(mm);以及
[0121]
(b)1mg/kg的剂量的抗ctla-4抗体。
[0122]
合适的mm、cm、间隔区和接头氨基酸序列包括本文所述的那些氨基酸序列的任一者。在这些实施方案的一些实施方案中,可活化抗pdl1抗体包含含有seq id no:118的氨基酸序列的重链可变区(vh)和含有seq id no:119的氨基酸序列的轻链可变区(vl)。在这些实施方案的某些实施方案中,可活化抗pdl1抗体包含轻链和重链,其中轻链包含mm、cm和vl,并且其中轻链包含seq id no:120的氨基酸序列,并且其中重链包含含有seq id no:118的氨基酸序列的vh;或者包含轻链和重链,并且其中轻链包含间隔区、mm、cm和vl,并且其中轻链包含seq id no:121的氨基酸序列,并且其中重链包含含有seq id no:118的氨基酸序列的vh。
[0123]
在另一个具体实施方案中,本发明提供了一种治疗患有实体瘤的受试者的癌症、减轻所述癌症的症状和/或延缓所述癌症的进展的方法,所述方法包括向所述受试者施用新辅助联合疗法,所述新辅助联合疗法包含:
[0124]
(a)800mg或约800mg的固定剂量的可活化抗pdl1抗体,
[0125]
其中所述可活化抗pdl1抗体包含含有seq id no:122的氨基酸序列的重链和含有选自由seq id no:123和seq id no:124组成的组的氨基酸序列的轻链,
[0126]
其中所述可活化抗pdl1抗体包含结合人pdl1的抗体或其抗原结合部分(ab)、可裂解部分(cm)和掩蔽部分(mm);以及
[0127]
(b)1mg/kg的剂量的抗ctla-4抗体。在这些实施方案的一些实施方案中,轻链包含seq id no:123的氨基酸序列。在其他实施方案中,轻链包含seq id no:124的氨基酸序列。
[0128]
在某些实施方案中,在完成一个或多个剂量的新辅助联合疗法的施用以及手术切除全部或部分实体瘤的程序之后,所述方法还包括向受试者施用一个或多个剂量的手术后联合疗法,所述手术后联合疗法包含一个剂量的可活化抗pdl1抗体和一个剂量的抗ctla-4抗体。在新辅助联合疗法和手术后联合疗法中采用的可活化抗pdl1抗体和抗ctla-4抗体通常是相同的。
[0129]
在一些实施方案中,在第一手术后时间段内以每一时间间隔一个剂量的手术后联合疗法的频率向受试者施用多个剂量的手术后联合疗法。例如,可向受试者施用二、三、四、五、六、七、八、九或十个或更多个剂量的手术后联合疗法。通常,每三周(21天)施用一个剂量的手术后联合疗法。在一些实施方案中,每周一次施用一个剂量的手术后联合疗法。在一些实施方案中,每两周一次施用一个剂量的手术后联合疗法。在一些实施方案中,每四周一次施用一个剂量的手术后联合疗法。在这些实施方案的某些实施方案中,在手术切除肿瘤之后,在(第一)手术后时间段内以每一时间间隔一个剂量的频率向受试者施用两个剂量的手术后联合疗法。在一些实施方案中,手术后以恒定频率施用多个剂量的手术后联合疗法(例如,可每3周一次施用两个或更多个剂量的手术后联合疗法)。在一些实施方案中,手术
后以可变频率施用多个剂量的手术后联合疗法(例如,手术后联合疗法的前两个剂量之间的时间段可为3周,而手术后联合疗法的未来剂量可每周施用一次)。如本领域普通技术人员将理解的,可采用本文所述的手术后联合疗法的其他恒定和可变给药周期。通常,在手术切除肿瘤之后一、二、三、四、五、六、七、八、九、十、十一或十二周施用第一剂量的手术后联合疗法。在某些实施方案中,在手术切除全部或部分肿瘤的程序之后四至八周或五至七周范围内的时间点施用第一剂量的手术后联合疗法。在一些实施方案中,在手术切除肿瘤之后约六周施用第一剂量的手术后联合疗法。
[0130]
在这些实施方案的某些实施方案中,以240mg至2400mg范围内的固定剂量施用手术后联合疗法的可活化抗pdl1抗体组分。在一些实施方案中,以800mg的固定剂量施用手术后联合疗法的可活化抗pdl1抗体组分。在其他实施方案中,以0.3mg/kg至30mg/kg范围内的剂量向受试者施用手术后联合疗法的可活化抗pdl1抗体组分。在一些实施方案中,以0.3mg/kg、1.0mg/kg、3.0mg/kg、10.0mg/kg或30.0mg/kg的剂量向受试者施用手术后联合疗法的可活化抗pdl1抗体组分。在这些实施方案的某些实施方案中,以约240mg至约2400mg范围内的固定剂量施用手术后联合疗法的可活化抗pdl1抗体组分。在一些实施方案中,以约800mg的固定剂量施用手术后联合疗法的可活化抗pdl1抗体组分。在其他实施方案中,以约0.3mg/kg至约30mg/kg范围内的剂量向受试者施用手术后联合疗法的可活化抗pdl1抗体组分。在一些实施方案中,以约0.3mg/kg、约1.0mg/kg、约3.0mg/kg、约10.0mg/kg或约30.0mg/kg的剂量向受试者施用手术后联合疗法的可活化抗pdl1抗体组分。
[0131]
在一些实施方案中,以0.3mg/kg至30mg/kg范围内的剂量施用手术后联合疗法的抗ctla-4抗体组分。有时,以0.1mg/kg至20mg/kg范围内、或0.1mg/kg至15mg/kg范围内、或0.1mg/kg至10mg/kg范围内、或0.5mg/kg至10mg/kg范围内、或0.5mg/kg至5mg/kg范围内、或0.5mg/kg至3mg/kg范围内、或0.5mg/kg至2mg/kg范围内的剂量施用手术后联合疗法的抗ctla-4抗体组分。在某些实施方案中,以小于3mg/kg或小于2mg/kg的剂量施用手术后联合疗法的抗ctla-4抗体组分。有时,以选自由以下组成的组的剂量施用手术后联合疗法的抗ctla-4抗体组分:1mg/kg和2mg/kg。通常,以1mg/kg的剂量施用手术后联合疗法的抗ctla-4抗体组分。在某些实施方案中,以800mg的固定剂量向受试者施用手术后联合疗法的可活化抗pdl1抗体组分,并且以1mg/kg的剂量向受试者施用手术后联合疗法的抗ctla-4抗体组分。在一些实施方案中,以约0.3mg/kg至约30mg/kg范围内的剂量施用手术后联合疗法的抗ctla-4抗体组分。有时,以约0.1mg/kg至约20mg/kg范围内、或约0.1mg/kg至约15mg/kg范围内、或约0.1mg/kg至约10mg/kg范围内、或约0.5mg/kg至约10mg/kg范围内、或约0.5mg/kg至约5mg/kg范围内、或约0.5mg/kg至约3mg/kg范围内、或约0.5mg/kg至约2mg/kg范围内的剂量施用手术后联合疗法的抗ctla-4抗体组分。在某些实施方案中,以小于约3mg/kg或小于约2mg/kg的剂量施用手术后联合疗法的抗ctla-4抗体组分。有时,以选自由以下组成的组的剂量施用手术后联合疗法的抗ctla-4抗体组分:约1mg/kg和约2mg/kg。通常,以约1mg/kg的剂量施用手术后联合疗法的抗ctla-4抗体组分。在某些实施方案中,以约800mg的固定剂量向受试者施用手术后联合疗法的可活化抗pdl1抗体组分,并且以约1mg/kg的剂量向受试者施用手术后联合疗法的抗ctla-4抗体组分。
[0132]
在一些实施方案中,采用作为单一疗法施用可活化抗pdl1抗体的手术后方案。通常,可活化抗pdl1抗体与新辅助联合疗法和手术后联合疗法中采用的抗体相同。在这些实
施方案中,在施用一个或多个剂量的手术后联合疗法之后,作为单一疗法向受试者施用一个或多个剂量的可活化抗pdl1抗体。在一些实施方案中,在施用最后一个剂量的手术后联合疗法之后至少1周施用第一剂量的手术后单一疗法。在一些实施方案中,在施用最后一个剂量的手术后联合疗法之后至少2周施用第一剂量的手术后单一疗法。在一些实施方案中,在施用最后一个剂量的手术后联合疗法之后至少3周施用第一剂量的手术后单一疗法。在一些实施方案中,在施用最后一个剂量的手术后联合疗法之后至少4周施用第一剂量的手术后单一疗法。在某些实施方案中,在施用最后一个剂量的手术后联合疗法之后1周施用第一剂量的手术后单一疗法。在某些实施方案中,在施用最后一个剂量的手术后联合疗法之后2周施用第一剂量的手术后单一疗法。在某些实施方案中,在施用最后一个剂量的手术后联合疗法之后3周施用第一剂量的手术后单一疗法。在某些实施方案中,在施用最后一个剂量的手术后联合疗法之后4周施用第一剂量的手术后单一疗法。
[0133]
通常,在第二手术后时间段内以每一时间间隔一个剂量的可活化抗pdl1抗体的频率向受试者施用多个剂量的手术后单一疗法。例如,可向受试者施用二、三、四、五、六、七、八、九或十个或更多个剂量的手术后单一疗法。在一些实施方案中,以每2周一个剂量的可活化抗pdl1抗体的频率向受试者施用多个剂量的手术后单一疗法。单一疗法治疗可持续直到受试者不再表现出改善。在一些实施方案中,单一疗法治疗持续长达一年。通常,将多个剂量的可活化抗pdl1抗体作为单一疗法施用至受试者。在一些实施方案中,单一疗法剂量每两周施用一次。在一些实施方案中,在第二手术后时间段内以恒定频率作为单一疗法向受试者施用多个剂量的可活化抗pdl1抗体(例如,作为单一疗法向受试者施用两个或更多个剂量的可活化抗pdl1抗体,可每两周施用一次)。在一些实施方案中,在第二手术后时间段内以可变频率作为单一疗法向受试者施用多个剂量的可活化抗pdl1抗体(例如,可活化抗pdl1的前两个剂量之间的时间段可为两周,而可活化抗pdl1抗体的未来剂量可每周或每月施用一次)。如本领域普通技术人员将理解的,可采用本文所述的可活化抗pdl1抗体的其他恒定和可变给药周期。
[0134]
在一些实施方案中,在先前没有施用手术后联合疗法的情况下,采用作为单一疗法施用可活化抗pdl1抗体的手术后方案。通常,可活化抗pdl1抗体与新辅助联合疗法中采用的抗体相同。在这些实施方案中,在手术之后,作为单一疗法向受试者施用一个或多个剂量的可活化抗pdl1抗体。在一些实施方案中,在手术之后至少1周施用第一剂量的手术后单一疗法。在一些实施方案中,在手术之后至少2周施用第一剂量的手术后单一疗法。在一些实施方案中,在手术之后至少3周施用第一剂量的手术后单一疗法。在一些实施方案中,在手术之后至少4周施用第一剂量的手术后单一疗法。在某些实施方案中,在手术之后1周施用第一剂量的手术后单一疗法。在某些实施方案中,在手术之后2周施用第一剂量的手术后单一疗法。在某些实施方案中,在手术之后3周施用第一剂量的手术后单一疗法。在某些实施方案中,在手术之后4周施用第一剂量的手术后单一疗法。
[0135]
通常,在第一手术后时间段内以每一时间间隔一个剂量的可活化抗pdl1抗体的频率向受试者施用多个剂量的手术后单一疗法。例如,可向受试者施用二、三、四、五、六、七、八、九或十个或更多个剂量的手术后单一疗法。在一些实施方案中,以每2周一个剂量的可活化抗pdl1抗体的频率向受试者施用多个剂量的手术后单一疗法。单一疗法治疗可持续直到受试者不再表现出改善。在一些实施方案中,单一疗法治疗持续长达一年。通常,将多个
剂量的可活化抗pdl1抗体作为单一疗法施用至受试者。在一些实施方案中,单一疗法剂量每两周施用一次。在一些实施方案中,在第一手术后时间段内以恒定频率作为单一疗法向受试者施用多个剂量的可活化抗pdl1抗体(例如,作为单一疗法向受试者施用两个或更多个剂量的可活化抗pdl1抗体,可每两周施用一次)。在一些实施方案中,在第一手术后时间段内以可变频率作为单一疗法向受试者施用多个剂量的可活化抗pdl1抗体(例如,可活化抗pdl1的前两个剂量之间的时间段可为两周,而可活化抗pdl1抗体的未来剂量可每周或每月施用一次)。如本领域普通技术人员将理解的,可采用本文所述的可活化抗pdl1抗体的其他恒定和可变给药周期。
[0136]
在一些实施方案中,(在先前施用或没有施用手术后联合疗法的情况下)作为单一疗法施用至受试者的可活化抗pdl1抗体的剂量是240mg至2400mg范围内的固定剂量。在一些实施方案中,当作为单一疗法施用时,以800mg的固定剂量施用可活化抗pdl1抗体。在其他实施方案中,当作为单一疗法施用时,以0.3mg/kg至30mg/kg范围内的剂量向受试者施用可活化抗pdl1抗体。在这些实施方案的某些实施方案中,以0.3mg/kg、1.0mg/kg、3.0mg/kg、10.0mg/kg或30.0mg/kg的剂量作为单一疗法向受试者施用可活化抗pdl1抗体。通常,每2周向受试者施用多个剂量的手术后单一疗法,每一剂量为800mg的固定剂量的可活化抗pdl1抗体。在一些实施方案中,(在先前施用或没有施用手术后联合疗法的情况下)作为单一疗法施用至受试者的可活化抗pdl1抗体的剂量是约240mg至约2400mg范围内的固定剂量。在一些实施方案中,当作为单一疗法施用时,以约800mg的固定剂量施用可活化抗pdl1抗体。在一些实施方案中,当作为单一疗法施用时,以约0.3mg/kg至约30mg/kg范围内的剂量向受试者施用可活化抗pdl1抗体。在这些实施方案的某些实施方案中,以约0.3mg/kg、约1.0mg/kg、约3.0mg/kg、约10.0mg/kg或约30.0mg/kg的剂量作为单一疗法向受试者施用可活化抗pdl1抗体。通常,每2周向受试者施用多个剂量的手术后单一疗法,每一剂量为约800mg的固定剂量的可活化抗pdl1抗体。
[0137]
在施用新辅助联合疗法和手术后联合疗法的可活化抗pdl1抗体和抗ctla-4组分时,可使用有关施用途径、施用持续时间和施用顺序的相同的方案。通常,当作为联合疗法(即,新辅助联合疗法或手术后联合疗法)的组分施用时,在施用抗ctla-4抗体之前向受试者施用可活化抗pdl1抗体。在某些实施方案中,在新辅助联合疗法或手术后联合疗法的可活化抗pdl1抗体组分的施用完成后不早于30分钟向受试者施用抗ctla-4抗体。通常,在同一天向受试者施用新辅助联合疗法的组分(即,可活化抗pdl1抗体和抗ctla-4抗体)。同样,通常在同一天施用手术后联合疗法的组分(即,可活化抗pdl1抗体和抗ctla-4抗体)。在一些实施方案中,通过静脉(iv)输注向受试者施用可活化抗pdl1抗体。相似地,在一些实施方案中,通过静脉输注向受试者施用抗ctla-4抗体。通常,通过静脉内(例如,通过静脉输注)向受试者施用可活化抗pdl1抗体和抗ctla-4抗体两者。
[0138]
在一些实施方案中,当作为联合疗法(即,新辅助联合疗法或手术后联合疗法)的组分施用时,在施用抗ctla-4抗体之后向受试者施用可活化抗pdl1抗体。在某些实施方案中,在新辅助联合疗法或手术后联合疗法的可活化抗ctla-4抗体组分的施用完成后不早于30分钟向受试者施用可活化抗pdl1抗体。通常,在同一天向受试者施用新辅助联合疗法的组分(即,可活化抗pdl1抗体和抗ctla-4抗体)。同样,通常在同一天施用手术后联合疗法的组分(即,可活化抗pdl1抗体和抗ctla-4抗体)。在一些实施方案中,通过静脉(iv)输注向受
试者施用可活化抗pdl1抗体。相似地,在一些实施方案中,通过静脉输注向受试者施用抗ctla-4抗体。通常,通过静脉内(例如,通过静脉输注)向受试者施用可活化抗pdl1抗体和抗ctla-4抗体两者。
[0139]
在施用可活化抗pdl1抗体手术后单一疗法时,可使用有关施用途径、施用持续时间和施用顺序的相同的方案。在一些实施方案中,以静脉内方式(例如,通过静脉输注)向受试者施用可活化抗pdl1抗体手术后单一疗法。
[0140]
在具体实施方案中,施用联合疗法(例如,新辅助联合疗法或手术后联合疗法)包括:
[0141]
(i)在60分钟或约60分钟时间段内通过静脉输注施用可活化抗pdl1抗体;
[0142]
(ii)施用盐水冲洗;以及
[0143]
(iii)在30分钟或约30分钟时间段内通过静脉输注施用抗ctla-4抗体,
[0144]
其中施用抗ctla-4抗体的步骤在施用可活化抗pdl1抗体的步骤完成后不早于30分钟或约30分钟进行。
[0145]
在具体实施方案中,施用联合疗法(例如,新辅助联合疗法或手术后联合疗法)包括:
[0146]
(i)在30分钟或约30分钟时间段内通过静脉输注施用抗ctla-4抗体;
[0147]
(ii)施用盐水冲洗;以及
[0148]
(iii)在60分钟或约60分钟时间段内通过静脉输注施用可活化抗pdl1抗体,
[0149]
其中施用可活化抗pdl1抗体的步骤在施用抗ctla-4可活化抗pdl1抗体的步骤完成后不早于30分钟或约30分钟进行。
[0150]
在一些实施方案中,在30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115或120分钟时间段内通过静脉输注施用可活化抗pdl1抗体。在一些实施方案中,在约30、约35、约40、约45、约50、约55、约60、约65、约70、约75、约80、约85、约90、约95、约100、约105、约110、约115或约120分钟时间段内通过静脉输注施用可活化抗pdl1抗体。在一些实施方案中,在15、20、25、30、35、40、45、50、55或60分钟时间段内通过静脉输注施用抗ctla-4抗体。在一些实施方案中,在约15、约20、约25、约30、约35、约40、约45、约50、约55或约60分钟时间段内通过静脉输注施用抗ctla-4抗体。在一些实施方案中,在施用可活化抗pdl1抗体的步骤完成后不早于15、20、25、30、35、40、45、50、55或60分钟施用抗ctla-4抗体。在一些实施方案中,在施用可活化抗pdl1抗体的步骤完成后不早于约15、约20、约25、约30、约35、约40、约45、约50、约55或约60分钟施用抗ctla-4抗体。在一些实施方案中,在施用抗ctla-4抗体的步骤完成后不早于15、20、25、30、35、40、45、50、55或60分钟施用可活化抗pdl1抗体。在一些实施方案中,在施用抗ctla-4抗体的步骤完成后不早于约15、约20、约25、约30、约35、约40、约45、约50、约55或约60分钟施用可活化抗pdl1抗体。
[0151]
在具体实施方案中,所述方法包括以每3周一个剂量的频率向受试者施用2个剂量的新辅助联合疗法,以及在第一手术后时间段内以每3周一个剂量的频率向受试者施用两个剂量的手术后联合疗法,以及在第二手术后时间段内以每2周一个剂量的频率向受试者施用多个剂量的手术后单一疗法,其中新辅助联合疗法和术后联合疗法各包含800mg的固定剂量的可活化抗fpdl1抗体和1mg/kg的剂量的抗ctla-4抗体,并且其中手术后单一疗法包含800mg的固定剂量的可活化抗pdl1抗体。在另一个具体实施方案中,所述方法包括以约
每3周一个剂量的频率向受试者施用2个剂量的新辅助联合疗法,以及在第一手术后时间段内以约每3周一个剂量的频率向受试者施用两个剂量的手术后联合疗法,以及在第二手术后时间段内以约每2周一个剂量的频率向受试者施用多个剂量的手术后单一疗法,其中新辅助联合疗法和术后联合疗法各包含约800mg的固定剂量的可活化抗pdl1抗体和约1mg/kg的剂量的抗ctla-4抗体,并且其中手术后单一疗法包含约800mg的固定剂量的可活化抗pdl1抗体。
[0152]
适用于本文所述的方法和治疗中的抗ctla-4抗体包括对人ctla-4具有结合特异性的任何抗ctla-4抗体。通常,抗ctla-4抗体是伊匹单抗。伊匹单抗是一种全人源igg1单克隆抗体,可阻断ctla-4与其b7配体的结合,并以yervoy销售。在一些实施方案中,抗ctla-4抗体是曲美木单抗(tremelimumab)(也称为替西木单抗(ticilimumab)或cp-675,206),这是一种阻断ctla-4与其b7配体的结合的全人源igg2单克隆抗体(参见,例如,lee等人,j gynecol oncol.2019年11月;30(6):e112.doi:10.3802/jgo.2019.30.e112.,所述文献以引用方式整体并入本文)。在一些实施方案中,抗ctla-4抗体是cs1002,这是一种阻断ctla-4与其b7配体的结合的全人源igg1单克隆抗体。在一些实施方案中,抗ctla-4抗体是泽弗利单抗(zalifrelimab)(也称为agen1884),这是一种igg1单克隆抗体。在一些实施方案中,抗ctla-4抗体是adu-1604,这是一种人源化igg2单克隆抗体。在一些实施方案中,抗ctla-4抗体是cbt-509,这是一种新型igg1人源化单克隆抗体(参见,例如,shi等人,doi:10.1200/jco.2019.37.8_suppl.32journal of clinical oncology 37,第8期_增刊(2019年3月10日)32-32,所述文献以引用方式整体并入本文)。考虑将其他抗ctla-4抗体与本文所述的方法和材料一起使用,这些抗体例如有waight等人(cancer cell.2018年6月11日;33(6):1033
–
1047.e5,doi:10.1016/j.ccell.2018.05.005,其以引用方式整体并入本文)公开的任何抗ctla-4抗体,或本领域普通技术人员通过搜索clinicaltrials.gov网站可找到的任何抗ctla-4抗体。
[0153]
在这些方法的实践中采用的受试者通常在医师的照料下,并且通常被诊断为患有实体瘤。在一些实施方案中,所述方法包括在施用最后一个剂量的新辅助联合疗法之后手术切除受试者的全部或部分实体瘤的另一步骤。在某些实施方案中,在手术切除全部或部分实体瘤的步骤之后,所述方法还包括根据本文所述的方法施用一个或多个剂量的手术后联合疗法。在一些实施方案中,所述方法还包括根据本文所述的方法施用一个或多个剂量的手术后单一疗法。
[0154]
在本文所述的实施方案中,癌症通常是黑素瘤。黑素瘤可为可切除的iii期黑素瘤。可通过组织学或细胞学评估确认可切除的iii期黑素瘤。
[0155]
实施例1中描述了利用上述联合疗法的例示性治疗方案。
[0156]
在本发明的方法中采用的可活化抗pdl1抗体和抗ctla-4抗体可配制成适于静脉内施用的药物组合物。每种化合物都可以冻干或溶液形式提供,但如果任一化合物以冻干形式提供,则在施用前将其溶解在药学上可接受的稀释剂中。对于静脉内施用,合适的稀释剂包括生理盐水、抑菌水、cremophor el
tm
(basf,parsippany,n.j.)、磷酸盐缓冲盐水(pbs)等。包含适用于本发明的实践中的可活化抗pdl1抗体的药物组合物描述于pct公布第wo 2016/149201号和第wo 2018/222949号中,所述公布各自以引用方式并入本文。在所有情况下,组合物必须是无菌的。
[0157]
在另一个实施方案中,本发明提供了一种用于治疗癌症的可活化抗pdl1抗体或包含可活化抗pdl1抗体和药学上可接受的稀释剂的组合物,其中所述治疗包括向受试者静脉内施用所述可活化抗pdl1抗体或其组合物与向所述受试者静脉内施用的抗ctla-4抗体的新辅助组合,
[0158]
其中所述可活化抗pdl1抗体包含:
[0159]
(i)结合人pdl1的抗体或其抗原结合部分(ab),所述ab包含:
[0160]
重链可变区(vh),所述vh包含:含有seq id no:125的氨基酸序列的互补决定区1(cdrh1)、含有seq id no:126的氨基酸序列的互补决定区2(cdrh2)和含有seq id no:127的氨基酸序列的互补决定区3(cdrh3),和
[0161]
轻链可变区(vl),所述vl包含:含有seq id no:128的氨基酸序列的轻链互补决定区1(cdrl1)、含有seq id no:129的氨基酸序列的轻链互补决定区2(cdrl2)和含有seq id no:130的氨基酸序列的轻链互补决定区3(cdrl3);
[0162]
(ii)直接或间接地连接至所述ab的可裂解部分(cm),其中所述cm是用作蛋白酶的底物的多肽;和
[0163]
(iii)直接或间接地连接至所述cm的掩蔽部分(mm);以及
[0164]
(b)抗ctla-4抗体,
[0165]
其中所述受试者患有实体瘤。
[0166]
编码适用于上述可活化抗pdl1抗体的结构中的cm、mm、vl、vh、接头和间隔区组分的氨基酸序列包括上文所述的那些中的任一者。
[0167]
在另一实施方案中,本发明提供了一种用于治疗癌症的可活化抗pdl1抗体,其中所述治疗包括向受试者静脉内施用800mg的固定剂量的可活化抗pdl1抗体与向所述受试者静脉内施用的1mg/kg的剂量的抗ctla-4抗体的新辅助组合,
[0168]
其中所述可活化抗pdl1抗体包含含有seq id no:122的氨基酸序列的重链和含有选自由seq id no:123和seq id no:124组成的组的氨基酸序列的轻链,
[0169]
其中所述可活化抗pdl1抗体包含结合人pdl1的抗体或其抗原结合部分(ab)、可裂解部分(cm)和掩蔽部分(mm),并且
[0170]
其中所述受试者患有实体瘤。在一些实施方案中,轻链包含seq id no:123的氨基酸序列。在其他实施方案中,轻链包含seq id no:124的氨基酸序列。
[0171]
在一些实施方案中,本文提供了一种用于治疗癌症的可活化抗pdl1抗体或包含可活化抗pdl1抗体和药学上可接受的稀释剂的组合物,其中所述治疗包括向受试者静脉内施用所述可活化抗pdl1抗体或其组合物与向所述受试者静脉内施用的抗ctla-4抗体的手术后组合。在一些实施方案中,在新辅助联合疗法和手术后联合疗法中采用的可活化抗pdl1抗体和抗ctla-4抗体是相同的。
[0172]
在一些实施方案中,本文提供了一种用于治疗癌症的可活化抗pdl1抗体或包含可活化抗pdl1抗体和药学上可接受的稀释剂的组合物,其中所述治疗包括在施用新辅助联合疗法和手术后联合疗法之后,作为手术后单一疗法向受试者静脉内施用所述可活化抗pdl1抗体或其组合物。在一些实施方案中,在新辅助联合疗法、手术后联合疗法和手术后单一疗法中采用的可活化抗pdl1抗体是相同的。
[0173]
新辅助组合的可活化抗pdl1抗体和抗ctla-4抗体组分、手术后联合疗法的可活化
抗pdl1抗体和抗ctla-4抗体组分或适用于上述治疗的手术后单一疗法的可活化抗pdl1抗体各自的剂量和/或给药方案包括本文关于对应治疗方法描述的那些剂量和/或给药方案中的任一者。在一些实施方案中,癌症是黑素瘤,诸如例如可切除的iii期黑素瘤。通常,抗ctla-4抗体是伊匹单抗。
[0174]
用于治疗癌症的可活化抗pdl1抗体可包括本文所述的治疗步骤中的任一者。
[0175]
以下实施例进一步说明了本发明的实践,但不应解释为以任何方式限制本发明的范围。
[0176]
实施例
[0177]
患有实体瘤的受试者中作为新辅助联合疗法的可活化抗pdl1抗体与抗ctla-4抗体的组合的评估
[0178]
本研究基于新辅助联合疗法的新辅助施用后的病理反应,评估pl07-2001-c5h9v2与伊匹单抗的组合在患有实体瘤的受试者中的抗肿瘤作用。
[0179]
pl07-2001-c5h9v2是一种蛋白酶可活化抗pdl1抗体,其包含seq id no:122的重链序列和seq id no:124的轻链序列。pl07-2001-c5h9v2包含两条重链和两条轻链。轻链含有包含mm和cm的前结构域序列。参见wo 2016/149201和wo 2018/222949。对应的活化抗pdl1抗体结合人pdl1。
[0180]
伊匹单抗是一种抗ctla-4抗体。它是一种全人源igg1单克隆抗体,可阻断ctla-4与其b7配体的结合,并以yervoy销售。
[0181]
在本研究中,受试者将接受这样的治疗:2个剂量的800mg pl07-2001-c5h9v2加1mg/kg伊匹单抗的组合(即,q3w,第1天和第22天;全部
±
2天),然后在第43天(-2/+7天)手术切除肿瘤。将在手术后大约6周(即,q3w,第85天(
±
2天)和第106天(
±
2天))再施用2个剂量的800mg p07-2001-c5h9v2加1mg/kg伊匹单抗的组合。在接受第四个剂量的联合治疗之后三周(即,第127天(
±
2天)),受试者将可选择继续接受800mg pl07-2001-c5h9v2单一疗法q2w。受试者可在手术后接受长达一年的pl07-2001-c5hv2(包括2个手术后组合剂量,然后作为单一疗法),直至出现疾病复发、不可接受的毒性或其他中断治疗的原因。向任何受试者施用最多4个剂量的伊匹单抗。研究设计的示意图描绘于图1中。
[0182]
将在60分钟内输注800mg可活化抗pdl1抗体pl07-2001-c5 h9v2。当作为联合疗法的组分施用时,将首先施用可活化抗pdl1抗体,接着是盐水冲洗,然后是伊匹单抗输注。伊匹单抗将在pl07-2001-c5h9v2(可活化抗pdl1抗体)输注完成后不早于30分钟输注。1mg/kg伊匹单抗将以30分钟iv输注形式施用。pl07-2001-c5h9v2输注之间至少需要间隔14天,而伊匹单抗输注之间至少需要间隔21天。在特殊情况下,输注可能最多延迟7天。
[0183]
本研究包括一个受试者群组:患有组织学上确认的可切除的iii期黑素瘤且患有可触及疾病、适于进行治愈性手术的受试者
[0184]
受试者资格标准如下:
[0185]
性别:全部
[0186]
接受健康志愿者:否
[0187]
纳入标准:
[0188]
1.至少18岁
[0189]
2.如通过recist v1.1定义可测量的疾病
[0190]
3.经评估东部肿瘤协作组(ecog)表现状态≤1。
[0191]
4.同意提供肿瘤组织和血液样品用于生物标志物评估
[0192]
5.接受脑转移治疗的受试者是符合条件的,条件是脑转移瘤是稳定的(在治疗完成后至少8周内且在研究治疗第一次给药前28天内磁共振成像(mri)未显示进展证据),并且受试者不需要放射疗法或类固醇。不需要主动筛查脑转移(例如,脑计算机断层扫描或mri)。
[0193]
6.筛查实验室值必须满足以下所有标准:
[0194]
i.白血细胞》2000/μl或2.0x109/l
[0195]
ii.中性粒细胞≥1500/μl或1.5x109/l
[0196]
iii.血小板≥100x103/μl或100x109/l
[0197]
iv.血红蛋白≥9.0g/dl(可能已输血)或90.0g/l
[0198]
v.肌酐≤2mg/dl或176.9μmol/l,或测量或计算的肌酐清除率(肾小球滤过率也可用于代替肌酐或肌酐清除率)》50ml/min
[0199]
vi.ast和alt≤2.5x正常值上限(uln)
[0200]
vii.uln内的总胆红素(除非被诊断为吉尔伯特综合征(gilbert's syndrome),否则这些受试者的总胆红素必须《3.0mg/dl或51.3μmol/l)
[0201]
viii.淀粉酶和脂肪酶≤1.5x uln
[0202]
ix.国际标准化比率(inr)和活化部分凝血活酶时间(aptt)≤1.5x uln
[0203]
x.血清白蛋白≥2.5g/dl
[0204]
7.组织学或细胞学上确认的可切除的iii期黑素瘤,有能够进行活组织检查的1个或多个宏观淋巴结转移(根据recist v1.1可测量的),且过去6个月内没有在途转移的历史。
[0205]
8.乳酸脱氢酶(ldh)在正常范围内。
[0206]
排除标准:
[0207]
1.在研究治疗的第一次给药前28天内用细胞毒性化学疗法、生物制剂、放射、免疫疗法或任何研究性剂进行治疗。对于接受纯骨放射疗法的受试者或最近一次先前疗法是经批准的半衰期为3天或更短时间的单剂小分子激酶抑制剂的受试者,此间隔可缩短至2周。
[0208]
2.先前用包含嵌合抗原受体t细胞的方案进行治疗。
[0209]
3.活动性自身免疫性疾病,包括但不限于炎症性肠病、类风湿性关节炎、自身免疫性甲状腺炎、自身免疫性肝炎、系统性硬化症、系统性红斑狼疮、自身免疫性血管炎、自身免疫性神经病、1型胰岛素依赖型糖尿病的历史。
[0210]
4.心肌炎病史,不论病因。
[0211]
5.对先前检查点抑制剂疗法不耐受的历史,定义为由于irae需要中断治疗。
[0212]
6.中毒性表皮坏死松解症或史蒂文斯-约翰逊综合征病史。
[0213]
7.需要系统性类固醇(≥10mg每日泼尼松等效物)或免疫抑制药物治疗的任何综合征或医学疾患的病史。允许吸入或局部使用类固醇。
[0214]
8.基线校正qt间期(qtc)》470ms。
[0215]
9.先前抗癌疗法导致的未解决的急性毒性ctcae v5.0等级≥1(或基线,以较大者为准)。脱发和其他非急性毒性是可接受的。
[0216]
10.对人mab疗法有严重过敏或过敏反应的历史,或对任何可活化抗体治疗剂有已知超敏反应的历史。
[0217]
11.患有已知人免疫缺陷病毒、获得性免疫缺陷综合征或任何相关疾病的受试者。
[0218]
12.患有急性或慢性乙型或丙型肝炎的受试者。
[0219]
13.同种异体组织/实质器官移植、干细胞移植或骨髓移植的历史。
[0220]
14.在研究治疗第一次给药之前4周内进行过大手术(例如,需要全身麻醉)或在研究治疗第一次给药之前14天进行过小手术(例如,不涉及胸部、腹部或颅内结构)或γ刀治疗(愈合充分)(不包括在局部/表面麻醉下进行的活组织检查),条件是确认完全愈合。
[0221]
15.在过去2年内与所治疗的癌症无关的活动性恶性肿瘤的历史,被认为已治愈且在研究者看来复发风险低的局部癌症除外。这些例外包括但不限于基底细胞或鳞状细胞皮肤癌、浅表性膀胱癌,以及前列腺、宫颈或乳腺的原位癌。
[0222]
16.在研究治疗第一次给药之前30天内接受活疫苗(例如麻疹、腮腺炎、风疹、水痘/疱疹、黄热病、狂犬病、卡介苗和伤寒疫苗)。
[0223]
17.并发疾病,包括但不限于持续的严重主动脉瓣狭窄;研究治疗第一次给药之前24周内发生过心肌梗塞或中风;研究治疗第一次给药之前12周内出现以下任何情况:有症状的充血性心力衰竭(即,纽约心脏协会iii级或iv级)、不稳定型心绞痛或临床上显著且不受控制的心律失常;第1天之前4周内未愈合的伤口或溃疡;以及在研究治疗第一次给药之前5天内需要系统性抗病毒、抗生素或抗真菌疗法的活动性感染。
[0224]
18.每月需要≥1次引流的胸腔或心包积液或腹水。
[0225]
19.多发性骨髓瘤病史。
[0226]
20.怀孕或正在哺乳的女性。
[0227]
21.参与正在进行的介入性临床研究(例如,药物、放射、手术),除非仅是为了获得长期结果而对受试者进行随访。
[0228]
22.黑素瘤的先前系统性治疗。
[0229]
23.诊断为葡萄膜黑素瘤、眼部黑素瘤或皮肤粘膜黑素瘤。
[0230]
定义抗癌活性证据的主要标准是基于对来自手术切除的肿瘤样品的中央审查在新辅助疗法后的病理反应。受试者护理和治疗中断的管理标准是放射学反应评估(手术前)、手术后手术样品的局部病理评估或疾病复发。将在手术切除之前评估如recist v1.1定义的肿瘤反应。
[0231]
下表1中示出了序列表。
[0232]
表1.序列表
[0233]
[0234]
[0235]
[0236]
[0237][0238]
虽然出于清楚和理解的目的已经相当详细地描述了前述发明,但是本领域技术人员通过阅读本公开将清楚,可以在不背离本发明的真实范围的前提下,在形式和细节上做出各种变化。本文提及的所有出版物、专利申请、专利以及其他参考文献以引用方式整体并入本文。如有冲突,以本说明书(包括定义)为准。应理解,本文所述的材料、实例和实施方案仅为了说明的目的,而非旨在限制,并且本领域技术人员将想到根据本发明的各种修改或变化,这些修改或变化均包括在所附权利要求书的精神和范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1