生物相容性膜复合材料的制作方法
1.本发明一般涉及可植入装置领域,尤其涉及生物相容性膜复合材料及其用途。
背景技术:
2.生物疗法是治疗外周动脉疾病、动脉瘤、心脏病、阿尔茨海默病和帕金森病、自闭症、失明、糖尿病和其他疾病的越来越可行的方法。
3.对于一般的生物疗法,细胞、病毒、病毒载体、细菌、蛋白质、抗体和其他生物活性部分可以通过将生物活性部分置于患者组织床中的手术或介入方法引入患者体内。通常,生物活性部分首先放置在装置中,然后再插入患者体内。或者,可以先将装置插入患者体内,然后再添加生物活性部分。
4.外部装置(例如,细胞封装装置、传感器和/或用于测量体内物理参数和/或分析物的监测器)的植入会触发免疫反应,在该免疫反应中异物巨细胞形成并至少部分地包封植入的装置。该装置可以由一种或多种生物相容性膜或其他生物相容性材料形成,这些膜或材料允许营养物或其他治疗上有用的物质通过但阻止细胞通过。在细胞不可渗透的界面处或附近存在异物巨细胞使得血管在靠近该表面的地方很难形成(如果不是不可能形成的话),从而限制了足够装置功能所需的通过装置界面对氧气、营养物、分析物或其他信号传导的可及性。
5.因此,本领域仍然需要一种材料,该材料可用于或可提供能够减轻或调整异物反应的环境,从而在细胞不可渗透界面的表面处或附近发生足够的血管化,从而允许植入的、包封的细胞存活并分泌治疗上有用的物质,并且允许植入的装置获得分析物和物理参数以进行测量。
技术实现要素:
6.在一个方面(“方面1”)中,生物相容性膜复合材料包括:具有第一实体特征体的第一层,该第一实体特征体具有第一实体特征体间距,其中大部分第一实体特征体间距小于约50微米;以及具有第二实体特征体的第二层,该第二实体特征体具有第二实体特征体间距,其中大部分第二实体特征体间距大于约50微米。
7.根据方面1的进一步的另一方面(“方面2”),第一层包括的大部分代表性短轴为约3微米到约20微米。
8.根据方面1或方面2的进一步的另一方面(“方面3”),第二层具有有效直径大于约9微米的第一孔径。
9.根据方面1到方面3中任一方面的进一步的另一方面(“方面4”),第一层具有小于约200微米的第一厚度。
10.根据方面1到方面4中任一方面的进一步的另一方面(“方面5”),第一层具有有效直径为约1微米至约9微米的第二孔径。
11.根据方面5的进一步的另一方面(“方面6”),第一层和第二层中的至少一者的实体
特征体通过原纤维连接并且所述原纤维是可变形的。
12.根据方面1到方面5中任一方面的进一步的另一方面(“方面7”),第二层具有约30微米到约200微米的第二厚度。
13.根据方面1到方面6中任一方面的进一步的另一方面(“方面8”),第一层和第二层中的至少一者包括选自以下的聚合物:膨胀聚四氟乙烯(eptfe)膜、氟化乙烯丙烯(fep)膜和改性的eptfe膜。
14.根据方面1到方面8中任一方面的进一步的另一方面(“方面9”),生物相容性膜复合材料在其上具有表面涂层,所述表面涂层包括选自抗微生物剂、抗体、药物和生物活性分子的一种或多种。
15.根据方面1到方面9中任一方面的进一步的另一方面(“方面10”),第一层和第二层中的至少一者是膨胀聚四氟乙烯膜。
16.根据方面1到方面10中任一方面的进一步的另一方面(“方面11”),第二层是纺粘非织造聚酯材料。
17.根据方面1到方面10中任一方面的进一步的另一方面(“方面12”),包括加强层。
18.根据方面12的进一步的另一方面(“方面13”),加强层是织造或非织造纺织品。
19.根据方面1到方面13中任一方面的进一步的另一方面(“方面14”),第一层的实体特征体包括代表性短轴、代表性长轴和实体特征体深度,其中代表性短轴、代表性长轴和实体特征体深度中的至少两者的大部分大于约5微米。
20.在方面1到方面14中任一方面的进一步的另一方面(“方面15”)中,包括第一层和第二层,该第一层具有有效直径为约1微米至约9微米的第一孔径,小于约200微米的第一厚度,以及第一实体特征体,该第一实体特征体的大部分第一实体特征体间距小于约50微米,其中第一实体特征体的大部分具有约3微米到约20微米的第一代表性短轴。
21.根据方面1到方面15中任一方面的进一步的另一方面(“方面16”),第二层具有有效直径大于约9微米的孔径。
22.根据方面1到方面16中任一方面的进一步的另一方面(“方面17”),第二层包括第二实体特征体,其中大部分第二实体特征体间距大于约50微米。
23.根据方面15到方面17中任一方面的进一步的另一方面(“方面18”),第二层具有约30微米到约200微米的第二厚度。
24.根据方面15到方面18中任一方面的进一步的另一方面(“方面19”),第一层的第一实体特征体各自包括大部分的第一代表性长轴和第一实体特征体深度,其中第一代表性短轴、第一代表性长轴和第一实体特征体深度中的至少两者的大部分大于约5微米。
25.根据方面15到方面19中任一方面的进一步的另一方面(“方面20”),实体特征体通过原纤维连接并且原纤维是可变形的。
26.根据方面15到方面20中任一方面的进一步的另一方面(“方面21”),第二层包括第二实体特征体,大部分第二实体特征体具有小于约40微米的第二代表性短轴。
27.根据方面15到方面21中任一方面的进一步的另一方面(“方面22”),第二层包括第二代表性长轴和第二实体特征体深度,其中第二代表性短轴、第二代表性长轴和第二实体特征体深度中的至少两者的大部分大于约5微米。
28.根据方面15到方面22中任一方面的进一步的另一方面(“方面23”),其中第一层和
第二层中的至少一者是选自以下的聚合物:膨胀聚四氟乙烯(eptfe)膜、氟化乙烯丙烯(fep)膜和改性的eptfe膜。
29.根据方面15到方面23中任一方面的进一步的另一方面(“方面24”),第二层是纺粘非织造聚酯材料。
30.根据方面15到方面24中任一方面的进一步的另一方面(“方面25”),第一层和第二层中的至少一者包括聚合物、含氟聚合物膜、非含氟聚合物膜、织造的生物相容性纺织品、非织造的生物相容性纺织品、纤维或纱线的织造或非织造集合、纤维基质以及它们的组合。
31.根据方面15到方面25中任一方面的进一步的另一方面(“方面26”),第一层的第一实体特征体包括选自以下的一种:热塑性聚合物、聚氨酯、硅酮、橡胶、环氧树脂(epoxies)及其组合。
32.根据方面15到方面26中任一方面的进一步的另一方面(“方面27”),包括加强组件。
33.根据方面27的进一步的另一方面(“方面28”),加强组件是织造或非织造纺织品。
34.根据方面15到方面28中任一方面的进一步的另一方面(“方面29”),生物相容性膜复合材料在其上具有表面涂层,所述表面涂层包括选自抗微生物剂、抗体、药物和生物活性分子的一种或多种。
35.根据方面15到方面29中任一方面的进一步的另一方面(“方面30”),生物相容性膜复合材料在其上具有亲水性涂层。
36.根据方面15到方面30中任一方面的进一步的另一方面(“方面31”),第一层包括可结合实体特征体,其中可结合实体特征体被结合至可植入装置或可植入细胞系统。
37.根据方面31的进一步的另一方面(“方面32”),可植入装置是支架。
38.根据方面32的进一步的另一方面(“方面33”),支架是细胞培养基质。
39.根据方面32的进一步的另一方面(“方面34”),支架是外植体。
40.根据方面31的进一步的另一方面(“方面35”),第一实体特征体至少部分地结合到细胞系统。
41.根据方面35的进一步的另一方面(“方面36”),细胞系统是细胞容器。
42.根据方面31的进一步的另一方面(“方面37”),可植入装置是传感器。
43.根据方面31的进一步的另一方面(“方面38”),细胞系统是生物活性支架。
44.根据前述方面中任一方面的进一步的另一方面(“方面39”),一种用于降低哺乳动物中血糖水平的方法包括移植包含前述方面中任一方面的生物相容性膜复合材料的细胞封装装置,其中封装在其中的细胞包括pdx1阳性胰腺内胚层细胞群,其中胰腺内胚层细胞成熟为胰岛素分泌细胞,从而降低血糖。
45.根据前述方面中任一方面的进一步的另一方面(“方面40”),pdx1阳性胰腺内胚层细胞包括细胞混合物,所述细胞混合物进一步包括内分泌和/或内分泌前体细胞,其中内分泌和/或内分泌前体细胞表达嗜铬粒蛋白a(chga)。
46.根据前述方面中任一方面的进一步的另一方面(“方面41”),一种用于降低哺乳动物中血糖水平的方法包括移植如权利要求1所述的细胞封装装置,其中封装在其中的细胞包括pdx1阳性胰腺内胚层细胞群,其中胰腺内胚层细胞成熟为胰岛素分泌细胞,从而降低血糖。
47.根据前述方面中任一方面的进一步的另一方面(“方面42”),pdx1阳性胰腺内胚层细胞包括细胞混合物,所述细胞混合物进一步包括内分泌和/或内分泌前体细胞,其中内分泌和/或内分泌前体细胞表达嗜铬粒蛋白a(chga)。
48.根据前述方面中任一方面的进一步的另一方面(“方面43”),一种用于降低哺乳动物中血糖水平的方法包括移植细胞封装装置,所述细胞封装装置包括至少一个传感器和至少部分地覆盖所述传感器的生物相容性膜复合材料,其中所述生物相容性膜复合材料包括第一层和第二层,以及细胞群,所述第一层是具有第一实体特征体且第一实体特征体的大部分第一实体特征体间距小于约50微米的第一层,所述第二层是具有第二实体特征体且第二实体特征体的大部分第二实体特征体间距大于约50微米的第二层,其中第一层位于传感器和第二层之间,其中至少一部分的结合的特征体与第一层紧密结合,所述细胞群是包括pdx1阳性胰腺内胚层细胞的细胞群,并且其中胰腺内胚层细胞成熟为胰岛素分泌细胞,从而降低血糖。
49.根据前述方面中任一方面的进一步的另一方面(“方面44”),pdx1阳性胰腺内胚层细胞包括细胞混合物,所述细胞混合物进一步包括内分泌和/或内分泌前体细胞,其中内分泌和/或内分泌前体细胞表达嗜铬粒蛋白a(chga)。
50.根据前述方面中任一方面的进一步的另一方面(“方面45”),一种用于降低哺乳动物中血糖水平的方法包括移植至少一个传感器和至少部分地覆盖所述传感器的生物相容性膜复合材料,其中所述生物相容性膜复合材料包括第一层和第二层、以及细胞群,所述第一层是具有第一实体特征体且第一实体特征体的大部分第一实体特征体间距小于约50微米的第一层,所述第二层是具有第二实体特征体且第二实体特征体的大部分第二实体特征体间距大于约50微米的第二层,其中第一层位于传感器和第二层之间,其中至少一部分的结合的特征体与第一层紧密结合,所述细胞群是包括pdx1阳性胰腺内胚层细胞的细胞群,并且其中胰腺内胚层细胞成熟为胰岛素分泌细胞,从而降低血糖。
51.根据前述方面中任一方面的进一步的另一方面(“方面46”),pdx1阳性胰腺内胚层细胞包括细胞混合物,所述细胞混合物进一步包括内分泌和/或内分泌前体细胞,其中内分泌和/或内分泌前体细胞表达嗜铬粒蛋白a(chga)。
52.根据前述方面中任一方面的进一步的另一方面(“方面47”),封装的体外pdx1阳性胰腺内胚层细胞包括细胞亚群的混合物,所述细胞亚群的混合物至少包括共表达pdx-1/nkx6.1的胰腺祖细胞群。
53.根据前述方面中任一方面的进一步的另一方面(“方面48”),封装的体外pdx1阳性胰腺内胚层细胞包括细胞亚群的混合物,所述细胞亚群的混合物至少包括共表达pdx-1/nkx6.1的胰腺祖细胞群和表达pdx-1/nkx6.1和chga的胰腺内分泌和/或内分泌前体群。
54.根据前述方面中任一方面的进一步的另一方面(“方面49”),群的至少30%包括共表达pdx-1/nkx6.1的胰腺祖细胞群。
55.根据前述方面中任一方面的进一步的另一方面(“方面50”),群的至少40%包括共表达pdx-1/nkx6.1的胰腺祖细胞群。
56.根据前述方面中任一方面的进一步的另一方面(“方面51”),群的至少50%包括共表达pdx-1/nkx6.1的胰腺祖细胞群。
57.根据前述方面中任一方面的进一步的另一方面(“方面52”),群的至少20%包括表
达pdx-1/nkx6.1/chga的内分泌和/或内分泌前体群。
58.根据前述方面中任一方面的进一步的另一方面(“方面53”),群的至少30%包括表达pdx-1/nkx6.1/chga的内分泌和/或内分泌前体群。
59.根据前述方面中任一方面的进一步的另一方面(“方面54”),群的至少40%包括表达pdx-1/nkx6.1/chga的内分泌和/或内分泌前体群。
60.根据前述方面中任一方面的进一步的另一方面(“方面55”),胰腺祖细胞和/或内分泌或内分泌前体细胞能够在体内成熟为胰岛素分泌细胞。
61.根据前述方面中任一方面的进一步的另一方面(“方面56”),一种体内产生胰岛素的方法包括移植细胞封装装置,该装置包括前述方面中任一方面的生物相容性膜复合材料和成熟为胰岛素分泌细胞的pdx-1胰腺内胚层细胞群,其中胰岛素分泌细胞响应葡萄糖刺激而分泌胰岛素。
62.根据前述方面中任一方面的进一步的另一方面(“方面57”),pdx1阳性胰腺内胚层细胞包括细胞混合物,所述细胞混合物进一步包括内分泌和/或内分泌前体细胞的细胞混合物,其中内分泌和/或内分泌前体细胞表达嗜铬粒蛋白a(chga)。
63.根据前述方面中任一方面的进一步的另一方面(“方面58”),群的至少约30%是表达pdx-1/nkx6.1/chga的内分泌和/或内分泌前体群。
64.根据前述方面中任一方面的进一步的另一方面(“方面59”),体外人pdx1阳性胰腺内胚层细胞培养物包括pdx-1阳性胰腺内胚层细胞和至少一种转化生长因子β(tgf-β)受体激酶抑制剂的混合物。
65.根据前述方面中任一方面的进一步的另一方面(“方面60”),还包括骨形态发生蛋白(bmp)抑制剂。
66.根据前述方面中任一方面的进一步的另一方面(“方面61”),tgf-β受体激酶抑制剂是tgf-β受体1型激酶抑制剂。
67.根据前述方面中任一方面的进一步的另一方面(“方面62”),tgf-β受体激酶抑制剂是alk5i。
68.根据前述方面中任一方面的进一步的另一方面(“方面63”),bmp抑制剂是头蛋白(noggin)。
69.附图简要说明
70.包括附图以提供对本公开的进一步理解,附图被并入本说明书中并构成本说明书的一部分,附图示出了实施方式,并且与说明书一起用于解释本公开的原理。
71.图1a是依据本文所述的实施方式,描绘实体特征体间距的确定的示意图,其中三个相邻实体特征体代表三角形的角,三角形的外接圆的内部没有附加的实体特征体,实体特征体间距是形成三角形的实体特征体中的两个实体特征体之间的直线距离;
72.图1b是依据本文所述实施方式,描绘非相邻实体特征体的确定的示意图,其中实体特征体形成三角形的角,三角形的外接圆包含至少一个附加的实体特征体;
73.图2是根据本文描述的实施方式的eptfe膜中实体特征体(白色形状)之间的间距(白线)的扫描电子显微照片;
74.图3a是描绘根据本文描述的实施方式的确定实体特征体的长轴和短轴的方法的示意图;
75.图3b是描绘根据本文描述的实施方式的实体特征体的深度的示意图;
76.图4是根据本文描述的实施方式的孔的有效直径的示意图;
77.图5是显示根据本文描述的实施方式的孔径的扫描电子显微照片(sem);
78.图6a是根据本文实施方式的可至少部分地被生物相容性膜复合材料覆盖的可植入装置的横截面图的示意图;
79.图6b是根据本文描述的实施方式的可以至少部分地被生物相容性膜复合材料覆盖的生物活性支架的示意图;
80.图7是根据本文描述的实施方式的生物相容性膜复合材料的示意图;
81.图8是根据本文描述的实施方式的另一种生物相容性膜复合材料的示意图;
82.图9是根据本文描述的实施方式的另一种生物相容性膜复合材料的示意图;
83.图10是根据本文描述的实施方式的实施例1的eptfe缓解层的顶表面的扫描电子显微照片(sem);
84.图11是由根据本文描述的实施方式的实施例1中使用的非织造聚酯形成的血管化层的顶表面的扫描电子显微照片(sem);和
85.图12是在根据本文描述的实施方式的实施例1中使用的材料和固定装置的构造的分解图;
86.图13是根据本文描述的实施方式在其上具有fep的实施例2的构建体a、b和c的第二eptfe层的代表性sem图像;
87.图14是根据本文描述的实施方式的实施例2的构建体a中的第二eptfe膜的节点和原纤维结构的代表性sem图像;
88.图15是根据本文描述的实施方式的实施例2的构建体b中的第二eptfe膜的节点和原纤维结构的代表性sem图像;
89.图16是根据本文描述的实施方式的实施例2的构建体c中的第二eptfe膜的节点和原纤维结构的代表性sem图像;
90.图17是根据本文描述的实施方式的实施例2的构建体a的生物相容性膜复合材料的横截面的sem图像;
91.图18是根据本文描述的实施方式的实施例2的构建体b的生物相容性膜复合材料的横截面的sem图像;和
92.图19是根据本文描述的实施方式的实施例2的构建体c的生物相容性膜复合材料的横截面的sem图像。
具体实施方式
93.本领域的技术人员容易理解,可通过构造以实施所需作用的任何数量的方法和设备来实现本公开内容的各个方面。还应注意,本文参考的附图不一定是按比例绘制,而是有可能放大以说明本公开的各个方面,就此而言,附图不应视为限制性的。诸如“上”、“下”、“顶”、“左”、“右”、“前”和“后”等方向描述旨在指代组件和方向所涉及的图(或多个图)中所示和描述的取向。应当理解,术语“生物相容性膜复合材料”和“膜复合材料”在本文中可互换使用。应当注意,本文描述的所有范围本质上都是示例性的并且包括其间的任何和所有值。此外,本文引用的所有参考文献均通过引用整体并入。
94.本公开涉及一种生物相容性膜复合材料,其可以提供能够减轻或调整异物反应的环境。生物相容性膜复合材料包含第一层和第二层。各层都是独立的,具有独特的功能,有助于减少可植入装置或生物活性实体(例如生物活性支架)的细胞不可渗透层上异物巨细胞的形成。在某些实施方式中,第一层起到缓解层的作用,而第二层起到血管化层的作用。在本文中,为方便起见,术语“第一层”与“缓解层”可互换使用,术语“第二层”与“血管化层”可互换使用。缓解层位于可植入装置或生物活性实体与血管化层之间。在至少一个实施方式中,缓解层包括固有地存在于形成缓解层的膜中的实体特征体(例如,节点)。加强组件可以任选地位于生物相容性膜复合材料的任一侧上(即,外部)或生物相容性膜复合材料内(即,内部)以提供对生物相容性膜复合材料的支撑并防止其扭曲。缓解层可以结合(例如,点结合或熔接)到可植入装置和/或生物活性实体。在一些实施方式中,缓解层和血管化层可以彼此紧密结合或以其他方式彼此连接以形成具有开口/开放结构的复合层。如本文所用,术语“紧密结合”和“紧密地结合”是指生物相容性膜复合材料的层或生物相容性膜复合材料内的实体特征体在其表面上的任何点处都不易分离或脱离。应当理解,本文所用的术语“约”表示指定(偏差为)测量单位的+/-10%。
95.在至少一个实施方式中,缓解层和血管化层通过一种或多种生物相容性粘合剂结合在一起以形成生物相容性膜复合材料。粘合剂可以以在层之间产生离散或紧密结合的方式施加到缓解层和血管化层之一或两者的表面上。如本文所用,短语“离散结合”或“离散地结合”意在包括围绕限定区域的连续周边的点和/或线的有意图案的结合。合适的生物相容性粘合剂的非限制性示例包括氟化乙烯丙烯(fep),聚碳酸酯聚氨酯,由tfe和pave组成的热塑性含氟聚合物,efep(乙烯氟化乙烯丙烯),pebax(聚醚酰胺),pvdf(聚偏二氟乙烯),(ab硅酮聚碳酸酯聚氨酯),elasthanetm(聚醚聚氨酯),(硅酮聚醚聚氨酯),聚乙烯,高密度聚乙烯(hdpe),乙烯氯四氟乙烯(ectfe),全氟烷氧基(pfa),聚丙烯,聚对苯二甲酸乙二醇酯(pet)以及它们的组合。
96.在一些实施方式中,本文所述的生物相容性膜复合材料可用作可植入传感器的生物界面,这些传感器用于检测体内产生的分子(例如葡萄糖或其他生物活性分子)或体外产生的分子(例如来自摄入食物的分子)。在另一个实施方式中,生物相容性膜复合材料可用作可植入装置的生物相容性覆盖物,这些装置提供或需要体内的分子、信号或活动以引起它们的功能,例如起搏器。可植入装置可用于测量身体的物理参数,例如血压。在本文中,术语“可植入装置”用于涵盖任何可植入的传感器或可植入的装置。在另一些实施方式中,生物相容性膜复合材料可用作需要血管化以发挥功能但需要保护免受宿主免疫反应(例如但不限于异物巨细胞的形成)的可植入装置的表面层或包封覆盖物。可植入装置可在其上包含第三层(即细胞不可渗透层)。细胞不可渗透层用作微孔性免疫隔离屏障,不受血管向内生长的影响,并防止细胞与宿主接触。在另一个实施方式中,生物相容性膜复合材料可与组织、细胞支架或细胞封装装置结合使用。一些例子包括但不限于外植体、二维(2d)和三维(3d)细胞培养系统或细胞容器。统称“细胞系统”在本文中用于描述可与生物相容性膜复合材料结合使用的任何生物实体。
97.可受益于生物相容性膜复合材料功能的可植入装置的元件包括但不限于开关、传感器、辐射热计、生物传感器、化学传感器、惯性传感器、声学传感器、麦克风、微型扬声器、压力传感器、谐振器、超声波谐振器、温度传感器、振动传感器、微型发动机、致动器、热致动
器、双压电晶片和单压电晶片致动器(例如压电和热)、电动旋转微型机器、微型齿轮、微型泵、微型传输器、微型发动机、光学微机电系统(mems)、微镜、光开关和生物微机电机械系统(mems)。
98.生物相容性膜复合材料与可植入装置的界面是缓解层,其具有足够的多孔性以允许血管组织生长到缓解层中。因此,在一些情况下,缓解层充当初始血管化层。缓解层创造了合适的环境以最大程度减少或甚至防止在可植入装置的表面上或附近形成连续的异物巨细胞层,同时允许血管进入可植入装置的表面。在本文中,具有足够大以允许血管向内生长的开口的层可被称为“开放”层。血管是可植入装置的分析物和营养物的来源,需要在距可植入装置一定距离处形成,以便轻松检测和传输信号。信号的非限制性示例包括葡萄糖、氧、生长因子或需要感测或监测的任何分析物。
99.缓解层的特征至少部分在于包括多个具有实体特征体间距的实体特征体。如本文所用,“实体特征体”可定义为缓解层内的三维组件,当暴露于环境力[例如但不限于细胞运动(例如细胞迁移和向内生长、宿主血管化/内皮血管形成)]时,这些三维组件通常是不可移动且不易变形的。缓解层中的实体特征体可由热塑性聚合物、聚氨酯、硅酮、橡胶、环氧树脂及其组合形成。
[0100]
在缓解层具有节点和原纤维微结构(例如由原纤化聚合物形成)的实施方式中,节点是实体特征体,原纤维不是实体特征体。实际上,在一些实施方式中,可以去除原纤维,仅在缓解层中留下节点。在缓解层内的节点是实体特征体的实施方式中,紧密结合到装置或传感器界面的这些节点在本文中被称为“结合的实体特征体”。“非结合的实体特征体”是缓解层内未结合(未紧密结合或未以其他方式结合)到装置或传感器界面的那些实体特征体。在一个实施方式中,缓解层由具有节点和原纤维微结构的膨胀聚四氟乙烯(eptfe)膜形成。
[0101]
与可植入装置或细胞系统相邻的实体特征体的大部分实体特征体间距小于约50微米,小于约40微米,小于约30微米,小于约20微米或小于约10微米。如本文所用,术语“大部分”意在描述超过一半(即,大于50%)的量为被测量参数的测量值。在一些实施方式中,大部分实体特征体间距的范围可以为约5微米到约45微米、约10微米到约40微米、约10微米到约35微米、或约15微米到约35微米。短语“实体特征体间距”在本文中被定义为两个相邻实体特征体之间的直线距离。在本公开中,如果实体特征体的质心表示外接圆具有空内部的三角形的角,则实体特征体被认为是相邻的。如图1a所示,指定的实体特征体(p)连接到相邻实体特征体(n)以形成三角形100,其中外接圆110内不包含实体特征体。实体特征体(x)表示不是相邻实体特征体的实体特征体。因此,在图1a所示的情况中,实体特征体间距130是指定实体特征体(p)、(n)之间的直线距离。相比之下,图1b中所示的从三角形160绘出的外接圆150在其内部包含实体特征体(n),因此不能用于确定缓解层(或血管化层)中的实体特征体间距。图2是描绘测量距离的扫描电子显微照片,例如由膨胀聚四氟乙烯膜形成的缓解层中的实体特征体210(白色形状)之间的白线200。
[0102]
实体特征体还包括代表性短轴、代表性长轴和实体特征体深度。实体特征体的代表性短轴在本文中被定义为拟合到实体特征体的椭圆的短轴的长度,其中该椭圆具有与实体特征体相同的面积、取向和质心。实体特征体的代表性长轴在本文中被定义为拟合到实体特征体的椭圆的长轴的长度,其中该椭圆具有与实体特征体相同的面积、取向和质心。长轴的长度大于或等于短轴的长度。拟合实体特征体310的椭圆320的短轴和长轴在图3a中以
图形方式示出。实体特征体310的代表性短轴由箭头300描绘,而实体特征体310的代表性长轴由箭头330描绘。大部分实体特征体的短轴的尺寸范围为约3微米到约20微米,约3微米到约15微米,或约3微米到约10微米。实体特征体深度是实体特征体在垂直于层(例如,缓解层或血管化层)表面的轴上的投影长度。实体特征体310的实体特征体深度在图3b中以图形方式示出。实体特征体310的深度由线340描绘。在至少一个实施方式中,实体特征体的深度等于或小于缓解层的厚度。在至少一个实施方式中,代表性短轴、代表性长轴和实体特征体深度中的至少两者的大部分大于5微米。
[0103]
在实体特征体通过原纤维或纤维互连的实施方式中,连接实体特征体的边界产生孔。这些孔必须足够开放,以允许细胞快速向内生长和血管化,并且不会对氧和营养物质的传质产生阻力。孔有效直径通过定量图像分析(qia)测量并在扫描电子显微照片(sem)图像上进行。术语孔的“有效直径”定义为面积等于表面孔的测量面积的圆的直径。这种关系由以下等式定义:
[0104][0105]
参考图4,有效直径是圆400的直径,表面孔由附图标记420表示。表面的总孔面积是该表面上所有孔的面积之和。层的孔径是孔的有效直径,其定义了满足以下条件的一个孔径:总孔面积的大约一半由直径小于该孔径的孔组成,并且总孔面积的一半由直径大于或等于该孔径的孔组成。图5示出了孔径500(白色)、孔径较小的孔510(以浅灰色显示)和孔径较大的孔520(以深灰色显示)。与图像530的边缘相交的孔被排除在分析之外并以黑色显示。
[0106]
缓解层的孔径可以在约1微米至约9微米的有效直径、约3微米至约9微米的有效直径、或约4微米至约9微米的有效直径的范围内,所述有效直径是通过在扫描电子显微照片(sem)图像上进行的定量图像分析(qia)测量的。缓解层的厚度小于约200微米、小于约290微米、小于约280微米、小于约270微米、小于约260微米、小于约200微米、小于约190微米、小于约180微米、小于约170微米、小于约160微米、小于约150微米、小于约140微米、小于约130微米、小于约120微米、小于约110微米、小于约100微米、小于约90微米、小于约80微米、小于约70微米、或小于约60微米、小于约50微米、小于约40微米、小于约30微米、小于约20微米,或小于约10微米。缓解层的厚度可在约60微米至约200微米、约60微米至约170微米、约60微米至约150微米、约60微米至约125微米、约60微米至约100微米、约3微米至约60微米、约10微米至约50微米、约10微米至约40微米、或约15微米至约35微米的范围内。在一些实施方式中,缓解层具有大于约60%的孔隙率。在其他实施方式中,缓解层具有大于约70%、大于约80%、大于约90%或大于约95%的孔隙率。在一些实施方式中,孔隙率可以是约98%或约99%。缓解层的孔隙率可以在约60%至约98%、约70%至约98%、或约80%至约98%的范围内。
[0107]
第二层(即血管化层)进一步促进了可植入装置的锚定和血管组织通过生物相容性膜复合材料向内生长直至装置的表面。血管化层是“开放”层,其允许来自宿主的额外血管渗透并且还允许生物相容性膜复合材料在宿主组织内快速锚定和附着。此外,血管化层提供多孔基质以容纳足够数量的额外新血管的生长,例如生长到可植入装置或细胞系统。
在血管化层不满足缓解层的相同标准的实施方式中,缓解层和血管化层被认为是分开的、独立的层。血管化层被设计成具有实体特征体,从而能够实现宿主的整合和附着。与缓解层的实体特征体相比,这些实体特征体之间具有增加的间距和孔径,以促进组织更快速地向内生长到层中。
[0108]
在一些实施方式中,血管化层中实体特征体的大部分实体特征体间距大于约50微米,大于约60微米,大于约70微米或大于约80微米。血管化层中的大部分实体特征体的实体特征体间距在约50微米到约90微米、约60微米到约90微米、或约70微米到约90微米的范围内。血管化层的孔径和总厚度足以提供空间来容纳必要数量的额外血管,从而为细胞提供营养和氧。血管化层的孔径可以为大于约9微米的有效直径、大于约25微米的有效直径、大于约50微米的有效直径、大于约75微米的有效直径、大于约100微米的有效直径、大于约125微米的有效直径,大于约150微米的有效直径、大于约175微米的有效直径,或大于约200微米的有效直径,所述有效直径是通过在sem图像上进行的qia来测量的。在一些实施方式中,血管化层的孔径的范围可以为约9微米的有效直径到约200微米的有效直径,约9微米的有效直径到约50微米的有效直径,约15微米的有效直径到约50微米的有效直径,约25微米的有效直径到约50微米的有效直径,约50微米的有效直径到约200微米的有效直径,约75微米的有效直径到约175微米的有效直径,所述有效直径是通过在sem图像上进行的qia来测量的。
[0109]
此外,血管化层的厚度可以大于约30微米、大于约50微米、大于约75微米、大于约100微米、大于约125微米、大于约150微米或大于约200微米。此外,血管化层的厚度可在约30微米至约300微米、约30微米至约200微米、约30微米至约100微米、约100微米至约200微米、或约100微米至约150微米的范围内。此外,血管化层中的大部分实体特征体具有小于约40微米、小于约30微米、小于约20微米、小于约10微米、小于约5微米、或小于约3微米的代表性短轴。在一些实施方式中,代表性短轴的尺寸范围可为约3微米至约40微米,约3微米至约30微米,约3微米至约20微米,约3微米至约10微米,或约20微米至约40微米。血管化层中的实体特征体还具有长轴,该长轴的长度大于短轴,并且可能实际上长度是无限的,例如非织造物的连续纤维。血管化层中的实体特征体的深度小于或等于血管化层的总厚度。
[0110]
可以包括任选的加强组件以向生物相容性膜复合材料提供机械支撑,从而使体内变形最小化。这种额外的任选的加强组件为生物相容性膜复合材料提供了大于生物相容性膜复合材料本身的刚度。这种任选的加强组件在本质上可以是连续的,或者其可以存在于生物相容性膜复合材料上的离散区域中,例如,在生物相容性膜复合材料的整个表面上形成图案或位于特定位置,例如围绕生物相容性膜复合材料的周边。适用于膜复合材料表面的非限制性图案包括点、直线、斜线、曲线、虚线、网格等。形成加强组件的图案可以单独使用或组合使用。此外,加强组件本质上可以是暂时的(例如,由生物可吸收材料形成)或本质上可以是永久性的(例如,聚对苯二甲酸乙二醇酯(pet)网或镍钛诺(nitinol))。组件刚度的最终确定不仅取决于单个加强组件的刚度,还取决于加强组件在最终装置形式中的位置和约束。
[0111]
在至少一个实施方式中,可以在血管化层的外表面上提供加强组件以增强生物相容性膜复合材料对环境力的抵抗。在该方向上,加强组件具有足以允许血管向内生长的孔径,因此被认为是“开放”层。可用作加强组件的材料包括比生物相容性膜复合材料具有显
著更高的刚度的材料。此类材料包括但不限于单独或组合的开放网状生物材料纺织品、织造纺织品、非织造纺织品(例如,纤维或纱线的集合)和纤维基质。
[0112]
在一些实施方式中,缓解层和血管化层可以通过一种或多种生物相容性粘合剂结合在一起以形成生物相容性膜复合材料。粘合剂可以以在缓解层和血管化层之间产生离散或紧密结合的方式施加到缓解层和血管化层之一或两者的表面上。合适的生物相容性粘合剂的非限制性示例包括氟化乙烯丙烯(fep),聚碳酸酯聚氨酯,由tfe和pave组成的热塑性含氟聚合物,efep(乙烯氟化乙烯丙烯),pebax(聚醚酰胺),pvdf(聚偏二氟乙烯),(ab硅酮聚碳酸酯聚氨酯),elasthane
tm
(聚醚聚氨酯),(硅酮聚醚聚氨酯),聚乙烯,高密度聚乙烯(hdpe),乙烯氯四氟乙烯(ectfe),全氟烷氧基(pfa),聚丙烯,聚对苯二甲酸乙二醇酯(pet)以及它们的组合。
[0113]
在一些实施方式中,缓解层和血管化层中的至少一者可以由聚合物膜、或者纤维或纱线的织造或非织造集合、或者纤维基质、单独或组合地形成。可以使用的聚合物的非限制性实例包括但不限于藻酸盐;醋酸纤维素;聚亚烷基二醇,例如聚乙二醇和聚丙二醇;泛乙烯基聚合物,例如聚乙烯醇;壳聚糖;聚丙烯酸酯,例如聚甲基丙烯酸羟乙酯;琼脂糖;水解聚丙烯腈;聚丙烯腈共聚物;聚乙烯基丙烯酸酯,例如聚乙烯-共-丙烯酸,聚烯烃,例如聚丙烯、聚乙烯;聚偏二氟乙烯;氟化乙烯丙烯(fep);全氟烷氧基烷烃(pfa);聚酯砜(pes);聚氨酯;聚酯;以及它们的共聚物和组合。在一些实施方式中,血管化层可以是纺粘、非织造聚酯或膨胀聚四氟乙烯(eptfe)膜。
[0114]
在一些实施方式中,缓解层、血管化层或加强组件中的至少一者由非织造织物形成。有许多类型的非织造织物,每种非织造织物在编织的紧密度和片材的厚度方面可能不同。长丝的横截面可以是三叶形的。非织造织物可以是结合织物、成形织物或通过除编织或针织以外的工艺制造的工程织物。在一些实施方式中,非织造织物是多孔的、类似纺织品的材料,通常呈平板形式,并且主要或完全由纤维组成,例如组装成网、片或毡的短纤维。非织造织物的结构基于例如通常随机排列的短纤维的排列。此外,非织造织物可以通过纺织工业中已知的各种技术制造。各种方法可以产生梳理、湿法成网、熔喷、纺粘或气流成网的非织造材料。方法和基材在例如授予colter等人的美国专利公开第2010/0151575号中有所描述。在一个实施方式中,非织造织物是聚四氟乙烯(ptfe)。在另一个实施方式中,非织造织物是纺粘聚酯。非织造织物的密度可根据加工条件而变化。在一个实施方式中,非织造织物是纺粘聚酯,其基重为约10g/m2至约20g/m2,标称厚度为约75微米至约150微米,且纤维直径为约20微米至约40微米。长丝的横截面是三叶形的。长丝的横截面是三叶形的。在一些实施方式中,非织造织物是可生物吸收的。
[0115]
在一些实施方式中,形成缓解层和/或血管化层的聚合物膜的聚合物是可原纤化的聚合物。如本文所定义的,可原纤化是指将原纤维引入聚合物膜的能力,包括但不限于将实体特征体的一些部分转化为原纤维。例如,原纤维是跨越实体特征体之间的间隙的实体元件。原纤维在暴露于环境力时通常对变形没有抵抗力,因此是可变形的。缓解层和/或血管化层中的大部分可变形原纤维的直径可小于约2微米、小于约1微米、小于约0.75微米、小于约0.50微米或小于约0.25微米。在一些实施方式中,原纤维可具有约0.25微米至约2微米、约0.5微米至约2微米、或约0.75微米至约2微米的直径。
[0116]
在一些实施方式中,缓解层和血管化层中的一者或两者的实体特征体可通过以下
方式来形成:将聚合物(例如,热塑性材料)微光刻、微成型、机械加工、选择性沉积或印刷(或以其他方式铺设)到缓解层或血管化层以形成至少一部分的实体特征体。可以利用任何常规印刷技术,例如转移涂布、丝网印刷、凹版印刷、喷墨印刷、图案化吸收和刮刀涂布,将热塑性聚合物放置在缓解层和/或血管化层上。任选地,可以将图案印刷到衬垫上并施加到缓解层、血管化层或可植入装置上。
[0117]
用于形成实体特征体的材料包括但不限于热塑性材料,聚氨酯,聚丙烯,硅酮,橡胶,环氧树脂,聚乙烯,聚醚酰胺,聚醚醚酮,聚苯砜,聚砜,硅酮聚碳酸酯聚氨酯,聚醚聚氨酯,聚碳酸酯聚氨酯,硅酮聚醚聚氨酯,聚酯,聚酯对苯二甲酸酯,可熔融加工的含氟聚合物,例如氟化乙烯丙烯(fep),四氟乙烯-(全氟烷基)乙烯基醚(pfa),乙烯和四氟乙烯的交替共聚物(etfe),四氟乙烯(tfe)、六氟丙烯(hfp)和偏二氟乙烯(thv)的三元共聚物,聚偏二氟乙烯(pvdf)以及它们的组合。在一些实施方式中,聚四氟乙烯可用于形成图案特征体。在另一些实施方式中,实体特征体可以单独形成并粘附到血管化层的表面或可植入装置的表面(未示出)。
[0118]
可用于形成缓解层、血管化层和任选的细胞不可渗透层中的一者或多者的可原纤化聚合物的非限制性实例包括但不限于四氟乙烯(tfe)聚合物,例如聚四氟乙烯(ptfe),膨胀ptfe(eptfe),改性的ptfe,tfe共聚物,聚偏二氟乙烯(pvdf),聚(对二甲苯)(eppx)(如sbriglia的美国专利公开第2016/0032069号中教导的),多孔超高分子量聚乙烯(euhmwpe)(如sbriglia的美国专利第9,926,416号中教导的),多孔乙烯四氟乙烯(eetfe)(如sbriglia的美国专利第9,932,429号中教导的),以及多孔偏二氟乙烯-共-四氟乙烯或三氟乙烯[vdf-共-(tfe或trfe)]聚合物(如sbriglia的美国专利第9,441,088号中教导的),以及它们的组合。
[0119]
在一些实施方式中,可原纤化聚合物是含氟聚合物膜,例如膨胀聚四氟乙烯(eptfe)膜。膨胀聚四氟乙烯(eptfe)(和其他原纤化的聚合物)具有节点和原纤维微结构,其中节点通过原纤维相互连接,孔是整个膜中位于节点和原纤维之间的空间。如本文所用,术语“节点”旨在表示主要由聚合物材料组成的实体特征体。当存在可变形的原纤维时,这些节点位于多个原纤维的交界处。在一些实施方式中,可以从膜去除原纤维,例如通过等离子体蚀刻来进行。在至少一个实施方式中,在缓解层、血管化层和任选的细胞不可渗透层中的一者或多者中使用膨胀聚四氟乙烯膜。在本文中可以使用膨胀聚四氟乙烯膜,例如但不限于根据以下专利文献中描述的方法制备的那些:戈尔(gore)的美国专利第3,953,566号,bacino等人的美国专利第7,306,729号,bacino的美国专利第5,476,589号,bacino的wo 94/13469,branca等人的美国专利第5,814,405号,或branca等人的美国专利第5,183,545号。
[0120]
在一些实施方式中,缓解层和血管化层中的一者或多者可由含氟聚合物膜形成,例如但不限于膨胀聚四氟乙烯(eptfe)膜,改性eptfe膜,四氟乙烯(tfe)共聚物膜,聚偏二氟乙烯(pvdf)膜或氟化乙烯丙烯(fep)膜。在另一些实施方式中,血管化层可以包括生物相容性纺织品,包括织造物和非织造物(例如纺粘非织造物、熔喷纤维材料、电纺纳米纤维等),非含氟聚合物膜,例如聚偏二氟乙烯(pvdf),纳米纤维,聚砜,聚醚砜,聚芳基砜,聚醚醚酮(peek),聚乙烯,聚丙烯和聚酰亚胺。在一些实施方式中,血管化层是纺粘、非织造聚酯或膨胀聚四氟乙烯(eptfe)膜。
[0121]
在一些实施方式中,可能希望血管化层和加强组件中的一者或多者是非永久性的(例如,可生物降解的)。在这种情况下,可以使用可生物降解材料来形成血管化层和/或加强组件。可生物降解材料的合适例子包括但不限于聚乙交酯:三亚甲基碳酸酯(pga:tmc),聚α羟基酸,例如聚乳酸,聚乙醇酸,聚(乙交酯)和聚(丙交酯-共-己内酯),聚(己内酯),聚(碳酸酯),聚(二噁烷酮),聚(羟基丁酸酯),聚(羟基戊酸酯),聚(羟基丁酸酯-共-戊酸酯),膨胀聚对二甲苯(eplla),例如sbriglia的美国专利公开第2016/0032069号中教导的,以及它们的共聚物和共混物。或者,血管化层可以涂覆有生物可吸收材料,或者生物可吸收材料可以以粉末形式结合到血管化层中或血管化层上。涂覆的材料可促进感染部位减少、血管形成和有利的1型胶原沉积。
[0122]
生物相容性膜复合材料可至少部分地在其上具有表面涂层,例如两性离子防污涂层、亲水性涂层或/肝素涂层(可从w.l.戈尔及同仁股份有限公司(w.l.gore&associates,inc.)商购获得)。表面涂层可以作为附加或者替代方式包含抗微生物剂、抗体(例如抗cd 47抗体(抗纤维化))、药物、生物活性分子(例如血管化刺激剂,例如fgf、vegf、内皮糖蛋白、pdgf、血管生成素、和整联蛋白;抗纤维化剂,例如tgfb抑制剂、西罗莫司、csf1r抑制剂、抗炎/免疫调节剂(例如cxcl12和皮质类固醇)以及它们的组合。
[0123]
参照图6a,在至少一个实施方式中,生物相容性膜复合材料可以与可植入装置600组合使用。特别地,生物相容性膜复合材料(未示出)可以部分或完全覆盖外壳605。外壳605可以是用于承载传感器、起搏器或电线的组件610的小袋或容器,或者其可以是可植入装置本身。在图6b所示的另一个实施方式中,生物相容性膜复合材料(未示出)可以部分或完全覆盖细胞系统620的外部和/或部分或全部结构元件650。部分630被放大以显示细胞系统的单独结构元件650和使用细胞系统620生长的细胞640。
[0124]
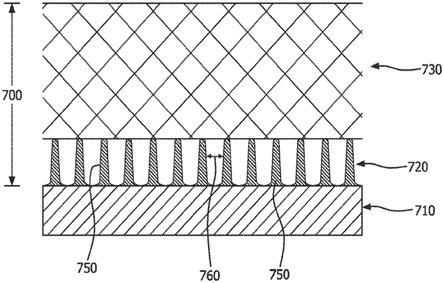
生物相容性膜复合材料700在图7中描绘。如图7所示,生物相容性膜复合材料700包括缓解层(即,第一层)720和血管化层(即,第二层)730。生物相容性膜复合材料700可用于至少部分地覆盖、包围或围绕可植入装置710。在所描绘的实施方式中,实体特征体750附接到可植入装置710的表面以形成缓解层720。本文所用的“附接”是指包括紧密附接或离散附接。在一些实施方式中,实体特征体750不渗透到血管化层730中。实体特征体750在图7中描绘为基本上具有相同的高度和宽度,并且在可植入装置710和血管化层730之间延伸,但是应当理解这是一个示例,实体特征体750可以在高度和/或宽度上变化。实体特征体750之间的距离是实体特征体间距760。
[0125]
图8是另一种生物相容性复合材料。如图8所示,生物相容性膜复合材料800包括缓解层820和血管化层830。在所描绘的实施方式中,实体特征体850是高度和宽度不同的节点,并且可以延伸或不延伸可植入装置810和血管化层830之间的距离。实体特征体850由原纤维870连接。在图8中,大部分实体特征体深度小于缓解层820的总厚度。可结合实体特征体880可以附接到可植入装置810的表面。
[0126]
参考图9,显示了生物相容性膜复合材料900。生物相容性膜复合材料900包括缓解层920和血管化层930。生物相容性膜复合材料900可以至少部分地覆盖或包围可植入装置910。在该实施方式中,缓解层920内的实体特征体是由膨胀聚四氟乙烯膜形成的节点。节点950通过原纤维970互连。节点950、980位于缓解层920内。然而,可结合实体特征体或节点980不仅在缓解层920内,而且还与可植入装置910接触,并且可能紧密结合到可植入装置
910。
[0127]
应当理解,在图7-9中描述的每个实施方式中,细胞系统可以代替可植入装置并且这样的实施方式被认为在本发明的范围内。
[0128]
测试方法
[0129]
孔隙率
[0130]
层的孔隙率在本文中定义为由孔隙空间构成的层体积与层总体积相比的比例。孔隙率是通过比较由实心部分和空隙部分组成的多孔结构的堆积密度与实心部分的密度使用以下等式来计算的:
[0131][0132]
质量/面积
[0133]
样品被切割(通过手工、激光或模具进行)成已知的几何形状。测量或验证样品的尺寸,并以平方米计算面积。然后在校准的秤上以克为单位对样品称重。以克为单位的质量除以以m2为单位的面积,以计算单位面积的质量,以g/m2为单位。
[0134]
厚度
[0135]
通过横截面sem图像的定量图像分析(qia)测量生物相容性膜复合材料中的层厚度。横截面sem图像是通过以下方式产生的:将膜固定到粘合剂上,使用液氮冷却的剃须刀片手动切割膜,然后将粘合剂背衬的膜在一端竖立起来,使得横截面是垂直的。然后使用emitech k550x溅射涂布机(可从英国quorum技术有限公司(quorum technologies ltd)商购)和铂靶对样品进行溅射涂布。然后使用来自赛默飞世尔科技公司(thermo scientific)的fei quanta 400扫描电子显微镜对样品进行成像。
[0136]
然后使用美国国立卫生研究院(nih)的imagej 1.51h测量横截面sem图像内的层的厚度。图像比例是根据sem提供的比例设置的。使用手动工具隔离和裁剪感兴趣的层。然后在层厚的方向上绘制多个(至少十个)等距的线。测量所有线的长度并取平均值以定义层厚度。
[0137]
刚度
[0138]
刚度测试根据astm d790-17标准测试方法进行,对未加强和加强的塑料和电绝缘材料的弯曲性能进行测试。该方法用于确定生物相容性膜复合材料层和/或最终装置的刚度。
[0139]
遵循astm方法的程序b,包括大于5%的应变和用于偏转的1型十字头位置。固定装置的尺寸被调整为具有16mm的跨度和1.6mm的支撑和鼻梁架半径。所使用的测试参数为3.14mm的偏转和96.8毫米/分钟的测试速度。在样品宽度与标准1cm不同的情况下,力通过线性比率归一化为1cm样品宽度。
[0140]
在最大偏转下以n/cm为单位报告载荷。
[0141]
sem样品制备
[0142]
通过以下方式来制备sem样品:首先将膜复合材料或膜复合材料层和粘合剂固定以便于操作,其中与用于成像的一侧相反的一侧面向粘合剂。然后切割膜以提供大约3mm x 3mm的区域用于成像。然后使用emitech k550x溅射涂布机和铂靶对样品进行溅射涂布。然后使用来自赛默飞世尔科技公司(thermo scientific)的fei quanta 400扫描电子显微镜
以特定的放大倍率和分辨率拍摄图像,该放大倍率和分辨率允许对足够数量的特征体进行可视化以进行稳健的分析,同时确保每个特征体的最小尺寸至少为五个像素的长度。
[0143]
实体特征体间距
[0144]
通过在美国国立卫生研究院(nih)的imagej 1.51h中分析sem图像来确定实体特征体。图像比例是根据sem图像提供的比例设置的。通过基于尺寸/阴影和/或手动识别的阈值组合来识别和隔离特征体。在结构由连续结构(例如非织造表面或蚀刻表面)组成的情况下,与具有离散实体特征体的结构相反,实体特征体被定义为围绕空隙的结构部分,它们的相应间距从空隙的一侧延伸到相对侧。在隔离特征体后,进行德劳内(delaunay)三角剖分以识别相邻特征体。在分析中忽略外接圆超出图像边缘的三角剖分。在相邻特征体的最近边缘之间画线并测量长度以定义相邻特征体之间的间距(参见例如图1a)。
[0145]
所有测量的实体特征体间距的中值标记的值小于或等于一半的测量的实体特征体间距且大于或等于一半的测量的实体特征体间距。因此,如果测量的中值高于或低于某个值,则大部分测量值同样高于或低于该值。因此,中值用作汇总统计量来表示大部分实体特征体间距。
[0146]
代表性短轴和代表性长轴的测量
[0147]
通过在nih的imagej 1.51h中分析膜表面的sem图像来测量代表性短轴。图像比例是根据sem图像提供的比例设置的。通过基于尺寸/阴影和/或手动识别的阈值组合来识别和隔离特征体。在隔离特征体后,利用内置的粒子分析功能来确定代表性椭圆的长轴和短轴。该椭圆的短轴是被测特征体的代表性短轴。该椭圆的长轴是被测特征体的代表性长轴。所有测量的短轴的中值标记的值小于或等于一半的测量的短轴且大于或等于一半的测量的短轴。类似地,所有测量的长轴的中值标记的值小于或等于一半的测量的长轴且大于或等于一半的测量的长轴。在这两种情况下,如果测量的中值高于或低于某个值,则大部分测量值同样高于或低于该值。因此,中值用作汇总统计量来表示大部分实体特征体代表性短轴和代表性长轴。
[0148]
实体特征体深度
[0149]
通过使用膜横截面的sem图像的定量图像分析(qia)来确定实体特征体深度。横截面sem图像是通过以下方式产生的:将膜固定到粘合剂上,使用液氮冷却的剃须刀片手动切割膜,然后将粘合剂背衬的膜在一端竖立起来,使得横截面是垂直的。然后使用emitech k550x溅射涂布机(可从英国quorum技术有限公司(quorum technologies ltd)商购)和铂靶对样品进行溅射涂布。然后使用来自赛默飞世尔科技公司(thermo scientific)的fei quanta 400扫描电子显微镜对样品进行成像。
[0150]
然后使用美国国立卫生研究院(nih)的imagej 1.51h测量横截面sem图像内的特征体的深度。图像比例是根据sem提供的比例设置的。通过基于尺寸/阴影和/或手动识别的阈值组合来识别和区分出特征体。在区分出特征体后,利用内置的粒子分析功能来计算每个实体特征体的弗里特(feret)直径和由弗里特直径轴定义的轴与水平面之间形成的角。弗里特直径是sem图像平面中特征体边界上任意两点之间的最远距离。弗里特直径轴是由这两个点定义的线。每个实体特征体的弗里特直径在层厚度方向上的投影是根据以下等式计算的:
[0151]
投影厚度=sinθ*长度最长轴。
[0152]
最长轴在层厚度方向上的投影是被测特征体的实体特征体深度。所有测量的实体特征体深度的中值标记的值小于或等于一半的测量的实体特征体深度且大于或等于一半的测量的实体特征体深度。因此,如果测量的中值高于或低于某个值,则大部分测量值同样高于或低于该值。因此,中值用作汇总统计量来表示大部分实体特征体深度。
[0153]
孔径
[0154]
通过在nih的imagej 1.51h中分析膜表面的sem图像来测量孔径。图像比例是根据sem图像提供的比例设置的。通过基于尺寸/阴影和/或手动识别的阈值组合来对孔进行识别和隔离。在将孔隔离后,利用内置的粒子分析功能来确定每个孔的面积。根据以下等式,将测量的孔面积转换为“有效直径”:
[0155][0156]
将孔面积求和以定义由孔限定的表面的总面积。这是表面的总孔面积。层的孔径是孔的有效直径,其定义了这样一个孔径:总孔面积的大约一半由直径小于该孔径的孔组成,并且总孔面积的大约一半由直径大于或等于该孔径的孔组成。
[0157]
人pdx1阳性胰腺内胚层和内分泌细胞的体外生产
[0158]
本文针对多能干细胞(例如hes和ips细胞)的定向分化方法可以描述为至少四个或五个或六个或七个阶段,这取决于最终阶段的细胞培养或所需的细胞群(例如pdx1阳性胰腺内胚层细胞群(或pec),或内分泌前体细胞群,或内分泌细胞群,或未成熟β细胞群或成熟内分泌细胞群)。
[0159]
阶段1是从多能干细胞产生定形内胚层,需要大约2至5天,优选2天或3天。多能干细胞悬浮在包含rpmi,tgfβ超家族成员生长因子如激活素a、激活素b、gdf-8或gdf-11(100ng/ml),wnt家族成员或wnt通路激活剂如wnt3a(25ng/ml)和替代的rho-激酶或rock抑制剂如y-27632(10μm)的培养基中,以增强生长、和/或存活和/或增殖、和/或细胞-细胞粘附。约24小时后,将培养基更换为包含rpmi和血清(例如0.2%fbs)以及tgfβ超家族成员生长因子如激活素a、激活素b、gdf-8或gdf-11(100ng/ml)和替代的rho-激酶或rock抑制剂的培养基,继续持续24小时(第1天)至48小时(第2天)。或者,在包含激活素/wnt3a的培养基中约24小时后,在随后的24小时期间在仅包含激活素的培养基(即,培养基不包含wnt3a)中培养细胞。重要的是,定形内胚层的生产需要血清含量低的细胞培养条件,因此胰岛素或胰岛素样生长因子的含量也低。参见mclean等人,(2007)干细胞(stem cells)25:29-38。mclean等人还表明,在第1阶段,将hes细胞与浓度低至0.2μg/ml的胰岛素接触可能不利于定形内胚层的产生。本领域的其他技术人员基本上如本文和以下文献中所述修改了多能细胞向定形内胚层的第1阶段分化:d’amour等人(2005),例如至少agarwal等人,从人胚胎干细胞有效分化功能性肝细胞(efficient differentiation of functional hepatocytes from human embryonic stem cells),stem cells(2008)26:1117-1127;borowiak等人,小分子有效地指导小鼠和人胚胎干细胞的内胚层分化(small molecules efficiently direct endodermal differentiation of mouse and human embryonic stem cells),(2009)cell stem cell 4:348-358;brunner等人,不同的dna甲基化模式表征分化的人胚胎干细
胞和发育中的人胎儿肝脏(distinct dna methylation patterns characterize differentiated human embryonic stem cells and developing human fetal liver),(2009)genome res.19:1044-1056,rezania等人,用人多能干细胞体外衍生的胰岛素产生细胞逆转糖尿病(reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells)(2014)nat biotech 32(11):1121-1133(gdf8&gsk3β抑制剂,例如chir99021);和pagliuca等人,(2014)体外产生功能人胰腺b细胞(generation of function human pancreatic b-cell in vitro),cell 159:428-439(激活素a&chir)。为了获得其他内胚层谱系细胞,必须进行正确的分化、规格化、表征和定性鉴定。在此阶段的定形内胚层细胞共表达sox17和hnf3β(foxa2),并且至少不明显表达hnf4alpha、hnf6、pdx1、sox6、prox1、ptf1a、cpa、cmyc、nkx6.1、ngn3、pax3、arx、nkx2.2、ins、gsc、ghrl、sst或pp。定形内胚层中hnf4α表达的缺失至少在以下文献中得到了支持和详细描述:duncan等人(1994),转录因子hnf-4在发育中的小鼠胚胎的胚外内胚层、肠道和肾源性组织中的表达:hnf-4是植入胚泡中初级内胚层的标志物(expression of transcription factor hnf-4in the extraembryonic endoderm,gut,and nephrogenic tissue of the developing mouse embryo:hnf-4is a marker for primary endoderm in the implanting blastocyst)”proc.natl.acad.sci,91:7598-7602和si-tayeb等人(2010),从诱导多能干细胞高效生成人肝细胞样细胞(highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells)”,hepatology 51:297-305。
[0160]
第2阶段采用第1阶段的定形内胚层细胞培养物,通过将悬浮培养物与低血清水平的rpmi(例如0.2%fbs,在1:1000的its中稀释)、25ng kgf(或fgf7)和替代的rock抑制剂一起孵育24小时(第2天至第3天),产生前肠内胚层或pdx1阴性前肠内胚层。24小时后(第3天至第4天),将培养基更换为相同的培养基,但不含tgfβ抑制剂,但仍含有rock抑制剂以增强细胞的生长、存活和增殖,再持续24天(第4天至第5天)到48小时(第6天)。正确规范前肠内胚层的关键步骤是去除tgfβ家族生长因子。因此,可以将tgfβ抑制剂添加到第2阶段细胞培养物中,例如2.5m tgfβ抑制剂4号或5μm sb431542,激活素受体样激酶(alk)的特异性抑制剂,其是一种tgfβi型受体。由第2阶段产生的前肠内胚层或pdx1阴性前肠内胚层细胞共表达sox17、hnf1β和hnf4α,并且至少不明显共表达hnf3β(foxa2),也不明显共表达hnf6、pdx1、sox6、prox1、ptf1a、cpa、cmyc、nkx6.1、ngn3、pax3、arx、nkx2.2、ins、gsc、ghrl、sst或pp,它们是定形内胚层、pdx1阳性胰腺内胚层或胰腺祖细胞或内分泌祖细胞/前体以及典型的多激素型细胞的标志。
[0161]
pec生产的第3阶段(第5-8天)采用第2阶段的前肠内胚层细胞培养物,并通过dmem或rpmi(在1%b27中),0.25μm kaad环巴胺,类视黄醇如0.2μm视黄酸(ra)或视黄酸类似物,诸如3nm的ttnpb(或ctt3,其是kaad环巴胺和ttnpb的组合)和50ng/ml的头蛋白(noggin)处理约24小时(第7天)至48小时(第8天)产生pdx1阳性前肠内胚层细胞。具体而言,申请人从大约2003年以来一直使用dmem-高葡萄糖,并且当时所有专利和非专利公开都采用dmem-高葡萄糖,即使没有提及“dmem-高葡萄糖”等也是如此。这部分是因为吉布可(gibco)等制造商没有这样命名他们的dmem,例如dmem(目录号11960)和knockout dmem(目录号10829)。值得注意的是,截至本技术的申请日,gibco提供了更多的dmem产品,但仍然没有在他们的某
些含有高葡萄糖的dmem产品中注明“高糖”,例如knockout dmem(目录号10829-018)。因此,可以假设在各情况中描述dmem,是指具有高葡萄糖的dmem,并且对该领域进行研究和开发的技术人员来说是很明显的。同样,rock抑制剂或rho-激酶抑制剂如y-27632可用于增强生长、存活、增殖和促进细胞间粘附。其他试剂和因素包括但不限于抗坏血酸(例如维生素c)、bmp抑制剂(例如头蛋白(noggin)、ldn、腱蛋白(chordin))、shh抑制剂(例如sant、环巴胺、hip1);和/或pkc激活剂(例如pdbu、tbp、ilv)或其任何组合。或者,第3阶段已经在没有shh抑制剂(例如第3阶段中的环巴胺)的情况下进行。从第3阶段产生的pdx1阳性前肠细胞共表达pdx1和hnf6以及sox9和prox,并且不明显共表达指示定形内胚层或前肠内胚层(pdx1阴性前肠内胚层)细胞或pdx1阳性前肠内胚层细胞的标志物,如上文第1阶段和第2阶段中所述。
[0162]
上述第3阶段方法是pec群生产的四个阶段之一。为了产生如下详述的内分泌祖细胞/前体和内分泌细胞,除了头蛋白(noggin)、kaad-环巴胺和类视黄醇外,还可以单独和/或组合使用激活素、wnt和调蛋白(heregulin)、甲状腺激素、tgfb受体抑制剂、蛋白激酶c激活剂、维生素c和rock抑制剂来抑制早期表达ngn3并增加chga阴性类型的细胞。
[0163]
第4阶段(大约第8-14天)pec培养生产从第3阶段获取培养基,并将其更换为含有以下组分的培养基:dmem(在1%体积/体积b27补充剂中),外加50ng/mlkgf和50ng/mlegf,有时还含有50ng/ml头蛋白(noggin)和rock抑制剂,还包括单独的激活素或与调蛋白结合的激活素。或者,可以使用kgf、ra、sant、pkc激活剂和/或维生素c或其任意组合进一步分化第3阶段细胞。这些方法产生至少共表达pdx1和nkx6.1以及ptf1a的胰腺祖细胞。这些细胞不明显表达指示定形内胚层或前肠内胚层(pdx1阴性前肠内胚层)细胞的标志物,如上文第1、2和3阶段中所述。
[0164]
第5阶段生产采用上述第4阶段pec细胞群,并将它们在含有dmem(具有1%体积/体积b27补充剂)、头蛋白(noggin)、kgf、egf、ro(一种γ分泌酶抑制剂)、烟酰胺和/或alk5抑制剂,或其任何组合(例如头蛋白和alk5抑制剂)的培养基中进一步分化约1至6天(优选约2天,即第13-15天),以产生内分泌祖细胞/前体或祖细胞型细胞和/或单激素和多激素胰腺内分泌型细胞。或者,可以使用视黄酸(例如ra或其类似物)、甲状腺激素(例如t3、t4或其类似物)、tgfb受体抑制剂(alk5抑制剂)、bmp抑制剂(例如头蛋白、腱蛋白、ldn),或γ分泌酶抑制剂(例如xxi、xx、dapt、xvi、l685458)和/或β细胞素,或其任何组合将第4阶段的细胞进一步分化。从第5阶段产生的内分泌祖细胞/前体至少共表达pdx1/nkx6.1并表达chga、ngn3和nkx2.2,并且不明显表达指示定形内胚层或前肠内胚层(pdx1阴性前肠内胚层)的标志物,如上文pec生产的第1、2、3和4阶段中所述。
[0165]
通过添加试剂或因子的任意组合,第6阶段和第7阶段可以进一步分化第5阶段的细胞群,所述试剂或因子包括但不限于pdgf+ssh抑制剂(例如sant、环巴胺、hip1),bmp抑制剂(例如头蛋白、腱蛋白、ldn),烟酰胺,胰岛素样生长因子(例如igf1、igf2),ttnbp,rock抑制剂(例如y27632),tgfb受体抑制剂(例如alk5i),甲状腺激素(例如t3、t4及其类似物)和/或γ分泌酶抑制剂(xxi、xx、dapt、xvi、l685458)或其任意组合,从而实现内分泌细胞、内分泌前体和未成熟β细胞的细胞培养群或适当比例。
[0166]
第7阶段或未成熟β细胞被认为是内分泌细胞,但是对于以生理方式对葡萄糖作出反应来说,可能足够成熟或可能不够成熟。第7阶段的未成熟β细胞可以表达mafb,而表达
mafa和mafb的细胞是完全成熟的细胞,能够以生理方式对葡萄糖作出反应。
[0167]
第1阶段到第7阶段的细胞群来源于人多能干细胞(例如人胚胎干细胞、诱导多能干细胞、转基因干细胞,例如使用现在可得或以后开发的任何基因编辑工具和应用程序),并且可能没有它们的确切的自然发生的相应细胞类型,因为它们来自体外(即在人工组织培养中)产生的永生人多能干细胞,而不是体内的内细胞团(即体内人发育不具有人es细胞等效物)。
[0168]
可使用第4、5、6或7阶段细胞群中的任何一个将本文中预期的胰腺细胞疗法替代物封装在本文所述的装置中,该装置由本文所述的膜组成,并装载和完全包含在大封装装置中并移植到患者体内,胰腺内胚层谱系细胞在体内(也称为“体内功能”)成熟为胰腺激素分泌细胞或胰岛,例如胰岛素分泌β细胞,并且能够正常响应血糖。
[0169]
在2009年11月13日提交的题为“来自人多能干细胞的胰腺谱系细胞的封装(encapsulation of pacreatic lineage cells derived from human pluripotent stem cells)”的美国申请第12/618,659号('659申请)中详细描述了胰腺内胚层谱系细胞的封装和体内胰岛素的产生。'659申请要求以下申请的优先权:2008年11月14日提交的题为“来自hes细胞的胰腺祖细胞的封装(encapsulation of pacreatic progenitors derived from hes cells)”的临时专利申请第61/114,857号;和2008年12月9日提交的题为“胰腺内胚层细胞的封装(encapsulation of pacreaticendoderm cells)”的美国临时专利申请第61/121,084号;现在是美国专利8,278,106和8,424,928。本文描述的方法、组成和装置目前代表了优选的实施方式并且是示例性的,不旨在限制本发明的范围。本领域技术人员将想到其中的变化和其他用途,它们包含在本发明的精神内并且由本公开的范围限定。因此,对本领域的普通技术人员而言显而易见的是,可以对本文公开的本发明进行各种取代和修改而不会偏离本发明的范围和精神。
[0170]
此外,本文所述的实施方式不限于任何一种类型的多能干细胞或人多能干细胞,并且包括但不限于人胚胎干(hes)细胞和人诱导多能干(ips)细胞或以后开发的其他多能干细胞。本领域还众所周知,在提交本技术时,可以在不破坏人胚胎的情况下进行制备人多能干细胞的方法,并且预期此类方法可用于生产任何人多能干细胞。
[0171]
从人多能细胞产生胰腺细胞谱系的方法基本上至少按照所列的属于维亚赛特公司(viacyte,inc.)的公开文本中的描述进行,包括但不限于:pct/us2007/62755(wo2007101130),pct/us2008/80516(wo2009052505),pct/us2008/82356(wo2010053472),pct/us2005/28829(wo2006020919),pct/us2014/34425(wo2015160348),pct/us2014/60306(wo2016080943),pct/us2016/61442(wo2018089011),pct/us2014/15156(wo2014124172),pct/us2014/22109(wo2014138691),pct/us2014/22065(wo2014138671),pct/us2005/14239(wo2005116073),pct/us2004/43696(wo2005063971),pct/us2005/24161(wo2006017134),pct/us2006/42413(wo2007051038),pct/us2007/15536(wo2008013664),pct/us2007/05541(wo2007103282),pct/us2008/61053(wo2009131568),pct/us2008/65686(wo2009154606),pct/us2014/15156(wo2014124172),pct/us2018/41648(wo2019014351),pct/us2014/26529(wo2014160413),pct/us2009/64459(wo2010057039);和d’amour等人,2005nature biotechnology 23:1534-41;d'amour等人,2006nature biotechnology 24(11):1392-401;mclean等人,2007stem cells 25:29-38,
kroon等人,2008nature biotechnology 26(4):443-452,kelly等人,2011nature biotechnology 29(8):750-756,schulz等人,2012plos one 7(5):e37004;和/或agulnick等人,2015stem cells transl.med.4(10):1214-22。
[0172]
从人多能细胞产生胰腺细胞谱系的方法基本上至少按照以下所列的属于杨森(janssen)的公开文本中的描述进行,包括但不限于:pct/us2008/68782(wo200906399),pct/us2008/71775(wo200948675),pct/us2008/71782(wo200918453),pct/us2008/84705(wo200970592),pct/us2009/41348(wo2009132063),pct/us2009/41356(wo2009132068),pct/us2009/49183(wo2010002846),pct/us2009/61635(wo2010051213),pct/us2009/61774(wo2010051223),pct/us2010/42390(wo2011011300),pct/us2010/42504(wo2011011349),pct/us2010/42393(wo2011011302),pct/us2010/60756(wo2011079017),pct/us2011/26443(wo2011109279),pct/us2011/36043(wo2011143299),pct/us2011/48127(wo2012030538),pct/us2011/48129(wo2012030539),pct/us2011/48131(wo2012030540),pct/us2011/47410(wo2012021698),pct/us2012/68439(wo2013095953),pct/us2013/29360(wo2013134378),pct/us2013/39940(wo2013169769),pct/us2013/44472(wo2013184888),pct/us2013/78191(wo2014106141),pctu/s2014/38993(wo2015065524),pct/us2013/75939(wo2014105543),pct/us2013/75959(wo2014105546),pct/us2015/29636(wo2015175307),pct/us2015/64713(wo2016100035),pct/us2014/41988(wo2015002724),pct/us2017/25847(wo2017180361),pct/us2017/37373(wo2017222879),pct/us2017/37373(wo2017222879);pct/us2009/049049(wo2010/002785),pct/us2010/060770(wo2011/079018),pct/us2014/042796,(wo2015/065537),pct/us2008/070418(wo2009/012428);bruin等人,2013diabetologia.56(9):1987-98,fryer等人,2013curr.opin.endocrinol.diabetes obes.20(2):112-7,chetty等人,2013nature methods.10(6):553-6,rezania等人,2014nature biotechnologyy 32(11):1121-33,bruin等人,2014stem cell res.12(1):194-208,hrvatin 2014proc.natl.acad.sci.u s a.111(8):3038-43,bruin等人,2015stem cell reports.5,1081
–
1096,bruin等人,2015science transl.med.,2015,7,316ps23,和/或bruin等人,2015stem cell reports.14;4(4):605-20。
[0173]
在一个实施方式中,人多能细胞根据以下优选条件a和/或b之一分化为pdx1阳性胰腺内胚层细胞,包括胰腺祖细胞和内分泌前体。
[0174]
表1
[0175][0176][0177]
表1图例:r0.2fbs:rpmi 1640(mediatech);0.2%fbs(hyclone),1xglutamax-1(生命技术(life technologies)),1%v/v青霉素/链霉素;db:dmem高葡萄糖(hyclone),辅以0.5x b-27补充剂(生命技术(life technologies));a100,a50,a5:100ng/ml重组人激活素a(r&d系统公司(r&d systems));a5i:1um,5um,10um alk5抑制剂;tt3:3nm ttnpb(西格玛-奥德里奇公司(sigma-aldrich));e50:50ng/ml重组人egf(r&d系统公司);its:胰岛素-转铁蛋白-硒(生命技术),按1:5000或1:1000稀释;iv:2.5mm tgf-b ri激酶抑制剂iv(emd生物科学公司(emd bioscience));k50,k25:50ng/ml,25ng/ml重组人kgf(r&d系统公司或派普泰克公司(peprotech));n50,n100:50ng/ml或100ng/ml重组人头蛋白(r&d系统公司);w50:50ng/ml重组小鼠wnt3a(r&d系统公司)。
[0178]
本领域普通技术人员将理解,可能存在其他方法产生pdx1阳性胰腺内胚层细胞或pdx1阳性胰腺内胚层谱系细胞,包括胰腺祖细胞或者甚至内分泌和内分泌前体细胞;以及至少kroon等人2008,rezania等人2014(同上)和pagliuca等人2014cell159(2):428-439(同上)描述的那些pdx1阳性胰腺内胚层细胞。
[0179]
本领域普通技术人员还将理解,本文描述的用于产生pdx1阳性胰腺内胚层细胞的实施方式由混合群或亚群的混合物组成。并且因为与沿前后轴发生的哺乳动物体内发育不同,并且细胞和组织也因此命名,任何培养容器中的细胞培养都缺乏这种定向模式,因此特别是由于它们的标志物表达而被表征。因此,在体内不会发生任何分化阶段的混合细胞亚群。因此,pdx1阳性胰腺内胚层细胞培养物包括但不限于:i)内分泌前体(例如,如早期内分
泌标志物,嗜铬粒蛋白a或chga所示);ii)表达任何典型的胰腺激素如胰岛素(ins)、生长抑素(sst)、胰腺多肽(pp)、胰高血糖素(gcg)或甚至胃泌素、肠促胰岛素、促胰液素或胆囊收缩素的单激素多激素细胞;iii)胰腺前细胞,例如,表达pdx-1但不表达nkx6.1或chga的细胞;iv)共表达pdx-1/nkx6.1和chga(pdx-1/nkx6.1/chga)的内分泌细胞,或非内分泌细胞,例如表达pdx-1/nkx6.1但不表达chga(pdx-1+/nkx6.1+/cha-);和v)仍然存在不表达pdx-1、nkx6.1或chga的细胞(例如三阴性细胞)。
[0180]
这种pdx1阳性胰腺内胚层细胞群及其混合细胞亚群大多至少表达pdx-1,特别是表达pdx-1/nkx6.1的亚群。pdx1/nkx6.1亚群也被称为“胰腺祖细胞”、“胰腺上皮细胞”或“pec”或pec的多个版本,例如pec-01。尽管表1描述了第4阶段的细胞群,但这些不同的亚群不仅仅限于第4阶段。这些亚群中的某些可以例如早在第3阶段和包括第5、6和7阶段在内的之后的阶段中发现(未成熟β细胞)。每个亚群的比例将根据所采用的细胞培养基条件而有所不同。例如,在agulnick等人2015(同上)中,73-80%的pdx-1/nkx6.1细胞被用于进一步分化为胰岛样细胞(ic),其中一般含有74-89%的内分泌细胞,并且其中的40-50%表达胰岛素(ins)。因此,不同的细胞培养条件能够产生不同比例的细胞亚群,这可能会影响体内功能,从而影响血清c肽水平。并且只有使用下文更详细描述的体内研究才能确定用于制造pdx1阳性胰腺内胚层谱系细胞培养群的修改方法是否会影响体内功能。此外,不能假设也不应该假设仅仅因为某种细胞类型已经制成并且得到良好的表征,这种方法就会产生相同的细胞中间体,除非这也得到很好的表征。
[0181]
一方面,提供了一种在体内产生成熟β细胞的方法。该方法包括在体外制造源自人多能干细胞的人定形内胚层谱系细胞,该方法使用至少一个tgfβ超家族成员和/或至少一个tgfβ超家族成员和wnt家族成员,优选tgfβ超家族成员和wnt家族成员,优选激活素a、b或gdf-8、gdf-11或gdf-15和wnt3a,优选激活素a和wnt3a,优选gdf-8和wnt3a。从定形内胚层细胞制备pdx1阳性胰腺内胚层细胞的方法,至少使用kgf、bmp抑制剂和视黄酸(ra)或ra类似物,优选使用kgf、头蛋白和ra。该方法可以进一步用甲状腺激素和/或tgfb-ri抑制剂、bmp抑制剂、kgf、egf、甲状腺激素和/或蛋白质激酶c激活剂,优选用头蛋白、kgf和egf,优选额外使用t3或t4和alk5抑制剂或单独的t3或t4或单独的alk5抑制剂,或t3或t4、alk5抑制剂和pkc激活剂例如ilv、tpb和pdbu将pdx1阳性胰腺内胚层细胞分化为未成熟的β细胞或mafa表达细胞。或者优选使用头蛋白和alk5i并将pdx1阳性胰腺内胚层细胞或mafa未成熟β细胞群植入哺乳动物宿主体内并使其成熟以产生包括能够对血糖作出反应的胰岛素分泌细胞的细胞群。
[0182]
一方面,提供了表达ins和nkx6.1但基本上不表达ngn3的单能人未成熟β细胞或pdx1阳性胰腺内胚层细胞。在一个实施方式中,单能人未成熟β细胞能够成熟为成熟β细胞。在一个实施方式中,单能人未成熟β细胞进一步在体外和体内表达mafb。在一个实施方式中,未成熟β细胞表达ins、nkx6.1和mafa并且基本上不表达ngn3。
[0183]
一方面,至少表达chga(或chga+)的胰腺内胚层谱系细胞是指内分泌细胞;不表达chga(或chga-)的胰腺内胚层细胞是指非内分泌细胞。在另一方面,这些内分泌和非内分泌亚群可以是多能祖细胞/前体亚群,例如非内分泌多能胰腺祖细胞亚群或内分泌多能胰腺祖细胞亚群;或者它们可以是单能亚群,例如未成熟的内分泌细胞,优选未成熟的β细胞、未成熟的胰高血糖素细胞等。
[0184]
一方面,胰腺内胚层或pdx1阳性胰腺内胚层细胞群(第4阶段)中超过10%,优选超过20%、30%、40%,更优选超过50%、60%、70%、80%、90%、95%、98%或100%的细胞是非内分泌(chga-)多能祖细胞亚群,当植入哺乳动物宿主时,它们会产生成熟的胰岛素分泌细胞并在体内对葡萄糖作出反应。
[0185]
一个实施方式提供了一种组合物和方法,用于在体外将多能干细胞基本上分化为胰腺内胚层培养物,并进一步在体外将胰腺内胚层培养物分化为内分泌或内分泌前体细胞。一方面,内分泌前体或内分泌细胞表达chga。一方面,内分泌细胞可以在体外产生胰岛素。一方面,体外内分泌胰岛素分泌细胞可响应葡萄糖刺激产生胰岛素。一方面,细胞群中超过10%、优选超过20%、30%、40%、更优选超过50%、60%、70%、80%、90%、95%、98%或100%的细胞是内分泌细胞。
[0186]
本文所述的实施方式提供将多能人干细胞在体外分化为内分泌细胞的组合物和方法。一方面,内分泌细胞表达chga。一方面,内分泌细胞可以在体外产生胰岛素。一方面,内分泌细胞是未成熟的内分泌细胞,例如未成熟的β细胞。一方面,体外产生胰岛素的细胞可以响应葡萄糖刺激产生胰岛素。
[0187]
一个实施方式提供了一种在哺乳动物体内产生胰岛素的方法,该方法包括:(a)将胰腺内胚层细胞或内分泌细胞或内分泌前体细胞群加载到可植入的半渗透装置中;(b)将带有细胞群的装置植入哺乳动物宿主中;和(c)在体内使装置中的细胞群成熟,其中至少一些内分泌细胞是胰岛素分泌细胞,其响应体内葡萄糖刺激而产生胰岛素,从而在体内为哺乳动物产生胰岛素。在一方面,内分泌细胞源自包含具有更高的非内分泌多能胰腺祖细胞亚群(chga-)的pec的细胞组合物。在另一方面,内分泌细胞源自包含具有减少的内分泌亚群(chga+)的pec的细胞组合物。在另一方面,内分泌细胞是未成熟的内分泌细胞,优选未成熟的β细胞。
[0188]
一方面,与pdx-1阳性胰腺内胚层群或pdx1/nkx6.1阳性的非内分泌(chga-)亚群相比,由多能干细胞体外制备的内分泌细胞表达更多的pdx1和nkx6.1。一方面,与pec非内分泌多能胰腺祖细胞亚群(chga-)相比,由多能干细胞体外制备的内分泌细胞表达pdx1和nkx6.1相对更多。一方面,将骨形态发生蛋白(bmp)和视黄酸(ra)类似物单独或组合添加到细胞培养物中以获得与pec非内分泌多能祖细胞亚群(chga-)相比具有增加的pdx1和nkx6.1表达的内分泌细胞。一方面,bmp选自下组:bmp2、bmp5、bmp6、bmp7、bmp8和bmp4,更优选为bmp4。一方面,视黄酸类似物选自下组:全反式视黄酸和ttnpb(4-[(e)-2-(5,6,7,8-四氢-5,5,8,8-四甲基-2-萘基)-l-丙烯基]苯甲酸芳维甲酸),或0.1-10μm am-580(4-[(5,6,7,8-四氢-5,5,8,8-四甲基-2-萘基)甲酰胺基]苯甲酸),更优选是ttnpb。
[0189]
一个实施方式提供了一种用于在体外将多能干细胞分化为内分泌细胞和未成熟内分泌细胞,优选未成熟β细胞的方法,包括使得聚集体解离和重新结合。一方面,解离和重新结合发生在第1阶段、第2阶段、第3阶段、第4阶段、第5阶段、第6阶段或第7阶段或它们的组合。一方面,定形内胚层、pdx1-阴性前肠内胚层、pdx1-阳性前肠内胚层、pec和/或内分泌和内分泌祖细胞/前体细胞被解离和重新结合。一方面,与内分泌(chga+)亚群相比,第7阶段解离和重新聚集的细胞聚集体由更少的非内分泌(chga-)亚群组成。一方面,细胞群中超过10%、优选超过20%、30%、40%、更优选超过50%、60%、70%、80%、90%、95%、98%或100%的细胞是内分泌(chga+)细胞。
[0190]
一个实施方式提供了一种通过去除在第4阶段pec生产过程中产生的内分泌细胞从而富集pdx1+和nkx6.1+的非内分泌多能胰腺祖细胞(chga-)亚群来在体外将多能干细胞分化为内分泌细胞的方法。
[0191]
在一个实施方式中,通过在第3阶段和/或第4阶段不添加头蛋白(noggin)家族成员来制备富集非内分泌多能祖细胞亚群(chga-)的pec培养物。在一个实施方式中,通过在第3阶段和/或第4阶段不添加头蛋白家族成员来制备相对充满定型为内分泌谱系(chga+)的细胞的pec培养物。一方面,头蛋白家族成员是选自下组的化合物:头蛋白(noggin)、腱蛋白(chordin)、卵泡抑素(follistatin)、卵泡抑素样蛋白、cerberus、coco、dan、gremlin、骨硬化蛋白(sclerostin)、prdc(与dan和cerberus相关的蛋白)。
[0192]
一个实施方式提供了一种通过在包含外源高水平葡萄糖的培养基中培养内分泌细胞来维持培养中的内分泌细胞的方法,其中添加的外源葡萄糖为约1mm至25mm、约1mm至20mm、约5mm至15mm、约5mm至10mm、约5mm至8mm。一方面,培养基是基于dmem、cmrl或rpmi的培养基。
[0193]
一个实施方式提供了一种在体外将多能干细胞分化为内分泌细胞的方法,其中进行和不进行细胞聚集体的解离和重新结合。一方面,未解离的或解离并重新结合的细胞聚集体在第6阶段和/或第7阶段被冷冻保存或冷冻,而不影响内分泌细胞的体内功能。一方面,冷冻保存的内分泌细胞培养物被解冻、培养并且当移植时在体内起作用。
[0194]
另一个实施方式提供了一种用于将多能干细胞分化为内分泌细胞的培养系统,该培养系统至少包含能够在分化的早期阶段阻抑或抑制内分泌基因表达的试剂和能够在分化的后期阶段诱导内分泌基因表达的试剂。一方面,将能够阻抑或抑制内分泌基因表达的试剂加入由胰腺pdx1阴性前肠细胞组成的培养系统。一方面,将能够诱导内分泌基因表达的试剂加入由pdx1阳性胰腺内胚层祖细胞或pec组成的培养系统。一方面,能够阻抑或抑制内分泌基因表达的试剂是激活tgfβ受体家族的试剂,优选其是激活素,优选其是高水平的激活素,然后是低水平的激活素。一方面,能够诱导内分泌基因表达的试剂是γ分泌酶抑制剂,其选自下组:n-[n-(3,5-二氟苯乙酰基-l-丙氨酰基)]-s-苯基甘氨酸叔丁酯(dapt),ro44929097,dapt(n
‑‑
[n-(3,5-二氟苯乙酰基-l-丙氨酰基)]-s-苯基甘氨酸叔丁酯),1-(s)-内(endo)-n-(1,3,3)-三甲基双环[2.2.1]庚-2-基)-4-氟苯基磺酰胺,wpe-iii31c,s-3-[n'-(3,5-二氟苯基-α-羟基乙酰基)-l-丙氨酰基]氨基-2,3-二氢-1-甲基-5-苯基-1h-1,4-苯并二氮杂-2-酮,(n)-[(s)-2-羟基-3-甲基-丁酰基]-1-(l-丙氨酰基)-(s)-1-氨基-3-甲基
‑‑
4,5,6,7-四氢-2h-3-苯并氮杂-2-酮,bms-708163(艾瓦甲西特(avagacestat)),bms-708163,司马西特(semagacestat)(ly450139),司马西特(semagacestat)(ly450139),mk-0752,mk-0752,yo-01027,yo-01027(二苯并氮杂dbz),ly-411575,ly-411575或ly2811376。一方面,高水平的激活素是指高于40ng/ml、50ng/ml和75ng/ml的水平。一方面,在第3阶段期间或在产生胰腺前肠内胚层细胞之前使用高水平的激活素。一方面,低水平的激活素是指低于30ng/ml、20ng/ml、10ng/ml和5ng/ml。一方面,在第4阶段期间或pec的生产中使用低水平的激活素。一方面,被抑制或诱导的内分泌基因是ngn3。在另一方面,激活素a和wnt3a单独或组合使用以抑制内分泌表达,优选在胰腺前肠内胚层细胞产生之前或优选在第3阶段期间抑制ngn3表达。一方面,γ分泌酶抑制剂,优选ro44929097或dapt,在培养系统中用于在pec产生后,或优选在第5、6和/或7阶段期间诱导
内分泌基因表达。
[0195]
一种包含内分泌细胞的体外细胞培养物,其中至少5%的人细胞表达选自下组的内分泌标志物:胰岛素(ins),nk6同源异型盒1(nkx6.1),胰腺和十二指肠同源异型盒1(pdx1),转录因子相关基因座2(nkx2.2),配对盒4(pax4),神经源性分化1(neurod),叉头盒a1(foxa1),叉头盒a2(foxa2),蜗牛家族锌指2(snail2)和肌腱膜纤维肉瘤癌基因家族a和b(mafa和mafb),并且基本上不表达选自下组的标志物:神经元素3(ngn3),胰岛1(isl1),肝细胞核因子6(hnf6),gata结合蛋白4(gata4),gata结合蛋白6(gata6),胰腺特异性转录因子1a(ptf1a)和sry(性别决定区y)-9(sox9),其中内分泌细胞是单能的,可以成熟为胰腺β细胞。
[0196]
实施例
[0197]
实施例1
[0198]
两层结合复合材料是通过将两个离散层热结合在一起而制成的。
[0199]
两层生物相容性膜复合材料的第一层是根据branca等人的美国专利第5,814,405号的教导制备的膨胀聚四氟乙烯膜(eptfe)(缓解层)。图10所示的扫描电子显微照片(sem)图像是第一层(即,缓解层)的eptfe膜的表面的代表性图像。该eptfe层的特性如表1所示。第二层是市售的纺粘聚酯非织造材料(血管化层)。第三层的代表性表面微结构显示在图11所示的sem图像中。该层的性质如表1所示。
[0200]
表1
[0201][0202]
缓解层和血管化层通过将它们彼此相邻放置并将它们限制在带有铝背衬块的铝张紧环内而结合在一起。血管化层(非织造层)的取向使其接触铝背衬块。eptfe膜在张紧箍中朝外。然后将带有背衬块的张紧环中的材料夹在两块钢板之间并放置在卡弗压机(carver press)中。图12图示了所用材料的构造的分解图。具体地,材料包括卡弗压机顶板1220、顶钢板1240、带背衬块的张力环1260、底钢板1280和卡弗压机底板1225。双层生物相容性膜复合材料1210包括第一层(缓解层)1230和第二层(血管化层)1250。
[0203]
将卡弗压机设置为235℃的温度并施加最小压力,以使卡弗压机板与钢板接触,但压力表上没有记录压力。在45秒的停留时间后,去除与卡弗压机板的接触。当缓解层和血管化层从张紧环上取下时,它们结合在一起作为生物相容性膜复合材料。
[0204]
实施例2
[0205]
三种生物相容性膜复合材料,每一种都有两个不同的层,每层都以类似的方式构建。这三种构建体都具有相似的第一层(缓解层),但具有不同的第二层(血管化层)。三种不同的生物相容性膜复合材料在下文中将被称为构建体a、构建体b和构建体c。
[0206]
第一膨胀聚四氟乙烯(eptfe)膜是根据branca等人的美国专利第5,814,405号的教导制备的。根据branca等人的美国专利第5,814,405号的教导,通过低于熔点(below-the-melt)的机器方向(md)膨胀步骤对第一eptfe层的eptfe带前体进行处理。在第一eptfe带前体的低于熔点md膨胀步骤期间,根据bacino的wo 94/13469的教导施加fep膜。根据branca等人的美国专利第5,814,405号的教导,通过非晶态锁定步骤和高于熔点(above-the-melt)md膨胀步骤对第二eptfe层的eptfe带前体进行处理。带前体的特性和在第二层上进行的md膨胀的量在三种构建体之间有所不同。在第二eptfe带前体的低于熔点md膨胀步骤期间,根据bacino的wo 94/13469的教导施加fep膜。将第二eptfe膜的膨胀eptfe带前体层压到第一eptfe膜的膨胀eptfe带前体上,使得第二eptfe带的fep侧与第一eptfe膜的eptfe带前体的ptfe侧接触。
[0207]
然后将两层生物相容性膜复合材料在ptfe熔点以上沿机器方向和横向共膨胀。其上具有fep1320的第一eptfe层的代表性表面微结构显示在图13的扫描电子显微照片(sem)图像中。图14,图15和图16显示的sem图像分别是第二eptfe膜1400、1500和1600(血管化层)的节点和原纤维结构的代表性图像。图17、图18和图19所示的sem图像分别是包括第一eptfe膜1720、1820和1920(缓解层)和第二eptfe膜1740、1840和1940(血管化层)的两层生物相容性膜复合材料的横截面结构的代表性图像。
[0208]
生物相容性膜复合材料的表征
[0209]
生物相容性膜复合材料的每一层都被评估并表征了各层功能的相关参数。用于表征相关参数的方法根据上述测试方法部分中描述的测试方法进行。结果总结在表2中。
[0210]
表2
[0211][0212]
*请注意,每个构建体下列出的值是在两层复合材料结合在一起后测量的,而不是单独的血管化层的测量结果。
[0213]
上文中已经概括性地并且结合具体实施方式描述了本技术的发明。对本领域的技术人员来说显而易见的是,可以在不偏离本公开的范围的情况下,对实施方式进行各种修改和变动。因此,实施方式旨在覆盖对本发明的这些修改和变动,只要这些修改和变动在所附权利要求及其等同方案的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1