治疗血管畸形的方法与流程
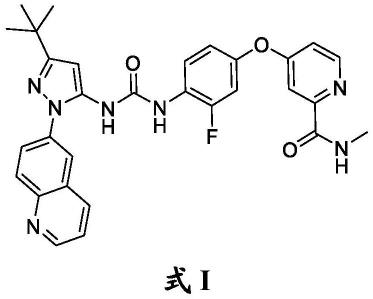
治疗血管畸形的方法
1.本技术主张2019年8月12日提交的u.s.s.n.62/885,519的优先权,其内容以全文引用的方式并入本文中。
2.发明背景
3.内膜内皮细胞激酶-2(tie2)主要限于在血管的内皮细胞中表现。tie2为血管生成素1(angpt1)、血管生成素2(angpt2)及血管生成素4(angpt4)的受体,且此信息传递系统在血管增生(新血管从现有血管芽生)及血管新生(新血管重新形成)两者中扮演重要的角色。
4.血管畸形包含各种各样的脉管系统疾病。这些疾病包括静脉畸形、淋巴管畸形、微血管畸形、动脉畸形及动静脉畸形。任何血管类型或组合皆可能涉及到畸形。血管畸形会随时间增长且会迅速生长,并且会发生局部组织浸润。静脉畸形可限制于局部或多病灶性发生。静脉畸形可与疼痛、肿胀、出血、外形病变、血栓形成及其他显著的发病有关。静脉畸形可影响诸如皮肤、关节、肌肉、肠道及骨骼的组织。许多静脉畸形可通过手术、雷射疗法或硬化疗法来治疗,然而并非所有静脉畸形都适合这些治疗。在大多数情况下,静脉畸形会在常规治疗的后复发。
5.已有大约50%的静脉畸形病例与性腺有所关联或与tie2激酶的体细胞突变有关。这些突变活化了tie2激酶,导致内皮细胞生长失调及静脉畸形。因此,需要有新的用于这些与tie2变动有关的疾病的治疗。
技术实现要素:
6.本文描述的是为tie2激酶的抑制剂的化合物及其在治疗或预防静脉畸形增长中的用途。本发明涉及使用以下所述的式i化合物作为tie2的强抑制剂以治疗静脉畸形的方法:
[0007][0008]
或其药学上可接受的盐。
[0009]
例如,本文提供一种治疗有需要的患者的tie2激酶介导的血管异常或tie2激酶突变体介导的血管异常的方法,其包含向该患者施用治疗有效量的式i化合物,或其药学上可接受的盐。
[0010]
此外,本文提供一种治有需要的患者的血管异常的方法,其包含向该患者施用治疗有效量的式i化合物,或其药学上可接受的盐,其中所述血管异常由tie2激酶介导或由tie2激酶突变体介导。
[0011]
再者,本文提供一种用于治疗有需要的患者的tie2激酶介导的血管异常或tie2激酶突变体介导的血管异常的式i化合物或其药学上可接受的盐,其包含向该患者施用治疗有效量的式i化合物,或其药学上可接受的盐。
[0012]
本文还提供一种治疗有需要的患者的静脉畸形的方法,其包含向该患者每天一次或两次施用约100mg至约200mg的式i化合物,或其药学上可接受的盐。
[0013]
本文还提供一种用于治疗有需要的患者的静脉畸形的式i化合物,或其药学上可接受的盐,其包含向该患者每天一次或两次施用约100mg至约200mg的式i化合物,或其药学上可接受的盐。
附图说明
[0014]
图1a-e显示在使用经转染的cho细胞的测定法中使用式i化合物抑制各种tie2突变型(分别为r849w、l914f、r1099*、y897c/r915c及y897f/r915l)的磷酸化。
[0015]
图2显示在使用经转染的人类脐静脉内皮细胞的测定法中使用式i化合物抑制各种tie2突变型的磷酸化。
[0016]
图3显示在使用经转染的人类脐静脉内皮细胞及各种tie2突变型的测定法中使用式i化合物抑制下游信息传递蛋白akt的磷酸化。
[0017]
图4显示在使用经转染的人类脐静脉内皮细胞及各种tie2突变型的测定法中使用式i化合物抑制下游信息传递蛋白stat1的磷酸化。
[0018]
图5a-f显示在使用经转染的人类脐静脉内皮细胞及各种tie2突变型(分别为wt或l914f、r849w、r1099*、y897c/r915c、y897c/r915l及t1105n/t1106p)的测定法中使用式i化合物恢复细胞的形态。
[0019]
图6a-f显示在使用经转染的人类脐静脉内皮细胞及各种tie2突变型的测定法中使用式i化合物表现angpt2、pdgfb、adamts1、adamts9、plat及plau的效果。
[0020]
图7显示在使用经转染的人类脐静脉内皮细胞及各种tie2突变型的测定法中使用式i化合物恢复胞外纤连蛋白。
[0021]
图8a显示实例10中所述的实验设计的示意图,其用于在静脉畸形模型中通过式i化合物评估体内的突变型tie2人类脐静脉内皮细胞的生长的抑制,其中在第0天给予小鼠对照饮食或注入式i化合物的饮食。
[0022]
图8b显示式i化合物在第7天在静脉畸形的体内模型中对于突变型tie2血管病变的眼观外型的效果。
[0023]
图9显示式i化合物在第7天在静脉畸形的体内模型中对于突变型tie2血管病变的尺寸的效果。
[0024]
图10显示式i化合物在第7天在静脉畸形的体内模型中对于突变型tie2血管病变的平滑肌细胞及外被细胞覆盖率的效果。
[0025]
图11显示式i化合物在第7天在静脉畸形的体内模型中对于突变型tie2血管病变中的tie2的磷酸化的效果。
[0026]
图12显示式i化合物在第16天在静脉畸形的体内模型中对于突变型tie2血管病变的尺寸的效果。
[0027]
图13显示式i化合物在第16天在静脉畸形的体内模型中对于突变型tie2血管病变
的平滑肌细胞及外被细胞覆盖率的效果。
[0028]
图14显示式i化合物在第16天在静脉畸形的体内模型中对于突变型tie2血管病变中的tie2的磷酸化的效果。
[0029]
图15显示式i化合物在第7及16天在静脉畸形的体内模型中对于突变型tie2血管病变的血管形态的效果。
[0030]
图16a显示实例10中所述的实验设计的示意图,其用于在静脉畸形模型中通过式i化合物评估体内的突变型tie2人类脐静脉内皮细胞的生长的抑制,其中在第7天给予小鼠对照饮食或注入式i化合物的饮食。
[0031]
图16b显示式i化合物在静脉畸形的体内模型中对于先前确立的突变型tie2血管病变的眼观外型的效果。
[0032]
图17a-b显示式i化合物在静脉畸形的体内模型中对于先前确立的突变型tie2血管病变的尺寸以及对于突变型tie2血管病变的平滑肌细胞及外被细胞覆盖率的效果。
[0033]
图18a-d比较式i化合物从注射日(第0天)至第7天的对于表现野生型及l914f tie2突变型的血管畸形(vm)病变的效果。通过肉眼可见的(图18a)及显微镜的(图18b)影像以及血管脉管面积的量化(图18c及图18d),将使用式i化合物饮食的治疗与使用对照饮食的治疗以及未经治疗的vm病变进行比较。
[0034]
图19a-c提供从注射日(第0天)至第16天,或从第7天至第16天的表现野生型及l914f tie2突变型的血管畸形(vm)病变的治疗比较。包括了未经治疗的vm病变以及使用式i化合物饮食与对照饮食治疗的表现tie2l914f的vm病变的显微镜视图比较(图19a),以及在表现tie2野生型或l914f的病变中的血管脉管面积的量化(图19b及图19c)。
具体实施方式
[0035]
本发明的特点及其他细节现将加以更明确的描述。本说明书、实施例及所附申请权利要求范围中所采用的特定术语在此处收集。这些定义应依据本发明的剩余部分且如本领域技术人员所理解来阅读。除非另外定义,否则本文所使用的所有技术及科学术语具有如一般本领域技术人员通常所理解的含义相同的含义。
[0036]
定义
[0037]
术语“个体(individual)”、“患者”或“受试者(subject)”可互换使用且包括任何动物,包括哺乳动物,优选为小鼠、大鼠、其他啮齿动物、兔、狗、猫、猪、牛、绵羊、马或者灵长类动物,且最优选为人类。本文所描述的化合物不仅可施用至诸如人类的哺乳动物,且还可施用至其他哺乳动物,诸如需要兽医治疗的动物,例如家畜(例如狗、猫及其类似动物)、农畜(例如母牛、绵羊、猪、马及其类似动物)及实验室动物(例如大鼠、小鼠、天竺鼠及其类似动物)。
[0038]“药学上或药理学上可接受”包括当适当时向动物或人类施用时不产生不利、过敏或其他不当反应的分子实体及组合物。对于人类施用,制剂应满足如fda生物制剂标准办公室(fda office of biologics standards)所要求的无菌性、发热性及通用安全及纯度标准。
[0039]
如本文所使用的术语“药学上可接受的载体”或者“药学上可接受的赋形剂”指与医药施用兼容的任何及所有溶剂、分散介质、包衣、等渗剂及吸收延迟剂以及其类似物。此
类介质及药剂用于药物活性物质的用途在本领域中众所周知。组合物还可含有提供补充、额外或者增强型治疗功能的其他活性化合物。
[0040]
如本文所使用的术语“药物组合物”指包含与一种或多种药学上可接受的载体一起调配的如本文所公开的至少一种化合物的组合物。
[0041]
如本文所使用的术语“医药上可接受的盐”指本文所公开的化合物的医药上可接受的有机或无机盐类。这些盐类可为可存于该组合物中所用的化合物中的酸性或碱性基团的盐。本质上为碱性的本发明组合物中所包括的化合物能够与各种无机酸及有机酸一起形成广泛多种的盐。可用于制备此类碱性化合物的药学上可接受的酸加成盐的酸为形成无毒酸加成盐的酸,即含有药理学上可接受的阴离子的盐,包括(但不限于)苹果酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟碱酸盐、乙酸盐、乳酸盐、水杨酸盐、柠檬酸盐、酒石酸盐、油酸盐、单宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、顺丁烯二酸盐、龙胆酸盐、反丁烯二酸盐、葡萄糖酸盐、葡萄糖醛酸盐、葡萄糖二酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐及双羟萘酸盐(即1,1'-亚甲基-双-(2-羟基-3-萘甲酸盐))、碱金属(例如钠及钾)盐、碱土金属(例如镁)盐及铵盐。药学上可接受的盐可涉及包括另一分子,诸如乙酸根离子、琥珀酸根离子或其他反荷离子。反荷离子可为使母体化合物上的电荷稳定的任何有机或无机部分。此外,药学上可接受的盐可在其结构中具有超过一个带电原子。在多个带电原子为该药学上可接受的盐的一部分的情形下可具有多个反荷离子。因此,药学上可接受的盐可具有一个或多个带电原子及/或一个或多个反荷离子。本发明化合物可含有酸性基团及碱性基团;例如一个胺基及一个羧酸基。在此类情况下,化合物可以酸加成盐、两性离子或者碱盐的形式存在。若如本文所公开的化合物为碱,则所要药学上可接受的盐可藉由本领域中可利用的任何适合方法来制备,例如用以下各物处理游离碱:无机酸,诸如盐酸、氢溴酸、硫酸、硝酸、甲磺酸、磷酸及其类似酸;或有机酸,诸如乙酸、马来酸、琥珀酸、杏仁酸、富马酸、丙二酸、丙酮酸、草酸、乙醇酸、水杨酸、哌喃糖基酸(诸如葡糖醛酸或半乳糖醛酸)、α醇酸(诸如柠檬酸或酒石酸)、氨基酸(诸如天冬胺酸或谷氨酸)、芳族酸(诸如苯甲酸或肉桂酸)、磺酸(诸如对甲苯磺酸或乙磺酸)或其类似物。若如本文所公开的化合物为酸,则所要药学上可接受的盐可藉由任何适合方法来制备,例如用以下各物处理游离酸:无机或有机碱,诸如胺(伯胺、仲胺或叔胺)、碱金属氢氧化物或碱土金属氢氧化物或其类似物。适合盐的说明性实例包括但不限于来源于诸如甘氨酸及精氨酸的氨基酸、氨、伯胺、仲胺及叔胺以及诸如哌啶、吗啉及哌嗪的环胺的有机盐,及来源于钠、钙、钾、镁、锰、铁、铜、锌、铝及锂的无机盐。
[0042]
如本文所使用的术语“治疗(treating或treatment)”包括以改良或稳定受试者的病状的方式逆转、减轻、或遏止病状的症状、临床征象、及潜在的病变。如本文所使用,且如本领域中所理解,“治疗”是一种用于获得有益或所需结果包括临床结果的方法。有益或所需临床结果可包括(但不限于)可检测或不可检测地减轻、改善、或减缓与病状(例如,癌症)相关的一或多个症状或病状,降低疾病程度,使疾病状态稳定(亦即,不恶化),延迟或推迟疾病进展,改善或缓解疾病状态,以及缓和(部分或完全)。“治疗”还可意指与在不接受治疗情况下预期的存活相比使存活延长。例示性有益临床结果描述于本文中。
[0043]
如本发明所使用的术语“施用(administer、administering或administration)”指向受试者直接施用组合物或是该化合物或组合物的药学上可接受的盐,或向该受试者施
用该组合物的前药衍生物或类似物或该化合物或组合物的药学上可接受的盐,其可在该受试者的体内形成等效量的活性化合物。
[0044]
在本说明书中,术语“治疗有效量”意指研究人员、兽医、医学医生或者其他临床医师正寻求的引发组织、系统或者动物(例如哺乳动物或者人类)的生物学或者医学反应的主题化合物的量。本文所述的化合物以治疗有效量施用以治疗所公开的病症。
[0045]
式i化合物在本文中还称为瑞把替尼(rebastinib)。
[0046]
本发明涉及治疗(阻断)或预防静脉畸形的生长。这类所公开的方法可包括向有需要治疗或降低这些病状的预防效果的患者施用有效量的式i化合物或其药学上可接受的盐,例如,作为调控tie2抑制的给药方案的一部分。
[0047]
在一些实施例中,式i化合物为依据式ii的磺酸盐。式ii(例如)为tie2(血管生成素配体的受体酪胺酸激酶)的强抑制剂。
[0048][0049]
例示性方法包括在患者中治疗静脉畸形,例如,其中这类患者在内皮细胞中具有可能致使或导致静脉畸形生长的tie2的表达、突变或变动。这类方法可包括向该罹患静脉畸形的患者施用式i化合物或其药学上可接受的盐。例如,提供例如式i化合物或其药学上可接受的盐的化合物可抑制包括有静脉畸形的生长的过程。所预期的化合物包括式i的游离碱。
[0050]
有效量、毒性及治疗功效可藉由标准医药程序、在细胞培养物或实验动物中判定,例如,以用于判定ld50(50%群体致死剂量)及ed50(50%群体治疗有效剂量)。剂量可视所用剂型及所用投药途径而变化。毒性与治疗效果之间的剂量比率为治疗指数且其可以ld50/ed50比率表示。在一些实施例中,该组合物及方法展现出大的治疗指数。所述组合物在血浆中的含量可(例如)藉由高效液相层析法测量,且任何特定剂量的效果尤其可藉由适宜生物分析法来监测。剂量可由医师判定且根据需要调整以适合所观测到的治疗效果。
[0051]
在某些实施例中,预防效果将引起至少约10%、至少约20%、至少约30%、至少约50%、至少约70%、或至少约90%的可定量变化。在一些实施例中,所述效果将引起约10%、约20%、约30%、约50%、约70%、或甚至约90%或更多的可定量变化。治疗益处还包括暂停或减缓所预期的潜在疾病或病症的进展,与是否实现改善无关。
[0052]
本文所述的式i或其药学上可接受的盐(及/或额外试剂)可以包含有药学上可接受的载体或媒介物的组合物的组分形式施用受试者。这类组合物可视情况包含适宜量的药学上可接受的赋形剂以提供用于适合施用的形式。
[0053]
药学上可接受的赋形剂可为液体,诸如水及油,包括石油、动物、植物或合成来源的油,诸如花生油、大豆油、矿物油、芝麻油等。药用赋形剂可为(例如)盐水、阿拉伯胶、明
胶、淀粉糊、滑石、角蛋白、胶态二氧化硅、尿素等。另外,可使用辅助剂、稳定剂、增稠剂、润滑剂及着色剂。在一些实施例中,药学上可接受的赋形剂当施用受试者时为无菌的。当本文所述的任何试剂静脉内施用时,水为适用的赋形剂。还可使用盐水溶液及右旋糖水溶液以及甘油溶液作为液体赋形剂,特别是用于可注射溶液。合适的药用赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、无水脱脂奶、甘油、丙烯、乙二醇、水、乙醇等。如果需要,本文所述的任何试剂还可包含少量润湿剂或乳化剂,或ph缓冲剂。
[0054]
在一些实施例中本文提供用以治疗静脉畸形或其他先天性静脉畸形的方法,其包含向有需要的患者施用有效量的式i化合物或其药学上可接受的盐。所预期的静脉畸形包括球形细胞静脉畸形、黏膜与皮肤的静脉畸形(还称为皮黏膜静脉畸形,vmcm)、蓝色橡皮疱痣综合症、胃或肠胃道病变、及/或马富西综合症(maffucci syndrome)。
[0055]
例如,本文所预期的是一种阻断静脉畸形生长的方法,其包含在(例如)足以阻断肿瘤微环境中的tie2激酶的给药方案中向有需要的患者施用有效量的式i化合物或其药学上可接受的盐。
[0056]
在一些实施例中,式i化合物或其药学上可接受的盐的给药方案为每天给药施用或每天两次给药施用。
[0057]
在其他实施例中,式i化合物或其药学上可接受的盐的给药方案为间歇性给药施用。该间歇非每天的给药方案可包括(但不限于)隔天给药、每隔两天给药、每周两次给药或每周一次给药。在一些实施例中,该方法包含向该患者施用式i化合物每天一次、间歇非每天一次、每隔一天一次,每隔两天一次、每隔一周一次、每天两次、每周一次或每周两次。
[0058]
在一些实施例中,式i化合物或其药学上可接受的盐的适宜给药方案包括施用每周两次、每周一次或隔周施用,例如每周两次或每周一次,例如每周两次。
[0059]
本发明的另一方面涉及一种阻断静脉畸形生长的方法,其包含以足以阻断tie2激酶或突变型tie2激酶活性的剂量施用式i化合物或其药学上可接受的盐,其中该式i化合物或其药学上可接受的盐以间歇非每天的给药方案施用。在一些实施例中,该间歇非每天的给药方案包括隔天给药、每隔两天给药、每周两次给药、及每周一次给药。
[0060]
本发明的另一方面涉及一种治疗在手术切除肿瘤之前处于前导性治疗中的静脉畸形患者的方法,其包含向有需要的患者施用有效量的式i化合物或其药学上可接受的盐,式i化合物或其药学上可接受的盐的给药方案足以阻断tie2激酶或突变型tie2激酶。
[0061]
在一些实施例中,该治疗在手术切除肿瘤之前处于前导性治疗中的静脉畸形患者的方法包含以足以阻断tie2激酶或突变型tie2激酶的给药方案向有需要的患者施用有效量的式i化合物或其药学上可接受的盐。
[0062]
在一些实施例中,一种治疗在手术切除之前处于前导性治疗中的静脉畸形患者的方法包含以足以阻断tie2激酶或突变型tie2激酶的剂量、以每天或每天两次施用式i化合物或其药学上可接受的盐的给药方案来施用式i化合物或其药学上可接受的盐。
[0063]
在一些实施例中,该治疗在手术切除的前处于前导性治疗中的静脉畸形患者的方法包含以足以阻断tie2激酶或突变型tie2激酶的给药方案、以间歇非每天的方式施用式i化合物或其药学上可接受的盐的给药方案来向有需要的患者施用有效量的式i化合物或其药学上可接受的盐,所述间歇非每天的方式包括隔天给药、每隔两天给药、每周两次给药、
及每周一次给药。
[0064]
在一些实施例中,该治疗在手术切除之前处于前导性治疗中的静脉畸形患者的方法包含以每周两次、每周一次或隔周施用的给药方案来向有需要的患者施用有效量的式i化合物或其药学上可接受的盐。
[0065]
本发明的另一方面涉及一种治疗有需要的患者的tie2激酶介导的血管异常或tie2激酶突变体介导的血管异常(例如,血管畸形、血管肿瘤(例如血管瘤)及/或其他先天性血管缺陷)的方法,其包含向该患者施用治疗有效量的式i化合物,或其药学上可接受的盐。
[0066]
在一些实施例中,该药学上可接受的盐为磺酸盐。在一些实施例中,该药学上可接受的盐为甲磺酸盐。在一些实施例中,该药学上可接受的盐为三氟甲磺酸盐。在一些实施例中,该药学上可接受的盐为乙磺酸盐。在一些实施例中,该药学上可接受的盐为苯磺酸盐。在一些实施例中,该药学上可接受的盐为氯苯磺酸盐。在一些实施例中,该药学上可接受的盐为樟脑磺酸盐。在一些实施例中,该药学上可接受的盐为甲苯磺酸盐。在一些实施例中,该药学上可接受的盐为单甲苯磺酸盐。在一些实施例中,该药学上可接受的盐为二甲苯磺酸盐。在一些实施例中,该药学上可接受的盐为三甲苯磺酸盐。在一些实施例中,该药学上可接受的盐为四甲苯磺酸盐。
[0067]
治疗有需要的患者的血管异常的方法在本文预期中,包含向该患者施用治疗有效量的式i化合物,或其药学上可接受的盐。在一些实施例中,血管异常是tie2激酶介导的血管异常或tie2激酶突变体介导的血管异常。tie2激酶介导的血管异常或tie2激酶突变体介导的血管异常可为慢血流型畸形。在一些实施例中,该慢血流型畸形选自微血管畸形、淋巴管畸形、淋巴管-静脉畸形、或静脉畸形。在一些实施例中,该慢血流型畸形为静脉畸形。
[0068]
调配物、施用、给药及治疗方案
[0069]
本发明还描述在药物组合物中的式i化合物(及/或额外试剂)或其药学上可接受的盐。本文所述的组合物可呈以下形式:溶液、悬浮液、乳液、滴剂、片剂、丸剂、球粒、胶囊、含液体胶囊、散剂、持续释放调配物、栓剂、乳液、气雾剂、喷雾、悬浮液或任何其它适用的形式。在一些实施例中,该组合物呈胶囊形式(参见例如美国专利第5,698,155号)。适合的药用赋形剂的其它实例描述于remington’s pharmaceutical sciences 1447-1676(alfonso r.gennaro编,第19版,1995)中,其以引用的方式并入本文中。
[0070]
必要时,本文中所描述的盐也可包括增溶剂。此外,试剂可用如所属领域中已知的适宜媒介物或传递装置传递。本文中概述的组合疗法可在单一传递媒介物或传递装置中共同传递。用于施用的组合物可视情况包括局部麻醉剂(诸如(例如)利诺卡因(lignocaine))以减轻注射部位的疼痛。
[0071]
在一些实施例中,本文所述的式i化合物或其药学上可接受的盐(及/或额外试剂)根据常规制程调配为适合于施用模式的组合物。
[0072]
在某些实施例中,施用途径包括例如:皮内、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外、口服、舌下、鼻内、脑内、阴道内、经皮、经直肠、通过吸入、或外用,尤其到耳、鼻、眼或皮肤。在一些实施例中,施用通过口服或通过肠胃外注射实现。施用模式可留给医师判断,且部分取决于医学病况的部位。在大多数情况下,施用会导致本文所述的任何试剂释放到血流中。
[0073]
在一些实施例中,向需要治疗或阻断的区域局部施用是可取的。
[0074]
在一些实施例中,本文所述的盐(及/或额外试剂)根据常规制程调配为适合向人类口服施用的组合物。口服传递的组合物可呈(例如)片剂、口含片、水性或油性悬浮液、颗粒、散剂、乳液、胶囊、糖浆剂或酏剂形式。口服施用的组合物可包含一种或多种试剂,例如甜味剂,诸如果糖、阿斯巴甜或糖精;调味剂,诸如胡椒薄荷、冬青油或樱桃油;着色剂;以及防腐剂,以提供药学上适口的制剂。此外,当呈片剂或丸剂形式时,该组合物可经包覆以延迟在胃肠道中的崩解及吸收,藉以提供时间周期延长的持续作用。本文所述的包围渗透活性驱动式i化合物或其药学上可接受的盐(及/或额外试剂)的可选择性渗透膜还适用于口服施用的组合物。在后面的这些平台中,来自包围胶囊的环境的流体由该驱动组合物吸收,所述驱动组合物膨胀以使该试剂或试剂组合物移位穿过开口。这些传递平台可提供与立即释放调配物的尖峰状曲线相对的基本上零级传递曲线。还可以使用延时材料,诸如单硬脂酸甘油酯或硬脂酸甘油酯。口服组合物可包括标准赋形剂,诸如甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素及碳酸镁。在一些实施例中,所述赋形剂是医药级的。除活性组合物之外,悬浮液可含有诸如(例如)乙氧基化异硬脂醇、聚氧化乙烯山梨糖醇及去水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂-琼脂及西黄蓍胶等及其混合物的悬浮剂。
[0075]
适用于肠胃外施用(例如静脉内、肌内、腹膜内、皮下及关节内注射及灌注)的剂型包括(例如)溶液、悬浮液、分散液、乳液等。其还可以无菌固体组合物(例如冻干组合物)形式制造,其可在即将使用的前溶解或悬浮于无菌可注射介质中。其可含有(例如)所属领域中已知的悬浮或分散剂。
[0076]
本文所述的式i化合物或其药学上可接受的盐(及/或额外试剂)的剂量以及给药时间表可取决于各种参数,包括(但不限于)所治疗的疾病、受试者的一般健康状况和施用医师的判断。本文所述的任何试剂可在施用另一治疗剂之前(例如之前5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周)、与其同时、或在其之后(例如之后5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周)向有需要的受试者施用。在各种实施例中,本文所述的任何试剂相隔1分钟、相隔10分钟、相隔30分钟、相隔不到1小时、相隔1小时、相隔1小时到2小时、相隔2小时到3小时、相隔3小时到4小时、相隔4小时到5小时、相隔5小时到6小时、相隔6小时到7小时、相隔7小时到8小时、相隔8小时到9小时、相隔9小时到10小时、相隔10小时到11小时、或相隔11小时到12小时施用。
[0077]
本文所述的式i化合物或其药学上可接受的盐(及/或额外试剂)的剂量可取决于若干因素,包括病况的严重度、病况是被治疗还是被预防的、以及待治疗的受试者的年龄、体重和健康状况。此外,关于特定受试者的药物基因体学(基因型对治疗的药物动力学、药效学或功效概况的作用)信息可影响所使用的剂量。此外,确切的个别剂量可视多种因素而略加调整,所述因素包括所施用试剂的特定组合、施用时间、施用途径、调配物性质、排泄的速率、所治疗的特定疾病、病症的严重度以及病症的解剖学位置。可预期剂量有一些变化。
[0078]
在一些实施例中,当哺乳动物向口服施用时,本文所述的式i化合物或其药学上可接受的盐(及/或额外试剂)的剂量可为0.001mg/kg/天至150mg/kg/天、0.001mg/kg/天至100mg/kg/天、0.01mg/kg/天至50mg/kg/天、或0.1mg/kg/天至10mg/kg/天。在一些实施例
中,当向人类口服施用时,本文所述的任何试剂的剂量通常为每天0.001mg至1500mg、每天1mg至600mg、或每天5mg至30mg。在一些实施例中,盐(或试剂)的剂量在每天50mg至1200mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至900mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至600mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至300mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至150mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至140mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至130mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至120mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至110mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至100mg范围内。在一些实施例中,盐(或试剂)的剂量在每天50mg至90mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至1200mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至150mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至140mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至130mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至120mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至110mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至100mg范围内。在一些实施例中,盐(或试剂)的剂量在每天57mg至90mg范围内。在其它实施例中,盐(或试剂)或盐的剂量在每天60mg至200mg范围内。在其它实施例中,盐(或试剂)或盐的剂量在每天60mg至150mg范围内。在其它实施例中,盐(或试剂)或盐的剂量在每天70mg至150mg范围内。在其它实施例中,盐(或试剂)或盐的剂量在每天80mg至150mg范围内。在其它实施例中,盐(或试剂)或盐的剂量在每天90mg至150mg范围内。在其它实施例中,盐(或试剂)或盐的剂量在每天100mg至150mg范围内。在其它实施例中,盐(或试剂)或盐的剂量在每天100mg至200mg范围内。
[0079]
在一些实施例中,对于本文所述的式i化合物或其药学上可接受的盐(及/或额外试剂)通过肠胃外注射的施用,剂量为每天0.1mg至250mg。在一些实施例中,该剂量为每天1mg至200mg。在一些实施例中,该剂量为每天1mg至150mg。在一些实施例中,该剂量为每天10mg至150mg。在一些实施例中,该剂量为每天20mg至200mg。在一些实施例中,该剂量为每天30mg至200mg。在一些实施例中,该剂量为每天40mg至200mg。在一些实施例中,该剂量为每天50mg至200mg。在一些实施例中,该剂量为每天50mg至150mg。在一些实施例中,该剂量为每天57mg至150mg。在一些实施例中,该剂量为每天57mg至100mg。在一些实施例中,该剂量为每天60mg至150mg。在一些实施例中,该剂量为每天70mg至150mg。在一些实施例中,该剂量为每天60mg至140mg。在一些实施例中,该剂量为每天60mg至130mg。在一些实施例中,该剂量为每天60mg至120mg。在一些实施例中,该剂量为每天60mg至110mg。在一些实施例中,该剂量为每天60mg至100mg。在一些实施例中,该剂量为每天60mg至90mg。在一些实施例中,该剂量为每天70mg至130mg。在一些实施例中,该剂量为每天70mg至120mg。在一些实施例中,该剂量为每天70mg至110mg。在一些实施例中,该剂量为每天70mg至100mg。在一些实施例中,该剂量为每天1mg至20mg,或每天3mg至5mg。注射可给予最多每天四次。在一些实施例中,当口服或肠胃外施用时,本文所述的任何试剂的剂量通常为每天0.1mg至1500mg、或每天0.5mg至10mg、或每天0.5mg至5mg。每天可施用最多3000mg的剂量。
[0080]
在一些实施例中,本文所述的盐(及/或额外试剂)的施用可独立地为每天一至四次。具体而言,所述盐的施用可以盐为约50mg至1500mg的给药方案一天一次。适用于所寻求
的预防性效果的日剂量为57-1200mg/天。在一些实施例中,本文所述的方法包含每天向该患者施用约100mg的式i化合物或其药学上可接受的盐。在一些实施例中,本文所述的方法包含每天向该患者施用约200mg的式i化合物或其药学上可接受的盐。在一些实施例中,本文所述的方法包含每天向该患者施用约300mg的式i化合物或其药学上可接受的盐。如果每天施用两次,合适的剂量为100mg至200mg的盐。在一些实施例中,本文所述的方法包含向该患者施用约150、200或300mg的式i化合物或其药学上可接受的盐每天一次或两次。在一些其他实施例中,所述盐还可间歇地非每天施用。在一些实施例中,可每月一至四次或每年一至六次或每两年、三年、四年或五年一次进行所述盐的施用。在某些实施例中,每周或每两周进行所述盐的施用。在一些实施例中,当每周或每两周施用时,在一些实施例中,合适的盐给药方案在50-200mg/每施用范围内。在一些实施例中,每周或每两周施用且剂量为200-400mg/每次施用。在一些实施例中,每周或每两周施用且剂量为400-500mg/每次施用。在一些实施例中,每周或每两周施用且剂量为500-600mg/每次施用。在一些实施例中,每周或每两周施用且剂量为600-700mg/每次施用。在一些实施例中,每周或每两周施用且剂量为700-800mg/每次施用。在一些实施例中,每周或每两周施用且剂量为800-900mg/每次施用。在一些实施例中,每周或每两周施用且剂量为900-1000mg/每次施用。在一些实施例中,每周或每两周施用且剂量为1000-1100mg/每次施用。在一些实施例中,每周或每两周施用且剂量为1100-1200mg/每次施用。施用的持续时间可为一天或一个月、两个月、三个月、六个月、一年、两年、三年,且可能甚至持续于该受试者的终生中。将在许多情况下指示慢性长期施用。剂量可以单一剂量形式或分成多个剂量施用。一般来说,所需剂量应以设定的时间间隔持续长期的施用,通常至少经数周或数月,不过可能需要数月或数年的施用较长时间。
[0081]
在一些实施例中,式i化合物或其药学上可接受的盐可以单一试剂形式或与其他治疗剂组合施用。这类其他治疗剂包括放射线疗法、抗微管蛋白剂、dna烷基化剂、dna合成抑制剂、dna嵌入剂、抗雌激素剂、抗雄激素、类固醇、抗egfr剂、激酶抑制剂、拓朴异构酶抑制剂、组蛋白去乙酰酶(hdac)抑制剂、dna甲基化抑制剂、抗her2剂、抗血管生成剂、蛋白酶体抑制剂、沙利多胺(thalidomide)、来那度胺(lenalidomide)、抗体-药物共轭物(adc)、免疫调节剂或癌症疫苗。在一些实施例中,式i化合物或其药学上可接受的盐可与vegf抑制剂一起向患者施用。在一些实施例中,式i化合物或其药学上可接受的盐可与akt抑制剂一起向患者施用。在一些实施例中,式i化合物或其药学上可接受的盐可与mtor抑制剂一起向患者施用。在一些实施例中,式i化合物或其药学上可接受的盐可与pi3k抑制剂一起向患者施用。
[0082]
当式i化合物或其药学上可接受的盐与其它试剂组合使用时,所述其它试剂可与式i化合物的给药时间表独立给药。所述其它试剂可以其先前确立的治疗剂量及给药时间表给药,或其剂量及给药时间表可在与式i化合物组合使用时修改以优化功效、安全性或耐受性。
[0083]
式i化合物或其药学上可接受的盐可与包括(但不限于)化学治疗剂、标靶治疗剂、生物制剂或放射线疗法的其它试剂组合使用。
[0084]
在一些实施例中,式i化合物或其药学上可接受的盐可与化学治疗剂组合使用,所述化学治疗剂包括(但不限于)抗微管蛋白剂(例如,太平洋紫杉醇(paclitaxel)、用于可注射悬浮液的太平洋紫杉醇蛋白结合粒子、艾日布尔(eribulin)、多西他赛(docetaxel)、伊
沙匹隆(ixabepilone)、长春新碱(vincristine)、长春瑞滨(vinorelbine)、埃博霉素(epothilones)、软海绵素(halichondrins)、美登醇(maytansinoids))、dna烷基化剂(例如,顺铂(cisplatin)、卡铂(carboplatin)、奥沙利铂(oxaliplatin)、环磷酰胺(cyclophosphamide)、异环磷酰胺(ifosfamide)、替莫唑胺(temozolomide))、dna嵌入剂(例如,多柔比星(doxorubicin)、聚乙二醇化脂质体多柔比星、道诺霉素(daunorubicin)、埃达霉素(idarubicin)和表柔比星(epirubicin))、5-氟尿嘧啶、卡培他滨(capecitabine)、阿糖胞苷(cytarabine)、地西他滨(decitabine)、5-氮杂胞苷、吉西他滨(gemcitabine)及甲胺蝶呤(methotrexate)。
[0085]
在一些实施例中,式i化合物或其药学上可接受的盐可与激酶抑制剂组合使用,所述激酶抑制剂包括(但不限于)埃罗替尼(erlotinib)、吉非替尼(gefitinib)、拉帕替尼(lapatanib)、依维莫司(everolimus)、西罗莫司(sirolimus)、坦罗莫司(temsirolimus)、ly2835219、leeol l、pd 0332991、克卓替尼(crizotinib)、卡博替尼(cabozantinib)、舒尼替尼(sunitinib、帕唑帕尼(pazopanib)、索拉非尼(sorafenib)、瑞格非尼(regorafenib)、阿西替尼(axitinib)、达沙替尼(dasatinib)、伊马替尼(imatinib)、尼罗替尼(nilotinib)、维罗非尼(vemurafenib)、达拉菲尼(dabrafenib)、曲美替尼(trametinib)、艾德昔布(idelalisib)、度维昔布(duvelisib)、阿培昔布(alpelisib)、科帕昔布(copanlisib)及喹杂替尼(quizartinib)。
[0086]
在一些实施例中,式i化合物或其药学上可接受的盐可与抗雌激素剂组合使用,所述抗雌激素剂包括(但不限于)他莫昔芬(tamoxifen)、氟维司群(fulvestrant)、阿那曲唑(anastrozole)、来曲唑(letrozole)及依西美坦(exemestane)。
[0087]
在一些实施例中,式i化合物或其药学上可接受的盐可与抗雄激素剂组合使用,所述抗雄激素剂包括(但不限于)乙酸阿比特龙酯(abiraterone acetate)、恩杂鲁胺(enzalutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、氟他胺(flutamide)、乙酸环丙孕酮(cyproterone acetate)。
[0088]
在一些实施例中,式i化合物或其药学上可接受的盐可与类固醇剂组合使用,所述类固醇剂包括(但不限于)强的松(prednisone)及地塞米松(dexamethazone)。
[0089]
在一些实施例中,式i化合物或其药学上可接受的盐可与拓扑异构酶i抑制剂组合使用,所述拓扑异构酶i抑制剂包括(但不限于)伊立替康(irinotecan)、喜树碱(camptothecin)及拓扑替康(topotecan)。
[0090]
在一些实施例中,式i化合物或其药学上可接受的盐可与拓扑异构酶ii抑制剂组合使用,所述拓扑异构酶ii抑制剂包括(但不限于)依托泊苷(etoposide)、磷酸依托泊苷(etoposide phosphate)及米托蒽醌(mitoxantrone)。
[0091]
在一些实施例中,式i化合物或其药学上可接受的盐可与组蛋白去乙酰基酶(hdac)抑制剂组合使用,所述组蛋白去乙酰基酶(hdac)抑制剂包括(但不限于)伏立诺他(vorinostat)、罗米地辛(romidepsin)、帕比司他(panobinostat)、丙戊酸(valproic acid)和贝林诺他(belinostat)。
[0092]
在一些实施例中,式i化合物或其药学上可接受的盐可与dna甲基化抑制剂组合使用,所述dna甲基化抑制剂包括(但不限于)dznep及5-氮杂-2'-脱氧胞苷。
[0093]
在一些实施例中,式i化合物或其药学上可接受的盐可与蛋白酶体抑制剂组合使
用,所述蛋白酶体抑制剂包括(但不限于)硼替佐米(bortezomib)及卡非唑米(carfilzomib)。
[0094]
在一些实施例中,式i化合物或其药学上可接受的盐可与沙立度胺(thalidomide)、来那度胺及泊马度胺(pomalidomide)组合使用。
[0095]
在一些实施例中,式i化合物或其药学上可接受的盐可与生物制剂组合使用,所述生物制剂包括(但不限于)曲妥珠单抗(trastuzumab)、阿多-曲妥珠单抗(ado-trastuzumab)、帕妥珠单抗(pertuzumab)、西妥昔单抗(cetuximab)、帕尼单抗(panitumumab)、伊派利单抗(ipilimumab)、抗pd-1剂(包括(但不限于)拉立珠单抗(labrolizumab)及尼沃单抗(nivolumab))、抗pd-l1剂(包括(但不限于)mpdl3280a)、抗血管生成剂(包括(但不限于)贝伐单抗(bevacizumab)及阿柏西普(aflibercept))、以及抗体-药物共轭物(adc)(包括贝伦妥单抗维多汀(brentuximab vedotin)、曲妥珠单抗德鲁特坎(trastuzumab deruxtecan)(ds-8201)、及曲妥珠单抗恩他新(trastuzumab emtansine))。
[0096]
在一些实施例中,式i化合物或其药学上可接受的盐可与放射线疗法组合使用。
[0097]
在一些实施例中,式i化合物或其药学上可接受的盐可与治疗性疫苗组合使用,所述治疗性疫苗包括(但不限于)西普鲁塞-t(sipuleucel-t)。
[0098]
在一些实施例中,式i化合物或其药学上可接受的盐可与vegf抑制剂组合使用,所述vegf抑制剂包括(但不限于)帕唑帕尼(pazopanib)、贝伐单抗(bevacizumab)、卡博替尼(cabozantinib)、舒尼替尼(sunitinib)、索拉非尼(sorafenib)、阿西替尼(axitinib)、瑞格菲尼(regorafenib)、帕纳替尼(ponatinib)、卡博替尼(cabozantinib)、凡德他尼(vandetanib)、雷莫芦单抗(ramucirumab)、乐伐替尼(lenvatinib)、贝伐单抗(bevacizumab)及ziv-阿柏西普(ziv-aflibercept)。
[0099]
在一些实施例中,式i化合物或其药学上可接受的盐可与akt抑制剂组合使用,所述akt抑制剂包括(但不限于)azd5363、米替福新(miltefosine)、哌立福新(perifosine)、vqd-002、mk-2206、gsk690693、gdc-0068、曲西立滨(triciribine)、cct128930、pht-427及厚朴酚(honokiol)。
[0100]
在一些实施例中,式i化合物或其药学上可接受的盐可与mtor抑制剂组合使用,所述mtor抑制剂包括(但不限于)西罗莫司(sirolimus)、坦西罗莫司(temsirolimus)、依维莫司(everolimus)、ap23841、azd8055、bez235、bgt226、迪福莫司(deferolimus)(ap23573/mk-8669)、em101/ly303511、ex2044、ex3855、ex7518、gdc0980、ink-128、ku-0063794、nv-128、osi-027、pf-4691502、雷帕霉素类似物(rapalogs)、雷帕霉素(rapamycin)、瑞达莫司(ridaforolimus)、sar543、sf1126、wye-125132、xl765、佐他莫司(zotarolimus)(abt578)、托林1(torin 1)、gsk2126458、azd2014、gdc-0349及xl388。
[0101]
在一些实施例中,式i化合物或其药学上可接受的盐可与pi3k抑制剂组合使用,所述pi3k抑制剂包括(但不限于)艾德昔布(idelalisib)、科帕昔布(copanlisib)、度维昔布(duvelisib)、阿培昔布(alpelisib)、nvp-bez235、bkm-120、gdc-0941、gdc-0980、sf1126、px-866、pf-04691502、xl-765、xl-147、gsk2126458及zstk474。
[0102]
在一些实施例中,式i化合物或其药学上可接受的盐可与本文所述的一种或多种其他试剂组合使用。
[0103]
实例
[0104]
本发明的范畴不受意欲作为本发明几个方面的说明的实例中所公开的特定实施例限制,且功能上等效的任何实施例均落入本发明的范畴内。实际上,除本文所示及所述之外,本发明的各种修改将为所属领域技术人员显而易见且欲落入所附权利要求范围的范畴内。
[0105]
实例1.式i化合物对r849w tie2突变体的生物化学抑制
[0106]
r849w tie2的生化分析法(seq.id no.1)
[0107]
r849w tie2激酶的活性藉由追踪从经由与丙酮酸激酶/乳酸脱氢酶系统偶联的激酶反应产生的adp来测定(例如schindler等人,science(2000)289:1938-1942)。在此测定法中,以分光亮度测定法连续监测nadh的氧化(由此在a340nm下会减少)。反应混合物(100μl)含有r849w tie2(signalchem)(7.5nm)、bsa(0.004%(w/v))、polyey(1mg/ml)、mgcl2(15mm)、dtt(0.5mm)、丙酮酸激酶(4个单位)、乳酸脱氢酶(7个单位)、磷酸烯醇丙酮酸(1mm)及nadh(0.28mm)及atp(4mm)于含有0.2%辛基-葡萄糖苷及1%dmso的100mm tris缓冲液(ph 7.5)中。抑制反应藉由将连续稀释的测试化合物与以上反应混合物混合一起而启动。在孔盘读取器(biotek)上在30℃下连续监测在340nm下的吸收持续8小时。使用3至4小时时间范围来计算反应速率。抑制百分比藉由比较反应速率与对照(即无测试化合物)的反应速率来获得。使用如graphpad prism软件包中所执行的软件例程,利用在一系列抑制剂浓度下所测定的一系列抑制百分比值计算ic
50
值。本文所公开的式i化合物展现0.9nm的ic
50
值。
[0108]
用于筛选的r849w tie2蛋白序列(seq.id no.1)
[0109]
qlkranvqrrmaqafqnvreepavqfnsgtlalnrkvknnpdptiypvldwndikfqdvigegnfgqvlkarikkdglwmdaaikrmkeyaskddhrdfagelevlcklghhpniinllgacehrgylylaieyaphgnlldflrksrvletdpafaianstastlssqqllhfaadvargmdylsqkqfihrdlaarnilvgenyvakiadfglsrgqevyvkktmgrlpvrwmaieslnysvyttnsdvwsygvllweivslggtpycgmtcaelyeklpqgyrlekplncddevydlmrqcwrekpyerpsfaqilvslnrmleerktyvnttlyekftyagidcsaeeaa
[0110]
实例2.式i化合物对一组tie2突变体的生物化学抑制
[0111]
一组tie2突变体及wt tie2的生化分析法
[0112]
将tie2 wt或tie2突变体(r849w、p883a、y897c、y897s、y1108f或a1124v)及polyey底物添加至反应缓冲液(20mm hepes ph 7.5,10mm mgcl2、2mm mncl2、1mm egta、0.02%brij35、0.02mg/ml bsa、0.1mm na3vo4、2mm dtt、1%dmso)。将化合物1添加至反应物中,随后20分钟之后添加atp及33p atp的混合物至最终浓度为10μm。反应在25℃下进行2小时。将反应物点至p81离子交换滤纸上且在0.75%磷酸中将未结合的冲洗出滤器。在减去源自含有非活性酶的对照反应的背景值后,激酶活性数据呈现为该等测试样本中剩余的激酶活性与dmso对照反应物相比下的百分比。使用如graphpad prism软件包中所执行的软件例程,利用在一系列抑制剂浓度下所测定的一系列抑制百分比值计算ic
50
值。本文所公开的式i化合物对于wt tie2展现0.97nm的ic
50
值,对于r849w tie2为1.3nm,对于p883a tie2为8.1nm,对于y897c tie2为1.2nm,对于y897s tie2为1.5nm,对于y1108f tie2为8.4nm,且对于a1124v tie2为2.7nm。
[0113]
实例3.式i化合物在cho细胞中对tie2突变体的细胞抑制
[0114]
cho-k1细胞培养
[0115]
cho-k1细胞(目录号ccl-61)获自美国典型培养物保存中心(atcc,manassas,va)。简言之,使细胞在rpmi 1640培养基(补充有10%特征化胎牛血清(invitrogen,carlsbad,ca)、100单位/ml盘尼西林g、100μg/ml链霉素、及0.29mg/ml l-麸酰胺酸(invitrogen,carlsbad,ca))中、于37℃、5%co2及95%湿度下生长。允许细胞扩增直至达到70-95%群集,此时对其进行继代培养或收集以供分析使用。
[0116]
突变型tie2转染的cho k1磷酸化-tie2西方墨点法
[0117]
将cho k1细胞(1x 105个细胞/孔)添加到24孔组织培养处理板中的补充有10%经特性分析胎牛血清及1x非必需氨基酸的1ml rpmi1640培养基(invitrogen公司,carlsbad,ca)内。接着将细胞在37℃、5%co2及95%湿度下培育过夜。抽吸培养基,且将0.5ml培养基添加到各孔中。将编码tie2突变体r849w、l914f、r1099*、y897c/r915c或y897f/r915l的转染级质体dna(克隆到pcdna3.2
tm
/v5-dest表达载体的tie2基因gateway,invitrogen公司,carlsbad,ca)在无血清的室温i培养基(invitrogen公司,carlsbad,ca)中稀释到5μg/ml。每0.5μg的质体dna添加2μl的lipofectamine ltx试剂(invitrogen公司,carlsbad,ca)。轻轻地混合试管,且在室温下培育25分钟以使dna-lipofectamine ltx复合物形成。将100μl的dna-lipofectamine ltx复合物直接添加到含有细胞的各孔中且轻轻地混合。转染后二十四小时,抽吸含有dna-lipofectamine ltx复合物的培养基,用无血清的rpmi 1640洗涤细胞,且添加无血清的rpmi 1640。将测试化合物或dmso添加到各孔中(0.5%最终dmso浓度)。接着将孔板在37℃、5%co2及95%湿度下培育4小时。在培育之后,抽吸培养基,且用pbs洗涤细胞。于4℃在摇晃的情况下使用含有halt磷酸酶及蛋白酶抑制剂(pierce,rockford,il)及磷酸酶抑制剂混合液2(sigma,st.louis,mo)的mper溶解缓冲液(pierce,rockford,il)溶解细胞10分钟。澄清的溶胞产物通过sds-page在4-12%novex nupage bis-tris凝胶(invitrogen公司,carlsbad,ca)上分离,且接着转移到immobilon-fl pvdf。在转移之后,将pvdf膜用odyssey阻断缓冲液(li-cor公司,lincoln,ne)阻断,且接着用磷酸化-tie2的兔抗体(emd millipore公司,burlington,ma)及小鼠抗tie2抗体(bd pharmingen公司,san jose,ca)探测。使用与近红外光染剂(发射波长为800nm)共轭的二级山羊抗兔抗体(li-cor公司,lincoln,ne)来检测磷酸化-tie2。使用与近红外光染剂(发射波长为680nm)共轭的二级山羊抗小鼠抗体(li-cor公司,lincoln,ne)来检测总tie2。使用odyssey cl成像仪(li-cor公司,lincoln,ne)来检测荧光。使用image studio软件(li-cor公司,lincoln,ne)来定量160kda磷酸化-tie2及总tie2的条带。数据使用prism软件(graphpad software公司,san diego,ca)分析以计算ic
50
值。本文所公开的式i化合物展现以下ic
50
值:对于r849w tie2为3.6nm、对于l914f tie2为0.58nm、对于r1099*tie2为0.41nm、对于y897c/r915c tie2为1.2nm、及对于y897f/r915l tie2为0.35nm(图1a-e)。
[0118]
实例4.式i化合物在人类脐静脉内皮细胞中对tie2突变体的细胞抑制
[0119]
人类脐静脉内皮细胞(huvec)培养
[0120]
用于体内作业的huvec由lauri eklund博士(oulu,finland)惠予提供。简言的,细胞在含有10%胎牛血清(sigma-aldrich公司,diegem,belgium)的内皮细胞生长培养基(tebu-bio公司,boechout,belgium)中在37℃、5%co2及95%湿度下培育。允许细胞扩增直至达到90-95%群集,此时对其进行继代培养或收集以供分析使用。
[0121]
突变型tie2转染的huvec西方墨点法
[0122]
将稳定表现wt或tie2突变体r849w、l914f、r1099*、y897c/r915c、y897f/f915l或t1105n/t1106p的huvec细胞(2.5x 105个细胞/孔)添加至覆有贴附因子溶液(tebu-bio公司,boechout,belgium)的6孔孔板中的含有10%胎牛血清(sigma-aldrich公司,diegem,belgium)的2ml内皮细胞生长培养基(tebu-bio公司,boechout,belgium)中。随后将细胞在37℃、5%co2及95%湿度下培育过夜。第二天将测试化合物或dmso添加到各孔(0.068%最终dmso浓度)中。接着将孔板在37℃、5%co2及95%湿度下培育4小时。接着,用1μg/ml angpt1刺激细胞15分钟。将细胞溶解且以西方墨点法检测ptie2、tie2、β-肌动蛋白、pakt(s473)、pakt(t308)、akt、pstat1及stat1。本文所公开的式i化合物浓度为100nm时在具有wt tie2及tie2突变体的huvec中在有或没有angpt1的刺激下皆展现出完全抑制tie2磷酸化(图2)。本文所公开的式i化合物浓度为100nm时在具有wt tie2及tie2突变体的huvec中在有或没有angpt1的刺激下皆展现出完全抑制tie2下游的akt ser473及thr308磷酸化(图3)。本文所公开的式i化合物浓度为100nm时在具有wt tie2及tie2突变体的huvec中在有或没有angpt1的刺激下皆展现出完全抑制tie2下游的stat1磷酸化(图4)。
[0123]
实例5.式i化合物在tie2突变型人类脐静脉内皮细胞中对于细胞形态的恢复
[0124]
突变型tie2转染的huvec细胞形态测定法
[0125]
将稳定表现wt或tie2突变体r849w、l914f、r1099*、y897c/r915c、y897f/f915l或t1105n/t1106p的huvec细胞(5x105个细胞/孔)添加至覆有贴附因子溶液(tebu-bio公司,boechout,belgium)的10公分孔板中的含有10%胎牛血清(sigma-aldrich公司,diegem,belgium)的6ml内皮细胞生长培养基(tebu-bio公司,boechout,belgium)中。接着将细胞在37℃、5%co2及95%湿度下培育2天。接着,将测试化合物或dmso添加到各孔(0.068%最终dmso浓度)中。接着将培养盘在37℃、5%co2及95%湿度下另外培育48小时。在添加化合物后的24及48小时通过显微镜对细胞进行成像。本文所公开的式i化合物浓度为100nm时于tie2突变型huvec细胞中将细胞形态恢复到与表现wt tie2的huvec细胞相当。图5a显示表现wt tie2或l914f tie2的huvec细胞在未经处理、以dmso对照处理、或以100nm化合物处理48小时后的细胞形态。图5b显示表现r849w tie2的huvec细胞在未经处理、以dmso对照处理、或以100nm化合物处理48小时后的细胞形态。图5c显示表现r1099*tie2的huvec细胞在未经处理、以dmso对照处理、或以100nm化合物处理48小时后的细胞形态。图5d显示表现y897c/r915c tie2的huvec细胞在未经处理、以dmso对照处理、或以100nm化合物处理48小时后的细胞形态。图5e显示表现y897c/r915l tie2的huvec细胞在未经处理、以dmso对照处理、或以100nm化合物处理48小时后的细胞形态。图5f显示表现t1105n/t1106p tie2的huvec细胞在未经处理、以dmso对照处理、或以100nm化合物处理48小时后的细胞形态。
[0126]
实例6.式i化合物在tie2突变型人类脐静脉内皮细胞中对于rna表现的效果
[0127]
突变型tie2转染的基因表现测定法
[0128]
将稳定表现wt或tie2突变体r849w、l914f、r1099*、y897c/r915c、y897f/f915l或t1105n/t1106p的huvec细胞(5x 105个细胞/孔)添加至覆有贴附因子溶液(tebu-bio公司,boechout,belgium)的10公分孔板中的含有10%胎牛血清(sigma-aldrich公司,diegem,belgium)的内皮细胞生长培养基(tebu-bio公司,boechout,belgium)中。接着将细胞在37℃、5%co2及95%湿度下培育2天。接着,将测试化合物或dmso添加到各孔(0.068%最终dmso浓度)中。接着将培养盘在37℃、5%co2及95%湿度下另外培育48小时。藉由将细胞收
集到tripure分离试剂(sigma-aldrich公司,diegem,belgium)内来萃取rna。随后,使用revertaid h minus第一链cdna合成套组(thermo fischer scientific公司,merelbeke,belgium)从萃取的rna合成cdna。使用lightcycler480 sybrgreen预混液及lightcycler 480ii仪器(roche公司,switzerland)进行定量pcr。对angpt2、pdgfb、adamts1、adamts9、plat及plau的cdna定量且以持家基因gapdh的表现进行归一化。本文所公开的式i化合物浓度为100nm时引起了编码tie2配位体的angpt2 rna的表现增加,且在tie2突变细胞中异常地下调。本文所公开的式i化合物浓度为100nm时还引起了编码pdgfrb配位体的pdgfb rna的表现增加,且在tie2突变细胞中异常地下调。本文所公开的式i化合物浓度为100nm时还引起了编码胞外金属蛋白分解酶的adamts1及adamts9 rna的表现减少,而其表现于突变型tie2转染细胞中异常地上调。本文所公开的式i化合物浓度为100nm时还引起了编码血纤维蛋白溶酶原活化子的plat及plau rna的表现减少,而其表现于突变型tie2转染细胞中异常地上调。图6a显示表现wt tie2、l914f tie2、r849w tie2及r1099*tie2的huvec细胞的angpt2及pdgfb rna表现。图6b显示表现wt tie2、l914f tie2、y897c/r915c tie2、y897c/r915l tie2及t1105n/t1106p tie2的huvec细胞的angpt2及pdgfb rna表现。图6c显示表现wt tie2、l914f tie2、r849w tie2及r1099*tie2的huvec细胞的adamsts1及adamsts9 rna表现。图6d显示表现wt tie2、l914f tie2、y897c/r915c tie2、y897c/r915l tie2及t1105n/t1106p tie2的huvec细胞的adamsts1及adamsts9 rna表现。图6e显示表现wt tie2、l914f tie2、r849w tie2及r1099*tie2的huvec细胞的plat及plau rna表现。图6f显示表现wt tie2、l914f tie2、y897c/r915c tie2、y897c/r915l tie2及t1105n/t1106p tie2的huvec细胞的plat及plau rna表现。
[0129]
实例6.式i化合物在tie2突变型人类脐静脉内皮细胞中对于胞外纤连蛋白的恢复
[0130]
突变型tie2转染的纤连蛋白测定法
[0131]
将稳定表现wt或tie2突变体r849w、l914f、r1099*、y897c/r915c、y897f/f915l或t1105n/t1106p的huvec细胞(3x105个细胞/孔)添加至覆有贴附因子溶液(tebu-bio公司,boechout,belgium)的6孔孔板中的含有10%胎牛血清(sigma-aldrich公司,diegem,belgium)的内皮细胞生长培养基(tebu-bio公司,boechout,belgium)中。接着将细胞在37℃、5%co2及95%湿度下培育24小时。接着,将测试化合物或dmso添加到各孔(0.068%最终dmso浓度)中。接着将孔盘在37℃、5%co2及95%湿度下另外培育48小时。将细胞转换到2%fbs中过夜。在转染体中的胞内纤连蛋白含量较低,因此收集细胞溶胞产物作为对照组。至于细胞残留物,将孔盘用含有0.05%triton-x及50nm nh4oh的1x pbs洗涤,随后用50mm的1x pbs洗涤,接着用1x pbs洗涤三次;接着用具有6.5m尿素的溶解缓冲液(9.1mm na2hpo4、1.7mm nah2po4、1%np-40、0.25%脱氧胆酸钠、150mm nacl、0.1%sds、1mm edta)萃取胞外基质蛋白。如图7所示,在dmso处理的情况下,于tie2突变体的胞外基质中看到比wt萃取物(上面的斑点)较低的纤连蛋白含量。细胞溶胞产物中的纤连蛋白含量与对照组中的相当。本文所公开的式i化合物浓度为100nm时恢复了表现tie2突变体的huvec细胞的胞外基质中的纤连蛋白含量,导致了与表现wt tie2的细胞相似的含量(图7)。
[0132]
实例7.式i化合物在静脉畸形模型中对体内的突变型tie2人类脐静脉内皮细胞的生长的抑制
[0133]
静脉畸形小鼠模型评估
[0134]
对于体内模型,使用慢病毒感染来制作新的转染体。简言之,将2x106个hek293细胞涂在10公分的培养皿上24小时,进行胰蛋白酶化,接着以含有pgag-pol、prsv-rev、pmd2.vsvg、慢病毒载体ptm945、2.5μg的ptie2-l914f、cacl2(merck公司,uk)、及2x hbs(thermo fischer scientific公司,merelbeke,belgium)的混合物培育20分钟。将1.5ml的细胞涂在24孔孔板中且培育48小时。随后,以每孔25,000个huvec(lgc standards sarl公司,france)在24孔孔盘上生长24小时,以500μl的慢病毒-tie2-l914f进行感染,接着另外培育48小时,收集,接着冷冻。
[0135]
为了评估该化合物在体内对于血管畸形(vm)病变的发展,将表现tie2-l914f的huvec细胞(2.5x106)培育、脱附、且接着再悬浮于200μl基质胶(corning公司)中。将该混合物皮下注射到5-7周龄的雄性无胸腺裸鼠(charles river公司)的背侧背部中。在注射当天(第0天),给予小鼠对照饮食或注入10mg/kg相等浓度化合物i的饮食;一旦引入,小鼠可以自由饮食,直到植入日后第7或16天采集基质胶塞的时点为止(图8a)。在植入日后第7或16天,将小鼠安乐死并切开各个基质胶塞周围的皮肤,接着平放在聚苯乙烯发泡板上并在10%中性福尔马林缓冲溶液(sigma-aldrich,diegem,belgium)中固定过夜。将基质胶塞从鼠皮移除,在一系列级配乙醇中脱水,并包埋在石蜡中。接着将包埋在石蜡中的基质胶塞切成5μm切片进行组织学分析。在二甲苯中脱蜡并在一系列递降的乙醇中再水合的后,将切片在含有或不含0.05%tween-20的0.1m柠檬酸盐缓冲液(ph 6.0)中进行热诱导的抗原修复。对于免疫组织化学染色,切片以3%h2o2(sigma-aldrich公司,diegem,belgium)进行阻断,与抗人类内皮细胞标志物荆豆凝集素(ulex europaeus agglutinin)1(uea1)(vector labs,brussels,belgium)的经生物素化抗体一起培育,随后与辣根过氧化物酶共轭的卵白素二级抗体(ge healthcare公司,diegem,belgium)一起培育,接着在dab溶液(vector labs公司,brussels,belgium)中培育。将切片用苏木素进行复染,并以vectamount永久封埋介质(vector labs公司,brussels,belgium)进行封固。对于免疫荧光染色(if),将切片与会辨识uea1、平滑肌层标志物sma(殖株1a4,sigma-aldrich公司,diegem,belgium)、经磷酸化-tie2(y772)(bioke公司,leiden,netherlands)、或总tie2(santa cruz公司,heidelberg,germany)的一级抗体一起培育。所使用的二级抗体与alexa488-、alexa649-或cy5-荧光团共轭。将载玻片用vectashield hardset封埋介质与dapi(vector labs公司,brussels,belgium)进行封固。经由panoramic 250flash iii数字玻片扫描仪(3d histech公司,hungary)获得影像,并用caseviewer 2.2版软件(3d histech公司,hungary)进行可视化。平均血管面积藉由各个基质胶塞的至少5个区域在20x接物镜下制作快照,并使用imagej软件分别测量至少6个uea+血管的面积而进行量化。
[0136]
在图8b中,所采集的病变的肉眼可见视图显示,在喂养正常或对照饮食的小鼠中于植入后第7天(d7)确立有充血的静脉通道且在第16天发展得更严重。一些喂养含有式i化合物的饮食的小鼠在基质胶塞内并未发展出任何病变;与未经治疗的突变体相比下,已确实形成的充血血管通道似乎受到更多控制且不那么严重。图9显示来自在植入后7天的给予对照饮食的小鼠的基质胶塞的uea1染色代表影像中的扩大的静脉通道及紊乱的内皮细胞(ec)斑块。然而,在来自经式i化合物治疗小鼠的基质胶塞内,扩张的血管形成则不那么严重。有证据表明,uea1+ec团簇的迁移性比对照组中的更高。也有若干未血管化的uea1+细胞。另外,采自经以式i化合物治疗的小鼠的基质胶塞内的血管平均面积大大低于喂养对照
饮食的小鼠的。
[0137]
vm病变的其中一种标志为不良且不一致的扩张静脉通道的平滑肌细胞/外被细胞覆盖率。在图10中,在喂食对照饮食的小鼠中的病变的if染色显示出血管周围没有阳性sma细胞或很少。在喂食式i化合物的小鼠中则显示出有一些sma阳性细胞但并非在ec层周围的所有细胞中。来自喂食对照及式i化合物饮食的小鼠的所有血管的ec皆强烈表现出总tie2;同样地,在喂食对照饮食的小鼠中的所有ec似乎表现经磷酸化的tie2(ptie2),如图11中所显现。在给予式i化合物饮食的小鼠的ec中的ptie2表现似乎较弱。
[0138]
到植入后第16天,基质胶内的病变已严重扩大,尽管看到了一些变异性,可能更多是由于技术/操作的问题(例如细胞与基质胶的非均质混合物)引起的(图12)。喂食对照饮食的小鼠发展出与未经治疗的小鼠相当的病变,但喂食式i化合物饮食的小鼠显示出小得多的血管。在未经治疗及喂食对照饮食的小鼠内,第16天的培植体发展出扩大的血管通道,且所述血管稀疏地被平滑肌层及少量sma+细胞包围。相反地,在喂食式i化合物的化合物中,血管似乎正常化且更一致地被sma+细胞所包围(图13)。图14显示出未经治疗的小鼠中的ec强烈表现ptie2。然而,在喂食式i化合物的小鼠中,ptie2大大降低。
[0139]
为评估培植体内的整体形态,进行基质胶塞内的血管全角包埋if。在切开附着有基质胶塞的皮肤之后,将其在10%中性福尔马林缓冲溶液中平置固定隔夜,将大约100-200μm的基质胶塞片切成薄片,且在1x pbs中洗涤。切片以1%bsa(v/v)(gibco公司)与0.3%triton-x100(sigma-aldrich公司,diegem,belgium)的1x pbs溶液进行阻断,接着在uea1中培育至少72小时,随后在cy5-卵白素二级抗体中(vector labs公司,brussels,belgium)培育。接着将切片在10%nbf中进行后固定10分钟,接着以荧光封固剂g(fluormount g)(thermo fischer scientific,merelbeke,belgium)封埋。以zeiss细胞观测转盘式共轭焦显微镜(zeiss公司,germany)获得z轴堆栈影像;通过arivis4d软件产生z轴堆栈影像的3d投影。图15显示出喂食对照饮食的小鼠中,形成在基质胶塞内的血管在植入后第7天及第16天皆异常伸长且絮乱。在第7天。采自喂食式i化合物的小鼠的培植体中看到扩张的且群聚的血管;然而,看到更正常且呈管状的血管。也看到许多未经血管化的uea+细胞;要注意的是,这与tie2-wt细胞在注入时展现的模式相同。在第16天,血管似乎在很大程度上正常化,具有均匀的管状结构。也存在有未经血管化的uea+细胞但其表现降低。也对第16天的具有野生型与l914f tie2突变体的经治疗与未经治疗vm病变进行了比较,其中治疗于第0天(图18a-d)或第7天(图19a-c)开始。此数据支持了用注入有式i化合物的食物喂养患有vm的小鼠会导致vm的发展性降低,且支持了向确立有vm的小鼠喂养式i化合物减轻了vm的严重性。
[0140]
为评估式i化合物对于先前确立的vm病变具有效果,依循了相同方法产生vm小鼠。然而,改为在在植入后第7天对小鼠引入对照或式i化合物饮食;接着,将小鼠安乐死且在第16天采集培植体(图16a)。全部的实验族群中皆发展出充血的血管通道,尽管严重程度差异很大(图16b)。来自喂食对照饮食的小鼠的第16天的培植体内的血管平均脉管面积与对照小鼠的相当,如图17a-b中所显示。来自喂食式i化合物饮食的小鼠的血管平均脉管面积适度降低。来自喂食式i化合物饮食的小鼠的病变展现出平滑肌细胞层覆盖率改善,与喂食对照饮食的小鼠的相当,这表明有增强的外被细胞稳定度及血管成熟度。图19a-d还绘示第16天的具有野生型与l914f tie2突变体的经治疗与未经治疗的vm病变的部分比较,其中治疗于植入后第7天开始。此数据支持了向确立有vm的小鼠喂养式i化合物减轻了vm的严重性。
[0141]
等效物
[0142]
所属领域技术人员将顶多使用常规实验即可认识到或能够确定尤其在本文中所述的特定实施例的许多等效物。这类等效物意欲涵盖在随附权利要求范围的范畴中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1