细胞封装装置的制作方法
1.本发明总体上涉及医疗装置领域,并且具体地涉及用于将细胞封装和植入到患者体内的治疗装置。技术领域
2.生物治疗是用于治疗外周动脉疾病、动脉瘤、心脏病、阿尔茨海默氏症和帕金森病、自闭症、失明、糖尿病和其它病症的越来越可行的方法。关于一般的生物治疗,可以通过将生物活性部分置于患者的组织床中的外科手术和/或介入方法将细胞、病毒、病毒载体、细菌、蛋白质、抗体和其它生物活性部分引入患者体内。通常,首先将生物活性部分置于装置中,然后将装置插入患者体内。或者,可先将装置插入患者体内,然后再添加生物活性部分。
3.通常,该装置具有芯部(例如,硅树脂),使得血管化只能从装置的外周界发生。引入这些装置的生物活性部分与氧气供应和营养素源之间的距离对细胞封装提出了问题,因为在相对较短的时间内没有足够的氧气和营养素供应的情况下,细胞将开始死亡。因此,需要这样的装置,它们封装细胞和/或其它生物部分(moiety),而同时确保细胞存活和生长。
技术实现要素:
4.本发明内容是本发明的各个方面的高度概述,并且介绍了在以下具体实施方式部分中进一步详细描述的一些概念。本发明内容并非旨在标识所要求保护的主题的关键特征或必要特征,也不是旨在孤立地用于确定所要求保护的主题的范围。应参照整个说明书合适的部分、任何或所有附图和每项权利要求来理解主题。
5.本公开的实施例涉及一种治疗装置,该治疗装置包括管状构件(例如,管状主体)和延伸穿过其中的内腔。治疗装置的壁包括第一可渗透复合层、第二可渗透复合层以及在第一复合层和第二复合层之间的贮存部。贮存部构造成接纳并包含生物部分。
6.在一些实施例中,第一复合层包括第一细胞可渗透层和第一细胞不可渗透层,并且第二复合层包括第二细胞可渗透层和第二细胞不可渗透层。
7.在一些实施例中,治疗装置具有第一端和第二端。第一端和第二端中的每一个都通向内腔,使得从第一复合层的第一细胞可渗透层和第二复合层的第二细胞可渗透层发生血管化。
8.在一些实施例中,贮存部的厚度在50微米至200微米之间。
9.在一些实施例中,生物部分是多个细胞。
10.在一些实施例中,多个细胞选自原核细胞、真核细胞、哺乳动物细胞、非哺乳动物细胞、干细胞及其组合。
11.在一些实施例中,该装置还包括与贮存部流体连通的端口。
12.本公开的实施例还涉及包括多个治疗装置的制品,每个治疗装置包括管状构件(例如,管状主体)。各治疗装置由连接构件连接。每个治疗装置包含延伸穿过其中的内腔。每个治疗装置具有第一端和第二端。第一端和第二端中的每一个都通向内腔。每个治疗装
置具有壁,该壁包括:第一可渗透复合层、第二可渗透复合层以及在第一复合层和第二复合层之间的贮存部。贮存部构造成接纳并包含生物部分。
13.在一些实施例中,治疗装置通过连接构件在治疗装置的第一端或第二端处互连。
14.在一些实施例中,各治疗装置可彼此独立地运动。
15.在一些实施例中,治疗装置通过连接构件流体互连。
16.在一些实施例中,贮存部具有50微米至200微米的厚度。
17.本公开的实施例还涉及一种装置,该装置包括其中具有第一开口和中空内部的环形治疗装置。环形治疗装置具有壁,该壁包括:第一可渗透复合层、第二可渗透复合层以及在第一复合层和第二复合层之间的贮存部。贮存部构造成接纳并包含生物部分。
18.在一些实施例中,环形治疗装置在与第一开口相对的一侧上具有第二开口并与其基本上对准。
19.在一些实施例中,该装置还包括第二环形治疗装置,该第二环形治疗装置具有其中定位在第二开口附近的第三开口。
20.在一些实施例中,第一环形治疗装置和第二环形治疗装置通过第二开口和第三开口流体互连。
21.在一些实施例中,生物部分是多个细胞。
22.在一些实施例中,多个细胞选自原核细胞、真核细胞、哺乳动物细胞、非哺乳动物细胞、干细胞及其组合。
23.在一些实施例中,第一复合层和第二复合层各自包括细胞可渗透层和细胞不可渗透层。
24.在一些实施例中,该装置还包括与贮存部流体连通的端口。
附图说明
25.包括附图以提供对本公开的进一步理解,且附图包含在本说明书中并且构成其一部分、示出实施例,并且与说明书一起阐释本公开的原理。
26.图1示出了根据本文所述的实施例的治疗装置的剖视图;
27.图2示出了根据本文所述的实施例的图1的治疗装置的第一复合层、第二复合层和贮存部的剖视图;
28.图3示出了根据本文所述的实施例的图1的治疗装置的一部分的放大图;
29.图4示出了根据本文所述的实施例的图1的治疗装置的内腔和各层的端视图;
30.图5示出了根据本文所述的实施例的治疗装置的剖视图;
31.图6示出了根据本文所述的实施例的图6所示的治疗装置的第一复合层、第二复合层和贮存部的剖视图;
32.图7示出了根据本文所述的实施例的包括通过连接构件连接的多个治疗装置的制品的立体图;
33.图8示出了根据本文所述的实施例的具有填充和冲洗端口的图7所示的制品的立体图;
34.图9示出了根据本文所述的实施例的环形治疗装置的立体图;
35.图10示出了根据本文所述的实施例的图9的血管化治疗装置的立体图;
36.图11示出了根据本文所述的实施例的堆叠在彼此之上的两个图9所示的治疗装置立体图;以及
37.图12示出了根据本文所述的实施例的图9所示的治疗装置的第一复合层、第二复合层和贮存部的剖视图。
具体实施方式
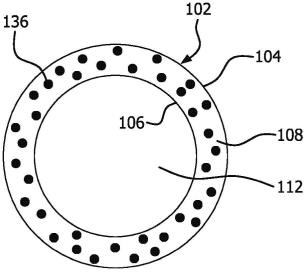
38.本领域的技术人员将容易理解,本公开的多个方面可通过构造成执行预期功能的任何数量的方法和装置来实现。还应注意的是,本文中参考的附图不一定是按比例绘制,而有可能放大以说明本公开的各个方面,并且就此而言,附图不应理解为限制性的。术语“治疗装置”和“装置”可在本文中互换使用。术语“可渗透复合层”、“多孔复合层”和“复合层”可在本文中互换使用。此外,术语“管状构件”和“管状主体”在本公开中可互换。
39.本文描述了用于封装生物部分的治疗装置,其中包含生物部分的(一个或多个)治疗装置植入患者体内,比如植入到组织床中,以提供生物治疗。本文还描述了用于形成治疗装置和将生物部分引入装置中的方法。在一些实施例中,治疗装置在形状方面是管状或基本上管状的,这允许从内腔内以及从治疗装置的外部进行血管化。在一些实施例中,治疗装置包括形成有多个复合层的管状构件(例如,管状主体),每个复合层具有细胞不可渗透层和能够实现血管化和细胞向内生长的细胞可渗透层。在一些实施例中,各复合层彼此间隔开以限定用于保持生物部分的贮存空间。
40.在一些实施例中,适于使用本文所描述的装置以供封装和植入的生物部分包括细胞、病毒、病毒载体、基因治疗(物)、细菌、蛋白质、多糖、抗体和其它生物活性部分。为了简单起见,在本文中生物部分被称为细胞,然而在本说明书中没有将生物部分限制为细胞或任何特定类型的细胞,并且以下描述也适用于非细胞的生物部分。在一些实施例中,各种类型的原核细胞、真核细胞、哺乳动物细胞、非哺乳动物细胞和/或干细胞可与本发明的细胞封装装置一起使用。在一些实施例中,细胞被装入微胶囊(微封装)在天然源或人工合成源的生物材料内,包括但不限于水凝胶材料。
41.在一些实施例中,细胞分泌治疗上有用的物质。在一些实施例中,这样的物质包括激素、生长因子、营养因子、神经递质、淋巴因子、抗体或为装置受体提供治疗上益处的其它细胞产物。这种治疗细胞产物的示例包括但不限于胰岛素、生长因子、白细胞介素、甲状旁腺激素、促红细胞生成素、转铁蛋白和因子viii。合适的生长因子的非限制性示例包括:血管内皮生长因子、血小板衍生生长因子、血小板活化因子、转化生长因子、骨形态发生蛋白、激活素、抑制素、成纤维细胞生长因子、粒细胞集落刺激因子、粒细胞-巨噬细胞集落刺激因子、神经胶质细胞系衍生神经营养因子、生长分化因子-9、表皮生长因子及其组合。应当理解,贯穿本公开,术语“细胞”或“多个细胞”可以分别由“生物部分”或“多个生物部分”代替。i.具有血管化内腔的治疗装置
42.用于封装细胞的治疗装置的一个实施例在图1-图5中示出。根据一个实施例,治疗装置100包括具有开口的第一端130至开口的第二端132的管状主体102(例如,管状构件)。主体102由第一可渗透复合层104和第二可渗透复合层106限定,这两个可渗透复合层沿着它们的周界110的至少一部分密封。在第一可渗透复合层104和第二可渗透复合层106之间形成用于接纳细胞的贮存部108。至少一个端口107与贮存部108流体连通并提供进入贮存
部108的路径,用以填充、冲洗或排空贮存部108。(一个或多个)端口107可定位在于主体102上的任何位置,只要它提供从治疗装置100的外部到贮存部108的路径。内腔112延伸穿过管状主体102,从而限定治疗装置100的内径id,而第一复合层104的外表面限定治疗装置100的外径od,如图1所示。内径可在约100微米至约5毫米、约150微米至约4.5毫米、约200微米至约4毫米、或约250微米至约3.5毫米的范围内。在一些实施例中,内腔112延伸穿过整个管状主体102。在一些实施例中,内腔112基本上居中地位于管状主体102内。第一复合层104、第二复合层106和定位在其间的贮存部108限定了管状主体102的壁。如下文将更详细描述的,治疗装置100的内腔112允许血管组织从内径id向内生长,使得贮存部中包含的细胞与血管组织(即,营养素源)之间的距离足以维持细胞增殖和生长。
43.如图2所描绘的,第一复合层104包括细胞可渗透层116和与细胞可渗透层116相邻布置的细胞不可渗透层118。第二复合层106包括细胞可渗透层120和细胞不可渗透层122。第一复合层104和第二复合层106的细胞可渗透层116、120分别可由相同或不同的材料形成。
44.在一些实施例中,细胞可渗透层116、120具有大到足以允许毛细血管网络137向内生长的孔径,如图2所示。在本文中,具有足够大的开口以允许血管向内生长的层可称为“细胞向内生长”层。在一些实施例中,细胞可渗透层116、120的孔径大于约5.0微米,如通过孔隙度法测量的。血管组织通过细胞可渗透层116、120两者(例如,通过面向内腔112的细胞可渗透层120和通过面向身体102周围的外部环境的细胞可渗透层116两者)的向内生长有利于营养素和生物分子通过细胞可渗透层116从患者转移到细胞不可渗透层118但不穿过细胞不可渗透层118。
45.如本文所述,各种细胞类型可以生长到治疗装置100的细胞向内生长层(即,细胞可渗透层116、120)中。生长到多孔材料中的主要细胞类型主要取决于植入部位、材料的成分和渗透性、以及任何生物因子,诸如举例来说细胞因子和/或细胞粘附分子,其可包括在材料中或通过(一种或多种)多孔材料引入。在一些实施例中,血管内皮是生长进入用于细胞封装装置中的多孔材料的主要细胞类型。如图3-图4中所描绘的,由于从患者组织进入并穿过细胞可渗透层116、120的厚度的新血管形成,促进由呈毛细血管网络137形式的完善的血管内皮细胞群形成的细胞可渗透层116、120的血管化的发生。图4描绘了图3所示的治疗装置的一部分的血管化的放大图。
46.细胞不可渗透层118、122对血管化和细胞向内生长是不可透的,因此是细胞保留层。例如,在一些实施例中,两个细胞不可渗透层118、122都具有足够小以防止血管向内生长的孔径。然而,细胞不可渗透层118、122具有足够大的孔径以允许来自患者的营养素和由细胞产生的产物从中通过。在一些实施例中,细胞不可渗透层118、122的孔径小于约5微米、小于约1微米或小于约0.5微米,如通过孔隙度法测量的。
47.在一些实施例中,外细胞可渗透层116、120和/或内细胞不可渗透层118、122可由以下形成:藻酸盐、乙酸纤维素、诸如聚乙二醇和聚丙二醇之类的聚亚烷基二醇、诸如聚乙烯醇之类的泛乙烯基聚合物、壳聚糖、诸如聚甲基丙烯酸羟乙酯之类的聚丙烯酸酯、琼脂糖、水解聚丙烯腈、聚丙烯腈共聚物、诸如聚乙烯-丙烯酸共聚物之类的聚乙烯丙烯酸酯,多孔聚四氟乙烯(ptfe)、多孔改性聚四氟乙烯聚合物、多孔四氟乙烯(tfe)共聚物、诸如多孔聚丙烯和多孔聚乙烯之类的多孔聚烯烃、多孔聚偏二氟乙烯、多孔聚酯砜(pes)、多孔聚氨
酯、多孔聚酯、多孔ppx(eppx)、多孔超高分子量聚乙烯(euhmwpe)、多孔乙烯四氟乙烯(eetfe)、多孔偏二氟乙烯(evdf)、多孔聚乳酸(eplla)及其共聚物和组合、以及单独或组合的纤维或纱线的织造物或非织造物集合或纤维基质。在一些实施例中,细胞可渗透层116、120是多孔膨胀型聚四氟乙烯膜(例如,eptfe膜)。
48.在治疗装置100仅包括细胞保留层(例如,细胞不可渗透层)且不包括细胞向内生长层(例如,细胞可渗透层)的实施例中,治疗装置100可选地可以与壳体一起使用,该壳体植入在患者体内或可以植入在患者体内,并且由允许血管组织向内生长的血管化材料制成其。在一些实施例中,在将治疗装置100插入到壳体中之前,壳体可植入到患者体内一段足以允许血管化的时间。在其它实施例中,治疗装置100和壳体可一起插入到患者体内。
49.如上所述,贮存部108形成在治疗装置100的第一复合层104和第二复合层106之间。如本文中所使用的,术语“贮存部”意在定义治疗装置100内细胞不可渗透层118和细胞不可渗透层122之间且在治疗装置100的范围内的总面积(总区域),在贮存部中(以及细胞或其它生物部分所在的位置处)发生细胞和其它生物部分的放置。在一些实施例中,贮存部108可包括用于放置细胞的多个贮存部子区段(未示出)。在一些实施例中,贮存部108包括两个或更多个贮存部子区段,它们互连以允许细胞流入和/或流过贮存部子区段。贮存部108可采用多种构造,诸如但不限于几何形状(例如,矩形、圆形、正方形、半圆形、半椭圆形、管状等的大致形式)。
50.如本文中所用的,贮存部108的“宽度”意在描述在细胞驻留的治疗装置100的长度上第一复合层104的细胞不可渗透层118和第二复合层106的细胞不可渗透层122之间的距离,如图2所示。在一些实施例中,贮存部108具有至少50微米的厚度。在一些实施例中,宽度为至少约50微米(例如,在50微米至100微米之间)、至少100微米(例如,在100至150微米之间)、或至少150微米(例如,在150微米至200微米之间)。应注意,本文所述的所有范围本质上是示例性的并且包括其间的任何和所有值。.
51.贮存部108构造成将细胞136保持在治疗装置100内,例如如图3所示。在一些实施例中,其中具有细胞136的治疗装置100构造为放置在患者的组织床中,以允许细胞136向患者提供生物治疗。
52.在一些实施例中,细胞136通过一个或多个端口107被引入治疗装置100的贮存部108,诸如图1中所示。(一个或多个)端口107可位于沿着治疗装置100的主体102的各个区域中,只要该(一个或多个)端口107延伸穿过第一复合层104至贮存部108以允许细胞136被引入到贮存部108中。在一些实施例中,细胞136以悬浮液或浆液的形式引入介质中。细胞136可以是单个细胞、细胞聚集体或细胞簇。在一些实施例中,介质可以是细胞培养物或细胞生长培养基,可选地包括所期望的营养素和/或其它生物分子。.在一些实施例中,可通过注射器实现将细胞136插入穿过(一个或多个)端口107。
53.可在将治疗装置100插入患者体内之前或之后将细胞136引入贮存部108中。例如,治疗装置100可插入到患者体内并且允许血管化,使得血管组织生长到装置100的细胞可渗透层118、122中。然后可在治疗装置100处于体内时添加细胞136。在另一实施例中,可在将治疗装置100插入到患者的组织床中之前将细胞136添加至治疗装置100的贮存部108。
54.如上所述,内腔112被细胞可渗透层120包围,这从内腔112促进了治疗装置100的血管化。此外,细胞可渗透层116促进从治疗装置100的外部的治疗装置100的血管化。因此,
血管化从内腔内和从治疗装置100的外部发生,如图2所描绘的。在一些实施例中,从自治疗装置100的内腔112和从治疗装置100外部的血管化允许贮存部108中所含细胞的体积增加,因为细胞从治疗装置100的两侧获得营养素。在一些实施例中,贮存部108的厚度能够以约0.01微米至约400微米的量扩张。在其它实施例中,贮存部108的厚度能够从约0.01微米扩张至约200微米。在其它实施例中,贮存部的厚度能够从约0.01微米成长至约300微米。在其它实施例中,贮存部的厚度能够从约0.01微米成长至约350微米。
55.在一些实施例中,治疗装置100如下所述地制造。以下描述仅是说明性的,因此形成治疗装置100的方法不限于该描述。在一些实施例中,第二复合层106通过最初围绕心轴(例如,4毫米不锈钢心轴)缠绕多孔eptfe膜的至少一层(例如,一层、两层、三层、四层等)以形成第二复合层106的细胞可渗透层120而形成。多孔膜可以是授予branca等人的美国专利第5,814,405号中描述的类型。诸如例如烙铁的局部热源用于将多孔eptfe膜的相对边缘固定到彼此,使得细胞可渗透层120采用管的形式。接着,在细胞可渗透层120上将细胞保留多孔膜的至少一层(例如一层、两层、三层、四层等)缠绕在心轴上,以形成第二复合层106的细胞不可渗透层122。细胞保留多孔膜可以是授予bacino的美国专利第5,476,589号中描述的类型。随后,局部热源用于将细胞保留多孔膜的相对的边缘固定到彼此,使得细胞不可渗透层122采用管的形式。
56.然后对心轴进行热处理(例如,放置在空气对流烘箱中),此后将其从烘箱中取出并实现对其冷却至环境温度(例如,大约20℃)。该热处理导致形成第二复合层的膜(即,形成细胞可渗透层120的(一个或多个)膜和形成细胞不可渗透层122的(一个或多个)膜)彼此粘附。与心轴的紧密接触使各膜的微观结构的变形最小化。
57.在形成第二复合层106之后,形成贮存部108。在一些实施例中,为了形成贮存部108,可将间隔件施加至第二复合层106的细胞不可渗透层122的表面。在这样的实施例中,间隔件的高度决定了贮存部108的深度。在一些实施例中,根据要容纳在其中的细胞类型来选择贮存部108的深度。
58.然后以类似于上述过程的方式,类似地通过将细胞保留多孔膜的至少一层(例如一层、两层、三层)围绕更大的心轴(例如5毫米不锈钢心轴)缠绕形成第一复合层104,以形成细胞不可渗透层118。然后在细胞不可渗透层118上将多孔膜的至少一层(例如,一层、两层、三层、四层等)缠绕在更大的心轴上,以形成第一复合层104的细胞可渗透层116。细胞不可渗透层118和细胞可渗透层116各自的相对边缘固定到彼此,并且第一复合层104如上所述被热处理。
59.一旦冷却就从心轴移除第一复合层104并放置在第二复合层106上,第二复合层106仍然定位在其心轴上,从而形成管状主体102的壁。此时,如果期望,则(一个或多个)端口107可设置成使得它们与贮存部108流体连通。然后使用热源熔融第一复合层和第二复合层的端部,从而使第一复合层104和第二复合层106的端部粘附并密封在一起。在一些实施例中,第一复合层104还通过热源粘附至定位在第二复合层106上的间隔件,从而形成治疗装置的管状主体。此时,治疗装置100可在每一端处进行修整。
60.在一个实施例中,对治疗装置100进行压力测试,以确保在第一复合层104和第二复合层106之间的治疗装置100的端部处的密封通过向(一个或多个)端口107施加压力而是牢固的。当测试完成时,将治疗装置100从心轴上剥离。所得的治疗装置100具有用于组织进
入和向内生长的内腔、具有开放孔以允许快速血管化的内表面和外表面,以及具有紧密孔以将细胞保留在其中的细胞贮存部。ii.包含具有血管化内腔的多个治疗装置的制品
61.图5-图8描绘了治疗装置200和包括多个治疗装置200的制品400。如图7所示,在一些实施例中,多个治疗装置200相互连接,使得它们沿着制品300的长度基本上彼此平行。转向图5,在一些实施例中,每个治疗装置200包括第一开口端230和第二开口端232。在一些实施例中,治疗装置200在它们的第一端230处包括连接构件260。内腔212从第一端230延伸穿过治疗装置202的管状主体205(例如,管状构件)到第二端232,使得管状主体205在两端230、232处均敞开。
62.在图5所示的一个实施例中,治疗装置200包括主体205、第一开口端230和第二开口端232。内腔212从第一开口端230延伸至第二开口端232。在一些实施例中,治疗装置200包括第一复合层204和第二复合层206,这两个复合层沿着它们的周界210的至少一部分密封。现在参考图6,在第一复合层204和第二复合层206之间形成贮存部208。第一复合层204、第二复合层206和定位在其间的贮存部208限定了治疗装置200的壁。治疗装置200的横截面可以是例如圆形、卵形或椭圆形。在一些实施例中,内腔212延伸穿过治疗装置200的整个主体205。在一些实施例中,治疗装置200的内径id由内腔212的横截面直径限定。在一些实施例中,第一复合层204的外表面限定了治疗装置200的外径od(参见图5)。如上文关于治疗装置100所述,治疗装置200的内腔212允许血管组织或毛细血管网络237从内腔212内向内生长到第二复合层206的细胞可渗透层220中。此外,第一复合层204的细胞可渗透层216促进治疗装置200的从治疗装置200的外部的血管化。因为在细胞不可渗透层216、220中形成了毛细血管网络237,所以贮存部208中所含的细胞与营养素源(即,血管组织或毛细血管网络)之间的距离最小化,从而允许贮存部208内的细胞以增加的速率生长。
63.如图6所描绘的,在一些实施例中,第一复合层204是基本上类似于第一复合层104的复合层,并且包括细胞可渗透层216和与细胞可渗透层216相邻布置的细胞不可渗透层218。类似地,在一些实施例中,第二复合层206是基本上类似于第二复合层106的复合层,并且包括细胞可渗透层220和细胞不可渗透层222。
64.在一些实施例中,细胞可渗透层216、220与细胞可渗透层116、120的基本相似之处在于它们是细胞向内生长层(例如,细胞可渗透层)并且至少具有上述关于细胞可渗透层116、120的特征。细胞可渗透层218、222与细胞可渗透层118、122的基本相似之处在于它们是细胞向内生长层(例如,细胞不可渗透层)并且至少具有上述关于细胞可渗透层118、122的特征。
65.在一些实施例中,细胞可渗透层216、220和细胞不可渗透层218、222可包括以上关于细胞可渗透层116、120和细胞不可渗透层118、122列出的任何材料。贮存部208能够以基本上相同的方式形成并且具有至少上述关于贮存部108的特征。具体地,贮存部208形成在治疗装置200的细胞不可渗透层218、222之间。贮存部208构造成将细胞236保持在制品400的(一个或多个)治疗装置200内,治疗装置放置在患者的组织床中以允许细胞向患者提供生物治疗。在一些实施例中,细胞236通过图7中所描绘的第一进入端口215和第二进入端口225被引入到治疗装置200的贮存部208中。
66.在一些实施例中,治疗装置202可以通过如下方式而是可扩展的(可按比例缩放
的),即,它们可以(例如,在物品400内的治疗装置200的直径、长度、横截面形状、数量等范围内)容易地构造为使得治疗装置200可以用于容纳具有不同形状和大小的细胞,同时确保这些细胞的存活和功能。在一些实施例中,治疗装置200的直径和长度可变化,以实现最佳性能所需的期望表面积量。管状构造设计为在宿主解剖结构内使用尽可能少的区域,但为制品400内的治疗装置200的性能提供足够的表面积。
67.此外,延伸穿过治疗装置200的内腔212减小了贮存部208中的细胞与其营养素源,即血管组织之间的距离。类似于治疗装置100的内腔112,内腔212由细胞可渗透层220在周向上环绕,这促进了治疗装置200从内腔212的血管化。此外,细胞可渗透层216促进治疗装置200的从治疗装置200的外部的血管化。因此,血管化通过从内腔212内和从治疗装置200的外部两者来发生,如图6所描绘的。在一些实施例中,从治疗装置200的内腔212和治疗装置200外部的这种血管化或毛细血管网络237的形成实现了贮存部208中所含细胞的体积翻倍或更多,因为细胞从治疗装置200的内部和外部获得营养素。
68.在本文公开的实施例中,治疗装置200的内径可在约100微米至约5毫米、从约150微米至约4.5毫米、从约200微米至约4毫米、或从约250微米至约3.5毫米的范围内。在一些使用多个治疗装置200的实施例中,各治疗装置200彼此分开约0.1微米至约3毫米、约5微米至约2.5毫米、约10微米至约2毫米、约25微米至约1.5毫米、或约50微米至约1毫米的距离。
69.在一些实施例中,诸如图7所示的实施例中,治疗装置200可相对于彼此独立运动,从而使制品400具有柔性和/或顺应组织和/或组织运动。在一些实施例中,各治疗装置200的贮存部208诸如通过连接构件260(如图7和8所描绘的)流体连接,因此,插入到一个治疗装置200中的细胞能够流入另一个分离的治疗装置200中。制品400包括至少一个填充端口275,在该实施例中,填充端口在治疗装置200的第一端处与治疗装置200流体连通。填充端口275允许将细胞插入治疗装置200的贮存部208中。制品400还可包括至少一个冲洗端口255,冲洗端口在不同的治疗装置200的第二端处与治疗装置200流体连通,如图8所描绘的。填充端口275和冲洗端口255可定位在沿着治疗装置200的长度的任何位置处,只要它们与贮存部208流体连通。在一些实施例中,治疗装置包括可用于填充和冲洗两者的单个端口(未示出)。一旦填充,治疗装置200就被密封,如下所述。
70.填充端口275和冲洗端口255可以重复地打开和利用密封件250关闭。密封件250包括但不限于盖、塞子、夹具、压缩环或阀。密封件250可利用摩擦、通过夹持或利用包括螺纹和凹槽的螺钉附连至填充端口275或冲洗端口255。取决于制品400的预期用途,填充端口275和/或冲洗端口255被密封以形成气密密封或其它流体密封。制品400旨在永久或长期(例如,至少三周)植入患者体内。iii.具有“c”形构造的治疗装置
71.图11-图12描绘了包括主体302的治疗装置300的实施例。治疗装置300与治疗装置100基本上相似,不同之处在于治疗装置300不是具有管状构造,而是基本上c形,如从图9-图10中可见的。具体地,主体302可以是围绕中心空间331大致环形或圈形的,其中开口333延伸穿过主体302的一侧。主体302由第一复合层304和第二复合层306限定,这两个复合层沿它们周界310的至少一部分密封。在第一复合层304和第二复合层306之间形成贮存部308。第一复合层304、第二复合层306和贮存部308形成主体302的壁。端口307与贮存部308流体连通并提供进入贮存部308以供填充、冲洗或排空贮存部308的路径。端口307可定位在
于主体302上的任何位置,只要它提供从治疗装置300的外部到贮存部308的路径。开口333允许从治疗装置300的主体302的外部和从中心空间331内(例如,从贮存部308的两侧)进行血管化,从而减小了包含在治疗装置300的贮存部308中的细胞与由血管组织提供的营养素之间的距离,如下文将更详细描述的。
72.如上文分别关于第一复合层104、204和第二复合层106、206所述,第一复合层304和第二复合层306都是足够多孔的,以允许来自患者的血管组织生长到细胞可渗透层的孔中。
73.如图12所描绘的,在一些实施例中,类似于治疗装置100的第一复合层104的第一复合层304包括细胞可渗透层316和与细胞可渗透层316相邻布置的细胞不可渗透层318。类似于第一治疗装置100的第二复合层106的第二复合层306包括细胞可渗透层320和与细胞可渗透层相邻定位的细胞不可渗透层322。
74.细胞可渗透层316、320与细胞可渗透层116、120的基本相似之处在于它们是细胞向内生长层并且至少具有上述关于细胞可渗透层116、120的特征。细胞不可渗透层318、322与细胞不可渗透层118、122的基本相似之处在于它们是细胞向内生长层并且至少具有上述关于细胞不可渗透层118、122的特征。
75.在一些实施例中,细胞不可渗透层318、322和细胞可渗透层316、320包含相同的材料。例如,在一些实施例中,细胞不可渗透层318、322和细胞可渗透层316、320分别包括任何上文关于细胞不可渗透层118、122和细胞可渗透层116、120分别列出的材料。
76.贮存部308以与贮存部108相同的方式形成在治疗装置300的主体302的第一复合层304和第二复合层306之间。如图12所描绘的,贮存部308构造成将细胞336保持在置于患者组织床中的治疗装置300内,以允许细胞336向患者提供生物治疗。在一些实施例中,细胞336通过一个或多个端口307被引入治疗装置300的贮存部308。在一些实施例中,(一个或多个)端口307延伸穿过治疗装置300的主体302的第一复合层304,使得细胞336可以被引入到贮存部308中。
77.如前所述,在一些实施例中,治疗装置300是大致环形的。主体302包括中心空间331和开口333,从而允许沿着治疗装置300外表面上的第一复合层304和沿着中心空间331内的第二复合层306发生血管化。因此,延治疗装置300的环形设计减小了贮存部308中的细胞336与其营养素源,即血管组织或毛细血管网络337之间的距离。此外,在一些实施例中,从治疗装置300的中心空间331内的第二复合层306和治疗装置300外表面上的第一复合层304的血管化允许贮存部308中包含的细胞336的体积增加两倍或更多,因为细胞336从治疗装置300的两侧(即,内部和外部)获得营养素。
78.在一些实施例中,治疗装置300是可堆叠的,如图11所示。如图所示,每个治疗装置300包括外表面378的第一部分380和外表面378的相对的第二部分382。在这些实施例中,至少两个治疗装置300以平行构造定位,其中第一治疗装置300的外表面378的第一部分380邻抵第二治疗装置300的外表面378的第二相对部分382,使得治疗装置300的第一端330和第二端332基本上对准。在一些实施例中,外表面的第一部分380包括开口333,而第二部分382不包括开口区段。在其它实施例中,第一部分380中的每一个包括开口333,而第二部分382包括开口337。在这样的实施例中,开口333、337基本上彼此对准,使得血管化可以从治疗装置300的外部延伸通过治疗装置300的中心空间331,从而形成血管化的治疗装置300的联
接。在另一实施例中,一个治疗装置300可具有开口333,而第二治疗装置300可具有两个开口333、337。iv.生物可吸收材料
79.在一些实施例中,治疗装置100、200、300的一个或两个复合层是生物可吸收材料或包括生物可吸收材料。生物可吸收材料可形成为固体(模制、挤出或晶体)、自粘网、凸起网或筛网。在一些实施例中,一层或多层生物可吸收材料附连于具有宏观孔隙率的非生物可吸收材料以允许细胞渗透(例如,细胞可渗透层),以形成复合材料。在其它实施例中,具有减少或防止细胞渗透的微观孔隙率的非生物可吸收材料可释放地附连于多孔自粘网,以允许在植入后的几天内从患者身上无创伤地移除治疗装置100、200、300。再吸收到患者体内可以促进有利的1型胶原沉积、新血管形成和减少感染。在一些实施例中,筛网结合到治疗装置100、200、300中,以防止一旦俘获细胞开始繁殖时装置“枕垫(pillowing)”。在其它示例中,可将生物可吸收材料作为粉末结合到细胞封装装置中。合适的生物可吸收材料的非限制性示例包括但不限于:聚乙交酯:碳酸三亚甲基酯(pga:tmc)、聚乳酸、聚乙醇酸、聚(乙交酯)、聚(丙交酯-共-己内酯)、聚(己内酯)、聚(碳酸酯)、聚(二恶烷酮)、聚(羟基丁酸酯)、聚(羟基戊酸酯)、聚(羟基丁酸酯-共-戊酸酯)及其共聚物和共混物。
80.在一些实施例中,将生物可吸收成分结合到治疗装置100、200、300中帮助促进植入。例如,在一些实施例中,生物可吸收材料可以是温度敏感的。具体地,生物可吸收材料在较冷的温度下更硬,而在较高温度(例如,一旦植入后的患者体温)下软化,使得生物可吸收材料在植入之后变得更加贴合和顺应。结果,由生物可吸收材料形成的纵向强度可允许临床医生以更少的耗费和对宿主的创伤将治疗装置100、200、300放置在患者体内,并且在植入时,生物可吸收材料变得更贴合和顺应。v.多孔层的选择性可透性
81.在一些实施例中,多孔材料仅在其厚度的一部分上是多孔的,使得多孔膜的分子量截断或筛分特性从表面开始。因此,某些溶质和/或细胞不会从一侧进入并穿过材料的多孔空间到另一侧。例如,多孔材料的选择性可透性阻止细胞迁移或生长到多孔材料的空间中,而同时允许溶质双向流动穿过多孔材料的厚度。然后,血管内皮细胞可以结合以在其上形成毛细血管。多孔材料的这种毛细血管形成或新血管形成允许增强患者组织与治疗装置100、200、300的内容物之间的流体和溶质通量。
82.在一些实施例中,多孔材料的可透性可以在本文所述的治疗装置100、200、300的多孔材料的厚度上连续变化。例如,多孔材料的选择性可透性(渗透率)可以在材料的厚度上连续变化。在一些实施例中,多孔材料的可透性从材料的一个横截面面积变化到另一个横截面面积以形成分层结构。
83.在一些实施例中,多孔材料的可透性随着多孔材料的附加层而在其厚度上变化。例如,在本文所述的一些治疗装置中,多孔材料的选择性可透性随着多孔材料的一个或多个附加层而在多孔材料的厚度上变化。多孔材料的附加层可具有与多孔材料的初始层相同的组成(成分)和可透性(渗透率),或者一个或多个附加层可具有不同的组成和/或可透性。
84.在另一实施例中,通过用水凝胶材料浸渍多孔材料的空隙空间来改变多孔材料的选择性可透性。水凝胶材料可以浸渍在多孔材料的所有或基本上所有空隙空间(例如,多孔膜的孔)中或仅在一部分空隙空间中。例如,通过在邻近和/或沿着多孔材料的内表面的多
孔材料内的连续带中用水凝胶材料浸渍多孔材料,多孔材料的选择性可透性从多孔材料的外横截面区域到多孔材料的内横截面区域发生变化。
85.浸渍到第一复合层和第二复合层的多孔材料中的水凝胶材料的组成在很大程度上取决于用于构造设备的具体多孔材料、对于给定应用场合所需的可透性程度、以及水凝胶材料的生物相容性。用于治疗装置100、200、300的可用的水凝胶材料的非限制性示例包括但不限于水解聚丙烯腈、藻酸盐、琼脂糖、角叉菜胶、胶原蛋白、明胶、聚乙烯醇、聚(甲基丙烯酸2-羟乙酯)、聚(n-乙烯基-2-吡咯烷酮)、聚乙二醇、聚乙烯亚胺、纤维蛋白-凝血酶凝胶或结冷胶及其单独或组合的共聚物。在某些方面,多孔材料(例如ptfe)/水凝胶复合材料的总厚度可以在30微米至1000微米的范围内。
86.在又一些实施例中,多孔材料的可透性可以随着多孔材料的附加层和水凝胶材料的另外的层而在多孔材料的厚度上变化。这些实施例的一个优点是这种构造将提供强大的细胞和体液免疫隔离屏障。
87.在一些实施例中,生物可吸收材料可具有在患者体内以不同水平再生活性氧基团(ros)的能力。ros已被证明促进患者体内的各种细胞反应,包括但不限于抑制或促进细胞增殖、分化、迁移、细胞凋亡和血管生成。
88.在一些实施例中,用于构造如本文所述的治疗装置100、200、300的材料本质上是不透射线的。可以例如通过用钡浸渍材料来将那些非固有不透射线的材料改性为不透射线的。用于使材料不透射线的其它可用的方法是本领域技术人员已知的。用于构造如本文所述的治疗装置100、200、300的材料的射线不透性主要用于促进治疗装置100、200、300的外科手术放置或者在植入之后将治疗装置100、200、300定位在患者体内。示例
89.本文描述了具有4毫米内径的50毫米长的治疗装置。第二复合层是通过最初将三层敞开式多孔eptfe膜围绕4毫米不锈钢心轴缠绕以形成第二复合层的细胞可渗透层而形成的。敞开式多孔膜可以是授予branca等人的美国专利第5,814,405号中描述的类型。诸如例如weller烙铁的局部热源用于将敞开式多孔膜的相对的边缘钉到彼此,使得细胞可渗透层呈管的形式。在一实施例中,膜具有敞开式结构,其模间距离(intermodal distance)大约为10至30微米。接下来,将两层细胞保留多孔膜缠绕在钢心轴上,在细胞渗透层之上,以形成第二复合层的内部多孔层。细胞保留多孔膜可以是授予bacino的美国专利第5,476,589号中描述的类型。随后,局部热源用于将细胞保留多孔膜的相对的边缘钉到彼此,使得内部多孔层呈管的形式。在该实施例中,细胞保留膜具有0.05至0.4微米范围内的孔径。
90.然后将心轴置于设定为365℃的空气对流烘箱中约15分钟,这之后将其从烘箱中取出并实现将其冷却至环境温度(例如,20℃)。这种热处理使形成第二复合层的各膜粘附在一起。与心轴的紧密接触使微观结构的变形最小化。为了形成贮存部,随后将多个间隔件施加至第二复合层的表面。在一些实施例中,间隔件是氟化乙烯丙烯(fep)的粘合剂点,其设置在细胞保留层的表面上。间隔件的高度将决定贮存部的深度,深度将会根据要容纳的细胞类型而有所不同。间隔件大约500微米高。fep的连续带也放置在内部多孔层的每一端处,用于稍后粘附第一复合层和第二复合层。在一些实施例中,各fep的带间隔开大约50mm。
91.然后,类似地通过将两层细胞保留多孔膜围绕5毫米不锈钢心轴缠绕来形成第一复合层,如上所述,以形成内部多孔层。然后将三层敞开式多孔膜缠绕同一个5毫米心轴、在
内部多孔层上,上以形成第一复合层的细胞可渗透层。内部多孔层和细胞可渗透层各自的相对的边缘钉到彼此,并且第一复合层如上所述被热处理。
92.在冷却至室温之后,将第一复合层从5毫米心轴移除并拉到第二复合层上,第二复合层仍位于4毫米心轴上,从而形成管状主体的壁。此时,(一个或多个)端口设置成使得它们与贮存部空间流体连通。然后使用局部热源在第二复合层的端部处熔融fep带。熔融的fep将流入第一复合层和第二复合层的孔中,并使第一复合层和第二复合层的端部粘附并密封在一起。还通过局部热源将第一复合层粘附至定位在第二复合层上的fep间隔件,从而形成治疗装置的管状主体。此时,治疗装置可在每一端处进行修整。
93.对治疗装置进行压力测试,以通过向(一个或多个)端口施加压力来确保密封件是可行的。当测试完成时,将治疗装置从心轴上剥离。所得的治疗装置具有用于组织进入和向内生长的4毫米内腔、带有开放孔以允许快速血管化的内表面和外表面、以及带有紧密孔以将细胞保留在其中的细胞贮存部。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1