治疗眼部病症的方法与流程
治疗眼部病症的方法
1.相关申请的交叉引用
2.本技术要求以下美国临时申请号的优先权:62/913567,2019年10月10日提交;62/935434,2019年11月14日提交;和62/971738,2020年2月7日提交,每一个都通过引用整体并入本文。
3.序列表
4.本技术与电子格式的序列表一起提交。序列表以2020年10月9日创建的名为seqlist_kdiak102wo.txt的文件提供,其大小为20,609字节。电子格式的序列表中的信息通过引用整体并入本文。
技术领域
5.本公开涉及抗体及其缀合物,以及使用和制造所述抗体、其缀合物和其他蛋白质缀合物的方法。
背景技术:
6.血管内皮生长因子(vegf)刺激血管内皮细胞生长并诱导血管通透性。这些生物活性使其在正常和病理条件下的血管生成中发挥重要作用。vegf的不当过度表达在视网膜血管疾病,例如糖尿病性视网膜病变(dr)、糖尿病性黄斑水肿(dme)、湿性年龄相关性黄斑变性(wamd)和视网膜静脉阻塞(rvo)中起着关键作用。此外,视网膜缺血性疾病患者的视网膜vegf表达增加。抑制vegf不当活性是一种治疗这些疾病的“抗血管生成”方法,并且是一种保持和改善这些视网膜血管疾病患者视敏度的有效方法。
7.目前,玻璃体内抗血管生成治疗是dme、wamd和由rvo引起的黄斑水肿的主要治疗方法。然而,根据眼部病症的不同,使用治疗性vegf-a抑制剂(例如玻璃体内阿柏西普(aflibercept)和玻璃体内雷珠单抗(ranibizumab))对这些眼部病症的标准治疗包括每月一次或每8周一次(在最初的每月负荷剂量(loading dose)后)的给药。因此,由于每月一次去视网膜专家处访视进行评估和治疗所带来的负担,现实世界的结果没有达到预期。医学上需要用更少和/或频率更低的玻璃体内注射来达到治疗结果。
技术实现要素:
8.本文提供了通过向患有眼部病症的受试者施用抗vegf抗体或抗vegf蛋白质来治疗眼部病症的方法。本公开的抗vegf抗体可以是抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物,其包括聚合物部分,当向受试者施用时,该聚合物部分延长抗体或蛋白质的半衰期(例如眼部半衰期等)。本公开的方法可提供用于眼部病症的治疗疗程,其包括与常规抗vegf疗法相比更少剂量(例如,更低频率的施用)的抗vegf抗体缀合物或抗vegf蛋白质缀合物,以实现抗vegf疗法对受试者的治疗效果。
9.本文提供了一种治疗眼部病症的方法,其中所述方法包括:以第一负荷剂量向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物
(例如,阿柏西普生物聚合物缀合物);及重复负荷剂量至少一次,但不超过两次,由此受试者在最终负荷剂量后保持抗vegf抗体缀合物(例如,ksi-301)疗法的治疗结果至少12周。任选地,所述眼部病症是糖尿病性黄斑水肿(dme)、视网膜静脉阻塞(rvo)、湿性年龄相关性黄斑变性(amd)和糖尿病性视网膜病变(dr)中的至少一种。在一些实施方案中,所述眼部病症是dme或rvo。
10.本文还提供了一种治疗视网膜静脉阻塞(rvo)的方法,其中所述方法包括:以第一负荷剂量向患有rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物);及重复负荷剂量一次;由此受试者在最终负荷剂量后保持抗vegf抗体缀合物(例如,ksi-301)疗法的治疗结果至少8周。
11.在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)疗法的治疗结果在最终负荷剂量后持续至少12、至少14(包括至少16)周。在一些实施方案中,抗vegf抗体缀合物疗法的治疗结果在最终负荷剂量后持续至少20周。
12.任选地,在最终负荷剂量的4周内不向受试者提供抗vegf抗体缀合物(例如,ksi-301)的进一步施用。在一些实施方案中,在最终负荷剂量的10周内、12周内或16周内不向受试者提供抗vegf抗体缀合物(例如,ksi-301)的进一步施用。在一些实施方案中,在最终负荷剂量的14周内不向受试者提供抗vegf抗体缀合物(例如,ksi-301)的进一步施用。在一些实施方案中,在最终负荷剂量的20周内不向受试者提供抗vegf抗体缀合物(例如,ksi-301)的进一步施用。
13.任选地,施用负荷剂量,其中每个负荷剂量之间间隔一个月。在一些实施方案中,施用负荷剂量,其中每个负荷剂量之间间隔约一到两个月。在一些实施方案中,施用负荷剂量,其中每个负荷剂量之间间隔约两个月。
14.任选地,本公开的方法包括在最终负荷剂量之后向受试者施用抗vegf抗体缀合物(例如,ksi-301)的一个或多个后续剂量。在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)的任何后续剂量的施用频率不超过每12周一次。在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)的任何后续剂量的施用频率不超过每20周一次。在一些实施方案中,抗vegf抗体缀合物的一个或多个后续剂量的施用频率平均不超过每24周一次。任选地,所述方法包括:在最终负荷剂量后的第一时间段施用抗vegf抗体缀合物(例如,ksi-301)的第一后续剂量;及在所述第一后续剂量之后的第二时间段施用第二后续剂量,其中在所述第一后续剂量与所述第二后续剂量之间不施用抗vegf抗体缀合物(例如,ksi-301),其中所述第一时间段比所述第二时间段短。在一些实施方案中,第一时间段是8周或更长。在一些实施方案中,第二时间间隔比第一时间段长至少4周。
15.任选地,以抗vegf抗体缀合物(例如,ksi-301)的形式向受试者施用约1.25mg抗体/负荷剂量。在一些实施方案中,以抗vegf抗体缀合物(例如,ksi-301)的形式向受试者施用约5mg抗体/负荷剂量。
16.在一些实施方案中,在负荷剂量后不施用剂量,直到最终负荷剂量后至少20周。
17.任选地,治疗结果包括以下中的一种或多种:与治疗前水平相比,视敏度改善、视网膜厚度降低、至少一只眼睛(例如,已施用抗vegf抗体缀合物(例如,ksi-301)的至少一只眼睛)中的灌注改善、糖尿病性视网膜病变严重程度评分(drss)改善、或眼部病症的疾病活动降低。
18.本文还提供了一种改善眼睛灌注的方法,该方法包括:确定患有dme、dr或rvo的受试者;及向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的至少2个负荷剂量;向受试者提供抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的一个或多个进一步剂量,直到受试者在至少一只眼睛中表现出改善的灌注。任选地,抗vegf抗体缀合物(例如,ksi-301)的每个负荷剂量包含至少1.25mg抗体蛋白质。任选地,在负荷剂量后不施用剂量,直到最终负荷剂量后至少20周。在一些实施方案中,在负荷剂量后不施用剂量,直到最终负荷剂量后至少24周。
19.本公开还提供了一种改善眼睛灌注的方法,该方法包括:确定患有非增殖性dr的受试者;及向受试者提供抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的初始剂量,以在至少一只眼睛中提供改善的灌注。任选地,所述方法包括在初始剂量之后向受试者提供抗vegf抗体缀合物(例如,ksi-301)的一个或多个进一步剂量。在一些实施方案中,不施用剂量,直到初始剂量后至少20周。在一些实施方案中,不向受试者施用抗vegf抗体缀合物(例如,ksi-301)的负荷剂量。任选地,抗vegf抗体缀合物(例如,ksi-301)的每个剂量包含至少1.25mg抗体蛋白质。任选地,改善的灌注至少包括至少一只眼睛中进行性非灌注速率的降低。在一些实施方案中,改善的灌注包括非灌注面积比治疗前减少至少10%。
20.本文还提供了一种治疗患有dme、dr或rvo的受试者的方法,该方法包括:向患有dme、dr或rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的1-3个负荷剂量;向受试者施用的负荷剂量不超过3个;在不早于最终负荷剂量或抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的最后一次后续应用后12周的时间点,提供抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的后续应用,其中负荷剂量以每月为基础向受试者施用。任选地,所述受试者患有增殖性dr,并且其中所述方法包括向所述受试者施用抗vegf抗体缀合物(例如,ksi-301)的3个负荷剂量。
21.本发明还提供了一种治疗患有非增殖性dr的受试者的方法,所述方法包括:向患有非增殖性dr的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的1个或2个负荷剂量;向受试者施用的负荷剂量不超过2个;和在不早于最终负荷剂量后12周的时间点提供抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的后续施用,其中负荷剂量以每月为基础向受试者施用。
22.本公开还提供了一种治疗患有rvo的受试者的方法,该方法包括:向患有rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的1个或2个负荷剂量;向受试者施用的负荷剂量不超过2个;在不早于最终负荷剂量后8周的时间点提供抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的后续施用,其中负荷剂量以每月为基础向受试者施用。
23.任选地,抗vegf抗体缀合物(例如,ksi-301)的每个负荷剂量包含至少1.25mg抗体蛋白质。
24.任选地,通过玻璃体内注射施用抗vegf抗体缀合物,例如,ksi-301。任选地,以5mg的量施用抗vegf抗体缀合物,例如,ksi-301。
25.任选地,抗vegf抗体缀合物(例如,ksi-301)包含:包含与聚合物键合的抗vegf-a免疫球蛋白g(igg)的抗体缀合物,所述聚合物包含mpc单体,其中抗vegf-a抗体重链的序列是seq id no:1,抗vegf-a抗体轻链的序列是seq id no:2,并且其中抗体在seq id no:1中的c449处与聚合物键合。在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)包含:包含轻链和重链的抗体缀合物,其中抗vegf-a抗体重链包含cdrh1:gydfthygmn(seq id no:9)、cdrh2:wintytgeptyaadfkr(seq id no:10)和cdrh3:ypyyygtshwyfdv(seq id no:11),并且抗vegf-a抗体轻链包含cdr
l
1:sasqdisnyln(seq id no:12)、cdr
l
2:ftsslhs(seq id no:13)和cdr
l
3:qqystvpwt(seq id no:14)。在一些实施方案中,抗体缀合物具有以下结构:
[0026][0027]
其中,抗vegf-a抗体的每条重链用字母h表示,并且抗vegf-a抗体的每条轻链用字母l表示;聚合物通过c443(eu编号)的巯基与抗vegf-a抗体键合,该键描绘在重链中的一条上;pc是其中曲线表示与聚合物其余部分连接的点;其中x是:a)
–
or,其中r是h、甲基、乙基、丙基、或异丙基;b)
–
h;c)任意卤素,包括
–
br、
–
cl、或
–
i;d)
–
scn,或者e)
–
ncs;并且n1、n2、n3、n4、n5、n6、n7、n8和n9相同或不同,使得n1、n2、n3、n4、n5、n6、
n6、n7、n8和n9的总和为2500
±
15%。
[0028]
本文还提供了一种治疗rvo的方法,其中所述方法包括:以1-3个负荷剂量向需要治疗rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物);及由此受试者在最终负荷剂量后保持针对rvo的抗vegf抗体缀合物(例如,ksi-301)疗法或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)疗法的治疗结果至少8周和/或保持至少8周的一个或多个后续给药间隔。任选地,受试者接受抗vegf抗体缀合物(例如,ksi-301)再治疗的频率不超过每10周一次。任选地,受试者接受抗vegf抗体缀合物(例如,ksi-301)再治疗的频率不超过每12周一次。
[0029]
本公开还提供了一种眼部病症的疾病改善的方法,其中所述方法包括:以第一负荷剂量向患有眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),由此以对受试者有益的方式改善眼部病症。
[0030]
本文还提供了一种治疗眼部病症的方法,所述方法包括:确定患有dme、dr或rvo的受试者;及向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的1-6个负荷剂量;在自最终负荷剂量起的第一时间量后,向受试者提供抗vegf抗体缀合物或抗vegf蛋白质缀合物的第一再治疗剂量;及在自抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的第一再治疗剂量起的第二时间量后,向受试者提供抗vegf抗体缀合物(例如,ksi-301或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的第二再治疗剂量,其中第二时间量等于或大于第一时间量。任选地,所述方法包括向受试者施用抗vegf抗体缀合物的1-3个负荷剂量。可选地,第二时间量比第一时间量多至少1周。在一些实施方案中,第二时间量比第一时间量多至少2周。在一些实施方案中,第二时间量比第一时间量多至少4周。
[0031]
本文还提供了一种治疗眼部病症的方法,包括:以第一负荷剂量向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症是糖尿病性黄斑水肿(dme);及重复负荷剂量至少一次,但不超过两次,由此受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果至少8周。任选地,所述方法还包括:在最终负荷剂量之后向受试者施用抗vegf抗体缀合物的一个或多个后续剂量。在一些实施方案中,所述方法包括:以q8w或更长的给药方案施用抗vegf抗体缀合物的一个或多个后续剂量。在一些实施方案中,给药方案在q8w和q24w之间。在一些实施方案中,在第一负荷剂量之后的至少约一年内,不向受试者施用抗vegf抗体缀合物的后续剂量。
[0032]
本文还提供了一种治疗眼部病症的方法,包括:以第一负荷剂量向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症是湿性年龄相关性黄斑变性(wamd);及重复负荷剂量至少一次,但不超过两次,由此受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果至少12周。任选地,所述方法还包括:在最终负荷剂量之后以q12w或更长的给药方案向受试者施用抗vegf抗体缀合物的一个或多个后续剂量。任选地,给药方案在q12w和q20w之间。在一些实施方案中,在第一负荷剂量的约一年内,向受试者施用不超过一个抗vegf抗体缀合物的后续剂量。
[0033]
本文还提供了一种治疗眼部病症的方法,包括:以第一负荷剂量向需要治疗眼部
病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症是视网膜静脉阻塞(rvo);及重复负荷剂量至少一次,但不超过两次,由此受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果至少8周。在一些实施方案中,所述方法还包括:在最终负荷剂量之后向受试者施用抗vegf抗体缀合物的一个或多个后续剂量。任选地,所述方法包括:以q8w或更长的给药方案施用抗vegf抗体缀合物的一个或多个后续剂量。
[0034]
本文提供了一种治疗眼部病症的方法,包括:以q12w或更长的给药方案向需要治疗眼部病症的受试者施用治疗有效量的抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症为糖尿病性视网膜病变(dr),从而治疗所述眼部病症。在一些实施方案中,给药方案在q12w和q24w之间。在一些实施方案中,所述方法还包括向受试者施用不超过两个抗vegf抗体缀合物的负荷剂量。任选地,任何两个连续负荷剂量之间的时间为约8周。
[0035]
还提供了一种治疗眼部病症的方法,包括以以下给药方案向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的多个剂量中的第一个剂量,所述给药方案包括:负荷给药方案,其包括抗vegf抗体缀合物或抗vegf蛋白质缀合物的1-3个负荷剂量,其中所述第一剂量是负荷剂量;然后是维持给药方案,其包括在最终负荷剂量之后的抗vegf抗体缀合物或抗vegf蛋白质缀合物的一个或多个后续剂量,其中所述维持给药方案包括q8w或更长的预定给药方案。任选地,所述方法还包括:在第一剂量后的一个或多个时间点评估抗vegf抗体缀合物疗法在受试者中的治疗结果;和在预定给药方案规定的后续时间点,向受试者施用抗vegf抗体缀合物的后续剂量,除非受试者保持了治疗结果,在这种情况下,延长时间间隔直至施用后续剂量。在一些实施方案中,所述眼部病症是wamd,并且预定给药方案为q12w或更长。在一些实施方案中,眼部病症是dme、dr或rvo。
[0036]
本文还提供了一种治疗眼部病症的方法,包括:确定需要治疗眼部病症的受试者,其中所述眼部病症被推定为眼组织胞浆菌病综合征;和向受试者玻璃体内施用治疗有效量的抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),从而治疗眼部病症。任选地,治疗有效量包含约1mg至约5mg的抗vegf抗体缀合物。
[0037]
附图的简要说明
[0038]
图1是显示了ksi-301在体内的延长半衰期的图。
[0039]
图2是显示了ksi-301的体内视网膜生物利用度的图。
[0040]
图3是显示了静脉内施用的ksi-301的快速全身清除的图。
[0041]
图4是显示了根据本公开的一些实施方案,在患有糖尿病性黄斑水肿(dme)的患者中单次玻璃体内施用ksi-301的治疗效果的图。
[0042]
图5是表示根据本公开的一些实施方案,在年龄相关性黄斑变性(wamd)、糖尿病性黄斑水肿(dme)和视网膜静脉阻塞(rvo)中的ksi-301玻璃体内施用方案的示意图。
[0043]
图6是显示了根据本公开的一些实施方案,在对患有湿性年龄相关性黄斑变性(wamd)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0044]
图7是显示了根据本公开的一些实施方案,由接受wamd治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。4%(1/25)在3个月内接受再治疗;5%(1/20)在3
个月时接受再治疗;90%(19/21)在最终负荷剂量后超过3个月;且80%(11/14)达到4个月或更长时间,直到第一次再治疗。
[0045]
图8是显示了根据本公开的一些实施方案,在对患有糖尿病性黄斑水肿(dme)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0046]
图9是显示了根据本公开的一些实施方案,由接受dme治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0047]
图10是显示了根据本公开的一些实施方案,在对患有视网膜静脉阻塞(rvo)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0048]
图11是显示了根据本公开的一些实施方案,由接受rvo治疗的个体患者接收的ksi-301的玻璃体内施用的方案的图。
[0049]
图12是显示了根据本公开的一些实施方案,对患有wamd(左栏)、dme(中间栏)和rvo(右栏)的患者玻璃体内施用ksi-301的负荷剂量后,视网膜健康持续改善的图像集合。
[0050]
图13是根据本公开的一些实施方案的ksi-301的结构示意图,其中抗vegf-a抗体的每条重链用字母h表示,且抗vegf-a抗体的每条轻链用字母l表示;聚合物通过根据eu编号的c443上的巯基与抗vegf-a抗体键合,该键描绘在上述重链中的一条上;pc是其中曲线表示与聚合物其余部分连接的点;且n1、n2、n3、n4、n5、n6、n7、n8和n9相同或不同,使得n1、n2、n3、n4、n5、n6、n6、n7、n8和n9的总和为2500
±
15%。
[0051]
图14描绘了根据本公开的一些实施方案的ksi-301的重链和轻链的氨基酸序列。
[0052]
图15是一组多种抗体的氨基酸序列。
[0053]
图16是显示了具有不同水平的糖尿病性视网膜病变严重程度的患者的比例的图,用标准化的摄影读数标度来衡量。
[0054]
图17a和17b显示了ksi-301在湿性amd中的功效以及对脉络膜新生血管的直接影响。图17a显示了ksi-301在湿性amd中的功效,以及在中位数bcva和oct cst方面从基线到周的变化。
[0055]
图18a-18d显示了在3个负荷剂量后具有疾病改善的dme患者中的结果,其中显著的drss改善和再灌注代表疾病改善。
[0056]
图19显示了rvo患者的结果,在3个负荷剂量之后,至少5个月不需要额外的剂量,代表可能的疾病改善。
[0057]
图20展示了患者的一组oct图像,其显示3个负荷剂量的效果持续8周,直到疾病复发并且患者接受再治疗。
[0058]
图21a-21c描绘了单剂量生物活性研究的结果。
[0059]
图22是显示了根据本公开的一些实施方案,由接受wamd治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0060]
图23是显示了根据本公开的一些实施方案,在对患有湿性年龄相关性黄斑变性(wamd)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0061]
图24是显示了根据本公开的一些实施方案,在对患有湿性年龄相关性黄斑变性(wamd)但不具有高色素上皮脱离的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的
持续治疗效果的一组图。
[0062]
图25是显示了根据本公开的一些实施方案,在对患有湿性年龄相关性黄斑变性(wamd)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0063]
图26是显示了根据本公开的一些实施方案,在对患有湿性年龄相关性黄斑变性(wamd)但不具有高色素上皮脱离的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0064]
图27是显示了根据本公开的一些实施方案,由接受dme治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0065]
图28是显示了根据本公开的一些实施方案,在对患有糖尿病性黄斑水肿(dme)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0066]
图29是显示了根据本公开的一些实施方案,在对患有糖尿病性黄斑水肿(dme)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0067]
图30是显示了根据本公开的一些实施方案,由接受rvo治疗的个体患者接收的ksi-301的玻璃体内施用的方案的图。
[0068]
图31是显示了根据本公开的一些实施方案,在对患有视网膜静脉阻塞(rvo)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0069]
图32是显示了根据本公开的一些实施方案,在对患有视网膜静脉阻塞(rvo)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0070]
图33是表示根据本公开的一些实施方案,在年龄相关性黄斑变性(wamd)、糖尿病性黄斑水肿(dme)和视网膜静脉阻塞(rvo)中的抗体结合构建体a玻璃体内施用方案的示意图。
[0071]
图34是显示了根据本公开的一些实施方案,由接受wamd治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0072]
图35是显示了根据本公开的一些实施方案,在对患有wamd的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0073]
图36是显示了根据本公开的一些实施方案,由接受dme治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0074]
图37是显示了根据本公开的一些实施方案,在对患有dme的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0075]
图38是显示了根据本公开的一些实施方案,由接受rvo治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0076]
图39是显示了根据本公开的一些实施方案,在对患有视网膜静脉阻塞(rvo)的患者玻璃体内施用ksi-301的负荷剂量之后,ksi-301的持续治疗效果的一组图。
[0077]
图40是表示根据本公开的一些实施方案,在首次接受治疗(treatment)的wamd患者中进行ksi-301治疗以及与照护标准(standard of care)治疗进行比较的2期研究设计的示意图。
[0078]
图41a和41b是显示了根据本公开的一些实施方案,基于来自1b期研究但应用2期再治疗标准的患者的数据,假设的治疗方案和保持q20w给药的概率的图表的集合。
[0079]
图42是描绘了本公开的方法的实施方案的流程图。
[0080]
图43是表示根据本公开的一些实施方案,在年龄相关性黄斑变性(wamd)、糖尿病性黄斑水肿(dme)和视网膜静脉阻塞(rvo)中的ksi-301玻璃体内施用方案的示意图。
[0081]
图44是显示了根据本公开的一些实施方案,向患有湿性年龄相关性黄斑变性(wamd)的患者施用的ksi-301的持续治疗效果的一组图。
[0082]
图45a是显示了根据本公开的一些实施方案,由接受wamd治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0083]
图45b是总结了图45a所示的wamd患者中ksi-301的施用间隔的表。
[0084]
图46是根据本公开的一些实施方案,用ksi-301治疗的wamd患者的oct图像的集合。
[0085]
图47是显示了根据本公开的一些实施方案,在wamd中ksi-301相对于照护标准治疗的基准的图。
[0086]
图48是显示了根据本公开的一些实施方案,在wamd中ksi-301相对于照护标准治疗的基准的图。
[0087]
图49是显示了根据本公开的一些实施方案,向患有糖尿病性黄斑水肿(dme)的患者施用的ksi-301的持续治疗效果的一组图。
[0088]
图50a是显示了根据本公开的一些实施方案,由接受dme治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0089]
图50b是总结了图50a所示的dme患者中ksi-301的施用间隔的表。
[0090]
图51是根据本公开的实施方案,用ksi-301治疗的dme患者的oct图像的集合。
[0091]
图52是根据本公开的一些实施方案,用ksi-301治疗的dme患者的oct图像的集合。
[0092]
图53是显示了根据本公开的一些实施方案,向患有视网膜静脉阻塞(rvo)的患者施用的ksi-301的持续治疗效果的一组图。
[0093]
图54a是显示了根据本公开的一些实施方案,由接受rvo治疗的个体患者接收的ksi-301的玻璃体内施用的方案的一组图。
[0094]
图54b是总结了图54a所示的rvo患者中ksi-301的施用间隔的表。
[0095]
图55是显示了根据本公开的一些实施方案,在rvo中ksi-301相对于照护标准治疗的基准的图。
[0096]
图56是根据本公开的一些实施方案,用ksi-301治疗的crvo患者的oct图像的集合。
[0097]
图57是表示根据本公开的一些实施方案,在年龄相关性黄斑变性(wamd)中的抗vegf抗体缀合物玻璃体内施用方案的示意图。
[0098]
图58是表示根据本公开的一些实施方案,在糖尿病性黄斑水肿(dme)中的抗vegf抗体缀合物玻璃体内施用方案的示意图。
[0099]
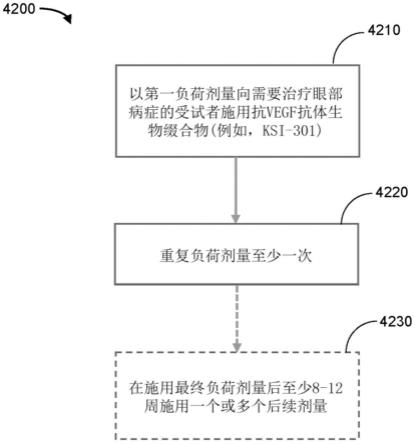
图59是表示根据本公开的一些实施方案,在视网膜静脉阻塞(rvo)中的抗vegf抗体缀合物玻璃体内施用方案的示意图。
具体实施方式
[0100]
本文提供了通过向患有眼部病症的受试者施用抗vegf抗体来治疗眼部病症的方法。本公开的抗vegf抗体可以是抗vegf抗体缀合物(例如,ksi-301),其包括聚合物部分,当
向受试者施用时,该聚合物部分延长抗体的半衰期。与不含聚合物部分的抗体相比,抗体缀合物在施用后可保持治疗功效更长的时间。因此,本公开的方法可提供用于眼部病症的治疗疗程,其包括与常规抗vegf抗体疗法相比更少剂量(例如,更低频率的施用)的抗vegf抗体缀合物,以实现抗vegf疗法对受试者的治疗效果。本发明方法可鼓励患者更好地依从治疗疗程,特别是当眼部病症治疗涉及治疗剂的玻璃体内施用时。
[0101]
定义
[0102]“新生血管性病症”是以改变的、失调的或未经调节的血管生成为特征的病症或疾病状态。新生血管性病症的实例包括致瘤性转化(例如癌症)和包括糖尿病性视网膜病变和年龄相关性黄斑变性在内的眼部新生血管性病症。
[0103]“眼部新生血管性”病症是以患者眼中改变的、失调的或未经调节的血管生成为特征的病症。这些病症包括视神经盘新生血管、虹膜新生血管、视网膜新生血管、脉络膜新生血管、角膜新生血管、玻璃体新生血管、青光眼、血管翳、翼状胬肉、黄斑水肿、糖尿病性视网膜病变、糖尿病性黄斑水肿、血管性视网膜病变、视网膜变性、葡萄膜炎、视网膜炎性疾病和增生性玻璃体视网膜病变。
[0104]
术语抗体包括完整抗体及其结合片段。结合片段是指不同于完整抗体的包含完整抗体的一部分的分子,其与完整抗体所结合的抗原相结合。结合片段的实例包括fv、fab'、fab'-sh、f(ab')2;双抗体;线性抗体;单链抗体分子(例如scfv);和由抗体片段形成的多特异性抗体。在houston js.1991.methods in enzymol.203:46-96中描述了scfv抗体。另外,抗体片段包括具有vh结构域特征(即能够与vl结构域一起组装到功能性抗原结合位点,从而提供全长抗体的抗原结合性质)或vl结构域特征(即能够与vh结构域一起组装到功能性抗原结合位点,从而提供全长抗体的抗原结合性质)的单链多肽。
[0105]
抗体与其靶抗原的特异性结合是指至少106、107、108、109、或10
10
m-1
的亲和力。特异性结合在更高量级上可以被检测到,并可区别于与至少一个不相关靶标的非特异性结合。特异性结合可以是特定官能团之间成键的结果或特定空间配合(例如,锁和钥匙类型)的结果,而非特异性结合通常是范德华力的结果。然而,特异性结合不一定意味着抗体或融合蛋白质结合一个且仅结合一个靶标。
[0106]
基本抗体结构单元是亚单元的四聚体。每个四聚体包括相同的两对多肽链,每对具有一个“轻”链(约25kda)和一个“重”链(约50-70kda)。每条链的氨基末端部分包括主要负责抗原识别的约100至110个或更多个氨基酸的可变区。该可变区最初表达为与可切割的信号肽连接。没有信号肽的可变区有时被称为成熟可变区。因此,例如,轻链成熟可变区是指没有轻链信号肽的轻链可变区。然而,提到可变区并不意味着信号序列必然存在;事实上一旦抗体或融合蛋白质被表达和分泌,信号序列就被切割。一对重链可变区和轻链可变区限定抗体的结合区。轻链和重链的羧基末端部分分别限定轻链恒定区和重链恒定区。重链恒定区主要负责效应子功能。在igg抗体中,重链恒定区分为ch1区、铰链区、ch2区和ch3区。ch1区通过二硫键和非共价键与轻链恒定区结合。铰链区在抗体的结合区和效应子区之间提供柔性,并且还提供四聚体亚单元中两个重链恒定区之间的分子间二硫键形成位点。ch2区和ch3区是效应子功能和fcr结合的主要位点。
[0107]
轻链分为κ或λ。重链分为γ、μ、α、δ或ε,并分别将抗体的同种型定义为igg、igm、iga、igd和ige。在轻链和重链内,可变区和恒定区通过约12个或更多个氨基酸的“j”区段连
接,重链还包括约10个或更多个氨基酸的“d”区段。(通常参见fundamental immunology(paul,w.,ed.,2nd ed.raven press,n.y.,1989),ch.7)(出于所有目的,通过引用将其全部内容并入本文)。
[0108]
每个轻链/重链对的成熟可变区形成抗体结合位点。因此,完整抗体具有两个结合位点,即是二价的。在天然抗体中,两个结合位点是相同的。然而,可以制备其中两个结合位点不同的双特异性抗体(参见,例如,songsivilai s,lachmann pc.1990.bispecific antibody:a tool for diagnosis and treatment of disease.clin exp immunol.79:315-321;kostelny sa,cole ms,tso jy.1992.formation of bispecific antibody by the use of leucine zippers.j immunol.148:1547-1553)。可变区均显示通过三个高变区(也称为互补决定区或cdr)连接的相对保守的框架区(fr)的相同基本结构。每对的两条链的cdr通过框架区对齐,使得能够结合特定表位。从n末端到c末端,轻链和重链都包含fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4结构域。为了方便起见,可变重链cdr可以称为cdrh1、cdrh2和cdrh3;可变轻链cdr可以称为cdr
l
1、cdr
l
2和cdr
l
3。每个结构域的氨基酸分配与以下的定义一致:kabat ea,et al.1987和1991.sequences of proteins of immunological interest(national institutes of health,bethesda,md)或chothia c,lesk am.1987.canonical structures for the hypervariable regions of immunoglobulins.j mol biol 196:901-917;chothia c,et al.1989.conformations of immunoglobulin hypervariable regions.nature 342:877-883。kabat还提供了广泛使用的编号惯例(kabat编号),其中不同重链可变区之间或不同轻链可变区之间的相应残基被指定相同的编号。尽管kabat编号可以用于抗体恒定区,但是eu编号更常用,如本技术中的情况一样。尽管提供了本文公开的示例性抗体的具体序列,但应当理解,在蛋白质链表达后,轻链和/或重链的氨基末端或羧基末端的一个至数个氨基酸,特别是重链c末端的赖氨酸残基,在一定比例的分子或所有分子中可能缺失或衍生化。
[0109]
术语“表位”是指抗体或细胞外捕获区段结合的抗原上的位点。蛋白质上的表位可以由连续氨基酸或通过一个或多个蛋白质的三级折叠而并置的非连续氨基酸形成。由连续氨基酸形成的表位(也称为线性表位)在暴露于变性溶剂后通常保留,而由三级折叠形成的表位(也称为构象表位)在用变性溶剂处理后通常丢失。表位通常包括至少3个,更通常地,至少5个或8-10个呈独特空间构象的氨基酸。确定表位的空间构象的方法包括例如x射线晶体学和2维核磁共振(参见,例如,epitope mapping protocols,in methods in molecular biology,vol.66,glenn e.morris,ed.(1996))。
[0110]
识别相同或重叠的表位的抗体可以在简单的免疫测定中鉴定,该免疫测定显示一种抗体与另一种抗体竞争结合靶抗原的能力。抗体的表位也可以通过与其抗原结合的抗体(或fab片段)的x射线晶体学来定义以鉴定接触残基。
[0111]
或者,如果抗原中降低或消除一种抗体的结合的所有氨基酸突变都降低或消除另一种抗体的结合,则两种抗体具有相同的表位。如果降低或消除一种抗体的结合的一些氨基酸突变降低或消除另一种抗体的结合,则两个抗体具有重叠的表位。
[0112]
抗体之间的竞争通过试验来测定,其中受测试的抗体抑制参考抗体与共同抗原的特异性结合(参见例如,junghans et al.,cancer res.50:1495,1990)。如果过量的测试抗体(例如,至少2x、5x、10x、20x或l00x)抑制至少50%的参考抗体的结合,则测试抗体与参考
抗体竞争。在一些实施方案中,如在竞争性结合测定中所测量的,测试抗体抑制75%、90%或99%的参考抗体的结合。通过竞争性测定鉴定的抗体(竞争性抗体)包括结合与参考抗体相同的表位的抗体和结合与参考抗体所结合的表位足够接近的相邻表位从而产生空间位阻的抗体。
[0113]
术语“患者”包括接受预防性或治疗性治疗的人和其他哺乳动物受试者。
[0114]
为了将氨基酸取代分类为保守的或非保守的,将氨基酸做如下分组:第i组(疏水侧链):met、ala、val、leu、ile;第ii组(中性亲水侧链):cys、ser、thr;第iii组(酸性侧链):asp、glu;第iv组(碱性侧链):asn、gin、his、lys、arg;第v组(影响链取向的残基):gly、pro;和第vi组(芳族侧链):trp、tyr、phe。保守取代涉及在同一种类的氨基酸之间的取代。将这些种类中一个种类的成员交换为另一个的成员构成非保守取代。
[0115]
通过kabat编号惯例(用于可变区)或通过eu编号(用于恒定区)对抗体序列进行最大化比对来确定序列同一性百分比。在比对之后,如果将主题抗体区域(例如重链或轻链的整个成熟可变区)与参考抗体的相同区域进行比较,则主题抗体区域和参考抗体区域之间的序列同一性百分比为主题抗体区域和参考抗体区域中相同氨基酸占据的位置数除以两个区域的比对位置的总数,并乘以100以转换为百分比,其中未计数空位(gap)。其它序列的序列同一性可以通过使用算法(如wisconsin genetics software package release 7.0,genetics computer group,575science dr.,madison,wi(威斯康星州麦迪逊市575科学博士,遗传计算机组,威斯康星遗传学软件包发布7.0)中的bestfit、fasta和tfasta)、使用默认空位参数比对序列,或通过检查和最佳比对(即,在比较窗口中产生最高序列相似性百分比)来确定。序列同一性百分比是通过以下步骤计算的:在比较窗口上比较两个最佳比对的序列,确定在两个序列中出现相同残基的位置数以得到匹配位置数,将匹配位置数除以比较窗口中的总的位置数(即窗口尺寸),并将结果乘以100以得到序列同一性百分比。
[0116]“包含”一个或多个所记载的要素的组合物或方法可以包括未具体记载的其他要素。例如,包含抗体的组合物可以包含单独的抗体或与其他成分组合的抗体。
[0117]
术语“抗体依赖性细胞毒性”或adcc是诱导细胞死亡的机制,其取决于包覆有抗体的靶细胞(即,具有结合的抗体的细胞)与具有细胞溶解活性的免疫细胞(也称为效应细胞)的相互作用。这种效应细胞包括自然杀伤细胞、单核细胞/巨噬细胞和嗜中性粒细胞。adcc由与细胞结合的抗体的fc区与免疫效应细胞(例如嗜中性粒细胞、巨噬细胞和自然杀伤细胞)上的fcy受体(特别是fcγri和fcγriii)之间的相互作用触发。根据介导的效应细胞类型,通过吞噬作用或细胞溶解来消除靶细胞。包覆有抗体的靶细胞的死亡是效应细胞活性的结果。
[0118]
术语调理作用(opsonization)也称为“抗体依赖性细胞吞噬作用”或adcp,是指包覆有抗体的细胞被与免疫球蛋白fc区结合的吞噬性免疫细胞(例如,巨噬细胞、嗜中性粒细胞和树突细胞)完全或部分内化的过程。
[0119]
术语“补体依赖性细胞毒性”或cdc是指诱导细胞死亡的机制,其中靶结合抗体的fc效应结构域激活一系列酶促反应,最终在靶细胞膜中形成孔。通常,抗原-抗体复合物(例如包覆有抗体的靶细胞上的抗原-抗体复合物)结合并激活补体成分clq,补体成分clq转而激活导致靶细胞死亡的补体级联反应。补体的激活也可导致补体成分沉积在靶细胞表面上,通过结合白细胞上的补体受体(例如cr3)来促进adcc。
[0120]
人源化抗体是基因工程抗体,其中将来自非人“供体”抗体的cdr移植到人“受体”抗体序列中(参见例如,queen,us 5,530,101和5,585,089;winter,us 5,225,539,carter,us 6,407,213,adair,us 5,859,205 6,881,557,foote,us 6,881,557)。受体抗体序列可以是例如成熟人抗体序列、这些序列的复合物、人抗体序列的共有序列或胚系区(germline region)序列。因此,人源化抗体是其中一些或全部cdr完全或基本上来自供体抗体而可变区框架序列和恒定区(如果存在)完全或基本上来自人抗体序列的抗体。类似地,人源化重链的至少一个、两个、通常全部三个cdr完全或基本上来自供体抗体重链,重链可变区框架序列和重链恒定区(如果存在)基本上来自人重链可变区框架序列和恒定区序列。类似地,人源化轻链的至少一个、两个、通常全部三个cdr完全或基本上来自供体抗体轻链,轻链可变区框架序列和轻链恒定区(如果存在)基本上来自人轻链可变区框架序列和恒定区序列。不同于纳米抗体和dab,人源化抗体包含人源化重链和人源化轻链。当各cdr之间至少85%、90%、95%或100%的相应残基(如kabat所定义的)相同时,人源化抗体中的cdr基本上来自非人抗体中的相应cdr。当至少85%、90%、95%或100%的由kabat定义的相应残基相同时,抗体链的可变区框架序列或抗体链的恒定区基本上分别来自人可变区框架序列或人恒定区。
[0121]
尽管人源化抗体通常整合了来自小鼠抗体的所有六个cdr(可以是按照kabat定义的),但它们也可由少于所有cdr(例如,来自小鼠抗体的至少3、4或5个cdr)制成(例如,de pascalis r,iwahashi m,tamura m,et al.2002.grafting“abbreviated”complementary-determining regions containing specificity-determining residues essential for ligand contact to engineer a less immunogenic humanized monoclonal antibody.j immunol.169:3076-3084;vajdos ff,adams cw,breece tn,presta lg,de vos am,sidhu,ss.2002.comprehensive functional maps of the antigen-binding site of an anti-erbb2 antibody obtained with shotgun scanning mutagenesis.j mol biol.320:415
–
428;iwahashi m,milenic de,padlan ea,et al.1999.cdr substitutions of a humanized monoclonal antibody(cc49):contributions of individual cdrs to antigen binding and immunogenicity.mol immunol.36:1079-1091;tamura m,milenic de,iwahashi m,et al.2000.structural correlates of an anticarcinoma antibody:identification of specificity-determining regions(sdrs)and development of a minimally immunogenic antibody variant by retention of sdrs only.j immunol.164:1432-1441)。
[0122]
嵌合抗体是其中非人抗体(例如小鼠)的轻链和重链的成熟可变区与人轻链恒定区和重链恒定区组合的抗体。这样的抗体基本上或完全保留小鼠抗体的结合特异性,并且为约三分之二的人序列。
[0123]
镶嵌抗体(veneered antibody)是一类人源化抗体,其保留非人抗体的一些但通常是所有的cdr和非人抗体的一些非人可变区框架残基,但将可能构成b细胞表位或t细胞表位的其他可变区框架残基例如暴露的残基(padlan ea.1991.a possible procedure for reducing the immunogenicity of antibody variable domains while preserving their ligand-binding properties.mol immunol.28:489-98)替换为来自人抗体序列相应位置的残基。结果得到这样的抗体:其中cdr完全或基本上来自非人抗体,且通过取代使
非人抗体的可变区框架与人更加相似。人抗体可以从人中分离,或者由人免疫球蛋白基因的表达(例如,在转基因小鼠中、体外或通过噬菌体展示)产生。产生人抗体的方法包括以下的三源杂交瘤(trioma)方法:l,pursch e.1983.human x(mouse x human)hybridomas stably producing human antibodies.hybridoma 2:361-367;美国专利号4,634,664;和engleman等人,美国专利4,634,666,其使用包含人免疫球蛋白基因的转基因小鼠(参见,例如,lonberg et al.,w093/12227(1993);us 5,877,397,us 5,874,299,us 5,814,318,us 5,789,650,us 5,770,429,us 5,661,016,us 5,633,425,us 5,625,126,us 5,569,825,us 5,545,806,nature 148,1547-1553(1994),nature biotechnology 14,826(1996),kucherlapati,wo 91/10741(1991));和噬菌体展示方法(参见,例如,dower等人,wo 91/17271和mccafferty等人,wo 92/01047,us 5,877,218,us 5,871,907,us 5,858,657,us 5,837,242,us 5,733,743和us 5,565,332)。
[0124]“聚合物”是指连接在一起的一系列单体基团。聚合物由多个单元的单一单体(均聚物)或不同单体(杂聚物)组成。高分子量聚合物由包括但不限于丙烯酸酯、甲基丙烯酸酯、丙烯酰胺、甲基丙烯酰胺、苯乙烯、乙烯基吡啶、乙烯基吡咯烷酮和乙烯基酯(如乙酸乙烯酯)的单体制备。另外的单体可用于高分子量聚合物。当使用两种不同的单体时,这两种单体被称为“共聚单体”,这意味着不同的单体共聚合形成单一聚合物。聚合物可以是线性的或支化的。当聚合物是支化的时,每条聚合物链被称为“聚合物臂”。与引发剂部分连接的聚合物臂的末端为近端,聚合物臂的增长链端为远端。在聚合物臂的增长链端上,聚合物臂端基团可以为自由基清除剂或另一基团。
[0125]“引发剂”是指能够引发单体或共聚单体聚合的化合物。聚合可以是常规的自由基聚合或可控/“活性”自由基聚合,例如原子转移自由基聚合(atrp)、可逆加成-断裂-终止(raft)聚合或氮氧自由基调控聚合(nmp)。聚合可以是“假”可控聚合,例如退化转移。当引发剂适用于atrp时,其包含不稳定键,该不稳定键可以被均裂以形成引发剂片段i(能够引发自由基聚合的基团),以及自由基清除剂i’,其与聚合物增长链的自由基反应以可逆地终止聚合。自由基清除剂i’通常是卤素,但也可以是有机部分,例如腈。在一些实施方案中,引发剂含有一个或多个2-溴异丁酸酯基团作为atrp聚合的位点。
[0126]“化学接头”是指将两个基团(例如半衰期延长部分与蛋白质)连接在一起的化学部分。接头可以是可裂解的或不可裂解的。可裂解接头可以是可水解的、可酶解的、ph敏感的、光不稳定的或二硫化物接头等。其它接头包括同型双功能接头和异型双功能接头。“连接基团”是能够形成由一个或多个与生物活性剂连接的键组成的共价连接的官能团。非限制性实例包括wo2013059137的表1中所示的那些(通过引用并入本文)。
[0127]
术语“反应性基团”是指在合适的反应条件下能够与另一化学基团反应以形成共价键(即,共价反应性)的基团,并且通常表示与另一种物质的连接点。反应性基团为诸如马来酰亚胺或琥珀酰亚胺酯的部分,它能够与不同部分上的官能团进行化学反应以形成共价键。反应性基团通常包括亲核体、亲电体和可光活化基团。
[0128]“磷酸胆碱”,也表示为“pc”,是指以下结构:
[0129][0130]
其中*表示连接点。磷酸胆碱是两性离子基团,并且包括盐(如内盐)及其质子化和脱质子化形式。
[0131]“含磷酸胆碱的聚合物”是含有磷酸胆碱的聚合物。“含两性离子的聚合物”是指含有两性离子的聚合物。
[0132]
含有聚(丙烯酰氧基乙基磷酸胆碱)的聚合物是指含有2-(丙烯酰氧基)乙基-2-(三甲基铵)乙基磷酸酯(hea-pc,示于下面实施例6中)作为单体的聚合物。
[0133]
含有聚(甲基丙烯酰氧基乙基磷酸胆碱)的聚合物是指含有2-(甲基丙烯酰氧基)乙基-2-(三甲基铵)乙基磷酸酯(hema-pc或mpc)作为单体的聚合物(见下文):
[0134][0135]
如本文所用,“mpc”和“hema-pc”是可互换的。
[0136]
在聚合物的上下文中,“分子量”可以表示为数均分子量或重均分子量或峰位分子量。除非另有说明,本文中所有提及的分子量是指峰位分子量。这些分子量测定,即数均分子量(mn)、重均分子量(mw)和峰位分子量(mp)的测定,可以使用尺寸排阻色谱或其它液相色谱技术测量。也可以使用测量分子量值的其它方法,例如使用端基分析或测量依数性(例如凝固点降低、沸点升高或渗透压)以确定数均分子量,或使用光散射技术、超速离心或粘度测定法来确定重均分子量。在一些实施方案中,通过sec-mals(尺寸排阻色谱-多角度光散射)测量分子量。在一些实施方案中,聚合物试剂通常是多分散的(即聚合物的数均分子量和重均分子量不相等),并且可以具有例如小于约1.5的低多分散性值(例如通过从sec-mals测量结果推导出的pdi值所判断的)。在一些实施方案中,多分散性(pdi)在约1.4至约1.2的范围内。在一些实施方案中,pdi小于约1.15、1.10、1.05或1.03。
[0137]
短语“一个/种”实体是指一个/种或多个/种该实体;例如,一种化合物是指一种或多种化合物或至少一种化合物。因此,术语“一个/种”、“一个/种或多个/种”和“至少一个/
种”在本文中可以互换使用。
[0138]“约”是指在不同仪器、样品和样品制备物之间进行的测量中可能看到的偏差。
[0139]“受保护的”、“保护形式”、“保护基团”和“保护性基团”是指存在防止或阻断分子中特定化学反应性官能团在某些反应条件下的反应的基团(即保护基团)。保护基团根据所保护的化学反应性基团的类型以及要使用的反应条件和分子中其他的反应性基团或保护基团的存在(如果有的话)而不同。合适的保护基团包括例如greene等人的论文,“protective groups in organic synthesis,”3
rd edition,john wiley and sons,inc.,new york,1999中记载的那些。
[0140]“烷基”是指具有指定碳原子数的直链或支链的饱和脂族基团。例如,c
1-c6烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基等。其它烷基包括但不限于庚基、辛基、壬基、癸基等。烷基可包括任何数目的碳,例如1-2、1-3、1-4、1-5、1-6、1-7、1-8、1-9、1-10、2-3、2-4、2-5、2-6、3-4、3-5、3-6、4-5、4-6和5-6。烷基通常是一价的,但可以是二价的,例如当烷基将两个部分连接在一起时。
[0141]
上文和下文中提及的与有机基团或化合物有关的术语“低级”分别定义可以为支链或非支链的化合物或基团,其具有至多且包括7个碳原子,或至多且包括4个碳原子和(如非支链的)一个或两个碳原子。
[0142]“亚烷基”是指连接至少两个其它基团的如上定义的烷基,即二价烃基。连接到亚烷基的两个部分可以连接到亚烷基的相同原子或不同原子。例如,直链亚烷基可以是-(ch2)n二价基团,其中n是1、2、3、4、5或6。亚烷基包括但不限于亚甲基、亚乙基、亚丙基、亚异丙基、亚丁基、亚异丁基、亚仲丁基、亚戊基和亚己基。
[0143]
烷基和杂烷基(包括通常称为亚烷基、烯基、杂亚烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基的那些基团)的取代基可以是选自以下的各种基团:-or’、=o、=nr’、=n-or’、-nr’r”、-sr’、-卤素、-sir’r”r
”’
、-oc(o)r’、-c(o)r’、-co2r’、-conr’r”、-oc(o)nr’r”、-nr”c(o)r’、-nr
’‑
c(o)nr”r
”’
、-nr”c(o)2r’、-nh-c(nh2)=nh、-nr’c(nh2)=nh、-nh-c(nh2)=nr’、-s(o)r’、-s(o)2r’、-s(o)2nr’r”、-cn和-no2,其数量范围为0到(2m’+1),其中m’是这种基团中的碳原子总数。r’、r”和r
”’
各自独立地是指氢、未取代的(c
1-c8)烷基和杂烷基、未取代的芳基、1-3个卤素取代的芳基、未取代的烷基、烷氧基或硫代烷氧基或芳基-(c
1-c4)烷基。当r’和r”连接至相同的氮原子时,它们可以与氮原子组合形成5元环、6元环或7元环。例如,-nr’r”意在包括1-吡咯烷基和4-吗啉基。术语“烷基”包括例如卤代烷基(例如-cf3和-ch2cf3)和酰基(例如-c(o)ch3、-c(o)cf3、-c(o)ch2och3等)的基团。在一些实施方案中,取代的烷基和杂烷基具有1-4个取代基。在一些实施方案中,取代的烷基和杂烷基具有1、2或3个取代基。例外是那些全卤代烷基(例如,五氟乙基等)。
[0144]
烷基和杂烷基(包括通常称为亚烷基、烯基、杂亚烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基的那些基团)的取代基可以是选自但不限于以下的各种基团中的一种或多种:-or’、=o、=nr’、=n-or’、-nr’r”、-sr’、-卤素、-sir’r”r
”’
、-oc(o)r’、-c(o)r’、-co2r’、-conr’r”、-oc(o)nr’r”、-nr”c(o)r’、-nr
’‑
c(o)nr”r
”’
、-nr”c(o)2r’、-nr-c(nr’r”r
’”
)=nr
””
、-nr-c(nr’r”)=nr
’”
、-s(o)r’、-s(o)2r’、-s(o)2nr’r”、-nrso2r’、-cn和
–
no2,其数量范围为0到(2m’+1),其中m’是这种基团中的碳原子总数。r’、r”、r
”’
和r
””
各自独立地指氢、取代或未取代的杂烷基、取代或未取代的芳基(例如1-3个卤素取代的芳
基)、取代或未取代的烷基、烷氧基或硫代烷氧基、或芳烷基。当化合物包括多于一个r基团时,例如,当存在多于一个这些基团时,各r基团独立地选择为r’、r”、r
’”
和r
””
基团。当r’和r”连接至相同的氮原子时,它们可以与氮原子组合形成5元环、6元环或7元环。例如,-nr’r”意在包括但不限于1-吡咯烷基和4-吗啉基。从上述对取代基的讨论中,本领域技术人员会理解术语“烷基”意在包括包含与氢基团以外的基团结合的碳原子的基团,例如卤代烷基(例如-cf3和
–
ch2cf3)和酰基(例如-c(o)ch3、-c(o)cf3、-c(o)ch2och3等)。
[0145]“烷氧基”是指具有氧原子的烷基,所述氧原子将烷氧基连接到连接点或与烷氧基的两个碳连接。烷氧基包括例如甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、2-丁氧基、异丁氧基、仲丁氧基、叔丁氧基、戊氧基、己氧基等。烷氧基可以进一步被本文所述的各种取代基取代。例如,烷氧基可以被卤素取代以形成“卤代烷氧基”。
[0146]“羧基烷基”是指被羧基取代的烷基(如本文所定义)。术语“羧基环烷基”是指被羧基取代的环烷基(如本文所定义)。术语烷氧基烷基是指被烷氧基取代的烷基(如本文所定义)。本文使用的术语“羧基”是指羧酸及其酯。
[0147]“卤代烷基”是指其中一些或所有氢原子被卤素原子取代的如上定义的烷基。卤素(卤代)表示氯代或氟代,但也可以是溴代或碘代。例如,卤代烷基包括三氟甲基、氟甲基、1,2,3,4,5-五氟苯基等。术语“全氟代”定义所有可用的氢均被氟取代的化合物或基团。例如,全氟苯基是指1,2,3,4,5-五氟苯基,全氟甲基是指1,1,1-三氟甲基,全氟甲氧基是指1,1,1-三氟甲氧基。
[0148]“氟取代的烷基”是指其中一个、一些或所有氢原子被氟取代的烷基。
[0149]“细胞因子”是可在免疫和炎症反应中参与细胞间通讯的一组蛋白质信号传导分子的成员。细胞因子通常是质量为约8-35kda的小的水溶性糖蛋白。
[0150]“环烷基”是指含有约3-12个、3-10个或3-7个环内碳原子的环状烃基。环烷基包括稠合环结构、桥环结构和螺环结构。
[0151]“环内”是指包含环状环结构的部分的原子或原子组。
[0152]“环外”是指连接的但不限定环状环结构的原子或原子组。
[0153]“环状烷基醚”是指具有3个或4个环内碳原子和1个环内氧原子或硫原子的4元或5元环状烷基(例如,氧杂环丁烷、硫杂环丁烷、四氢呋喃、四氢噻吩);或具有1个或2个环内氧原子或硫原子的6元至7元环状烷基(例如四氢吡喃、1,3-二噁烷、1,4-二噁烷、四氢噻喃、1,3-二噻烷、1,4-二噻烷、1,4-氧硫杂环己烷)。
[0154]“烯基”是指具有至少一个双键的2-6个碳原子的直链或支链烃。烯基的实例包括但不限于乙烯基、丙烯基、异丙烯基、1-丁烯基、2-丁烯基、异丁烯基、丁二烯基、1-戊烯基、2-戊烯基、异戊烯基、1,3-戊二烯基、1,4-戊二烯基、1-己烯基、2-己烯基、3-己烯基、1,3-己二烯基、1,4-己二烯基、1,5-己二烯基、2,4-己二烯基或1,3,5-己三烯基。烯基还可以具有2至3、2至4、2至5、3至4、3至5、3至6、4至5、4至6和5至6个碳。烯基通常是一价的,但可以是二价的,例如当烯基将两个部分连接在一起时。
[0155]“亚烯基”是指连接至少两个其它基团的如上定义的烯基,即二价烃基。与亚烯基连接的两个部分可以连接到亚烯基的相同原子或不同原子。亚烯基包括但不限于亚乙烯基、亚丙烯基、亚异丙烯基、亚丁烯基、亚异丁烯基、亚仲丁烯基、亚戊烯基和亚己烯基。
[0156]“炔基”是指具有至少一个三键的2-6个碳原子的直链或支链烃。炔基的实例包括
但不限于乙炔基、丙炔基、1-丁炔基、2-丁炔基、异丁炔基、仲丁炔基、丁二炔基、1-戊炔基、2-戊炔基、异戊炔基、1,3-戊二炔基、1,4-戊二炔基、1-己炔基、2-己炔基、3-己炔基、1,3-己二炔基、1,4-己二炔基、1,5-己二炔基、2,4-己二炔基或1,3,5-己三炔基。炔基还可以具有2至3、2至4、2至5、3至4、3至5、3至6、4至5、4至6和5至6个碳。炔基通常是一价的,但可以是二价的,例如当炔基将两个部分连接在一起时。
[0157]“亚炔基”是指连接至少两个其它基团的如上定义的炔基,即二价烃基。连接到亚炔基的两个部分可以连接到亚炔基的相同原子或不同原子。亚炔基包括但不限于亚乙炔基、亚丙炔基、亚丁炔基、亚仲丁炔基、亚戊炔基和亚己炔基。
[0158]“环烷基”是指含有3-12个环原子或指定原子数的饱和或部分不饱和的、单环、稠合双环或桥连多环组合体。单环包括例如环丙基、环丁基、环戊基、环己基和环辛基。双环和多环包括例如降莰烷(norbornane)、十氢萘和金刚烷。例如,c
3-8
环烷基包括环丙基、环丁基、环戊基、环己基、环辛基和降莰烷。
[0159]“亚环烷基”是指连接至少两个其它基团的如上定义的环烷基,即二价烃基。连接到亚环烷基的两个部分可以连接到亚环烷基的相同原子或不同原子。亚环烷基包括但不限于亚环丙基、亚环丁基、亚环戊基、亚环己基和亚环辛基。
[0160]“杂环烷基”是指具有3个环成员至约20个环成员和1个至约5个诸如n、o和s的杂原子的环系统。也可以使用其他杂原子,包括但不限于b、al、si和p。杂原子也可以被氧化,例如但不限于-s(o)-和-s(o)
2-。例如,杂环包括但不限于四氢呋喃基、四氢噻吩基、吗啉代、吡咯烷基、吡咯啉基、咪唑烷基、咪唑啉基、吡唑烷基、吡唑啉基、哌嗪基、哌啶基、二氢吲哚基、奎宁环基和1,4-二氧杂-8-氮杂螺[4.5]癸-8-基。
[0161]“亚杂环烷基”是指连接至少两个其它基团的如上所定义的杂环烷基。连接到亚杂环烷基的两个部分可以连接到亚杂环烷基的相同原子或不同原子。
[0162]“芳基”是指含有6-16个环碳原子的单环或稠合双环、三环或更大的芳族环组合体。例如,芳基可以是苯基、苄基或萘基。“亚芳基”是指衍生自芳基的二价基团。芳基可以被一个、两个或三个选自烷基、烷氧基、芳基、羟基、卤素、氰基、氨基、氨基烷基、三氟甲基、亚烷基二氧基和氧-c
2-c
3-亚烷基的基团单取代、双取代或三取代;所有这些基团任选地进一步被取代,例如如上文所定义;或1-萘基或2-萘基;或1-菲基或2-菲基。亚烷基二氧基是连接到苯基的两个相邻碳原子的二价取代基,例如亚甲基二氧基或亚乙基二氧基。氧-c
2-c
3-亚烷基也是连接到苯基的两个相邻碳原子的二价取代基,例如氧亚乙基或氧亚丙基。氧-c
2-c
3-亚烷基-苯基的实例为2,3-二氢苯并呋喃-5-基。
[0163]
在一些实施方案中,芳基为萘基、苯基或被烷氧基、苯基、卤素、烷基或三氟甲基单取代或双取代的苯基,特别是苯基或被烷氧基、卤素或三氟甲基单取代或双取代的苯基,特别是苯基。
[0164]
作为r的取代的苯基的实例为例如4-氯苯-1-基、3,4-二氯苯-1-基、4-甲氧基苯-1-基、4-甲基苯-1-基、4-氨基甲基苯-1-基、4-甲氧基乙基氨基甲基苯-1-基、4-羟乙基氨基甲基苯-1-基、4-羟乙基-(甲基)-氨基甲基苯-1-基、3-氨基甲基苯-1-基、4-n-乙酰基氨基甲基苯-1-基、4-氨基苯-1-基、3-氨基苯-1-基、2-氨基苯-1-基、4-苯基-苯-1-基、4-(咪唑-1-基)苯基、4-(咪唑-1-基甲基)苯-1-基、4-(吗啉-1-基)-苯-1-基、4-(吗啉-1-基甲基)-苯-1-基、4-(2-甲氧基乙基氨基甲基)-苯-1-基和4-(吡咯烷-1-基甲基)-苯-1-基、4-(噻吩
基)-苯-1-基、4-(3-噻吩基)-苯-1-基、4-(4-甲基哌嗪-1-基)-苯-1-基和杂环任选地被取代的4-(哌啶基)-苯基和4-(吡啶基)-苯基。
[0165]“亚芳基”是指连接至少两个其它基团的如上定义的芳基。连接到亚芳基的两个部分被连接到亚芳基的不同原子。亚芳基包括但不限于亚苯基。
[0166]“亚芳基-氧基”是指如上定义的亚芳基基团,其中连接到亚芳基的部分之一通过氧原子连接。亚芳基-氧基包括但不限于亚苯基-氧基。
[0167]
类似地,芳基和杂芳基的取代基是多样的并且选自:-卤素、-or’、-oc(o)r’、-nr’r”、-sr’、-r’、-cn、-no2、-co2r’、-conr’r”、-c(o)r’、-oc(o)nr’r”、-nr”c(o)r’、-nr”c(o)2r’、-nr
’‑
c(o)nr”r
”’
、-nh-c(nh2)=nh、-nr’c(nh2)=nh、-nh-c(nh2)=nr’、-s(o)r’、-s(o)2r’、-s(o)2nr’r”、-n3、-ch(ph)2、全氟(c
1-c4)烷氧基和全氟(c
1-c4)烷基,数量范围为从0到芳族环系统上的开放化合价的总数;并且其中r’、r”和r
”’
独立地选自氢、(c
1-c8)烷基和杂烷基、未取代的芳基和杂芳基、(未取代的芳基)-(c
1-c4)烷基和(未取代的芳基)氧基-(c
1-c4)烷基。
[0168]
芳基或杂芳基环的相邻原子上的取代基中的两个可以任选地被式-t-c(o)-(ch2)
q-u-的取代基替代,其中t和u独立地为-nh-、-o-、-ch
2-或单键,且q为0至2的整数。或者,芳基或杂芳基环的相邻原子上的取代基中的两个可以任选地被式-a-(ch2)
r-b-的取代基替代,其中a和b独立地为-ch
2-、-o-、-nh-、-s-、-s(o)-、-s(o)
2-、-s(o)2nr
’‑
或单键,且r为1至3的整数。如此形成的新环的单键之一可以任选地被双键代替。或者,芳基或杂芳基环的相邻原子上的取代基中的两个可以任选地被式-(ch2)
s-x-(ch2)
t-的取代基替代,其中s和t独立地为0-3的整数,x为-o-、-nr
’‑
、-s-、-s(o)-、-s(o)
2-、或-s(o)2nr
’‑
。-nr
’‑
和-s(o)2nr
’‑
中的取代基r’选自氢或未取代的(c
1-c6)烷基。
[0169]“杂芳基”是指含有5-16个环原子的单环或稠合双环或三环芳族环组合体,其中1-4个环原子为杂原子,各自为n、o或s。例如,杂芳基包括吡啶基、吲哚基、吲唑基、喹喔啉基、喹啉基、异喹啉基、苯并噻吩基、苯并呋喃基、呋喃基、吡咯基、噻唑基、苯并噻唑基、噁唑基、异噁唑基、三唑基、四唑基、吡唑基、咪唑基、噻吩基或任何其它被例如烷基、硝基或卤素取代(尤其是单取代或双取代)的基团。吡啶基表示2-吡啶基、3-吡啶基或4-吡啶基,有利地表示2-吡啶基或3-吡啶基。噻吩基表示2-噻吩基或3-噻吩基。在一些实施方案中,喹啉基表示2-喹啉基、3-喹啉基或4-喹啉基。在一些实施方案中,异喹啉基表示1-异喹啉基、3-异喹啉基或4-异喹啉基。在一些实施方案中,苯并吡喃基、苯并噻喃基可分别表示3-苯并吡喃基或3-苯并噻喃基。在一些实施方案中,噻唑基可表示2-噻唑基或4-噻唑基。在一些实施方案中,三唑基可以是1-(1,2,4-三唑基)、2-(1,2,4-三唑基)或5-(1,2,4-三唑基)。在一些实施方案中,四唑基可以是5-四唑基。
[0170]
在一些实施方案中,杂芳基为吡啶基、吲哚基、喹啉基、吡咯基、噻唑基、异噁唑基、三唑基、四唑基、吡唑基、咪唑基、噻吩基、呋喃基、苯并噻唑基、苯并呋喃基、异喹啉基、苯并噻吩基、噁唑基、吲唑基或任何被取代的(特别是单取代或二取代的)所述基团。
[0171]
术语“杂烷基”是指具有1至3个诸如n、o和s的杂原子的烷基。也可以使用其他杂原子,包括但不限于b、al、si和p。杂原子也可以被氧化,例如但不限于-s(o)-和-s(o)
2-。例如,杂烷基可以包括醚、硫醚、烷基-胺和烷基-硫醇。
[0172]
术语“亚杂烷基”是指连接至少两个其它基团的如上所定义的杂烷基。连接到亚杂
烷基的两个部分可以连接到亚杂烷基的相同原子或不同原子。
[0173]“亲电体”是指这样的离子或原子或原子集合,其可以是离子的,具有亲电中心,即寻找电子、能够与亲核体反应的中心。亲电体(或亲电试剂)是通过从其反应搭档(reaction partner)(亲核体)接受两个成键电子而与该反应搭档形成键的试剂。
[0174]“亲核体”是指这样的离子或原子或原子集合,其可以是离子的,具有亲核中心,即寻求亲电中心或能够与亲电体反应的中心。亲核体(或亲核试剂)是通过提供两个成键电子而与其反应搭档(亲电体)形成键的试剂。“亲核基团”是指与反应性基团反应之后的亲核体。非限制性实例包括氨基、羟基、烷氧基、卤代烷氧基等。
[0175]“马来酰亚胺基”是指具有以下结构的吡咯-2,5-二酮-1-基:
[0176][0177]
其在与巯基(例如硫代烷基)反应时形成具有如下结构的-s-马来酰亚胺基团:
[0178][0179]
其中“·”表示马来酰亚胺基团的连接点,表示硫醇的硫原子与原始的含巯基基团的其余部分的连接点。
[0180]
为了本发明的目的,在蛋白质和多肽中出现的“天然存在的氨基酸”为l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-谷氨酰胺、l-谷氨酸、l-甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸和/或l-缬氨酸。在蛋白质中出现的“非天然存在的氨基酸”为除了那些记载为天然存在的氨基酸以外的任何氨基酸。非天然存在的氨基酸包括但不限于天然存在的氨基酸的d异构体,以及天然存在的氨基酸的d异构体和l异构体的混合物。对于其它氨基酸,例如n-α-甲基氨基酸(例如肌氨酸)、4-羟脯氨酸、锁链素、异锁链素、5-羟赖氨酸、ε-n-甲基赖氨酸、3-甲基组氨酸,虽然其发现于天然存在的蛋白质中,但为了本发明的目的,其被认为是蛋白质中发现的非天然存在的氨基酸,因为它们通常通过mrna的核糖体翻译以外的手段引入。
[0181]
涉及聚合物的几何形状、架构或整体结构时,“线性”是指具有单个聚合物臂的聚合物。
[0182]
涉及聚合物的几何形状、架构或整体结构时,“支化”是指具有从包含在引发剂内
的芯结构延伸的2个或更多个聚合物“臂”的聚合物。引发剂可以用于原子转移自由基聚合(atrp)反应。支化聚合物可具有2个聚合物链(臂)、3个聚合物臂、4个聚合物臂、5个聚合物臂、6个聚合物臂、7个聚合物臂、8个聚合物臂、9个聚合物臂或更多个聚合物臂。每个聚合物臂从聚合物引发位点延伸。每个聚合物引发位点是可通过加入单体而增长聚合物链的位点。例如但不限于,使用atrp,引发剂上的聚合物引发位点通常是经历由过渡金属化合物(如卤化亚铜)催化的可逆氧化还原过程的有机卤化物。在一些实施方案中,该卤化物为溴。
[0183]“药学上可接受的赋形剂”是指可以包含在组合物中、对患者没有显著不利的毒理学作用并且被fda批准或可被fda批准用于治疗用途(特别是在人类中)的赋形剂。药学上可接受的赋形剂的非限制性实例包括水、nacl、生理盐水溶液、乳酸林格氏液、生理蔗糖、生理葡萄糖等。
[0184]
以有效方案施用治疗性蛋白质,所述有效方案是指延迟病症发作、降低病症严重程度、抑制病症进一步恶化和/或改善病症的至少一种体征或症状的剂量、施用途径和施用频率。如果患者已经患有病症,则该方案可以被称为治疗有效方案。如果患者相对于一般群体处于高患病风险但尚未发现症状,则该方案可以被称为预防有效方案。在一些情况下,相对于同一患者的历史对照或以往经历,可以在该个体患者中观察到治疗功效或预防功效。在其它情况下,相对于未经治疗的患者的对照群体,可在临床前或临床试验中在经治疗的患者群体中证明治疗功效或预防功效。
[0185]
物质的“生物半衰期”是药代动力学参数,其说明在物质引入后一半物质从组织或生物体中除去所需的时间。
[0186]“og1786”是用于聚合物合成的9-臂引发剂,描述了og1786与三氟乙酸形成的盐形式。og1786可作为其它盐或作为游离碱使用。
[0187]“og1801”是采用og1786作为atrp合成的引发剂并采用单体hema-pc制备的约(+/-15%)750kda的聚合物(mn或mp)。
[0188]“og1802”是增加马来酰亚胺官能团(functionality)的og1801,其中n1、n2、n3、n4、n5、n6、n7、n8和n9各自是整数(正数)(从0直到约3000),使得聚合物的总分子量为750,000
±
15%道尔顿(mw)。
[0189]“bcva”表示最佳矫正视力。
[0190]“oct-a”表示oct-血管造影。
[0191]“sd-oct”表示谱域光学相干断层扫描。
[0192]
多角度光散射(mals)是分析大分子的技术,其中激光撞击在分子上,光的振荡电场在其内部引起振荡偶极子。该振荡偶极子将重新辐射光并且可以使用诸如wyatt minidawn treos的mals检测器来测量。辐射光的强度取决于在大分子中诱导的偶极子的大小,其反过来与大分子的极化性成比例,诱导的偶极子越大,因此散射光的强度越大。因此,为了分析来自这种大分子的溶液的散射,人们应该知道它们相对于周围介质(例如溶剂)的极化性。这可以通过使用wyatt optilab t-rex差示折射计测量溶液折射率n的变化δn与分子浓度变化δc,通过测量dn/dc(=δn/δc)值来确定。mals测定采用的两个摩尔重量参数为数均分子量(mn)和重均分子量(mw),其中多分散指数(pdi)等于mw除以mn。sec还可以测定另一种平均分子量,即峰位分子量mp,其被定义为sec的最高峰的分子量。
[0193]
pdi用作聚合物和生物缀合物的分子量分布宽度的量度,所述生物缀合物衍生自
离散蛋白质(例如og1950)与多分散生物聚合物(例如,og1802)的缀合。对于蛋白质样品,其多分散性接近1.0,因为它是翻译产物,其中溶液中的每个蛋白质分子预期具有几乎相同的长度和摩尔质量。相反,由于生物聚合物的多分散性质,其中在聚合过程中合成了不同长度的聚合物链,因此将样品的pdi确定为其分子量窄分布的质量属性之一是非常重要的。
[0194]
尺寸排阻色谱(sec)是一种将溶液中的分子按其大小分离的色谱技术。通常,施加水性溶液以将样品输送通过填充有各种孔径的树脂的柱。期望在分析物通过柱时,树脂对分析物呈惰性,并且分析物基于其独特的尺寸和所选柱的孔径特征而彼此分离。
[0195]
将sec与mals或sec/mals偶联可提供摩尔质量和大小(均方根半径)的精确分布,而不是依赖于一组sec校准标准。与传统的柱校准方法相比,这种类型的布置具有许多优点。由于测量每种洗脱级分的光散射和浓度,因此可以独立于洗脱位置而确定摩尔质量和大小。这对于具有非球形大分子的物种尤其相关,例如生物聚合物(og1802)或生物缀合物(例如,ksi-301);这些物种通常不会以可能由一组柱校准标准描述的方式洗脱。
[0196]
在一些实施方案中,sec/mals分析包括具有alliance 2695溶剂递送模块的waters hplc系统和配备有shodex sec-hplc柱(7.8
×
300mm)的waters 2996光电二极管阵列检测器。它与wyatt minidawn treos和wyatt optilab t-rex差示折射计在线连接。waters的empower软件可以用于控制waters hplc系统,wyatt的astra v 6.1.7.16软件可用于从wyatt minidawn treos获取mals数据,从t-rex检测器获取dn/dc数据,并使用a280吸光度信号从waters 2996光电二极管阵列检测器获取质量恢复数据(mass recovery data)。sec可以在1xpbs ph 7.4中在样品注射后以1ml/min进行,可以通过astra软件分析mals和ri信号以测定绝对摩尔质量(mp,mw,mn)和多分散指数(pdi)。此外,计算还涉及聚合物和蛋白质的输入dn/dc值,分别为0.142和0.183。对于ksi-301dn/dc值,使用下式,基于聚合物和蛋白质的加权mw计算dn/dc,为约0.148:
[0197]
缀合物dn/dc=0.142x[mw聚合物/(mw聚合物+mw蛋白质)]+0.183x[mw蛋白质/(mw聚合物+mw蛋白质)]
[0198]
其中og1802的mw聚合物为800kda,og1950的mw蛋白质为146kda。
[0199]“ksi-301”是重组的、哺乳动物细胞表达的全长人源化抗vegf单克隆抗体与基于支链高分子量磷酸胆碱的生物聚合物共价缀合的生物缀合物。在一些实施方案中,ksi-301作为不含防腐剂的无菌水溶液在一次性玻璃瓶中以50mg/ml的浓度(基于抗体质量)提供。图14显示了ksi-301的抗体部分的氨基酸序列。ksi-301是一种抗血管内皮生长因子(vegf)生物药物,具有延长的眼半衰期。ksi-301是以下两种中间体的生物缀合物:(1)og1950抗体中间体,一种重组全长人源化抗huvegf a单克隆抗体,和(2)og1802生物聚合物中间体,一种磷酸胆碱生物聚合物。惰性生物聚合物og1802的添加增加了生物制剂的大小,从而使ksi-301的眼药代动力学(pk)超过了目前批准的抗huvegf-a治疗药物。ksi-301的非临床研究表明,它以高亲和力与huvegf-a适当结合,然后huvegf-a与huvegf受体1和2(huvegfr)的结合受到抑制。这反过来又会消除huvegf-a介导的功能。
[0200]
在兔中进行的药代动力学研究表明,ksi-301延长了眼半衰期,能很好地穿透眼组织并分布到视网膜和脉络膜。在兔中,ksi-301的眼半衰期为约11天,其明显长于报告的对于阿柏西普和雷珠单抗测量的兔半衰期(分别为4至5天和3至4天)(covancestudy 8376321,park 2016)。在食蟹猴中进行了一系列非临床glp重复剂量(4周给药间隔)毒理学
研究,以测试ksi-301的眼部和全身安全性,这些研究分别进行了26周(7个玻璃体内剂量)和10周(3个静脉内剂量)。结果表明,在眼部和全身研究中,ksi-301在测试的分别达到5mg/眼(玻璃体内)和5mg/kg(静脉内)的最大剂量时耐受良好。总之,从非临床pk和毒理学研究推断的数据表明,ksi-301可以安全有效地用于人类受试者。在一些实施方案中,施用途径是通过玻璃体内注射。在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)可以在负荷剂量完成后每3-4个月施用一次,或者甚至以更低的频率施用。
[0201]
在一些实施方案中,在本文提供的任何一种或多种方法中施用的分子是美国专利公开号2017/0190766中公开的分子中的任何一种,该专利的全部内容通过引用并入本文。
[0202]
治疗方法
[0203]
一般而言,本公开的方法包括向需要治疗眼部病症的受试者(例如,人或其它哺乳动物受试者)施用抗vegf抗体缀合物(例如,ksi-301,或与磷酸胆碱聚合物缀合的图14中的实施方案,如本文提供的那样,或图13中描述的构建体)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的一或多个剂量,从而治疗眼部病症。在向受试者施用时,抗vegf抗体缀合物或抗vegf蛋白质缀合物可提供持久的治疗效果,这使得给药方案的给药间隔比以前使用抗vegf疗法的给药方案的给药间隔更长。在一些实施方案中,一旦通过施用抗vegf抗体缀合物或抗vegf蛋白质缀合物一个或多个剂量(例如,负荷剂量和/或维持剂量),而实现了抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果,则该治疗结果可被受试者保持,此后无需任何额外的剂量,例如,保持至受试者的余生。
[0204]
参考图42,描述了本公开的方法的实施方案。方法4200可包括:以第一负荷剂量向需要治疗眼部病症(例如wamd、dme或rvo)的受试者施用4210抗vegf抗体缀合物(例如ksi-301)。然后,负荷剂量可以重复4220至少一次(例如,重复一次、两次、三次等)。在施用负荷剂量之后,抗vegf抗体缀合物(例如,ksi-301)疗法的治疗结果可在最终负荷剂量之后由受试者保持至少8周,例如,至少12周、至少16周、至少20周、至少24周或更长时间。在一些实施方案中,所述方法包括:在施用最终负荷剂量之后至少8周(例如,至少12周、至少16周、至少20周、至少24周)向受试者施用4230抗vegf抗体缀合物(例如,ksi-301)的一个或多个后续剂量(例如,维持剂量)。在一些实施方案中,所述方法包括根据本文公开的任何方法,向需要治疗眼部病症的受试者施用抗vegf蛋白质(例如阿柏西普)缀合物(代替抗vegf抗体缀合物)。
[0205]
在一些实施方案中,该方法包括:向需要治疗眼部病症的受试者(例如人或其他哺乳动物受试者)施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的第一负荷剂量,及随后再施用至少一次,但不超过两次的负荷剂量,以获得持续延长时间段的抗vegf疗法的治疗结果(例如,改善视力、减缓疾病进展、减轻症状、改善视网膜健康等)。在一些实施方案中,在接受最终负荷剂量后,患者可能在延长的时间段内不需要再治疗眼部病症。在一些实施方案中,施用抗vegf抗体缀合物(或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物))可能提供抗vegf疗法的治疗结果,而无需任何负荷剂量,以治疗患有眼部病症(例如,非增殖性糖尿病性视网膜病变)的受试者。
[0206]
如本文所用,每当提及“抗vegf抗体”或“抗vegf抗体缀合物”时,也考虑抗vegf蛋白质,例如抗vegf融合蛋白质,例如阿柏西普。因此,如本文所公开的,每当提及“抗vegf抗体缀合物”时,还考虑如本文公开的与含磷酸胆碱的生物聚合物(例如og1802)共价结合的
抗vegf蛋白质(例如,阿柏西普)。在本文公开的各种实施方案中,任何提及的抗vegf抗体缀合物疗法也考虑抗vegf蛋白质(例如阿柏西普)缀合物疗法。在本文公开的治疗眼部病症的方法的各种实施方案中,任何提及的抗vegf抗体缀合物也考虑阿柏西普生物聚合物缀合物。
[0207]“负荷剂量”具有本领域普通技术人员根据本公开所理解的普通和惯用的含义。负荷剂量可以指在受试者中观察到治疗剂的治疗效果之前,或者在受试者中达到治疗剂的治疗效果的所需水平之前,向受试者施用的治疗剂的量。负荷剂量通常在疗法的疗程开始时施用。在一些实施方案中,与用于维持治疗结果的后期剂量相比,负荷剂量的施用更频繁或间隔更短。受试者接受一个或多个负荷剂量的时间段可称为负荷阶段。在一些实施方案中,在负荷阶段,不对受试者的疾病进展或状态进行监测(例如,不对视敏度、视网膜厚度等进行评估)。在一些实施方案中,在负荷阶段,抗vegf抗体缀合物疗法(例如,ksi-301疗法)的治疗结果(如本文所公开的)没有达到期望的或阈值水平。负荷剂量可以是例如在负荷阶段向受试者施用的一系列负荷剂量之一。“最终负荷剂量”可以指向受试者施用的一系列负荷剂量中的最后一个负荷剂量,在该负荷剂量时和/或之后实现药剂的期望治疗效果水平。因此,当受试者被给予一个负荷剂量时,最终负荷剂量是第一负荷剂量。当受试者被给予两个负荷剂量时,最终负荷剂量是第二负荷剂量。类似地,当受试者被给予三个负荷剂量时,最终负荷剂量是第三负荷剂量,依此类推。在负荷阶段之后向受试者施用的治疗剂的剂量可称为维持剂量或再治疗剂量。“维持剂量”和“再治疗剂量”在本文中可互换使用。在本文提供的一些实施方案中,负荷剂量可以是足够的,而不会频繁需要或不需要后续的再治疗或维持剂量。在一些实施方案中,以比向受试者施用一系列维持(或再治疗)剂量更高的频率向受试者施用一系列负荷剂量。在一些实施方案中,给予的负荷剂量可能足以将受试者的疾病活动保持在控制之下,而不需要维持(或再治疗)剂量。
[0208]
在一些实施方案中,通过本文公开的方法实现的抗vegf疗法的治疗结果被充分保持,从而在预定给药方案中的预定时间点不需要维持剂量。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约2个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约3个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约4个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂
量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约5个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约6个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约7个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约8个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约9个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约10个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约12个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约14个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约16个月或更长时间。在一些实施方案中,受试者有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更高的机会、或任意两个前述值之间的百分比,不需要抗vegf抗体缀合物的后续剂量(例如,维持剂量),直到接受最终负荷剂量或最终维持剂量后约18个月或更长时间。
[0209]
在接受最终剂量(例如,最终负荷剂量,或最后发生的任何剂量)后,受试者可在持续的时间段内保持抗vegf疗法的治疗结果,而无需受试者接受抗体缀合物的后续剂量(例如,维持剂量)。抗vegf疗法的治疗结果可以包括与第一负荷剂量之前或之时相比,在最终
负荷剂量时或其前后,视敏度或视网膜健康(例如,视网膜厚度、视网膜灌注程度等)中的一种或多种的改善。根据本公开的方法,可以使用抗vegf疗法的任何合适的治疗结果。用于确定治疗结果的合适量度包括,例如,视敏度、视网膜厚度、至少一只眼睛中的灌注、糖尿病性视网膜病变严重程度评分(drss)、眼部病症的疾病活动或其任意组合。在一些实施方案中,wamd、dme、rvo或dr疾病活动包括视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的渗出物中的一种或多种。
[0210]
在一些实施方案中,治疗结果包括视敏度的改善或至少减缓的下降。可使用任何合适的方法监测视敏度。在一些实施方案中,通过最佳矫正视力(bcva)来测量视敏度,使用例如etdrs字母或snellen图等。在一些实施方案中,治疗结果可包括:与治疗前相比,由etdrs字母测量的bcva改善为3个或更多个字母,例如4个或更多个字母、5个或更多个字母、6个或更多个字母、7个或更多个字母、8个或更多个字母、9个或更多个字母、10个或更多个字母、12个或更多个字母、15个或更多个字母、18个或更多个字母、20个或更多个字母、22个或更多个字母,包括25个或更多个字母,或者由任意两个前述值限定的范围内的数目。在一些实施方案中,治疗结果可包括与治疗前相比,bcva的恶化速度降低至少10%,例如至少15%、至少25%、至少50%、至少75%、至少90%,包括约100%,或由前述值中的任意两个定义的范围内的任意百分比。
[0211]
在一些实施方案中,治疗结果包括视网膜厚度(例如,中心子区厚度)的减少或至少增加减慢。视网膜厚度可以使用任何合适的方法测量,包括但不限于光学相干断层扫描(oct)。在一些实施方案中,治疗结果可包括与治疗前相比,视网膜厚度减少约25μm或更多,例如约50μm或更多、约75μm或更多、约100μm或更多、约125μm或更多、约150μm或更多、约175μm或更多、约200μm或更多、约225μm或更多、约250μm或更多、约275μm或更多、约300μm或更多、约325μm或更多、约350μm或更多、约375μm或更多、约400μm或更多,或者在由任意两个前述值限定的范围内的减少。在一些实施方案中,治疗结果可包括与治疗前相比,视网膜厚度增加的速率降低至少10%,例如至少15%、至少25%、至少50%、至少75%、至少90%,包括约100%,或由前述值中的任意两个定义的范围内的任意百分比。
[0212]
在一些实施方案中,治疗结果包括视网膜的灌注改善,或至少非灌注的扩张速率降低。可以使用任何合适的方法监测灌注。合适的方法包括但不限于oct-血管造影术(oct-a)、荧光素血管造影或超宽视野荧光素血管造影。灌注或非灌注的程度可以使用任何合适的测量方法来测量。在一些实施方案中,测量非灌注面积或毛细血管非灌注的面积。在一些实施方案中,通过将非灌注面积除以总视网膜面积来计算缺血指数。在一些实施方案中,测量血管造影照片上视网膜象限中视网膜非灌注的存在或不存在。在一些实施方案中,治疗结果可包括与治疗前相比,非灌注面积减少至少10%,例如至少15%、至少25%、至少50%、至少75%、至少90%,包括约100%,或由前述值中的任意两个定义的范围内的任意百分比。在一些实施方案中,治疗结果可包括与治疗前相比,进行性非灌注的速率降低至少10%,例如至少15%、至少25%、至少50%、至少75%、至少90%,包括约100%,或由前述值中的任意两个定义的范围内的任意百分比。
[0213]
在一些实施方案中,治疗结果包括糖尿病性视网膜病变严重程度评分(drss)的改善或防止其恶化。在一些实施方案中,治疗结果可包括与治疗前相比,drss改善2级或更多级、或3级或更多级。在一些实施方案中,治疗结果可以包括与治疗前相比,防止drss恶化2
级或更多级、或3级或更多级。
[0214]
如果与改善后的水平相比,视敏度或视网膜健康水平(例如,视网膜厚度、非灌注程度等)没有恶化超过预定量,则治疗结果保持。在一些实施方案中,如果在最终剂量(例如,最终负荷剂量)后,视敏度或视网膜健康水平没有回复到视敏度或视网膜健康的治疗前水平的30%或更多,例如50%或更多、75%或更多、90%或更多,包括100%或更多,则治疗结果保持。在一些实施方案中,如果在最终剂量(例如,最终负荷剂量)后,视敏度或视网膜健康的变化率没有回复到视敏度或视网膜健康的变化率的治疗前水平的30%或更多,例如50%或更多、75%或更多、90%或更多,包括100%或更多,则治疗结果保持。
[0215]
在一些实施方案中,治疗结果包括视敏度的改善。在一些实施方案中,如果bcva没有从最终负荷剂量时(例如,在三个每月负荷剂量后的第12周)的bcva评分起下降3个字母或更多、4个字母或更多、5个字母或更多、6个字母或更多、7个字母或更多、8个字母或更多、9个字母或更多、或10个字母或更多,则治疗结果可以保持。在一些实施方案中,如果bcva没有从最后一次评估(例如,4周前)测得的bcva评分起下降3个字母或更多、4个字母或更多、5个字母或更多、6个字母或更多、7个字母或更多、8个字母或更多、9个字母或更多、或10个字母或更多,则治疗结果可以保持。在一些实施方案中,如果bcva没有从受试者的最佳测量的bcva评分或2个最佳测量的bcva评分的平均值起下降3个字母或更多、4个字母或更多、5个字母或更多、6个字母或更多、7个字母或更多、8个字母或更多、9个字母或更多、或10个字母或更多,则治疗结果可以保持。
[0216]
在一些实施方案中,治疗结果包括视网膜厚度(例如,中心子区厚度)的降低。在一些实施方案中,如果视网膜厚度(例如,中心子区厚度)没有从最终剂量(例如,最终负荷剂量)(例如,在三个每月负荷剂量后的第12周)时的视网膜厚度起增加25μm或更多、50μm或更多、75μm或更多、100μm或更多、125μm或更多、或150μm或更多,则治疗结果可以保持。在一些实施方案中,如果视网膜厚度(例如,中心子区厚度)没有从最后一次评估(例如,4周前)测量的视网膜厚度起增加25μm或更多、50μm或更多、75μm或更多、100μm或更多、125μm或更多、或150μm或更多,则治疗结果可以保持。在一些实施方案中,保持的治疗结果包括:与受试者的测量的最低视网膜厚度相比,视网膜厚度不大于150μm、125μm、100μm、75μm、50μm、40μm、或30μm。
[0217]
在一些实施方案中,治疗结果包括改善的视网膜灌注。在dr、dme和rvo患者中,视网膜可能有非灌注区或无血流区。在一些实施方案中,非灌注在血管造影照片上可视化。在一些实施方案中,根据本公开的方法,抗vegf抗体缀合物(例如,ksi-301)施用或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)施用的治疗结果包括视网膜的非灌注的消退或再灌注。在一些实施方案中,如果非灌注的面积相对于最终剂量(例如,最终负荷剂量)时的非灌注面积减少10%或更多,例如15%或更多、25%或更多、50%或更多、75%或更多、90%或更多、或约100%,则治疗结果可以保持。在一些实施方案中,如果非灌注的面积相对于最终剂量(例如,最终负荷剂量)时的非灌注面积没有增加10%或更多,例如15%或更多、25%或更多、50%或更多、75%或更多、90%或更多、或约100%,则治疗结果可以保持。在一些实施方案中,如果非灌注的面积相对于最后一次评估时(例如,4周前)测量的非灌注的面积没有增加10%或更多,例如15%或更多、25%或更多、50%或更多、75%或更多、90%或更多、或约100%,则治疗结果可以保持。在一些实施方案中,如果非灌注的面积相对于在受试
者中测量的最小非灌注面积没有增加10%或更多,例如15%或更多、25%或更多、50%或更多、75%或更多、90%或更多、或约100%,则治疗结果可以保持。
[0218]
根据本公开的方法,在施用最终剂量(例如,最终负荷剂量)后,抗vegf疗法的治疗结果在最终剂量(例如,最终负荷剂量)后可以保持至少8周或更多,例如,至少10周或更多、至少12周或更多、至少14周或更多、至少16周或更多、至少20周或更多、至少24周或更多、至少28周或更多、至少32周或更多、至少36周或更多、至少40周或更多、至少44周或更多、至少48周或更多,包括至少52周或更多。在一些实施方案中,在施用最终负荷剂量后,治疗结果可保持8周至1年的时间段,例如8周至40周、8周至32周,包括12周至28周的时间段。这可以是针对本文提供的任何一种或多种眼部病症,包括例如rvo、dme、dr和/或wamd。
[0219]
在一些实施方案中,所述方法包括:向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的一个、两个或三个负荷剂量,和在最终负荷剂量后,施用抗vegf抗体缀合物(例如,ksi-301)(或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物))的一个或多个后续剂量(例如维持剂量)。可以以不超过每8周,例如每10周、每12周、每14周、每16周、每18周、每20周、每24周、每28周、每32周、每40周,包括每52周一次的频率,向受试者施用后续剂量。是否施用抗vegf抗体缀合物的后续剂量可以基于任何方便的原因来确定。在一些实施方案中,可以基于预定的方案(例如,在受试者被施用一个或多个负荷剂量中的任何一个之前确定的方案)来施用后续剂量。在一些实施方案中,可以基于预定的方案来施用后续剂量,所述预定的方案基于眼部病症的严重程度、受试者先前对眼部病症的其他疗法的反应或缺乏反应、或与受试者相关的任何其他临床相关因素。在一些实施方案中,可以基于在用抗vegf抗体缀合物治疗的过程中对受试者进行的一种或多种关于眼睛健康和/或功能的评估试验的结果来施用后续剂量。在一些实施方案中,可以基于每4周或更多周,例如每6周或更多周、每8周或更多周、每10周或更多周、每12周或更多周、每16周或更多周、每20周或更多周、每24周或更多周、每28周或更多周、每32周或更多周、每36周或更多周,包括每40周或更多周,对受试者进行的一次或多次评估试验的结果来施用后续剂量。在一些实施方案中,如果一个或多个评估试验表明抗vegf疗法的治疗结果的减少大于预定阈值,则可以施用后续剂量。
[0220]
如本文所用,“q4w”、“q8w”等是指给药方案,并且对本领域普通技术人员具有普通和惯用的含义。数字可以表示由后续字母规定的时间单位的数目。“w”表示以周为单位;“m”规定以月为间隔。因此,q4w指4周的给药间隔,也包括1个月的给药间隔;q8w指8周的给药间隔,也包括2个月的给药间隔;等等。如本文所用,给药方案的说明不一定意味着超过两个的剂量数,除非另有说明。在一些实施方案中,给药方案是指维持剂量的给药方案(包括最终负荷剂量和第一维持剂量之间的间隔)。提及给药方案“更长”或“更短”(例如,“q12w或更长”)是指剂量之间的时间间隔长于指定的时间间隔(例如,12周或更长的给药间隔)。
[0221]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的第一年向受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是10次或更少、9次或更少、8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前两年向受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是10次或更少、9次或更少、8次或更少、7次或更少、6次或更少、5次
或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前三年向受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是10次或更少、9次或更少、8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。
[0222]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在一年的治疗期内向受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在两年的治疗期内向受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在三年的治疗期内向受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、1次或更少、或零。
[0223]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的第一年向wamd受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前两年向wamd受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前三年向wamd受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。
[0224]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在一年的治疗期内向wamd受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在两年的治疗期内向wamd受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在三年的治疗期内向wamd受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为4次或更少、3次或更少、2次或更少、1次或更少、或零。
[0225]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的第一年向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前两年向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前三年向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维
持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。
[0226]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗期间在一年的时间段内向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗期间在两年的时间段内向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗期间在三年的时间段内向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为4次或更少、3次或更少、2次或更少、1次或更少、或零。
[0227]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的第一年向rvo受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前两年向rvo受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗的前三年向rvo受试者施用的抗vegf抗体缀合物(例如,ksi-301)的注射总数(包括负荷剂量和维持剂量)是8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、3次或更少、2次或更少、或1次。
[0228]
在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗期间在一年的时间段内向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为5次或更少、4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗期间在两年的时间段内向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为5次或更少、4次或更少、3次或更少、2次或更少、1次或更少、或零。在一些实施方案中,为了保持抗vegf抗体缀合物疗法的治疗结果,在治疗期间在三年的时间段内向dme受试者施用的抗vegf抗体缀合物(例如,ksi-301)的维持剂量的总数为5次或更少、4次或更少、3次或更少、2次或更少、1次或更少、或零。
[0229]
在一些实施方案中,在最终负荷剂量后的第一时间施用第一后续剂量,并在第一后续剂量后的第二时间段施用第二后续剂量,其中在最终负荷剂量和第一后续剂量之间,或在第一后续剂量和第二后续剂量之间不施用其他剂量。第一和第二后续剂量之间的第二时间段可以与最终负荷剂量和第一后续剂量之间的第一时间段相同或不同。在一些实施方案中,第一时间段是8周或更长,例如,10周或更长、12周或更长、14周或更长、16周或更长、18周或更长、20周或更长、24周或更长、28周或更长、32周或更长、36周或更长、40周或更长、至少44周或更长、至少48周或更长,包括52周或更长。在一些实施方案中,第二时间段比第一时间段长0周或更多,例如长4周或更多、长6周或更多、长8周或更多、长10周或更多、长12周或更多、长16周或更多、长20周或更多,包括长24周或更多。施用第二后续剂量的时间可取决于一次或多次对受试者眼部健康和/或功能的评估的结果。
[0230]
可以以后续剂量(例如,维持剂量)向受试者施用任何合适量的抗vegf抗体缀合物或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)。在一些实施方案中,后续剂量包括约1mg或更多,例如约1.25mg或更多、约1.5mg或更多、约1.75mg或更多、约2mg或更多、约2.5mg或更多、约3mg或更多、约3.5mg或更多、约4mg或更多、约4.5m或更多,包括约5mg或更多(按抗vegf抗体部分的重量计)的抗vegf抗体缀合物。在一些实施方案中,后续剂量包括约1mg至约10mg,例如约1mg至约7.5mg、约1.25mg至约5mg,包括约2mg至约5mg(按抗vegf抗体部分的重量计)的抗vegf抗体缀合物。
[0231]
由于抗vegf疗法的治疗结果在最终剂量(例如,最终负荷剂量)后持续一段时间,因此受试者可能不需要接受抗vegf抗体缀合物或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的剂量,而治疗效果维持。在一些实施方案中,在最终剂量(例如,最终负荷剂量)后的4周或更长时间内,例如,6周或更长时间内、8周或更长时间内、10周或更长时间内、12周或更长时间内、14周或更长时间内、16周或更长时间内、20周或更长时间内、24周或更长时间内、28周或更长时间内、32周或更长时间内、36周或更长时间内、40周或更长时间内、44周或更长时间内、48周或更长时间内,包括52周或更长时间内,不再对受试者施用抗vegf抗体缀合物或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)。
[0232]
本公开的方法可以包括:在最终负荷剂量后,施用比照护标准治疗中的注射次数更少的(抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的)注射次数,以维持治疗结果。在一些实施方案中,在最终负荷剂量后施用的(例如抗vegf抗体缀合物的)平均注射次数为在16周内约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、约0.4或更少、约0.35或更少、约0.3或更少、约0.25或更少、约0.2或更少、约0.18或更少、约0.17或更少、或由任意两个前述值定义的范围内的数字。在一些实施方案中,在最终负荷剂量后施用的(例如抗vegf抗体缀合物的)平均注射次数为在12周内约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、约0.4或更少、约0.35或更少、约0.3或更少、约0.25或更少、约0.2或更少、约0.18或更少、约0.17或更少、或由任意两个前述值定义的范围内的数字。在一些实施方案中,在最终负荷剂量后施用的(抗vegf抗体缀合物,例如,ksi-301)的平均注射次数为在8周内约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、约0.4或更少、约0.35或更少、约0.3或更少、约0.25或更少、约0.2或更少、约0.18或更少、约0.17或更少、或由任意两个前述值定义的范围内的数字。
[0233]
在一些实施方案中,受试者患有dme,并且在最终负荷剂量后施用的(抗vegf抗体缀合物,例如,ksi-301)的平均注射次数为在16周内约1.75或更少、约1.5或更少、约1.25或更少、约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、约0.4或更少、约0.35或更少、约0.3或更少、约0.25或更少、约0.2或更少、或由任意两个前述值定义的范围内的数字。在一些实施方案中,受试者患有dme,并且在最终负荷剂量后施用的(抗vegf抗体缀合物,例如,ksi-301)的平均注射次数为在12周内约1.75或更少、约1.5或更少、约1.25或更少、约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、约0.4或更少、约0.35或更少、约0.3或更少、约0.25或更少、约0.2或更少、或由任意两个前述值定义的范围内的数字。在一些实施方案中,受试者患有dme,并且在最终负荷剂量后施用的(抗vegf抗体缀合物,例如,ksi-301)的平均注射次数为在8周内约
1.75或更少、约1.5或更少、约1.25或更少、约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、约0.4或更少、约0.35或更少、约0.3或更少、约0.25或更少、约0.2或更少、或由任意两个前述值定义的范围内的数字。
[0234]
在一些实施方案中,受试者患有rvo,并且在最终负荷剂量后施用的(抗vegf抗体缀合物,例如,ksi-301)的平均注射次数为在16周内约2.75或更少、约2.5或更少、约2.25或更少、约2或更少、约1.75或更少、约1.5或更少、约1.25或更少、约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、或由任意两个前述值定义的范围内的数字。在一些实施方案中,受试者患有rvo,并且在最终负荷剂量后施用的(抗vegf抗体缀合物,例如,ksi-301)的平均注射次数为在12周内约2.75或更少、约2.5或更少、约2.25或更少、约2或更少、约1.75或更少、约1.5或更少、约1.25或更少、约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、或由任意两个前述值定义的范围内的数字。在一些实施方案中,受试者患有rvo,并且在最终负荷剂量后施用的(抗vegf抗体缀合物,例如,ksi-301)的平均注射次数为在8周内约2.75或更少、约2.5或更少、约2.25或更少、约2或更少、约1.75或更少、约1.5或更少、约1.25或更少、约1或更少、约0.9或更少、约0.8或更少、约0.7或更少、约0.5或更少、约0.45或更少、或由任意两个前述值定义的范围内的数字。
[0235]
在一些实施方案中,通过本发明方法治疗的眼部病症包括以下中的一种或多种:年龄相关性黄斑变性(amd)、糖尿病性黄斑水肿(dme)、视网膜静脉阻塞(rvo)(例如,视网膜中央静脉阻塞(crvo)和视网膜中央分支静脉阻塞(brvo))、糖尿病性视网膜病变(dr)(例如,非增殖性dr和增殖性dr)和推定的眼组织胞浆菌病综合征。在一些实施方案中,通过本公开的方法治疗的受试者患有湿性amd。在一些实施方案中,受试者患有湿性amd,但没有高色素上皮脱离(ped)。在一些实施方案中,当受试者眼睛中的基线中心子区视网膜厚度(cst)为500微米或更大时,受试者具有高ped。
[0236]
在一些实施方案中,患有眼部病症的受试者在接受根据本公开的方法的治疗之前具有约200微米或更大、约250微米或更大、约275微米或更大、约300微米或更大、约325微米或更大、约350微米或更大、约375微米或更大、约400微米或更大、约425微米或更大、约450微米或更大、约475微米或更大、约500微米或更大、约525微米或更大、约550微米或更大、约575微米或更大、约600微米或更大、约625微米或更大、约650微米或更大、约675微米或更大、约700微米或更大、约725微米或更大、约750微米或更大、约775微米或更大、约800微米或更大、约825微米或更大、约850微米或更大、约875微米或更大、约900微米或更大、或者由任意两个前述值定义的范围内的距离的cst。cst可通过例如光学相干断层扫描(oct)进行测量。
[0237]
在一些实施方案中,患有眼部病症的受试者在接受根据本公开的方法的治疗之前具有约80或更低、约75或更低、约70或更低、约68或更低、约66或更低、约64或更低、约62或更低、约60或更低、约58或更低、约56或更低、约54或更低、约52或更低、约50或更低、约48或更低、约46或更低、约44或更低、约42或更低、约40或更低、或在由任意两个前述值定义的范围内的bcva(以etdrs字母计)。
[0238]
在一些实施方案中,本公开的方法包括:向需要治疗wamd或dme的受试者(例如人类或其他哺乳动物受试者)施用抗vegf抗体缀合物(例如,ksi-301)(或抗vegf蛋白质缀合
物(例如,阿柏西普生物聚合物缀合物))的第一负荷剂量,及随后施用至少一次,但不超过两次的负荷剂量以达到抗vegf疗法的治疗结果(例如,改善视力、减轻症状等),其中治疗结果在施用最终负荷剂量后保持至少12周。在一些实施方案中,治疗结果在施用最终负荷剂量后保持至少14周,例如至少16周、至少20周、至少24周、至少28周、至少32周、至少36周、至少40周、至少44周、至少48周,包括至少52周。
[0239]
在一些实施方案中,所述眼部病症是wamd,并且所述方法包括:在最终负荷剂量约24个月后,施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的后续剂量。在一些实施方案中,所述眼部病症是湿性amd,没有高色素上皮脱离(ped)。在一些实施方案中,当受试者眼睛中的基线中心子区视网膜厚度(cst)为500微米或更大时,受试者具有高ped。
[0240]
在一些实施方案中,通过本发明方法治疗的受试者患有rvo。在一些实施方案中,本公开的方法包括:向需要治疗rvo的受试者(例如人类患者)施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的第一负荷剂量,及随后施用一个以上负荷剂量以达到抗vegf疗法的治疗结果(例如,改善视力、减轻症状等),其中治疗结果在施用最终负荷剂量后保持至少8周。在一些实施方案中,治疗结果在施用最终负荷剂量后保持至少10周,例如至少12周、至少14周、至少16周、至少20周、至少24周、至少28周、至少32周、至少36周、至少40周,包括至少52周。在一些实施方案中,所述方法还包括在最终负荷剂量之后施用抗vegf抗体缀合物(例如,ksi-301)的一个或多个后续剂量(例如维持剂量)。可以以不超过每8周,例如每10周、每12周、每14周、每16周、每18周、每20周、每24周、每28周、每32周、每36周、每40周、每44周、每48周,包括每52周一次的频率,向受试者施用后续剂量。
[0241]
本文还提供了治疗患有眼部病症的受试者的方法,其中所述方法包括:向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的1至3个负荷剂量,但不超过3个负荷剂量,和在不早于施用最终负荷剂量后的14周,提供抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续应用。在一些实施方案中,抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续应用在施用最终负荷剂量后不早于16周,例如不早于18周、不早于20周、不早于24周、不早于28周、不早于32周、不早于36周,包括不早于40周提供。在一些实施方案中,所治疗的眼部病症是dme。
[0242]
还提供了治疗患有眼部病症的受试者的方法,其中所述方法包括:在一个月、两个月或三个月内,向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的每月负荷剂量,和在最终负荷剂量后不少于每8周施用抗vegf抗体缀合物的一个或多个后续剂量。在一些实施方案中,所述眼部病症是amd(例如,wamd)、dme、rvo或dr。在一些实施方案中,所述眼部病症是rvo。在一些实施方案中,所述眼部病症wamd、dme或dr,并且抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量在最终负荷剂量后不少于每12周,例如,每16周、每20周、每24周、每28周、每32周、每36周、每40周,包括每52周施用。在一些实施方案中,所述眼部病症为wamd,且抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量不少于每12周施用。在一些实施方案中,所述眼部病症是湿性amd,没有高色素上皮脱离(ped)。在一些实施方案中,当受试者眼睛中的基线中心子区视网膜厚度(cst)为500微米或更大时,受试者具有高ped。
[0243]
在一些实施方案中,本公开的方法包括:向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的至少一个且至多三个负荷剂量,从而实现抗vegf疗法的治疗结果,在最终负荷剂量后评估受试者的眼部健康,以确定抗vegf疗法的治疗结果是否得以保持,和在最终负荷剂量后的至少8周内不施用抗vegf抗体缀合物或抗vegf蛋白质缀合物的任何后续剂量,直到确定抗vegf疗法不再保持。在一些实施方案中,所述眼部病症是amd(例如,wamd)、dme或rvo。在一些实施方案中,所述眼部病症是rvo。在一些实施方案中,所述眼部病症是wamd或dme,且抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量在最终负荷剂量后至少12周施用。在一些实施方案中,所述眼部病症是wamd,并且所述方法包括:在最终负荷剂量约24个月后,施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的后续剂量。在一些实施方案中,所述眼部病症是湿性amd,没有高色素上皮脱离(ped)。在一些实施方案中,当受试者眼睛中的基线中心子区视网膜厚度(cst)为500微米或更大时,受试者具有高ped。
[0244]
在一些实施方案中,本公开的方法包括:向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的至少一个且至多三个负荷剂量,以达到抗vegf疗法的治疗结果(例如,改善视力、减轻症状等),及在最终负荷剂量后不少于每8周施用抗vegf抗体缀合物或抗vegf蛋白质缀合物的一个或多个后续剂量,其中抗vegf疗法的治疗结果与在最终负荷剂量后每4周施用抗vegf抗体缀合物或抗vegf蛋白质缀合物的一个或多个后续剂量一样有效。在一些实施方案中,所述眼部病症是amd(例如,wamd)、dme或rvo。在一些实施方案中,所述眼部病症是rvo。在一些实施方案中,所述眼部病症是wamd或dme,并且抗vegf抗体缀合物的后续剂量在最终负荷剂量后不低于每12周施用一次,其中抗vegf疗法的治疗结果与在最终负荷剂量后每4周施用抗vegf抗体缀合物的一个或多个后续剂量一样有效。在一些实施方案中,所述眼部病症是wamd,并且所述方法包括:在最终负荷剂量约24个月后,施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的后续剂量。在一些实施方案中,所述眼部病症是湿性amd,没有高色素上皮脱离(ped)。在一些实施方案中,当受试者眼睛中的基线中心子区视网膜厚度(cst)为500微米或更大时,受试者具有高ped。
[0245]
根据一些实施方案,本公开的方法包括:向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的至少一个且至多三个负荷剂量,以达到抗vegf疗法的治疗结果(例如,改善视力、减轻症状等),及在最终负荷剂量后不少于每12周施用抗vegf抗体缀合物的一个或多个后续剂量,其中抗vegf疗法的治疗结果与眼部病症的照护标准治疗的治疗结果一样有效,其中所述照护标准治疗包括施用三个每月负荷剂量的照护标准治疗剂,并且在照护标准治疗剂的最终负荷剂量后,每8周或每4周施用一个或多个后续剂量的照护标准治疗剂。在一些实施方案中,眼部病症是wamd。在一些实施方案中,眼部病症是湿性amd,没有高色素上皮脱离(ped)。在一些实施方案中,当受试者眼睛中的基线中心子区视网膜厚度(cst)为500微米或更大时,受试者具有高ped。在一些实施方案中,照护标准治疗剂是阿柏西普。在一些实施方案中,在抗vegf抗体缀合物的最终负荷剂量后,抗vegf抗体缀合物的后续剂量不少于每16周,例如不少于每20周、不少于每24周、不少于每28周,包括不少于每32周施用。
[0246]
本文还提供了在患有dme的受试者中进行眼睛再灌注的方法,其中所述方法包括:确定患有dme、dr或rvo的受试者,向所述受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的至少2个负荷剂量,和向所述受试者提供抗vegf抗体缀合物或抗vegf蛋白质缀合物的一个或多个进一步的剂量,直到所述受试者在至少一只眼睛中表现出再灌注。可使用任何合适的措施监测眼睛的再灌注。在一些实施方案中,眼睛的再灌注由与治疗前状态相比的血管计数(例如视网膜组织中的血管计数)的增加决定。可以使用任何合适的方法监测眼睛的再灌注,所述方法包括但不限于oct血管造影术(oct-a)、荧光素血管造影或超宽视野荧光素血管造影。在一些实施方案中,所述方法提供了改善的眼睛灌注,如测得的与治疗前非灌注面积相比,非灌注面积减少至少10%,例如至少20%、至少30%、至少50%、至少75%、至少90%,包括约100%。在一些实施方案中,所述方法提供了眼睛的再灌注,如测得的与治疗前非灌注面积相比,非灌注面积减少10%至100%,例如10%至75%、10%至50%,包括10%至30%。在一些实施方案中,与治疗前水平相比,改善的灌注提供了受试者视敏度的至少10%的恢复,例如至少20%的恢复、至少30%的恢复、至少50%的恢复、至少75%的恢复、至少90%的恢复,包括大约100%的恢复。在一些实施方案中,与治疗前水平相比,改善的灌注提供了受试者视敏度的10%至100%之间的恢复,例如10%至90%之间的恢复、10%至75%之间的恢复、10%至50%之间的恢复,包括10%至30%之间的恢复。
[0247]
可以以任何合适的时间间隔向受试者施用负荷剂量,以达到所需的治疗结果。在一些实施方案中,施用负荷剂量,其中在每个负荷剂量之间间隔3周或更长,例如,4周或更长、1个月或更长、5周或更长、6周或更长、8周或更长、12周或更长,包括16周或更长。当有两个以上的负荷剂量时,每个负荷剂量之间的时间段可以相同,也可以不同。在一些实施方案中,一些负荷剂量可以以相同的间隔施用,而一些其他负荷剂量可以以不同的间隔施用。
[0248]
可以以负荷剂量向受试者施用任何合适量的抗vegf抗体缀合物或抗vegf蛋白质缀合物。在一些实施方案中,负荷剂量包括约1mg或更多,例如约1.25mg或更多、约1.5mg或更多、约1.75mg或更多、约2mg或更多、约2.5mg或更多、约3mg或更多、约3.5mg或更多、约4mg或更多、约4.5m或更多,包括约5mg或更多(按抗vegf抗体部分的重量计)的抗vegf抗体缀合物。在一些实施方案中,负荷剂量包括约1mg至约10mg,例如约1mg至约7.5mg、约1.25mg至约5mg,包括约2mg至约5mg(按抗vegf抗体部分的重量计)的抗vegf抗体缀合物。
[0249]
本文还提供了通过向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)来治疗眼部病症的方法,其中抗vegf抗体缀合物或抗vegf蛋白质缀合物的单剂量足以获得抗vegf疗法的治疗效果。在一些实施方案中,通过单剂量的抗vegf抗体缀合物或抗vegf蛋白质缀合物获得持久的治疗效果,而不施用任何负荷剂量(例如,在治疗方案中不具有每月负荷剂量的负荷阶段)。在一些实施方案中,所述眼部病症是非增殖性dr。在一些实施方案中,向患有非增殖性dr的患者施用vegf抗体缀合物或抗vegf蛋白质,以改善受试者的至少一只眼睛的灌注。
[0250]
可以以剂量向受试者施用任何合适量的抗vegf抗体缀合物或抗vegf蛋白质缀合物。在一些实施方案中,所述剂量包括1mg或更多,例如1.25mg或更多、1.5mg或更多、1.75mg或更多、2mg或更多、2.5mg或更多、3mg或更多、3.5mg或更多、4mg或更多、4.5mg或更多,包括5mg或更多(按抗vegf抗体部分的重量计)的抗vegf抗体缀合物。在一些实施方案中,所述剂
量包括1mg至10mg,例如1mg至7.5mg、1.25mg至5mg,包括2mg至5mg(按抗vegf抗体部分的重量计)的抗vegf抗体缀合物。
[0251]
在一些实施方案中,本公开的方法提供了用于眼部病症的抗vegf疗法,其中降低了眼内炎症(例如,睑缘炎、传染性结膜炎、角膜炎、巩膜炎、眼内炎)的风险。在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的玻璃体内施用与眼内炎症的风险降低相关,例如,与眼部病症的照护标准治疗相比。在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的玻璃体内施用不会引起眼内炎症。
[0252]
在一些实施方案中,再治疗wamd包括以下一项或多项:
[0253]
–
与第12周相比,cst增加≥75μm,bcva减少≥5个字母,或
[0254]
–
由于wamd活动恶化,与第1天相比,bcva减少》5个字母,或
[0255]
–
由于wamd活动恶化,与最佳既往bcva相比,bcva减少≥10个字母。
[0256]
在一些实施方案中,再治疗wamd包括以下一项或多项:
[0257]
–
与第12周相比,cst增加≥50μm,bcva减少≥5个字母,或
[0258]
–
由于wamd活动恶化,与最佳既往bcva相比,bcva减少》10个字母,或
[0259]
–
与第12周相比,增加≥75微米,或
[0260]
–
新的黄斑出血
[0261]
在一些实施方案中,再治疗dme和rvo包括以下一项或多项:
[0262]
–
与第12周或既往访视相比,cst增加≥75μm,bcva减少≥5个字母,或
[0263]
–
由于dme/rvo疾病活动恶化,与最佳既往bcva相比,bcva减少≥10个字母
[0264]
在一些实施方案中,受试者在一年的持续时间内,包括在超过1、2、3或4年的持续时间内,需要不超过0、1、2、3、4、5或6次再治疗事件。
[0265]
在一些实施方案中,当一种或多种上述标准出现时,进行再治疗。在一些实施方案中,再治疗是受试者最终负荷剂量或治疗后的治疗。负荷剂量是最初提供以使患者或受试者体内的药物量达到具有初始治疗效果的所需水平的剂量。相比之下,再治疗剂量或维持剂量是在既往剂量(最终负荷剂量或再治疗/维持剂量)的有效性降低之后,或按照预定的间隔,为使受试者恢复药物的治疗效果而提供的剂量。
[0266]
在一些实施方案中,该方法涉及:如果满足下列再治疗标准中的至少一个,则通过玻璃体内注射抗体或其缀合物(例如,ksi-301)进行再治疗。在一些实施方案中,该标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。在一些实施方案中,受试者患有wamd,且标准为以下一项或多项:与第12周相比,oct中心子区视网膜厚度(cst)增加≥75μm,bcva减少≥5个字母;由于wamd疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的视网膜下出血),与第1天相比,bcva减少≥10个字母;和/或由于wamd疾病活动恶化,与最佳既往bcva相比,bcva减少≥10个字母。在一些实施方案中,受试者患有dme或rvo,且标准为以下一项或多项:与第12周或既往访视(两次访视之间相隔4周)相比,oct中心子区视网膜厚度(cst)增加≥75μm,bcva减少≥5个字母;和/或由于dme/rvo疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的渗出物),与最佳既往bcva相比,bcva减少≥10个字母。
[0267]
在一些实施方案中,该方法涉及:如果满足下列再治疗标准中的至少一个,则通过
玻璃体内注射抗体或其缀合物(例如,ksi-301)进行再治疗。在一些实施方案中,该标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。在一些实施方案中,受试者患有wamd,且标准为以下一项或多项:与第12周相比,oct中心子区视网膜厚度(cst)增加≥50μm,bcva减少≥5个字母;由于wamd疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的视网膜下出血),与最佳既往bcva相比,bcva减少≥10个字母;oct中心子区视网膜厚度(cst)增加≥75μm;和/或新的黄斑出血。
[0268]
在一些实施方案中,在最终负荷剂量后的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或更多周内,不对受试者给予再治疗剂量。在一些实施方案中,施用1个负荷剂量,且在最终负荷剂量后的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或更多周内,不对受试者给予再治疗剂量。在一些实施方案中,给予受试者2个负荷剂量,且在最终负荷剂量后的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或更多周内,不给予再治疗剂量。在一些实施方案中,给予受试者3个负荷剂量,且在最终负荷剂量后的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或更多周内,不给予再治疗剂量。在一些实施方案中,给予受试者1-2个负荷剂量,且在最终负荷剂量后的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或更多周内,不给予再治疗剂量。在一些实施方案中,给予受试者1-3个负荷剂量,且在最终负荷剂量后的至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或更多周内,给予1、2、3或4个再治疗剂量。在一些实施方案中,向受试者施用不超过2、3、4或5个负荷剂量。在一些实施方案中,不向受试者提供第4个负荷剂量。在一些实施方案中,上述治疗方法允许受试者的视力保持改善在第一、第二或第三负荷剂量后达到的水平或与之接近。在一些实施方案中,上述治疗方法允许受试者的视力保持改善至不需要对受试者进行再治疗的程度。
[0269]
在一些实施方案中,本公开的方法可以提供长的给药间隔并且仍然维持抗vegf抗体缀合物(例如,ksi-301)治疗或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)疗法的治疗结果。在一些实施方案中,至少75%的根据本公开的方法治疗的患者可以基于q4m给药间隔。在一些实施方案中,至少90%的根据本公开的方法治疗的患者可以基于q4m给药间隔。在一些实施方案中,至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%的根据本公开的方法治疗的患者可以基于q4m给药间隔。在一些实施方案中,约40%至约95%,例如约45%至约90%、约50%至约85%、约55%至约85%、约60%至约85%、约65%至约85%,包括约70%至约80%的根据本公开的方法治疗的患者可以基于q4m给药间隔。在一些实施方案中,至少75%的根据本公开的方法治疗的患者可以基于q5m给药间隔。在一些实施方案中,至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%的根据本公开的方法治疗的患者可以基
于q5m给药间隔。在一些实施方案中,约40%至约95%,例如约45%至约90%、约50%至约85%、约55%至约85%、约60%至约85%、约65%至约85%,包括约70%至约80%的根据本公开的方法治疗的患者可以基于q5m给药间隔。在一些实施方案中,至少55%的根据本公开的方法治疗的患者可以基于q6m给药间隔。在一些实施方案中,至少70%的根据本公开的方法治疗的患者可以基于q6m给药间隔。在一些实施方案中,至少75%的根据本公开的方法治疗的患者可以基于q6m给药间隔。在一些实施方案中,至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、或至少80%的根据本公开的方法治疗的患者可以基于q6m给药间隔。在一些实施方案中,约30%至约85%,例如约30%至约80%、约35%至约75%、约40%至约70%、约45%至约65%、约50%至约65%,包括约50%至约60%的根据本公开的方法治疗的患者可以基于q6m给药间隔。
[0270]
在一些实施方案中,基于q5m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有至少75%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q5m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、或至少80%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q5m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有约40%至约95%,例如约45%至约90%、约50%至约85%、约55%至约85%、约60%至约85%、约65%至约85%,包括约70%至约80%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q6m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有至少55%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q6m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有至少70%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q6m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有至少80%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q6m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有至少30%、至少35%、至少40%、至少45%、至少50%、至少55%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q6m给药间隔,根据本公开的方法治疗的患者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的患者)具有约30%至约85%,例如约30%至约80%、约35%至约75%、约40%至约70%、约45%至约65%、约50%至约65%,包括约50%至约60%的机会维持抗vegf疗法的治疗结果。
[0271]
在一些实施方案中,基于q4m给药间隔,根据本公开的方法治疗的患有rvo的患者具有至少75%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q5m给药间隔,根据本公开的方法治疗的患有rvo的患者具有至少80%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q5m给药间隔,根据本公开的方法治疗的患有rvo的患者具有至少90%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q4m给药间隔,根据本公开的方法治疗的患有rvo的患者具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%或至少900%的机会维持抗vegf疗法的治疗结果。在一些实施方案中,基于q4m给药间隔,根据本公开的方法治疗的患有rvo的患者具有约40%至约95%,例
如约45%至约95%、约50%至约95%、约55%至约95%、约60%至约95%、约65%至约95%,包括约70%至约90%的机会维持抗vegf疗法的治疗结果。
[0272]
在一些实施方案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用1、2、3、4、5或6个负荷剂量(抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约28周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用3个负荷剂量(抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约28周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0273]
在一些实施方案中,已经根据本公开的一些方法施用了(抗vegf抗体缀合物,例如ksi-301的)1、2、3、4、5或6个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约28周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)(或者,可以持续至少0.5、0.6、0.7、0.8、0.9、1、11.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19、20年或更长时间,而不需要随后再次注射ksi-301(或者,抗vegf蛋白质治疗剂,例如阿柏西普生物缀合物))。在一些实施方案中,已经根据本公开的一些方法施用了(抗vegf抗体缀合物,例如ksi-301的)3个负荷剂量的wamd受试者有约70%或更多的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约28周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方案中,已经根据本公开的一些方法施用了(抗vegf抗体缀合物,例如,ksi-301的)3个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约28周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0274]
在一些实施方案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用1、2、3、4、5或6个负荷剂量(抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约24周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方
案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用3个负荷剂量(抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约24周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0275]
在一些实施方案中,已经根据本公开的一些方法施用了(抗vegf抗体缀合物,例如,ksi-301的)1、2、3、4、5或6个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约24周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方案中,已经根据本公开的一些方法施用了(例如,ksi-301的)3个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约24周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0276]
在一些实施方案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用1、2、3、4、5或6个负荷剂量(抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约20周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用3个负荷剂量(例如,抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约20周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0277]
在一些实施方案中,已经根据本公开的一些方法施用了(抗vegf抗体缀合物,例如,ksi-301的)1、2、3、4、5或6个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约20周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方案中,已经根据本公开的一些方法施用了(抗vegf抗体缀合物,例如,ksi-301的)3个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、
85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约20周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0278]
在一些实施方案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用1、2、3、4、5或6个负荷剂量(抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约16周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方案中,50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的根据本公开的一些方法施用3个负荷剂量(抗vegf抗体缀合物(例如,ksi-301)的负荷剂量)的受试者(例如患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)在最终负荷剂量后或最后一次再治疗剂量后的至少约16周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0279]
在一些实施方案中,已经根据本公开的一些方法施用了(抗vegf抗体缀合物,例如,ksi-301的)1、2、3、4、5或6个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约16周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。在一些实施方案中,已经根据本公开的一些方法施用了(例如,ksi-301的)3个负荷剂量的受试者(例如,患有眼部病症(例如但不限于wamd、rvo或dme)的受试者)有50%或更多、55%或更多、60%或更多、65%或更多、70%或更多、75%或更多、80%或更多、85%或更多、90%或更多、95%或更多、或约100%、或由前面任意两个值定义的范围内的百分比的机会在最终负荷剂量后或最后一次再治疗剂量后的至少约16周内不接受再治疗剂量(例如,由于疾病活动符合一个或多个再治疗标准)。
[0280]
在一些实施方案中,对于本文提供的任何眼部病症(例如,wamd、rvo和/或dme),2或3个负荷剂量将提供病症的永久消退,使得不需要进一步的再治疗剂量或维持剂量。在一些实施方案中,对于本文提供的任何眼部病症(例如,wamd、rvo和/或dme),2或3个负荷剂量将提供1、2、3、4、5、6、7、8、9、10年或更长时间的对病症的有效抑制,使得在该时间段期间不需要维持剂量的进一步再治疗。
[0281]
在一些实施方案中,任何上述给药方案均来自任何眼部病症。在一些实施方案中,其用于治疗和/或预防rvo、amd、wamd和/或dme和/或本文提供的任何其它病症。
[0282]
在一些实施方案中,wamd患者通过使用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)获得3至6个月的持久性。
[0283]
在一些实施方案中,dme患者通过使用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),仅用3个负荷剂量,就实现了3至5+个月的持久性。在一些实施方案中,dme患者通过使用抗vegf抗体缀合物(例如,ksi-301)或
抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),仅用3个负荷剂量,就实现了3至6+个月的持久性。
[0284]
在一些实施方案中,rvo患者通过使用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),仅用3个负荷剂量,即可实现2至4+个月的持久性。在一些实施方案中,rvo患者通过使用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),仅用3个负荷剂量,就实现了2至5+个月的持久性。
[0285]
在一些实施方案中,通过使用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),用3个负荷剂量,实现了pdr的持续改善。
[0286]
在一些实施方案中,通过使用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),实现了dme和rvo中负荷剂量的数量降低。在一些实施方案中,湿性amd的给药方案为:每3至5个月一次(尽管一些wamd患者可受益于每8周一次的给药)。在一些实施方案中,dme的给药方案为每3至6个月一次。在一些实施方案中,rvo的给药方案为每8周或更长时间(例如,6个月)一次。在一些实施方案中,糖尿病性视网膜病变(无糖尿病性黄斑水肿)的给药方案为每3个月或更长时间一次(例如,每4个月或每6个月一次)。在一些实施方案中,给药方案可用于治疗糖尿病性视网膜病变(非增殖性糖尿病性视网膜病变和增殖性糖尿病性视网膜病变)。
[0287]
在一些实施方案中,在负荷剂量后接受一次以上再治疗的rvo患者,第二次再治疗的时间长于第一次再治疗的时间。这也是令人惊讶和意外的。
[0288]
在一些实施方案中,向受试者施用的抗体的量将在1和5mg之间,例如1.25(25微升)、2.5(50微升)或5mg(100微升)。
[0289]
在一些实施方案中,仅施用两个负荷剂量,然后每八周施用一次再治疗剂量(例如,用于rvo)。在rvo的情况下,仅使用两个负荷剂量或甚至三个负荷剂量,并具有与每月一次一样好的结果,是令人惊讶和意想不到的(因为数据显示lucentis、eylea和avastin都需要每月一次给药以获得基本结果)。在一些实施方案中,对于dme使用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),有可能用3个负荷剂量获得良好的结果,而其他抗体系统需要4或5个每月负荷剂量。
[0290]
在一些实施方案中,对于非增殖性dr,可避免任何负荷剂量或仅包括单一负荷剂量以获得治疗。
[0291]
在一些实施方案中,可以降低患有非增殖性或增殖性糖尿病性视网膜病变的患者的糖尿病性视网膜病变的严重程度。使用与dme相同的治疗方案(3个负荷剂量,然后q12w或更少的频率),或使用“无负荷剂量或2个负荷剂量,然后每3、4或6个月一次”,可以达到这一结果。在一些实施方案中,结果量度是:1)在视网膜的标准彩色照片上糖尿病性视网膜病变严重程度状态的2个或更多级的改善,或2)使用照片,预防drss恶化2个或更多级。在一些实施方案中,再治疗的频率低于每8周一次。
[0292]
在一些实施方案中,给药方案可用于非增殖性dr,使用1至2个负荷剂量,或仅1个负荷剂量且不超过此。再治疗可在其后不早于12或16或24周发生。
[0293]
在一些实施方案中,对于增殖性dr,可施用3个每月负荷剂量,随后每12周或更长时间施用一次。
[0294]
在一些实施方案中,提供了施用抗vegf抗体缀合物或抗vegf蛋白质缀合物的方法,其中患者进入负荷阶段(例如,2个负荷剂量q4周),然后在8周时进行再治疗,然后第二次再治疗的时间比第一次再治疗的时间长(例如,16+周)。在一些实施方案中,这反映了“疾病改善”。
[0295]
在一些实施方案中,可将抗vegf抗体缀合物(例如ksi-301)或抗vegf蛋白质缀合物(例如阿柏西普生物聚合物缀合物)施用给患有糖尿病的受试者,用于缺血区域的“再灌注”:给予抗vegf抗体缀合物(例如ksi-301)的剂量(或抗vegf抗体缀合物(例如ksi-301)的负荷阶段,例如,每4周3个负荷剂量三次,因此第0天、第4周、第8周),然后根据需要进行再治疗。
[0296]
在一些实施方案中,提供了一种眼部病症的疾病改善的方法。该方法包括:以第一负荷剂量向患有眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),由此以对受试者有益的方式改善眼部病症。
[0297]
在一些实施方案中,提供了治疗眼部病症的方法。该方法包括:确定患有dme、dr或rvo的受试者;向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的1-6个负荷剂量;在自最终负荷剂量起的第一时间量后,向受试者提供抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的第一再治疗剂量;及在自抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的第一再治疗剂量起的第二时间量后,向受试者提供抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的第二再治疗剂量,其中第二时间量大于第一时间量。在一些实施方案中,第二时间量比第一时间量大10、20、30、40、50、60、70、80、90、100%或更多。在一些实施方案中,第二时间量比第一时间量长1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16周或更多周。在一些实施方案中,负荷剂量包括向受试者施用的抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的3个剂量。
[0298]
在一些实施方案中,抗vegf抗体缀合物(例如ksi-301)或抗vegf蛋白质缀合物(例如阿柏西普生物聚合物缀合物)可被应用于用抗vegf抗体缀合物(例如ksi-301)或抗vegf蛋白质缀合物(例如阿柏西普生物聚合物缀合物)治疗dme或增殖性糖尿病性视网膜病变或非增殖性糖尿病性视网膜病变的方法中,其导致(缺血组织的)再灌注,并因此代表基础疾病的改善。术语灌注和再灌注在本文中可互换使用。
[0299]
在一些实施方案中,在负荷注射和第一次再治疗注射之后,每次后续再治疗注射都将比第一次再治疗注射频率更低。也就是说,考虑到本发明方法的特性,再治疗注射之间的时间量可以增加。特别是,每次后续再治疗注射的时间量可增加1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20周或更多周。在一些实施方案中,每次再治疗之间的时间量增加1、2、3、4、5、6、7、8、90、10、15、20、25、30、35、40、45、50、100、500、1000、5000、10000%或更多。
[0300]
在一些实施方案中,治疗眼部病症的方法可以包括:以第一负荷剂量向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症是糖尿病性黄斑水肿(dme);及重复负荷剂量至少一次,但不超过两次,由此受试者在最终负荷剂量后保持抗vegf抗体缀合物(例
如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)疗法的治疗结果至少8周。在一些实施方案中,受试者在最终负荷剂量后保持抗vegf抗体缀合物(例如,ksi-301)疗法或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)疗法的治疗结果至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、32、34、36、38、40、44、48、52、56、或60周或更多周。在一些实施方案中,负荷剂量施用两次或三次。在一些实施方案中,每月或每隔一个月施用负荷剂量。
[0301]
在一些实施方案中,所述方法还包括在最终负荷剂量之后,向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的一个或多个后续剂量。在一些实施方案中,抗vegf抗体缀合物的后续剂量以q8w、q12w、q16w、q20w或q24w或更长的给药方案施用。在一些实施方案中,给药方案在q8w和q24w之间。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,不向受试者施用抗vegf抗体缀合物的后续剂量。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,向受试者施用的抗vegf抗体缀合物的后续剂量不超过一个。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,向受试者施用的抗vegf抗体缀合物的后续剂量不超过两个。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,向受试者施用的抗vegf抗体缀合物的后续剂量不超过三个。
[0302]
在一些实施方案中,治疗眼部病症的方法包括:以第一负荷剂量向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症是湿性年龄相关性黄斑变性(wamd);及重复负荷剂量至少一次,但不超过两次,由此受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果至少12周。在一些实施方案中,受试者在最终负荷剂量后保持抗vegf抗体缀合物(例如,ksi-301)疗法的治疗结果至少12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、32、34、36、38、40、44、48、52、56、或60周或更多周。在一些实施方案中,负荷剂量施用两次或三次。在一些实施方案中,每月或每隔一个月施用负荷剂量。
[0303]
在一些实施方案中,所述方法还包括在最终负荷剂量之后,向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的一个或多个后续剂量。在一些实施方案中,抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量以q2w、q4w、q8w、q12w、q16w、q20w、或q24w或更长的给药方案施用。在一些实施方案中,给药方案在q12w和q20w之间。在一些实施方案中,在第一负荷剂量的约一年内,向受试者施用的抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量不超过一个、两个、三个或四个,或不施用后续剂量。在一些实施方案中,给药方案在q12w和q20w之间。在一些实施方案中,在第一负荷剂量的约两年内,向受试者施用的抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量不超过一个、两个、三个或四个,或不施用后续剂量。在一些实施方案中,在第一负荷剂量的约三年内,向受试者施用的抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量不超过一个、两个、三个或四个,或不施用后续剂量。
[0304]
在一些实施方案中,治疗眼部病症的方法包括:以第一负荷剂量向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症是视网膜静脉阻塞(rvo),例如crvo或brvo;及
重复负荷剂量至少一次,但不超过两次,由此受试者在最终负荷剂量后保持抗vegf抗体缀合物(例如,ksi-301)疗法或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)疗法的治疗结果至少8周。在一些实施方案中,受试者在最终负荷剂量后保持抗vegf抗体缀合物(例如,ksi-301)疗法或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)疗法的治疗结果至少8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、32、34、36、38、40、44、48、52、56、或60周或更多周。在一些实施方案中,负荷剂量施用两次或三次。在一些实施方案中,每月或每隔一个月施用负荷剂量。
[0305]
在一些实施方案中,所述方法还包括在最终负荷剂量之后,向受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的一个或多个后续剂量。在一些实施方案中,抗vegf抗体缀合物的后续剂量以q8w、q12w、q16w、q20w或q24w或更长的给药方案施用。在一些实施方案中,给药方案为q8w或更长。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,不向受试者施用抗vegf抗体缀合物的后续剂量。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,向受试者施用的抗vegf抗体缀合物的后续剂量不超过一个。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,向受试者施用的抗vegf抗体缀合物的后续剂量不超过两个。在一些实施方案中,在第一负荷剂量之后的至少约一年、约两年或约三年内,向受试者施用的抗vegf抗体缀合物的后续剂量不超过三个。
[0306]
在一些实施方案中,治疗眼部病症的方法包括:向需要治疗眼部病症的受试者施用治疗有效量的抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),其中所述眼部病症为糖尿病性视网膜病变(dr),从而治疗所述眼部病症。在一些实施方案中,抗vegf抗体缀合物根据q12w、q16w、q20w或q24w或更长的给药方案施用。在一些实施方案中,给药方案在q12w和q24w之间。在一些实施方案中,所述方法还包括向受试者施用抗vegf抗体缀合物的至少一个负荷剂量,但不超过两个负荷剂量。在一些实施方案中,任何两个连续负荷剂量之间的时间为约4或8周(每月一次或每隔一个月一次)。
[0307]
在一些实施方案中,治疗眼部病症的方法包括:以以下给药方案向需要治疗眼部病症的受试者施用抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)的多个剂量中的第一剂量,所述给药方案包括:负荷给药方案,其包括抗vegf抗体缀合物的1-3个负荷剂量,其中所述第一剂量是负荷剂量;然后是维持给药方案,其包括在最终负荷剂量之后的抗vegf抗体缀合物的一个或多个后续剂量,其中所述维持给药方案包括q8w或更长的预定给药方案。在一些实施方案中,预定给药方案为q8w、q12w、q16w、q20w或q24w或更长。在一些实施方案中,眼部病症为wamd,并且预定给药方案为q12w或更长,例如q16w、q20w或q24w或更长。在一些实施方案中,眼部病症是dme、dr或rvo。
[0308]
在一些实施方案中,所述方法包括个体化给药方案。采用个体化给药方案治疗眼部病症的方法可包括:在第一剂量(例如,负荷剂量或维持剂量)后的一个或多个时间点,评估受试者中抗vegf抗体缀合物(例如,ksi-301)疗法或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)疗法的治疗结果;及在预定给药方案规定的后续时间点,向受试者施用抗vegf抗体缀合物或抗vegf蛋白质缀合物的后续剂量,除非受试者保持了治疗结果,在这种情况下,延长时间间隔直至施用后续剂量。在一些实施方案中,在最终剂量(例如,最终
负荷剂量或最终维持剂量)后,可在4、8或12周或上述值限定的范围内的任意时间点的随访时,对受试者的眼睛健康(例如,视网膜健康)进行评估或评价。在一些实施方案中,抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果可以通过本文公开的任何合适的选项(例如,视敏度、视网膜厚度等)来评估。在一些实施方案中,如本文所公开的,如果抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果得以保持,则不需要后续剂量,例如维持剂量,并且实际的给药方案可能偏离预定的给药方案。在一些实施方案中,只要抗vegf抗体缀合物疗法或抗vegf蛋白质缀合物疗法的治疗结果得以保持,就推迟下一后续剂量,例如维持剂量。在一些实施方案中,例如,如果在最终负荷剂量或最终维持剂量后8周,受试者的经治疗的眼睛保持了抗vegf抗体缀合物疗法的治疗结果,则实际给药方案可能偏离预定的q8w给药方案,不在预定时间施用抗vegf抗体缀合物。在一些实施方案中,只要抗vegf抗体缀合物疗法的治疗结果保持,则下一维持剂量可以无限期推迟。
[0309]
在一些实施方案中,治疗眼部病症的方法包括:确定需要治疗眼部病症的受试者,其中所述眼部病症被推定为眼组织胞浆菌病综合征;和向受试者玻璃体内施用治疗有效量的抗vegf抗体缀合物(例如,ksi-301)或抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),从而治疗眼部病症。在一些实施方案中,治疗有效量包含约1mg至约5mg、约1.25mg至约5mg或约2.5mg至约5mg(按抗vegf抗体部分的重量计)的抗vegf抗体缀合物。在一些实施方案中,需要抗vegf抗体缀合物或抗vegf蛋白质缀合物的不超过一次注射来治疗眼部病症。
[0310]
在一些实施方案中,向需要治疗眼部病症的受试者施用不超过三个负荷剂量的抗vegf抗体缀合物(例如,ksi-301)提供持续至少24周或更长时间的治疗结果。在一些实施方案中,向需要治疗眼部病症的受试者施用不超过两个剂量的抗vegf抗体缀合物(例如,ksi-301)提供持续至少24周或更长时间的治疗结果。在一些实施方案中,向需要治疗眼部病症的受试者施用不超过一个剂量的抗vegf抗体缀合物(例如,ksi-301)提供持续至少24周或更长时间的治疗结果。在一些实施方案中,在最终负荷剂量后,在至少24周内不对受试者施用额外剂量(例如维持剂量)的抗vegf抗体缀合物(即,在该时间段内是有效的,因此在该时间段内不需要额外的维持剂量或再治疗剂量)。在一些实施方案中,在施用一个负荷剂量后,在至少24周内不对受试者施用额外剂量(例如维持剂量)的抗vegf抗体缀合物。在一些实施方案中,在施用两个负荷剂量后,在至少24周内不对受试者施用额外剂量(例如维持剂量)的抗vegf抗体缀合物。在一些实施方案中,在施用三个负荷剂量后,在至少24周内不对受试者施用额外剂量(例如维持剂量)的抗vegf抗体缀合物。在一些实施方案中,负荷剂量之间的间隔为约一个月至约两个月。在一些实施方案中,负荷剂量之间的间隔为约一个月或约两个月。在一些实施方案中,以q24w或更长的给药方案(例如,维持给药方案)向受试者施用抗vegf抗体缀合物(例如,ksi-301)。在一些实施方案中,眼部病症是wamd。在一些实施方案中,眼部病症是rvo。在一些实施方案中,眼部病症是dme。在一些实施方案中,眼部病症是dr。
[0311]
抗体缀合物
[0312]
本文提供了抗vegf抗体(包括抗vegf蛋白质,例如阿柏西普)及其缀合物。在一些实施方案中,抗体本身不同于其他抗vegf剂并且提供优于其他抗vegf剂的优异结果。在一些实施方案中,抗vegf抗体缀合物显示出优于其他抗体和/或优于对其他抗体缀合物的活
性的预期的惊人优势。
[0313]
在一些实施方案中,抗vegf抗体缀合物是ksi-301,其是包含以下的抗体缀合物:
[0314]
(1)抗vegf-a抗体;和
[0315]
(2)含磷酸胆碱的聚合物,其中所述聚合物在抗vegf-a抗体的可变区之外的半胱氨酸处与抗vegf-a抗体共价键合,其中所述半胱氨酸取代了序列中相同位置出现的非半胱氨酸氨基酸,其中抗vegf-a抗体包含轻链和重链,所述重链包含fc区,其中半胱氨酸位于重链的fc区,其中重链的序列包含seq id no 1,且其中轻链的序列包含seq id no:2,其中抗体缀合物具有以下结构:
[0316]
其中:
[0317]
抗vegf-a抗体的每条重链用字母h表示,且抗vegf-a抗体的每条轻链用字母l表示;
[0318]
聚合物通过根据eu编号的c443上的巯基与抗vegf-a抗体键合,该键描绘在上述重链中的一条上;
[0319]
pc是其中曲线表示与聚合物其余部分连接的点;且
[0320]
n1、n2、n3、n4、n5、n6、n7、n8和n9相同或不同,使得n1、n2、n3、n4、n5、n6、n6、n7、n8和n9的总和为2500
±
15%。
[0321]
历史上,将分子与蛋白质缀合通常导致蛋白质与其预期靶标的结合相互作用降低。在本公开的一些实施方案中,当缀合到活性位点外部的位置时,不一定观察到与可能的预期相同的降低水平。本文提供的证据表明与可能的预期相反的效果。在一些实施方案中,并且不打算受理论限制,缀合物可优于单独的抗体。例如,配体与其特异性受体的相互作用通常通过配体和受体的立体特异性相互作用驱动,如由配体上的亲水性氨基酸与受体上的亲水性氨基酸的相互作用所引导的,并且水分子是这些相互作用的前沿和中心。同时,通过不再强调(de-emphasize)和/或抑制通常可能由疏水-疏水氨基酸介导/产生的非特异性疏水相互作用,进一步增强了这种亲水性立体特异性。
[0322]
在一些实施方案中,提供了能够阻断vegf配体(“vegfl”)和vegf-受体(“vegfr”)之间的至少90%的相互作用的抗vegf抗体缀合物。例如,它可以阻断vegfr和vegfl之间的至少90、91、92、93、94、95、96、97、98、99或实际上所有的相互作用。在一些实施方案中,所述阻断发生在饱和浓度下。在一些实施方案中,提供了阻断vegf配体和vegf-受体之间的至少95%的相互作用的抗vegf抗体缀合物。这种阻断优势的实例是抗vegf抗体生物缀合物(本文提供的抗体缀合物,例如,ksi-301)比(雷珠单抗)或(贝伐单抗(bevacizumab))或甚至抗体og1950(未缀合的)更高程度地阻断的能力。实际上,这一结果是出乎意料的,因为虽然可以预计向抗体添加聚合物(以形成抗体缀合物)会对抗体的结合/活性产生一些不利影响或没有不利影响,但出乎意料的是,它实际上会以这种方式改善抗体的阻断能力。
[0323]
在一些实施方案中,所述抗体或其缀合物抑制至少70、80、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%的vegfr和vegfl之间的活性和/或相互作用。在一些实施方案中,ic50值可以是0.1、1、2、3、4、5、6、7、8、9、10、20、30、40、50、100nm或小于前述值的任意一个或多个。在一些实施方案中,kd可以是2*10^-13、1*10^-13、1*10^-12、1*10^-11、1*10^-10m或小于任意一个前述值。在一些实施方案中,ic50值可以是1、5、10、20、30、40、50、60、70 80、90、100、200、300、400、500、600、700、800、900、1,000、1,100、1,200、1,300、或小于任意一个前述值。
[0324]
在一些实施方案中,提供了阻断vegf配体和vegf-受体之间的至少90%的相互作用的抗vegf抗体。例如,它可以阻断vegfr和vegfl之间的至少91、92、93、94、95、96、97、98、99或实际上所有的相互作用。这种阻断优势的实例是og1950(和本文提供的抗体)比(雷珠单抗)或(贝伐单抗)更高程度地阻断的能力。
[0325]
在一些实施方案中,可通过本文所述的一种或多种方法将其他抗体,例如(雷珠单抗)或(贝伐单抗)与本文所述的一种或多种聚合物缀合。在一些实施方案中,可通过本文所述的一种或多种方法将任意抗体或其片段与本文所述的一种或多种聚合物缀合。
[0326]
在一些实施方案中,抗体包含重链氨基酸可变区,其包含seq id no 1,和轻链氨基酸可变区,其包含seq id no:2。在一些实施方案中,抗体与本文提供的一种或多种聚合物缀合。在一些实施方案中,缀合的抗体与seq id no:1和/或seq id no:2至少90%一致。
id no:13)和cdr
l
3:qqystvpwt(seq id no:14)。贝伐单抗可变重链cdr为cdrh1:gytftnygmn,cdrh2:wintytgeptyaadfkr(seq id no:10),和cdrh3:yphyygsshwyfdv。除了cdrh1使用kabat/chothia复合定义之外,cdr由kabat定义。在一些实施方案中,可以将半胱氨酸添加至贝伐单抗序列,并且可以将抗体(和/或包括贝伐单抗的6个cdr的变体)与本文提供的任意一种或多种聚合物缀合。
[0334]
衍生自与贝伐单抗相同的小鼠单克隆抗体的另一种抗vegf分子已经被批准用于治疗湿性amd:雷珠单抗((雷珠单抗),genentech/roche)。雷珠单抗是抗体片段或fab。雷珠单抗由贝伐单抗的可变重链和轻链的亲和力成熟而产生。雷珠单抗(如novartis所公布的)的重链和轻链的序列分别在seq id no:5和seq id no:6中列出。在一些实施方案中,可以将半胱氨酸添加至雷珠单抗序列,并且可以将抗体(和/或包括雷珠单抗的6个cdr的变体)与本文提供的任意一种或多种聚合物缀合。
[0335]
雷珠单抗cdr与贝伐单抗相同,除了在亲和力成熟后增加了改进:雷珠单抗可变轻链cdr为:cdr
l
1:sasqdisnyln(seq id no:12)、cdr
l
2:ftsslhs(seq id no:13)和cdr
l
3:qqystvpwt(seq id no:14)。雷珠单抗可变重链cdr为:cdrh1:gydfthygmn(seq id no:9)、cdrh2:wintytgeptyaadfkr(seq id no:10)和cdrh3:ypyyygtshwyfdv(seq id no:11)。
[0336]
在一些实施方案中,提供的抗体缀合物具有在抗体可变区外的半胱氨酸处与含磷酸胆碱的聚合物键合的抗vegf-a抗体,其中半胱氨酸已通过重组dna技术添加。在一些实施方案中,聚合物与单个半胱氨酸键合。在一些实施方案中,“通过重组dna技术添加”是指使半胱氨酸残基取代在已知或现有抗体或共有抗体序列中在相同位置存在的非半胱氨酸氨基酸。因此,例如,当抗体是igg1并且重链在eu位置443具有亮氨酸时,该亮氨酸通过重组dna技术被半胱氨酸取代(l443c,eu编号,或seq id no:1中的449c)。相应地,eu位置347处的天然igg1序列是q(谷氨酰胺),并且通过重组dna技术用半胱氨酸取代q以产生q347c。
[0337]
在一些实施方案中,抗vegf-a抗体包含轻链和重链,其中重链具有fc区。在一些实施方案中,半胱氨酸在fc区中,并且抗vegf-a抗体是免疫球蛋白g(igg)。在一些实施方案中,抗vegf-a重链具有cdrh1:gydfthygmn(seq id no:9)、cdrh2:wintytgeptyaadfkr(seq id no:10)和cdrh3:ypyyygtshwyfdv(seq id no:11),并且位置221(通过如seq id no:3中的顺序计数)是t,抗vegf-a轻链具有cdr
l
1:sasqdisnyln(seq id no:12)、cdr
l
2:ftsslhs(seq id no:13)和cdr
l
3:qqystvpwt(seq id no:14),并且kabat位置4为l。
[0338]
在一些实施方案中,抗vegf-a重链同种型是igg1。在一些实施方案中,igg1恒定结构域相对于igg1恒定结构域(例如seq id no:3的恒定区)具有一个或多个突变以调节效应子功能。在一些实施方案中,效应子功能突变是以下中的一种或多种(eu编号):e233x、l234x、l235x、g236x、g237x、a327x、a330x和p331x,其中x是任意天然或非天然氨基酸。在一些实施方案中,突变选自由以下组成的组(eu编号):e233p、l234v、l234a、l235a、g237a、a327g、a330s和p331s。在一些实施方案中,抗体缀合物具有以下突变(eu编号):l234a、l235a和g237a。
[0339]
在一些实施方案中,半胱氨酸残基在抗vegf-a重链中并且为q347c(eu编号)或l443c(eu编号)。在一些实施方案中,半胱氨酸残基是l443c(eu编号,或seq id no:1中的449c)。在一些实施方案中,抗vegf-a重链的序列是seq id no:1,抗vegf-a轻链的序列是seq id no:2。
[0340]
在一些实施方案中,含磷酸胆碱的聚合物包含2-(甲基丙烯酰氧乙基)-2'-(三甲基铵)乙基磷酸酯(mpc)单体,如下所示:
[0341][0342]
使得聚合物包含以下重复单元:
[0343][0344]
其中n是自1至3000的整数,波浪线表示聚合物中单体单元之间的连接点。
[0345]
在一些实施方案中,聚合物具有三个或更多个臂,或用包含三个或更多个聚合物引发位点的引发剂合成。在一些实施方案中,聚合物具有2、3、4、5、6、7、8、9、10、11或12个臂,或者用包含2、3、4、5、6、7、8、9、10、11或12个聚合物引发位点的引发剂合成。更优选地,聚合物具有3、6或9个臂,或者用包含3、6或9个聚合物引发位点的引发剂合成。在一些实施方案中,聚合物具有9个臂,或者用包含9个聚合物引发位点的引发剂合成。
[0346]
在一些实施方案中,添加的聚合物的分子量在约300,000至约1,750,000da(sec-mal)之间。在一些实施方案中,聚合物的分子量在约500,000至约1,000,000da之间。在一些实施方案中,聚合物的分子量在约600,000至约900,000da之间。在一些实施方案中,聚合物的分子量在约750,000至约850,000da之间。在一些实施方案中,聚合物的分子量在约800,000至约850,000da之间。在一些实施方案中,聚合物的分子量在约750,000至约800,000da之间。
[0347]
在一些实施方案中,本文所述的任意抗体均可进一步与聚合物缀合以形成生物缀合物。生物缀合物的分子量(总共,sec-mal)可在约350,000至2,000,000道尔顿之间,例如在约450,000至1,900,000道尔顿之间,在约550,000至1,800,000道尔顿之间,在约650,000至1,700,000道尔顿之间,在约750,000至1,600,000道尔顿之间,在约850,000至1,500,000道尔顿之间,在约900,000至1,400,000道尔顿之间,在约950,000至1,300,000道尔顿之间,
在约900,000至1,000,000道尔顿之间,在约1,000,000至1,300,000道尔顿之间,在约850,000至1,300,000道尔顿之间,在约850,000至1,000,000道尔顿之间,以及在约1,000,000至1,200,000道尔顿之间。
[0348]
在一些实施方案中,抗体缀合物是经纯化的。在一些实施方案中,聚合物是抗体缀合物的一部分,是多分散的,即聚合物pdi不为1.0。在一些实施方案中,pdi小于1.5。在一些实施方案中,pdi小于1.4。在一些实施方案中,pdi小于1.3。在一些实施方案中,pdi小于1.2。在一些实施方案中,pdi小于1.1。
[0349]
在一些实施方案中,抗体缀合物具有与聚合物键合的抗vegf-a免疫球蛋白g(igg),该聚合物包含mpc单体,其中抗vegf-a重链的序列是seq id no:1,抗vegf-a轻链的序列是seq id no:2,并且其中抗体仅在seq id no:1中的c449处与聚合物键合。在一些实施方案中,聚合物具有9个臂并且分子量在约600,000至约1,000,000da之间。
[0350]
在一些实施方案中,抗体缀合物具有与聚合物键合的抗vegf-a免疫球蛋白g(igg),该聚合物包含mpc单体,其中抗vegf-a重链的序列是seq id no:1,抗vegf-a轻链的序列是seq id no:2,并且其中抗体仅在c443(eu编号,或seq id no:1中的449c)处与聚合物键合。在一些实施方案中,聚合物具有9个臂并且分子量在约600,000至约1,000,000da之间。
[0351]
在一些实施方案中,抗体缀合物具有以下结构:
[0352][0353]
其中:抗vegf-a抗体的每条重链均用字母h表示,并且抗vegf-a抗体的每条轻链均
用字母l表示;
[0354]
聚合物通过seq id no:1中的c449的巯基与抗vegf-a抗体键合,该键描绘在重链中的一条上;pc是其中曲线表示与聚合物其余部分连接的点;其中x是:a)
–
or,其中r是h、甲基、乙基、丙基、或异丙基;b)-h;c)任意卤素,包括
–
br、
–
cl、或
–
i;d)
–
scn;或e)
–
ncs;并且n1、n2、n3、n4、n5、n6、n7、n8和n9相同或不同,使得n1、n2、n3、n4、n5、n6、n6、n7、n8和n9的总和为2500
±
10%。在一些实施方案中,n1、n2、n3、n4、n5、n6、n7、n8和n9相同或不同,并且是自0至3000的整数。在一些实施方案中,n1、n2、n3、n4、n5、n6、n7、n8和n9相同或不同,并且是自0至500的整数。在一些实施方案中,x是-or,其中r是糖、氨基烷基、以下残基的单取代、多取代或未取代的变体:饱和c
1-c
24
烷基、不饱和c
2-c
24
烯基或c
2-c
24
炔基、酰基、酰氧基、烷氧基羰氧基、芳氧基羰氧基、环烷基、环烯基、烷氧基、环烷氧基、芳基、杂芳基、芳基烷氧基羰基、烷氧基羰基酰基、氨基、氨基羰基、氨基羰基氧基、硝基、叠氮基、苯基、羟基、烷硫基、芳硫基、氧磺酰基、羧基、氰基和包括多卤代烷基在内的卤代烷基、
‑‑
co
‑‑o‑‑
r7、羰基
‑‑
cco
‑‑
r7、
‑‑
co
‑‑
nr8r9、
‑‑
(ch2)n‑‑
coor7、
‑‑
co
‑‑
(ch)n‑‑
coor7、
‑‑
(ch2)n‑‑
nr8r9、酯、烷氧基羰基、芳氧基羰基,其中n是1至6的整数,其中每个r7、r8和r9分别选自由以下组成的组:氢原子、卤素原子、以下残基的单取代、多取代或未取代的变体:饱和c
1-c
24
烷基、不饱和c
2-c
24
烯基或c
2-c
24
炔基、酰基、酰氧基、烷氧基羰氧基、芳氧基羰氧基、环烷基、环烯基、烷氧基、环烷氧基、芳基、杂芳基、芳基烷氧基羰基、烷氧基羰基酰基、氨基、氨基羰基、氨基羰基氧基、硝基、叠氮基、苯基、羟基、烷硫基、芳硫基、氧磺酰基、羧基、氰基和包括多卤代烷基在内的卤代烷基、5元环和6元环。
[0355]
在一些实施方案中,抗体缀合物具有以下结构:
和r9分别选自由以下组成的组:氢原子、卤素原子、以下残基的单取代、多取代或未取代的变体:饱和c
1-c
24
烷基、不饱和c
2-c
24
烯基或c
2-c
24
炔基、酰基、酰氧基、烷氧基羰氧基、芳氧基羰氧基、环烷基、环烯基、烷氧基、环烷氧基、芳基、杂芳基、芳基烷氧基羰基、烷氧基羰基酰基、氨基、氨基羰基、氨基羰基氧基、硝基、叠氮基、苯基、羟基、烷硫基、芳硫基、氧磺酰基、羧基、氰基和包括多卤代烷基在内的卤代烷基、5元环和6元环。在一些实施方案中,该构建体被命名为ksi-301。
[0359]
在一些实施方案中,抗体缀合物存在于液体制剂中。在一些实施方案中,抗体缀合物与药学上可接受的载体组合。
[0360]
在一些实施方案中,提供了抗vegf-a抗体。抗vegf-a抗体重链具有至少以下cdr序列:cdrh1:gydfthygmn(seq id no:9)、cdrh2:wintytgeptyaadfkr(seq id no:10)和cdrh3:ypyyygtshwyfdv(seq id no:11)。在一些实施方案中,抗vegf-a重链具有那些cdr并且另外在位置221(通过如在seq id no.3中的顺序计数)处具有苏氨酸(t)。在一些实施方案中,抗vegf-a轻链具有至少以下cdr:cdr
l
1:sasqdisnyln(seq id no:12)、cdr
l
2:ftsslhs(seq id no:13)和cdr
l
3:qqystvpwt(seq id no:14)。在一些实施方案中,抗vegf-a抗体具有那些cdr并且另外在kabat位置4处具有亮氨酸(l)。在一些实施方案中,抗vegf-a抗体重链的同种型是igg1并且具有ch1、铰链、ch2和ch3结构域。在一些实施方案中,轻链同种型是κ。在一些实施方案中,抗vegf抗体缀合物(例如,ksi-301)构建体将具有一个或多个这些cdr。
[0361]
在一些实施方案中,抗vegf-a抗体的igg1结构域具有一个或多个突变以调节效应子功能,例如adcc、adcp和cdc。在一些实施方案中,igg1突变降低效应子功能。在一些实施方案中,用于效应子功能突变的氨基酸包括(eu编号)e233x、l234x、l235x、g236x、g237x、g236x、d270x、k322x、a327x、p329x、a330x、a330x、p331x和p331x,其中x是任意天然或非天然氨基酸。在一些实施方案中,突变包括以下中的一种或多种:e233p、l234v、l234a、l235a、g237a、a327g、a330s和p331s(eu编号)。在一些实施方案中,抗vegf-a重链具有以下突变(eu编号):l234a、l235a和g237a。在一些实施方案中,相对于天然人igg1序列的效应子功能突变数目不超过10个。在一些实施方案中,相对于天然人igg1序列的效应子功能突变数目不超过5、4、3、2或1个。在一些实施方案中,抗体的fcγ结合和/或补体c1q结合降低,使得抗体产生效应子功能的能力降低。这对于眼科适应症/病症尤其有利。
[0362]
在一些实施方案中,抗vegf-a抗体包含以下氨基酸突变中的一种或多种:l234a、l235a、g237a(eu编号)和l443c(eu编号,或seq id no:1中的449c)。
[0363]
在一些实施方案中,抗vegf-a抗体是人免疫球蛋白g(igg1)或是其一部分。
[0364]
在一些实施方案中,vegf-a抗体包含重链恒定结构域,其包含降低免疫介导的效应子功能的一种或多种突变。
[0365]
在一些实施方案中,提供了抗vegf-a抗体。抗vegf抗体包含重链,所述重链包含:cdrh1,其包含序列gydfthygmn(seq id no:9);cdrh2,其包含序列wintytgeptyaadfkr(seq id no:10);cdrh3,其包含序列ypyyygtshwyfdv(seq id no:11);cdr
l
1,其包含序列sasqdisnyln(seq id no:12);cdr
l
2,其包含序列ftsslhs(seq id no:13);及cdr
l
3,其包含序列qqystvpwt(seq id no:14)。
[0366]
或者,igg结构域可以是igg2、igg3或igg4或复合物,在所述复合物中恒定区由这些同种型中的一种以上形成(例如,来自igg2或igg4的ch1区,来自igg1的铰链、ch2和ch3
区)。此类结构域可在关于igg1提及的一个或多个eu位置处含有突变以降低和/或调节效应子功能。人igg2和igg4相对于人igg1和igg3具有降低的效应子功能。
[0367]
抗vegf-a重链具有通过重组dna技术作为突变添加的半胱氨酸残基,其可用于缀合半衰期延长部分。在一些实施方案中,突变是(eu编号)q347c(eu编号)和/或l443c(eu编号,或seq id no:1中的449c)。在一些实施方案中,突变是l443c(eu编号,或seq id no:1中的449c)。在一些实施方案中,抗体与聚合物的化学计量比为1:1;换句话说,缀合物是一个抗体分子与一个聚合物分子缀合。
[0368]
抗vegf-a抗体的半衰期可以通过连接“半衰期延长部分”或“半衰期延长基团”来延长。半衰期延长部分包括可以与所讨论的生物学药物一起在框架内表达的(或根据情况化学缀合的)肽和蛋白质,和可以与一个或多个氨基酸侧链或末端官能团(例如-sh、-oh、-cooh、-conh2、-nh2,或一种或多种n-和/或o-聚糖结构)连接或缀合的各种聚合物。半衰期延长部分通常起到增加生物学药物的体内循环半衰期的作用。
[0369]
肽/蛋白质半衰期延长部分的实例包括fc融合(capon dj,chamow sm,mordenti j,et al.designing cd4 immunoadhesions for aids therapy.nature.1989.337:525-31)、人血清白蛋白质(has)融合(yeh p,landais d,lemaitre m,et al.design of yeast-secreted albumin derivatives for human therapy:biological and antiviral properties of a serum albumin-cd4 genetic conjugate.proc natl acad sci usa.1992.89:1904-08)、羧基末端肽(ctp)融合(fares fa,suganuma n.nishimori k,et al.design of a long-acting follitropin agonist by fusing the c-terminal sequence of the chorionic gonadotropin beta subunit to the follitropin beta subunit.proc natl acad sci usa.1992.89:4304-08)、非精确重复肽序列(xten)融合的遗传融合(schellenberger v,wang cw,geething nc,et al.a recombinant polypeptide extends the in vivo half-life of peptides and proteins in a tunable manner.nat biotechnol.2009.27:1186-90)、弹性蛋白样肽(elp化)(mcpherson dt,morrow c,minehan ds,et al.production and purification of a recombinant elastomeric polypeptide,g(vpgvg19-vpgv,from escheriachia coli.biotechnol prog.1992.8:347-52)、人转铁蛋白融合(prior cp,lai c-h,sadehghi h et al.modified transferrin fusion proteins.专利wo2004/020405.2004)、脯氨酸-丙氨酸-丝氨酸(pas化)(skerra a,theobald i,schlapsky m.biological active proteins having increased in vivo and/or vitro stability.专利wo2008/155134a1.2008)、同型氨基酸聚合物(hap化)(schlapschy m,theobald i,mack h,et al.fusion of a recombinant antibody fragment with a homo-amino acid polymer:effects on biophysical properties and prolonged plasma half-life.protein eng des sel.2007.20:273-84)和明胶样蛋白质(glk)融合(huang y-s,wen x-f,zaro jl,et al.engineering a pharmacologically superior form of granulocyte-colony-stimulating-factor by fusion with gelatin-like protein polymer.eur j.pharm biopharm.2010.72:435-41)。
[0370]
聚合物半衰期延长部分的实例包括聚乙二醇(peg)、支化peg、(warwick effect polymers;coventry,uk)、聚唾液酸(psa)、淀粉、羟乙基淀粉(hes)、羟烷
基淀粉(has)、碳水化合物、多糖、普鲁兰多糖(pullulane)、壳聚糖、透明质酸、硫酸软骨素、硫酸皮肤素、葡聚糖、羧甲基葡聚糖、聚环氧烷(pao)、聚亚烷基二醇(pag)、聚丙二醇(ppg)、聚恶唑啉、聚丙烯酰吗啉、聚乙烯醇(pva)、聚羧酸酯、聚乙烯吡咯烷酮、聚磷腈、聚恶唑啉、聚乙烯-共-马来酸酐、聚苯乙烯-共-马来酸酐、聚(1-羟甲基亚乙基羟甲基缩甲醛)(poly(1-hydroxymethyethylene hydroxymethylformal),phf)、两性离子聚合物、含磷酸胆碱的聚合物和包含mpc、聚(gly
x-sery)、透明质酸(ha)、肝素前体(heparosan)聚合物(hep)、fleximer、葡聚糖和聚唾液酸(psa)的聚合物。
[0371]
在一个实施方案中,半衰期延长部分可以使用n-羟基琥珀酰亚胺(nhs)酯通过蛋白质的游离氨基与抗体缀合。靶向与胺基缀合的试剂可以随机与赖氨酸的ε-胺基、n-末端氨基酸的α-胺基和组氨酸的δ-胺基发生反应。
[0372]
然而,本文公开的抗vegf-a抗体具有许多可用于聚合物缀合的胺基。因此,聚合物与游离氨基的缀合可能负面影响抗体蛋白质与vegf结合的能力。
[0373]
在一些实施方案中,使用任意合适的硫醇反应性化学方法(包括但不限于马来酰亚胺化学方法),或聚合物酰肼或聚合物胺与事先氧化后的抗体的碳水化合物部分的偶联,将半衰期延长部分偶联至一个或多个游离sh基团。在一些实施方案中,使用马来酰亚胺偶联。在一些实施方案中,偶联发生在天然存在的或通过基因工程引入的半胱氨酸处。
[0374]
在一些实施方案中,将聚合物共价连接至通过定点诱变引入到抗vegf-a抗体中的半胱氨酸残基。在一些实施方案中,半胱氨酸残基用于抗体的fc部分。在一些实施方案中,wo 2013/093809、us 7,521,541、wo 2008/020827、us 8,008,453、us 8,455,622和us2012/0213705(为了所有目的通过引用并入本文)提供了将半胱氨酸残基引入fc区的位点。在一些实施方案中,半胱氨酸突变是q347c(eu编号)和l443c,参考eu编号的人igg重链。
[0375]
在一些实施方案中,提供了抗体和用作半衰期延长部分的高mw聚合物的缀合物。在一些实施方案中,缀合物包含与两性离子聚合物偶联的抗体,其中所述聚合物由一种或多种单体单元形成,并且其中至少一种单体单元具有两性离子基团。在一些实施方案中,两性离子基团是磷酸胆碱。
[0376]
在一些实施方案中,单体单元之一是hema-pc。在一些实施方案中,聚合物由单一单体合成,所述单体是hema-pc。
[0377]
在一些实施方案中,一些抗体缀合物具有2、3或更多个聚合物臂,其中单体是hema-pc。在一些实施方案中,缀合物具有2、3、4、5、6、7、8、9、10、11或12个聚合物臂,其中单体是hema-pc。在一些实施方案中,缀合物具有3、6或9个臂。在一些实施方案中,缀合物具有9个臂。
[0378]
在一些实施方案中,聚合物-抗体缀合物具有分子量在100,000和1,500,000da之间的聚合物部分。在一些实施方案中,缀合物的聚合物部分的分子量在500,000和1,000,000da之间。在一些实施方案中,缀合物的聚合物部分的分子量在600,000和800,000da之间。在一些实施方案中,缀合物的聚合物部分的分子量在600,000和850,000da之间并且具有9个臂。当考虑与聚合物缀合的抗体的分子量时,分子量将是蛋白质(包括与其结合的任意碳水化合物部分)的分子量与聚合物的分子量的加和。
[0379]
在一些实施方案中,抗vegf-a抗体具有hema-pc聚合物,由mw测量的所述hema-pc聚合物的分子量在约100kda和1650kda之间。在一些实施方案中,由mw测量的聚合物的分子
量在约500kda和1000kda之间。在一些实施方案中,由mw测量的聚合物的分子量在约600kda至约900kda之间。在一些实施方案中,由mw测量的聚合物的分子量为750kda
±
15%。
[0380]
在一些实施方案中,聚合物由具有一个或多个聚合物引发位点的、适用于atrp的引发剂制备。在一些实施方案中,聚合物引发位点具有2-溴异丁酸酯位点。在一些实施方案中,引发剂具有3个或更多个聚合物引发位点。在一些实施方案中,引发剂具有3、4、5、6、7、8、9、10、11或12个聚合物引发位点。在一些实施方案中,引发剂具有3、6或9个聚合物引发位点。在一些实施方案中,引发剂具有9个聚合物引发位点。在一些实施方案中,引发剂是og1786。
[0381]
抗vegf-a抗体可以通过重组表达产生,包括(i)通过基因工程产生重组dna,(ii)通过例如但不限于转染、电穿孔或显微注射将重组dna引入原核或真核细胞中,(iii)培养转化的细胞,(iv)表达抗体,例如组成型或诱导表达,和(v)分离抗体,例如从培养基中分离或通过收获转化的细胞分离,以便(vi)获得纯化的抗体。
[0382]
抗vegf-a抗体可以通过在合适的原核或真核宿主系统中表达来产生,所述原核或真核宿主系统的特征在于产生药理学上可接受的抗体分子。真核细胞的实例是哺乳动物细胞,例如cho、cos、hek 293、bhk、sk-hip和hepg2。其他合适的表达系统是原核细胞(例如,具有pet/bl21表达系统的大肠杆菌)、酵母细胞(酿酒酵母和/或巴斯德毕赤酵母系统)和昆虫细胞。
[0383]
多种载体可用于制备本文公开的抗体,并选自真核表达载体和原核表达载体。用于原核表达的载体的实例包括质粒,例如但不限于,preset、pet和pad,其中用于原核表达载体的启动子包括但不限于lac、trc、trp、reca或arabad中的一种或多种。用于真核表达的载体的实例包括:(i)用于在酵母中表达的载体,例如但不限于pao、ppic、pyes或pmet,使用启动子例如但不限于aox1、gap、gal1或aug1;(ii)用于在昆虫细胞中表达的载体,例如但不限于pmt、pac5、pib、pmib或pbac,使用启动子例如但不限于ph、p10、mt、ac5、opie2、gp64或polh,和(iii)用于在哺乳动物细胞中表达的载体,例如但不限于psvl、pcmv、prc/rsv、pcdna3或pbpv,以及在一方面衍生自病毒系统的载体,所述病毒系统例如但不限于痘苗病毒、腺相关病毒、疱疹病毒或逆转录病毒,使用启动子例如但不限于cmv、sv40、ef-1、ubc、rsv、adv、bpv和β-肌动蛋白质。
[0384]
蛋白质与聚合物的缀合方法
[0385]
在一些实施方案中,提供了制备治疗性蛋白质-半衰期延长部分缀合物的方法,其具有以下步骤:将治疗性蛋白质与半衰期延长部分缀合以提供治疗性蛋白质-半衰期延长部分缀合物,所述治疗性蛋白质具有通过重组dna技术添加的半胱氨酸残基,所述半衰期延长部分具有选自由以下组成的组的巯基特异性反应基团:马来酰亚胺、二乙烯基砜、邻二硫吡啶和碘乙酰胺。
[0386]
在一些实施方案中,提供了从og1950制备抗vegf抗体缀合物例如ksi-301的方法。该方法包括用50倍摩尔过量的tcep还原剂还原og1950蛋白质。还原后,将抗体氧化以产生脱帽的og1950抗体,其中抗体中天然存在的轻链和重链链间和链内二硫键形成,但重链位置l443c(eu编号,或seq id no:1中的449c)上的经工程化的半胱氨酸仍然保持脱帽。然后通过添加赋形剂并添加5-10倍摩尔过量的马来酰亚胺生物聚合物来缀合og1950。生物聚合物通过共价硫醚键连接到og1950抗体。缀合后,纯化抗vegf抗体缀合物,例如,ksi-301,除
去未缀合的抗体和聚合物。
[0387]
上述蛋白质和方法也可以变化。因此,在一些实施方案中,提供了制备缀合的蛋白质(其不必是抗体或抗vegf抗体)的方法。该方法包括还原蛋白质中的一个或多个半胱氨酸以在溶液中形成脱帽蛋白质。在将所述一个或多个半胱氨酸还原后,将脱帽蛋白质再氧化以恢复被还原的蛋白质中的至少一个二硫键,同时确保蛋白质中的经工程化的半胱氨酸残基保持游离硫醇形式以在溶液中形成再氧化的脱帽蛋白质。然后向溶液中加入至少一种赋形剂。赋形剂减少聚合物诱导的蛋白质沉淀。在添加赋形剂后,将聚合物添加到溶液中,其在经工程化的半胱氨酸残基处与再氧化的脱帽蛋白质缀合以形成缀合的蛋白质。
[0388]
在一些实施方案中,摩尔过量的还原剂可以改为起作用的任意量。在一些实施方案中,可以使用10、20、30、40、50、60、70、80、90倍摩尔过量的还原剂(不必所有实施方案都是tcep)。在一些实施方案中,可以使用任意抗体(治疗性或其他)。在一些实施方案中,可以使用1、2、3、4、5、6、7、8、9、10、11、12、13、14、15倍摩尔过量的马来酰亚胺生物聚合物。在一些实施方案中,存在对于聚合物而言过量的脱帽蛋白质。在一些实施方案中,被还原的蛋白质的量小于聚合物的量。在一些实施方案中,被还原的蛋白质的量为聚合物的量的90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、4%、3%、2%、1%。在一些实施方案中,使用的聚合物是蛋白质的10-15倍。在一些实施方案中,被还原的抗体的量大于聚合物的量。在一些实施方案中,聚合物的量大于被还原的抗体的量。
[0389]
在一些实施方案中,纯化步骤是任选的。
[0390]
在一些实施方案中,制备抗体缀合物的方法包括将抗vegf-a抗体与含磷酸胆碱的聚合物缀合。在一些实施方案中,所述方法包括将抗vegf-a抗体与含磷酸胆碱的聚合物缀合的步骤。抗vegf-a抗体包含通过重组dna技术添加的氨基残基。在一些实施方案中,所添加的氨基酸残基是半胱氨酸残基。在一些实施方案中,将半胱氨酸残基添加到抗体的可变区之外。可以将半胱氨酸残基添加到抗体的重链或轻链中。
[0391]
在一些实施方案中,聚合物包含含磷酸胆碱的聚合物或由含磷酸胆碱的聚合物组成。在一些实施方案中,含磷酸胆碱的聚合物包含选自由以下组成的组的巯基特异性反应基团:马来酰亚胺、乙烯基砜、邻二硫吡啶和碘乙酰胺。在一些实施方案中,含磷酸胆碱的聚合物上的巯基特异性反应基团与抗vegf-a抗体上的半胱氨酸残基反应以制备抗体缀合物。
[0392]
在一些实施方案中,待缀合的蛋白质可以是抗体、抗体蛋白质融合体或其结合片段。在一些实施方案中,蛋白质不是抗体,而是酶、配体、受体或其他蛋白质或其突变体或变体。在一些实施方案中,天然蛋白质含有至少一个二硫键和至少一个非天然半胱氨酸。
[0393]
在一些实施方案中,赋形剂可以是酸或碱。在一些实施方案中,赋形剂是去污剂、糖或带电荷的氨基酸。在一些实施方案中,赋形剂有助于在与聚合物缀合期间将蛋白质保持在溶液中。在一些实施方案中,在将聚合物添加到含有蛋白质的溶液之前,将赋形剂添加到含有蛋白质的溶液中。
[0394]
在一些实施方案中,反应在约ph 5至约ph 9之间的水性条件下发生。在一些实施方案中,反应在6.0至8.5之间、6.5至8.0之间或7.0至7.5之间发生。
[0395]
在一些实施方案中,聚合物在2-37摄氏度下与蛋白质缀合。在一些实施方案中,缀合在0-40摄氏度、5-35摄氏度、10-30摄氏度和15-25摄氏度发生。
[0396]
在一些实施方案中,可使本文所述的缀合的蛋白质与离子交换介质或疏水相互作
用色谱或亲和色谱介质接触以进行纯化(以从未缀合的蛋白质中去除缀合的蛋白质)。在一些实施方案中,离子交换介质、疏水相互作用色谱或亲和/或色谱介质将缀合的蛋白质与游离聚合物和再氧化的脱帽蛋白质分离。
[0397]
在一些实施方案中,本文所述和图18中概述的方法涉及能够促进和/或维持溶解度体系的赋形剂。在一些实施方案中,该方法允许溶液维持意欲相互作用的两种组分的溶解度。这可以包括蛋白质和聚合物的溶解度,然后也包括终端缀合物的溶解度。在一些实施方案中,在不使用赋形剂方法的情况下,问题可能是虽然蛋白质可溶,但当加入生物聚合物时,溶液(例如蛋白质)的溶解度下降并且蛋白质从溶液中析出(crash)/沉淀出来。当然,当蛋白质析出时,其不能有效地与生物聚合物缀合。因此,可以使用赋形剂来维持在生物聚合物存在下蛋白质的溶解度,因此两者可以偶联形成蛋白质缀合物(或如图18中所示,抗体缀合物)。这也允许保持缀合物的溶解度。
[0398]
在一些实施方案中,本文公开的聚合物可包含以下中的一种或多种:两性离子、磷酸胆碱或peg接头,所述peg接头将聚合物分支点的中心桥接至马来酰亚胺官能团。在一些实施方案中,可以通过本文提供的方法将本文提供的任意聚合物添加至蛋白质。
[0399]
在一些实施方案中,本文提供的任意蛋白质可以通过本文提供的一种或多种方法与本文提供的任意聚合物缀合。
[0400]
在一些实施方案中,本文提供的方法允许进行较大规模的加工以制备和纯化蛋白质和/或抗体缀合物。在一些实施方案中,所用体积为至少1升,例如1、10、100、1,000、5,000、10,000升或更多。在一些实施方案中,制备的和/或纯化的抗体缀合物的量可以是0.1、1、10、100、1000或更多克。
[0401]
在一些实施方案中,治疗性蛋白质可以是本文所述的任意抗vegf-a抗体,其具有通过重组dna技术添加的半胱氨酸残基。在一些实施方案中,抗vegf抗体重链具有以下cdr:cdrh1:gydfthygmn(seq id no:9)、cdrh2:wintytgeptyaadfkr(seq id no:10)和cdrh3:ypyyygtshwyfdv(seq id no:11)。重链还可以在位置221(通过如seq id no.3中的顺序计数)具有苏氨酸(t)。在一些实施方案中,抗vegf轻链具有以下cdr:cdr
l
1:sasqdisnyln(seq id no:12)、cdr
l
2:ftsslhs(seq id no:13)和cdr
l
3:qqystvpwt(seq id no:14)。抗vegf-a轻链还可以在kabat位置4具有亮氨酸(l)。
[0402]
在一些实施方案中,抗vegf-a抗体是igg1。在一些实施方案中,重链具有一个或多个突变以调节效应子功能。在一些实施方案中,突变是针对以下氨基酸位置(eu编号)中的一个或多个:e233、l234、l235、g236、g237、a327、a330和p331。在一些实施方案中,突变选自由以下组成的组:e233p、l234v、l234a、l235a、g237a、a327g、a330s和p331s(eu编号)。在一些实施方案中,突变是(eu编号)l234a、l235a和g237a。
[0403]
在一些实施方案中,通过重组dna技术添加至治疗性蛋白质的半胱氨酸残基不应参与cys-cys二硫键配对。在此方面,治疗性蛋白质可以是二聚体。因此,例如,完整的抗vegf-a抗体具有两条轻链和两条重链。如果将cys残基引入到例如重链中,则完整抗体将在相同位置具有两个这样引入的半胱氨酸,并且存在这些半胱氨酸残基将形成链内二硫键的可能性。如果引入的半胱氨酸残基形成cys-cys二硫键或具有这样做的倾向,那么引入的cys残基将不能用于缀合。本领域已知如何避免重链和轻链中将导致链内二硫键配对的位置。参见,例如,美国专利申请号2015/0158952。
[0404]
在一些实施方案中,通过重组dna技术引入的半胱氨酸残基选自由(eu编号)q347c和l443c组成的组。在一些实施方案中,半胱氨酸残基是l443c(eu编号,或seq id no:1中的449c)。在一些实施方案中,抗体的重链具有seq id no.1中所示的氨基酸序列并且轻链具有seq id no.2的氨基酸序列。
[0405]
在一些实施方案中,巯基特异性反应基团是马来酰亚胺。
[0406]
在一些实施方案中,半衰期延长部分选自由以下组成的组:聚乙二醇(peg)、支化peg、(warwick effect polymers;coventry,uk)、聚唾液酸(psa)、淀粉、羟乙基淀粉(hes)、羟烷基淀粉(has)、碳水化合物、多糖、普鲁兰多糖(pullulane)、壳聚糖、透明质酸、硫酸软骨素、硫酸皮肤素、葡聚糖、羧甲基葡聚糖、聚环氧烷(pao)、聚亚烷基二醇(pag)、聚丙二醇(ppg)、聚噁唑啉、聚丙烯酰吗啉、聚乙烯醇(pva)、聚羧酸酯、聚乙烯吡咯烷酮、聚磷腈、聚噁唑啉、聚乙烯-共-马来酸酐、聚苯乙烯-共-马来酸酐、聚(1-羟甲基亚乙基羟甲基缩甲醛)(phf)、两性离子聚合物、含磷酸胆碱的聚合物和包含2-甲基丙烯酰氧基-2
’‑
乙基三甲基磷酸铵(mpc)的聚合物。
[0407]
在一些实施方案中,半衰期延长部分是两性离子聚合物。在一些实施方案中,两性离子是磷酸胆碱,即含磷酸胆碱的聚合物。在一些实施方案中,聚合物由mpc单元组成。
[0408]
在一些实施方案中,mpc聚合物具有三个或更多个臂。在一些实施方案中,mpc聚合物具有2、3、4、5、6、7、8、9、10、11或12个臂。在一些实施方案中,mpc聚合物具有3、6或9个臂。在一些实施方案中,mpc聚合物具有9个臂。在一些实施方案中,聚合物用包含2、3、4、5、6、7、8、9、10、11,12或更多个聚合物引发位点的引发剂合成。
[0409]
在一些实施方案中,mpc聚合物的分子量在约300,000至1,750,000da之间。在一些实施方案中,mpc聚合物的分子量在约500,000至1,000,000da之间或在约600,000至900,000da之间。
[0410]
在一些实施方案中,制备治疗性蛋白质-半衰期延长部分缀合物的方法具有如下额外步骤:在产生还原型半胱氨酸巯基的条件下使治疗性蛋白质与硫醇还原剂接触。如上所述,优选地,通过重组dna技术添加的半胱氨酸残基是不配对的,即不参与cys-cys链内二硫键或基本上不参与这种键合。然而,已知不参与这种cys-cys二硫键合并且可自由缀合的cys残基与培养基中的游离半胱氨酸反应形成二硫化物加合物。参见,例如,wo 2009/052249。如此衍生的半胱氨酸将不可用于缀合。为了从二硫化物加合物中释放新添加的半胱氨酸,用还原剂例如二硫苏糖醇处理纯化后的蛋白质。然而,用还原剂进行的这种处理将还原治疗性蛋白质中的所有半胱氨酸残基,包括天然半胱氨酸,其中许多参与链间和链内cys-cys二硫键。天然cys-cys二硫化物通常对蛋白质稳定性和活性至关重要,应对其进行重建。在一些实施方案中,重建所有天然(例如,间和内)cys-cys二硫化物。
[0411]
为了重建天然链间和链内二硫化物残基,在还原以除去半胱氨酸二硫化物加合物后,将治疗性蛋白质暴露于氧化条件和/或氧化剂一段规定的时间,例如过夜。在一些实施方案中,过夜暴露环境空气可用于实现天然二硫键的重建。在一些实施方案中,使用氧化剂来恢复天然二硫化物。在一些实施方案中,氧化剂选自由含水cuso4和脱氢抗坏血酸(dhaa)组成的组。在一些实施方案中,氧化剂是dhaa。在一些实施方案中,所用dhaa的范围为5-30当量的范围。在一些实施方案中,所述范围为10-20当量。在一些实施方案中,所述范围为15当量。
[0412]
在一些实施方案中,硫醇还原剂选自由以下组成的组:三[2-羧乙基]膦盐酸盐(tcep)、二硫苏糖醇(dtt)、二硫赤藓糖醇(dte)、硼氢化钠(nabh4)、氰基硼氢化钠(nacnbh3)、β-巯基乙醇(bme)、半胱氨酸盐酸盐和半胱氨酸。在一些实施方案中,硫醇还原剂是tcep。
[0413]
在一些实施方案中,硫醇还原剂浓度相对于治疗性蛋白质浓度为1至100倍摩尔过量。在一些实施方案中,硫醇还原剂浓度相对于治疗性蛋白质浓度为20至50倍摩尔过量。在一些实施方案中,硫醇还原剂在与治疗性蛋白质孵育后,在治疗性蛋白质的氧化之前被除去。
[0414]
在一些实施方案中,用于将治疗性蛋白质与半衰期延长部分缀合的方法还具有以下步骤:在缀合后纯化治疗性蛋白质缀合物。在一些实施方案中,使用选自由以下组成的组的技术纯化治疗性蛋白质缀合物:离子交换色谱、疏水相互作用色谱、尺寸排阻色谱和亲和色谱或其组合。
[0415]
在一些实施方案中,治疗性蛋白质缀合物相对于未缀合的治疗性蛋白质保留至少20%的生物学活性。在一些实施方案中,治疗性蛋白质缀合物相对于未缀合的治疗性蛋白质保留至少50%的生物学活性。在一些实施方案中,治疗性蛋白质缀合物相对于天然治疗性蛋白质保留至少90%的生物学活性。
[0416]
在一些实施方案中,相对于未缀合的治疗性蛋白质,治疗性蛋白质缀合物的半衰期增加。在一些实施方案中,相对于未缀合的治疗性蛋白质,治疗性蛋白质缀合物的半衰期增加至少1.5倍。在一些实施方案中,相对于未缀合的治疗性蛋白质,治疗性蛋白质缀合物的半衰期增加至少5倍。
[0417]
在一些实施方案中,将治疗性蛋白质与半衰期延长部分缀合的方法中的两性离子聚合物是具有两性离子基团的可自由基聚合的单体,并且该方法还具有使可自由基聚合的两性离子单体在聚合介质中聚合以提供聚合物的步骤,该介质包括:可自由基聚合的两性离子单体;过渡金属催化剂m
t(q-1)+
,其中mt是过渡金属,q是金属的较高氧化态,q-1是金属的较低氧化态,其中金属催化剂以mt
(q-1)+
x’(q-1)
形式的盐提供,其中x’是反离子(counterion)或基团,或者过渡金属催化剂通过提供处于其较高氧化态的非活性金属盐m
tq+
x’q
与还原剂一起原位提供,所述还原剂能够将过渡金属从非活性的氧化态还原为活性的还原态;配体;和引发剂。
[0418]
为了起到atrp过渡金属催化剂的作用,过渡金属应该具有至少两个由一个电子隔开的、易于达到的氧化态,即较高氧化态和较低氧化态。在atrp中,可逆的氧化还原反应导致过渡金属催化剂在较高氧化态和较低氧化态之间循环,而聚合物链在具有增长链端和休眠链端之间循环。参见,例如,美国专利号7,893,173。
[0419]
在一些实施方案中,可自由基聚合的两性离子单体选自由以下组成的组:
[0420]
[0421]
其中r1是h或c
1-6
烷基,zw是两性离子,n是1-6的整数。
[0422]
在一些实施方案中,可自由基聚合的单体是
[0423][0424]
其中r1是h或c
1-6
烷基,r2、r3、r4相同或不同且是h或c
1-4
烷基,并且x和y相同或不同且是1-6的整数。在一些实施方案中,r1、r2、r3和r4各自为甲基,并且x和y各自为2。
[0425]
在一些实施方案中,可自由基聚合的单体是
[0426][0427]
其中r1是h或c
1-6
烷基,r2和r3相同或不同且是h或c
1-4
烷基,r4是po
4-、so
3-或co
2-,并且x和y相同或不同且是1-6的整数。在一些实施方案中,r1、r2和r3为甲基,r4是po
4-并且x和y各自为2。
[0428]
在一些实施方案中,单体是
[0429][0430]
其中r1是h或c
1-6
烷基,r2、r3和r4相同或不同且是h或c
1-4
烷基,r5是po
4-、so
3-或co
2-,并且x和y相同或不同且是1-6的整数。在一些实施方案中,r1、r2、r3和r4为甲基,r5是po
4-并且x和y为2。
[0431]
在一些实施方案中,过渡金属mt选自由以下组成的组:cu、fe、ru、cr、mo、w、mn、rh、re、co、v、zn、au和ag。在一些实施方案中,金属催化剂以mt
(q-1)+
x’(q-1)
形式的盐提供。m
t(q-1)+
选自由以下组成的组:cu
1+
、fe
2+
、ru
2+
、cr
2+
、mo
2+
、w
2+
、mn
3+
、rh
3+
、re
2+
、co
+
、v
2+
、zn
+
、au
+
、和ag
+
,并且x’选自由以下组成的组:卤素、c
1-6
烷氧基、(so4)
1/2
、(po4)
1/3
、(r7po4)
1/2
、(r72po4)、三氟甲磺酸盐、六氟磷酸盐(hexaluorophosphate)、甲磺酸盐、芳基磺酸盐、cn和r7co2,其中r7是h或直链或支链c
1-6
烷基,其可被卤素取代1至5次。在一些实施方案中,m
t(q-1)+
是cu
1+
并且x’是br。
[0432]
在一些实施方案中,原位提供m
t(q-1)+
。在一些实施方案中,m
tq+
xq是cubr2。在一些实施方案中,还原剂是无机化合物。在一些实施方案中,还原剂选自由以下组成的组:低氧化水平的硫化合物、亚硫酸氢钠、含金属离子的无机盐、金属、水合肼和这些化合物的衍生物。在一些实施方案中,还原剂是金属。在一些实施方案中,还原剂是cu0。
[0433]
在一些实施方案中,还原剂是有机化合物。在一些实施方案中,有机化合物选自由以下组成的组:烷基硫醇、巯基乙醇、或易于烯醇化的羰基化合物、抗坏血酸、乙酰丙酮酸酯、樟脑磺酸、羟基丙酮、还原糖、单糖、葡萄糖、醛,以及这些有机化合物的衍生物。
[0434]
在一些实施方案中,配体选自由以下组成的组:2,2'-联吡啶、4,4'-二-5-壬基-2,2'-联吡啶、4,4-二壬基-2,2'-联吡啶、4,4',4
”‑
三(5-壬基)-2,2':6',2
”‑
三联吡啶、n,n,n',n',n
”‑
五甲基二亚乙基三胺、1,1,4,7,10,10-六甲基三亚乙基四胺、三(2-二甲基氨基乙基)胺、n,n-双(2-吡啶基甲基)十八烷基胺、n,n,n',n'-四[(2-吡啶基)甲基]乙二胺、三[(2-吡啶基)甲基]胺、三(2-氨基乙基)胺、三(2-双(3-丁氧基-3-氧代丙基)氨基乙基)胺、三(2-双(3-(2-乙基己氧基)-3-氧代丙基)氨基乙基)胺和三(2-双(3-十二烷氧基-3-氧代丙基)氨基乙基)胺。在一些实施方案中,配体是2,2'-联吡啶。
[0435]
在一些实施方案中,引发剂具有以下结构:
[0436][0437]
其中r1是亲核反应性基团,r2包含接头,并且r3包含具有以下结构的聚合物合成引发剂部分:
[0438][0439]
其中r4和r5相同或不同且选自由以下组成的组:烷基、取代的烷基、亚烷基、烷氧基、羧基烷基、卤代烷基、环烷基、环烷基醚、烯基、亚烯基、炔基、亚炔基、亚环烷基、杂环烷基、亚杂环烷基、芳基、亚芳基、亚芳基-氧基、杂芳基、氨基、酰胺基或其任意组合;z是卤素、
–
or(其中r是
–
h、甲基、乙基、丙基、或异丙基)、
–
scn或
–
ncs;并且s是1至20之间的整数。
[0440]
在一些实施方案中,z是br并且r4和r5各自是甲基。在一些实施方案中,r1选自由以下组成的组:-nh2、-oh、和-sh。
[0441]
在一些实施方案中,r2是烷基、取代的烷基、亚烷基、烷氧基、羧基烷基、卤代烷基、环烷基、环烷基醚、烯基、亚烯基、炔基、亚炔基、亚环烷基、杂环烷基、亚杂环烷基、芳基、亚芳基、亚芳基-氧基、杂芳基、氨基、酰胺基或其任意组合。在一些实施方案中,r2是
[0442][0443]
其中x和y相同或不同且是1-20的整数。在一些实施方案中,x和y各自为4。
[0444]
在一些实施方案中,r3是
[0445][0446]
其中r6、r7和r8相同或不同且选自由以下组成的组:
[0447]
[0448][0449]
其中z是
–
or(其中r是
–
h、甲基、乙基、丙基、或异丙基)、
–
scn、
–
ncs、
–
f、
–
cl、
–
br或
–
i。在一些实施方案中,z是
–
br并且r6、r7和r8各自是
[0450][0451]
在一些实施方案中,引发剂具有以下结构:
[0452][0453]
其中a和b相同或不同且是2至12的整数,并且z是任意卤化物,例如br。在一些实施方案中,a和b各自为4。
[0454]
在一些实施方案中,该方法还具有使聚合物与马来酰亚胺试剂反应以提供具有末端马来酰亚胺的聚合物的步骤。在一些实施方案中,马来酰亚胺化合物是
[0455][0456]
治疗方法
[0457]
在一些实施方案中,提供了用于治疗或预防眼部疾病的方法,其具有以下步骤:施用选自由抗vegf-a抗体(及其缀合物)和抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物)组成的组的治疗性蛋白质。在一些实施方案中,本文提供的任意一种或多种抗体或抗体缀合物或蛋白质缀合物可用作眼部疾病的治疗和/或预防。所述方法包括向受试者施用本文提供的任意一种或多种抗体或抗体缀合物。
[0458]
在一些实施方案中,提供了用于治疗或预防眼部疾病的方法。所述方法包括向有此需要的受试者施用有效剂量的本文所述的任意抗体和/或抗体缀合物和/或蛋白质缀合
物。在一些实施方案中,疾病可以是年龄相关性黄斑变性(amd)或糖尿病性黄斑水肿(dme)。在一些实施方案中,疾病可以是湿性amd。在一些实施方案中,眼部病症是湿性amd,没有高色素上皮脱离(ped)。在一些实施方案中,当受试者眼睛中的基线中心子区视网膜厚度(cst)为500微米或更大时,受试者具有高ped。
[0459]
在一些实施方案中,眼部疾病选自由以下组成的组中的一种或多种:糖尿病性视网膜病变、脉络膜新生血管(cnv)、年龄相关性黄斑变性(amd)、糖尿病性黄斑水肿(dme)、病理性近视、冯希-林二氏病、眼睛的组织胞浆菌病、视网膜中央静脉阻塞(crvo)、视网膜中央分支静脉阻塞(brvo)、角膜新生血管、视网膜新生血管、早产儿视网膜病变(rop)、结膜下出血和高血压性视网膜病变。在一些实施方案中,眼部疾病是糖尿病性视网膜病变。
[0460]
在一些实施方案中,抗体或抗体缀合物或蛋白质缀合物的施用频率不超过每月一次。在一些实施方案中,抗体或其缀合物每月施用两次或每周施用一次。在一些实施方案中,抗体或其缀合物每两个月施用一次、每三个月施用一次、每四个月施用一次、每五个月施用一次、每六个月施用一次、每七个月施用一次、每八个月施用一次、每九个月施用一次、每十个月一次、每十一个月施用一次、或每十二个月施用一次。
[0461]
在一些实施方案中,本文提供的一种或多种组合物可以减少由于使用玻璃体内注射抗vegf剂来治疗湿性(增殖性)形式的年龄相关性黄斑变性(amd)而产生的高治疗负担的后果。湿性amd患者的现实世界结果落后于3期临床研究中证实的临床结果,例如使用(雷珠单抗)的marina和anchor研究以及使用(阿柏西普)的view 1和view 2研究。抗vegf治疗剂具有较长眼部停留时间使得其可以较不频繁地施用,并且因此具有更多的患者可耐受特征,可以使更多患者的现实世界结果更接近3期临床结果。
[0462]
在一些实施方案中,本文所述的化合物,包括抗体缀合物和抗vegf-a抗体、以及抗vegf蛋白质缀合物(例如,阿柏西普生物聚合物缀合物),用于治疗患有背景或非增殖性糖尿病性视网膜病变但具有很少或没有视力损伤的患者。在一些实施方案中,这些患者通过玻璃体内注射每月给药少于一次。在一些实施方案中,这些患者每年给药六次。在一些实施方案中,这些患者每年给药不超过四次。在一些实施方案中,所述患者每年给药不超过三次。在一些实施方案中,所述患者每年给药不超过两次。在一些实施方案中,所述患者每年给药不超过一次。在一些实施方案中,受试者通过玻璃体内注射接受抗体或抗体缀合物或蛋白质缀合物。
[0463]
本文所述的治疗性蛋白质(例如,抗体和抗体缀合物两者)可以通过在患者体内表达这种多肽(即基因疗法)来使用。
[0464]
使核酸(任选地包含在载体中)进入患者细胞有两种主要方法:体内和离体。对于体内递送,将核酸直接注射到患者体内,通常在需要治疗性蛋白质的部位,即需要治疗性蛋白质的生物活性的部位。对于离体治疗,移除患者的细胞,将核酸引入到这些分离的细胞中,并将修饰的细胞直接或例如包封在植入患者体内的多孔膜中施用于患者(参见,例如,美国专利号4,892,538和5,283,187)。有多种技术可用于将核酸引入到活细胞中。这些技术根据核酸是在体外转移到培养细胞中,还是在体内转移到预期宿主的细胞中而变化。适于在体外将核酸转移到哺乳动物细胞中的技术包括使用脂质体、电穿孔、显微注射、转导、细胞融合、deae-葡聚糖、磷酸钙沉淀法等。转导涉及复制缺陷型重组病毒(包括逆转录病毒)颗粒与细胞受体的结合,然后将颗粒所含的核酸引入到细胞中。用于离体递送基因的常用
载体是逆转录病毒。
[0465]
在一些实施方案中,体内核酸转移技术包括用病毒或非病毒载体(例如腺病毒、慢病毒、单纯疱疹病毒i或腺相关病毒(aav))和基于脂质的系统(用于脂质介导的基因转移的有用脂质是例如dotma、dope和dc-chol;参见,例如tonkinison等人,cancer investigation,14(1):54-65(1996))进行的转染。在一些实施方案中,用于基因疗法的载体是病毒,其包括腺病毒、aav、慢病毒或逆转录病毒。病毒载体如逆转录病毒载体包括至少一种转录启动子/增强子或(多个)基因座限定元件,或通过其他方式(例如可变剪接、核rna输出或信使的翻译后修饰)控制基因表达的其他元件。另外,病毒载体如逆转录病毒载体包括核酸分子,当在编码治疗性蛋白质的基因存在下转录时,该核酸分子与其可操作地连接并起到翻译起始序列的作用。此类载体构建体还包括包装信号、长末端重复序列(ltr)或其部分以及适合于所用病毒的正链和负链引物结合位点(如果它们尚未存在于病毒载体中)。另外,这种载体通常包括信号序列,用于从其位于其中的宿主细胞分泌pro多肽。在一些实施方案中,用于此目的的信号序列是哺乳动物信号序列。在一些实施方案中,信号是治疗性蛋白质的天然信号序列。任选地,载体构建体还可以包括指导多腺苷酸化的信号以及一个或多个限制性位点和翻译终止序列。举例来说,此类载体通常包括5'ltr、trna结合位点、包装信号、第二条链dna合成的起点和3'ltr,或它们的一部分。可以使用非病毒的其他载体,例如阳离子脂质、聚赖氨酸和树枝状大分子。
[0466]
在一些情况下,需要为核酸源提供靶向靶细胞的试剂,例如对细胞表面膜蛋白质或靶细胞特异性的抗体、靶细胞上受体的配体等。在使用脂质体的情况下,结合与内吞作用相关的细胞表面膜蛋白质的蛋白质可用于靶向和/或促进摄取,例如,对特定细胞类型具有嗜性的衣壳蛋白质或其片段、在周期中经历内化的蛋白质的抗体以及靶向细胞内定位并增强细胞内半衰期的蛋白质。受体介导的内吞作用的技术描述于例如wu et al.,j.biol.chem.,262:4429-4432(1987);及wagner et al.,proc.natl.acad.sci.usa,87:3410-3414(1990)。关于目前已知的基因标记和基因治疗方案的综述,参见anderson et al.,science,256:808-813(1992)。还参见wo 93/25673和其中引用的参考文献。
[0467]
合适的基因疗法和制备逆转录病毒颗粒和结构蛋白质的方法可见于例如美国专利号5,681,746中。
[0468]
在一些实施方案中,提供了用于治疗或预防哺乳动物眼部疾病的方法,其中施用编码治疗性蛋白质的核酸分子,所述治疗性蛋白质选自由抗vegf-a抗体组成的组。
[0469]
在一些实施方案中,重链是seq id no.1中所示的重链,轻链是seq id no.2中所示的轻链。在一些实施方案中,核酸分子通过离体基因疗法施用。
[0470]
制备适用于本公开的方法的抗体缀合物的方法见于例如pct公开号wo2017117464中,其全文通过引用并入本文。
[0471]
药物组合物
[0472]
可以将治疗性蛋白质与药学上可接受的赋形剂一起掺入药物组合物中。适合口服施用的药物组合物可以作为分离的单位(discrete unit)如胶囊、作为溶液、糖浆剂或悬浮液(在水性或非水性液体中;或作为可食用泡沫状物(foams)或粘稠物(whips);或作为乳剂)提供。适用于片剂或硬明胶胶囊的赋形剂包括乳糖、玉米淀粉或其衍生物、硬脂酸或其盐。适于与软明胶胶囊一起使用的赋形剂包括例如植物油、蜡、脂肪、半固体或液体多元醇
等。对于溶液和糖浆剂的制备,可使用的赋形剂包括例如水、多元醇和糖。对于悬浮液的制备,可以使用油(例如植物油)来提供水包油或油包水悬浮液。
[0473]
药物组合物可适合于鼻内施用,其中赋形剂为固体,包括粒度例如在20至500微米范围内的粗粉末,其以摄取鼻烟的方式施用,即通过从靠近鼻子的粉末容器经鼻道快速吸入。其中赋形剂为液体、作为鼻喷雾剂或滴鼻剂施用的合适组合物包括活性成分的水性溶液或油溶液。适于通过吸入施用的药物组合物包括细颗粒粉剂或雾剂,其可通过各种类型的计量剂量加压气溶胶、喷雾器或吹入器产生。
[0474]
适于肠胃外施用的药物组合物包括可含有抗氧化剂、缓冲剂、抑菌剂和使制剂与预期接受者的血液基本等渗的溶质的水性和非水性无菌注射溶液;和可包含悬浮剂和增稠剂的水性和非水性无菌悬浮液。可用于可注射溶液的赋形剂包括例如水、醇、多元醇、甘油和植物油。组合物可以存在于单位剂量或多剂量容器中,例如密封的安瓿瓶和小瓶中,并且可以在冷冻干燥(冻干)条件下储存,使用前仅需加入所携带的无菌液体,例如注射用水。临时注射溶液和悬浮液可以由无菌粉末、颗粒和片剂制备。药物组合物可以是基本上等渗的,意味着渗透压为约250-400mosm/kg水。
[0475]
药物组合物可以含有防腐剂、增溶剂、稳定剂、润湿剂、乳化剂、甜味剂、着色剂、添味剂、盐(物质本身可以以药学上可接受的盐的形式提供)、缓冲剂、包衣剂或抗氧化剂。除所述物质外,它们还可以含有治疗活性剂。药物组合物可以与一种或多种药学上可接受的赋形剂组合使用。此类赋形剂可以包括但不限于盐水、缓冲盐水(例如磷酸盐缓冲盐水)、葡萄糖、脂质体、水、甘油、乙醇及其组合。
[0476]
抗体和含有它们的药物组合物可以以有效方案施用用于治疗或预防患者的疾病,包括例如通过口服、玻璃体内、静脉内、皮下、肌内、骨内、鼻内、局部、腹膜内和病灶内施用。肠胃外输注包括肌内、静脉内、动脉内、腹膜内或皮下施用或其他途径等。在治疗中或作为预防剂时,活性剂可作为可注射组合物向个体施用,例如作为无菌水性分散液。在一些实施方案中,所述药剂是等渗的或基本上等渗的。
[0477]
对于向哺乳动物特别是人类施用,预期活性剂的剂量为0.01mg/kg体重,通常为约1mg/kg。医师可以确定最适合个体的实际剂量,其取决于包括个体的年龄、体重、性别和反应、所治疗的疾病或病症以及所治疗个体的年龄和状况在内的因素。上述剂量是平均情况的示例。当然,可存在需要更高或更低剂量的情况。在一些实施方案中,剂量可以是0.5至20mg/眼,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18或19mg。
[0478]
该剂量可以视情况重复(例如每周一次、每两周一次、每月一次、每两个月一次、每季度一次、每年两次、每年一次)。如果发生副作用,则可以根据正常临床实践减少剂量的量和/或频率。在一个实施方案中,药物组合物可以每一至三十天施用一次。在一个实施方案中,药物组合物可以每三十天施用两次。在一个实施方案中,药物组合物可以每周施用一次。
[0479]
抗体和药物组合物可单独使用或与其它化合物(例如治疗性化合物或分子,例如抗炎药、镇痛药或抗生素)联合使用。这种与其它化合物一起的施用可以是同时的、分开的或相继的。组分可以以试剂盒的形式制备,试剂盒可以视情况包括说明书。
[0480]
本文公开的抗体和药物组合物可用于治疗或预防疾病,特别是本文所述的眼部疾病或病况。
[0481]
抗vegf抗体缀合物、或抗vegf蛋白质缀合物、以及含有它们的药物组合物可以被配制为用于以下方式并通过以下方式施用:眼部、眼内、和/或玻璃体内注射、和/或近巩膜(juxtascleral)注射、和/或视网膜下注射、和/或眼球筋膜下(subtenon)注射、和/或脉络膜上腔(superchoroidal)注射和/或结膜下施用和/或以滴眼剂和/或软膏的形式局部施用。这样的抗体和组合物可以通过多种方法递送,例如作为允许化合物缓慢释放到玻璃体中的装置和/或贮库(depot)进行玻璃体内递送,包括例如intraocular drug delivery,jaffe,ashton,and pearson,editors,taylor&francis(march 2006)的参考文献中描述的那些。在一个实例中,装置可以是在长时间内释放化合物的微型泵和/或基质(matrix)和/或被动扩散系统和/或封装单元(encapsulated cell)的形式(intraocular drug delivery,jaffe,ashton,and pearson,editors,taylor&francis(march 2006))。
[0482]
用于眼、眼内或玻璃体内施用的制剂可以通过本领域已知的方法使用本领域已知的成分制备。高效治疗的主要要求是适当渗透眼睛。不同于药物可以局部递送的眼睛前部的疾病,视网膜疾病需要更加位点特异性的方法。滴眼剂和软膏很少渗透到眼睛后部,并且血眼屏障阻碍全身施用的药物渗透到眼组织中。因此,通常选择的用于治疗视网膜疾病(例如amd和cnv)的药物递送方法为直接玻璃体内注射。玻璃体内注射通常以取决于患者的状况以及所递送的药物的性质和半衰期的间隔进行重复。
[0483]
治疗性抗体和相关缀合物通常置于具有无菌入口的容器中,例如具有可被皮下注射针刺穿的塞子的静脉内溶液袋或小瓶。这种组合物也可以以预填充注射器的形式提供。
[0484]“稳定的”制剂为其中蛋白质或与其它半衰期延长部分的聚合物缀合的蛋白质在储存时基本上保持其物理稳定性和/或化学稳定性和/或生物活性的制剂。“稳定的”还指表现出很少不稳定性迹象(包括聚集和/或脱酰胺)或没有表现出不稳定性迹象的制剂。例如,当如文在5-8℃的温度下储存时,所提供的制剂可保持稳定至少两年。用于本公开的抗vegf抗体缀合物的合适制剂描述于例如pct公开号wo2017117464中,其全文通过引用并入本文。
[0485]
在本领域中可获得用于测量蛋白质稳定性的各种分析技术,并在例如peptide and protein drug delivery,247-301(vincent lee ed.,new york,n.y.,1991)和jones,1993adv.drug delivery rev.10:29-90中对其进行了综述。稳定性可以在选定的温度下测量选定的时间段。在一些实施方案中,制剂的储存稳定至少6个月、12个月、12-18个月、或2年或更多年。
[0486]
如果在肉眼检查颜色和/或透明度或通过紫外光散射或尺寸排阻色谱法测量时,没有显示出聚集、沉淀、脱酰胺和/或变性的迹象,则蛋白质(例如抗体或其片段)在药物制剂中“保持其物理稳定性”。
[0487]
如果在给定时间的化学稳定性使得蛋白质被认为仍然保持其生物活性,则蛋白质在药物制剂中“保持其化学稳定性”。化学稳定性可以通过检测和定量蛋白质的化学改变形式来评价。化学改变可涉及尺寸变化(例如剪切),其可以使用例如尺寸排阻色谱法、sds-page和/或基质辅助激光解吸电离/飞行时间质谱(maldi/tof ms)进行评价。其它类型的化学改变包括电荷改变(例如,作为脱酰胺的结果而发生),其可以通过例如离子交换色谱法进行评价。如果,例如在抗原结合测定中测定的,抗体在给定时间的生物活性在药物制剂制备时显示的生物活性的约10%以内(在测定的误差内),则抗体在药物制剂中“保持其生物活性”。
reducing endotoxin in moraxella catarrhalis uspa2 protein preparations.j chrom b.753:269-278)。所有药典均将药物和生物制品的静脉内应用的内毒素的最大水平设定为每小时每kg体重5个内毒素单位(eu)(daneshiam m,guenther a,wendel a,hartung t,von aulock s.2006.in vitro pyrogen test for toxic or immunomodulatory drugs.j immunol method 313:169-175)。eu是内毒素的生物活性的量度。例如,100pg的标准内毒素ec-5和120pg的来自大肠杆菌o111:b4的内毒素具有1eu的活性(hirayama c,sakata m.2002.chromatographic removal of endotoxin from protein solutions by polymer particles.j chrom b 781:419-432)。达到该阈值水平在生物研究和制药工业中一直是一个挑战(berthold w,walter j.1994.protein purification:aspects of processes for pharmaceutical products.biologicals 22:135-150;petsch d,anspach fb.2000.endotoxin removal from protein solutions.j biotech 76:97-119)。
[0497]
在要通过玻璃体内注射递送的药物中内毒素的存在受到特别的关注。在1945年,药物(青霉素)的玻璃体内注射首次由rycroft进行(rycroft bw.1945.penicillin and the control of deep intra-ocular infection.british j ophthalmol 29(2):57-87)。玻璃体是一个腔室,高水平的药物可引入其中并维持相对长的时间段。通过玻璃体内注射可获得的药物浓度远远超过通过局部施用或通过全身施用(例如静脉内施用)可以产生的浓度。
[0498]
可能由玻璃体内注射引起的最危险的并发症之一是眼内炎。眼内炎分为两类:感染性眼内炎和无菌性眼内炎。感染性眼内炎通常由细菌、真菌或寄生虫引起。感染性眼内炎的症状包括严重的疼痛、视力丧失以及结膜和下面的巩膜外层发红。感染性眼内炎需要紧急诊断和治疗。在一些情况下可能的治疗包括玻璃体内注射抗生素和平坦部玻璃体切除术。可能需要摘除术以除去失明和疼痛的眼睛。参见,例如christy ne,sommer a.1979.antibiotic prophylaxis of postoperative endophthalmitis.ann ophthalmol 11(8):1261
–
1265。
[0499]
相反,无菌性眼内炎不涉及传染原,并且可以被定义为玻璃体腔的急性眼内炎症,其不需要玻璃体内抗生素和/或玻璃体视网膜手术即可消退。如果已经进行了玻璃体微生物学研究,则需要证明为阴性培养物以维持无菌性眼内炎的诊断。marticorena j,romano v,gomez-ulla f.2012“sterile endophthalmitis after intravitreal injections”med inflam.928123。
[0500]
已经观察到玻璃体内注射被内毒素污染的生物药物可导致无菌性眼内炎(marticorena等人)。贝伐单抗(阿瓦斯汀)被美国食品和药物管理局批准用于治疗成胶质细胞瘤、转移性结肠直肠癌、晚期非鳞状非小细胞肺癌和转移性肾癌。贝伐单抗也在核准标示外广泛用于湿性amd的治疗。制造商提供的贝伐单抗为100mg/4ml。该溶液不能直接用于玻璃体内注射,必须由药剂师配制。已经观察到一些无菌性眼内炎并且理论上认为是由配制药剂师无意造成的内毒素对贝伐单抗的污染引起的。
[0501]
鉴于玻璃体内注射内毒素的可怕的临床结果,可以通过玻璃体内给药给予患者的内毒素的总量是非常有限的。在一些实施方案中,提供了具有抗体或抗体缀合物的溶液,其内毒素水平不超过5.0eu/ml。在一些实施方案中,内毒素水平不超过1.0eu/ml。在一些实施方案中,内毒素水平不超过0.5eu/ml。在一些实施方案中,内毒素水平不超过0.2eu/ml。在
一些实施方案中,内毒素水平不超过2、1、0.5、0.2、0.1、0.09、0.08、0.07、0.06、0.05、0.04、0.03、0.02或0.01eu/ml。
[0502]
两种常用的fda批准的用于内毒素存在的测试为兔热原测试和鲎变形细胞溶解物(lal)测定(hoffman s,et al.2005.international validation of novel pyrogen tests based on human monocytoid cells j.immunol.methods 298:161-173;ding jl,ho ba.2001.new era in pyrogen testing.biotech.19:277-281)。兔热原测试在20世纪20年代开发,包括监测注射有测试溶液的兔子的体温升高。然而,由于花费和长的周转时间,几年来兔热原测试的使用已经大大减少。更常见的是lal测试。lal来自鲎的血液,并在暴露于内毒素时凝结。
[0503]
最简单的lal测定之一是lal凝胶-凝结测定。本质上,将lal凝结测定与所讨论的样品的连续稀释组合。凝胶的形成与样品中内毒素的量成比例。由样品制备连续稀释液,并测定每种稀释液形成lal凝胶的能力。在某点含有阴性反应。原始样品中内毒素的量可以根据稀释测定估算。
[0504]
还开发了其他lal测试,包括比浊lal测定(ong kg,lelan jm,zeng kf,barrett g,aourob m,grimes ca.2006.a rapid highly-sensitive endotoxin detection system.biosensors and bioelectronics 21:2270-2274)和显色lal测定(haishima y,hasegawa c,yagami t,tsuchiya t,matsuda r,hayashi y.2003.estimation of uncertainty in kinetic-colorimetric assay of bacterial endotoxins.j pharm biomed analysis.32:495-503)。比浊测定和显色测定比简单的凝胶-凝结稀释测定更加灵敏和定量。
[0505]
在一些实施方案中,提供了降低具有本文公开的抗体的组合物中内毒素的量的方法。该方法具有以下步骤:使组合物与结合抗体的亲和色谱树脂接触;从亲和色谱树脂中洗脱抗体,以形成具有拮抗剂的亲和色谱洗脱液;使亲和色谱洗脱液与结合抗体的离子交换树脂接触;以及从离子交换树脂中洗脱抗体,其中从离子交换树脂中洗脱的抗体基本上不含内毒素。
[0506]
用于减少内毒素的量的上述方法或本文所述的其它方法或过程可以以上述步骤中描述的顺序进行,或者其可任选地通过改变步骤的顺序或甚至重复一个或多个步骤进行。在一个实施方案中,减少组合物中内毒素的量的方法以所描述的步骤的顺序进行。在一些实施方案中,在亲和色谱洗脱液与离子交换树脂接触之前,以相同的顺序将亲和色谱树脂接触步骤、洗涤步骤和洗脱步骤重复一次以上。该方法还可以包括使用例如0.1微米、0.22微米或0.44微米过滤器的过滤步骤,可以对在每个树脂结合步骤后移走的一个或多个洗脱液进行该步骤。
[0507]
在某些情况下,在使第一洗脱液与离子交换树脂接触之前,可将组合物与亲和色谱树脂接触的步骤、洗涤步骤和从亲和色谱树脂中洗脱抗体的步骤重复多于一次。在一个实施方案中,亲和色谱树脂包含重组蛋白质a(“rproteina”)树脂。合适的重组蛋白质a树脂的一个实例为rproteina sepharose树脂(amersham,piscataway,n.j.)。在另一个实施方案中,合适的亲和色谱树脂将包含蛋白质g色谱树脂。在其它实施方案中,合适的亲和色谱树脂包含混合的蛋白质a/蛋白质g树脂。在其它实施方案中,合适的亲和色谱树脂包含
含有4-巯基乙基吡啶配体的疏水性电荷诱导树脂,例如mep树脂(biosepra,cergy,saint christophe,france)。
[0508]
在一些实施方案中,离子交换树脂包含阴离子交换树脂。如本领域技术人员所知的,对基质以及所连接的带电基团而言,离子交换剂可以是基于各种材料的。例如,可以使用以下基质,其中所提及的材料可以或多或少地交联:macrocap q(ge healthcare biosciences,piscataway,nj)、基于琼脂糖的基质(例如sepharosesepharose fast和sepharose highhigh)、基于纤维素的基质(例如deae)、基于葡聚糖的基质(例如)、基于二氧化硅的基质和基于合成聚合物的基质。对于阴离子交换树脂,共价连接到基质上的带电基团可以是例如二乙基氨基乙基、季氨基乙基和/或季铵。在一些实施方案中,阴离子交换树脂包含季胺基团。用于结合抗m-csf抗体的具有季胺基团的示例性阴离子交换树脂为q树脂(amersham,piscataway,n.j.)。
[0509]
在其它方面,如果在组合物经历上述阴离子交换色谱步骤之后,内毒素水平高于所需的水平,则组合物可以备选地经历阳离子交换树脂。在一些实施方案中,组合物中的任何内毒素与离子交换树脂的结合应当不同于所讨论的蛋白质的结合,从而从内毒素中纯化蛋白质。在这点上,内毒素是带负电荷的,并且通常与阴离子交换树脂结合。如果蛋白质和内毒素都与阴离子交换树脂结合,则可以通过使用盐梯度将两者洗脱至不同的级分来实现其中一种从另一种中的纯化。通过相对于蛋白质的pi改变缓冲剂的ph,也可以影响蛋白质与特定树脂的相对结合。在一些实施方案中,阳离子交换色谱是采用的唯一的离子交换色谱。
[0510]
在一些实施方案中,如果在阴离子交换树脂之后内毒素水平太高,则组合物可以进一步经历第二离子交换步骤,例如通过使组合物与阳离子交换树脂接触,随后进行洗涤步骤,然后从离子交换树脂中洗脱。在一些实施方案中,阳离子交换树脂包含用于结合的磺酸基。示例性的阳离子交换树脂为sp树脂ff(amersham,piscataway,n.j.)、poros xs(cex)(life technology,grand island,new york)。
[0511]
在一些实施方案中,在产生具有规定水平的内毒素的抗体蛋白质溶液之后,在蛋白质的最终制剂之前有多个步骤。在一些实施方案中,半衰期延长部分与蛋白质缀合。然后将缀合物配制成注射到患者体内的最终药物制剂。在一些实施方案中,缀合物再次在离子交换树脂上纯化,该离子交换树脂可以是阳离子交换树脂。在其他实施方案中,对蛋白质进行配制。在所有情况下,应当使用正常的实验室程序以防止内毒素污染物引入至蛋白质样品或蛋白质-聚合物缀合物中。
[0512]
实施例
[0513]
实施例1:ksi-301的视网膜半衰期、视网膜生物利用度和全身清除
[0514]
在兔模型中,玻璃体内施用的ksi-301在视网膜和脉络膜/视网膜色素上皮(rpe)中的半衰期延长(图1)。将ksi-301数据与已公布的阿柏西普和雷珠单抗结果进行比较,表明与其他抗vegf治疗药物相比,ksi-301表现出更好的持久性。数据来自兔模型。雷珠单抗数据:gaudrealt et al(2007)iovs 46(2)726,gaudrealt et al(2007)retina 27(9)
1260,bakri et al(2007)ophthalmol 114(12)2179;阿柏西普数据:ever congress portoroz slovenia(2008)struble(covance)koehler-stec(regeneron)。对阿柏西普数据进行算术调整,以反映2,000μg的施用剂量(基于500μg的兔体内给药);对ksi-301数据进行算术调整,以反映5,000μg的施用剂量(基于725μg的兔体内给药)。误差线反映平均值的标准误差。
[0515]
玻璃体内施用的ksi-301显示出优异的视网膜生物利用度(图2)。将ksi-301数据与阿柏西普的公布结果进行比较表明,ksi-301具有更好的生物利用度。图2的数据来自covance兔adme(吸收、分布、代谢、消除)模型。阿柏西普数据(2008):ever congress portoroz slovenia struble(covance),koehler-stec(regeneron)。误差线反映平均值的标准误差。
[0516]
静脉施用的ksi-301显示出快速的全身清除(图3)。将ksi-301数据与贝伐单抗的公布结果进行比较表明,ksi-301的全身清除更快。贝伐单抗数据来自yeung et al 2010cancer research。
[0517]
实施例2:在患有糖尿病性黄斑水肿(dme)的受试者中玻璃体内施用ksi-301的剂量递增研究
[0518]
研究设计
[0519]
进行了一项剂量递增研究,以评估ksi-301的眼部和全身安全性、耐受性,并确定其最大耐受剂量(mtd)。将1.25mg、2.5mg和5mg(按蛋白质重量计)三种剂量中的一种以单次注射形式给予每个受试者。每个剂量水平有三名受试者参加。在以下时间点对受试者进行了总共12周的随访;第2天、第1周、第2周、第4周、第8周以及第12周的最终随访。
[0520]
在研究开始时,前3名受试者被纳入第一个给药群组(1.25mg的ksi-301),并接受ksi-301的单一玻璃体内剂量的治疗。继续对受试者进行评估,受试者之间的等待期为至少24小时,以便在批准对下一位受试者进行注射前,为每位受试者留出足够的安全审查时间。
[0521]
一旦前一剂量水平的第3名受试者在其ksi-301剂量后完成一周的安全期,就以递增的方式招募剂量组。受试者招募和剂量递增基于安全信息审查和剂量限制毒性(dlt)的发生。
[0522]
九名入选受试者中有八名以前接受过治疗,尽管以前接受过多次抗vegf治疗并患有严重疾病(前一年bcva中位数为3,范围为0-7),但反应有限或无反应。
[0523]
结果
[0524]
单次注射ksi-301导致持续12周的快速、高强度反应(图4)。没有观察到眼内炎症和药物相关的不良事件。图4:向患有糖尿病性黄斑水肿(dme)的受试者玻璃体内施用1.25mg、2.5mg、或5mg(按蛋白质重量计)的ksi-301。玻璃体内注射ksi-301后测量bcva和oct cst。从基线到第12周的中位数变化,汇总3个剂量组(n=总共9名患者,每个剂量组3名患者)。do dv,angiogenesis 2019;patel et al.,arvo 2019。
[0525]
该结果显示了单次注射形式的ksi-301在患者中的有效性,其中大多数患者之前曾使用其他抗vegf药物(贝伐单抗、阿柏西普和/或雷珠单抗)治疗其dme。结果表明,玻璃体内施用ksi-301可在12周内以稳定的方式改善视敏度和视网膜厚度(通过oct测量)。该实验检查了患有严重疾病的糖尿病性黄斑水肿(dme)患者(n=9)。一些患者以前接受过治疗(8/9),尽管以前接受过多次抗vegf治疗且患有严重疾病(前一年中位数为3,范围为0-7),但反
应有限或无反应。结果表明,单次注射ksi-301可产生持续12周的快速、高强度反应。没有观察到眼内炎症和药物相关的不良事件。
[0526]
这些结果是通过向患有糖尿病性黄斑水肿的受试者玻璃体内施用1.25mg、2.5mg或5mg(按蛋白质重量计)的ksi-301获得的。该结果显示了单次注射形式的ksi-301在患者中的有效性,其中大多数患者之前曾使用其他抗vegf药物(贝伐单抗、阿柏西普和/或雷珠单抗)治疗其dme。结果表明,当如本文所述以单剂量施用ksi-301时,具有意想不到的治疗效果,因为视敏度和视网膜厚度(通过oct测量)在12周内以稳定的方式改善。
[0527]
实施例3:调查在湿性年龄相关性黄斑变性(wamd)患者中多次玻璃体内施用ksi-301的开放标签、多中心探索性研究
[0528]
除非另有说明,否则在实施例3、4和5中遵循以下研究设计和方法。总的来说,首次接受抗vegf治疗的wamd、dme或rvo患者被随机分配接受三个每月负荷剂量的2.5mg或5mg(按抗体重量计)ksi-301,然后每个月随访一次或以后更频繁,当医生确定由于疾病活动而需要再治疗或患者符合任何再治疗标准时进行再治疗。
[0529]
总体研究设计
[0530]
在本研究中,首次接受抗vegf治疗的wamd、dme或rvo患者被随机分配接受三个每月负荷剂量的2.5mg或5mg(按抗体重量计)ksi-301,然后每个月随访一次或以后更频繁,当医生确定由于疾病活动而需要再治疗或患者符合任何再治疗标准时进行再治疗。这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0531]
在一项多剂量研究中评估了ksi-301的两个剂量水平,即2.5mg(50μl)和5mg(100μl)(按蛋白质重量计)。每个受试者接受了3次ksi-301的初始玻璃体内注射,第一次在第1天,第二次在第4周,第三次在第8周(图5)。所有队列按1:3随机分配至2.5mg或5mg剂量。
[0532]
图5:评估ksi-301的玻璃体内施用的多剂量安全性、功效和持久性的随机开放标签研究的研究设计。
[0533]
每4周对受试者进行一次评估,如果符合特定的再治疗标准,则受试者可以从第16周开始接受研究药物的额外施用。在评估访视时没有强制注射,但湿性amd队列除外,在湿性amd队列中,如果距离上次注射已有24周,则在访视时进行强制玻璃体内注射。
[0534]
基于预定的纳入和排除标准选择合格受试者。受试者对于要治疗的眼部病症的治疗是首次接受治疗,并且除了正在研究的病况外,没有视网膜疾病史。
[0535]
将ksi-301配制在约12.5mm磷酸钠和0.025%聚山梨醇酯20中,形成50mg/ml(基于抗体质量)的水溶液,并填充到一次性2.0ml小瓶中。
[0536]
在研究期间,ksi-301的多剂量暴露耐受性良好,未观察到眼内炎症。113名受试者接受给药,总剂量为308剂(第1天104剂,第4周96剂,第8周84剂)。观察到以下情况:
[0537]
■
迄今为止,未报告研究眼睛中的眼内炎症或眼部sae;
[0538]
■
迄今为止,未报告药物相关不良事件(ae)或药物相关严重不良事件(sae);
[0539]
■
大多数ae被评估为轻度,符合玻璃体内抗vegf的特征;
[0540]
■
在4名受试者中报告了8例非药物相关性的非眼部sae:
[0541]
■
一名92岁的rvo受试者因既有病况住院,导致死亡
[0542]
■
一名66岁的rvo受试者因头晕住院
[0543]
■
一名43岁的dme受试者因既有病况住院
[0544]
■
一名56岁的dme受试者因既有病况住院
[0545]
wamd队列
[0546]
wamd队列中的患者:年龄≥50岁;首次接受涉及中央凹的湿性年龄相关性黄斑变性的治疗;任意损伤类型的损伤面积《30mm2(12个盘(disc)区域);在筛选时,研究眼睛的bcva etdrs字母评分≤78且≥23(~20/25至~20/320snellen等效值),并在第1天得到确认;且在研究眼睛中视力下降,确定主要是wamd的结果。
[0547]
研究人群的平均特征如表1所示。
[0548]
表1:研究人群特征
[0549][0550]
试验评估
[0551]
在ksi-301的3次初始玻璃体内注射后,每4周进行以下评估:最佳矫正视力(bcva),通过早期治疗糖尿病性视网膜病变研究(etdrs)视敏度测试进行;谱域光学相干层析成像(sd-oct);oct血管造影(oct-a)。
[0552]
再治疗标准(非负荷剂量)
[0553]
如果至少符合以下再治疗标准之一,则进行玻璃体内注射ksi-301的再治疗。这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0554]-与第12周相比,oct中心子区视网膜厚度(cst)增加≥75μm,bcva减少≥5个字母;
[0555]-由于wamd疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的视网膜下出血),与第1天相比,bcva减少》5个字母;
[0556]-由于wamd疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的视网膜下出血),与之前的最佳bcva相比,bcva减少≥10个字母;或者
[0557]-自上次注射后已过去24周/6个月。
[0558]
结果
[0559]
在第1天施用第一负荷剂量后,观察到患者的bcva和oct cst有所改善(图6;图12,
左栏)。改善的bcva和oct cst值与照护标准抗vegf疗法相当。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少8周(图6)。在一名代表性患者中,cst下降持续了7个月,没有进行再治疗(图12,左栏)。
[0560]
图6:湿性amd患者最佳矫正视力(bcva)和视网膜厚度(oct)的初步改善。wamd队列的bcva和cst评估。n=25。包括在数据截止日期前达到第16周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。
[0561]
图12:wamd队列患者的治疗持久性。在用ksi-301治疗的第1天(第1行)、第1周(第2行)、第3个月(第3行)和第7个月(第4行)对个体视网膜进行oct扫描。左栏:wamd患者;中间栏:dme患者;右栏:rvo患者。
[0562]
结果显示了wamd队列患者迄今为止的治疗持久性(图7)。数据表明,ksi-301提供了相对于现有药物意想不到的治疗效果,并且可能提供更好的结果,因为只有1名患者在第20周之前(或自最终负荷剂量后约3个月)进行了再治疗,1名患者自最终负荷剂量后3个月进行了再治疗,并且11/14(80%)的患者已经达到4个月或更长时间,直到第一次再治疗。这表明wamd中3至5个月的目标给药间隔是可能的。
[0563]
总之,25名患者中仅有1名(4%)在3个月内接受了再治疗(图7)。20名患者中只有1名(5%)在3个月时接受了再治疗。86%(18/21)的患者在最终负荷剂量后达到3个月或更长时间而没有接受再治疗,80%(11/14)的患者在最终负荷剂量后达到4个月或更长时间而没有接受再治疗。这表明wamd的目标给药间隔可以是3至5个月。
[0564]
图7:wamd队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。所有描述的患者都在指定的最后评估时间点(用右箭头表示)后接受随访。结果可以总结如下:
[0565]
●
18.5%接受了再治疗(5/27),在达到第20周的患者中,95%(20/21)在最终负荷剂量后超过12周未接受再治疗
[0566]
●
81.5%尚不需要再治疗(22/27)
[0567]
●
在达到第20周的患者中,95%(20/21)在第3个负荷剂量后至少12周未接受再治疗
[0568]
●
ksi-301 5mg剂量实现了负荷阶段后高达6个月的再治疗。
[0569]
实施例4:调查在糖尿病性黄斑水肿(dme)患者中多次玻璃体内施用ksi-301的开放标签、多中心探索性研究
[0570]
总体研究设计和试验评估如实施例3所述。
[0571]
dme队列
[0572]
dme队列中的患者有:糖尿病性黄斑水肿,首次接受治疗;在筛选时,研究眼睛的bcva etdrs字母评分≤78且≥23(~20/25至~20/320snellen等效值),并在第1天得到确认;sd-oct上的中心子区厚度(cst)≥300微米(heidelberg spectralis或同等产品);且在研究眼睛中视力下降,确定主要是dme的结果。
[0573]
研究人群的平均特征如上表1所示。
[0574]
再治疗标准(非负荷剂量)
[0575]
如果至少符合以下再治疗标准之一,则进行玻璃体内注射ksi-301的再治疗。这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0576]
与第12周或前次访视(两次访视之间相隔4周)相比,oct中心子区视网膜厚度(cst)增加≥75μm,bcva减少≥5个字母;或
[0577]
由于dme/rvo疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的渗出物),与之前的最佳bcva相比,bcva减少≥10个字母。
[0578]
结果
[0579]
在第1天施用第一负荷剂量后,观察到患者的bcva和oct cst有所改善(图8;图12,中间栏)。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少8周(图8)。在一名代表性患者中,cst下降持续了7个月,没有进行再治疗(图12,中间栏)。
[0580]
数据证明了ksi-301在dme患者中3个每月剂量后的作用(图8)。数据出乎意料,因为目前的产品需要每月治疗或5个每月负荷剂量,而ksi-301仅在3个负荷剂量后就提供了高水平的改善。
[0581]
图8:dme队列的bcva和cst评估。n=12。包括在数据截止日期前达到第16周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。
[0582]
最终负荷剂量后3个月内,无患者需要再治疗,且无患者需要第4或第5个每月负荷剂量(图9)。18%(2/11)的患者在3个月时进行了再治疗。在达到第20周的患者中,81.8%(9/11)在第3个负荷剂量后超过12周不需要再治疗。部分患者达到了4、5或6个月未再治疗。
[0583]
数据表明,在dme患者中,在仅3个负荷剂量后,有可能达到3+个月的给药间隔(图9)。此外,这些数据是出乎意料的,因为没有dme患者在3个月内接受再治疗。此外,超过80%在最终负荷剂量后超过3个月才需要再治疗。这是意料之外的,因为常规治疗在治疗的前12个月内会进行多达9-10次注射。
[0584]
图9:dme队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。对所有描述的患者都进行了随访,随访超过了指示的最后评估时间点(由右箭头指示)。结果可以总结如下:
[0585]
●
11.8%接受了再治疗(2/17)
[0586]
●
在达到第20周的患者中,80%(8/10)在最终负荷剂量后超过12周未接受再治疗
[0587]
●
88.2%尚未接受再治疗(15/17)
[0588]
●
在达到第20周的患者中,81.8%(9/11)在仅3个负荷剂量后超过12周未接受再治疗
[0589]
●
没有患者需要第4或第5个每月负荷剂量。
[0590]
图15描绘了糖尿病性视网膜病变严重程度结果(drss)。该图显示了具有不同水平的糖尿病性视网膜病变严重程度的患者的比例,由独立专家阅读中心采用标准化的摄影读数标度来衡量。dr可被描述为不同水平的严重程度,例如从轻度到中度到重度的非增殖性糖尿病性视网膜病变,或从轻度到高危增殖性dr。在这种情况下,大多数患者在基线时患有47级(level 47)疾病(中度npdr)。12周后(3个负荷剂量,然后1个月),27%的患者的dr严重程度改善》=2级,13%的患者改善一级,60%的患者保持相同水平的dr严重程度。(众所周知,在应用抗vegf疗法后,dr的严重程度得到改善,但使用其他药物需要1至2年才能达到峰值效果,并且如果停止抗vegf疗法,在许多患者中效果消失,疾病会再次恶化)。该图像显示
了患有增殖性(65级)疾病的患者,其在第12周时具有疾病改善并改善为非增殖性(53级,标准分级量表中的2级)。在没有给予额外剂量的情况下,对dr严重程度的影响维持了额外的14周,这是该患者可获得的最大随访时间。
[0591]
在一些实施方案中,可以使用抗vegf抗体缀合物(例如,ksi-301)治疗患有非增殖性dr的患者,而不使用或可能仅使用少量负荷剂量(例如,1个、2个或3个起始剂量),然后每3至6个月再治疗一次(对于治疗非增殖性dr)。
[0592]
实施例4.5
[0593]
确定患有非增殖性dr的患者。患者不接受负荷剂量治疗,但每3-6个月接受抗vegf抗体缀合物(如ksi-301)的单次注射治疗,治疗非增殖性dr。或者,患者先接受1、2或3个负荷剂量的治疗。
[0594]
实施例5:调查在视网膜静脉阻塞(rvo)受试者中多次玻璃体内施用ksi-301的开放标签、多中心探索性研究
[0595]
总体研究设计和试验评估如实施例3所述。
[0596]
rvo队列
[0597]
rvo队列中的患者有:视网膜静脉阻塞伴黄斑水肿和继发性视力损害,首次接受治疗;在筛选时,研究眼睛的bcva etdrs字母评分≤78且≥23(~20/25至~20/320snellen等效值),并在第1天得到确认;sd-oct上的中心子区厚度(cst)≥300微米(heidelberg spectralis或同等产品);视网膜分支静脉阻塞(brvo)或视网膜中央静脉阻塞(crvo);及研究眼睛中的视力下降,研究者确定这主要是rvo继发黄斑水肿的结果。
[0598]
研究人群的平均特征如表1所示。
[0599]
再治疗标准
[0600]
如果至少符合以下再治疗标准之一,则进行玻璃体内注射ksi-301的再治疗。这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0601]-与第12周或前次访视(两次访视之间相隔4周)相比,oct中心子区视网膜厚度(cst)增加≥75μm,bcva减少≥5个字母;或
[0602]-由于dme/rvo疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的渗出物),与之前的最佳bcva相比,bcva减少≥10个字母。
[0603]
结果
[0604]
在第1天施用第一负荷剂量后,观察到患者的bcva和oct cst有所改善(图10;图12,右栏)。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少8周(图10)。在一名代表性患者中,cst下降持续了7个月,没有进行再治疗(图12,右栏)。
[0605]
数据证明了ksi-301在rvo患者中3个每月剂量后的作用(图10)。数据出乎意料,因为在8周至16周期间观察到视敏度持续改善。在rvo的雷珠单抗、阿柏西普和贝伐单抗研究中,从每月一次的治疗转换到少于每月一次的治疗会导致视敏度和oct cst恶化。
[0606]
图10:rvo队列的bcva和cst评估。n=14。包括在数据截止日期前达到第16周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。
[0607]
rvo队列中75%(18/24)的患者不需要再治疗(图11)。8%(2/24)的患者在1个月时进行第一次再治疗;23%(3/13)的患者在2个月时进行第一次再治疗;11%(1/9)的患者在3
个月时进行第一次再治疗。在达到第20周的患者中,56%(5/9)在第3个负荷剂量后超过12周不需要再治疗。5mg队列中100%(18/18)的患者不需要第4或第5个每月负荷剂量,且如果有,在最终负荷剂量后9周或以后接受再治疗。此外,8名接受5mg治疗的患者中仅有2名在2个月时接受了第一次再治疗,并且两人在下次治疗前都有较长的时间。因此,在接受一次以上再治疗的患者中,第一次和第二次再治疗之间的时间比最终负荷剂量和第一次再治疗之间的时间延长。
[0608]
数据显示,在5mg剂量组中,rvo患者在第8周或之后接受第一次再治疗(图11)。这个结果是出乎意料的,因为常规疗法需要每月给药来治疗rvo。此外,在接受一次以上再治疗的患者中,第一次和第二次再治疗之间的时间延长了,这也是出乎意料的,因为典型的rvo患者的疾病复发具有特定的模式或规律的间隔。最后,超过一半的患者(5/9)自最终负荷剂量后已经超过3个月,这也是在rvo高眼内vegf负荷的情况下未预料到的。
[0609]
图11:rvo队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。随访超过了指示的最后评估时间点的患者由右箭头指示。左箭头表示终止。图11所示的进一步结果可以总结如下:
[0610]
●
25%患者接受了再治疗(6/24)
[0611]
●
在达到第20周的患者中,56%(5/9)在最终负荷剂量后超过12周未接受再治疗
[0612]
●
75%尚未接受再治疗(18/24)
[0613]
●
在达到第20周的患者中,56%(5/9)在仅3个负荷剂量后超过12周未接受再治疗
[0614]
●
ksi-301 5mg队列中18/18的患者不需要第4个每月负荷剂量。
[0615]
实施例6
[0616]
首先确定需要治疗(预防性或其他)眼部病症的受试者。然后以第一负荷剂量、任选的第二负荷剂量和任选的第三负荷剂量(在彼此的约一个月内)向受试者施用1至5mg的抗体的抗vegf抗体缀合物(例如,ksi-301)。最终负荷剂量后,受试者将保持抗vegf疗法的治疗益处至少12周。这可用于糖尿病性黄斑水肿(dme)、视网膜静脉阻塞(rvo)、湿性年龄相关性黄斑变性(amd)和/或替代的糖尿病性视网膜病变(dr)。
[0617]
实施例6.5
[0618]
首先确定需要治疗(预防性或其他)眼部病症的受试者。然后以第一负荷剂量、任选的第二负荷剂量和任选的第三负荷剂量(在彼此的约一个月内)向受试者施用1至5mg的抗体的抗vegf抗体缀合物(例如,ksi-301)。最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少16周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少20周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少24周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少30周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少36周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少42周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少48周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少54周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少60周。这可用于糖尿病性黄斑水肿(dme)、视网膜静脉阻塞(rvo)、湿性年龄相关性黄斑变性(amd)和/或替代的糖尿病
性视网膜病变(dr)。
[0619]
实施例7
[0620]
本实施例提供了一种治疗视网膜静脉阻塞(rvo)的方法。该方法包括以第一负荷剂量向患有rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)。然后可以重复该负荷剂量一次或两次。这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少8周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体生物缀合物(例如,ksi-301)疗法的治疗结果至少12周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体生物缀合物(例如,ksi-301)疗法的治疗结果至少20周。
[0621]
实施例7.5
[0622]
本实施例提供了一种治疗视网膜静脉阻塞(rvo)的方法。该方法包括以第一负荷剂量向患有rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)。然后可以重复该负荷剂量一次或两次。这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少24周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少30周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少36周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少42周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少48周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少54周。在替代方案中,这导致受试者在最终负荷剂量后保持抗vegf抗体缀合物疗法的治疗结果至少60周。
[0623]
实施例8
[0624]
本实施例提供了一种改善眼睛灌注的方法,该方法包括确定患有dme、dr或rvo的受试者。然后以1.25-5mg向受试者施用抗vegf抗体缀合物(例如,ksi-301)的至少2个负荷剂量,每次注射之间间隔一个月。一个人注射不超过2次。然后向受试者提供抗vegf抗体缀合物(例如,ksi-301)的一个或多个进一步剂量(再治疗),直到受试者在至少一只眼睛中表现出改善的灌注。
[0625]
实施例9
[0626]
本实施例提供了一种改善眼睛灌注的方法。该方法包括确定患有非增殖性dr的受试者,及向受试者施用抗vegf抗体缀合物(例如,ksi-301)的初始剂量(1到5mg的抗体),以在至少一只眼睛中提供改善的灌注。重复该剂量,直到在受试者的治疗眼内实现灌注。
[0627]
实施例10
[0628]
本实施例提供了治疗患有dme、dr或rvo的受试者的方法。该方法包括向患有dme、dr或rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)的1-3个负荷剂量(以1-5mg的抗体每月一次)。向受试者施用不超过3个负荷剂量。根据需要(如果有的话),在不早于最终负荷剂量后12周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。
[0629]
实施例10.5
[0630]
本实施例提供了治疗患有dme、dr或rvo的受试者的方法。该方法包括向患有dme、dr或rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)的1-3个负荷剂量(以1-5mg的抗体每月一次)。向受试者施用不超过3个负荷剂量。根据需要(如果有的话),在不早于最终负荷剂量后16周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终
负荷剂量后20周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终负荷剂量后24周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终负荷剂量后30周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终负荷剂量后36周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终负荷剂量后42周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终负荷剂量后48周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终负荷剂量后54周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。或者,在不早于最终负荷剂量后60周的时间点提供抗vegf抗体缀合物的后续应用(再治疗)。
[0631]
实施例11
[0632]
本实施例提供了一种治疗患有非增殖性dr的受试者的方法。确定需要治疗的患者,并向患有非增殖性dr的受试者施用抗vegf抗体缀合物(例如,ksi-301)的1或2个负荷剂量(1-5mg,每月一次)。向受试者施用不超过2个负荷剂量。任选地,可以在不早于最终负荷剂量后12周的时间点提供抗vegf抗体缀合物(例如,ksi-301)的后续施用(再治疗)。
[0633]
实施例11.5
[0634]
本实施例提供了一种治疗患有非增殖性dr的受试者的方法。确定需要治疗的患者,并向患有非增殖性dr的受试者施用抗vegf抗体缀合物(例如,ksi-301)的1或2个负荷剂量(1-5mg,每月一次)。向受试者施用不超过2个负荷剂量。可选地,可以在不早于最终负荷剂量后16周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后20周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后24周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后30周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后36周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后42周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后48周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后54周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,可以在不早于最终负荷剂量后60周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。
[0635]
实施例12
[0636]
本实施例提供了治疗患有rvo的受试者的方法。该方法包括向患有rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)的1或2个负荷剂量(1-5mg,每月一次)。不向该3受试者施用另外的负荷剂量。然后,可选地,在不早于最终负荷剂量后8周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,再治疗发生在不早于12周。或者,再治疗发生在不早于16周。或者,再治疗发生在不早于20周。或者,再治疗发生在不早于24周。
[0637]
实施例12.5
[0638]
本实施例提供了治疗患有rvo的受试者的方法。该方法包括向患有rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)的1或2个负荷剂量(1-5mg,每月一次)。不向该3受试者施用另外的负荷剂量。然后,可选地,在不早于最终负荷剂量后30周的时间点提供抗vegf抗体缀合物的后续施用(再治疗)。或者,再治疗发生在不早于36周。或者,再治疗发生在不早于42周。或者,再治疗发生在不早于48周。或者,再治疗发生在不早于54周。或者,再治疗
发生在不早于60周。
[0639]
实施例13
[0640]
本实施例提供了一种治疗rvo的方法。以1-3个负荷剂量向需要治疗rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)(1-5mg,每月一次)。因此,受试者在最终负荷剂量后保持对于rvo的抗vegf抗体缀合物疗法的治疗结果至少8周。在这段时间内,受试者将保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体缀合物后至少14周内基本上不会从另一次再治疗中获益。
[0641]
实施例13.5
[0642]
本实施例提供了一种治疗rvo的方法。以1-3个负荷剂量向需要治疗rvo的受试者施用抗vegf抗体缀合物(例如,ksi-301)(1-5mg,每月一次)。因此,受试者在最终负荷剂量后保持对于rvo的抗vegf抗体缀合物疗法的治疗结果至少12周。在这段时间内,受试者将保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少18周内基本上不会从另一次再治疗中获益。或者,在这段时间内,受试者保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少24周内基本上不会从另一次再治疗中获益。或者,在这段时间内,受试者保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少30周内基本上不会从另一次再治疗中获益。或者,在这段时间内,受试者保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少36周内基本上不会从另一次再治疗中获益。或者,在这段时间内,受试者保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少42周内基本上不会从另一次再治疗中获益。或者,在这段时间内,受试者保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少48周内基本上不会从另一次再治疗中获益。或者,在这段时间内,受试者保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少54周内基本上不会从另一次再治疗中获益。或者,在这段时间内,受试者保留至少一种(如果不是大部分或全部)治疗益处,使得受试者在最后一次应用抗vegf抗体生物缀合物后至少60周内基本上不会从另一次再治疗中获益。
[0643]
实施例14
[0644]
首先确定需要治疗(预防性或其他)眼部病症的受试者。然后以第一负荷剂量、任选的第二负荷剂量和任选的第三负荷剂量(在彼此的约一个月内)向受试者施用1至5mg的抗体的抗vegf抗体缀合物(例如,ksi-301)。最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少12周。这可用于糖尿病性黄斑水肿(dme)、视网膜静脉阻塞(rvo)、湿性年龄相关性黄斑变性(amd)和/或替代的糖尿病性视网膜病变(dr)。在任何再治疗应用之后,任何后续再治疗事件之间的持续时间将增加,因为受试者对所施用的每次再治疗需要的治疗越来越少。
[0645]
实施例14.5
[0646]
首先确定需要治疗(预防性或其他)眼部病症的受试者。然后以第一负荷剂量、任选的第二负荷剂量和任选的第三负荷剂量(在彼此的约一个月内)向受试者施用1至5mg的抗体的抗vegf抗体缀合物(例如,ksi-301)。最终负荷剂量后,受试者将保持抗vegf抗体缀
合物疗法的治疗益处至少18周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少24周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少30周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少36周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少42周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少48周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少54周。或者,最终负荷剂量后,受试者将保持抗vegf抗体缀合物疗法的治疗益处至少60周。
[0647]
这可用于糖尿病性黄斑水肿(dme)、视网膜静脉阻塞(rvo)、湿性年龄相关性黄斑变性(amd)和/或替代的糖尿病性视网膜病变(dr)。在任何再治疗应用之后,任何后续再治疗事件之间的持续时间将增加,因为受试者对所施用的每次再治疗需要的治疗越来越少。
[0648]
实施例15
[0649]
本实施例总结了通过重复施用使用ksi-301观察到的安全性和特征。113名受试者在1a期和1b期给药。共施用308个剂量。就安全性而言,观察到以下情况:
[0650]
■
迄今为止,未报告研究眼睛中的眼内炎症或眼部sae;
[0651]
■
迄今为止,未报告药物相关性ae或药物相关性sae
[0652]
■
大多数ae被评估为轻度,符合玻璃体内抗vegf的特征
[0653]
■
在4名受试者中报告了8例非药物相关性的非眼部sae:
[0654]
–
一名92岁的rvo受试者因既有病况住院,导致死亡
[0655]
–
一名66岁的rvo受试者因头晕住院
[0656]
–
一名43岁的dme受试者因既有病况住院
[0657]
–
一名56岁的dme受试者因既有病况住院。
[0658]
上述实施例表明,抗体生物聚合物缀合物(abc)构建体是长耐久性玻璃体内药物的新设计平台。ksi-301取得了重要的发展成果,包括:
[0659]
极好的安全性:300+剂量后眼内炎症为零例
[0660]
强效:适用于3种主要表型可变的视网膜疾病湿性amd、dme/dr&rvo
[0661]
显著的生物学持久性:在3个负荷剂量后,大多数接受治疗的眼睛延长至4个月或更长时间而未进行再治疗。预计将展示以下方面的潜力:
[0662]
○
在wamd中3至5个月以上的间隔期
[0663]
○
在dme中3至5个月以上的间隔期
[0664]
○
在rvo中2至3个月以上的间隔期
[0665]
实施例16
[0666]
图17a和17b描述了湿性amd患者的oct和oct血管造影术,该患者已经在基线、第4周和第8周用3个负荷剂量的5mg ksi-301进行了治疗。除了减少oct图像上的流体,还对脉络膜新生血管膜的流量和大小有直接影响,如图中心的斑点减少所示。脉络膜新生血管膜是湿性amd的核心特征,对该膜的直接影响被认为是疾病改善的标志。
[0667]
实施例17
[0668]
图18a-18d显示了在3个负荷剂量后具有疾病改善的dme的实例,其中显著的drss改善和再灌注代表疾病改善。图18a显示了一个时间过程,揭示了在dme中仅用3个负荷剂量(至少5个月内不需要再治疗)就可以获得快速且长效效果。图18b证明了ksi-301的仅三个
负荷剂量在增殖性糖尿病性视网膜病变中的有效性。如图所示,在ksi-301的3个负荷剂量后,有快速且显著(2级)的改善,持续14周。除了从pdr转化为npdr,受试者还表现出外周血管再灌注的迹象(图18c和18d)。
[0669]
因此,以本文提供的方式使用ksi-301可用于实现快速且延长的结果和再灌注。
[0670]
实施例18
[0671]
图19显示了在rvo患者中的结果,即在3个负荷剂量之后,至少5个月不需要额外的剂量,这代表了被认为是疾病改善的情况。因此,以本文提供的方式使用ksi-301可用于实现疾病改善。
[0672]
实施例19
[0673]
图20展示了患者的一组oct图像,其显示3个负荷剂量的效果持续8周,直到疾病复发并且患者接受再治疗。第4个剂量的效果持续16周,直到患者需要再治疗,有效地将再治疗间隔从8周加倍到16周,这可能是疾病改善的标志。因此,这表明通过再治疗过程也实现了额外的有效性,允许在后续所需的再治疗之间有更多的时间。
[0674]
实施例20
[0675]
图21a-21c显示了ksi-301的单次注射的结果。1期单剂量研究-总结:
[0676]
●
在测试的所有剂量水平上都观察到了快速、高强度和持久的治疗反应。
[0677]
●
单剂量后12周,观察到相对于基线的中值bcva改善为+9个etdrs图表字母,视网膜水肿的中值改善为-121微米(oct cst)。
[0678]
●
在每个患者12周的最后一次访视中,没有观察到剂量限制性毒性、药物相关的不良事件或眼内炎症。
[0679]
图21a显示了从基线到第12周的中值变化图。它展示了ksi-301施用持久的快速、高响应。案例研究1的结果显示在图21b中,其证明了ksi-301施用对先前具有次优反应的受试者的慢性黄斑水肿的有效性。图21c显示了来自案例研究2的结果,其显示了在患有慢性水肿和广泛中央凹脂质渗出的受试者中视网膜下液在12周内消退。
[0680]
这些结果提供了两种情况,其中在单次注射后,在先前治疗且失败的患者中,单次注射ksi-301具有长期持续的益处。在案例2中,注射ksi-301后,效果缓慢显现并随时间增加,证明了一种疾病改善的形式。
[0681]
实施例21
[0682]
对参与实施例3所述研究的患者进行了随访评估。结果显示,ksi-301治疗的持久性在来自wamd队列的患者中延长至3至5个月或更长时间(图22)。83%(20/24)的患者在第一次再治疗前达到了4个月或更长时间。85%(22/26)的患者在最终负荷剂量后超过3个月未接受再治疗。6%(2/31)在最终负荷剂量后的3个月内接受了再治疗,且8%(2/25)在最终负荷剂量后的3个月时接受了再治疗。这些结果表明,wamd的目标给药间隔可以是负荷剂量后的3至5个月或更长时间。
[0683]
图22:wamd队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。随访超过了指示的最后评估时间点的患者(由右箭头指示)。左箭头所示为一名不继续的患者。
[0684]
在第20周,即最终负荷剂量后12周,在患者中继续观察到bcva和oct cst的改善(图23)。改善的bcva和oct cst值与照护标准抗vegf疗法相当。ksi-301的治疗效果在负荷
阶段持续,并在第8周施用最终负荷剂量后持续至少12周(图23)。在达到第12周的较大患者队列中观察到了bcva和oct cst改善(图25)。
[0685]
图23:湿性amd患者最佳矫正视力(bcva)和视网膜厚度(oct)的改善。amd队列的bcva和cst评估。n=25。包括在数据截止日期前达到第20周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0686]
图25:使用ksi-301治疗的湿性amd患者的bcva和oct改善。n=31。包括在数据截止日期前达到第12周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0687]
对wamd队列中没有高色素上皮脱离(ped)的患者子集的bcva和oct cst的改善进行了分析。这些患者的bcva和oct cst值也持续改善,ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少12周(图24)。在达到第12周的无高ped的wamd患者的较大队列中观察到了bcva和oct cst改善(图26)。
[0688]
图24:无高ped的湿性amd患者的最佳矫正视力(bcva)和视网膜厚度(oct)的改善。wamd队列的bcva和cst评估。n=23。高ped被定义为存在基线cst≥500微米的ped。包括在数据截止日期前达到第20周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0689]
图26:使用ksi-301治疗的高ped湿性amd患者的bcva和oct改善。n=29。高ped被定义为存在基线cst≥500微米的ped。包括在数据截止日期前达到第12周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0690]
实施例22
[0691]
对参与实施例4所述研究的患者进行了随访评估。结果显示,ksi-301治疗的持久性在来自dme队列的患者中延长超过4个月(图27)。72%(8/11)的患者实现了4个月或更长时间没有再治疗。81%(13/16)在最终负荷剂量后3个月以上不需要再治疗。1例患者在3个月内接受了再治疗,13%(2/15)的患者在3个月时接受了再治疗。这些结果表明,dme的目标给药间隔可以是负荷剂量后的3个月或更长时间。
[0692]
图27:dme队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。对所有描述的患者都进行了随访,随访超过了指示的最后评估时间点(由右箭头指示)。
[0693]
在第20周,即最终负荷剂量后12周,在dme患者中观察到了bcva和oct cst的改善(图28)。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少12周。在达到第12周的较大dme患者队列中观察到了bcva和oct cst改善(图29)。
[0694]
图28:dme队列的bcva和cst评估。n=15。包括在数据截止日期前达到第20周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0695]
图29:dme队列的bcva和cst评估。n=19。包括在数据截止日期前达到第12周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0696]
实施例23
[0697]
对参与实施例5所述研究的患者进行了随访评估。结果显示,ksi-301治疗的持久性在来自rvo队列的患者中延长超过3个月(图30)。只有3例患者接受了1次以上的再治疗,在这3例患者中,每次再治疗的间隔都比第一次间隔长,直至再治疗。50%(9/18)的患者实现了3个月或更长时间没有再治疗。6%(2/32)、30%(7/23)和14%(2/14)的患者分别在第1、2和3个月接受第一次再治疗。这些结果表明,rvo的目标给药间隔可以是2至3个月或更长。
[0698]
图30:rvo队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。随访超过了指示的最后评估时间点的患者由右箭头指示。左箭头表示终止。
[0699]
在第20周,即最终负荷剂量后12周,在rvo患者中观察到了bcva和oct cst的改善(图31)。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少12周(图31)。在达到第12周的较大rvo患者队列中观察到了bcva和oct cst改善(图32)。
[0700]
图31:rvo队列的bcva和cst评估。n=15。包括在数据截止日期前达到第20周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0701]
图32:rvo队列的bcva和cst评估。n=32。包括在数据截止日期前达到第12周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0702]
实施例24
[0703]
在实施例22-23所述的研究期间,ksi-301的多剂量暴露耐受良好,未观察到眼内炎症。116名受试者接受给药,总剂量为338剂(第1天107剂,第4周103剂,第8周96剂)。观察到以下情况:
[0704]
■
迄今为止,未报告研究眼睛中的眼内炎症或眼部sae;
[0705]
■
迄今为止,未报告药物相关不良事件(ae)或药物相关严重不良事件(sae);
[0706]
■
大多数ae被评估为轻度,符合玻璃体内抗vegf的特征;
[0707]
■
在7名受试者中报告了12例非药物相关性的非眼部sae:
[0708]
■
一名92岁的rvo受试者因既有病况住院,导致死亡;
[0709]
■
一名66岁的rvo受试者因头晕住院;
[0710]
■
一名43岁的rvo受试者腿部骨折,与摩托车事故有关;
[0711]
■
一名85岁的rvo受试者因既有病况住院。
[0712]
实施例24
[0713]
实施例3-5、15-23中所述的研究进一步延长至多达72周,如图33所示。
[0714]
图33:评估ksi-301的玻璃体内施用的多剂量安全性、功效和持久性的随机开放标签研究的更新研究设计。
[0715]
更新的研究人群平均特征如表2所示。
[0716]
表2:更新的研究人群特征
[0717][0718][0719]
sd=标准偏差;bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度
[0720]
对参与实施例21所述研究的患者进行了进一步的随访评估。结果显示,ksi-301治疗的持久性在来自wamd队列的患者中延长至3至6个月或更长时间(图34)。在55%(16/29)的患者中,第一次再治疗是在最终负荷剂量后的6个月时,这在wamd队列的研究设计中是强制再治疗。72%(21/29)的患者在最终负荷剂量后5个月或更长时间未接受再治疗。84%(27/32)的患者在最终负荷剂量后4个月或更长时间未接受再治疗。86%(30/35)的患者在最终负荷剂量后3个月或更长时间未接受再治疗。14%(5/35)在最终负荷剂量后3个月时或之前接受了再治疗。这些结果表明,wamd的目标给药间隔可以是最终负荷剂量后的3至6个月或更长时间。
[0721]
图34:wamd队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。随访超过了指示的最后评估时间点的患者由右箭头指示。左箭头所示为一名不继续的患者。
[0722]
在第24周,即最终负荷剂量后的16周,患者中维持了bcva和oct cst的改善(图35)。该队列的基线(治疗前)bcva是64.1个etdrs字母。第24周时bcva的平均改善为+5.9个字母(对应于20/40snellen va)。改善的bcva和oct cst值与照护标准抗vegf治疗中报告的改善相当(在第20周时,基线为60.8个字母,增加了约6个字母;或者基线为61.5,增加了约
5.2个字母)。第24周时oct cst的平均改善为-58微米。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少16周(图35)。
[0723]
在最终负荷剂量后的16周内,患者平均接受了0.16次ksi-301注射,用于再治疗(图35)。这与照护标准治疗阿柏西普或布洛赛珠单抗(brolucizumab)相比,根据各自的标签,阿柏西普或布洛赛珠单抗需要在相同的时间段内平均注射1.0次。
[0724]
图35:湿性amd患者最佳矫正视力(bcva)和视网膜厚度(oct)的改善。amd队列的bcva和cst评估。n=31。包括在数据截止日期前达到第24周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0725]
实施例25
[0726]
对参与实施例22所述研究的患者进行了进一步的随访评估。dme队列人群特征如表2所述。结果显示,ksi-301治疗的持久性在来自dme队列的患者中延长超过6个月(图36)。69%(9/13)的患者实现了6个月或更长时间没有再治疗。73%(11/15)在最终负荷剂量后5个月以上不需要再治疗。80%(16/20)在最终负荷剂量后4个月以上不需要再治疗。83%(20/24)在最终负荷剂量后3个月以上不需要再治疗。17%(4/24)的患者在前3个月期间接受了再治疗。这些结果表明,dme的目标给药间隔可以是最终负荷剂量后的3至6个月或更长时间。
[0727]
图36:dme队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。对所有描述的患者都进行了随访,随访超过了指示的最后评估时间点(由右箭头指示)。
[0728]
在第24周,即最终负荷剂量后16周,在dme患者中观察到了bcva和oct cst的改善(图37)。第24周时bcva的平均改善为+6.8个字母(对应于~20/32
+2
snellen va)。第24周时oct cst的平均改善为-133微米。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少16周。
[0729]
在负荷剂量后的16周内,患者平均接受了0.21次ksi-301注射(图37)。这与照护标准治疗阿柏西普或布洛赛珠单抗形成对比,根据标签(阿柏西普)或基于关键研究设计(布洛赛珠单抗),阿柏西普或布洛赛珠单抗在同一时间段内要求平均注射2.0次。
[0730]
图37:dme队列的bcva和cst评估。n=19。包括在数据截止日期前达到第24周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0731]
实施例26
[0732]
对参与实施例23所述研究的患者进行了随访评估。rvo队列人群特征如表2所述。结果显示,ksi-301治疗的持久性在来自rvo队列的患者中延长超过4个月(图38)。53%(16/30)的患者实现了4个月或更长时间没有再治疗。55%(17/31)的患者实现了3个月或更长时间没有再治疗。34%(11/32)的患者在最终负荷剂量后的前2个月内接受了再治疗,而45%(14/31)在最终负荷剂量后的前3个月内接受了再治疗。这些结果表明,rvo的目标给药间隔可以是2至4个月或更长。
[0733]
图38:rvo队列中ksi-301的治疗持久性。包括在数据截止日期前达到第一次再治疗机会(第12周访视)的随机患者。每个条形代表一位患者。再治疗用(
◆
)表示。随访超过了
指示的最后评估时间点的患者由右箭头指示。左箭头表示终止。
[0734]
在第24周,即最终负荷剂量后16周,在rvo患者中继续观察到bcva和oct cst的改善(图39)。第24周时bcva的平均改善为+22.2个字母(对应于20/32snellen va)。第24周时oct cst的平均改善为-350微米。ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少16周(图39)。
[0735]
在最终负荷剂量后的16周内,患者平均接受了0.46次ksi-301注射,用于再治疗(图39)。这与照护标准治疗阿柏西普或布洛赛珠单抗形成对比,根据标签(阿柏西普)或基于关键研究设计(布洛赛珠单抗),阿柏西普或布洛赛珠单抗在同一时间段内要求平均注射3.0次。
[0736]
图39:rvo队列的bcva和cst评估。n=30。包括在数据截止日期前达到第24周访视的随机患者;合并2.5mg和5mg剂量。bcva=最佳矫正视力;oct=光学相干断层扫描;cst=中心子区厚度。误差线表示平均值的标准误差。
[0737]
实施例27
[0738]
在实施例3-5和15-26所述的研究期间,ksi-301的多剂量暴露耐受良好,未观察到眼内炎症。130名受试者接受给药,总剂量为420剂(第1天121剂,第4周112剂,第8周105剂)。注意到以下情况:
[0739]
■
迄今为止,未报告研究眼睛中的眼内炎症或眼部sae;
[0740]
■
迄今为止,未报告药物相关不良事件(ae)或药物相关严重不良事件(sae);
[0741]
■
大多数ae被评估为轻度,符合玻璃体内抗vegf的特征;
[0742]
■
在10名受试者中报告了16例非药物相关性的非眼部sae:
[0743]
■
一名92岁的rvo受试者因既有病况住院,导致死亡;
[0744]
■
六名(分别为43、56、62、66、70和72岁)dme受试者因既有病况住院;
[0745]
■
一名66岁的rvo受试者因头晕住院;
[0746]
■
一名43岁的rvo受试者腿部骨折,与摩托车事故有关;
[0747]
■
一名85岁的rvo受试者因既有病况住院。
[0748]
实施例28:wamd中ksi-301和照护标准治疗的2期随机研究
[0749]
约550名首次接受治疗的wamd患者参与了一项随机研究,该研究比较了ksi-301治疗与照护标准疗法(阿柏西普)治疗。照护标准治疗包括3个负荷剂量的治疗药物(每次施用2mg),每隔4周施用,然后改为从初始治疗后16周开始,每4周施用维持剂量或假注射(图40)。因此,每8周向患者施用照护标准治疗药物。
[0750]
向另一患者队列施用3个负荷剂量的ksi-301(每次施用5mg),间隔为4周。在最终负荷剂量(第8周)后,从初始治疗后16周开始,患者每4周至少接受一次假注射(图40)。在最终负荷剂量(第8周)后,每12周(q12w)评估一个接受ksi-301治疗的患者的队列的疾病活动。在最终负荷剂量(第8周)后,每16周(q16w)评估另一个接受ksi-301治疗的患者的队列的疾病活动。如果评估的疾病活动符合预先指定的再治疗标准,则用ksi-301对患者进行再治疗。第三组接受ksi-301治疗的患者的队列在最终负荷剂量(第8周)后每20周(q20w)施用ksi-301。所有患者都在最终负荷剂量(第8周)后20周施用ksi-301。
[0751]
图40:随机研究的研究设计,以评估ksi-301与阿柏西普对首次接受治疗的wamd患者的治疗。ksi-301的给药频率低至每20周一次。
[0752]
再治疗标准(非负荷剂量)
[0753]
如果至少符合以下再治疗标准之一,则进行玻璃体内注射ksi-301的再治疗。这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0754]-与第12周相比,oct中心子区视网膜厚度(cst)增加≥50μm,bcva减少≥5个字母;
[0755]-由于wamd疾病活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的视网膜下出血),与之前的最佳bcva相比,bcva减少≥10个字母;
[0756]-oct中心子区视网膜厚度(cst)增加≥75μm;
[0757]-新的黄斑出血。
[0758]
如实施例3、15、21和24中所述的在1b期研究中在对接受ksi-301治疗的wamd患者的评估期间观察到的疾病活动被用于根据2期临床试验中规定的更严格的再治疗标准为每位患者构建一个假设的再治疗方案(图41a)。在总共32名患者中,24名患者(或75%)将达到5个月的再治疗上限,而无需提前再治疗(图41a和41b)。只有12.5%的患者需要在12周时进行第一次再治疗,另有12.5%的患者需要在16周时进行第一次再治疗(图41a和41b)。
[0759]
图41a和41b:在2期临床试验的假设再治疗标准下,wamd队列中ksi-301的治疗持久性(图41),以及患者保持q20w给药的假设概率(图41b)。包括在数据截止日期时在28周内或第28周符合再治疗标准的随机患者。每个条形代表一位患者。
[0760]
实施例29
[0761]
实施例3-5、15-24中描述的研究进一步延长至第76至148周(第19至36个月)(图43)。图43显示了评估ksi-301的玻璃体内施用的多剂量安全性、功效和持久性的随机开放标签研究的更新研究设计。该研究的wamd、dme和rvo组的患者人数分别为51、35和35。
[0762]
实施例30
[0763]
该实施例显示了对实施例21和24中描述的ksi-301治疗wamd的临床研究的进一步随访评估。结果显示,在第44周,即最终负荷剂量后的36周,患者维持了改善的平均bcva和oct cst(图44)。抗vegf抗体缀合物的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少36周。58%的患者在第32周接受了第一再治疗剂量(q6m给药),这是自最终负荷剂量以来未再接受再治疗的患者的强制再治疗剂量。此外,患者在第12周至第40周期间平均接受了1.32次抗vegf抗体缀合物注射,其中44%为强制q6m剂量。相比之下,在同一时间段内,根据常规治疗(阿柏西普)标签的平均注射次数为4次。
[0764]
图45a显示了随访评估的个体细分。wamd队列患者中抗vegf抗体缀合物治疗的持久性延长至3至6个月或更长时间。图45b总结了图45a所示的结果。在72%的患者中,患者在最终负荷剂量后的某个时间达到了至少一次6个月的治疗间隔(q6m—治疗剂量之间的间隔的强制上限)(图45b)。49%(20/41)的患者在最终负荷剂量后6个月未接受再治疗。66%(27/41)的患者在最终负荷剂量后5个月或更长时间未接受再治疗。82%(40/49)的患者在最终负荷剂量后4个月或更长时间未接受再治疗。92%(45/49)的患者在最终负荷剂量后3个月或更长时间未接受再治疗。只有8%(4/49)在最终负荷剂量后2个月时或之前接受了再治疗。这些结果表明,wamd中抗vegf抗体缀合物的目标给药间隔可以是最终负荷剂量后的3至6个月或更长时间。
[0765]
因此,将近一半的wamd患者按时进行了6个月的第一次再治疗,并且》60%的wamd患者在随访期间至少实现了一次6个月的间隔。仅从ksi-301的半衰期来看,这些结果是出
乎意料的。
[0766]
图46显示了上述1b期研究中wamd患者的案例,该患者接受了ksi-301治疗,6-月给药,为期1年。在指定时间点拍摄oct图像。还评估了bcva(由“周”标签下etdrs字母值的变化指示)。早在最终负荷剂量后1个月(第12周)就观察到了oct和bcva改善,并且在最终负荷剂量后持续至少6个月(第32周)。在6个月时(第32周),施用了强制再治疗剂量。再治疗后6个月(第56周),患者保持了oct和bcva的改善。患者在治疗的第一年总共接受了4次玻璃体内注射。
[0767]
在一些实施方案中,在wamd患者被施用最终负荷剂量后的任意时间段,以约3个月、约4个月、约5个月或约6个月、或者上述任意两个值之间的任意时间间隔的给药间隔,向该患者玻璃体内施用有效量的抗vegf抗体缀合物(例如,ksi-301)。在一些实施方案中,wamd患者不施用抗vegf抗体缀合物的维持剂量,直到最终负荷剂量后至少约3个月、至少约4个月、至少约5个月、至少约6个月或更长时间、或者直到上述任意两个值之间的任意时间点。在一些实施方案中,wamd患者具有约40%、约50%、约55%、约60%、或约65%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约6个月或更长时间。在一些实施方案中,wamd患者具有约50%、约55%、约60%、约65%、或约70%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约5个月或更长时间。在一些实施方案中,wamd患者具有约50%、约60%、约70%、或约80%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约4个月或更长时间。在一些实施方案中,wamd患者具有约60%、约70%、约80%、或约90%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约3个月或更长时间。在一些实施方案中,受试者在wamd治疗的第一年接受8次或更少、7次或更少、6次或更少、5次或更少、4次或更少的抗vegf抗体缀合物的玻璃体内注射,包括负荷剂量。在一些实施方案中,对于wamd治疗,受试者每年接受4次或更少、3次或更少、2次或更少、或1次抗vegf抗体缀合物的维持剂量。
[0768]
实施例31
[0769]
本实施例显示了与首次接受治疗的wamd的阿柏西普的长间隔rct数据(图47)和wamd的eylea现实世界数据(图48)相比的ksi-301持久性的基准。图47显示了将上述ksi-301 1b期研究中首次接受治疗的wamd患者中的治疗间隔分布与雷珠单抗和阿柏西普(两种常规抗vegf治疗的组合)的治疗延长(treat-and-extend)随机临床试验中的治疗间隔分布进行了比较。几乎50%接受常规抗vegf治疗的患者的治疗间隔为4周,对于约15%的患者,治疗间隔延长至最大间隔12周(3个月)。相比之下,约50%接受ksi-301治疗的患者的治疗间隔为24周(6个月)——这是该研究允许的最大间隔。超过80%接受ksi-301治疗的患者的治疗间隔为16周或更长,超过了常规抗vegf治疗达到的最大治疗间隔。
[0770]
图48显示了上述1b期研究中使用ksi-301治疗的患者的平均治疗间隔与阿柏西普治疗延长的现实世界数据的平均治疗间隔的比较。接受阿柏西普治疗的患者的平均治疗间隔为8周,平均最大治疗间隔为9.6周。相比之下,ksi-301的患者的平均首次间隔(最终负荷剂量后第一次再治疗的平均间隔)为19.3周,平均最大间隔为20.6周。这些结果表明,与用于治疗wamd的常规抗vegf治疗相比,抗vegf抗体缀合物的治疗效果持续时间
更长。
[0771]
在一些实施方案中,用抗vegf抗体缀合物(例如,ksi-301)治疗wamd的平均最大间隔比常规抗vegf治疗的平均最大间隔长至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约110%、至少约120%、至少约130%、至少约140%、至少约150%、至少约170%或至少约200%。在一些实施方案中,以比常规抗vegf治疗的施用频率低至多约80%、至多约70%、至多约60%、至多约50%、至多约40%、至多约30%、至多约20%、至多约10%或更低的频率向wamd患者施用抗vegf抗体缀合物,以治疗wamd。
[0772]
实施例32
[0773]
该实施例显示了对实施例22和25中描述的ksi-301治疗dme的临床研究的进一步随访评估。图49显示,ksi-301的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少36周。患者在第12周至第40周期间平均接受了0.61次抗vegf抗体缀合物注射,且67%的患者无需再治疗注射。相比之下,在同一时间段内,根据常规治疗(阿柏西普)标签的平均注射次数为5次。
[0774]
图50a显示了随访评估的个体细分。dme队列患者中ksi-301治疗的持久性延长至3至6个月或更长时间。图50b总结了图50a所示的结果。迄今为止,45%(15/33)的患者(自最终负荷剂量后超过6个月)在负荷剂量后无需再治疗剂量。在79%的患者中,患者在最终负荷剂量后的某时间达到至少一次6个月或更长的治疗间隔。67%(22/33)的患者接受再治疗的时间为最终负荷剂量后6个月或更长时间。70%(23/33)的患者在最终负荷剂量后5个月或更长时间未接受再治疗。76%(25/33)的患者在最终负荷剂量后4个月或更长时间未接受再治疗。97%(32/33)的患者在最终负荷剂量后3个月或更长时间未接受再治疗。只有3%(1/33)的患者在最终负荷剂量后的2个月时接受了再治疗。无患者在最终负荷剂量后的2个月内接受再治疗。
[0775]
这些结果表明,dme中抗vegf抗体缀合物(例如,ksi-301)的目标给药间隔可以是最终负荷剂量后的3至6个月或更长时间。
[0776]
总之,2/3的dme患者在3个负荷剂量后超过6个月不再需要额外治疗。基于在dme中对已上市抗vegf治疗的高治疗需求(例如,基于drcr.net治疗算法,第一年中注射次数的中位数为9-10次),这些结果是预料不到的。
[0777]
图51显示了上述1b期研究中的dme患者的案例,该患者用ksi-301治疗,在负荷阶段后未接受治疗。在指定时间点拍摄oct图像。还评估了bcva(由“周”标签下etdrs字母值的变化指示)。早在最终负荷剂量后1个月(第12周)就观察到了oct和bcva改善,并且在最终负荷剂量后持续至少12个月(第56周)。在最终负荷剂量后12个月以上无需再治疗剂量。患者在治疗的第一年总共接受了3次玻璃体内注射。
[0778]
在一些实施方案中,在dme患者被施用最终负荷剂量后的任意时间段,以约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、或约10个月、约11个月、约12个月、约13个月、或约14个月或更长时间、或者上述任意两个值之间的任意时间间隔的给药间隔,向该患者玻璃体内施用有效量的抗vegf抗体缀合物(例如,ksi-301)。在一些实施方案中,dme患者不施用抗vegf抗体缀合物的维持剂量,直到最终负荷剂量后至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个
月、至少约11个月、至少约12个月、至少约13个月、或至少约14个月或更长时间、或者直到上述任意两个值之间的任意时间点。在一些实施方案中,dme患者具有约30%、约35%、约40%、约45%、或约50%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约7个月或更长时间。在一些实施方案中,dme患者具有至少约40%、至少约50%、至少约55%、至少约60%、或至少约65%的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约6个月或更长时间。在一些实施方案中,dme患者具有至少约50%、至少约55%、至少约60%、至少约65%、或至少约70%的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约5个月或更长时间。在一些实施方案中,dme患者具有至少约50%、至少约60%、至少约70%、或至少约75%的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约4个月或更长时间。在一些实施方案中,dme患者具有至少约60%、至少约70%、至少约80%、至少约90%、或至少约95%的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约3个月或更长时间。在一些实施方案中,受试者在dme治疗的第一年接受8次或更少、7次或更少、6次或更少、5次或更少、4次或更少、或3次或更少的抗vegf抗体缀合物的玻璃体内注射,包括负荷剂量。在一些实施方案中,对于dme治疗,受试者每年接受4次或更少、3次或更少、2次或更少、或1次或更少、或不接受抗vegf抗体缀合物的维持剂量。
[0779]
实施例33
[0780]
本实施例显示了在dme中与eylea相比,ksi-301的持久性的基准。图52显示了在上述1b期研究中用ksi-301(右)或用eylea(阿柏西普)(左)(一种常规抗vegf治疗)治疗的dme患者在一年间隔内所需的平均注射次数。接受常规抗vegf治疗的患者在治疗的第一年平均需要6个每月负荷剂量和3.2个维持剂量,总共9.2次注射。相比之下,用ksi-301治疗的患者在治疗的第一年平均只需要3个每月负荷剂量和1个维持剂量,总共4次注射。因此,与常规抗vegf治疗相比,ksi-301允许以一半的负荷和维持剂量数目治疗dme。这些结果表明,与用于治疗dme的常规抗vegf治疗相比,抗vegf抗体缀合物的治疗效果持续时间更长。
[0781]
在一些实施方案中,用抗vegf抗体缀合物(例如,ksi-301)治疗dme所需的负荷剂量(例如,每月负荷剂量)的数目为常规抗vegf治疗所需的负荷剂量的数目的至多约75%、至多约70%、至多约65%、至多约60%、至多约55%、至多约50%、至多约45%、或至多约40%。在一些实施方案中,用抗vegf抗体缀合物治疗dme所需的维持剂量的数目为常规抗vegf治疗所需的维持剂量的数目的至多约75%、至多约70%、至多约65%、至多约60%、至多约55%、至多约50%、至多约45%、或至多约40%。在一些实施方案中,用抗vegf抗体缀合物治疗dme所需的每年剂量的总数目为常规抗vegf治疗每年所需的剂量的总数目的至多约75%、至多约70%、至多约65%、至多约60%、至多约55%、至多约50%、至多约45%、或至多约40%。
[0782]
实施例34
[0783]
该实施例显示了对实施例23和26中描述的ksi-301治疗rvo的临床研究的进一步随访评估。图53显示,抗vegf抗体缀合物的治疗效果在负荷阶段持续,并在第8周施用最终负荷剂量后持续至少36周。患者在第12周至第40周期间平均接受了1.33次抗vegf抗体缀合物注射,且仅36%的患者需要一次以上的再治疗剂量。相比之下,在同一时间段内,根据常规治疗(阿柏西普)标签的平均注射次数为8次。
[0784]
图54a显示了随访评估的个体细分。在3个每月负荷剂量后,rvo队列患者中ksi-301治疗的持久性延长至2至4个月或更长时间。图54b总结了图54a所示的结果。81%的患者在最终负荷剂量后的某时间达到至少一次4个月或更长的治疗间隔。56%(18/32)的患者接受再治疗的时间为最终负荷剂量后4个月或更长时间。66%(21/32)的患者在最终负荷剂量后3个月或更长时间未接受再治疗。94%(31/33)的患者在最终负荷剂量后2个月或更长时间未接受再治疗。只有6%(2/34)的患者在最终负荷剂量后的1个月时接受了再治疗。
[0785]
这些结果表明,rvo中抗vegf抗体缀合物(例如,ksi-301)的目标给药间隔可以是最终负荷剂量后的2至4个月或更长时间。
[0786]
图56显示了接受ksi-301治疗的上述1b期研究中一名crvo患者的案例。在指定时间点拍摄oct图像,厚度测量值显示在左侧“周”标签下方。还评估了bcva(由右侧etdrs字母值的变化指示)。治疗前的oct测量表明患者患有最严重的crvo。早在第一负荷剂量后1周就观察到oct和bcva改善,并在接下来的3周内持续改善,直到下一个每月负荷剂量。第二负荷剂量后一个月,oct持续改善,bcva得以维持。这些结果表明,仅用抗vegf抗体缀合物的2个负荷剂量就有可能控制最严重的crvo案例。
[0787]
在一些实施方案中,在最终负荷剂量后的任意时间段,以约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约12个月、约13个月、约14个月、或约15个月或更长时间、或者上述任意两个值之间的任意时间间隔的给药间隔,向rvo(例如brvo、crvo)患者玻璃体内施用有效量的抗vegf抗体缀合物(例如,ksi-301)。在一些实施方案中,rvo患者不施用抗vegf抗体缀合物的维持剂量,直到最终负荷剂量后至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约13个月、至少约14个月、或至少约15个月或更长时间、或者上述任意两个值之间的任意时间点。在一些实施方案中,rvo患者具有约45%、约50%、约55%、约60%、约65%、或约70%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约4个月或更长时间。在一些实施方案中,rvo患者具有约50%或更高、约55%或更高、约60%或更高、约65%或更高、或约70%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约3个月或更长时间。在一些实施方案中,rvo患者具有约60%、约70%、约80%、约85%、约90%、或约95%或更高的机会不需要抗vegf抗体缀合物的维持剂量,直到最终负荷剂量或最终维持剂量后约2个月或更长时间。在一些实施方案中,受试者在rvo治疗的第一年接受8次或更少、7次或更少、6次或更少、5次或更少、4次或更少的抗vegf抗体缀合物的玻璃体内注射,包括负荷剂量。在一些实施方案中,对于rvo治疗,受试者每年接受5次或更少、4次或更少、3次或更少、2次或更少、或1次抗vegf抗体缀合物的维持剂量。在一些实施方案中,rvo患者(例如,crvo患者)接受抗vegf抗体缀合物的2或3个负荷剂量。
[0788]
实施例35
[0789]
本实施例显示了在rvo中与eylea相比,ksi-301的持久性的基准。图55显示了在上述1b期研究中用ksi-301(右)或用eylea(阿柏西普)(左)(一种常规抗vegf治疗)治疗的rvo患者在一年间隔内所需的平均注射次数。接受常规抗vegf治疗的患者在治疗的第一年平均需要6个每月负荷剂量和2.6个维持剂量,总共8.6次注射。相比之下,用ksi-301治疗的患者
在治疗的第一年平均只需要3个每月负荷剂量和1.7个维持剂量,总共4.7次注射。因此,与常规抗vegf治疗相比,ksi-301允许以一半的负荷剂量的数目和约2/3的维持剂量的数目来治疗rvo。这些结果表明,与用于治疗rvo的常规抗vegf治疗相比,抗vegf抗体缀合物的治疗效果持续时间更长。
[0790]
在一些实施方案中,用抗vegf抗体缀合物(例如,ksi-301)治疗rvo所需的负荷剂量(例如,每月负荷剂量)的数目为常规抗vegf治疗所需的负荷剂量的数目的至多约75%、至多约70%、至多约65%、至多约60%、至多约55%、至多约50%、至多约45%、或至多约40%。在一些实施方案中,用抗vegf抗体缀合物治疗rvo所需的维持剂量的数目为常规抗vegf治疗所需的维持剂量的数目的至多约80%、至多约75%、至多约70%、至多约65%、或至多约60%。在一些实施方案中,用抗vegf抗体缀合物治疗rvo所需的每年剂量的总数目为常规抗vegf治疗每年所需的剂量的总数目的至多约80%、至多约75%、至多约70%、至多约65%、至多约60%、至多约55%、或至多约50%。
[0791]
实施例36
[0792]
本实施例提供了使用ksi-301的2b/3期wamd研究,ksi-301的给药频率低至每20周一次(在负荷剂量后)。图57显示了研究设计的示意图。本研究的ksi-301治疗组中的患者按q12w、q16w或q20w给药方案给药,除非在任何随访评估中符合疾病活动性评估标准(如下所示),此时患者施用维持剂量。疾病活动评估标准(非负荷剂量)
[0793]
这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0794]-与第12周相比,oct中心子区视网膜厚度(cst)增加≥50μm,bcva减少≥5个字母;
[0795]-由于wamd活动恶化(例如,视网膜内液增加、视网膜下液增加、新的视网膜内出血、新的视网膜下出血),与之前的最佳bcva相比,bcva减少≥10个字母;
[0796]-与第12周相比,oct中心子区视网膜厚度(cst)增加≥75μm;
[0797]-新的黄斑出血。
[0798]
实施例37
[0799]
本实施例提供了使用ksi-301的3期dme研究,ksi-301的给药频率低至每24周一次(在负荷剂量后)。图58显示了研究设计的示意图。本研究的ksi-301治疗组中的患者按q8w、q12w、q16w、q20w、q24w给药方案给药,除非在任何随访评估中符合疾病活动评估标准(如下所示),此时患者施用维持剂量。
[0800]
疾病活动评估标准(非负荷剂量)
[0801]
这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0802]-由于dme疾病活动恶化,与之前的最低测量值相比,oct中心子区视网膜厚度(cst)增加≥50μm,与之前2个最佳bcva评估的平均值相比,bcva减少≥5个字母;
[0803]-由于dme疾病活动恶化,与之前的最低测量值相比,oct cst增加≥75μm;
[0804]-新的或恶化的增殖性dr(pdr)。
[0805]
实施例38
[0806]
本实施例提供了使用ksi-301的3期rvo研究,ksi-3018周给药一次(在负荷剂量之后)。图58显示了研究设计的示意图。该研究的ksi-301治疗组中的患者接受两个每月负荷剂量,然后两次每8周的给药,然后每8周给药,进行疾病活动评估以个体化给药。如果在任何随访评估中符合疾病活动评估标准(如下),则向患者施用维持剂量。
[0807]
疾病活动评估标准(非负荷剂量)
[0808]
这些标准与疾病复发迹象和/或因疾病复发导致的视力丧失有关。
[0809]-由于rvo疾病活动恶化,与之前的最低测量值相比,oct中心子区视网膜厚度(cst)增加≥75μm;
[0810]-由于rvo疾病活动恶化,与之前的最低测量值相比,oct cst增加≥75μm。
[0811]
实施例39
[0812]
该实施例显示了对非增殖性糖尿病性视网膜病变(npdr)的临床研究,其中ksi-301的给药频率低至每6个月一次(负荷剂量后)。该研究的ksi-301治疗组的患者接受两次负荷剂量,间隔8周。然后,患者每4或6个月接受维持剂量。终点不仅是灌注,而且使用etdrs drss(糖尿病性视网膜病变严重程度评分)%,患者具有》=2或3级改善和2或3级恶化。
[0813]
实施例40
[0814]
在实施例3-5、15-26和29-35所述的研究期间,ksi-301的多剂量暴露耐受良好,未观察到眼内炎症。对130名受试者进行给药,给予了546个总剂量。121名受试者完成了1b期的负荷阶段,81名受试者在第12周或以后接受了至少一次额外的再治疗。注意到以下情况:
[0815]-大多数不良事件(ae)被评估为轻度,与常规玻璃体内抗vegf治疗的特征一致;
[0816]-迄今为止,在16名受试者中报告了29例严重不良事件(sae)——均与药物无关;
[0817]-研究眼睛中发生一例眼部sae(继发于全身性液体超负荷的dme恶化,与药物无关);
[0818]-仅有两例眼内炎症ae,均可追溯至1+玻璃体细胞,且完全消退
[0819]
○
按照注射基础,率为0.37%(546次注射中有2次),按照患者基础,率为1.5%(130名患者中有2名)
[0820]
○
两名患者均无血管炎或视网膜炎。
[0821]
上文或下文引用的所有专利申请、网站、其他出版物、登录号等出于所有目的以相同程度通过引用整体并入,就好像每个单独的项目被具体地和单独地指示以通过引用的方式并入一样。如果序列的不同版本与不同时间的登录号相关联,则指的是在本技术的有效申请日时与登录号相关联的版本。有效申请日指的是实际申请日或涉及登录号的优先权申请的申请日(如适用)中较早的一个。同样地,如果在不同时间公开了出版物、网站等的不同版本,则指的是在本技术的有效申请日时最近公开的版本,除非另有说明。除非另有明确说明,否则本文公开的任意特征、步骤、元素、实施方式或方面均可以与任意其它组合使用。尽管为了清楚和理解的目的通过说明和实施例的方式对一些实施方案进行了详细的描述,但显而易见的是,可以在所附权利要求的范围内进行某些改变和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1