用于选择性的体内放射疗法的组合物、装置和套件的制作方法
用于选择性的体内放射疗法的组合物、装置和套件
1.相关申请
2.本技术为:a)2020年5月11日提交的美国申请序列号16/872,295的部分继续申请,该申请要求2020年4月3日提交的美国临时申请序列号63/005,172的优先权并且要求2019年11月1日提交的美国临时申请顺序号62/929,692的优先权;并且b)还要求2020年4月3日提交的美国临时申请序列号63/005,172的优先权和2019年11月1日提交的美国临时申请序列号62/929,692的优先权权益,这些文献通过引用整体并入本文。本技术还涉及2010年5月31日提交的pct申请号pct/it2010/000241和2011年10月21日提交的pct申请号pct/it2011/000354,其通过引用整体并入本文。
3.背景
4.本技术和方法一般性涉及放射治疗剂,更具体地涉及组合物、装置和方法,其使用包含载体基质和放射治疗颗粒的组合物来治疗各种肿瘤和增殖性疾病,包括但不限于乳腺癌和肝癌。
5.导管原位癌(dcis)或0期乳腺癌是一种生物学和临床异质性疾病,其自然病程受肿瘤和宿主相关因素的影响。因此,保乳手术(bcs)后的dcis治疗仍存在争议。据估计,必须对9名患者进行治疗以防止1名局部复发,但一些试验表明,在某些选定的低风险早期乳腺癌患者组中使用术中放疗(iort)产生可接受的结果,因此可以为作为常规全乳照射的替代方案。
6.bcs后的乳腺外线束放射疗法将局部乳腺肿瘤复发率从在十年时的25-30%降低至10%以下。然而,对于在bcs和外线束放射疗法(ebrt)后数年出现肿瘤复发的剩余10%乳腺癌患者而言,寻找最佳治疗方式仍然是一个问题。即使在数年后,正常组织的耐受性也不允许在第二次bcs后对整个乳腺进行第二次全剂量放射治疗过程。尤其是小的局部的且在技术上能够进行局部切除的复发的患者,通常首选乳腺切除术而不是bcs,因为担心由于省略放疗而导致更恶化的结果。直到1980年代,乳腺切除术都是dcis患者的参考治疗方法,病灶控制率约为98%。不仅基于疾病扩展和/或多中心性,而且考虑到患者的偏好,在2000年后至少有三分之一的dcis病例继续进行乳腺切除术。美国近期关于早期乳腺癌(i期和ii期)的数据表明,由于难以进行放射疗法以及患者对治疗的依从性低,因此,高达60%的患者可能未接受任何放射疗法,且因此仍采用乳腺切除术。
7.然而,随着诊断方式和定期随访的不断进步,复发性乳腺肿瘤通常在非常小的肿瘤尺寸下被诊断出来。此外,这些患者最常见的和限制生存的问题通常不是乳腺内的病灶情况,而是发生远端转移的风险增加。最终,超过90%的同侧乳腺肿瘤复发发生在指标肿瘤附近。一种新的选择是重新切除复发肿瘤后用部分乳腺照射对这些患者进行治疗。这种方法基于这样的假说,即对有限体积的再照射将是有效的,并且产生可接受的副作用发生率。iort是一种将高剂量输送到有风险的受限区域的选项,所述区域即肿瘤切除后的肿瘤空腔附近的组织。iort可以通过手术室中的专用直线加速器或使用电子或低能x-射线的新型移动装置递送。
8.iort,其中术后全乳腺照射被手术期间采用相同剂量的一段时间的放疗所替代,
可允许在同一天完成治疗。近期的试验,例如早期乳腺癌的电子术中放疗相比外部放疗(eliot试验)以及乳腺癌的靶向的术中放疗相比全乳放疗(targit-a试验)已经证明,在一些选定的低风险早期乳腺癌患者中,iort导致可接受的结果,因此可作为传统wbrt的替代方案。
9.在eliot试验中,1305位患者被随机分组(654位接受外部放疗,651位接受术中放疗),随访时间为5-8年。该试验的结果表明,术中放疗组的局部复发率低于先前研究(milan i试验)中乳腺切除术后达到的局部复发率。targit-a试验是一项随机、非劣效性试验,其比较了使用单剂量靶向的术中放疗(targit)的风险调整后的放疗与分次ebrt对乳腺癌的效果。3451位患者的5年结果(1721位患者被随机分配至targit,1730位患者被随机分配至ebrt)表明,targit联合风险调整方法中的病灶切除术,应当被视为符合条件的乳腺癌患者的一种选择。该试验表明,与在选定的患者中保乳手术后的标准wbrt(50-56gy)相比,使用20gy的术中放疗(iort)、随后仅在有危险因素的患者中进行全乳腺放疗(wbrt)具有病灶控制的非劣效性。vaidya等人的统合分析证实,在患有乳腺癌的女性中,当给予部分乳腺照射(pbi)而不是全乳腺照射(wbi)时,死亡率会出现小幅但确定地降低。基于vaidya等人使用的2个统计模型,非乳腺癌症死亡率的绝对差为1.1%-1.3%,且具有统计学意义(p=.023或p=.011)。总死亡率的绝对差可能在1.0%-1.3%。p=.15或p=.05的低p值表明,如果pbi和wbi之间没有真正的差异,那么不可能观察到这种差异。鉴于总死亡率仅为4.9%(4231人中的207人),相对而言,采用pbi的死亡率降低了25%;因此它也具有临床意义。
10.肝细胞癌(hcc)是成人最常见的原发性肝癌类型,也是肝硬化患者最常见的死亡原因。它发生在慢性肝脏炎症的情况下,并且与慢性病毒性肝炎感染(乙型或丙型肝炎)或接触酒精或毒素如黄曲霉毒素等最密切相关。某些疾病,如血色素沉着症和α1-抗胰蛋白酶缺乏症会显著增加发生hcc的风险,而代谢综合征和非酒精性脂肪性肝炎越来越被视为hcc的风险因素。与任何癌症一样,hcc的治疗和预后取决于肿瘤组织学、大小、局部/远处扩散和整体健康状况的具体情况而变化。如果在疾病过程中更早开始治疗,则结果会显著改善。患有早期hcc的个体通常接受三种类型的疗法:(1)在选定的病例中原位肝移植;(2)手术切除受累肝段;(3)局部疗法,包括基于经皮或导管的疗法。大多数当前形式的经皮消融已被证明与手术切除一样有效。它们对患者和医疗设施的侵入性和要求也较少。然而,在许多情况下,很难获得阴性的“手术”边缘,原因有很多,包括病灶的大小及其解剖位置。这意味着带有卫星微小转移的肿瘤病灶的周围区域可能会被遗漏并且不会坏死。因此又使肿瘤复发成为一种明显的可能性。目前报告的总体成功率实际上是热消融(例如射频、激光、微波)为70-80%,冷冻消融术为70-80%,乙醇注射为60-80%(数据来自梅奥诊所2017)。因此,至少有20%的肿瘤病灶随后出现局部复发。
11.经皮局部消融(pla)技术目前被视为不适合手术切除的早期hcc患者的最佳治疗选择。它们安全、微创、有效且具有成本效益。在一些中心,射频消融被认为是一线治疗,不过,大多数指南建议将其用于手术切除不可行的小型hcc。pla是一种相对简单的微创手术,其选择性地靶向肿瘤和额外的0.5-1.0cm健康组织的人为边缘。这个额外的边缘有助于实现类似于术后r0切除的完全消融(a0)。此外,肝切除术对于非常小的hcc病例不是理想的治疗方法,因为可能会丧失肝功能以及并发症的高风险。对此,国际消融专家小组最近发表了一篇关于pla治疗结直肠癌肝转移的立场文件。在位置良好(易于进入)的情况下,治疗高达
5cm的结节达到了强烈的共识水平。同样,对于仅针对全身治疗的联合策略也达成了强烈的共识水平。专家组还同意pla作为一线治疗时在可切除患者中具有潜在的治愈作用。1994年基于门静脉血栓形成患者的一项随机化研究首次证明了使用
131
i-放射性标记碘化油的选择性内部照射疗法(sirt,也称作经动脉放射栓塞术,tare)的临床有效性。特别地,一项回顾性研究表明,与化疗栓塞相比,玻璃微球能够显著改善降期的比率,对t3期hcc患者的副作用显著减少,而另一项研究表明,接受局部疗法(如化疗栓塞和放疗栓塞)治疗的hcc患者无进展生存期显著改善。
90
y树脂微球(—sirtex medical)为ce标记的近距离放射疗法设备,其通过国家综合癌症网络和欧洲医学肿瘤学学会的指南推荐用于治疗选定的具有肝病或以肝脏为主的疾病的患者中的化疗难治性结直肠癌的肝转移-。
12.简述
13.由于15年以上基于经动脉输注
90
y-涂覆的微球的治疗所积累的临床经验,认为施用适当的
90
y活性应减少局部复发的机会,这种复发情况发生在手术床上的绝大多数病例中。
14.在一些变通方案中,哺乳动物、例如人类患者可以用
90
y微球和定位载体剂的组合进行治疗,包括但不限于生物胶或水凝胶。所述联合疗法可以直接注射到肿瘤、术后肿瘤部位或活检部位。在一些另外的变通方案中,可以提供联合疗法而不需要治疗前成像,例如锝-99扫描,以评估任何分流到肝脏或肺或其他脱靶位置,例如静脉曲张或动静脉畸形(avm)。这归因于减少、最小化或消除了定位载体的分流效应。因此,由于治疗前成像来评估分流,所以也不需要治疗潜在分流的预处理操作。这可能会将治疗时间缩短1、2、3、4、5、6或7天或更长的治疗时间,因为治疗不会因预处理前分流成像、治疗前减少分流操作和治疗前重新扫描以评估减少分流操作的有效性而延迟。不再需要或不再进行的分流手术可能包括动脉栓塞形成、肝静脉气囊阻塞以及静脉曲张和avm阻塞手术。因为不再需要考虑分流的给药剂量调整,所以也可以简化给药剂量计算,例如不再需要基于分流比例和/或肺给药剂量限制而调整。具有显著肝、肺或肝肺分流比例的患者也不再需要被排除在疗法之外。肿瘤治疗方案的这些特征中的一种或多种可以包含在本文所述的不同治疗中。
15.在一个实例中,提供了治疗人类患者的方法,包含进行
90
y剂量计算以确定使用定位载体的肿瘤部位的治疗有效
90
y剂量并使用定位载体将
90
y剂量递送至肿瘤部位,其中与不使用定位载体递送
90
y剂量相比,该治疗延长了无进展生存期。在一些另外的实例中,不需要用于评估分流的治疗前成像。通过不进行治疗前成像,治疗时间可能会减少至少一天。权利要求2的方法,其中不需要或不进行的治疗前成像扫描,可以为锝-99m扫描。分流可以为肝肺分流。定位载体可以为戊二醛和牛血清白蛋白的组合。肿瘤部位是未切除的肿瘤或切除的瘤床。在一些实例中,不进行手术前分流比例估计的计算和/或手术后生物分布成像。不需要使用动脉栓塞形成、肝静脉气囊阻塞和/或静脉曲张或动静脉畸形阻塞的预处理。在一些实施方案中,
90
y剂量计算不包括基于分流比例估计和/或肺给药剂量限制的调整。单次治疗过程中肺给药剂量限制为30gy或更低,多次治疗过程中为50gy或更低。该方法可能不排除高于分流比例限制的患者,例如肝肺分流比例限制为20%或以上。
16.在另一个实施方案中,提供了一种用
90
y治疗患者而不进行预处理锝-99m扫描的方法,并且在另一个实施方案中,提供了一种用
90
y治疗患者而不测定分流比例的方法。在又一个实施方案中,提供了一种用
90
y治疗患者而不进行任何排除高于肝肺分流比例限制的患者
的方法。
17.公开了使用组合的
90
y-基质和递送系统的示例性装置、套件和方法,以治疗患有dcis或其他形式的早期乳腺癌的患者,并且评估dcis切除后基于放射性的外科手术边缘消融的有效性和安全性。示例性装置、套件和方法用于治疗肝细胞癌,包括但不限于注射或施用到病灶部位或切除病灶部位后的治疗部位。递送套件包含同轴双腔导管,其用于提供直接的成像引导的
90
y微球-基质组合的瘤内注射。
18.在一些变通方案中,选择进行治疗的患者可以包含接受瘤内或瘤床注射治疗的0期乳腺癌(例如dcis)患者。在其他变通方案中,患者可能患有i期或ii期乳腺癌,其接受瘤内注射或病灶切除术后瘤床治疗。这也可以包含iia期和/或iib期患者,并包括瘤内注入一个或多个腋窝淋巴结。
19.认为
90
y-基质和递送系统可以在dcis切除后对外科手术切缘进行有效和安全的放射消融,因此与单独的
90
y微球治疗相比,为早期乳腺癌的局部区域治疗提供了一种使用医疗设备的新的治疗方法。
20.在其他变通方案中,选择进行治疗的患者可以包含患有肝细胞癌的患者,如转移性肝肿瘤,无论是可切除的还是不可切除的。患有hcc的患者可以包含患有t1、t1a、t1b、t2、t3或t4原发性肿瘤的患者,以及有或没有或未知区域淋巴结转移灶和/或远端转移灶的患者,包括ia、ib、ii、iiia、iiib、iva和ivb期hcc患者。治疗可以包含对肝脏、淋巴结或远端转移部位的肿瘤床进行肿瘤内施用或切除后施用。
21.在一个实例中,
90
y-基质系统为(cryolife;kennesaw,ga)、牛血清白蛋白和戊二醛以4:1比例的混合物以及涂覆了纯β发射体同位素
90
y的微球(sirtex medical;north sydney,au)的组合。使用双室注射器递送该混合物。然后将具有
90
y的预装载的微球与粘性胶成分混合,并且用于对治疗部位的手术边缘进行放射消融。
22.在不同的实例中,用于制备注射系统和/或用选择性内部放射疗法治疗靶病灶的系统、套件和方法包括装载了双成分组织胶的双筒注射器并且提供装载放射性同位素的微球。基于目标位置的大小将微球装入注射器,并用针头或双腔导管注射。包括了用于治疗直径达130mm的乳腺癌病灶和达50mm的肝细胞癌病灶的给药方案。
23.在一个实例中,提供了制备可植入的放射治疗剂的方法,包含将放射性同位素微球与悬浮介质混合,其中微球位于包含在第一容器中的悬浮介质中,基于目标尺寸确定混合的微球的转移体积,向注射系统装载转移体积,所述注射系统包含具有第一横截面面积的第一隔室和具有第二横截面面积的第二隔室,第一和第二横截面面积具有比例xy,将第一部分的转移体积转移至第一隔室,并将第二部分的转移体积转移至第二隔室,其中第一部分与第二部分具有xy的部分比例。放射性微球可以以沉降状态提供在容器中的预定体积的悬浮介质内。该方法可以进一步包含在将放射性微球与悬浮介质混合之前从悬浮介质的预定体积中去除悬浮介质的去除体积。去除体积可以为2ml并且悬浮介质的预定体积可以为5ml。转移体积的第一部分可以为转移体积的x/(x+y),并且其中转移体积的第二部分为转移体积的y/(x+y)。注射系统可以为双筒注射器,其包含具有第一隔室的第一筒和具有第二隔室的第二筒。第一横截面积与第二横截面积之比可以为4:1。第一筒可以预装载第一物质并且第二筒可以预装载第二物质。第一物质和第二物质的总体积可以为2ml。第一物质和
第二物质的总体积可以为5ml。转移体积可以包含0.1mbq-250mbq范围内的活性水平。活性水平可以在0.3mbq-220mbq的范围内,并且转移体积可以在0.3μl-220μl的范围内。目标尺寸的平均直径可以在1mm-50mm的范围内。转移体积可以包含10mbq-200mbq范围内的活性水平。活性水平可以在20mbq-150mbq的范围内,并且转移体积可以在100μl-750μl的范围内。目标尺寸的平均直径可以在40mm-130mm的范围内。第一物质可以包含白蛋白并且第二物质可以包含戊二醛。放射性微球可以包含3gbq或更少的活性水平,并且悬浮介质的预定体积可以为5ml或更少。放射性同位素微球的混合和注射系统的装载都可以通过带有长度50mm-100mm范围内的针头的遮蔽转移注射器来进行。该方法可以进一步包含通过在装载注射系统之后确定容器的活性水平或在装载注射系统之后确定注射系统的活性水平来验证放射性同位素微球的转移体积的活性水平。该方法还可以包含将装载的注射系统放置到辐射防护容器中。该方法可以进一步包含以xy的体积比设置第一物质和第二物质中的每一种的一部分,并且其中这两个部分的总和等于混合的微球的转移体积。
24.在另一个实例中,提供了治疗患者的方法,包含使用具有混合针头的双筒注射器将混合的放射性微球的治疗体积递送至病灶,其中所述病灶包括肿瘤病灶和/或术后病灶部位,其中注射器的第一筒包含牛血清白蛋白和放射性同位素,而注射器的第二筒包含戊二醛和放射性同位素。病灶可以为早期乳腺癌病灶,包括原位导管癌病灶(0期)。病灶处的标称剂量可以至少为18-20gy。该方法还可以包含基于病灶的大小为双筒注射器的每个筒装载不同量的放射性微球。双筒注射器在注射前可以包含2.1-2.5ml的总可注射体积和20-90mbq的活性。治疗位置可以具有20-45mm的平均半径。注射的治疗体积可以为总可注射体积。双筒注射器在注射前可以包含5.1-6ml的总可注射体积和90-150mbq的活性。导管原位癌病灶的平均半径可能为45-65mm。注射的治疗体积可以等于可注射的总体积。病灶可以为肝细胞癌病灶。病灶处的剂量可以至少为150gy。双筒注射器在注射之前可以包含2.0001-2.05ml的总可注射体积和0.3-30mbq的活性。病灶的平均半径可以为0.5-25mm。递送的治疗体积可以为总可注射体积。在注射之前,筒形注射器可以包含5.01-5.5ml的总可注射体积和20-250mbq的活性。原位导管癌病灶或切除部位的平均半径可能为25-50mm。注射的治疗体积可以等于可注射的总体积。牛血清白蛋白的浓度可以在30-60重量百分比之间。戊二醛的浓度可以在5-15重量百分比之间。
25.在又一个实例中,提供了治疗患者的方法,包含从密封的无菌包装中取出双筒注射器,其中每个筒可以预装载不同体积的不同物质,所述不同物质的总体积可以为5ml或更小,基于病灶尺寸确定放射性微球混悬液的转移体积,并且将放射性混悬液转移体积的不同大小部分转移到双筒注射器的各筒中。所述不同物质的总体积可以为5ml或更小。放射性微球混悬液的转移体积可以小于300μl,活性水平可以小于300mbq,并且病灶的平均直径可以在25mm-50mm。该方法可以进一步包括用总体积在5.01-5.3ml之间的所述不同物质和放射性微球混悬液来治疗病灶。所述不同物质的总体积可以为2ml或更小。放射性微球混悬液的转移体积可能小于30μl,活度水平可能小于30mbq,病灶的平均直径可能在0.3mm-30mm。该方法可以进一步包含用总体积可以大于2ml且小于2.1ml的不同物质和放射性微球混悬液来治疗病症。
26.在另一个实施方案中,提供了病灶治疗系统,包含双筒注射器,该双筒注射器包含具有第一滑动密封件和第一横截面面积并且包含第一种胶成分的第一筒、具有第二滑动密
封件和第二横截面面积并且包含第二种胶成分的第二筒、被配置为从第一和第二筒分配固定比例的第一和第二种胶成分的驱动器、装载在第一和第二筒中的至少一个中的放射性同位素、设置在双筒注射器上的多个病灶尺寸标记,包括沿双筒注射器在空间上以非均匀间隔定位的尺寸范围内的均匀尺寸间隔。多个病灶尺寸标记包括40mm-130mm范围内的病灶直径。驱动器可以为连接至第一滑动密封件和第二滑动密封件的互连双柱塞,并且可以构造成以相等的纵向距离移动第一滑动密封件和第二滑动密封件。第一和第二横截面积可以不同。第一种胶成分可以为牛血清白蛋白,且第二种胶成分可以为戊二醛。牛血清白蛋白可以为45%重量,且戊二醛可以为10%重量。放射性同位素可以为
90
y,其活度水平在10和250mbq之间。放射性同位素可以为
90
y,具有在10和100mbq之间的活性水平,并且其中病灶尺寸的多个标记可以包含在40mm-90mm范围内的病灶直径。放射性同位素可以为
90
y,具有80和160mbq之间的活性水平,并且其中病灶尺寸的多个标记可以包含90mm-130mm范围内的病灶直径。放射性同位素可以为
90
y,具有0.1-50mbq之间的活性水平,并且其中病灶尺寸的多个标记可以包含0.5mm-25mm范围内的病灶直径。放射性同位素可以为
90
y,具有25-250mbq之间的活性水平,并且其中病灶尺寸的多个标记可以包含25mm-50mm范围内的病灶直径。
27.在一个实施方案中,提供了治疗患者的方法,包含使用目标活性水平a0确定治疗剂量并且使用确定目标组织质量,其中每单位活性递送的能量k(r)基于目标组织的半径。在一些变通方案中,k(r)值为49.35(j/gbq)。目标组织半径可以包含0.5cm至2.0cm范围内的一个或多个目标组织半径。该方法可以进一步包括将
90
y的量装载到两室注射器中,其中该量基于确定的治疗剂量。
90
y的量可以进一步基于注射器尺寸,并且可以进一步基于注射器尺寸和与注射器尺寸相关的死区。注射器的两个腔室可各自容纳双成分胶或载体组合物中的一种成分。注射器的第一腔室包含白蛋白,第二腔室包含戊二醛。
90
y可以装载到注射器的第一腔室和第二腔室中。在其他变通方案中,
90
y仅装载在注射器的第一腔室或第二腔室中的一个中。该方法可以进一步包含通过连接至两室注射器的混合尖端注射
90
y和胶或载体组合物,其中混合尖端包括具有多个角度混合结构的轴。在另一个实施方案中,提供了非暂时性计算机可读介质,包括计算机程序产品,该计算机程序产品包括一个或多个计算机指令,以便在计算机程序在一个或多个处理器上运行时执行如上所述的治疗剂量的确定。
28.在另一个实施方案中,提供了非暂时性计算机可读介质,其包含一个或多个计算机指令,包含基于与肿瘤尺寸相关的按比例的肿瘤摄取和4mm的平均
90
y组织穿透距离确定
90
y治疗剂量。计算机指令可以进一步包含输出
90
y的第一体积以被转移到注射器递送装置中、输出转移注射器尺寸、任选地输出注射器递送装置的第一腔室以用于
90
y的第一体积的输送、任选地确定待转移到注射器递送装置中的第二体积的
90
y的输出和/或任选地输出用于转移第二体积的
90
y的第二腔室的指令。在另一个变通方案中,计算机可读介质还可以包含计算机指令以确定载体组合物的目标体积,输出载体组合物的目标体积,并且基于转移注射器尺寸确定和输出载体组合物的废物体积。输出可以在显示屏上提供,并且可以包括具有数字输出的图形指示器的注射器的数字输出和/或图形输出。当计算机在一个或多个处理器上运行时,计算机程序产品可以执行上述步骤。
29.在一个实施方案中,提供了治疗乳腺癌的方法,包含确定乳腺癌病灶的平均肿瘤
尺寸,使用平均肿瘤尺寸选择
90
y注射器活性水平和
90
y治疗活性水平,其中对于相当于20mm-24mm范围的半径的平均肿瘤尺寸,
90
y治疗活性水平为15mbq-20mbq;对于相当于25mm-29mm范围的半径的平均肿瘤尺寸,
90
y治疗活性水平为20mbq-25mbq;对于相当于30mm-34mm范围的半径的平均肿瘤尺寸,
90
y治疗活性水平为25mbq-35mbq;对于相当于35mm-39mm范围的半径的平均肿瘤尺寸,
90
y治疗活性水平为40mbq-50mbq;对于相当于40mm-44mm范围的半径的平均肿瘤尺寸,
90
y治疗活性水平为55mbq-65mbq;对于相当于45mm-49mm范围的半径的平均肿瘤尺寸,
90
y治疗活性水平为75mbq-85mbq;对于相当于50mm-54mm范围的半径的平均肿瘤尺寸,
90
y治疗活性水平为90mbq-100mbq,给双室注射器装载选定的
90
y注射器活性水平,其中双室注射器包括预装载牛血清白蛋白的第一室和预装载戊二醛的第二室,并且使用双室注射器在乳腺癌病灶的治疗部位注射选定的
90
y治疗活性水平。
90
y注射器活性水平对于相当于20mm-24mm范围的半径的平均肿瘤尺寸可以为20mbq,对于相当于25mm-29mm范围的半径的平均肿瘤尺寸可以为25mbq,对于相当于30mm-34mm范围的半径的平均肿瘤尺寸可以为35mbq,对于相当于35mm-39mm范围的半径的平均肿瘤尺寸可以为50mbq,对于相当于40mm-44mm范围的半径的平均肿瘤尺寸可以为70mbq,对于相当于45mm-49mm范围的半径的平均肿瘤尺寸可以为90mbq,并且对于相当于50mm-54mm范围的半径的平均肿瘤尺寸可以为110mbq。该方法还可以进一步包括在抽出所选的
90
y注射器活性水平之前调节
90
y源的浓度,其中调节浓度包含向
90
y源添加5ml水,或将
90
y源的浓度调节为3gbq/10ml,并从
90
y源中抽出选定的90y注射器活性水平。在一些进一步的实施方案中,该方法可以进一步包含基于
90
y衰减和平均肿瘤尺寸确定用于取出的
90
y注射器活性水平的体积。双室注射器的装载可以包含将
90
y注射器活性水平以1:4的比例装载到双室注射器的第一和第二室中。该方法还可以进一步包含:在向双室注射器装载所选
90
y注射器活性水平之前将双室注射器放入第一放射防护容器中,将转移注射器放入第二辐射防护容器中,并使用转移注射器装载双室注射器。第一和第二辐射防护容器可以包含pmma圆筒。该方法还可以进一步包含确认
90
y源的源活性水平,从
90
y源中抽出
90
y注射器活性水平,以及在装载双室注射器之后确认双室注射器的注射器活性水平。在另一个进一步的实施方案中,该方法可以进一步包含在注射治疗部位之后确认双室注射器的残留活性水平。乳腺癌可以为原位导管癌和/或治疗部位可以为乳腺癌病灶的切除后治疗部位。
30.在另一个实例中,可以提供准备乳腺癌治疗的方法,包含根据图像确定乳腺癌病灶的平均肿瘤尺寸,使用平均肿瘤选择
90
y注射器活性水平和
90
y治疗活性水平大小,其中
90
y治疗活性水平对于相当于20mm-24mm范围的半径的平均肿瘤尺寸为15mbq-20mbq,对于相当于25mm-29mm范围的半径的平均肿瘤尺寸为20mbq-25mbq,对于相当于30mm-34mm范围的半径的平均肿瘤尺寸为25mbq-35mbq,对于相当于35mm-39mm范围的半径的平均肿瘤尺寸为40mbq-50mbq,对于相当于40mm-44mm范围的半径的平均肿瘤尺寸为55mbq-65mbq,对于相当于45mm-49mm范围的半径的平均肿瘤尺寸为75mbq-85mbq,对于相当于50mm-54mm范围的半径的平均肿瘤尺寸为90mbq-100mbq,并且给双室注射器装载选定的
90
y注射器活性水平,其中双室注射器包括预装载牛血清白蛋白的第一室和预装载戊二醛的第二室。
90
y注射器活性水平对于相当于20mm-24mm范围的半径的平均肿瘤尺寸可以为20mbq,对于相当于25mm-29mm范围的半径的平均肿瘤尺寸可以为25mbq,对于相当于30mm-34mm范围的半径的平均肿瘤尺寸可以为35mbq,对于相当于35mm-39mm范围的半径的平均肿瘤尺寸可以为50mbq,对于
相当于40mm-44mm范围的半径的平均肿瘤尺寸可以为70mbq,对于相当于45mm-49mm范围的半径的平均肿瘤尺寸可以为90mbq,并且对于相当于50mm-54mm范围的半径的平均肿瘤尺寸可以为110mbq。该方法可以进一步包含在抽出选定的
90
y注射器活性水平之前调整
90
y源的浓度,其中调整浓度包含向
90
y源添加5ml水,或将
90
y源的浓度调整为3gbq/10ml,并从
90
y源中抽出选定的
90
y注射器活性水平。该方法还可以进一步包括基于
90
y衰减和平均肿瘤尺寸确定抽出的
90
y注射器活性水平的体积。双室注射器的装载可以包含将
90
y注射器活性水平以1:4的比例装载到双室注射器的第一和第二室中。该方法还可以进一步包含:在向双室注射器装载所选
90
y注射器活性水平之前将双室注射器放入第一放射防护容器中,将转移注射器放入第二辐射防护容器中,并使用转移注射器装载双室注射器。第一和第二辐射防护容器可以包含pmma圆筒。该方法还可以包含确认
90
y源的源活性水平,从
90
y源中抽出
90
y注射器活性水平,并且在装载双室注射器之后确认双室注射器的注射器活性水平。乳腺癌可以为原位导管癌。
31.在又一个实施方案中,提供了用于进行放射治疗操作的套件。该套件可以包含两个无菌1ml注射器、两个鲁尔锁、两个22g针头、两个无菌20gx70mm针头和两个pmma圆筒,每个均配置为保留1ml或2ml注射器。在其他变通方案中,两个20gx70mm的针头可以用任何尺寸为20g或以上并且包括至少50mm的长度的针头替代,和/或pmma圆筒可以包含非圆形横截面形状,例如正方形或多边形形状,并且可包含除pmma之外的金属或聚合物材料。
32.附图简述
33.图1a为可与示例性手术一起使用的管心针(stylet)、导引器(introducer)和导管的示例性组件视图;图1b描绘了图1a的导管和导引器,其中导管插入导引器并且它们的接头(hub)锁定在一起;
34.图2a和2b为装载了载体中的
90
y微球的注射器圆筒的前后位和后前位视图;
35.图3a和3b分别为装载在塑料球中的放射性凝胶的pet/ct和ct扫描;
36.图4a-4c分别描绘填充有
90
y-基质组合物的0.5ml、4.2ml和11.4ml体积的吸收剂量;
37.图5为图4a-4c中相对于距三个腔中心的距离的活性百分比图;
38.图6为图4a-4c中相对于距三个腔中心距离的估计的gray/mbq的图;
39.图7为图4a-4c中相对于距三个腔中心距离的估计的总吸收剂量的图;
40.图8a为患有大腿肿瘤的小鼠的横向ct视图;图8b为图8a中描述肿瘤活性的小鼠的复合横向ct/pet/spect视图;图8c为图8b中的pet/spect图像分量;图8d为另一只患有大腿肿瘤的小鼠的横向ct视图;图8e为图8d中描绘肿瘤活性的小鼠的复合横向ct/pet/spect视图;图8f为图8e中的pet/spect图像分量;
41.图9a为具有同心腔的双腔导管轴的示意性横断面图;图9b为具有偏心腔的双腔导管轴的示意性横断面图;图9c为双腔导管轴的示意性横断面图,在两个腔之间具有弓形隔膜;图9d为双腔导管轴的示意性横断面图,在两个腔之间具有直隔膜;
42.图10a为双腔导管递送套件的另一个实例的照片;图10b为导管近端及组合导引器和管心针的特写照片;图10c为图10a和10b中导管近端的纵向横断面图;图10d为图10a和10b中导引器近端的纵向横断面图;
43.图11a和11b分别为外植的肿瘤的侧面和上方横截面ct视图;图11c和11d分别为图11a和11b外植的肿瘤的复合侧面和上方横截面ct/pet/spect视图;图11e和11f分别为来自图11c和11d的pet/spect图像分量;
44.图12a和12b分别为另一个外植肿瘤的侧面和上方横截面ct视图;图12c和12d分别为图12a和12b中外植肿瘤的复合侧面和横截面ct/pet/spect视图;图12e和12f分别为来自图12c和12d的pet/spect图像分量;
45.图13a和13b分别为另一个外植肿瘤的侧面和上方横截面ct视图;图13c和13d分别为图13a和13b中外植肿瘤的复合侧面和横截面ct/pet/spect视图;图13e和13f分别为来自图13c和13d的pet/spect图像分量;
46.图14a-14c为10倍放大组织学载玻片,具有20倍幅度的插图,其是在瘤内注射
90
y-基质后,在动物中切除床的治疗后7、14和21天,其中箭头指示坏死区域;图14d-14f为10倍放大组织学载玻片,具有20倍幅度的插图,其是在瘤内注射无任何基质的
90
y后,在动物中切除床的治疗后7、14和21天;图14g-14i为10倍放大组织学载玻片,具有20倍幅度的插图,其是在瘤内注射无任何
90
y的基质后,在动物中切除床的治疗后7和14天;图14j为在1、2和3周时每个研究臂的坏死百分比的图;
47.图15示例
90
y-基质和仅
90
y的治疗组的p53和β-微管蛋白表达的蛋白质印迹分析;
48.图16为
90
y-基质、仅
90
y和定位载体的治疗组在选择的时间点的肿瘤体积的图;
49.图17a和17b分别描绘
90
y微球和
90
y-基质的器官系统生物分布;图17c和17d分别描绘仅
90
y和
90
y-基质在7天时的器官系统生物分布,图17e和17f分别描绘仅
90
y和
90
y-基质在14天时的器官系统生物分布;
50.图18为作为肿瘤尺寸函数的
90
y吸收入肿瘤中的剂量比例的图,其中对ρ=1.00g/cm3(水密度)和ρ=1.05g/cm3(肝密度)进行了模拟;
51.图19为用于图18a的模型中实施的
90
yβ谱的图;
52.图20为使用作为肿瘤直径的函数的mcnp4c计算的每
90
y单位活性的递送能量k(r)的图;
53.图21为作为肿瘤直径函数的残差图;
54.图22为每单位施用活性(gbq)的吸收剂量的图,ρ=1.05g/cm3(肝密度),其中插图描绘了0cm-1cm病灶直径的细节;
55.图23为每单位施用活性的吸收剂量的图,ρ=1.00g/cm3(水密度),其中插图描绘了0cm-1cm病灶直径的细节;
56.图24a和24b为分别在1和3周时
90
y-基质与仅
90
y的治疗组之间的
90
y生物分布的图;且
57.图25a和25b为分别描绘
90
y-基质和仅
90
y的治疗组的肿瘤与非肿瘤位置之间的
90
y生物分布的图。
58.详细描述
59.在一个实施方案中,提供了用于进行直接注射放疗的套件。该套件包括孔针、放射屏蔽注射器和长度至少为50mm-100mm的细长针头。套件的这些组件可用于将放射性同位素微粒从它们的运输容器转移到包含基质的注射器中。通气注射器可以穿过运输容器的密封件插入以破坏或释放在转移过程中可能在运输容器中形成的任何真空,并且可以为22g、
25g、28g、30g、31g或32g皮下注射针头。孔针可以在剩余的手术操作过程中任选地留在原处,或在插入后立即移除。细长针头在使用点或制造点连接至放射屏蔽注射器,并用于从运输容器中取出液体介质。
60.在一些变通方案中,套件可以包含导引器、双腔导管和针。该套件还可以任选地包含放射屏蔽注射器、长度至少为50mm-100mm的细长针头和/或如上所述的孔针。在其他变通方案中,套件还可以包含胶或基质和/或放射性同位素源,但在其他实例中,胶/基质和/或放射性同位素与套件分开来源放置。在这些变通方案中,套件还可以包含适配器,其配置为将套件组件连接至用户选择的第三方注射器系统,或者一个或多个套件组件可配置以便连接至第三方的胶/基质注射器或注射器系统。
61.90
y源可以包含一小瓶放射治疗微球。小瓶可以为透明的无屏蔽玻璃小瓶,其可以可移除地配备在衬铅罐或其他容器中。提供了在5ml水或其他混悬液中包含3gbq
90
y的小瓶。
90
y为一种纯的高能量(最大能量2.227mev,平均0.93mev)的β-发射体同位素。它的半衰期为64.1小时;组织中的最大穿透力为11mm,平均为2.5mm。小瓶可以配备在铅罐或其他屏蔽容器中。小瓶或其他包装可以包含校准或验证数据,和/或用于在线访问的代码,以便治疗的医疗保健提供者可以补偿自初始制造和验证以来发生的任何放射性衰变。然而,在其他实例中,微球活性的量可以不同,例如100mbq、200mbq、300mbq、400mbq、500mbq、600mbq、700mbq、800mbq、900mbq、1gbq、2gbq、3gbq、4gbq、5gbq,或这些活性水平的任意两个之间的范围,并且每瓶微球的数量可能不同,例如1,000万、2,000万、3,000万、4,000万、5,000万、6,000万、7,000万、8,000万、9,000万、1亿或这些微球计数中任意两个之间的范围。在一个具体实例中,
90
y源可以包含在3ml水中的2.4gbq颗粒。
62.在一个特定实施方案中,可用于
90
y或
90
y颗粒的来源。为一种生物相容性微球溶液,其在5ml水中包含约4千万至约8千万个微球。微球包含直径在20-60微米(μm)之间的生物不可降解树脂,其包含
90
y,即一种纯的高能量(最大能量2.227mev,平均0.93mev)β-发射体同位素。半衰期为64.1小时;组织中的最大穿透力为11mm,平均为2.5mm。微球为永久性植入物(例如,微球在植入后不会代谢或排泄)。94%的总辐射在11天内局部递送。微球由制造商提供,其装在带水的屏蔽(6.4mm厚)小瓶中,用于施用。每个小瓶在5ml的最终体积中包含大约3gbq的
90
y,或者在3ml的最终体积中包含2.4gbq的
90
y,或在2-5ml或2-3ml的最终体积中包含2-3gbq;微球的数量为40-80x106/小瓶或32-64x106/小瓶。小瓶应储存在15-25℃。
63.与使用相关的潜在不良事件包括:
64.·
发热
65.·
血红蛋白短暂减少
66.·
肝功能检查轻度至中度异常(例如alt、ast、碱性磷酸酶和/或胆红素轻度升高)
67.·
腹痛
68.·
恶心
69.·
呕吐
70.·
腹泻
71.如前所述,套件还可以任选地包含胶或基质源,但胶或基质源也可单独放置并与套件一起使用。在一个特定实例中,可用于
90
y胶基质组合物的胶成分。为牛血清白蛋白(bsa;在无菌注射用水中45%重量/体积)和戊二醛(在无菌注射用水中10%重量/体积)以4:1比例的混合物。牛血清通过热沉淀、色谱法和γ辐照进行纯化,以根除可能的传染性疾病。戊二醛暴露导致牛血清白蛋白、胞外基质蛋白和细胞表面的赖氨酸分子相互结合,形成强共价键。该反应是自发的,并且与患者的凝血状态无关。胶在20-30秒内开始聚合,并在大约2分钟内达到最大强度,从而形成固体植入物。降解过程大约需要2年,然后植入物被纤维化肉芽组织替代。粘合剂溶液(bsa和戊二醛以4:1的比例)在双室注射器的涂抹器尖端混合,其中开始交联。不认为是真正的止血剂,因为它不会加速血液中的凝血过程。然而,在完全硬化后通过填塞实质组织起到密封剂的作用。它通常用作更标准止血方法的辅助手段,例如缝合或使用局部止血剂。
72.与使用相关的潜在不良事件包括:
73.·
产品不粘附在组织上
74.·
将粘合剂涂布于与手术无关的组织
75.·
炎症和免疫反应
76.·
过敏反应
77.·
组织矿化
78.·
局部组织坏死
79.·
血管阻塞
80.·
支气管或管腔阻塞
81.·
血栓形成和/或血栓栓塞
82.·
肺栓塞
83.·
正常血管或组织的损伤或损害
84.·
传染性病原体可能从动物来源的材料中传播。
85.在其他实例中,具有不同浓度的bsa和戊二醛成分的替代组合物可以以不同的浓度提供和/或以不同的比例使用,例如:
86.1. 45%bsa和40%戊二醛成分,两者之比为1:1
87.2. 45%bsa和20%戊二醛成分,两者之比为2:1
88.3. 36%bsa和8%戊二醛成分,两者之比为4:1
89.4. 36%bsa和12%戊二醛成分,两者之比为3:1
90.在另一个实例中,密封剂(baxter healthcare;deerfield,il)可用于
90
y组合物的胶、基质或载体成分。tisseel为由混合的人血浆制成的双成分纤维蛋白密封剂。当封闭蛋白和凝血酶这两种成分合并在一起时,其组成类似于血液成分级联的最后阶段。封闭蛋白是一种无菌、无热原、蒸汽加热和溶剂/去污剂处理的制剂,其由汇集的人血浆制成。封闭蛋白以冷冻干燥粉末的形式提供,用于用纤维蛋白溶解抑制剂溶液进行重配,或者以成品冷冻溶液的形式提供,预填充到双室注射器的一侧。封闭蛋白的活性成分为纤维蛋白原。封闭蛋白溶液含有一种纤维蛋白溶解抑制剂,该抑制剂包括合成的抑肽酶,可延迟纤维蛋白溶解。抑肽酶由完全非人类/非动物来源的材料通过固相合成制造。封闭蛋白溶液
的组合物具有96-125mg/ml的总蛋白水平,纤维蛋白原67-106mg/ml,抑肽酶2250-3750kiu/ml,还具有人白蛋白、柠檬酸三钠、组氨酸、烟酰胺、聚山梨醇酯80和注射用水。凝血酶成分为无菌、无热原、蒸汽加热和溶剂/去污剂处理的制剂,其由汇集的人血浆制成。凝血酶(人的)也可以作为冷冻干燥粉末提供,用于用氯化钙溶液重配,或者作为预先填充到双室注射器一侧的成品冷冻溶液提供。凝血酶溶液含有400-625单位的凝血酶/ml、36-44μmol/ml的氯化钙以及一些人白蛋白、氯化钠和注射用水。tisseel的两种成分,即封闭蛋白和凝血酶可以在具有相同的室尺寸的2ml、4ml和10ml总体积的双室注射器中提供,例如每个室1ml、2ml和5ml的双室,并以1:1的比例提供。在其他实例中,封闭蛋白溶液和凝血酶溶液的浓度可以不同,从而使用非等比例的封闭蛋白溶液和凝血酶溶液。
91.可以使用的另一种双溶液密封剂为(chemo-sero therapeutic institute;kumamoto,jp),其包含80mg/ml人纤维蛋白原、75iu/ml人血浆来源的凝血因子(xiii)和1000kie牛抑肽酶的第一种溶液,以及250iu/ml的人凝血酶和5.9ml/ml氯化钙的第二种溶液,它们在使用时以1:1比例混合。
92.可用于
90
y-基质系统的另一基质为(ethicon,inc;somerville,nj),其包含8ml可流动无菌明胶的第一成分和2000iu冻干的可用2ml无菌注射用水重配的人凝血酶粉的第二成分。
93.在又一个实例中,可以使用多成分聚乙二醇密封剂,例如外科手术密封剂(baxter healthcare;deerfield,il)。可以包含预填充的涂抹器或注射器组件,其具有两个液体储存隔室和一个干粉隔室。一种溶液为稀盐酸溶液,另一种为磷酸钠/碳酸钠溶液。干粉注射器包含分子量为10kda的4-臂聚乙二醇聚合物(其中臂上用巯基封端)以及季戊四醇聚(乙二醇)醚四琥珀酰亚胺基戊二酸酯。这两种溶液以相同尺寸的注射器提供。首先,通过在干粉与缓冲溶液之间来回强制转移至少20次直到干粉显示溶解,从而用缓冲液溶液重配干粉。
94.在其他实例中,胶成分可以包含单成分胶、密封剂或基质,例如氰基丙烯酸酯、藻酸盐、聚乙烯醇、聚丙烯酸钠、琼脂糖、甲基纤维素、羧甲基纤维素、透明质酸等。
95.在操作过程中,可以推荐以下一项或多项:
[0096]-维持手术手套、无菌纱布/毛巾和其他手术器械的位置与基质分离,以便将基质与这些表面潜在和不慎的粘附减少到最低限度。
[0097]-注射器、涂药器和尖端涂药器延长件仅供单个患者使用。不要重新消毒。
[0098]-如果包装打开或损坏,请勿使用。
[0099]-小心不要意外溢出注射器的内容物。
[0100]-连接注射器时不要按压注射器柱塞。
[0101]-在启动过程中,避免织物与从涂药器排出的材料接触。
[0102]
90
y-基质组合物的基质成分可以快速聚合。启动必须迅速进行,然后应立即涂布化合物。启动和涂布之间的暂停会导致尖端涂药器中发生聚合。建议:
[0103]-从手术区域中抽吸过量的
90
y-基质组合物时,请勿使用采血装置。
[0104]-请勿在过湿的手术区域应用基质。这可能会导致握紧差。
[0105]-请勿使
90
y-基质组合物与无意中接触的点或表面剥离,因为这可能会损坏织物。
[0106]-不要在紧邻神经结构的封闭解剖部位植入
90
y-基质组合物。
[0107]-妊娠或哺乳期女性中使用y-基质组合物时要谨慎。目前还没有关于
90
y-基质组合物在妊娠或哺乳期女性中使用的有效性或安全性研究。
[0108]-由于该设备的放射性和不正确的产品放置的严重后果,所以临床医师不应在没有进行适当处理和植入技术培训的情况下植入该产品。
[0109]-所有处理、分配和植入该设备的人员都必须了解并遵守所有有关治疗性放射性材料的地区和州法规要求。在处理同位素和患者时,应使用公认的辐射防护技术来保护人员。
[0110]-一些患者在使用
90
y-基质组合物治疗后可能会出现胃部问题,但h-2阻滞剂可以在植入前一天使用,必要时继续使用,以减少胃部并发症。
[0111]-当在动物模型的皮肤上测试时,
90
y-基质组合物的放射性同位素成分显示出轻微的潜在致敏性。
[0112]-如果人员没有得到充分保护(即戴手套、口罩、防护服和防护眼镜),则不要使用
90
y-基质组合物。未聚合的戊二醛可导致刺激眼睛、鼻子、喉咙或皮肤,以及呼吸困难和局部组织坏死。长时间暴露于未聚合的戊二醛(其为的成分)会导致心脏或中枢神经系统疾病。如果发生接触,则立即用大量水冲洗受影响的区域并就医。
[0113]-不要在感染存在下使用
90
y-基质组合物,在身体受污染的区域谨慎使用。
[0114]-谨慎地让同一患者多次暴露于
90
y-基质组合物的多次应用。暴露于基质成分时可能观察到因超敏反应导致的反应。已在动物中观察到致敏现象。
[0115]-90
y-基质成分中的一些包含能够传播传染原的动物来源的材料。
[0116]
本文所述操作的潜在副作用可以包含:
[0117]-产品未能粘附到组织或治疗侧,
[0118]-将粘合剂涂布到不进行操作的组织上,
[0119]-炎症和免疫反应,
[0120]-过敏反应,
[0121]-组织矿化,
[0122]-局部组织坏死,
[0123]-血管阻塞,
[0124]-支气管或腔室阻塞,
[0125]-血栓形成或血栓栓塞,
[0126]-肺栓塞,
[0127]-对正常血管或组织的损害,
[0128]-来自动物来源材料中的传染性病原体的可能传播,
[0129]-发热,
[0130]-血红蛋白暂时减少
[0131]-改变的牵涉肝脏的生化测试(轻度至中度)(例如alt、ast、碱性磷酸酶、胆红素),
[0132]-腹痛,
[0133]-恶心,
[0134]-呕吐,
[0135]-腹泻。
[0136]
在一些变通方案中,本文所述的装置、套件和方法可用于在手术切除或消融后治疗一个或多个目标位置,以治疗任何残留的肿瘤细胞,但在其他变通方案中,目标位置可以为在切除之前进行治疗,例如,试图使癌症阶段降级以将不可切除的肿瘤转变为可切除的肿瘤。在其他变通方案中,可以在没有任何计划进行外科手术或消融手术的情况下治疗目标位置。在一些变通方案中,该疗法可用于治疗非癌性疾病或症状,例如,关节内注射治疗滑膜炎,皮内注射治疗瘢痕疙瘩和肥大性瘢痕,血管内注射治疗血管瘤等。
[0137]
在一个示例性实施方案中,用于治疗小肿瘤的方法利用混合注射器,该混合注射器被配置为连接至胶的供应注射器和放射治疗颗粒的供应源。将小瓶从其包装中取出,并且在不摇晃或以其他方式重配微球在水中的混悬液的情况下,首先取出预定量的未搅拌的或不含微球的混悬液,例如0.5ml、1ml、1.5ml、2ml或2.5ml,或10%、20%、30%、40%或50%。在其他变通方案中,取出的液体量可变,但产生的混悬液具有例如每1ml 0.5gbq、0.8gbq、1.0gbq、1.2gbq或1.5gbq的活性/体积比,或在这些比率中的任何两个之间的范围内。在取出一些混悬液后,通过摇动或其他搅拌来重配小瓶。基于放射治疗剂的剩余浓度,例如在4ml混悬液中3gbq,基于体积将期望的活性量抽取入放射治疗转移注射器中。在一些实例中,放射疗法转移注射器与用于取出预定体积的非搅拌或非微球混悬液的注射器相同,但在其他实例中,使用不同的注射器取出非搅拌或非微球混悬液。
[0138]
然后打开基质注射器的盖子。在一些实例中,基于计算的微球/混悬液的体积,可以分配来自胶源注射器的预定体积的胶,以容纳递送期望活性水平的微球所需的微球溶液的体积。在一些变通方案中,可以通过拉回柱塞结构而在注射器中提供额外的体积。在其他变通方案中,在添加同位素溶液之前不需要对基质注射器进行体积调整,因为在基质注射器中提供的现有空气隙足以容纳待转移的放射性同位素的量。
[0139]
在包含双成分基质的一些变通方案中,使用混合尖端递送放射治疗剂-基质组合物,该混合尖端可以在距包含所述成分的室的远端1、2或3cm内混合两种成分。混合尖端的远端可以包含多个远端开口,这些远端开口可以包含跨越混合尖端的横向尺寸的一般线性构造,以增加混合尖端的单程覆盖区域。例如,混合末端可以包含沿至少1、1.5、2、2.5或3cm宽的横向尺寸对齐的2、3、4、5、6、7或8个远端开口。
[0140]
在其他变通方案中,递送套件可以包含双腔管、双腔针头或双腔导管,使得两种成分的混合或聚合发生在更远侧,以避免单个腔管或导管内部的成分聚合,这可能会导致在基质到达目标位置之前堵塞。当从皮肤表面到目标表面的距离相对于包含基质成分的腔室的末端超过2、3、4或5cm时,这些递送组件可能是优选的。
[0141]
在一个实例中,递送套件可以包含双腔注射针头或导引器针(introducer needle)。该针头可以为经测量尺寸为11g、12g、13g、14g、15g或16g的针头,并且包含例如在100mm-200mm、120mm-150mm或140mm-170mm范围内的轴长度。针头可以由aisi 302、304或306l不锈钢制成,并连接至近端母鲁尔锁接头(female luer lock hub)上。针头还可以包含管心针,该管心针被配置为通过针头的内腔插入,该管心针包括实心芯,其带有或不带有从针头的远端伸出的尖的或刺穿的远端尖端。针头可与直径为12g、13g、14g、15g、16g、17g或18g的同轴双腔导管一起使用,并且包含例如在100mm-300mm、150mm-250mm或170mm-200mm范围内的轴长度。导管还可以包含近端鲁尔锁接头(luer lock hub)。导管的接头也
可以构造成与导引器针的近端鲁尔锁接头锁定,例如,借助当导管通过针座和针轴插入时可以锁定到导引器针针座的公鲁尔锁结构,或借助可逆地连接到导引器针针座的外表面的可变形或偏压的夹具结构。可以选择针头和导管的直径,使得导管被配置成可移除地插入通过导引器针,而不会在导管外壁和导引器针的内腔壁之间发生显著液体泄漏,例如导管的尺寸可以比导引器针小至少1g或2g。
[0142]
在一个具体实例中,可以使用图1a中描绘的来自svas biosana的套件10,其包括15g x 150mm同轴导引器针12和16g x 120mm同轴导管14,它们被配置为相互配合。导引器的近端包括公鲁尔锁接头16,使得导管接头20的远端18包括母鲁尔锁接头,当导管14插入导引器12时,该母鲁尔锁接头可以衔接公鲁尔锁接头16。导管接头20的近端22还包含连接器(connector),该连接器构造成连接至基质注射器或基质注射系统。例如,其可以是与注射器连接的专有互补母连接器接口,或母鲁尔锁接头。套件10还可以包含管心针24,该管心针24能够可靠地锁定并插入导引器12中,并且在导引器12插入和定位到目标位置期间使用。管心针24可以包含实心近端26,该近端26包含可释放的夹具结构以连接到导引器12的近端接头,或者在其他实例中可以包含母鲁尔锁。图1b描绘了插入导引器12中的导管14,其中公鲁尔锁接头16与母鲁尔锁接头18衔接。
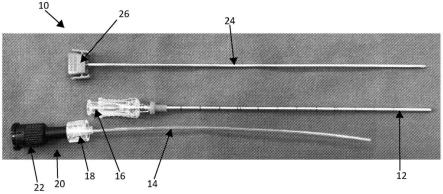
[0143]
在一个实例中,从其防辐射容器中取出装有放射性同位素微球的小瓶或瓶子,且如果可利用,则任选地放入铅或丙烯酸开顶盒中。用酒精棉签清洁小瓶上的密封物,然后用针刺穿密封物而在密封物中形成空气开口。针头,例如22g、25g、28g、30g、31g或32g皮下注射针头任选地留在原位。然后将5ml注射器连接至长度范围为50mm-150mm、50mm-120mm或70mm-100mm的20g或22g针头上。然后使用注射器和连接的针头重新穿刺密封物。在小瓶或瓶子底部不搅拌或混合沉降的微球的情况下,针尖位于混悬液内但在沉降的微球上方,取出并丢弃2ml混悬液,优选不显著除去任何微球。使用剂量校准器,检查或确认小瓶或瓶中剩余的活性。假设小瓶或瓶子在5ml混悬液中包含3gbq,则现在小瓶或瓶子在3ml混悬液中标称应包含3gbq。在其他变通方案中,可以去除不同量的混悬液,或者可以将额外的混悬液体(例如注射用水或等渗氯化钠溶液)添加到小瓶或瓶子中以改变每体积的活性浓度。
[0144]
然后确定或基于(a)小瓶中的校准或标称活性浓度,(b)目标活性水平或要递送至靶病灶或在靶病灶中达到的吸收剂量,和(c)任选地考虑在完全或最大注射后注射器注射系统中可能存在的材料的剩余体积,例如注射器尖端距离柱塞或注射器滑动密封件的剩余体积,以及混合尖端或注射导管或针头中的剩余体积,从而确定待注射到靶病灶中的目标活性水平和体积。例如,从切除的乳房病灶到手术床的目标吸收剂量可以为18gy或20gy,而对于肝脏病灶,则为150gy。然后将注射器和连接的针头重新插入小瓶或瓶子中并用于搅拌和悬浮在混悬液中的沉降微球,其通过来回移动注射器的柱塞数次,例如10-20次,和/或直到通过混悬液外观均匀且没有任何明显沉降的微球而目测确认充分混合。然后使用注射器取出目标活性体积。然后移除胶/基质注射器的注射器盖,然后将含有微球的混悬液的目标活性体积以与bsa:戊二醛室的4:1比例或以相当于它们的横截面积或基质成分室体积的比例分配在胶/基质注射器的两个室中。对于其他注射器/注射系统,例如,当两个腔室之间的体积或横截面积比为1:1、1.5:1或2:1时,目标体积以1:1、1.5:1和2:1比例分配。对于三室递送系统,例如1:1:1或4:1:1或4:2:1比例的注射系统,目标体积可以以相同的比例分别分配到三个室。
[0145]
在将目标活性体积分配或装载到基质注射器中后,将注射器盖放回基质注射器上。放射性药房中常用的商购剂量校准器可用于确认注射器中的预期活性,并在需要时对其进行校正。然后将装载的基质注射器放回其防辐射容器中,以便储存或运输到手术室或手术设施。
[0146]
在手术室或手术设施中,以通常的无菌方式对患者进行准备和覆盖,并实现麻醉。靶病灶,例如肝病灶,使用例如超声或荧光透视的成像方式或基于先前的成像(使用或不使用任何造影剂进行的成像)来识别。将管心针插入导引器针中,然后经皮插入靶病灶,优选使用超声或ct引导。将预先装载有放射治疗颗粒的预装注射器从其防辐射容器中取出,并通过保持注射器直立并左右旋转帽来取下注射器帽。然后将同轴导管的双侧帽与双室注射器的两个开口对齐。可以提供导管上的标记以便于与注射器对齐。然后可以使用锁定环或其他锁定结构将导管锁定到注射器上,例如以防止注射器和导管的无意中分离。
[0147]
在任选地重新确认导引器/导管组合的位置后,注射器/递送系统的柱塞或致动器被致动以分配混合物。在一些实例中,注射器柱塞或递送系统致动器可以以大约每秒0.5mm-1mm、每秒0.5mm-2mm或每秒0.5mm-1.5mm的速率致动。一旦递送完成,则可将导引器针/导管留在原位30至60秒,或至少5秒、10秒、15秒、20秒或30秒,和/或不超过30秒、45秒,60秒、90秒或120秒。这可以确保在目标位置聚合,此后可以使用任选的扭转运动从目标位置移除导引器针/导管,以确保基质与导引器针/导管充分分离,而不会由于注射基质和导引器针/导管的不完整分离而发生对插入路径的播撒或对目标位置的牵拉。然后可以检查导引器针/导管插入部位是否有任何液体泄漏,并任选地用非放射性生物胶或基质缝合或密封,然后根据需要包扎和敷料。适当地处置任何放射性或生物危害性成分。
[0148]
在已施用或递送期望量的组合物之后,从插入的导引器中取出管心针,同时维持导引器的位置。然后通过导引器插入注射器/导管,直到导管的远端接头与导引器的近端接头锁定。
[0149]
在不需要用针头或导管经皮进入的实施方案中,在上述操作中,混合工具尖端可以连接至混合物注射器而不是通过导引器进入,然后连接针头和/或导管。连接混合尖端后,可摇动注射器,使放射性同位素混悬液与胶或基质成分充分混合。然后注射器柱塞或递送系统致动器可以以每秒约0.5mm-1mm的速率致动,以将混合物施加到手术腔的表面。递送完成后,可将手术腔暴露30至60秒,以确保在目标位置聚合。然后可以关闭手术腔并以通常的方式敷料。适当地处置任何放射性或生物危害性成分。
[0150]
在其他实例中,放射性同位素微粒可以在制造地与预装注射器的基质或胶的一种或两种成分预混合。例如,
90
y微球可以与预装注射器的bsa和/或戊二醛成分预混合并一起装载。在一些变通方案中,由于具体病灶大小或疾病可能需要不同的治疗浓度,因此可以提供具有不同治疗浓度的不同尺寸的注射器。例如,可以提供1ml、2ml、5ml或10ml预装注射器注射系统,但每毫升预混bsa成分的活性不同,但在戊二醛成分中没有活性。注射器可以包含5mbq-50mbq/ml、7mbq-45mbq/ml、7mbq-40mbq/ml、15mbq-40mbq/ml或15mbq-30mbq/ml的范围内的活性浓度。例如,这些浓度可用于治疗乳腺癌。在其他实例中,1或2ml注射器可以包含0.1mbq-20mbq/ml或0.2mbq-15mbq/ml范围内的活性浓度,并且5ml或10ml注射器可以包含3mbq-30mbq/ml或5mbq-25mbq/ml范围内的活性浓度。这些注射器的浓度可用于对辐射更敏感的肿瘤或需要减少对周围正常组织的影响的部位,例如hcc。下文某些实施例中提供
了肝癌和乳腺癌的剂量选择的具体实例。
[0151]
放射量测定
[0152]
如前所述,肝细胞癌(hcc)是最常见的原发性肝脏恶性肿瘤,并且是全世界癌症相关死亡的主要原因。它是一种通常发生在肝硬化背景下的侵袭性癌症。令人遗憾地,它通常出现在晚期,此时患者已经变得有症状并且具有一定程度的肝损伤。在美国,2013年发生了总共30,640例新的肝癌和肝内胆管癌,还有21,670例死亡。hcc在男性中比在女性中更常发生(2.4:1),其中在东亚和南亚、中非和西非、美拉尼西亚和密克罗尼西亚/波利尼西亚的发病率更高。尽管预防技术、新技术和筛查程序(在诊断和治疗中)取得了重大进展,但发病率和死亡率正在增加,其中肝硬化是hcc发展的最重要的风险因素,不管病因如何。当今存在多种治疗方式。然而,只有原位肝移植或手术切除可以被认为是治愈性的。其他治疗方式包括经动脉化学栓塞、放射栓塞、经皮乙醇注射、放射疗法和消融疗法。特别地,经皮消融是治疗肝脏中不能手术的原发性肿瘤或转移的有希望的方法。事实上,在hcc的治疗中,低于40%的患者是手术候选者,且在治愈性手术后复发的可能性通常很高。在这种背景下,经皮技术代表了成功的治疗选择,并且今天广泛用于治疗转移性和小的原发性肿瘤。在这些技术中,诸如化学消融、冷冻消融、高温消融(例如射频、微波、激光和超声)的方法已经被广泛接受用于治疗肝肿瘤,因为它们可用作移植候选者的桥梁,特别是关于小的原发性病灶。根据肿瘤尺寸、位置、肝外扩散和潜在肝功能选择治疗方式。
[0153]
由于缺乏hcc的有效全身疗法,研究人员自20世纪60年代以来一直在研究利用
90
y放射栓塞进行局部区域肿瘤控制的用途。目前,放射栓塞(或选择性内部放射治疗sirt,也称为经动脉放射栓塞,tare)是基于经动脉输注载有
90
y微球的肝恶性肿瘤的既定且有效的治疗。过去,许多作者已经研究了由肝内动脉输注
90
y微球引起的辐射剂量分布。现在,存在两种临床上可用的掺入
90
y的微球装置:一种具有由玻璃制成的微球(therasphere;mds nordion,ottawa,ontario,canada),另一种具有由树脂制成的微球(sir-spheres;sirtex medical,sydney,australia)。树脂微球装置由直径为20-40μm的生物相容的携带
90
y的微球组成。一旦施用,则球体作为永久植入物保留在肝脏中。
[0154]
在传统的基于导管的方法中,放疗栓塞涉及微球的动脉内输注。然而,近年来,许多研究已经解决了基于通过经皮穿刺应用瘤内施用
90
y-缀合物的疗法中的放射剂量测定问题。近年来,该技术已成功应用于使用
90
y-标记的[dota
0-d-phe
1-tyr3]奥曲肽(
90
y-dotatoc)治疗恶性神经胶质瘤的患者。
[0155]
此外,基于在肝脏放射性栓塞术中获得的临床经验,通过瘤内注射适当活性的
90
y经皮消融hcc有可能显著减少局部复发的机会。在这种情况下,人们越来越关注开发新的通过与生物相容性化合物混合的微球形式的
90
y局部施用的hcc瘤内操作方法。
[0156]
通常,放射性核素的瘤内施用引起关于小病灶的剂量测定的问题,因为这种方法允许选择性地治疗亚厘米的肿瘤。迄今为止,当施用
90
y时,没有简单的方法来精确地评估对肿瘤和正常肝组织的吸收剂量。这是因为
90
y仅发射在组织中具有有限穿透范围的纯β辐射。因此,递送剂量高度依赖于微球的分布和肿瘤质量。特别地,用于评估肝脏和肝脏实质内的肿瘤块的吸收剂量的当前分析形式是基于给定器官内从
90
y释放的所有颗粒被该器官完全吸收的假设。然而,当肿瘤尺寸小时,这种假设可能不再是真实的,并且当前的分析方法在用于评估小目标区域中的剂量时可能提供不准确的剂量结果。
[0157]
因此,目前用于评估
90
y微球施用后吸收剂量的分析形式在用于计算小目标区域中的剂量时可能会提供不准确的结果,因为它基于假设所有β-粒子能量均被治疗过的肿块完全吸收。本文的工作评估了在不同大小的病灶中瘤内注射
90
y的情况下的吸收剂量,并提供了一种给药方案,该给药方案负责被治疗的肿块完全吸收的部分吸收的β-粒子能量。
[0158]
在一个实例中,评估小病灶的吸收剂量,推定选择性地将
90
y递送入肿瘤中(即在通过瘤内注射放射性核素的经皮消融hcc的情况下)。在mcnp4c monte carlo(mc)代码中实施了肿瘤块的简化模型,目的在于确定当肿瘤块均匀填充
90
y时病灶的吸收剂量。
[0159]
在一些变通方案中,在不同大小的球体(直径0.5-20cm)中使用monte carlo计算评估每单位施用活性的吸收剂量。球体代表肿瘤区域,并且意图均匀填充
90
y。将monte carlo结果与充分建立的分析方法进行比较。
[0160]
初始结果表明,对于直径大于约2cm的病灶,当前分析模型的使用提供了低于10%的剂量高估。然而,对于直径小于2cm的病灶,分析模型可能显著(》10%)偏离monte carlo结果,对于0.5cm直径的病灶提供大于50%的剂量高估。提供了用于计算小目标区域中的吸收剂量的替代方程。
[0161]
90
y主要通过β发射(99.983%)分解为稳定的
90
y基态能级。在1760kev激发能级出现弱β分支,该激发能级因e0γ跃迁而衰减。这种0
+-0
+
跃迁之后会发射两个伽马,或电子-正电子对,或内部转换。采用的
90
y基态的半衰期为64.041小时或2.6684天。
[0162]
在临床实践中使用的放射性核素中,
90
y具有吸引力的物理和放射生物学特征,其使得这种放射性核素适合于局部区域治疗选择。高能β-粒子(最大能量2278.7kev,平均能量926.7kev)及其穿透深度(组织中的最大粒子范围,11mm;转移50%能量粒子之后的组织范围,4mm)允许将高辐射剂量选择性地递送至目标区域,同时保护周围组织和正常器官。特别地,高能β-粒子的穿透深度为该放射性核素在放射性栓塞中成功的关键因素,从而允许高剂量沉积到栓塞的毛细血管之间的组织中。在传统的剂量计算形式中(
90
y局部施用后),通常会做出两个重要的简化假设:
[0163]
·
给定器官内从
90
y释放的β辐射被该器官完全吸收。在大部分情况下,该假设得到组织中平均4mm 90
yβ范围的支持。
[0164]
·
在已递送的区域内具有
90
y的持久性(即放射性药物不会迁移到肿瘤区域之外)。
[0165]
结合这两个假设可以在宏观尺度上便利地计算关注的器官的平均吸收剂量。使用
90
y迄今为止最新核数据进行的计算如下所示,并且通常称作mird(医用内照射剂量)方法:
[0166][0167][0168]
其中e
avg
是基于发射的概率密度函数的
90
y每次衰减释放的平均能量,λ是基于64.041小时的半衰期的
90
y衰减常数,并且k是常数项。a0是以gbq计的器官中存在的活性,e
tot
是a0从其输注时直到其完全衰减时释放的总能量。
[0169]
假设β衰变的所有能量在发生衰变的体积中被吸收,则可以采用给定的物理值及
其统计学不确定性来计算常数项k:
[0170][0171]
常数因子49.38(j/gbq)是每单位
90
y活性释放的能量。在下面的方程中报告的核数据上采用的不确定性导致常数项上0.1%的相对标准不确定性,即49.38(5)(j/gbq),符合美国医学物理学家协会的建议。
[0172]
最终,可以通过将递送的能量e
tot
除以目标区域的质量m(以kg表示)来获得吸收剂量d(以gy表示):
[0173][0174]
值得注意的是,在其他出版物中已经报道了具有略微不同的常数项k(例如49.98、49.67)的相同公式。
[0175]
根据分区模型,一旦已知肿瘤摄取分数fu
tumor
(即肿瘤中累积的施用活性的分数),则上述方程可用于计算肿瘤中的吸收剂量:
[0176][0177]
必须重申的是,上述方程(4)和(5)仅对
90
y放射栓塞有效,并且仅代表器官或大病灶中的平均吸收剂量,即在宏观尺度上。在本文中假设这些方程对于非常小的肿瘤质量可能不成立,因为在衰减期间发射的能量被目标质量m完全吸收的假设不再成立。特别地,当病灶的尺寸非常小时(特别是在亚厘米区域中),每单位
90
y活性释放的能量可能显著降低。因此,在下文中,方程(3)中的常数项k将被视为病灶半径(r)的函数,并表示为k(r)。
[0178]
在本研究中,使用简化几何学中的monte carlo计算来评估每单位施用活性的吸收剂量。mc代码mcnp4c已用于此目的。mcnp是一个通用、连续能量、广义几何、时间相关的耦合中子/光子/电子的monte carlo输运程序。对于光子输运,该代码考虑了光电吸收,具有k壳层和l壳层荧光发射或俄歇电子的可能性,相干和非相干散射以及对产生。光电截面基于storm和israel,而散射截面取自endf列表。电子输运采用连续慢化近似能量损失模型。
[0179]
针对两种不同的密度:ρ=1.00g/cm3(水密度)和ρ=1.05g/cm3(肝密度)模拟不同尺寸(直径在0.5-20cm的范围内)的球形病灶。在这两种情况下,假设球体浸没在具有相同球体密度的半无限介质中。球体代表肿瘤区域,并且假定均匀地填充有
90
y,而周围介质假定不含放射性。
[0180]
使用el03电子相互作用数据库(elib=03e)和mcnplip2光子相互作用数据库(plib=02p)以耦合电子-光子模式[模式pe]进行计算。考虑到所有可用的高级选项,例如通过光子的电子产生、韧致辐射效应和爆震电子产生,进行模拟。mcnp模拟运行足够的时间以使吸收剂量的统计学不确定性低于0.01%。
[0181]
图18显示从mcnp模拟获得的作为肿瘤尺寸的函数的进入肿瘤的
90
y吸收剂量的分
数。在模型中实现的
90
yβ谱也报告在图19中。对水球体(ρ=1.00g/cm3)和由肝组织制成的球(ρ=1.05g/cm3)进行计算。在这两种情况下,当病灶直径下降到2cm以下时,更大量的β粒子能量被递送到球体外部,并且上述第一假设(从给定器官内的微球释放的辐射被该器官完全吸收)不成立。与此一致,每单位活性的递送能量k(r)显示出相同的趋势(图20),证实当肿瘤尺寸小时,该项显著偏离其在方程(4)中考虑的恒定值49.38(j/gbq)。为了在临床水平上使用图20中报告的信息,用以下函数拟合从mc计算获得的k(r)数据:
[0182][0183]
其中r是以cm为单位的病灶半径(假设球形肿瘤),并且k0、a、a、b、b是通过拟合确定的参数,如下表1中针对水密度和肝密度两者所报告的:
[0184]
表1:对于水和肝密度(分别用上标w和
l
表示)的具有相对标准不确定性的方程(6)的拟合参数。两种情况中r2=0.999。
[0185]
参数值
wurelw
/%值
lurell
/%k
0-11.8831.10-12.9991.00a4.4161.154.6541.10a2.1900.901.9091.00b56.8200.0557.7010.05b0.2900.150.2710.10
[0186]
对于水和肝密度两者,从拟合获得r2=0.999。此外,还通过残差分析评估了拟合优度(图21),其显示计算数据和拟合数据之间的最大偏差低于0.2,证实了拟合的准确性。基于方程(6)中描述的拟合函数,方程(4)可以以下形式重写:
[0187][0188]
对于给定的活性a0,方程(7)可以用于准确地计算非常小的病灶(小至0.5cm直径)的吸收剂量。使用方程(7)计算的病灶的吸收剂量提供了与mc计算良好一致的结果(最大偏差低于0.5%)。如所预期的,当理想地r
→
∞时,方程(7)简化为方程(4)。值得注意的是,当x
→
∞时从方程(6)获得的每单位活性的能量k(r)为49.35(j/gbq),相对于从方程(4)导出的49.38(j/gbq)的接受值(0.06%偏差)。
[0189]
图22比较了对于不同尺寸的球形病灶和对于ρ=1.05g/cm3,用monte carlo计算的每单位活性的吸收剂量(gy/gbq)与使用mird分析方法获得的吸收剂量。图23中示出了对于ρ=1.00g/cm3的相同结果。此外,图23报告了使用由核医学学会的辐射剂量评估资源(radar)任务组开发的已确立的olinda/exm代码计算的吸收剂量。如图23所示,用mc方法计算的吸收剂量值与使用olinda/emx获得的吸收剂量值有很好的一致性。当病灶直径降至2cm以下时,在mc计算剂量值与使用mird分析方法获得的剂量值之间发现显著偏差(图23,插图)。
[0190]
最终,下表2和3比较了用mc计算(d
mcnp
)和mird分析方法(d
mird
)获得的每gbq施用活性的吸收剂量值。还报告了两种方法之间的百分比差异(两个表的最后一列,δ),计算为100
·
(d
mcnp-d
mird
)/d
mird
。只要病灶直径超过2cm,吸收剂量值的差异在约10%以内。当病灶
尺寸下降到2cm以下时,由于球体外部的显著能量沉积,这两种计算方法显著偏离。这与组织中
90
y的最大颗粒范围一致(约11mm)。在这种情况下,对于2cm、1cm和0.5cm的肿瘤直径,对于水(肝脏)密度,mc计算提供的吸收剂量分别比mird分析方法低-9.3%(-9.6%)、-27.8%(-26.7%)、-56.7%(-55.4%)(表2和3)。
[0191]
表2:对不同大小的均匀填充
90
y的球形病灶用mcnp4c计算的单位活性剂量。假设病灶具有密度为ρ=1.05g/cm3(肝密度)。已使用方程(4)描述的mird分析方法计算了相同的量(每单位活性的剂量)。表的最后一列(δ)显示两种方法之间的百分比偏差,计算为100
·
(d
mcnp-d
mird
)/d
mird
。
[0192][0193][0194]
表3:对不同大小的均匀填充
90
y的球形病灶用mcnp4c计算的单位活性剂量。假设病灶具有密度为ρ=1g/cm3(水密度)。已使用方程(4)描述的mird分析方法计算了相同的量(每单位活性的剂量)。表的最后一列(δ)显示两种方法之间的百分比偏差,计算为100
·
(d
mcnp-d
mird
)/d
mird
。
[0195][0196]
在过去二十年中,
90
y的剂量测定受到了很大的关注。然而,很少有研究人员解决了非常小的肝脏病灶中的剂量测定问题。
90
yβ粒子在组织中的最大范围为11mm,而平均能量β粒子具有约4mm的范围。值得注意的是,高能
90
yβ粒子的穿透深度是这种放射性核素在肝脏放射性栓塞中成功的关键组成部分,允许高剂量递送到栓塞的毛细血管之间的组织中。
[0197]
本工作旨在评估通过在不同大小的病灶中瘤内注射
90
y经皮消融hcc的情况下每单位活性的吸收剂量。将简化的模型肿瘤面积实施到mcnp4c mc代码中,目的是确定当肿瘤块均匀填充
90
y时病灶的吸收剂量。针对两种不同的密度:ρ=1.00g/cm3(水密度)和ρ=1.05g/cm3(肝密度)模拟不同尺寸(直径在0.5-20cm的范围内)的球形病灶。在这两种情况下,假设病灶浸没在具有与病灶相同密度的半无限介质中。无论病灶的密度如何,只要病灶直径超过2cm,mird分析方法和mcnp计算提供偏差10%以内的结果。当病灶直径下降到2cm以下时,在mc计算和mird方法之间获得显著差异(即偏差》10%)。作为一般结论,mird方法倾向于高估小病灶中的吸收剂量,因为该模型的基本假设是β辐射被衰减所发生的肿瘤或组织完全吸收。当肿瘤的半径小于介质中β辐射的最大范围时,大量的能量被递送出病灶,从而提供较小的吸收剂量值。
[0198]
目前,尽管存在不同的剂量算法,但是由方程(4)描述的mird分析算法仍然广泛用于在临床水平上评估肿瘤和肝隔室中的吸收剂量。对于较大的肝脏病灶,方程(4)可以提供准确的剂量估计(条件是引入准确的输入参数,其中包括靶的分数摄取)。然而,当应用该方法来评估小肿瘤块(即,直径大约低于2cm)的吸收剂量时,可能获得不准确的剂量估计。
[0199]
此外,mird分析算法已经安全地用于利用玻璃微球的治疗计划。基本原理基于方程(4),其描述了作为
90
y活性的函数的组织体积中的平均剂量。在治疗计划期间,可以针对治疗活性a0求解方程(4)。在本文实施例中获得的结果提出了关于mird分析方法是否应该用于评估规定的
90
y活性以便在小肝脏病灶中实现给定的杀肿瘤终点的问题。当肿瘤内注射
90
y时尤其如此。例如,对于hcc,120gy通常被认为是合理的最小目标剂量。因此,当用
90
yβ粒子治疗hcc患者时,可能希望将d
tumor
设定为120gy的最小值。可以重新排列方程(5)以导出规定的治疗活性:
[0200]
a(gbq)=d
tumor
·mtumor
(kg)/49.38(j/gbq)
·
f u
tumor
[0201]
例如,假设0.52mg(直径1cm)的肿瘤块m
tumor
,fu
tumor
=1和d
tumor
=120gy,方程(5)将产生1.21mbq的治疗活性(考虑ρ=1.05g/cm3)。另一方面,如果使用方程(7)而不是方程(4),则获得1.62mbq的规定活性。如前所述,这种差异的原因是球体外的显著能量沉积的结果(约26%的β粒子能量被递送到球体外部,如图18a所示)。因此,1.21mbq的治疗活性实际上对应于约90gy的吸收剂量,远低于治疗终点。
[0202]
如上所述,
90
y的瘤内注射可能造成与非常选择性地治疗非常小的病灶的可能性相关的特定治疗计划问题。在其论文中,ariel报道了首次在间质使用
90
y微球治疗横纹肌肉瘤(ariel i 1978cure of an embryonal rhabdomyosarcoma of nose of an infant by interstitial
90
yttrium microspheres:a case report international journal of nuclear medicine and biology 5 37-41)。通过间质注射185mbq的微球成功地治疗了直径1.5cm的结节。在另一项研究(tian jh,xu bx,zhang jm,dong bw,liang p,wang xd 1996ultrasound-guided internal radiotherapy using yttrium-90-glass microspheres for liver malignancies journal of nuclear medicine 37 958-63)中,使用超声引导程序将
90
y-玻璃微球注射到预定的肿瘤部位。肿瘤尺寸范围为1.9至8.8cm,大多数病灶直径小于5cm。最近,ferrari及其同事评估了局部
90
y-dotatoc注射后对小体积脑肿瘤和周围组织的吸收剂量(ferrari m,cremonesi m,bartolomei m,bodei l,chinol m,fiorenza m,tosi g,paganelli g.dosimetric model for locoregional treatments of brain tumors with
90
y-conjugates:clinical application with90y-dotatoc,j nucl med.2006jan;47(1):105-12.)。关于用放射性β发射微粒进行肿瘤内治疗的文献的最近综述可见于bakker r,lam m,van nimwegen s,rosenberg a,van es r and nijsen j 2017intratumoral treatment with radioactive beta-emitting microparticles:a systematic review journal of radiation oncology 6 323-341。
[0203]
本文描述了一种操作,其中使用如本文所述的递送系统,使用
90
y微球(包埋在生物相容性基质中)的直接的图像引导的肿瘤内注射将微球递送至靶标。该操作也称为经皮放射消融,并且是使用以下组分的组合进行的用于患有小(低于约3cm)肝脏肿瘤的患者的微创治疗:i)(cryolife,atlanta,us),fda批准的4:1比例的牛血清白蛋白和戊二醛的混合物,批准用于软组织修复或密封受损的实质,ii)涂覆有
90
y的(sirtex medical,sydney,australia),批准用于通过肝动脉植入肝肿瘤中,和iii)(svas biosana,naples,italy),一种专用的同轴双腔导管,用于直接的成像引导的肿瘤内注射胶和
90
y微球混合物。本研究的证据表明,当计划用
90
y治疗非常小的病灶时,必须小心,实施标准分析方法。当进行瘤内施用
90
y时尤其如此,因为这种
方法允许选择性治疗亚厘米的肿瘤。在这种情况下,使用分析方法计算实现给定的杀肿瘤终点所需的治疗活性可能导致重要的剂量低估。
[0204]
在一些实施方案中,由方程(7)呈现的替代算法可以有用地用于瘤内注射微球的治疗计划,提供与monte carlo计算非常一致的结果(最大偏差低于0.5%)。
[0205]
总之,对于给定的活性a0,mird模型提出的分析方程(方程4)可能高估了2cm以下的病灶中的吸收剂量。相反,如果使用分析方法来评估规定的
90
y活性,则可以获得活性低估。这是因为导出方程(4)的基本假设(β粒子完全吸收到目标体积中)对于小病灶不再成立。然而,对于直径大于约2cm的病灶,高估的量低于10%。通常,病灶尺寸越大,mird模型与monte carlo计算的一致性越好。当病灶尺寸下降到2cm以下时,两种计算方法显著偏离,其中分析算法提供高达57%的剂量高估(对于0.5cm直径的病灶)。因此,当在非常小的病灶中使用方程(4)进行吸收剂量确定时,建议谨慎。具体而言,为了评估小肿瘤区域中的吸收剂量,建议使用方程(7)而不是方程(4)。
[0206]
实施例1:临床前研究
[0207]
在一个实例中,在使用与水凝胶或组织胶混合的
90
y微球的一组实验中证明了
90
y标记的颗粒的均匀分布。通过在注射或植入过程中固化,放射性胶或凝胶可以均匀分布,并且它可以抵抗来自重力、分散或泄漏到血液或淋巴管、血肿等的不期望的影响。图2a和2b描绘了在2.5ml注射器筒中的bioglue中的1mci(37mbq)的
90
y微球的γ相机视图,所述bioglue是45%w/v牛血清白蛋白和10%w/v戊二醛以4:1比率的混合物。使用5ml塑料球进行另外的研究,该塑料球填充有
90
y微球和凝胶载体或基质材料,例如bioglue、coseal(peg/hcl/naphos/naco3;baxter healthcare,hayward,ca)或beriplast(纤维蛋白原/凝血酶;csl behring gmbh;marburg,germany),活性水平为370至740mbq,使用双腔同轴导管填充。在这些研究中,使用4mm切片进行γ相机和pet/ct成像,以更精确地评估固化载体中的放射性分布,如图3a和3b所示。图3a中的pet/ct成像还表明,在混合后,用于将微球悬浮在空腔中的固体载体材料中的液体没有分离,并且在较大尺寸的空腔内,均匀分布没有变化或固化过程没有其他变化。
[0208]
γ相机和pet/ct成像的使用也用于评估
90
y微球和固化基质的剂量分布。图4a至4c描绘了0.5ml、4.2ml和11.4ml球体积(分别为0.5cm、1cm和1.5cm半径)的空腔中的相对吸收剂量,如从每个相应体积的中心和距球体表面1mm厚的壳体积测量的。
[0209]
图5描绘了
90
y微球-组合物在上文在图4a至4c中描述的每个体积中的活性百分比。对于0.5cm、1cm和1.5cm半径体积中的每一个,在距体积表面0.5cm半径距离内,或在距体积中心150%半径距离内,活性百分比有效地下降到小于50%活性。对于半径为0.5cm的体积,活性百分比分别在离其表面0.5cm或离其中心1cm内降至小于10%或5%,并且在离其表面1cm或离其中心1.5cm内降至零。对于1cm半径体积,活性百分比分别在距其表面0.5cm或距其中心1.5cm内下降至小于10%或5%,并且在距其表面1cm或距其中心2cm内下降至小于1%。对于1.5cm半径体积,活性百分比分别在距其表面0.5cm或距其中心2cm内下降至小于10%或5%,并且在距其表面1cm或距其中心2.5cm内下降至小于1%。这些体积的估计的吸收剂量提供如下:
[0210]
0.5ml体积,具有0.5cm半径和185mbq活性:
[0211]
距离中心(cm)gy/mbqgy
0.562.9116400.635.064670.714.025870.85.610350.92.138810.5591031.20.070131.50.00020.04
[0212]
4.2ml体积,具有1cm半径和370mbq活性:
[0213]
距离中心(cm)gy/mbqgy110.13732.31.16.72488.21.22.2829.41.31.0373.21.40.6207.41.50.11241.51.60.0041.71.70.0010.4
[0214]
14.1ml体积,具有1.5cm半径和1110mbq活性:
[0215]
距离中心(cm)gy/mbqgy1.53.463843.21.61.151281.11.70.81896.71.80.35384.31.90.12128.120.0664.12.10.009210.22.30.00121.3
[0216]
图6描绘了三个体积的相邻壳体积中每单位的吸收剂量(gy/mbq)。这些图表明,在距体积表面0.5cm的距离内,吸收剂量减少至少95%,或减少1至2个数量级,并且在半径的150%内减少至少90%。
[0217]
图7描绘了三个体积的相邻壳体积中以gray为单位的总吸收剂量。对于半径为0.5cm的体积,距离表面0.5cm内(距离中心1cm)的吸收剂量减少约90%。对于1cm半径体积,距离表面0.5cm内(距离中心1.5cm)的吸收剂量减少超过90%。对于1.5cm半径的体积,距离表面0.5cm内(距离中心2cm)的吸收剂量减少超过90%。
[0218]
实施例2:小鼠研究
[0219]
在一项研究中,申请人的胰腺癌动物模型使用在cd1裸鼠大腿中的人mia-paca-2rfp细胞,然后将新基质应用于诱导的肿瘤部位,所述新基质将充当
90
y球体的载体。具有
90
y球体的新基质的瘤内应用通过其均匀分布导致组织中化合物的水平增加,并且使得可以
通过降低扩散速率并避免和最小化治疗的全身副作用来实现用于治疗肿瘤的有效剂量。
[0220]
实验方案涉及影响肿瘤缩小的局部区域治疗,对宿主具有明显的益处。从本文的该研究和其他研究获得的结果可以转化为临床实践,引入显著的益处,因为在大多数情况下,胰腺癌对于局部晚期疾病而言是不可手术的。
[0221]
用于本研究的放射性同位素和基质为如上所述的和认为该组合物:
[0222]-可以肿瘤内施用,以引起注射部位周围的肿瘤组织完全坏死,从而允许治疗不能手术去除的恶性肿瘤块;
[0223]-在恶性肿瘤块的手术切除或消融治疗之后,可以用作手术伤口的涂层或填充材料,以引起沿着这些伤口边缘定位的任何剩余肿瘤细胞的完全坏死;
[0224]-可以导致抗癌物质的功效增加,在局部水平上产生所述物质的施用和给药时间的有益增加,这是通过所治疗的肿瘤块内或来自肿瘤的手术切除或消融治疗的手术伤口内的物质的浓度增加而实现;
[0225]-防止抗癌物质在患者体内自由分散,从而限制其毒性组分的全身暴露;和/或
[0226]-避免了一些副作用,这些副作用来自于采用恶性肿瘤块手术切除的替代治疗方法。
[0227]
放射性同位素-基质组合物包括了在能够包埋微球的合适粘性材料中的具有足够抗癌能力的物质,例如
90
y或与钬类似的其他类型,认为该组合物可以提供均匀的分布并充当所述物质的载体。通过适当的内部电子放射疗法(ier)诱导目标肿瘤细胞的坏死,所述内部电子放射疗法(ier)通过用
90
y放射性标记的上述微球的放射性粒子的局部发射来确定。通过γ照相机和pet/ct/spect成像研究,如图8a至8f所示,发现由于形成基质的组分的粘性,
90
y以几乎均匀的方式分散在其所注射的肿瘤块内或其所施加的手术伤口内,并且这种均匀分布对位于这些区域的肿瘤细胞的坏死是非常重要的。
[0228]
在注射人mia-paca-2 rfp细胞后,在小鼠中诱导肿瘤。图8a和8d描绘了不含任何
90
y球体的基质的pet/spect图像,而图8b和8e描绘了注射组合的
90
y-基质组合物的小鼠的pet图像。图8c和8f是图8b和8d中小鼠的相应spect图像,证实了
90
y球体都没有从注射部位泄漏或分散,并且在肿瘤内存在放射性同位素的均匀分布。
[0229]
结果还表明,通过使用具有足够固化速率的水凝胶或基质作为放射性标记的微球的载体,可以基本上限制可能由诸如重力、血液和/或淋巴管中的循环、血肿的存在等因素引起的所述微球在患者体内的可能分散,从而避免或大大减少来自患者体内放射性材料的潜在泄漏的可能副作用。
[0230]
形成水凝胶或基质的材料是粘性凝胶或基质,其被设计用于直接肿瘤内注射或用于施用在肿瘤切除部位的表面。该基质被配置为包含
90
y球体,由于其尺寸和组成(例如树脂或玻璃),其被捕获在凝胶基质中,因此在肿瘤或切除部位定位更长的时间段,以便增加或最大化局部剂量水平和暴露持续时间。具有
90
y微球的基质的总体效果导致局部
90
y微球浓度的增加,限制或减少峰值全身暴露。
[0231]
实施例3:基质-注射器的研发
[0232]
由于形成止血凝胶、密封剂或水凝胶的两种溶液的密度和粘度不同,一种溶液可能比另一种溶液以更大的量流入导管,由此可能发生以下问题:
[0233]-化合物损耗;
[0234]-由于操作者必须用双手对注射器施加相当大的力而难以施用化合物;
[0235]-由于在输注期间操作者不能仅用一只手将所述导管保持在适当位置而使导管的端部移位,从而导致化合物的错误应用;这种移位需要操作者使用更大量的化合物,以确保其已经到达并覆盖整个靶体积。
[0236]
此外,两种化合物中任一种的流速降低会促进在发生混合以活化化合物的导管端部附近(即,在两种物质的出口附近)活化化合物,这导致所述导管的阻塞,因此导致操作者施加更大的力以克服两种溶液对输注的阻力。此外,操作者所需的力越大,就越难以将导管的端部部分保持在目标附近位置;这涉及需要进行导管的正确定位和可能需要的任何重新定位的连续超声或x射线监测。
[0237]
由于这些潜在的问题,并且直到现在,各种胶和基质仅在手术中使用。此外,由于使用双腔导管,经皮给药或腹腔镜检查期间存在很大的困难,所述双腔导管被设计和开发用于其他目的,并且不能将两种溶液同时输送到相关区域,导致化合物或药物的明显浪费和不良的治疗结果。
[0238]
因此,技术问题包括确保具有不同粘度和密度的两种溶液具有相同的流速,这意味着它们必须同时流入和流出导管的远端或出口。
[0239]
因此,用能够以所需比率将化合物输送到靶区域的装置递送载体基质和载有
90
y的微球的组合是有益的,并且同时优选地避免迄今为止在经皮图像引导治疗和腹腔镜和手术中治疗的情况下存在的所有缺点。
[0240]
在一个实例中,开发了用于输注双组分化合物的双腔导管,特别是用于含有凝血酶和纤维蛋白原的胶或试剂。导管包括用于第一成分的第一种溶液的第一管腔和用于第二组分的第二种溶液的第二管腔。根据导管横截面,所述管腔分别形成第一面积和第二面积,其中所述面积的比率与相应流体的粘度比率成正比。根据本发明的另一方面,优选地,所述面积的所述比率大于通过相应管腔的流体粘度的比率的平方根。
[0241]
特别地,优选所述面积的所述比率近似等于通过相应管腔的流体粘度的比率的平方。所述比率值考虑了另一方面,即粘度根据温度而变化。
[0242]
在一些实例中,管腔具有圆形横截面并且是同心的,并且第一管腔包含第二管腔,如图9a所示。在这种情况下,优选第一管腔的构造和尺寸设置成接收较高粘度的溶液,使得所述溶液在输注期间可能更多地暴露于由导管与患者组织接触引起的升温。
[0243]
因此,允许更好地利用来自外部的热量渗透的导管的变体要求两个管腔具有圆形横截面并且是同心的,并且要求较高粘度的溶液在外管腔中流动,因此外管腔具有比内管腔更大的横截面。
[0244]
上述导管在医学/临床领域中应用于微创经皮手术、外科手术、腹腔镜或介入式放射手术中,只要需要施用抗癌化合物。
[0245]
作为本发明的结果,可确保两种溶液具有相同的流速,并且因此同时沿着导管移动,即,以相等量离开导管,以便确保当在患者的靶组织附近输注时试剂的正确活化。作为优点,可以最小化输注时间和操作者在输注期间需要使用的工作量,并且还可以最小化注射的化合物的量。
[0246]
本发明的导管的特征被证明是非常令人惊讶的,因为本领域技术人员已经清楚地
应用了泊肃叶定律,泊肃叶定律指出,粘性且不可压缩的流体在具有恒定横截面的管道中以恒定速度的运动是层流的,即,由与管轴线同轴的无限数量的圆柱体的相对滑动组成。
[0247]
因此,分别位于管的入口和出口处的两个点之间的压力变化δp由下式给出:
[0248][0249]
其中l是管的长度,r是管的直径,qv是管中粘性流体的流速,η是流体的粘度。
[0250]
由于需要两种溶液沿着导管具有相同的流速和相同的压力变化,以便最小化操作者在双腔室注射器的主体上施加的努力,因此:
[0251]
或
[0252]
因此
[0253][0254]
其中,s1和s2分别表示管腔横截面面积。换句话说,通过应用泊肃叶定律,结果应该是两个管腔的横截面的比率与相应粘度的比率的平方根成比例。
[0255]
更确切地说,本发明规定了面积比率和横截面比率之间的优选比例,使用以下公式表示,其似乎与预测的所述物理定律相反:
[0256][0257]
事实上,当温度变化时,特别是当导管插入患者体内时,所述物理定律不能考虑形成止血剂的两种溶液的行为。事实上,在所述情况下,两种溶液的温度从大约18℃的环境温度变化到大约37℃的人体温度。
[0258]
可以进行上述公式的变化,以便考虑内腔相对于外腔的不同位置,例如腔的轴线重合(图9a)、不重合但平行(图9b),或者两个腔被弯曲或直的隔膜分开(分别为图9c和9d)。
[0259]
然而,在一些变通方案中,当管腔横截面的面积之间的比率略大于相应粘度的比率的平方根时,根据以下关系获得导管的性质:
[0260][0261]
一个实施方案具有16g的外径,相当于大约1.6mm的外径。此外,两个管腔是同心的,因此:
[0262]
第一管腔的直径为0.022英寸,即0.56mm
[0263]
第二管腔的直径为0.010英寸,即0.25mm
[0264]
因此,第二管腔的横截面积为π
×
0.1252=0.04906mm2,第一管腔的毛面积为π
×
0.282=0.24617mm2,而净面积为0.24617-0.04906=0.19711mm2。这意味着第一腔和第二腔的面积之间的比率约为4;因此,它适用于粘度比率约为4的平方根,即约为2的溶液。在外部,导管的其他实施例可以具有标准化的横截面,例如20g、18g、16g或14g。
[0265]
优选地,导管由在x射线和/或其他成像模式期间可见的不透射线材料制成。与其使用相容的长度为大约20cm,并且优选地所述材料使其为半刚性的,但是在其他示例中可以是柔性的或刚性的。优选地,它包括刚性连接器,该刚性连接器可以连接至用于注射双组分化合物的特殊注射器。在其他示例中,导管的轴长度可以在10cm至100cm、约20cm至70cm或30cm至60cm的范围内。它可以包括专用于两个部件的刚性y形连接器,具有作为标准连接器的鲁尔锁末端连接器。最后,优选的是,导管主体具有间隔设定距离的特定标记,例如间隔一厘米的距离,即对于导管的至少一部分分成厘米表示。
[0266]
该套件还可以包括与导管长度相同的导引器,例如20cm,并且其横截面与导管的可能横截面之一相容。在一些变型中,导管的远侧尖端可以与导引器的远侧尖端齐平。在其他示例中,导管尖端可以延伸出导引器的远端或与导引器的远端靠近但分隔开1mm至10mm、或1mm至5mm、或2mm至4mm。导引器也可以被分成厘米,即间隔开设定距离的标记,并由不透射线材料制成。此外,它可以具有可移除的钢芯,该钢芯具有比导引器稍长的尖锐尖端,例如210mm长,并可包括鲁尔锁连接器。导管主体的优选材料是elg6260(peba)。最后,导管以沿着轴线的正交切口结束。
[0267]
图10a为可以用于递送
90
y-基质组合物的另一示例性套件1000的照片,其包括导管1002、导引器1004、导引器芯(未示出)和针1006。为了执行该操作,使用超声、ct或mr成像引导来定位导引器1004及其芯。在移除导引器1004的芯之后,将针1006插入穿过导引器1004。可以通过针1006执行任何活检或其他消融术。在执行诊断和/或治疗操作之后,针1006被移除,并且导管1002被插入到导引器1004中,并且多室密封剂注射器(未示出)被连接到导管1002。然后,当组合的注射器和导管从组织通道中抽出时,沿着组织通道注射密封剂。
[0268]
针1006的远端1008具有尖锐的倾斜尖端,并且优选地在超声波上可见。例如,针的横截面可以是16g,即,相当于1.60mm的外径和1.20mm的内径,由aisi 304制成,其中尖端在超声上可见。针1006的近侧接头1010可以具有连接的鲁尔锁远侧连接器1012,例如包括透明abstr2812。针轴1014的优选长度为200mm,并且轴1014被配置为插入到导引器1004中。导引器1004可以包括grilamid l25轴,其具有任选的锥形远侧尖端。导引器1004的内径约为1.70mm,而导引器1004的长度应优选地略长于针1006,例如210mm,或者比针1006长1mm至20mm、5mm至10mm或5mm至15mm的长度。在其他示例中,导引器的内径可以在0.8mm至2.2mm、或1mm至2.2mm的范围内,或者以其他方式接受尺寸为12g至18g的导管或针轴。
[0269]
图10b分别为导管1002、导引器1004和针1006的近侧接头1016、1018、1010的特写照片,其中针1006插入导引器1004中,使得近侧针接头1010经由互补的鲁尔锁1012、1022结合到近侧导引器接头1018。导管1002的近侧接头1016包括两个端口1024、1026,其被构造成连接到双室注射器(未示出)的两个尖端。图10c和10d描绘了导管1002的纵向截面,其中公鲁尔锁连接器1028分别与导引器1004的母鲁尔锁连接器1022兼容。该构造允许针1006和导管1002在插入到导引器1004中时可释放地锁定在导引器1004。导引器1004可包括具有沿其
纵向长度可见的距离标记1032的轴1030,并且其中轴1030优选地是不透射线的,例如,装载有30%硫酸钡并插入保护性聚乙烯管中。导管1002和导引器1004还被描绘为具有任选的手柄1034、1036,以帮助在使用期间进行操作。
[0270]
在进行微创治疗之前,准备套件,使得首先插入导引器,其直径对应于根据待执行的手术选择的导管,并且将其置于超声引导、ct或mri扫描下。一旦移除导引器的芯,然后插入同轴双腔导管,并且根据需要施用化合物,以便填充治疗区域,并且如果需要,填充由导引器覆盖的距离,然后将其缓慢移除,以便沿着导引器的路线释放包括在内的化合物。这确保了有效的功能、易于施用、保护药物,并且避免了用于外部输送抗癌剂的额外侵入性手术。在不脱离范围的情况下,可以在其各种优选实施方案中组合上述元件和特征。
[0271]
实施例4:猪研究
[0272]
在另一项动物研究中,在超声引导下,对三个不同的肝段或肝叶注射生物胶-90
y微球,所述八只体重为75
±
5kg的大白雌性猪选自特殊农场,没有感染并预先免疫。对于这些操作,在左叶、右叶和右下副叶中使用24ml含有60/80mci的
90
y微球的戊二醛交联白蛋白兽医检查所有动物以评估其健康状态和不存在与任何疾病相关的症状,然后进行8小时的术前禁食、麻醉和血液取样。取自颈静脉的血液样品如下进行:a)手术前(t0),b)手术后,醒来前(t1),和c)外植肝脏前(t2)。在全身麻醉后,将所有猪分成四组,每组2只动物,在不同时间进行:正中剖腹术、术中超声识别约3.5cm2的消融区域、用抗癌化合物治疗3个不同的肝段、器官外植和安乐死:第一组在治疗后7天处死,第二组在14天后处死,第三组在21天后处死,第四组在28天后处死。然后将移植的肝脏用于宏观和微观评估。
[0273]
处理后,将所有猪转移到动物设施并每天监测;设施条件符合适用的现行法规,因为所有动物都可以自由漫游并“随意”进食。
[0274]
图11a至11f、12a至12f和13a至13f分别是7天后移植的三种不同猪肝的pet/spect图像。根据方案中指示的定时从猪采集的血液样品没有记录血液凝固参数的任何显著异常。下表中所示的外植肝脏的解剖学和病理学评估的结果表征了
90
y-基质组合物在不同注射后时间段的消融区域。
[0275]
75kg猪#1:
[0276]
试验#位置外长外宽内长内宽尺寸1左叶5.04.84.64.04.4x3.83右叶5.24.64.34.04.3x3.84右下叶5.44.45.04.64.7x4.2
[0277]
80kg猪#2:
[0278]
试验#位置外长外宽内长内宽尺寸1左叶第二位置4.05.04.54.24.3x4.03左叶4.04.04.14.24.0x4.13外侧右叶5.85.55.55.05.2x5.0
[0279]
85kg猪#3:
[0280]
试验#位置外长外宽内长内宽尺寸1右叶内侧4.54.24.94.54.7x4.5
2外侧右叶4.54.04.64.24.3x4.03左叶内侧5.04.94.35.04.1x4.7
[0281]
75kg猪#4:
[0282]
试验#位置外长外宽内长内宽尺寸1左叶内侧5.45.15.14.15.0x4.02右叶内侧6.05.25.54.95.3x4.83外侧右叶5.45.05.04.25.0x4.0
[0283]
85kg猪#5:
[0284]
试验#位置外长外宽内长内宽尺寸1左叶内侧5.54.55.24.25.0x4.02深右叶5.24.34.24.04.0x4.03外侧右叶6.05.05.14.25.0x4.0
[0285]
100kg猪#6:
[0286]
试验#位置外长外宽内长内宽尺寸1左叶内侧6.25.15.44.25.3x4.22右叶内侧5.54.15.04.04.8x4.03外侧右叶5.04.64.64.24.5x4.0
[0287]
90kg猪#7:
[0288][0289][0290]
80kg猪#8:
[0291]
试验#位置外长外宽内长内宽尺寸1右叶内侧5.24.55.04.55.0x4.52右叶内侧5.74.84.74.24.7x4.03外侧右叶5.05.04.54.54.5x4.3
[0292]
上述分析表明每个治疗部位和每个评估时间点的消融面积。正如在组织病理学方面评估的,分别在
90
y组合物注射后1、2、3和4周后,坏死平均值
±
sd面积(cm2)为18.8
±
3.7、20.5
±
2.8、19.2
±
2.1和20.5
±
2.0。
[0293]
进行了急性全身毒性试验、皮内反应性试验和延迟超敏反应,以验证对实验动物施用
90
y-基质组合物试验的安全性。在治疗动物中观察到的结果与对照组非常相似:在急性全身毒性试验中未检测到任何症状;皮内反应性试验未见红斑或轻微红斑,迟发性超敏试
验未见明显变化。
[0294]
此外,考虑到
90
y-基质组合物的部分不可吸收性质和
90
y衰减时间,在植入26周和52周后评估了皮下
90
y-基质组合物对雄性白化病大鼠的局部和全身影响。考虑到局部影响,所有植入部位经肉眼评估和尸检后均未发现异常。组织学评估用于计算治疗组和对照组的平均最终反应指数,在26周时分别为1.5和1.8(数值从0.0到2.9是指最小或无反应),在52周时分别为3.5和4.2(数值从3.0至8.9是指轻微反应)。
[0295]
就全身作用而言,与对照相比,当评估以下参数时:组织结构;细胞肥大;坏死;炎症人群;萎缩;水肿;充血;纤维化;和血管充血,
90
y-基质组合物不会导致显著的不同作用。
[0296]
在不同时间点从测试动物采集的血液样本没有记录任何显著的血液和肝脏参数异常;施用
90
y-基质组合物后对cbc血细胞计数未检测到放射性影响。
[0297]
根据上述结果,基于长度为3.7至5.3cm和宽度为4.0至5.0cm的消融尺寸,以及对器官和骨髓没有副作用,使用局部区域方法治疗肝脏病灶显然可能是有用的并且适合于人体治疗。
[0298]
实施例5:家兔研究
[0299]
在另一个动物研究中,瘤内注射
90
y负载的水凝胶基质用于治疗不可切除的原发性或继发性实体瘤和/或术中局部应用,以预防或延迟具有阳性边缘的切除后的局部复发并确认该程序的功效和安全性。在一项研究中,使用
90
y微球
‑‑
组合物治疗患有诱导的肾旁肿瘤的70只新西兰家兔。对于肿瘤植入手术,家兔接受剑腹剖腹手术。钝性解剖用于通过无血管白线暴露腹膜。仔细解剖腹膜,可以探查腹膜腔直至右肾房,在那里植入了一个vx2肿瘤(约5mm3)。虽然vx2肿瘤细胞起源于棉尾兔皮肤癌,但后来发现它可以移植到所有家兔品系中,用于研究多种实体瘤人类癌症,包括肺癌、膀胱癌、乳腺癌、肾癌和肝癌。
[0300]
允许肾旁肿瘤进展2周,并通过超声监测直到其质量达到直径约2厘米,通过重复肾超声检查,从肿瘤细胞植入后1周开始。在此期间结束时,通过第二次剖腹手术进行了右肾切除术。切除源自vx2植入物的肿瘤,留下小于1cm厚的原位残留肿块。区域用一个小的手术夹标记,以便在尸检时组织识别,当残留的肿瘤块完全去除时。在2周肿瘤植入物生长结束时和如上所述的部分肿瘤切除后,46只动物被随机分配到如下组之一,以评估每种治疗的安全性、有效性和生物分布:
[0301]
a)用1ml 90
y-基质组合物治疗22只家兔(a组):这些动物中的6只动物在1周后、8只在2周后和8只在3周后在全身麻醉下实施安乐死;
[0302]
b)将15只家兔分配给仅
90
y治疗(b组),其中185mbq 90
y微球(在1ml盐水溶液中)用于每次施用;这些动物中的5只在1周时且10只在2和3周时分别在全身麻醉下实施安乐死;
[0303]
c)9只家兔被分配到仅携带载体的定位治疗组(c组),其中使用了0.3ml牛血清白蛋白/戊二醛组合(在1ml盐水溶液中);这些动物中的3只在第1周时在全身麻醉下实施安乐死,在第2周和第3周时分别有6只实施安乐死。
[0304]
给肿瘤注射对其随机分配的组合物,并随时间推移进行监测。收获在治疗后1、2和3周后收集的所有动物的残余肿瘤病灶(用
90
y-基质组合物、仅
90
y或仅定位载体治疗),并进行宏观和显微镜检查。根据公式体积=1/2(长
×
宽2)计算移植瘤质量。在pet/ct扫描后用4%pfa溶液固定收集的标本(下文更详细描述),用低温恒温器切割(切成5-um厚),使用常规苏木精和伊红方法染色,最后由对原始治疗不知情的病理学家分析以确定靶向组织坏
死。为了评估a组和b组
90
y诱导的残余肿瘤坏死,在每个时间点处死的动物收集的蛋白质裂解物中,通过蛋白质印迹分析(wb)检测p53蛋白(坏死标志物)的表达;β-微管蛋白用作对照标记。基线时进行肝酶(alt、ast、ggt、碱性磷酸酶)、胆红素和全血细胞计数(cbc))检测;然后在动物被安乐死之前每7天进行一次血液检查,从麻醉动物的心脏中收集血液。
[0305]
如上所述,在手术后第1周和第3周,用
90
y-基质组合物和仅
90
y组合物治疗的动物在全身麻醉下处死并立即进行pet/ct成像。这些评估不仅检查了放射性物质在靶病灶内的扩散及其均匀分布,而且还检查了注射化合物在靶器官其他部位以及身体其他区域的可能扩散。事实上,在pet扫描之后,从动物身上取出选定的器官,进行彻底的
90
y生物分布分析。外植器官包括大脑、甲状腺、肌肉、气管、支气管、右肺、心脏壁、淋巴结、肝、胆囊、脾脏、小肠、结肠、胰腺、腹膜、右肾上腺、睾丸、左肾、右肾、膀胱、皮肤、骨骼和肿瘤病灶。对上述器官进行称重,并通过geiger-muller计数器检测每个器官的
90
y活性,以β发射吸收光谱中的每分钟计数(cpm)表示。
[0306]
数据包含在microsoft excel 14.1.0数据库中。graphpad prism 6用于平均值
±
sd示意图。描述性统计学用于基线变量,并使用非配对mann-whitney检验检查统计学显著性。如有说明,以百分比表示的变异系数计算为sd与平均值之比,结果乘以100。
[0307]
发现抗肿瘤作用与暴露于
90
y微球-组合物的时间成正比,其中治疗的肿瘤在第7天表现出10%的平均坏死率在第14天表现出30%的平均坏死率,以及在21天90%的平均坏死率。这项研究的结果表明,肾切除术和用
90
y-微球水凝胶混合物治疗后床的阳性切除边缘的组织学检查表明,21天后存活的vx2癌肿瘤细胞几乎完全坏死。
[0308]
图14a、14b和14c描绘肾切除术和用水凝胶基质和
90
y微球治疗后分别在7、14和21天后床的阳性切除边缘的组织学分析。图14a显示治疗后7天,坏死细胞百分比为70%,而图14b显示治疗14天后,坏死细胞百分比为90%,其中箭头表示坏死区域。
[0309]
相比之下,仅用水凝胶或
90
y-微球处理的动物的切除床中的组织显示出可触知的宏观肿瘤生长,并且组织学检查显示在7、14和21天后存在活的vx2癌细胞。图14d-14f描绘了分别在7天、14天和21天后在肾切除术和仅用
90
y微球治疗后肿瘤床的阳性切除边缘的组织学,并且图14g-14i描绘了分别在7天、14天和21天后在肾切除术和仅用水凝胶治疗后肿瘤床的阳性切除边缘的组织学。图14d-14f显示在仅
90
y微球注射后7、14和21天坏死细胞百分比为20%。在图14g-14i组织学载玻片中,在用水凝胶处理后5%坏死区域内可以看到活肿瘤细胞。在h&e染色后对收获的残留肿瘤进行的组织学评估中量化了坏死百分比。如图14j示意图中所示,
90
y-基质组合物和仅
90
y均比只使用基质的治疗组显著更有效(*=p《0.05;**=p《0.005;***=p《0.0005;***=p《0.0005,mann whitney检验),在每个时间点均诱导坏死。此外,三周后,用
90
y-基质组合物治疗的家兔表现出比任何其他治疗组更高的坏死率(***=p《0.0005.mann
–
whitney检验)。
[0310]
图15中描述的蛋白质印迹分析进一步显示p53蛋白表达增加,这是肿瘤坏死的标志物,尤其是在3周的观察点检测到,并且与研究组中通过组织学评估检测到的坏死增加一致。
[0311]
还在选定的时间点比较肿瘤体积,如图16所示。该比较用于评估每个治疗组减缓或削弱肿瘤生长的能力。两周后,
90
y-基质组合物和仅
90
y治疗组均比仅基质组更有效地抑制肿瘤生长(**=p《0.005;mann
–
whitney检验)。然而,更令人惊讶地,在三周后,用
90
y-基
质组合物治疗的家兔表现出的肿瘤体积抑制显著大于任何其他治疗组(*=p《0.05.mann
–
whitney检验)。并不预期
90
y-基质组合物疗法能优于仅
90
y疗法。
[0312]
在用
90
y-基质组合物和仅用
90
y(不含基质)治疗的家兔组织中
90
y的总水平包括如下:
[0313]
[0314][0315]
此外,由于应用了包含
90
y微球的水凝胶基质,本研究中描述的用于在切除床中施用组合物的系统代表了治疗实体瘤的多模式方法,其显然使用相同的活性水平实现了比单独的
90
y注射更高的计数。
[0316]
水凝胶基质(水凝胶)的粘度和密度允许水凝胶混合物在切除部位内直接注射或分层,确保均匀分布、
90
y辐射剂的局部浓度的增加、原位更长的保留以及
90
y球的低分散或无分散,从而潜在地限制全身副作用。
[0317]
通过本研究,当与单独注射
90
y球体的家兔的治疗相比时,在
90
y装载的基质中的高浓度
90
y水平在施用部位持续更长的时间期限,实现在我们的动物模型中产生的残留肿瘤细胞(阳性边缘)的完全破坏。
[0318]
这些结果表明,与单独施用
90
y微球相比,使用
90
y微球和水凝胶组合在延长的时间段内实现了高浓度的
90
y,并且还实现了均匀分布,从而治疗了动物模型中的肿瘤细胞,并且与单独接受
90
y的动物相比,潜在地降低了接受
90
y-基质治疗的动物中局部复发的相对风险。此外,与对照相比,在用
90
y-基质处理的动物中进行的评估显示血液中没有放射性水平,没有骨髓抑制,没有肾、心脏或肺毒性,并且没有与
90
y微球的扩散相关的肠穿孔或出血,这与在单独接受
90
y的动物中观察到的发现相反。
[0319]
在一个初始评估中,在目标位置向三只家兔注射
90
y微球,并使用β计数器定量
90
y在整个身体中的分布。图17a示例了在每只家兔的目标位置处几乎没有活性,并且在每个器官位置处检测到一些活性,但是在至少一些动物的脾、小肠、腹膜和肾上腺处具有大量活性。相反,对于在相同的位置注射
90
y-基质的家兔,如图17b中所示,仅在目标位置处检测到活性,在任何其他器官位置处检测到可忽略的活性或未检测到活性。
[0320]
在对研究中登记的家兔的进一步分析中,在仅
90
y组和
90
y-基质组中,在7天和14天评估了
90
y在选定器官中的分布,如图17c-17f中所示。如图17c中所示,在7天时,在另外的仅
90
y家兔的肿瘤部位检测到显著活性,而且在一只家兔的支气管和胰腺中也检测到显著活性,并且在其他部位例如淋巴结、肝、胆囊、小肠、结肠、腹膜和膀胱可检测到活性。相反,
90
y-基质家兔在7天时在肿瘤部位检测到的活性显著升高,而在其他选定的部位检测到的活性很小或几乎没有检测到,如图17d中所示。在14天时,
90
y-基质家兔肿瘤部位具有较低但仍然显著的活性,且在其他肿瘤部位有仍然很小的或没有可检测到的活性(图17f),而仅
90
y的家兔在14天时在肿瘤部位的活性显著降低,但
90
y进一步重新分布到其他器官部位,即使是那些在7天时没有可检测到活性的部位(图17e),包括脑、甲状腺、肌肉、气管、右肺、脾、右肾上腺、睾丸、右肾皮肤和骨骼。该数据启示,
90
y-基质不仅在肿瘤部位达到更高的治疗水平,而且也能抵抗可能在7至14天之间发生的延迟生物分布至脱靶器官。
[0321]
通过pet/ct成像在第1周和第3周时间点分析肿瘤区域中的放射性同位素存在。
90
y活性在注射区域以及其他解剖区域由geiger-muller计数器评估,在1周和3周时间点,
90
y辐射强度的结果显示在
90
y-基质组合物治疗的家兔的肿瘤注射部位可再现和升高的水平(p《0.05,mann-whitney检验),分别如图24a和24b中所示。当在预先指定的远端器官中进行时,
同样的分析显示在1周和3周的时间点,与仅
90
y治疗的家兔相比,
90
y基质组合物治疗的家兔的信号要低得多,几乎无法检测到(图24a和24b,p《0.05,mann-whitney检验)。基于在远处非靶器官(非肿瘤)中检测到的总信号量,
90
y-基质组合物疗法显示在所有评价时间点在肿瘤注射部位保留
90
y信号方面非常有效(图25a和25b,p《0.005,mann-whitney检验)。正如预期的,
90
y-基质组合物疗法在3周时的肿瘤注射部位的信号远低于化合物注射1周后的相同信号。仅游离的
90
y治疗远不能同样有效地保留目标注射中的
90
y活性。比较肿瘤与非肿瘤目标区活性水平的变异系数(cov)证实,与仅
90
y治疗相比,在两个时间点检测到的
90
y-基质组合物疗法的变异性要低得多(即重复性更高)。在
90
y-基质组合物治疗组中,在1周时,肿瘤部位cov为5.69%,非肿瘤部位为14.33%,3周时,肿瘤部位cov为1.89%,非肿瘤部位为29.56%。在仅90y治疗组中,在1周时,肿瘤部位cov为136%,非肿瘤部位为156.18%,3周时,肿瘤部位cov为199.87%,非肿瘤部位为175.38%。
[0322]
这些结果启示,
90
y-基质组合物疗法不仅能通过局限部化放射治疗效果和通过分流局部减少和最小化它们的逃逸来显著降低副作用或严重不良反应的发生率,而且当与通过相同途径或通过经动脉放射栓塞术用仅接受
90
y-基质组合物治疗的患者相比时,可能会增加接受
90
y-基质组合物治疗的患者的无病进展的持续时间和/或生存率。此外,在人类患者治疗中,如果患者需要在
90
y放疗前进行广泛的预处理工作流程和评估,则
90
y-基质组合物疗法可以可靠地降低与肝肺分流或其他脱靶分流相关的风险相,使得其不需要,或者是不进行所有预处理工作流程。例如,在某些另外的变通方案中,可以提供
90
y-基质组合物疗法而不需要进行治疗前成像,例如锝-99扫描,以评估任何分流到肺或其他脱靶位置的情况,例如与静脉曲张或动静脉畸形相关的情况。这归因于通过分流减少或最小化
90
y泄漏,通过定位载体实现。反过来,因为不需要用于评估分流的预处理成像,所以也不需要用于治疗潜在分流的预处理操作。这可能会将治疗时间缩短1、2、3、4、5、6或7天或更长时间,因为治疗不会因治疗前分流成像、治疗前减少分流操作和治疗前重新扫描以评估减少分流操作的有效性而延迟。不再需要或不再进行的分流手术可能包括动脉栓塞、肝静脉球囊阻塞以及静脉曲张和avm闭塞手术。因为不再需要考虑分流的给药剂量调整,所以也可以简化给药剂量计算,例如不再需要基于分流比例和/或肺给药剂量限制的调整。具有大量肝、肺或肝肺分流比例的患者也不再需要被排除在疗法之外。肿瘤治疗方案的这些特征中的一个或多个可以包括在本文所述的各种治疗中。
[0323]
实施例6:乳腺癌
[0324]
随着放射学检测到的非常小的亚临床病灶的发生率增加,几个小组在20世纪90年代开始考虑大多数dcis诊断为可能的“惰性疾病”,并声称单独的肿块切除术可以是呈现小尺寸单灶性dcis的患者的治疗选择。直到几年前,在5周内以25个分次向整个乳房施用50gy被认为是标准的,因为当时重要的英国和加拿大随机研究的长期结果的公布证明了在较短时间内施用的方案(低分次放射治疗)的有效性和效率。dcis通常不可触知;筛查乳房摄影的广泛使用允许诊断越来越多的dcis患者,其现在占所有乳房摄影检测到的乳腺癌的20-30%。
[0325]
在有或没有辅助疗法的情况下,在2/3以上的病例中,诊断患有dcis的女性用保乳手术(bcs)治疗。对于dcis通过bcs手术的女性,同侧复发率为每年1-3%,对于仅通过手术治疗的女性,长期局部复发率可高于35%,并且如果在手术中添加外部射线束,则低得多
(10年时为15%)。若干因素与bcs后局部复发的风险增加相关,其中最强的因素是dcis是否已被完全切除:
[0326]
1.远离癌症或距离癌症超过1mm的边缘具有低得多的风险。如果边缘与癌症不清楚,则患者应进行新的手术以实现根治性治疗;这可能发生在约20%的患者中。
[0327]
2.术中放射治疗(iort),其中术后全乳腺照射被手术切除后剂量为16-20gy的一个疗程的放射治疗所替代,允许在同一天完成治疗。
[0328]
3.最近的试验,例如用于早期乳腺癌的电子术中放射治疗相比外部射束放射治疗(eliot试验)和用于乳腺癌的靶向术中放射治疗相比全乳腺放射治疗(targit-a试验)已经证明,在选定的低风险早期乳腺癌患者组中,iort在局部疾病控制方面产生可接受的结果,因此可以用作常规wbrt的替代方案,代表了用外部射束放射治疗来治疗所有患者与根本不治疗患者之间的良好折衷。
[0329]
在美国放射肿瘤学会(astro)于2017年发表的关于加速部分乳房照射的共识声明中,提供了一些关于“合适的”低风险dcis患者的选择标准的建议。根据15多年来基于经动脉输注
90
y涂覆的微球的治疗积累的临床经验,可以合理地假设在切除的乳腺的手术床中施用适当活性的
90
y应该克服wbrt和iort的一些限制,并大大降低在绝大多数病例中在手术床中发生的局部复发的机会。根据文献中可获得的数据,20gy(≥18gy)的目标剂量被认为足以有效地消融切除的dcis病灶的手术床周围的组织。
[0330]
在一个实例中,进行了关于使用
90
y-基质组合物的临床研究。
90
y-基质组合物包括与装载有钇-90的球的组合。在该研究中,将预装载有90y的微球与手术胶混合,用于在切除乳腺dcis后对手术边缘进行放射性消融。该研究是一项多中心、非劣效性、上市前、首次在人中的试点研究,针对具有经活检证实的乳腺dcis、有资格接受保乳手术的患者。本研究的主要目的是评估按计划到达dcis切除的手术床的能力,并递送预定的剂量而没有治疗限制的临床并发症。或者,主要目的可以是评估
90
y-基质组合物在递送20gy(≥18gy)的吸收剂量用于dcis切除后手术边缘的放射性消融手术中的性能。本研究的次要目的是通过成像程序(pet-ct和dw-mri)评估
90
y-基质组合物的性能,评估局部和全身毒性,以及评估招募患者的生活质量。在dcis切除后用
90
y-基质组合物放射性消融手术边缘后,受试者将随访1至3个月。然而,在磁共振-扩散加权成像或乳房x线照相检查后,将认为每个受试者的研究结束。每个患者的总研究持续时间为15周,招募期为6个月。该研究的主要终点将是按计划到达dcis切除的手术床并递送预定剂量而没有治疗限制性临床并发症的能力。次要终点将是(1)在手术切除含有病灶的区段后,通过使用90y-胶基质组合物消融的手术边缘组织的体积/程度,如在手术后2-6小时和手术后24小时通过pet-ct(正电子发射断层扫描-计算机断层扫描)以及通过乳房x线照相术或(如果可用)磁共振-扩散加权成像(mri-dw,第30天)测量的;(2)手术的安全性,其通过生命体征、实验室测试、任何不良事件的类型和严重程度和/或与手术切除后的放射消融手术相关的装置缺陷或可用性确定;和(3)通过eortc qlq-c30和br23问卷测量的登记患者的生活质量。
[0331]
将招募10至20名受试者的样本量。在进一步的实施方案中,20名受试者的样本量可以实现使用单侧(α=0.025)一个样品测试检测非劣效性主要终点的80%功效。因为该fih研究探索了
90
y-基质组合物的性能和安全性,所以通过观察类似研究的结果,已经认为由
90
y-基质组合物局部递送的20gy的效果是合理的。18gy的非劣效性边缘已被评估为临床
上显著的,并且标准偏差已被假定为3gy。使用sas版本9.4进行样本量估计。
[0332]
研究的纳入标准为:
[0333]-女性,年龄≥50;
[0334]-根据最新的astro指南,具有活检证实的乳腺dcis、有资格接受bcs并且“适合”部分乳腺照射(年龄≥50;低至中等核分级;切除后边缘阴性≥3mm;tis;大小≤25mm)的受试者。
[0335]-如果治疗医师认为合适,则受试者可以经历随后的外部射束放射疗法(ebrt);
[0336]-具有乳腺摄影或对比增强磁共振成像证据的dcis的受试者;
[0337]-具有局部dcis(≥3mm且≤25mm)的受试者,其具有可经皮消融的位置;
[0338]-腋窝淋巴结临床阴性,且无启示浸润性乳腺癌的临床表现。
[0339]
研究的排除标准为:
[0340]-女性,年龄≥50;
[0341]-组织型与癌不同;
[0342]-佩吉特癌;
[0343]-位于腋窝区域或皮肤区域附近的病灶(≤15mm);
[0344]-存在延伸超过30mm的微钙化;
[0345]-妊娠或母乳喂养正在进行;
[0346]-瘤形成的阳性病史(排除一部分原位癌或手术切除的皮肤癌和对侧乳腺癌,在过去15年中没有任何疾病进展迹象)。
[0347]
每个受试者将进行成像并对dcis病灶进行诊断和分期,如下:
[0348]-切除靶病灶后的手术床将使用实验装置用放射消融进行治疗;
[0349]-在dcis切除后,将20gy(≥18gy)的适当吸收剂量施用于手术床以实现消融;
[0350]-在手术程序后7天内,患者将返回现场以评估
90
y-基质组合物在手术床上的施用效果的体积,以及其美容和毒性评估;
[0351]-30(
±
5)天后,将使用磁共振扩散加权成像或乳房x线照相术评估用放射消融治疗的手术床,以便评估消融组织的程度。
[0352]
任选地,对于前五名患者,将进行另外的患者评估和临床清除。临床清除将包括验证随访数据至少1周(如果没有发生并发症)或4周(如果发生并发症)。这将包括验证与患者的计划外接触(如果执行的话)。
[0353]
一旦确认了dcis的诊断并且符合纳入/排除标准,则根据正常临床实践,受试者将参加研究并在其预定手术前一天进入医院。在手术当天,通过需要外科医生和核医学专家之间协作的程序,受试者将经历dcis切除加上用
90
y-基质组合物的手术床消融。一旦进行治疗,受试者将返回外科病房并在手术/消融操作后的第二天出院。受试者将在手术后7、30和90天随访以评估其局部和一般状况;在随访结束时,如果治疗医师认为合适,他们可以进行随后的外部射束放射治疗。
[0354]
受试者将被告知研究的目的、程序和可能的风险,并将被要求签署知情同意书。每个筛选的受试者将通过进行性筛选编号来确认。受试者将仅在任何其他研究程序之前签署知情同意书之后登记。将检查研究中心跟踪的所有患者对纳入和排除标准的遵守。将收集以下信息中的一个或多个,但是不需要在相同的示例性时间表上收集信息的收集:
[0355][0356]
[0357]
如果满足所有进入标准,则将在筛选后1周通过使用90y-基质组合物来计划患者进行消融程序。在整个研究持续时间期间,从知情同意签字日期起,对每个患者进行任何不良事件或不良反应的随访。在每次研究访问时收集血液样品用于以下血液学和生物化学测定:
[0358]-具有分类的全血细胞计数
[0359]-蛋白质电泳图谱
[0360]-aptt
[0361]-inr
[0362]-纤维蛋白原
[0363]-血糖
[0364]-血尿素氮(bun)
[0365]-肌酸酐
[0366]-ast、alt、总胆红素和分级胆红素、ggt、ldh、碱性磷酸酶
[0367]-血清离子:钠、钙、钾、氯离子
[0368]-肿瘤标志物(afp)
[0369]
在v0时递送90y-基质组合物后1、3、6和12小时进行血液取样以检测早期血液病症:
[0370]-全血细胞计数伴差异
[0371]-ast、alt、总胆红素和分级胆红素、ggt、ldh、碱性磷酸酶
[0372]
研究受试者的所有数据将视情况使用描述性统计学呈现为平均值、标准偏差、中值、最小值、最大值或频率表。对于主要终点,将估计显著性水平为5%的置信区间(ci),并将ci的下限与非劣效性裕度进行比较以测试非劣效性。次要终点涉及评估生活质量(如通过eortc qlq-c30和br23问卷测量)、评估消融的手术边缘组织的体积/程度(如通过pet-ct和通过乳房x线照相术或磁共振-扩散加权成像测量)以及证明
90
y-基质组合物的安全性特征。将通过描述性统计学评估生活质量问卷的评分、手术切缘组织消融的体积/程度及其随时间的变化。关于与
90
y-基质组合物的关系,还将计算所有患者的不良事件的发生率以及它们的严重性和严重性。安全性评估将包括所有不良事件的记录和制表,以及分析生命体征和实验室参数的变化。将为安全性变量提供描述性统计学。
[0373]
对于一个示例性方法,将基于在操作前后处理中确定的肿瘤的尺寸或总体积来选择注射器的尺寸,2ml或5ml。
90
y-基质组合物在操作前的设置期间制备如下:
[0374]
1.拆开微球,将装运瓶留在铅罐中。
[0375]
2.如果有的话,将其置于工作台顶部的铅或丙烯酸屏蔽盒中。
[0376]
3.从铅罐中取出微球运输小瓶并剧烈摇动以分散微球。
[0377]
4.使用剂量校准器,例如伽马相机,以确定运输小瓶中的活性并将其返回到铅罐。
[0378]
5.测定要抽出的体积以提供所需的患者辐射剂量。下表显示了待插入2ml或5ml注射器中的的活性值,这取决于肿瘤床的半径。为了计算活性,考虑含有3gbq/5ml剂量的的小瓶。此外,已经认为在对患者的
spheres微球运输小瓶的隔膜,并快速来回抽吸数次以便彻底混合sir-spheres微球。
[0385]
9.快速抽出预先计算的患者辐射剂量并转移到注射器的两个室中,如以下第10-13点所述。
[0386]
10.拆下装有胶成分的双室射器盖。
[0387]
11.按照4:1的比例(bsa室中80%,戊二醛室中20%),将微球分布在胶的双室注射器中,如前表所报道的。
[0388]
12.将盖重新插入注射器上。
[0389]
13.通过用剂量校准器重新测量运输小瓶中的活性来验证患者剂量,并在必要时进行校正。
[0390]
14.将注射器放置在适于运输到手术室/放射手术室中的辐射防护容器中。
[0391]
15.在手术室/放射学手术室,从辐射防护容器中取出准备好的具有
90
y的注射器/注射器系统。
[0392]
16.打开含有混合尖端的无菌包装。
[0393]
17.保持注射器直立,并轻敲注射器,直到液体中的任何气泡上升到注射器的顶部。
[0394]
18.连接装在胶包装中的无菌混合尖端涂抹器。
[0395]
19.短暂摇动注射器。
[0396]
20.推动注射器的活塞将化合物施用到手术腔中。
[0397]
21.等待化合物聚合(例如等待几秒钟)。
[0398]
22.进而缝合该区域。
[0399]
待注射的实际量将由执行放射消融程序的核医学专家决定,这取决于待消融的手术切除区域(瘤床)的大小和他/她的临床判断。
[0400]
对于消融术,患者将根据治疗设施的标准程序进行消融术的准备。患者将以通常的无菌方式准备和覆盖,并且将实现麻醉。目标区域将由外科医生在术中识别,也使用适当的标记物/墨水。
[0401]
对于剂量测定评估,假设放射性示踪剂泄漏可忽略/不存在,将采集乳房区域的两次pet/ct扫描,第一次在注射后(p.i.)2/6小时之间,第二次在注射后(p.i.)24小时。这两个扫描将使我们能够根据临床前数据确认时间-活性曲线遵循物理衰减。通过使用mird形式(olinda/exm软件)进行剂量计算。特别地,对于病灶剂量,将使用olinda/exm中可用的单位密度球体模型,假设盘状形态和均匀分布。
[0402]
为了确认放射性示踪剂生物分布,患者将经历通过spect/ct装置采集的一次全身扫描:采集在注射后16-24小时进行。该信息可用于确认放射性示踪剂保持被限制在肿瘤床中。
[0403]
出院后,患者将随访90天。在消融后评估(v3)后,将认为每个受试者的研究结束;然而,在随访期间,将收集关于可能与放射消融程序相关并包括在临床研究表格中的任何不良事件的信息。
[0404]
不良事件将根据已建立的分类系统进行分类,例如不良事件的通用术语标准v5.0。
[0405]
在操作结束时,必须按照机构的用于处理生物危险和/或放射性材料的标准操作
程序处理针头、注射器和任何其他部件。
[0406]
在乳腺癌治疗方法的一些另外的变通方案中,可以提供
90
y-基质组合物疗法,而不需要预处理成像,例如锝-99扫描,以评估是否有任何分流到肝或肺或其他脱靶位置,包括静脉曲张和avm。在一些变通方案中,因为不需要预处理成像来评估分流,所以也不需要治疗潜在分流的预处理程序。这可能会导致治疗时间缩短1、2、3、4、5、6或7天或更长时间,因为治疗不会因治疗前分流成像、治疗前减少分流操作和治疗前重新扫描以评估减少分流操作的有效性而延迟。不再需要或不再进行的分流手术可能包括动脉栓塞、肝静脉气囊阻塞以及静脉曲张和avm闭塞手术。因为不再需要考虑分流的给药剂量调整,所以也可以简化给药剂量计算,例如不再需要基于分流比例和/或肺剂量限制的调整。具有大量肝、肺或肝肺分流比例的患者也不再需要被排除在疗法之外。
[0407]
实施例7:乳腺癌
[0408]
在另一个示例性研究设计或治疗方案中,患者选择、监测和随访如上文实施例6所公开,但手术、套件和/或给药可以不同。在本实施例中,产品包括手术胶(其本身是牛血清白蛋白和戊二醛以4:1比率的组合)和覆盖有β发射90y同位素的微球的组合。套件还可以包括一个或多个注射器屏蔽装置,以保护使用者免受无意的放射性暴露。
[0409]
该套件可用于在保乳手术后消除手术边缘,并且在对牛来源的材料或其他胶组分具有已知敏感性的患者中是禁忌的。利用2ml注射器以及以在肿瘤床处实现20gy或≥18gy剂量的给药方案的一个实例为:
[0410][0411]
在一些另外的实施方案中,可以基于标称衰减小时周期(每x小时x:00至x:59)和肿瘤大小如下调节装载到
90
y基质注射器中的
90
y微球溶液的体积:
[0412]
瘤床半径:20mm-24mm
[0413][0414][0415]
瘤床半径:25mm-29mm
[0416][0417]
瘤床半径:30mm-34mm
[0418][0419]
瘤床半径:35mm-39mm
[0420]
[0421][0422]
瘤床半径:40mm-44mm
[0423]
[0424][0425]
瘤床半径:45mm-49mm
[0426][0427]
瘤床半径:50mm-54mm
[0428][0429]
可以使用的套件包括:
[0430]-两个带鲁尔锁的注射器(1ml.),无菌提供
[0431]-两个无菌22g针,无菌提供
[0432]-两个无菌针头(例如20g x 70mm),例如b.braun的针头
[0433]-两个防辐射注射器支架,例如聚甲基丙烯酸甲酯(pmma)圆柱体:
[0434]
·
一个圆筒,用于2ml胶注射器(圆筒a”)
[0435]
·
一个圆筒,用于1ml注射器(圆筒b”)
[0436]-1个不由betaglue提供的无菌辐射防护盒(用于手术室中运输);
[0437]
套件可以任选地包含以下成分,但是在其他实例中这些成分可以单独提供:
[0438]-一小瓶
90
y微球,例如含有在5ml注射用水(wfi)中的3gbq+/-10%,装在铅罐中
[0439]-一个装在带盖双腔注射器(2ml.)中的双成分胶注射器,例如2ml
注射器,以盒子和/或其他包装形式提供
[0440]
此外,对于上述套件,医疗保健提供者或被许可或授权提供放疗的场所也将可获得并将在手术期间使用:
[0441]-用于运输
90
y微球小瓶的无菌辐射防护盒或容器
[0442]-防辐射废物容器
[0443]-用于处理
90
y微球小瓶的镊子或钳子
[0444]-测量放射性的剂量校准器,如γ相机
[0445]-酒精垫
[0446]
为了初步准备放射治疗以供使用:
[0447]
1.打开装有胶注射器包装的盒子
[0448]
2.以无菌方式打开装有胶注射器的包装
[0449]
3.取下胶注射器的盖子
[0450]
4.将胶注射器放入其pmma圆筒(圆筒“a”)中
[0451]
5.打开含有
90
y微球小瓶的铅罐,并使用镊子从罐中取出小瓶
[0452]
6.使用剂量校准器测量
90
y微球小瓶的放射性并确认放射性(测量应报告3gbq+/-10%)
[0453]
7.将小瓶放回铅罐中
[0454]
8.从小瓶周围部分地去除任何保护材料并用酒精垫清洁小瓶
[0455]
9.将一个20g针放入小瓶中以到达90y微球,并将一个22g针插入小瓶中进行通风。
[0456]
10.将1ml注射器放入其pmma圆筒(圆筒“b”)中
[0457]
11.以循环运动摇动铅罐至少10秒。
[0458]
12.将1ml注射器连接至20g针头,根据下文报告的量将用于戊二醛腔的
90
y微球的量抽吸出来,用于2ml胶注射器。
[0459]
13.将
90
y微球注射到胶注射器的戊二醛成分室中,并将空的1ml注射器置于辐射防护的废物箱中,而不处置含有1ml注射器的pmma圆筒(圆筒“b”)。
[0460]
14.将第二个1ml注射器放入pmma圆筒(圆筒“b”)中并连接第二个20g
×
70mm针头
[0461]
15.以循环运动搅动或摇动铅罐至少10秒
[0462]
16.用1ml注射器,根据上表中报告的量(对于2ml的双成分胶注射器),抽取用于双成分胶注射器的牛血清白蛋白(bsa)室的90y微球的量。针对任何90y衰减进行调整
[0463]
17.将
90
y微球注射到双成分胶注射器的bsa组分室中,并用20g
×
70mm针头将空的1ml注射器置于放射性防护废物容器中。不要处理圆筒护罩。
[0464]
18.将混合尖端连接至双成分胶注射器,现在在bsa成分室中包含预装载的胶和
90
y微球
[0465]
19.使用剂量校准器,使用γ相机测量
90
y-基质注射器的放射性,并将注射器放置在放射性保护盒中。
90
y-基质注射器现在准备好运输到手术室或操作室。
[0466]
待注射的实际量将由执行放射消融程序的核医学专家决定,并且可以取决于待消融的手术切除区域(瘤床)的大小和临床判断。在递送治疗之前,系统可以进一步组装有如下所述的示例性混合尖端:
[0467]
1.从辐射防护盒中取出装有准备好的
90
y-基质注射器的辐射防护pmma圆筒,在整
个分配过程中保持pmma圆筒中的注射器直立,以保持注射器上部的任何气泡
[0468]
2.打开包含混合尖端的无菌包装,并从包装中取出混合尖端,检查混合尖端套环以确保套环上的指针位于两个连接开口中最大的连接开口的正上方。如果轴环的指针不在最大开口处,则旋转尖端主体上的锁定轴环,直到指针在最大连接开口上方。
[0469]
3.当注射器尖端处于直立位置时,移除盖子。将混合尖端对准并连接至注射器
[0470]
4.通过将所述混合末端牢固地推到所述注射器上并旋转所述混合末端锁定套环来锁定所述混合末端。
[0471]
5.保持注射器直立,将双柱塞头与相应的大注射器和小注射器对准。将柱塞插入并推入注射器的后部,直到遇到阻力,然后任选地重新盖上注射器。
[0472]
一旦组装了
90
y-基质注射器,则可以通过以下示例性方法施用90y放射疗法:
[0473]
1.搅拌
90
y-基质注射器至少5秒,同时
90
y-基质注射器保持插入其pmma圆筒中
[0474]
2.如果需要,从
90
y-基质注射器上取下盖子
[0475]
3.推动柱塞以去除任何气泡
[0476]
4.通过推动柱塞将
90
y-基质立即施加到手术腔
[0477]
5.通过等待预定量的时间(例如60、90或120秒)或通过经由成像模式(例如荧光透视、ct、超声或内窥镜检查)观察
90
y-基质中的相变来确认
90
y-基质已聚合。
[0478]
6.通过缝合、钉合或胶合来闭合手术部位
[0479]
7.将
90
y-基质注射器放入辐射防护容器中并将其丢弃,无论是否有pmma圆筒
[0480]
在乳腺癌治疗方法的一些另外的变通方案中,可以提供
90
y-基质组合物疗法,而不需要预处理成像,例如锝-99扫描,以评估是否有任何分流到肝或肺或其他脱靶位置,包括静脉曲张和avm。在一些变通方案中,因为不需要预处理成像来评估分流,所以也不需要治疗潜在分流的预处理操作。这可能会导致治疗时间缩短1、2、3、4、5、6或7天或更长时间,因为治疗不会因治疗前分流成像、治疗前减少分流操作和治疗前重新扫描以评估减少分流操作的有效性而延迟。不再需要或不再进行的分流手术可能包括动脉栓塞、肝静脉气囊阻塞以及静脉曲张和avm闭塞手术。因为不再需要考虑分流的给药剂量调整,所以也可以简化给药剂量计算,例如不再需要基于分流比例和/或肺剂量限制的调整。具有大量肝、肺或肝肺分流比例的患者也不再需要被排除在疗法之外。
[0481]
实施例8:肝细胞癌
[0482]
在另一项研究中,将预装载
90
y的微球与手术胶基质混合,用于原发性肝脏病灶的放射消融,然后切除它们。然而,在研究的其他变通方案中,切除不一定在递送放射性同位素颗粒之后进行。用
90
y-基质组合物经皮消融肝脏病灶可能是更有效的疗法,使局部或全身副作用最小化。这种新颖的局部区域方法的应用显然适合于基于以下的人体治疗:
[0483]-在有或没有超声引导的情况下,施用时间在2-5min的范围内;
[0484]-烧蚀尺寸,长度在3.8至5.3cm之间,宽度在4.0至5.0cm之间;以及
[0485]-没有全身副作用。
[0486]
选择用于研究的受试者将是可消融的(即,适合经皮消融)和可切除的(即,由肝脏外科医生判断),如纳入标准中所示。他们将在通常预期的时间范围内(诊断/分期后35-40天)被提供用于早期肝细胞癌(hcc)的手术切除,但是通过参加研究,他们还将在诊断后5-10天被提供经皮β-消融其病灶的微创手术,然后在约30天后进行肝脏手术,此时
90
y的所有
mri)或腹部计算机断层扫描,以便诊断和分期hcc病灶;
[0505]-将使用实验装置用放射消融治疗病灶之一(认为符合经皮消融和肿瘤内施用
90
y-基质组合物的标准);
[0506]-在消融操作之后24-48小时将通过pet评估预定剂量的
90
y-基质组合物的适当且有效的递送;
[0507]-在消融手术后21天通过dw-mri评估治疗的病灶的坏死程度;
[0508]-dw-mri后7-9天,手术切除整个肿瘤块;
[0509]-根据方案中描述的操作,切除的病灶(用放射消融预处理)将被送去进行组织学检查;以及
[0510]-随访将在手术后2个月进行。
[0511]
收集的数据将通过描述性统计学进行汇总。连续变量将呈现为病例数、平均值和标准偏差、具有四分位数范围的中值、最小值和最大值。分类变量将使用受试者计数和百分比来总结。对于主要终点,将估计平均递送剂量和显著性水平为5%的标准偏差的置信区间(ci)。次要终点将通过描述性统计学和95%置信区间来总结。手术样本将由病理学家处理以评估手术切缘,并且将观察由于坏死引起的总体变化。安全性评估将包括记录使用不良事件的常用术语标准v5.0分类的所有不良事件(ae),以及生命体征和实验室参数的变化。
[0512]
每个受试者将被告知研究的目的、程序和可能的风险,并将被要求签署知情同意书。每个筛选的受试者将通过进行性筛选编号来确认。受试者将仅在任何研究程序之前签署知情同意书之后登记。将检查在研究中心监测的所有患者对研究纳入和排除标准的遵守。
[0513]
将收集以下信息:
[0514]-人口统计数据
[0515]-身高和体重
[0516]-生命体征(如血压(bp)、心率(hr)、呼吸频率(rr))
[0517]-ecg
[0518]-一般和体格检查
[0519]-内科和外科病史
[0520]-酒精消费检查
[0521]-尿液分析,包括本周蛋白
[0522]-育龄妇女妊娠尿试验
[0523]-伴随药物/治疗
[0524]-使用对比增强超声加组织学(如果适用)的肿瘤评估
[0525]-使用磁共振成像(mri)或计算机断层扫描(ct)进行肝脏成像
[0526]-使用pet扫描进行肿瘤成像
[0527]-除了mrecist标准之外,还将使用tnm分类和巴塞罗那临床分期算法对肿瘤进行分期
[0528]-向患者给予生活质量问卷(eortc-qlq c-30)和hcc18
[0529]
在出现任何不良事件的情况下,将指示患者立即联系研究团队,所述不良事件可能出现在初始筛选与消融程序当天之间的时间范围内。在用
90
y-基质组合物治疗当天,每位
患者将经历手术前审查,其将包括:
[0530]-生命体征(如bp;hr;rr)
[0531]-一般体检
[0532]-肿瘤评估
[0533]-pet成像(消融后24-48小时内)
[0534]-放射量测定评估
[0535]-伴随药物
[0536]-不良事件检查
[0537]-注射
90
y-基质组合物的麻醉
[0538]-对比增强的超声检查
[0539]-通过使用
90
y-基质的消融
[0540]
如果满足所有进入标准并且患者已经签署知情同意书,则他们将在这些筛选测试后七天安排使用
90
y-基质组合物进行β-消融术。在整个研究持续时间期间,从知情同意签字日期起,对每个患者进行任何不良事件或不良反应的随访。将收集血液样品用于以下测定:
[0541]-全血细胞计数伴分类
[0542]-蛋白质电泳图谱
[0543]-活化部分凝血活酶时间(aptt)
[0544]-国际标准化比率(inr)
[0545]-纤维蛋白原
[0546]-血糖
[0547]-血尿素氮(bun)
[0548]-肌酸酐
[0549]-血清谷草转氨酶(ast/sgot)、丙氨酸转氨酶(alt/sgpt)、总胆红素和分级胆红素、γ谷氨酰转移酶(ggt)、乳酸脱氢酶(ldh)、碱性磷酸酶(alp)
[0550]-血清离子:钠、钙、钾、氯离子
[0551]-肿瘤标志物(α-甲胎蛋白,afp)
[0552]
在执行消融术之前进行操作前检查,如下:
[0553]-遵守纳入和排除标准
[0554]-生命体征(bp;hr;rr)
[0555]-一般体检
[0556]-伴随药物/治疗
[0557]
90
y-基质套件包括如本文其他地方所述的放射性同位素源和基质源,例如来自sirtex medical(公司)的
90
y微球和来自cryolife的此外,套件包括双腔导管,其被配置成连接至的双室注射器,以促进两种基质成分通过导管单独递送,使得基质在递送期间不会在导管内胶凝或固化。上面描述了导管特征,以及其导引器针和其管心针。
[0558]
对于手术,将基于在操作前的后处理中确定的肿瘤的尺寸或总体积来选择的注射器尺寸2ml或5ml。在操作前的设置期间如下制备
90
y-基质组合物:
[0559]
1.打开装有微球小瓶的盒子,将小瓶留在铅容器中
[0560]
2.如果有的话,将其放在平台上的铅盒或丙烯酸盒中
[0561]
3.从小瓶中部分移除铝密封件并用酒精拭子清洁
[0562]
4.将25g针插入小瓶隔膜中以形成开口,确保针清楚地在小瓶的内容物中
[0563]
5.使用用至少70mm长的20-22g脊椎针筛过的5ml注射器来刺穿微球安瓿的隔膜
[0564]
6.取2ml悬浮液并将其处理
[0565]
7.使用剂量校准器,确定运输小瓶中的活性并将其放置在前导容器中
[0566]
8.根据肿瘤床的大小的不同,测定要取出的体积以向肝病灶提供所需的辐射剂量。
[0567]
为了计算活性,认为的小瓶包含3gbq/3ml的浓度剂量,在移除等于2ml体积的上清液后,并且考虑到在双腔导管中,在患者中使用结束时,剩余158μl的体积。然而,在其他变通方案中,可以去除或添加不同量的上清液,或者根本不改变。对于小于30mm直径的肿瘤尺寸,选择2ml注射器,并且假设和均匀混合并且分配最大量的混合物,在导管中留下标称158μl的混合物残留物:
[0568][0569]
对于50mm半径至70mm半径或更大的肿瘤尺寸,选择5ml注射器,并且假设和均匀混合并且分配最大量的混合物,在注射器中留下标称300μl的混合物残留物:
[0570][0571]
9.将注射器插回到小瓶中并来回移动柱塞以充分混合珠。快速抽出预先计算的辐射剂量并继续转移到如下所述的室。
[0572]
10.拆下装有胶成分的双腔注射器的盖子。
[0573]
11.将微球以4:1的比例(在bsa室中80%,在戊二醛室中20%)分配在双室注射器中。
[0574]
12.将盖子放回注射器上。
[0575]
13.通过用剂量校准器重新评估注射器中的活性来检查患者的剂量,并在必要时进行校正。
[0576]
14.将注射器放置在适于在手术室/放射室中运输的辐射防护容器中。
[0577]
对于用于经皮消融的
90
y-基质组合物的施用,使用图1a和1b中描绘的svas biosana system的mipp-套件,因为其特别设计用于经皮应用的生物胶的最佳使用,具有以下尺寸的成分:
[0578]-导引器针:15g直径和150mm长度
[0579]-注射器导管:16g直径和120mm长度
[0580]
该操作继续如下:
[0581]
15.应当实现经皮进入以便于将针导管插入肝实质中。
[0582]
16.根据中心的标准手术方法,应使用适当的麻醉。
[0583]
17.借助于超声扫描仪或在ct引导或其他成像模式下,将套件的导引器和管心针放置在肝脏病灶中。
[0584]
18.从辐射防护容器中取出包含
90
y-基质组合物组分的无菌注射器。
[0585]
19.移除包含
90
y-基质组合物组分的注射器盖。
[0586]
20.用针朝上牢固地握住注射器,逆时针旋转帽90
°
,并通过从一侧到另一侧摆动帽来移除帽。使用每个上的相应凹口将套件的双腔导管与注射器对准,并将套件的双腔导管的端部放置在注射器上。在组装期间,注意不要意外地从注射器中溢出溶液。
[0587]
21.通过朝向注射器牢固地推动导管并顺时针旋转导管套环90
°
来将套件的双侧
导管锁定就位。
[0588]
22.保持注射器笔直,将溶液注射器的大储器和小储器在相应的注射器柱塞头上对齐。将柱塞朝向注射器的后部滑动,直到其遇到阻力。由此组装分配装置。
[0589]
23.移除套件的导引器的管心针。
[0590]
24.将导管插入导引器中并通过鲁尔锁配件将其锁定。
[0591]
25.按压柱塞以分配混合物。
[0592]
26.应以0.5至1.0mm/s的速度按压柱塞。
[0593]
27.在缩回所述导引器之前等待至少30秒,同时提供轻微旋转以防止所述胶将所述导引器与所述组织粘附。
[0594]
28.在操作结束时,应按照生物危害处理中心的标准操作程序处理针导管和注射器。
[0595]
29.插入部位必须适当闭合并通过包扎保护。
[0596]
30.如果认为合适,可以施用局部抗生素。
[0597]
准备和植入程序必须被认为是对人员的潜在辐射危害和严重的污染风险。应遵循关于植入和植入后护理的放射使用的当地指南。
[0598]
在手术后24-48小时使用pet扫描评估
90
y-基质组合物的递送。通过从pet扫描采集的数据的数学分析来分析放射量测定。
[0599]
在21天后,在手术切除之前,还将重新评估每位患者的肿瘤评估,这将包括造影增强超声、mri和/或ct成像以及临床评估。将使用pet扫描并对数据进行数学分析来重新评估剂量测定。将监测插入部位和肝脏组织在放射消融和切除之间的时间期间的变化。观察到的任何发病和/或并发症必须记录在crf上。另外的评估包括:
[0600]-生命体征(如bp;hr;rr)
[0601]-一般体检
[0602]-完整实验室测试(如血液化学和血液学参数)
[0603]-mrecist标准
[0604]-伴随药物
[0605]-不良事件检查
[0606]-eortc-30/hcc18问卷
[0607]
在重新评估后7至9天,即在消融术28-30天,患者将返回医院进行靶病灶手术切除,这将根据研究现场的标准程序进行。手术操作包括:
[0608]-生命体征(bp;hr;rr)
[0609]-一般体检
[0610]-肿瘤评估
[0611]-为手术目的的麻醉
[0612]-手术
[0613]-组织学评估
[0614]-伴随药物
[0615]-不良事件检查
[0616]
从放射防护的角度来看,手术对于外科医生和所有辅助人员是放射安全的,因为
20天后,在放射消融过程中注射2gbq剂量的
90
y后的残余发射降低至10mbq。在1米处的效果在体外约为3msv/h,并且在体内(在人体中)约为1msv/h,两者均低于背景环境辐射水平。
[0617]
在手术在到期日变得禁忌的情况下,受试者将退出研究,但将经历与术后评估所述相同的评估并随访任何安全问题。
[0618]
切除的肝组织将被送到病理学部门进行评估。标本将由病理学家处理以评估手术切缘,并将观察由于坏死引起的总体变化。测量肿瘤块坏死的百分比,并在组织学上评估治疗的病灶中任何活细胞的存在。还将评估和测量
90
y微球的径向分布。样品取向将使用适当的系统(诸如彩色墨水)来执行。将通过成像(适当时)、总体和显微镜评估切除边缘。将处理肝脏样本,包括经处理的肝脏组织,并通过显微镜检查进行评估。在样品定向后,观察样品由于坏死引起的总体变化,然后用显微镜检查治疗区域内的组织是否诱导组织坏死。坏死的程度将使用苏木精/伊红染色技术和标准免疫组织化学来确定,苏木精/伊红染色技术依赖于目视检查细胞膜和结构的状况以评估细胞的活力。
[0619]
出于手术在放射学上安全的相同原因,组织病理学评估对于病理学家和所有辅助人员也是安全的。
[0620]
手术后的患者护理将遵循当地标准惯例和实践,包括(在适当的情况下)在手术后进入重症监护病房24-48小时,然后转移到医院常规病房,其中患者将在出院前进行以下评估:
[0621]-生命体征(例如,bp、hr、rr)
[0622]-ecg
[0623]-体检
[0624]-血液化学(包括肝功能评估:ast、alt、总胆红素和分级胆红素、γgt、ldh、碱性磷酸酶)和血液学
[0625]-手术降低分期标准
[0626]-伴随药物/治疗
[0627]-使用对比增强的超声的肿瘤评估
[0628]-不良事件和不良反应检查
[0629]
出院后,患者将随访2个月。在2个月的随访期后,每个受试者的研究将被认为结束;在随访期间,将收集关于可能与放射消融术或手术切除相关并包括在crf中的任何不良事件的信息。
[0630]
在将在手术后28天、消融后56天进行的出院后随访期间,患者将经历以下研究操作:
[0631]-生命体征(例如bp、hr;rr)
[0632]-一般体格检查,体重
[0633]-完成实验室测试(如血液化学和血液学参数)
[0634]-肿瘤评估
[0635]-成像评估(例如pet扫描)
[0636]-伴随药物
[0637]-不良事件检查
[0638]
在肝肿瘤治疗方法的一些另外的变通方案中,可以提供
90
y-基质组合物治疗,而无
需进行预处理成像,例如锝-99扫描,以评估任何分流到肝或肺或其他脱靶位置的情况,包括静脉曲张和avm。在一些变通方案中,因为不需要预处理成像来评估分流,所以也不需要治疗潜在分流的预处理操作。这可能会导致治疗时间缩短1、2、3、4、5、6或7天或更长时间,因为治疗不会因治疗前分流成像、治疗前减少分流操作和治疗前重新扫描以评估减少分流操作的有效性而延迟。不再需要或不再进行的分流手术可能包括动脉栓塞、肝静脉气囊阻塞以及静脉曲张和avm闭塞手术。因为不再需要考虑分流的给药剂量调整,所以也可以简化给药剂量计算,例如不再需要根据分流比例和/或肺剂量限制进行调整。具有大量肝、肺或肝肺分流比例的患者也不再需要被排除在疗法之外。
[0639]
为了评价主要终点,将估计显著性水平为5%的平均递送剂量的置信区间(ci)。此外,将计算递送剂量的平均值的标准偏差及其95%置信区间,以便量化新技术的性能的分散和动态范围。如果适合,将通过描述性统计学和95%置信区间总结次要终点。将在筛选访视(v-1)和访视1(v1)时评估通过eortc qlq c30和hcc18问卷测量的生活质量。将提供每次研究访视时的单项分数和v1时的分数相对于筛选访视(v-1)时的分数的变化的描述性统计学。手术样本将由病理学家处理以评估手术切缘,并且将观察由于坏死引起的总体变化。安全性评估将包括所有不良事件的记录和制表,以及分析生命体征和实验室参数的变化。关于与
90
y-基质组合物的关系,还将计算所有患者的不良事件的发生率以及它们的严重性和严重程度。不良事件或严重不良事件的严重程度评估应使用nci ctcae版本5完成。实验室数据将按实验室测试的类型汇总。将针对基线处的每种实验室分析物以及针对每个预定时间点处的观测值和相对于基线的变化计算描述性统计学。将提供任何实验室结果在参考范围之外的受试者的列表。将总结具有预定义的nci-ctcae毒性等级的参数。总结生命体征值和从基线的变化的描述性统计学。为安全性变量提供描述性统计学。
[0640]
尽管为了清楚和理解的目的,已经通过使用示例和实施例对前述实施方式进行了一些详细的描述,但显而易见地可以实施某些改变和变型,并且旨在落入所附权利要求的范围内。此外,应当理解,本文所述的装置和材料的组件和特性可以以任意组合使用,并且本文所述的方法可以包含本文所述的全部或部分要素。关于具体附图的某些要素或特征的描述不旨在限制或也不应将它们解释为暗示该要素不能与任何其他描述的要素结合使用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1