一种甲型流感病毒通用DNA疫苗及其构建方法
本发明涉及基因工程领域,涉及一种甲型流感病毒通用dna疫苗及其构建方法。
背景技术:
流感是由流感病毒感染引起的一种严重的急性呼吸道传染病。每年在全球造成人和动物的大量死亡,给全球的公共卫生健康以及经济发展带来了严重的威胁。流感病毒根据病毒核衣壳蛋白(np)和基质蛋白m的特征,可将其分为甲、乙、丙三种亚型,其中甲型流感病毒(influenzaavirus)是目前流行最广和影响最深远的流感病毒。甲型流感病毒其基因特性使其经常发生不可预测的变异,因此,对于甲型流感病毒的研究与防制不容忽视。
预防和控制甲型流感的最有效方法是接种疫苗,目前可获得的大多数甲型流感疫苗是亚型特异性的,甲型流感病毒又极易发生变异出现新变异株,并且不能保护患者免受其他病毒亚型的影响,这大大限制了疫苗的适用性和有效性。开发新型通用甲型流感疫苗可以提供较为广泛的保护。其中,dna疫苗是根据实验需求利用分子生物学技术进行设计,与减毒疫苗、灭活疫苗和亚单位疫苗等传统疫苗相比具有较强的可控性。通过设计安全、高效的递送载体有助于dna疫苗顺利靶向免疫细胞,提高其免疫效力。因此,基于现有技术中甲型流感病毒疫苗存在的问题,设计一种新型的通用性甲型流感疫苗非常必要。
技术实现要素:
本发明的目的是提供一种甲型流感病毒通用dna疫苗及其构建方法,该疫苗将甲型流感病毒m2蛋白胞外区、通用疫苗和dna疫苗的优势结合,可以有效预防和控制甲型流感病毒。
为实现上述目的,本发明提供了如下方案:
本发明提供了一种甲型流感病毒通用dna疫苗,包括基因构建体、载体和递送系统,所述基因构建体插入所述载体构建表达质粒,所述递送系统包被所述表达质粒构成甲型流感病毒通用dna疫苗,其中,所述基因构建体是由四种不同亚型甲型流感病毒的保守序列m2e基因串联组合而成,所述递送系统为细胞穿透肽。
优选的是,所述基因构建体的核苷酸序列如seqidno:1所示。
优选的是,所述甲型流感病毒的四种不同亚型为h1亚型、h3亚型、h5亚型和h9亚型。
优选的是,所述表达质粒:所述细胞穿透肽按照质量比为(1:10)-(1:20)混合,实现包被。
优选的是,所述细胞穿透肽包括rvg9dr和protamine至少一种。
优选的是,所述细胞穿透肽是由rvg9dr和protamine按质量比(1-3):(1:3)混合而成。
优选的是,所述疫苗为预防甲型流感病毒通用dna疫苗。
本发明还提供一种所述的甲型流感病毒通用dna疫苗的构建方法,包括以下步骤:
将四种不同亚型甲型流感病毒的保守序列m2e基因串联,形成基因构建体;
将所述基因构建体转入真核表达载体构建表达质粒;
用细胞穿透肽包被所述表达质粒,构建甲型流感病毒通用dna疫苗。
优选的是,所述基因构建体还包括组织纤溶酶原激活物tpa的分泌序列,所述分泌序列的核苷酸序列如seqidno:2所示。
本发明公开了以下技术效果:
本发明通过将h1、h3、h5、h9亚型流感病毒的m2e序列串联(4m2e)基因片段克隆到真核表达载体,构建出真核表达质粒,然后通过筛选,以最佳细胞穿透肽包被适量的dna进行小鼠免疫实验,发现对甲型流感病毒h1n1和h9n2均具有高保护效力。本发明将甲型流感病毒胞外区、通用疫苗和dna疫苗的优势结合,设计基于甲型流感病毒m2胞外区的通用dna疫苗,该疫苗可以有效的预防和控制甲型流感病毒,具有重要的科学意义和社会价值。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
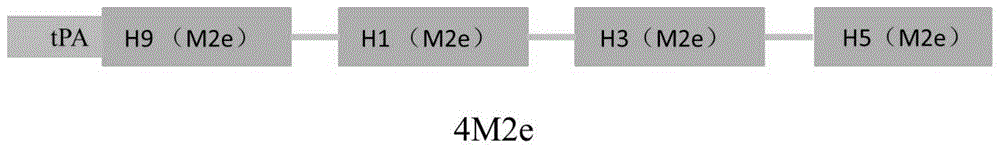
图1为目的基因4m2e的设计结构图;
图2为目的片段4m2e的凝胶电泳图;
图3为三种细胞穿透肽的凝胶阻滞实验凝胶电泳图;a为实施例2实验一组的凝胶阻滞实验凝胶电泳图,2-6分别为按照1:0.5、1:1、1:2、1:4、1:8的比例将pvax1-4m2e与rvg(9dr)混合,1为对照;b为实施例2实验二组的凝胶阻滞实验凝胶电泳图,2-6分别为按照1:0.5、1:1、1:2、1:4、1:8的比例将pvax1-4m2e与protamine混合,1为对照;c为实施例2实验三组的凝胶阻滞实验凝胶电泳图,2-8分别为按照1:0.125、1:0.25、1:0.5、1:1、1:2、1:4、1:8的比例将pvax1-4m2e与细胞穿透肽复合物rvg(9dr)+protamine混合液混合,1为对照;
图4为pvax1-egfp:细胞穿透肽rvg9dr的重量比分别为1:2、1:4、1:8、1:10、1:20(对应a-e;f为阴性对照)进行转染后随机拍摄的荧光图;
图5为细胞穿透肽rvg9dr不同实验组随机拍摄的荧光图荧光强度分析图;横坐标1-5分别代表pvax1-egfp:细胞穿透肽rvg9dr的重量比分别为1:2、1:4、1:8、1:10、1:20;纵坐标为荧光强度;
图6为pvax1-egfp:细胞穿透肽protamine的重量比分别为1:2、1:4、1:8、1:10、1:20(对应a-e;f为阴性对照)进行转染后随机拍摄的荧光图;
图7为细胞穿透肽protamine不同实验组随机拍摄的荧光图荧光强度分析;横坐标1-5分别代表pvax1-egfp:细胞穿透肽protamine的重量比分别为1:2、1:4、1:8、1:10、1:20;纵坐标为荧光强度;
图8为pvax1-egfp:细胞穿透肽复合物rvg9dr+protamine的重量比分别为1:1、1:2、1:4、1:8、1:10、1:20(对应a-f;g为阴性对照)进行转染后随机拍摄的荧光图;
图9为细胞穿透肽复合物rvg9dr+protamine不同实验组随机拍摄的荧光图进行荧光强度分析;横坐标1-6分别代表pvax1-egfp:细胞穿透肽protamine的质量比分别为1:1、1:2、1:4、1:8、1:10、1:20;纵坐标为荧光强度;
图10为h1n1攻毒组的小鼠21d内小鼠的体重变化情况以及存活率;a为体重变化,b为存活率;
图11为h9n2攻毒组的小鼠21d内小鼠的体重变化情况以及存活率;a为体重变化,b为存活率。
具体实施方式
现以实施例方式对本发明技术方案进行具体说明,但其不应该被认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1构建质粒pvax1-4m2e
根据4种亚型甲型流感病毒的m2e的核苷酸序列通过一种组合策略设计通用dna疫苗的目的基因4m2e序列。
首先,将h9亚型、h1亚型、h3亚型和h5亚型的基因串联组合形成一个基因构建体,并进行密码子优化后,将所设计的基因构建体与组织纤溶酶原激活物(tpa)的分泌序列(核苷酸序列如seqidno:2所示)结合,进一步改善目的蛋白的分泌(如图1)。
利用pcr技术进行目的片段4m2e的扩增,扩增引物为:
上游引物序列:aatcgaattcatggatgcaatgaagagagg
下游引物序列:aatcctcgagtcaatcagaggagtagtgtcactac
目的基因4m2epcr扩增体系如表1所示:
表1
目的基因4m2e的pcr反应程序如表2所示:
表2
扩增产物用2%琼脂凝胶进行电泳,结果如图2所示,在378bp出现亮条带,与预期片段长度相同。其中,新合成的目的片段4m2e的dna序列(seqidno:1)为:
atggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtttcgcccagccaggaatcttcaagtcttctaaccgaggtcgaaacgcttaccagaaccggatgggggtgcaactgcagcggttcaagtgattccctgctgacagaggtggaaacccctacaaggtccgagtgggaatgccgctgttctgactctagtgatgcagccgctagcctgctgactgaggtggaaaccccaattcgaaacgagtggggctgccggtgtaatgactcaagcgatgcagccgcttctctgctgaccgaagtggaaactcccaccagaaacgagtgggaatgcaggtgtagtgactcctctgattga
回收pcr产物,并将pcr胶回收的4m2e目的片段和真核表达质粒pvax1使用限制性内切酶ecori和xhoi进行酶切;利用t4dnaligase连接以上两个酶切片段,构建质粒pvax1-4m2e。
实施例2凝胶阻滞实验
实验分为如下三组:
实验一组:从-20℃中将储存浓度为1mg/ml的细胞穿透肽rvg(9dr)(上海生工生物工程股份有限公司)取出提前放入冰盒上自然融化,然后从大量提取的pvax1-4m2e真核表达质粒中取出1μg,按照1:0.5、1:1、1:2、1:4、1:8的比例与rvg(9dr)配置好混合液,用移液枪轻轻吹打混匀,室温下静置20min,使其充分结合。
实验二组:从-20℃中将储存浓度为1mg/ml的细胞穿透肽protamine(上海生工生物工程股份有限公司)取出提前放入冰盒上自然融化,然后从大量提取的pvax1-4m2e真核表达质粒中取出1μg,按照1:0.5、1:1、1:2、1:4、1:8的比例与protamine配置好混合液,用移液枪轻轻吹打混匀,室温下静置20min,使其充分结合。
实验三组:从-20℃中将储存浓度为1mg/ml的细胞穿透肽rvg(9dr)和protamine取出提前放入冰盒上自然融化,使细胞穿透肽rvg(9dr)和protamine按质量比1:1先结合形成多肽混合物,然后从大量提取的pvax1-4m2e真核表达质粒中取出1μg,按照1:0.125、1:0.25、1:0.5、1:1、1:2、1:4、1:8的比例与多肽复合物配置好混合液,用移液枪轻轻吹打混匀,室温下静置20min,使其充分结合。
将上述三组实验组进行1%的琼脂糖电泳,120v,200ma,30min,利用紫外凝胶成像系统观察。结果如图3所示:dna与rvg9dr最适合结合比例为1:2,dna与protamine的最适合结合比例为1:2,dna与rvg9dr+protamine的最适合结合比例是1:1。
实施例3细胞转染实验
细胞培养:293t细胞培养在含有10%胎牛血清的(fetalbovineserum,fbs)和1%双抗(penicillin-streptomycinsolution,ps)的dmem培养液于37℃培养箱培养。(培养基和血清均购自biologicalindustries公司)。
转染:将293t细胞铺在6孔细胞培养板中,每孔1×106个细胞,待其长成均匀的单层细胞,次日进行后续转染实验。
以质粒dna(pvax1-egfp)为模型进行细胞转染实验,从细胞荧光及荧光强度来判断3种细胞穿透肽在细胞水平上对质粒dna递送效果。具体步骤如下:
(1)将6孔板中各个孔内的原细胞培养液弃掉,并用磷酸盐缓冲液pbs液清洗1-2次。
(2)6孔板每孔中需在加入2mlopti-mem培养基,置于37℃、5%co2细胞培养箱。
(3)取出1.5ml灭菌后的离心管,按照所需实验计划分成四组,每个1.5ml离心管需要加入100μlopti-mem无血清培养基。
(4)实验分组:
第一组:1-5号离心管中分别加入1μgpvax1-egfp,相对应的6-10号离心管中分别加入rvg(9dr)2μg、4μg、8μg、10μg、20μg,室温静置5min后将1-5号离心管中的试剂加入到相应的6-10号离心管中,轻轻地吹打混匀,室温静置20-30min。
第二组:1-5号离心管中分别加入1μgpvax1-egfp,相对应的6-10号离心管中分别加入protamine2μg、4μg、8μg、10μg、20μg,室温静置5min后将1-5号离心管中的试剂加入到相应的6-10号离心管中,轻轻地吹打混匀,室温静置20-30min。
第三组:1-5号离心管中分别加入1μgpvax1-egfp,相对应的6-10号离心管中分别加入(rvg9dr+protamine)1μg、2μg、4μg、8μg、10μg、20μg,室温静置5min后将1-5号离心管中的试剂加入到相应的6-10号离心管中,轻轻地吹打混匀,室温静置20-30min。
(5)取出6孔板,做好标记,每孔加入相应的混合液,预留一个细胞培养孔不做处理将其作为空白对照,于37℃、5%co2培养箱中培养。
(6)培养6-8h后,将6孔板中的opti-mem无血清培养基替换成dmem细胞培养基,继续培养24h,利用荧光倒置显微镜观察荧光并利用imagej软件进行荧光强度分析。
如图4和图5所示,结果显示随着穿透肽rvg9dr质量比逐渐增加,细胞转染后细胞荧光及荧光强度越高,其与质粒dna的结合效果越明显,且质粒dna与细胞穿透肽rvg9dr在质量比1:20处结合效果最好。
如图6和图7所示,结果显示随着穿透肽protamine质量比逐渐增加,细胞转染后细胞荧光及荧光强度越高,其与质粒dna的结合效果越明显,且质粒dna与细胞穿透肽protamine在质量比1:20处结合效果最好。
如图8和图9所示,结果显示随着细胞穿透肽复合物(rvg9dr+protamine)质量比逐渐增加,细胞转染后细胞荧光及荧光强度越高,其与质粒dna的结合效果越明显,且质粒dna与细胞穿透肽复合物(rvg9dr+protamine)在质量比1:20处结合效果最好。
综上所述,以质粒dna(pvax1-egfp)为模型进行的三组细胞转染试验,从细胞荧光及荧光强度结果得出:随着细胞穿透肽rvg9dr、protamine以及(rvg9dr+protamine)质量比逐渐增加(1:2、1:4、1:8、1:10、1:20),其与质粒dna的结合效果越明显,并且细胞穿透肽复合物(rvg9dr+protamine)的效果最佳,其中质粒dna与细胞穿透肽(rvg9dr+protamine)在质量比1:20处结合效果最好。
实施例4dna疫苗免疫小鼠
根据细胞转染实验结果得出,(rvg9dr+protamine)多肽包被dna的效果较好,且质量比1:20的效果最好。按照dna:rvg9dr+protamine多肽质量比为1:20进行小鼠免疫实验。实验共8组balb/c小鼠,8只/每组,按照以下实验分组操作。
第一组(25ugpvax1-4m2e+500ug多肽免疫组,pr8h1n1攻毒组):一次免疫肌注小鼠25ugpvax1-4m2e+500ug(rvg9dr+protamine),14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的pr8h1n1病毒原液稀释1000倍滴鼻,21d内观察小鼠的存活率和体重变化情况。
第二组(25ugpvax1-4m2e+500ug多肽免疫组,wm01-p15h9n2攻毒组):一次免疫肌注小鼠25ugpvax1-4m2e+500ug(rvg9dr+protamine),14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的wm01-p15h9n2代病毒原液稀释1000倍滴鼻,21d内观察小鼠的存活率和体重变化情况。
第三组(50ugpvax1-4m2e+1000ug多肽免疫组,pr8h1n1攻毒组):一次免疫肌注小鼠50ugpvax1-4m2e+1000ug(rvg9dr+protamine),14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的pr8h1n1病毒原液稀释1000倍滴鼻,21d内观察小鼠的存活率和体重变化情况。
第四组(50ugpvax1-4m2e+1000ug多肽免疫,wm01-p15h9n2攻毒组):一次免疫肌注小鼠50ugpvax1-4m2e+1000ug(rvg9dr+protamine),14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的wm01-p15h9n2代病毒原液稀释1000倍进行攻毒,21d内观察小鼠的存活率和体重变化情况。
第五组(25ug载体pvax1免疫+500ug多肽免疫组、pr8h1n1攻毒组):一次免疫肌注小鼠25ugpvax1+500ug(rvg9dr+protamine),14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的pr8h1n1病毒原液稀释1000倍进行攻毒,21d内观察小鼠的存活率和体重变化情况。
第六组(25ug载体pvax1免疫+500ug多肽免疫组、wm01-p15h9n2攻毒组):一次免疫肌注小鼠25ugpvax1+500ug(rvg9dr+protamine),14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的wm01-p15h9n2代病毒原液稀释1000倍进行攻毒,21d内观察小鼠的存活率和体重变化情况。
第七组(pr8h1n1免疫组):将实验室保存的pr8h1n1病毒原液稀释500万倍,滴鼻免疫小鼠(50μl/只)一次,14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的pr8h1n1病毒原液稀释1000倍进行攻毒,21d内观察小鼠的存活率和体重变化情况。
第八组(wm01-p15h9n2免疫组):将实验室wm01-p15h9n2病毒原液稀释100万倍,滴鼻免疫小鼠(50μl/只)一次,14d后使用相同剂量再次免疫,再次免疫14d后将实验室保存的wm01-p15h9n2病毒原液稀释1000倍进行攻毒,21d内观察小鼠的存活率和体重变化情况。
h1n1攻毒组和h9n2攻毒组21d内小鼠的存活率和体重变化情况,如图10和11所示。从图10a和b可以看出,pr8h1n1免疫组感染pr8h1n1后,小鼠体重无明显变化;25μgpvax1-4m2e+500μg(rvg9dr+protamine)免疫组和50μgpvax1-4m2e+1000μg(rvg9dr+protamine)免疫组在感染pr8h1n1后,小鼠临床表现较明显,被毛粗乱、呼吸急促、弯腰驼背、活动迟缓、扎堆聚集以及体重下降等症状;25μgpvax1-4m2e+500μg(rvg9dr+protamine)免疫组,有4只小鼠死亡,剩余小鼠攻毒后第7天后体重又开始回升;50μgpvax1-4m2e+1000μg(rvg9dr+protamine)免疫组,未出现小鼠死亡,6-7d后体重开始逐渐回升;25μg载体pvax1+500μg(rvg9dr+protamine)免疫组在感染pr8h1n1后,小鼠临床表现明显,体重急剧下降,5d内小鼠全部死亡。(p值<0.0001,体重百分比下降>25%人为判定其死亡)。
从图11a、b可看出,wm01-p15h9n2免疫组感染wm01-p15h9n2后,未发生小鼠死亡,小鼠体重无明显变化;25μgpvax1-4m2e+500μg(rvg9dr+protamine)免疫组和50μgpvax1-4m2e+1000μg(rvg9dr+protamine)免疫组在感染wm01-p15h9n2后,小鼠临床表现也较明显,被毛粗乱、呼吸急促、弯腰驼背、活动迟缓、扎堆聚集以及体重下降等症状;25μgpvax1-4m2e+500μg(rvg9dr+protamine)免疫组,有1只小鼠死亡,其余小鼠攻毒后第7d起体重开始回升;50μgpvax1-4m2e+1000μg(rvg9dr+protamine)免疫组,无小鼠死亡,攻毒后第7d后体重逐渐回升;25μg载体pvax1+500μg多肽复合物免疫组在感染wm01-p15h9n2后,小鼠临床表现明显,体重急剧下降,8d内小鼠全部死亡。(p值<0.0001,体重百分比下降>25%人为判定其死亡)。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110>青岛农业大学
<120>一种甲型流感病毒通用dna疫苗及其构建方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>378
<212>dna
<213>人工序列(artificialsequence)
<400>1
atggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtt60
tcgcccagccaggaatcttcaagtcttctaaccgaggtcgaaacgcttaccagaaccgga120
tgggggtgcaactgcagcggttcaagtgattccctgctgacagaggtggaaacccctaca180
aggtccgagtgggaatgccgctgttctgactctagtgatgcagccgctagcctgctgact240
gaggtggaaaccccaattcgaaacgagtggggctgccggtgtaatgactcaagcgatgca300
gccgcttctctgctgaccgaagtggaaactcccaccagaaacgagtgggaatgcaggtgt360
agtgactcctctgattga378
<210>2
<211>75
<212>dna
<213>人工序列(artificialsequence)
<400>2
atggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtt60
tcgcccagccaggaa75
- 还没有人留言评论。精彩留言会获得点赞!