一种可穿过血迷路屏障的偶联物及其制备方法
1.本发明涉及生物工程及医药技术领域,具体涉及一种可穿过血迷路屏障的偶联物及其制备方法。
背景技术:
2.人耳解剖结构主要分为外耳,中耳及内耳,其中内耳是相对封闭且结构极其复杂的声电转换及平衡感应器官,是人体最为精密的感觉器官之一,其内部复杂的膜迷路系统中充斥着内外两种含有不同离子浓度且独立循环的淋巴液,以便为毛细胞进行声电转化时产生动作电位提供必要的电势差。为保障该机制正常运转,内耳淋巴系统与外周血液循环系统之间的物质交换及离子平衡需要受到血迷路屏障(blood
‑
labyrinth barrier,blb)的严格把控。然而这一保证内耳特殊功能所必需的屏障系统,也同时成为制约药物分子进入内耳,治疗相关疾病的重要障碍,因此包括耳聋,耳鸣,眩晕等一系列听觉及平衡医学相关内耳疾病均为世界性疑难病症,目前除手术之外尚无任何切实有效的内耳给药措施,而手术在预防性给药及多次用药方面存在诸多不便,且风险较大。因此内耳疾病治疗领域迫切需要一种生理状态下能够无创携带药物分子跨越blb定向进入内耳的载药系统。如果突破这一技术“瓶颈”,则可获得巨大的社会及经济效益。
技术实现要素:
3.本发明的目的在于提供一种可穿过血迷路屏障的偶联物及其制备方法。该偶联物通过将一种肽和具有内耳诊断或治疗活性的活性分子进行偶联,实现了无创内耳给药,开发了适用于静脉滴注给药的新型内耳靶向载药系统。
4.为此,本发明的第一方面,提供了一种可穿过血迷路屏障的偶联物,所述偶联物由肽和活性分子偶联而成;其中所述肽选自具有以下结构通式的肽:
5.tfyggrx1krnnfx2x3x4x5x6x7,
6.其中,
7.x1为p、v、s或r;
8.x2为l、a、p或t;
9.x3为r、l、k或a;
10.x4为g、s、l或v;
11.x5为i、l、h或s;
12.x6为r、w、r或a;
13.x7为srgd或不存在
14.所述活性分子具有内耳诊断或治疗活性。
15.进一步,所述肽选自下组:tfyggrpkrnnflrgir,tfyggrvkrnnfalslw,tfyggrskrnnfpklhr,tfyggrrkrnnftavsa,tfyggrpkrnnflrgirsrgd,tfyggrvkrnnfalslwsrgd,tfyggrskrnnfpklhrsrgd,tfyggrrkrnnftavsasrgd。
16.进一步,所述活性分子与所述肽通过连接键偶联,所述连接键选自:二硫键、腙键、酰胺键、酯键、醚键、羰基键、硫酯键、巯基
‑
马来酰亚胺键。
17.进一步,所述活性分子选自:小分子药物、染料、多肽、抗体、质粒dna、核酸、脂质体、噬菌体颗粒、超顺磁性粒子、病毒、量子点、磁共振成像造影剂。
18.在具体的实施方式中,所述活性分子为姜黄素。
19.进一步,所述姜黄素通过戊二酸偶联nhs活性酯,并通过巯基
‑
马来酰亚胺键与所述肽偶联。
20.本发明的第二方面提供了肽在制备穿血迷路屏障药物和/或内耳靶向药物中的应用,所述肽选自具有与以下结构通式的肽:
21.tfyggrx1krnnfx2x3x4x5x6x7,
22.其中,
23.x1为p、v、s或r;
24.x2为l、a、p或t;
25.x3为r、l、k或a;
26.x4为g、s、l或v;
27.x5为i、l、h或s;
28.x6为r、w、r或a;
29.x7为srgd或不存在。
30.进一步,所述肽选自下组:tfyggrpkrnnflrgir,tfyggrvkrnnfalslw,tfyggrskrnnfpklhr,tfyggrrkrnnftavsa,tfyggrpkrnnflrgirsrgd,tfyggrvkrnnfalslwsrgd,tfyggrskrnnfpklhrsrgd,tfyggrrkrnnftavsasrgd。
31.本发明的第三方面提供了所述偶联物的制备方法,包括,(1)向所述活性分子修饰偶联基团,所述偶联基团选自下组:硫醇反应基团、胺反应基团、马来酰亚胺基团、硫醇基、醛基、碳二亚胺基团、nhs
‑
酯基、nhs
‑
马来酰亚胺基;(2)将修饰后的活性分子与所述肽进行偶联。
32.进一步,所述制备方法包括,以戊二酸酐和活性分子的游离羟基进行缩合反应引入游离羧基,加入dcc和nhs,得到活性分子
‑
戊二酸
‑
nhs活性酯;将所述活性分子
‑
戊二酸
‑
nhs活性酯与所述肽进行偶联。
33.进一步,所述肽与活性分子
‑
戊二酸
‑
nhs活性酯的摩尔比为1:5
‑
10,优选为1:7.5。
34.在具体的实施方式中,所述活性分子为姜黄素,所述制备方法包括,以戊二酸酐和姜黄素进行缩合反应,加入dcc和nhs,得到姜黄素
‑
戊二酸
‑
nhs活性酯;将所述姜黄素
‑
戊二酸
‑
nhs活性酯与所述肽进行偶联。
35.进一步,所述肽与所述姜黄素
‑
戊二酸
‑
nhs活性酯的摩尔比为1:5
‑
10,优选为1:7.5。
36.本发明的第四方面提供了所述偶联物在制备穿血迷路屏障药物和/或内耳靶向药物中的应用。
37.进一步,所述药物包括检测药物和治疗药物。
38.进一步,所述药物用于治疗神经性耳聋或噪声性耳聋,或用于听力保护。
39.申请人在中国专利cn 109666973 a中公开了一种穿过血脑屏障的肽库、利用所述
肽库筛选穿血脑屏障肽的方法、获得的穿血脑屏障肽。本发明基于所述多肽在内耳富集的现象进一步提出其诊断和治疗内耳疾病的新功能,通过将所述肽与内耳诊断或治疗活性分子偶联获得一种可穿过血迷路屏障递送药物、治疗内耳疾病的偶联物,具体以姜黄素为例,提供了一种肽
‑
姜黄素偶联物,该偶联物具有内耳靶向功能,可用于治疗神经性耳聋,具有显著的听力保护效果。
40.与现有技术相比,本发明的技术方案具有以下优点:
41.(1)本发明提供的偶联物可穿过血迷路屏障进行药物递送,是一种适用于全身给药的新型内耳靶向载药系统,能够携带活性分子无创进入内耳。突破了现有技术中药物难以进入内耳的技术瓶颈。
42.(2)本发明提供了一种肽
‑
姜黄素偶联物,在动物实验水平上验证了其能够有效跨越小鼠内耳迷路屏障,进入淋巴液中,具有良好的内耳靶向及富集功能,且可有效治疗神经性耳聋,并起到噪声暴露后的听觉保护作用。
附图说明
43.通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。在附图中:
44.图1为肽库梯度稀释空斑计数
45.a:稀释度10e2;b:稀释度10e4;c:稀释度10e6
46.图2为小鼠脑部噬菌体展示肽给药后最佳富集时间
47.图3为合成m1的质谱检测图
48.图4为m1标记cy5.5荧光质谱检测图
49.图5为m1
‑
cy5.5静脉注射后4h小鼠活体成像检测图
50.a:m1
‑
cy5.5;b:阴性对照。
51.图6为器官荧光分布图
52.图7为器官荧光分布值
53.图8为戊二酸酐和姜黄素缩合产物的质谱检测图
54.图9为m1
‑
rgd
‑
cur合成与纯化质谱检测图
55.图10为m1
‑
rgd
‑
cur在小鼠内耳富集效果的评价图
56.图11为m1
‑
rgd
‑
cur在小型猪内耳富集效果的评价图
57.图12为abr测序结果图
58.图13为abr数据统计分析结果
具体实施方式
59.下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
60.在本发明的说明书中,使用了氨基酸的单字母代码,本文提及的氨基酸根据
iupac
‑
iub的命名规则缩写如下:
61.丙氨酸(ala,a)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
精氨酸(arg,r)
62.天冬酰胺(asn,n)
ꢀꢀꢀꢀꢀꢀꢀꢀ
天冬氨酸(asp,d)
63.半胱氨酸(cys,c)
ꢀꢀꢀꢀꢀꢀꢀꢀ
谷氨酸(glu,e)
64.谷氨酰胺(gln,q)
ꢀꢀꢀꢀꢀꢀꢀꢀ
甘氨酸(gly,g)
65.组氨酸(his,h)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异亮氨酸(ile,i)
66.亮氨酸(leu,l)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
赖氨酸(lys,k)
67.甲硫氨酸(met,m)
ꢀꢀꢀꢀꢀꢀꢀꢀ
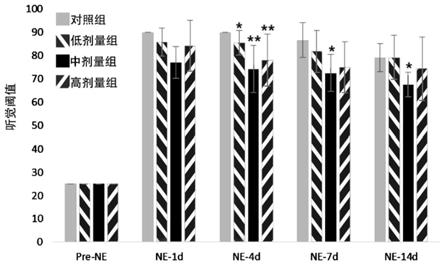
苯丙氨酸(phe,f)
68.脯氨酸(pro,p)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
丝氨酸(ser,s)
69.苏氨酸(thr,t)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
色氨酸(trp,w)
70.酪氨酸(tyr,y)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
缬氨酸(val,v)
71.根据本发明的实施方式,参考牛胰岛抑制剂以及β
‑
淀粉样肽跨血脑屏障蛋白保守的活性中心kunitz区域,选择骨架,利用噬菌体展示技术,体外人工合成构建高通量噬菌体展示文库,从基础获取新型自主知识产权高效穿血脑屏障短肽,利用小鼠体内筛选技术,优化筛选流程,通过三轮筛选,得到高效穿过血脑屏障短肽。
72.实施例1建库
73.1、基于活性中心kunitz区域的序列分析,找到如下中心骨架序列,设计完成噬菌体展示的多肽库kun
‑
m的构建。
74.构建方法:
75.library 1:tfyggrxkrnnf xxxxx(seq id no:1)
76.x为随机氨基酸。
77.长引物:
78.library1
[0079]5’‑
cccaggtgcagctgcagaccttttatggtggtcgtnnkaaacgtaataattttnnknnknnknnknnktctagaggggacccaggtc
‑3’
(seq id no:2)
[0080]
所述的n为a、t、c或g;所述的k为g或t
[0081]
下划线标出了酶切位点,大写字母为肽库编码核酸序列。
[0082]
设计第一对引物nag
‑
f:gcccaggtgcagctg(tm 57.24)(seq id no:3)
[0083]
第二对引物nag
‑
r:gacctgggtcccctctag(tm 57.29)(seq id no:4)
[0084]
引物交引物合成公司合成。
[0085]
2、目的片段的扩增
[0086]
pcr扩增条件:
[0087][0088]
pcr条件:
[0089][0090]
扩出目的片段在100bp左右,天根pcr纯化回收试剂盒回收pcr产物。测定回收产物的浓度。
[0091]
3、酶切、回收、纯化
[0092]
酶切回收pmesy 4
‑
质粒,pcr目的片段。
[0093]
酶切体系:
[0094][0095]
跑1%的琼脂糖胶,切胶回收酶切开的质粒片段。
[0096]
酶切pcr目的片段ang2nw,采用同样酶切体系,利用生工pcr纯化回收试剂盒回收目的片段。
[0097]
4、目的片段连接
[0098]
连接体系,质粒与目的片段按1:3的摩尔量加:
[0099][0100]
16℃过夜,将连接产物按产物回收试剂盒回收,用超纯水70℃洗脱。
[0101]
5、转感受态制备:
[0102]
制备感受态
[0103]
(1)将过夜培养的er2738菌按1:100的比例将过夜菌液转接到500ml的lb+tet培养基中,培养到对数期0.6,冰上孵育30min。
[0104]
(2)大肠杆菌液在4℃,4000rpm下离心10min,弃上清液。
[0105]
(3)弃上清,离心管中加入少量ddh2o,轻柔的悬浮沉淀后,100ml再将水注满离心管,4℃,4000rpm离心10min。
[0106]
(4)重复步骤(3)1次。
[0107]
(5)小心弃上清(沉淀可能会很松散),再往离心管中加入100ml量10%甘油(灭菌,预冷),重悬菌体,4℃,4000rpm离心10min。重复步骤5一次
[0108]
(6)用10%甘油重悬浮细胞至最终体积为2ml,将细胞按100μl等份装入微量离心管,放置于
‑
80℃下保存。
[0109]
6、电转化:
[0110]
将电转杯冰上预冷30min,取连接产物进行电转,
[0111]
电转2.5kv、5ms、20uf.
[0112]
电转加入0.9ml2yt培养基,37度培养1h,涂amp平板。
[0113]
取10ul梯度稀释,稀释涂小板,37度孵育过夜,结果如图1所示。
[0114]
挑噬菌体克隆,部分测序结果如序列seq id no:9
‑
21所示。
[0115]
实施例2肽库体内筛选
[0116]
筛选之前先通过预实验,确定小鼠脑部最佳富集噬菌体展示肽的时间,结果如图2所示。接种后24h噬菌体脑血比最高,表明在脑的富集程度最高。
[0117]
筛选方法如下:
[0118]
1、成年balb/c小鼠(18~22g),取噬菌体库tbs稀释到100ul/1011pfu,尾静脉注射,根据预实验在24h噬菌体在脑的富集脑血比最高。
[0119]
2、取24h时间点,5%的水合氯醛麻醉,小鼠保持无菌,心脏贯流100ml生理盐水,解剖取脑,将脑网状体匀桨超声打碎,离心,过0.45μm滤膜,取上清溶液与培养到对数期的er2738菌液混匀,37度感染培养4h。
[0120]
3、12000rpm离心20min,取菌液上清,用peg/nacl的方法富集噬菌体,将该富集的库用于下一轮的筛选。
[0121]
4、如上重复至少三轮。在看到输出噬菌体的滴度出现明显富集,可取噬菌体感染克隆,送测序分析展示多肽纳米抗体的序列。挑克隆测序,结果如表1:
[0122]
表1:克隆测序获得的高频序列
[0123]
labelsequencefrequencyno.m1tfyggrpkrnnflrgir3seq id no:5m2tfyggrvkrnnfalslw2seq id no:6m3tfyggrskrnnfpklhr2seq id no:7m4tfyggrrkrnnftavsa2seq id no:8
[0124]
实施例3动物体内验证
[0125]
1、肽的合成及荧光标记
[0126]
选取m1进行动物体内验证,将多肽序列tfyggrpkrnnflrgir(mw:2053)送多肽合成
公司进行合成多肽合成以及标记荧光纯化。得到超过95%纯度以上的纯度多肽。
[0127]
无标记多肽质谱检测结果如图3所示。肽分子量为1027.86*2
‑
2=2053.6,分子量符合。
[0128]
标记上cy5.5荧光多肽质谱检测结果如图4示。cy5.5标记上荧光分子量873.22*3
‑3‑
2053=564,为cy5.5荧光试剂反应后的分子量。说明m1短体连上一个荧光分子。
[0129]
2、荧光标记肽的体内检测
[0130]
连荧光分子短肽用于后续小鼠体内检测。准确称取连短肽,用生理盐水将其溶解,调整稀释连接荧光短肽,到荧光当量为5um,尾静脉注射裸鼠100ul,在不同时间点,利用ivis小动物活体成像系统分不同时间点观测成像(图5)。
[0131]
在尾静脉注射4h,可以明显观测到m1
‑
cy5.5在脑部富集。取小鼠,5ml/min的速度心脏贯流100ml生理盐水,洗掉血液中的荧光干扰,
[0132]
取小鼠脑,以及其他器官观察,可以看出脑部有明显荧光,且高于肌肉心脏等,脑\肌肉荧光比约为3:1(图6、7)。说明短肽能穿过血脑屏障的阻拦,具有高效的穿血脑屏障的能力,且比没有屏障的部位如肌肉富集量高。
[0133]
实施例4制备姜黄素
‑
戊二酸
‑
nhs活性酯
[0134][0135]
利用戊二酸作为连接子,以戊二酸酐和姜黄素(curcumin)的酚羟基缩合成酯相连接,其图谱见图8所示。再利用dcc(二环己基碳二亚胺)活化羧基,使nhs(n
‑
羟基琥珀酰亚胺)活性酯与羧基偶联,得到姜黄素
‑
戊二酸
‑
nhs活性酯,可以直接与蛋白/短肽的赖氨酸残基连接。经质谱确认,得到姜黄素
‑
戊二酸
‑
nhs活性酯产物。理论分子量:579,质谱峰1:580(m+h
+
),质谱峰2:602m+na
+
。
[0136]
实施例5 m1
‑
rgd
‑
cur的制备
[0137]
本实施例选用序列为tfyggrpkrnnflrgirsrgd的多肽(m1
‑
rgd),制备肽
‑
姜黄素,具体命名为m1
‑
rgd
‑
cur。
[0138]
将m1
‑
rgd与姜黄素
‑
戊二酸
‑
nhs活性酯以物质的量1:7.5混合,溶于dmf中,加入7.5倍当量的三乙胺作为碱,37℃反应3h。
[0139]
用高效制备液相色谱进行纯化,流动相为乙腈(0.1%甲酸)
‑
水(0.1%甲酸)梯度洗脱。色谱图及鉴定质谱图如图9所示。
[0140]
实施例6内耳富集效果评价
[0141]
取小鼠9只,按照3只/组随机分为3组,按照不同分组进行尾静脉注射:实验组,实施例5制备得到的m1
‑
rgd
‑
cur,给药量:以姜黄素计3mg/kg;对照组,姜黄素3mg/kg;空白组,等体积生理盐水。
[0142]
注射结束30min后处死小鼠,分离耳蜗组织,并在解剖显微镜下吸取耳蜗淋巴液
(同组小鼠混合于同一er管中收集),将所收集的不同组小鼠内耳淋巴液进行hplc检测分析,结果见图10所示。
[0143]
如图10所示,小鼠内耳淋巴液中cur标准品能够被有效检测(左上),而空白组小鼠内耳淋巴液中无姜黄素特异峰出现(左下),而单纯注射姜黄素的小鼠内耳淋巴液中未能检测到相关姜黄素特异峰(右上),表明单纯注射姜黄素后30min后内耳药物浓度未能达到检测基线;而m1
‑
rgd
‑
cur组内耳淋巴液中能够检测到比单纯姜黄素保留时间更短的姜黄素特征峰,经初步分析断定,该峰为linker
‑
cur特征峰,该结果充分证明,本发明涉及的内耳靶向载药系统(m1
‑
rgd
‑
cur)能够成功运载小分子化合物(以姜黄素为例)进入小鼠内耳淋巴液,并在进入后成功实现短肽与所装载活性分子的有效分离。
[0144]
进一步地,上述实验结论在大动物模型(滇南小耳猪)中进行了进一步验证,实验结果见图11所示。这表明本发明提供的载药系统具有广泛的适用性。
[0145]
实施例7治疗噪声性聋效果评价
[0146]
取初始听力正常的5周龄c57小鼠12只,按照3只/组随机分为4组,低剂量组、中剂量组和高剂量组所用药物为实施例2制备得到的m1
‑
rgd
‑
cur,对照组使用生理盐水。将各组小鼠置于爆震隔音屏蔽室中,连续2日进行120db窄带白噪声2h暴露处理后,于震后连续给药14天,给药剂量以姜黄素计分别为:低剂量组,1mg/kg/日;中剂量组,3mg/kg/日;高剂量组,9mg/kg/日;对照组,等体积生理盐水。给药方式为尾静脉注射。分别于震后4d、7d、14d,进行听觉脑干诱发电位(abr)测序,依据小鼠不同频率听阈变化情况,判断其听觉功能是否异常。
[0147]
abr测序结果见图12所示,abr数据统计分析结果见图13所示。根据图12可知,中剂量组m1
‑
rgd
‑
cur可叠加形成较好的脑干诱发电位波,听觉电位波分化相对清晰,而对照组及低剂量组的电位波杂乱且分化异常。如图13所示,依据上述abr数据进行听觉阈值判读后统计分析发现,m1
‑
rgd
‑
cur治疗4d后,各治疗组(低剂量组、中剂量组、高剂量组)听觉阈值显著低于对照组,震后7d及14d,中剂量组听觉阈值显著低于其他各组,表明m1
‑
rgd
‑
cur可计量性治疗神经性耳聋,并起到噪声暴露后的听觉保护作用。
[0148]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1