一种复合药物及其制备方法和用途
本发明属于制药技术领域,具体涉及一种复合药物及其制备方法和用途。
背景技术:
青蒿琥酯是利用中国特有的青蒿草为原料,提取其中的有效成分青蒿素后,经化学方法合成而制得,主要作用于疟原虫红内期的无性体,是目前已经发现的唯一能制成水溶性制剂的青蒿素有效衍生物。青蒿琥酯可以杀灭红细胞内期的疟原虫,达到抗疟作用,因此可以用于各类疟疾患者,尤其适用于抗氯喹和哌喹的恶性疟和凶险型脑型疟疾患者的救治,具有抗疟活性高、退热快、原虫转阴时间短、毒副作用小等特点,是治疗重症疟疾的首选药。同大多数青蒿素类药物一样,青蒿琥酯水溶性差、口服生物利用度低、药物半衰期短,其中静脉注射药物的半衰期短至30min。针对这些问题,现存的各种剂型如片剂、注射剂等都不能解决这个问题。
技术实现要素:
鉴于以上现有技术中存在的问题,本发明的目的在于提供一种复合药物及其制备方法和用途,用于解决现有技术中的问题。
为实现上述目的及其他相关目的,本发明是通过以下技术方案获得的。
本发明的目的之一在于提供一种复合药物,所述复合药物至少包括红细胞和青蒿琥酯,所述青蒿琥酯包载于所述红细胞内部。
优选地,所述红细胞包载青蒿琥酯的载药量为2mg/ml~20mg/ml红细胞。具体地,1ml的红细胞中含有109个红细胞。
更优选地,所述红细胞包载青蒿琥酯的载药量为5mg/ml~11mg/ml红细胞。
优选地,所述复合药物中红细胞表面还修饰有戊二醛。
优选地,所述红细胞为压积红细胞。本申请中优先采用去除血浆和血液中其他细胞和物质,如白细胞、血小板等对载药过程的影响的压积红细胞。
更优选地,所述压积红细胞的制备方法为:对动物取血,分离血清和白细胞,pbs离心洗涤后,得到所述压积红细胞。
进一步优先地,所述动物为哺乳动物,可以为啮齿类动物、灵长类动物。例如,可以为兔子、大鼠、羊、猴子。
进一步优先地,所述离心条件为:2℃~5℃,转速为3000r/min~5000r/min。具体地,转速为3800r/min。
本发明的目的之二在于提供上述所述复合药物的制备方法,所述方法为:采用低渗溶液以打开红细胞的膜孔来负载青蒿琥酯,再采用高渗溶液以封闭红细胞的膜孔来完成包覆,获得所述复合药物。
优选地,包括步骤如下:
1)将红细胞与含有青蒿琥酯的低渗溶液中,进行第一次孵育,得到红细胞混合液;
2)所述红细胞混合液与高渗溶液混合,进行第二次孵育,然后固液分离,得到所述复合药物。
更优选地,所述低渗溶液的渗透压为100mosm/l~130mosm/l。
更优选地,所述含有青蒿琥酯的低渗溶液中青蒿琥酯的含量为1mg/ml~10mg/ml。
更优选地,所述青蒿琥酯与红细胞的质量体积比为(16~80)mg:1ml。
进一步优选地,所述青蒿琥酯与红细胞的质量体积比为(30~50)mg:1ml。
更优选地,所述第一次孵育的温度为25℃~30℃。
更优选地,所述第一次孵育的时间为1s~30s。
进一步优选地,所述常温孵育的时间为5s~20s。
更优选地,所述高渗溶液的渗透压为1600mosm/l~2400mosm/l。
更优选地,所述高渗溶液与红细胞混合液的体积比为1:(4~20)。
进一步优选地,所述高渗液与红细胞混合液的体积比为1:(8~15)。
更优选地,所述第二次孵育的温度为25℃~30℃。
更优选地,所述恒温孵育的时间为10min~30min。
进一步优选地,所述低渗溶液为由碳酸氢钠溶于水形成;所述低渗溶液中,碳酸氢钠的含量为0.5wt%~0.6wt%。
进一步优选地,所述高渗溶液为由氯化钠、丙酮酸钠和葡萄糖溶于水形成;所述高渗溶液中,氯化钠的浓度为2.5wt%~5.5wt%,丙酮酸钠的浓度为1mg/ml~10mg/ml,葡萄糖的浓度为2mg/ml~20mg/ml。
优选地,再采用高渗溶液以封闭红细胞的膜孔来完成包覆后,还包括与戊二醛水溶液混合,孵育。
更优选地,所述戊二醛与红细胞的质量体积比为(50~100)μg:100μl。具体地,100μl的红细胞中含有108个红细胞。
更优选地,所述戊二醛水溶液的浓度为0.01%~0.10%。
更优选地,所述孵育的时间为5min~15min。
本发明的目的之三在于提供上述所述的复合药物在制备疟疾治疗药物或疟疾预防药物中的用途。
优选地,使用时,将所述复合药物经静脉注射给药。
与现有技术相比,本发明具有以下有益效果:
1)与天然红细胞相比,本发明制备的红细胞包载青蒿琥酯的复合药物在形态和/或渗透脆性都没有显著性差异;而经戊二醛修饰后的红细胞包载青蒿琥酯的复合药物,不仅形态没有变化,而且能明显提高红细胞对外界渗透压的抵抗力。
2)本发明的复合药物与传统青蒿琥酯注射剂相比,进入体内后能实现药物的缓慢释放,药效维持9天左右,具有明显的缓释作用,可以解决传统青蒿琥酯注射剂的血药浓度快速下降以及短时多次给药带来的副作用问题。
3)本发明制备得到的复合药物治疗疟疾时,小鼠的存活率达到了71.43%,此外,该药物在体内存活时间长,可起到预防疟疾发生的作用。
附图说明
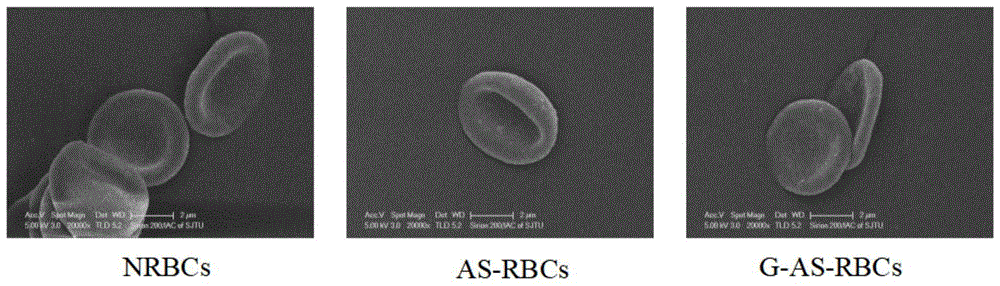
图1显示为本申请实施例5的g-as-rbcs、as-rbcs和nrbcs的sem图。
图2显示为本申请实施例6的g-as-rbcs和nrbcs的渗透脆性曲线图。
图3显示为本申请实施例7的g-as-rbcs在体内的存活率图。
图4显示为本申请实施例8的小鼠给药g-as-rbcs和as后,在体内药代动力学实验结果图。
图5显示为本申请实施例9的小鼠给药g-as-rbcs和as-rbcs后,不同时间在各组织中的荧光强度图。
图6显示为本申请实施例10的小鼠感染疟原虫3h后,分别给药g-as-rbcs和as后疟原虫抑制率和存活率图。
图7显示为本申请实施例11的小鼠分别给药g-as-rbcs和as后,经感染疟原虫后的存活率图。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
本申请实施例中,青蒿琥酯购买自国药集团化学试剂有限公司,含量是99%。
本申请实施例中,经戊二醛修饰的红细胞包载青蒿琥酯的复合药物标记为g-as-rbcs,天然红细胞标记为nrbcs,未经戊二醛修饰的红细胞包载青蒿琥酯的复合药物标记为as-rbcs,青蒿琥酯溶液标记为as;其中,青蒿琥酯溶液为由青蒿琥酯溶于生理盐水形成。
实施例1
本实施例中,制备压积红细胞,包括如下步骤:
取体重为200g左右的雄性sd大鼠,用直径0.5mm的毛细管进行后眼眶静脉丛取血,每次取血量为0.2ml-0.3ml。
然后于4℃,3800r/min下离心4min,弃上清,除去血浆和白细胞层,进一步加入1ml预冷的pbs洗涤1次-2次至上清接近无色,下层即得压积红细胞,备用。1ml的红细胞中含有109个红细胞。
实施例2
本实施例中,采用实施例1制备的压积红细胞,制备未经戊二醛修饰的红细胞包载青蒿琥酯的复合药物,并标记为as-rbcs,包括如下步骤:
(1)取0.1ml实施例1中制备的压积红细胞与1ml的含有青蒿琥酯的低渗溶液轻轻混匀,25℃孵育9s,得到红细胞混合液。其中,低渗溶液由碳酸氢钠溶于水形成,低渗溶液的渗透压为125mosm/l,碳酸氢钠的浓度为0.57wt%;含有青蒿琥酯的低渗溶液中,青蒿琥酯的浓度为4mg/ml。
(2)1ml的红细胞混合液中与0.1ml高渗溶液轻轻混匀,30℃孵育20min;然后于4℃、3800r/min、4min/次下离心,取上清液备用,沉淀用预冷的pbs于4℃、3800r/min、4min/次下离心洗涤3次,得到未经戊二醛修饰的红细胞包载青蒿琥酯的复合药物,并标记为as-rbcs。其中,高渗溶液由氯化钠、丙酮酸钠和葡萄糖溶于水形成,高渗溶液的渗透压为1700mosm/l,其中,氯化钠的浓度为5.5wt%,丙酮酸钠的浓度为5mg/ml,葡萄糖的浓度为10mg/ml。
本实施例中,as-rbcs中红细胞包载青蒿琥酯的载药量为6.56mg/ml红细胞。
实施例3
本实施例中,采用实施例1制备的压积红细胞,制备经戊二醛修饰的红细胞包载青蒿琥酯的复合药物,并标记为g-as-rbcs,包括如下步骤:
(1)取0.1ml实施例1中制备的压积红细胞与1ml的含有青蒿琥酯的低渗溶液轻轻混匀,25℃孵育9s,得到红细胞混合液。其中,低渗溶液由碳酸氢钠溶于水形成,低渗溶液的渗透压为125mosm/l,碳酸氢钠的浓度为0.57wt%;含有青蒿琥酯的低渗溶液中,青蒿琥酯的浓度为4mg/ml。
(2)1ml的红细胞混合液中与0.1ml高渗溶液轻轻混匀,30℃孵育20min;然后于4℃、3800r/min、4min/次下离心,取上清液备用,沉淀用预冷的pbs于4℃、3800r/min、4min/次下离心洗涤3次,得到未经戊二醛修饰的红细胞包载青蒿琥酯的药物。其中,高渗溶液由氯化钠、丙酮酸钠和葡萄糖溶于水形成,高渗溶液的渗透压为1700mosm/l,其中,氯化钠的浓度为5.5wt%,丙酮酸钠的浓度为5mg/ml,葡萄糖的浓度为10mg/ml。
(3)取0.1ml步骤(2)获得的未经戊二醛修饰的红细胞包载青蒿琥酯的药物,与0.1ml0.05wt%的戊二醛水溶液,混匀,30℃孵育10min;然后于4℃、3800r/min、4min/次下离心1次,取上清液备用,沉淀用预冷的pbs于4℃、3800r/min、4min/次下离心洗涤3次,即得经戊二醛修饰的红细胞包载青蒿琥酯的复合药物,标记为g-as-rbcs。
本实施例中,g-as-rbcs中红细胞包载青蒿琥酯的载药量为6.56mg/ml红细胞。
实施例4
本实施例中,考察不同浓度低渗溶液、不同浓度青蒿琥酯对载药量的影响,步骤均同实施例3。
载药量试验的步骤为:将实施例3中步骤(2)和(3)中的上清液混合,吸取0.2ml混合后的上清液,加入1ml甲醇混匀,12000r/min离心10min,取上清液用0.22μm一次性滤膜过滤后,高效液相色谱仪进样,测定上清液中游离青蒿琥酯的含量。载药量=加入的青蒿琥酯总量-上清液中游离青蒿琥酯含量。
其中高效液相色谱仪的测定条件为:色谱柱:agilentxb-c18(5μm,4.6×250nm);检测器:agilenttechnologic紫外检测器;流动相:乙腈-0.01mol/l磷酸盐缓冲液(44:56);流速:1ml/min;柱温:30℃;检测波长:210nm;进样量:20μl。
不同浓度低渗溶液对载药量的研究:低渗溶液的浓度、渗透压以及载药量见下表1:
表1
不同浓度青蒿琥酯对载药量的试验:青蒿琥酯的低渗溶液中,青蒿琥酯的浓度及载药量见下表2:
表2
经研究发现,低渗溶液对载药量的试验中,载药量为5.2mg/ml~6.7mg/ml红细胞;青蒿琥酯的浓度对载药量的试验中,载药量为2.3mg/ml~11.0mg/ml红细胞。
实施例5
本实施例,通过sem观察实施例2的as-rbcs、实施例3的g-as-rbc以及nrbcs的形貌,包括如下步骤:
1)将洁净的盖玻片放在铬明矾溶液中蘸一下取出,再放于37℃烘箱中烘干。
2)分别取0.1ml的g-as-rbcs、as-rbcs和nrbcs各加10mlpbs得到稀释液,再分别吸取0.5mlg-as-rbcs的稀释液、as-rbcs的稀释液和nrbcs的稀释液加入到ep管中,加入0.5ml2.5%戊二醛固定30min,于4℃、3800r/min离心去除上清液。用系列梯度乙醇(30%、50%、70%、80%、90%、95%、100%)脱水,每种浓度乙醇通过1次,其中100%乙醇通过2次,每次5min,每次1ml,离心速度3800r/min。最后用醋酸异戊酯置换脱水30min。用毛细管吸2滴滴在干净的载玻片上,铺展开,通风橱内挥干,镀金等待观测。
图1结果显示,g-as-rbcs、as-rbcs和nrbcs形态没有显著性差异,都是双面凹的圆饼状。
实施例6渗透脆性试验
本实施例,采用实施例3制备的g-as-rbcs进行渗透脆性试验,包括如下步骤:
用1%氯化钠溶液和超纯水配制一系列不同渗透压的氯化钠溶液,如表3所述。取10份0.1ml的g-as-rbcs,分别与1ml不同渗透压的氯化钠溶液混合,于4℃静置2h后,在4℃、3800r/min离心5min,取上清0.1ml加入到96孔板中,每份样品设置3个平行孔,用酶标仪测定各样品孔在540nm处的吸光度。按照以下公式计算溶血率,以渗透压为横坐标,溶血率为纵坐标,绘制渗透脆性曲线。平行试验3次,nrbcs的渗透脆性测定方法与此相同。
其中:a540=各样品孔在540nm处的吸光度;
a540(308)=0.9%nacl(渗透压为308mosml-1)与红细胞孵育组的样品孔在540nm处的吸光度;
a540(0)=水(渗透压为0)与红细胞孵育组的样品孔在540nm处的吸光度。
表3
从图2可知,相比于nrbcs,g-as-rbcs的渗透脆性曲线显著下移,说明戊二醛修饰后可以明显提高红细胞对外界渗透压的抵抗力。
实施例7体内循环寿命的研究
本实施例,采用实施例3制备的g-as-rbcs在小鼠体内进行体内循环寿命试验,包括如下步骤:
将200g左右的sd雄性大鼠6只分为2组,每组3只,一组为天然红细胞组,记为nrbcs组;另一组为经戊二醛修饰的红细胞包载青蒿琥酯的复合药物组,记为g-as-rbcs组。各组大鼠分别于眼眶取血0.7ml,于转速为3800r/min下离心4min,收集血浆,放置在冰上。沉积细胞再用pbs洗1-2次,然后加入100倍体积的浓度为15μg/ml的biotin试剂,振荡孵育30min,离心弃除上清,再用含有甘氨酸的pbs(100mmgly)洗2次。最后用自体血浆重悬,尾静脉注射0.7ml至原大鼠体内。
分别在5min、1h、3h、5h、8h、24h、3d、5d、7d和9d进行大鼠眼眶取血,取血量为50μl,经离心分离血清和白细胞后用pbs洗涤,得到压积红细胞。然后取10μl压积红细胞与0.5mlpbs混合,再加入50μlfitc-链霉亲和素工作液(储备液稀释10倍制得,浓度为10μg/ml),避光振荡孵育30min。离心去掉上清液,再用pbs洗2次。取1mlpbs加入流式管中,每个流式管加入对应的压积红细胞1μl-2μl。用流式细胞仪检测各管平均荧光强度(mf,meanfluorescence),以各组5min的平均荧光强度对应100%存活率,计算各个时间点载药细胞的存活率,以时间为横坐标,绘制存活曲线。
从图3可知,nrbcs组的天然红细胞回输到大鼠体内后,在前24h内几乎没有被清除,半寿命t50大约为7天;而g-as-rbcs组的g-as-rbcs的清除率达到30%左右,t50大约为5天。红细胞回输到大鼠体内9天后,nrbcs组和g-as-rbcs组的存活率分别为38.53%和22.31%,说明g-as-rbcs进入大鼠体内后存活时间至少为9天,具有长循环的潜力。
实施例8体内药代动力学研究
本实施例,采用实施例3制备的g-as-rbcs在小鼠体内进行药代动力学试验,包括如下步骤:
200g左右的sd雄性大鼠6只分为2组,每组3只,一组为as组,另一组为g-as-rbcs组。每组大鼠经尾静脉注射青蒿琥酯溶液或g-as-rbcs,其中青蒿琥酯的有效含量均为1.5mg。
注射完成后,分别在5min、15min、30min、1h、2h、4h、8h、12h、1d、1.5d、2d、4d、6d、8d和10d对各组大鼠眼眶取血,每次取血量0.2ml左右。将采血样品离心收集血浆80μl,再加入10μl的1μg/ml青蒿素溶液(作为内标参照物),混匀后再加入410μl甲醇沉淀蛋白,涡旋1min混合均匀,12000r/min离心10min,用uplc-ms/ms检测收集的上清液。
从图4可知,as组的药物血浆半衰期平均为0.035天,给药12h后,血浆中几乎检测不到青蒿琥酯和双氢青蒿素(dha);而g-as-rbcs组呈现出明显的缓释作用,药物血浆半衰期为3.73天,在给药后第8天仍然能在血浆中检测到血药浓度,说明本申请制备的g-as-rbcs可以实现青蒿琥酯在体内的缓慢释放。
实施例9体内肝靶向研究
本实施例,采用实施例2制备的as-rbcs和实施例3制备的g-as-rbcs进行体内肝靶向试验,包括如下步骤:
将20g左右的km雄性小鼠45只分为3组,每组15只,第一组为生理盐水组,第二组为as-rbcs组,第三组为g-as-rbcs组。在给药前,将g-as-rbcs和as-rbcs分别以1:1的比例加入20μg/mldir碘化物溶液,避光静置20min后,于4℃、3800r/min离心4min,pbs洗涤2次后,以1:1的比例加入血浆,获得dir碘化物标记的as-rbcs和dir碘化物标记的g-as-rbcs。生理盐水组经尾静脉注射0.2ml生理盐水,g-as-rbcs组的小鼠经尾静脉注射0.2ml的dir碘化物标记的as-rbcs,as-rbcs组的小鼠经尾静脉注射0.2ml的dir碘化物标记的g-as-rbcs。
注射完成后,分别在0d、1d、3d、5d和7d从各组小鼠中随机取出3只用co2窒息处死后,解剖出心、肝、脾、肺、肾,称重后加入3倍量生理盐水,在全自动组织研磨仪中研磨后,在12000r/min下离心10min,收集上清于96孔板中,用酶标仪检测。
从图5可知,g-as-rbcs组各个时间点在肝脏的平均荧光强度极显著性高于as-rbcs组;第1天时,g-as-rbc组的平均荧光强度为228.00,显著高于as-rbcs组的155.67(p<0.05),证明经戊二醛修饰后的载药红细胞肝靶向性明显增强。
实施例10体内疟疾治疗研究
本实施例,采用实施例3制备的g-as-rbcs进行疟疾治疗试验,包括如下步骤:
将20g左右的km雄性小鼠20只分为4组,每组5只,分别为阴性对照组、阳性对照组、青蒿琥酯溶液组即as组、g-as-rbcs组。除阴性对照组外,其余各组的每只小鼠进行染虫,具体为经腹腔注射0.2ml稀释后的含虫血(每1ml含5×107个疟原虫感染的红细胞)。
染虫3h后,分别对各组进行尾静脉给药,阴性对照组的小鼠经尾静脉注射0.2ml生理盐水,阳性对照组的小鼠经尾静脉注射0.2ml生理盐水,as组的小鼠经尾静脉注射0.2ml的6mg/ml青蒿琥酯溶液,g-as-rbcs组的小鼠经尾静脉注射0.2ml的g-as-rbcs。
疟疾治疗试验:于染虫后第5天经尾静脉取血,涂制薄血膜,甲醇固定,瑞氏-吉姆萨混合染色法染色,10×100显微镜下观察。随机计数5个视野,并且红细胞总数大于1000个,按照疟原虫抑制率公式计算疟原虫的抑制率(如果连续随机查看50个视野后均未发现疟原虫无性体,则认为是阴性),同时统计各组小鼠的存活率。
从图6可知,感染疟原虫5天后,as组的抑制率为43.98%,g-as-rbcs组的抑制率为61.21%。对于各组小鼠的存活率,在感染后第14天时,as组的存活率为34.29%,g-as-rbcs组的存活率为71.43%,说明,本申请的复合药物由于其长效缓释、疾病响应等特点极大增强了对疟原虫的杀灭作用,且戊二醛修饰后的载药红细胞,可以将药物富集于肝脏,进一步杀死感染集体后处于潜伏期的疟原虫。
实施例11体内疟疾预防研究
本实施例,采用实施例3制备的g-as-rbcs进行疟疾预防试验,包括如下步骤:
将20g左右的km雄性小鼠15只分为3组,每组5只,分别为阳性对照组、青蒿琥酯溶液组即as组、g-as-rbcs组。阳性对照组的小鼠经尾静脉注射0.2ml生理盐水,as组的小鼠经尾静脉注射0.2ml的6mg/ml青蒿琥酯溶液,g-as-rbcs组的小鼠经尾静脉注射0.2ml的g-as-rbcs,各组小鼠注射结束,然后进行染虫试验。染虫试验的具体操作为每组的每只小鼠经腹腔均注射0.2ml稀释后的含虫血(每1ml含5×107个疟原虫感染的红细胞)。统计各组小鼠的存活率。
从图7可知,疟原虫感染后,as组的平均存活天数为6天,g-as-rbcs组的平均存活天数为10天,小鼠的存活时间有一定的延长,说明由于g-as-rbcs可以在体内长时间维持有效血药浓度,能将感染机体后处于潜伏期的疟原虫杀灭,而起到一定的预防作用。
综上,本申请实施例将青蒿琥酯包载于红细胞内,并用戊二醛进行修饰红细胞外表面,制得用于疟疾防治和治疗的肝靶向的复合药物,并对载药量和形态进行表征。进一步,通过体内循环寿命实验、体内药代动力学实验、体内肝靶向实验、体内疟疾治疗实验、体内疟疾预防实验考察了该给药药物的作用。结果表明,as-rbcs、g-as-rbcs与nrbcs的形态基本一致,都呈现出中央双凹的圆盘状。g-as-rbcs的渗透脆性曲线显著下移,表明,经戊二醛修饰后可以明显提高载药红细胞对抗外界渗透压的能力。g-as-rbcs进入体内后能实现药物的缓慢释放,药效维持9天左右。该复合药物能实现青蒿琥酯的缓慢释放,可以解决传统青蒿琥酯注射剂血药浓度快速下降以及短时多次给药带来的副作用的问题。小鼠经给药g-as-rbcs用于治疗疟疾,小鼠存活率达到了71.43%;g-as-rbcs可延长疟原虫感染的小鼠的存活时间,证明本申请制备的药物对于疟疾有很好预防效果,其对疟疾强的预防和治疗效果,大概原因是疟原虫最初发生在肝脏,而申请经戊二醛修饰后的复合药物具有肝靶向功能,此外,疟原虫可能先攻击复合药物中的红细胞,释放青蒿琥酯,从而杀灭疟原虫。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!