牙髓间充质干细胞在脓毒症治疗中的应用的制作方法
1.本发明涉及医药领域,特别是涉及牙髓间充质干细胞在脓毒症治疗中的应用。
背景技术:
2.脓毒症(sepsis)是细菌、病毒等微生物感染诱发的全身炎症反应综合征(systemic inflammatory response syndrome,sirs),严重时可诱发感染性休克(septic shock)和多器官功能障碍综合征(multiple organ dysfunction syndrome,mods),己经成为危重症患者的主要死亡原因之一。脓毒症的并发症是脓毒症病理生理各阶段过程中的临床表现,常见的并发症包括休克、急性肺损伤(ali)、急性呼吸窘迫综合症(ards)、深静脉血栓(dvt)形成、应激性溃疡、代谢性酸中毒、弥漫性血管内凝血(dic)直至多器官功能障碍综合征(mods)。
3.欧洲一项临床流行病学调查研究发现,在2527例全身炎症反应患者中,脓毒症、严重脓毒症和感染性休克发病率分别为26%、18%和4%,病死率分别达到16%、20%和46%。我国每年脓毒症病人大约有300万~400万例,死亡人数超过100万人,北京协和医院的一项前瞻性调查研究显示,脓毒症发病率为15.7%,其中61.1%进展为多器官功能障碍综合征,病死率高达30.6%。随着我国逐渐步入老龄化社会,特别是伴有慢性阻塞性肺疾病、糖尿病、获得性免疫缺乏综合症(acquired immune deficiency syndrome,aids)、器官移植术后、口服免疫抑制剂等免疫力低下的人群,脓毒症发病率将进一步增高。脓毒症因其高病死率仍然是目前面临的重大难题,脓毒症发病机制的研究日益受到关注。尽管随着多个脓毒症治疗指南的推出,伴有感染性休克的早期治疗已经取得不少进展,但是人们对败血症时迟发的脏器功能障碍的发病机制仍知之甚少。
4.自1992年脓毒症1.0定义的提出至2016年脓毒症3.0定义的更新,对于脓毒症的理解从以感染诱导的过度炎症反应发展到机体对于感染的异常应答及器官功能障碍,炎症反应的失衡及免疫功能紊乱是脓毒症发生、发展的主要机制,亦与脓毒性休克的发生密切相关。脓毒症以机体炎症路径的血管内激活为特征,通过该路径强有力的炎症介质释放入血,进而引起感染性休克,连续的多器官功能衰竭与不良临床结果和高死亡率相关。肝脏是人体重要的内脏器官,有合成、分解、解毒和免疫等多种代谢功能,在脓毒症诱发的多器官功能障碍中,肝脏是脓毒症最常累及的重要器官之一,也经常是最早受累的器官。研究表明对于脓毒症确诊患者及时进行干预可以明显改善预后,并且病死率显著下降。目前临床上判断感染的一般指标有:临床表现、血液白细胞计数和胸部x线片等,但是这些指标对于脓毒症的判断缺乏特异性;尤其部分危重患者并不存在感染,例如严重创伤、大手术、烧伤和急性胰腺炎,这些患者也可以表现为全身炎症反应综合征(sirs),但与真正脓毒症患者在治疗和预后上明显不同。此外,怀疑感染部位的分泌物和血液培养是诊断脓毒症的主要依据,但是培养结果需要2
‑
3天的时间,不能及时诊断,部分患者使用抗生素后或者留取培养标本时操作不规范都有可能导致培养结果的假阴性,出现漏诊,在实际临床上,将近30%的感染患者是没有明确的微生物结果的。及时有效治疗多器官功能损伤是脓毒症治疗的关键,但
是脓毒症多器官功能障碍的发生涉及到多种机制,这就给治疗带来了复杂性和挑战性。
5.干细胞是一类具有自我复制的多潜能细胞,间充质干细胞则是其中被认为最具有医学价值的干细胞种类。间充质干细胞(mesenchymal stem cells,msc)作为间质起源的非造血干细胞,其存在于多种人体组织,如骨髓(bone marrow,bm),脐带(umbilical cord,uc)、脐带血(umbilical cord blood,ucb)、脂肪组织(adipose tissue,at)、牙髓(dental pulp、dp)和皮肤。根据不同的组织来源及分离培养方法,msc由一大类特征和功能各异的细胞亚型所组成。msc对于主要组织相容性复合体(major histocompatibility complex,mhc)i类分子的表达水平较低,并且不表达mhc ii类分子和共刺激因子(cd80、cd86、cd40),因而其免疫原性低,移植排斥风险小。
技术实现要素:
6.鉴于以上所述现有技术的缺点,本发明的目的在于提供牙髓间充质干细胞在脓毒症治疗中的应用,用于解决现有技术中的问题。
7.为实现上述目的及其他相关目的,本发明提供牙髓间充质干细胞在制备药物中的用途,所述药物用于治疗全身炎症反应综合征相关疾病。
8.在本发明一些实施方式中,所述牙髓间充质干细胞来源于牙齿,优选来源于乳牙。
9.在本发明一些实施方式中,所述牙髓间充质干细胞来源于人。
10.在本发明一些实施方式中,所述药物用于治疗微生物相关的全身炎症反应综合征相关疾病。
11.在本发明一些实施方式中,所述微生物选自细菌、病毒中的一种或多种的组合。
12.在本发明一些实施方式中,所述药物用于治疗内脏损伤相关的全身炎症反应综合征相关疾病。
13.在本发明一些实施方式中,所述内脏损伤包括内脏细胞凋亡水平上升。
14.在本发明一些实施方式中,所述内脏损伤选自肝脏损伤、肾脏损伤、肺损伤、肠损伤、脾脏损伤中的一种或多种的组合。
15.在本发明一些实施方式中,所述肝脏损伤包括炎性细胞浸润、肝索紊乱中的一种或多种的组合;
16.和/或,所述肾脏损伤包括炎性细胞浸润、球囊间隙变窄、肾小管上皮细胞水肿、空泡变性中的一种或多种的组合;
17.和/或,所述肺损伤包括肺泡消失或融合、肺泡壁明显水肿增厚、间质淤血、炎性细胞浸润中的一种或多种的组合;
18.和/或,所述肠损伤包括肠壁变薄、黏膜萎缩、绒毛结构模糊、上皮坏死脱落中的一种或多种的组合。
19.在本发明一些实施方式中,所述全身炎症反应综合征相关疾病为脓毒症。
附图说明
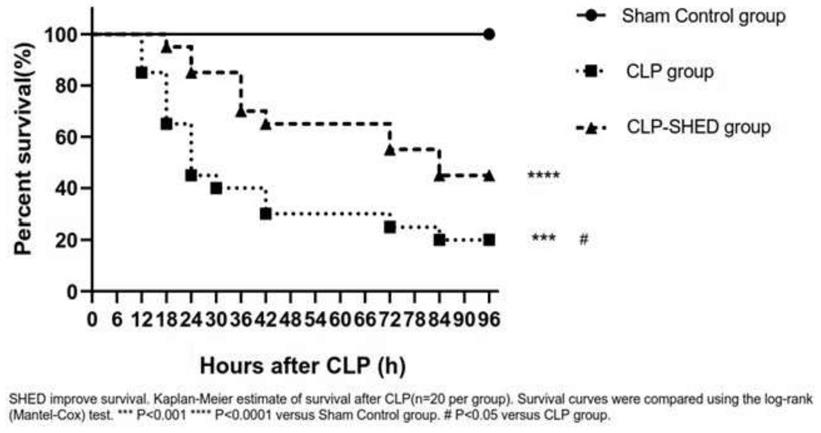
20.图1显示为本发明实施例2中各组小鼠术后生存率曲线示意图。
21.图2显示为本发明实施例2中各组小鼠脾脏组织菌落计数示意图。
22.图3显示为本发明实施例2中各组小鼠血生化指标示意图。
23.图4显示为本发明实施例2中各组小鼠血清中细胞因子水平示意图。
24.图5显示为本发明实施例2中各组小鼠术后肝、肾、肺、肠组织病理学变化(he染色)示意图。
25.图6显示为本发明实施例2中各组小鼠术后肝、肾、肺、脾组织细胞凋亡水平变化(tunel)示意图。
26.图7显示为本发明实施例2中各组小鼠术后肾、肺、脾组织tunel法检测图片示意图。
具体实施方式
27.为了使本发明的发明目的、技术方案和有益技术效果更加清晰,以下结合实施例对本发明进行进一步详细说明,熟悉此技术的人士可由本说明书所揭露的内容容易地了解本技术发明的其他优点及功效。
28.本发明第一方面提供牙髓间充质干细胞在制备药物中的用途,所述药物用于治疗全身炎症反应综合征相关疾病。牙髓间充质干细胞是一种来源于牙髓的间充质干细胞,是机体中一种重要的间充质干细胞种类,牙髓组织位于牙齿内部的牙髓腔内,通常是牙体组织中唯一的软组织。牙髓间充质干细胞是一种与骨髓间充质干细胞有着极其相似的免疫表型及形成矿化结节能力的细胞,细胞中形态通常呈梭形,可以自我更新和/或多向分化,通常有着较强的克隆能力。本发明发明人经过大量实践研究,意外发现牙髓间充质干细胞移植对脓毒症具有良好的治疗效果,在动物模型实验中,被施用牙髓间充质干细胞的小鼠的生存率、生化指标等受到明显改善,从而验证了牙髓间充质干细胞可以被用于制备治疗相关疾病的药物。
29.上述用途中,牙髓间充质干细胞可以来源于牙齿,更具体可以来源于乳牙(例如,儿童脱落乳牙等)。牙髓间充质干细胞作为机体的重要间充质干细胞成员,其可以存在于恒牙、或乳牙的牙髓组织中,与其他来源间充质干细胞相比,牙髓来源的间充质干细胞具有其独特的性质,它的异质性低、增殖迅速、型别稳定并无成瘤现象。
30.上述用途中,药物通常可以用于治疗微生物相关的全身炎症反应综合征相关疾病,更具体可以是脓毒症等。脓毒症是一种全身炎症反应综合征(systemic inflammatory response syndrome,sirs),其通常可以由微生物(例如,细菌、病毒等)诱发的疾病。通过本发明实施例可知,脓毒症小鼠模型中有着明显的细菌感染(例如,大肠埃希氏菌和/或弗氏柠檬酸杆菌等),且炎症相关因子il
‑
6、il
‑
10、mcp
‑
1、tnfα的表达情况与正常小鼠存在明显差异。而通过施用牙髓间充质干细胞,可以有效降低脓毒症模型小鼠的细菌感染状况,还可以降低脓毒症模型炎症相关因子表达水平。
31.上述用途中,牙髓间充质干细胞通常与受试者可以是同源的,或者可以来源于人。
32.上述用途中,全身炎症反应综合征相关疾病、或脓毒症,通常可以与内脏损伤相关,其表现形式可以为内脏细胞的凋亡水平上升。通过本发明实施例可知,脓毒症小鼠模型中血生化指标(例如,尿素氮、肌酐、天冬氨酸转氨酶、丙氨酸氨基转移酶、和胆红素等)相对于正常小鼠有着明显的变化,且he病理检测显示内脏组织存在明显的病理改变,从而说明脓毒症小鼠模型中存在明显的内脏损伤。具体的内脏损伤种类可以是例如,肝脏损伤、肾脏损伤、肺损伤、肠损伤、脾脏损伤等中的一种或多种的组合。再例如,肝脏损伤可以表现为炎
性细胞浸润、肝索紊乱等中的一种或多种的组合。再例如,肾脏损伤可以表现为炎性细胞浸润、球囊间隙变窄、肾小管上皮细胞水肿、空泡变性等中的一种或多种的组合。再例如,肺损伤可以表现为肺泡消失或融合、肺泡壁明显水肿增厚、间质淤血、炎性细胞浸润等中的一种或多种的组合。再例如,肠损伤可以表现为肠壁变薄、黏膜萎缩、绒毛结构模糊、上皮坏死脱落等中的一种或多种的组合。而通过施用牙髓间充质干细胞,可以有效干预内脏组织的凋亡细胞数量,减轻内脏组织的细胞凋亡的程度、保护受损器官。
33.本发明第二方面提供一种组合物,所述组合物包括牙髓间充质干细胞。
34.上述组合物中,还可以包括至少一种药学上可接受的载体,其通常指用于给药的载体,它们本身不诱导产生对接受该组合物的个体有害的抗体,且给药后没有过分的毒性。这些载体是本领域技术人员所熟知的,例如,在remington’s pharmaceutical sciences(mack pub.co.,n.j.1991)中公开了关于药学上可接受的载体的相关内容。具体来说,所述载体可以是包括但不限于盐水、缓冲液、葡萄糖、水、甘油、乙醇、佐剂等中的一种或多种的组合。本发明中,“个体”通常包括人类、非人类的灵长类,如哺乳动物、狗、猫、马、羊、猪、牛等。
35.本技术第三方面提供一种治疗方法,包括:向个体施用有效量的上述牙髓间充质干细胞、或本技术第二方面所提供的组合物。所述“有效量”通常指一用量在经过适当的给药期间后,能够达到欲求的效果,例如,造影、治疗疾病等。
36.本发明利用来源于脱落乳牙的牙髓间充质干细胞移植对脓毒症进行有效的治疗,不仅具有良好的疗效,还具有优良的安全性,具有良好的产业化前景。
37.下面通过实施例对本技术予以进一步说明,但并不因此而限制本技术的范围。
38.实施例1
39.牙髓间充质干细胞培养及注射液制备:
40.1.牙髓干细胞原代培养
41.将牙髓从髓腔中取出,经过无菌处理后,将牙髓切割成小块后放入无菌ep管中,再向ep管中加入消化酶,然后放入37摄氏度培养箱中消化15
‑
20分钟。
42.将消化后的牙髓组织块加入到干细胞完全培养基,充分吹打均匀,制成单细胞悬液。
43.将牙髓组织块悬液接种培养瓶中,置于37摄氏度,5%co2培养箱中培养10
‑
15天。
44.2.传代培养
45.吸出培养瓶中的培养基,消化贴壁细胞,加入完全培养基吹打成细胞悬液,按照传代比例将细胞接种于培养瓶中;按照此方法制备p2代种子库细胞。
46.3.细胞制剂制备
47.复苏p2代牙髓间充质干细胞种子库细胞,培养基成分为90%α
‑
mem和10%fbs,细胞生长至90%汇合率时进行传代,传代4次后得到p6代的牙髓间充质干细胞;细胞生长至80~90%汇合率时用0.25%胰蛋白酶消化收获细胞,经过生理盐水洗涤后,进行细胞计数,根据计数结果用生理盐水重悬细胞并调整细胞密度,将细胞注射液置于冰上保存,并于12h内使用。
48.实施例2
49.shed(乳牙牙髓干细胞,stem cells from human exfoliated deciduous teeth)
注射在脓毒症模型小鼠中疗效研究:
50.实验中所使用的小鼠信息具体如下:c57bl/6小鼠,8
‑
10周龄,spf级,常州卡文斯实验动物有限公司,许可证号scxk(苏)2016
‑
0010,实验涉及的所有动物处理内容均遵从实验动物实验管理和动物福利相关条例和法规。
51.小鼠饲养环境条件标准符合中华人民共和国国标gb14925
‑
2010,自动控制全新风中央空调系统,温度:20
‑
26℃(日温差≦4℃),湿度:相对湿度40
‑
70%,光照:人工照明12小时明暗交替。
52.饲料给料方法为自由摄取(试验有特殊要求时除外),营养成分检测由饲料供应商每批提供检测报告,常规营养成分指标:粗蛋白、粗脂肪、粗纤维、粗灰分、水分、钙和磷,饮水种类为实验动物饮用水(自来水高压灭菌),供水方法为饮水瓶盛装,自由摄取。
53.1)建立小鼠脓毒症模型:
54.分组:将上述健康成年c57小鼠67只,至饲养环境适应一周后用于建模,期间12/12(小时)光/暗周期,自由取食、正常饮水。小鼠随机分为3组,对照组(clp模型组)和干预组每组各25只,假手术组每组17只(每组中12只用于观察存活率,其余用于血液、组织样品采集)。
55.手术前12小时禁食,正常饮水。术前以10%(w/v)水合氯醛(400mg/kg体重)腹腔注射麻醉;
56.第一组,假手术组,于时间点0h进行腹部切开、缝合操作;
57.第二组,对照组(clp模型组),于时间点0h进行腹部正中切口1.5cm,1号丝线结扎盲肠根部,18号穿刺针穿刺盲肠2次,挤出少量肠内容物,盲肠纳还腹腔,逐层缝合;术后即刻颈背部皮下注射预热的氯化钠注射液1ml进行补液复苏;
58.第三组,牙髓间充质干细胞干预组,建模过程同上。
59.小鼠送返饲养笼,正常取食、饮水。
60.2)牙髓间充质干细胞注射治疗
61.对照组(clp模型组),造模手术后30min尾静脉注射生理盐水200ul;
62.牙髓间充质干细胞干预组,造模手术后30min尾静脉注射200ul牙髓间充质干细胞注射液(1*106cells);
63.小鼠送返饲养笼,正常取食、饮水;
64.3)生存率研究:
65.生存率:各组随机选择12只小鼠,分别于造模后48小时内,每6小时观察一次;造模后48h至96小时,每12小时观察一次,定时观察小鼠存活情况,并绘制存活曲线,比较各组动物生存率差异,结果如图1所示。
66.由图1可知,与假手术组(sham)相比,脓毒症对照组(clp模型组)小鼠生存率降至20%,而牙髓间充质干细胞干预组(shed治疗组)术后96小时生存率由20%上升至45%,差异有统计学意义。
67.该结果提示shed治疗可提高脓毒症模型小鼠的生存率。
68.4)机制研究:
69.a)取样:
70.细胞输注后24h,以10%(w/v)水合氯醛(400mg/kg体重)腹腔注射麻醉各组剩余小
鼠,分别经心脏穿刺获取全血(0.8
‑
1ml),置于抗凝管中并做好标记,置于冰上;
71.分别解剖获取肺、肝、肾、小肠,各器官组织置于4%多聚甲醛4℃固定过夜;
72.分别解剖获取脾脏,分为二份,一份置于4%多聚甲醛4℃固定过夜,另一份进一步进行如下处理;
73.b)脾脏组织菌落计数:
74.取步骤a中各组每只小鼠的新鲜脾脏组织,各称取100mg,无菌条件下以1ml pbs匀浆,匀浆液以10倍梯度稀释培养100mm于麦康凯琼脂(北京华越洋生物,货号gx752
‑
250g)培养板上,37℃培养24h,计数各样品菌落数,并进行统计,结果如图2所示;
75.由图2可知,clp模型组大肠埃希氏菌/弗氏柠檬酸杆菌计数显著高于假手术,牙髓间充质干细胞干预组(shed治疗组)大多数小鼠脾脏组织菌落计数有显著降低,该结果提示shed治疗可降低脓毒症模型小鼠的菌落感染。
76.c)血生化检测:
77.取步骤a中各组每只小鼠的抗凝血样,离心后收集血清,部分血清以生化分析仪器检测尿素氮、肌酐、天冬氨酸转氨酶、丙氨酸氨基转移酶、和胆红素,结果如图3所示;
78.由图3可知,clp术后24h,脓毒症模型小鼠(clp模型组)血液中谷丙转氨酶(alt)、谷草转氨酶(ast)、总胆红素(tbil)、尿素氮(bun)、肌酐(crea)的生化指标较假手术组升高;给予shed治疗后,牙髓间充质干细胞干预组各项生化指标都有降低,该结果提示shed治疗可减轻脓毒症模型小鼠的肝脏及肾脏损伤情况。
79.d)细胞因子检测:
80.部分血清以bd cba流式液相多重蛋白定量技术(bd,mouse inflammation kit,货号552364)同时检测炎症相关因子il
‑
6、il
‑
10、mcp
‑
1、ifn
‑
γ、tnfα的表达情况,结果如图4所示;
81.由图4可知,与假手术组相比,脓毒症对照模型组(clp模型组)血清il
‑
6、il
‑
10、mcp
‑
1、tnf
‑
α水平增高,差异有统计学意义;与对照模型组相比,牙髓间充质干细胞干预组(shed治疗组)il
‑
6、il
‑
10、mcp
‑
1、tnf
‑
α水平降低,差异有统计学意义,该结果提示shed输注治疗可降低脓毒症模型全身炎症水平。
82.e)组织he病理检测:
83.取步骤a中各组每只小鼠多聚甲醛固定组织,进行冰冻(或石蜡)切片,he染色观察个组织病理改变,结果如图5所示;
84.由图5可知,术后24小时,假手术组小鼠肝脏未见明显异常,clp模型组可见大量炎性细胞浸润、肝索紊乱等改变,经shed治疗(牙髓间充质干细胞干预组),上述肝组织病理改变明显减轻。
85.假手术组小鼠肾小球、肾小管结构完整,clp模型组肾小球毛细血管扩张、充血,有炎性细胞浸润,球囊间隙变窄,肾小管上皮细胞水肿、空泡变性,经移植shed(牙髓间充质干细胞干预组),肾组织病理损伤有明显改善。
86.假手术组小鼠肺组织未见异常,pbs组肺泡结构受破坏,正常肺泡消失或融合,肺泡壁明显水肿增厚,间质淤血并有大量炎性细胞浸润,而shed组(牙髓间充质干细胞干预组)上述肺组织病理改变有明显减轻。
87.假手术组小肠黏膜形态正常,各层解剖结构完整,绒毛排列整齐;clp模型组肠壁
明显变薄,黏膜萎缩,绒毛结构模糊,上皮坏死脱落;shed治疗组(牙髓间充质干细胞干预组)小肠黏膜病理改变较脓毒症组明显减轻,肠壁结构完整,小肠绒毛结构破坏相对较轻。
88.组织病理检查结果显示,shed治疗后脓毒症小鼠受损的肝、肾、肺、肠组织结构得到修复。结果充分说明,shed对脓毒症时受损的肝、肾、肺、小肠器官有保护作用。
89.f
‑
)tunel荧光染色检测组织细胞凋亡
90.tunel法荧光染色(terminal deoxynucleotidyl transferase dutp nick end labeling),分析各组织细胞凋亡情况,image j光密度分析结果如图6所示,tunel染色图片结果如图7所示。
91.由图6、图7可知,采用tunel法检测小鼠肺、肝、脾、肾细胞凋亡情况,与假手术组相比,脓毒症组细胞凋亡的数量显著增高,而牙髓间充质干细胞干预组较脓毒症组的凋亡细胞数量明显降低。由此结果可见,shed治疗可减轻脓毒症小鼠肺、肝、脾、肾细胞凋亡的程度、保护受损器官。
92.综上所述,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
93.上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1