crocin-1和/或crocin-2’在制备降血脂和内皮细胞保护药物中的应用
crocin
‑
1和/或crocin
‑2’
在制备降血脂和内皮细胞保护药物中的应用
技术领域
1.本发明涉及治疗动脉粥样硬化疾病的药物领域,关于藏红花酸单葡萄糖苷(crocin
‑
1)与藏红花酸双葡萄糖苷(crocin
‑2’
)在制备治疗降血脂和内皮细胞保护药物中的作用。
技术背景
2.传统中医学中,藏红花为性平味甘,散郁开结、活血化瘀,也常被用在对妇科疾病、痢疾,以及黄疸、肝脾肿大、发热等病症的治疗上(scientific reports,2016,6(1):19809)。随着对藏红花的深入研究发现,藏红花能够防治动脉粥样硬化以及治疗心血管疾病,能够抑制癌细胞扩散、抗氧化,也能够治疗肝硬化等肝类疾病,具有抵抗乙醇引起的记忆衰退、提高机体免疫功能,预防视网膜变性等作用。
3.藏红花植物体中具有多种活性成分,主要集中于藏红花的柱头,主要含有类胡萝卜素与其糖苷类物质、酚酸与其糖苷类物质、微量元素等。藏红花柱头中可以发挥药理作用的有效成分主要是类胡萝卜素类及其糖苷,如藏红花酸(crocetin)、藏红花酸糖苷(crocins)、藏红花酸二甲酯(dimetyl
‑
crocetin)、藏红花苦苷(picrocrocin)等(phytotherapy research,2013,27(4):475
‑
483)。其中,藏红花酸糖苷也被叫做藏红花素、番红花素等,它是传统中药藏红花的主要有效活性成分,是一种水溶性类胡萝卜素。现有研究已证实,藏红花酸糖苷具有抗肿瘤、治疗心血管与神经系统等疾病的药理活性(avicenna journal of phytomedicine,2017,7(4):345
‑
352)。藏红花酸糖苷根据糖基类型和糖基化位置的不同,又可以分为藏红花酸单葡萄糖苷(crocin
‑
1)、藏红花酸单龙胆二糖苷(crocin
‑
2)、藏红花酸双葡萄糖苷(crocin
‑2’
)、藏红花酸糖苷
‑
3(crocin
‑
3)、藏红花酸双龙胆二糖苷(crocin
‑
4),其结构式如下:
[0004][0005]
在天然植物体内,crocin
‑
3和crocin
‑
4占其体内总藏红花酸糖苷的94%以上,而
μg/ml,更优选2
‑
4μg/ml。
[0014]
作为一种优选的实施方式,所述藏红花酸双葡萄糖苷(crocin
‑2’
)的浓度是0.02
‑
6μg/ml;更优选0.1
‑
5μg/ml。
[0015]
作为一种优选的实施方式,所述crocin
‑
1或crocin
‑2’
可抑制mek/erk信号通路的炎症反应过程。
[0016]
作为一种优选的实施方式,所述crocin
‑
1或crocin
‑2’
可抑制mek/erk信号通路的促炎细胞因子表达水平。
[0017]
作为一种优选的实施方式,所述促炎细胞因子包括tnf
‑
α、il
‑
6。
[0018]
本发明的第二目的在于提供crocin
‑
1和/或crocin
‑2’
在制备降血脂药物中的应用。
[0019]
作为一种优选的实施方式,所述crocin
‑
1的浓度是25
‑
100μg/ml;优选25
‑
50μg/ml。
[0020]
作为一种优选的实施方式,所述crocin
‑2’
的浓度是25
‑
100μg/ml;优选50
‑
100μg/ml。
[0021]
本发明选用huvecs,分别用crocin
‑
4、crocin
‑
1、crocin
‑2’
对细胞进行预保护后,再用ox
‑
ldl对细胞进行处理,用mtt法检测不同浓度的藏红花酸糖苷对细胞的保护效果,并用elisa法及rt
‑
pcr的方法探索crocin
‑
1、crocin
‑2’
的作用机制。细胞实验发现,在0.02
‑
6μg/ml浓度范围内,crocin
‑
1及crocin
‑2’
可有效保护ox
‑
ldl对huvecs造成的细胞损伤,有望用于制备新型的内皮细胞保护药物。此外,一个已发现的crocin
‑
1、crocin
‑2’
作用途径是,通过抑制mrk/erk途径,降低tnf
‑
α、il
‑
6因子的水平,来实现内皮细胞保护。
[0022]
本发明还选用斑马鱼胚胎,饲喂高胆固醇饲料进行建模,通过于培养用水中分别添加crocin
‑
1、crocin
‑2’
进行给药,观察其体内tg、tc、ldl
‑
c、hdl
‑
c水平,从而指示其动脉粥样硬化指数。结果发现,crocin
‑
1及crocin
‑2’
在25
‑
100μg/ml浓度范围内,可有效降低动脉粥样硬化高风险斑马鱼的风险水平,具有作为降血脂药物及抗动脉粥样硬化药物的潜力,为治疗降血脂和动脉粥样硬化提供新的药物选择。
附图说明
[0023]
图1为在不同浓度ox
‑
ldl处理下huvecs的生长情况。
[0024]
图2为洛伐他汀、crocin
‑
4用于血管内皮细胞保护的给药浓度范围对比。
[0025]
图3为不同浓度的crocin
‑
1、crocin
‑2’
、crocin
‑
4对huvecs进行预处理后,再用ox
‑
ldl对细胞进行诱导后细胞的相对活性。
[0026]
图4为elisa检测crocin
‑
1、crocin
‑2’
对huvecs进行预处理,再用ox
‑
ldl对细胞进行诱导后细胞内mek的含量。
[0027]
图5为elisa检测crocin
‑
1、crocin
‑2’
对huvecs进行预处理,再用ox
‑
ldl对细胞进行诱导后细胞内erk的含量。
[0028]
图6为rt
‑
pcr检测crocin
‑
1、crocin
‑2’
对huvecs进行预处理,再用ox
‑
ldl对细胞进行诱导后细胞内tnf
‑
α的mrna差异倍数。
[0029]
图7为rt
‑
pcr检测crocin
‑
1、crocin
‑2’
对huvecs进行预处理,再用ox
‑
ldl对细胞进行诱导后细胞内il
‑
6的mrna差异倍数。
[0030]
图8为每组斑马鱼体内tg的含量。
[0031]
图9为每组斑马鱼体内ldl
‑
c的含量。
[0032]
图10为每组斑马鱼体内hdl
‑
c的含量。
[0033]
图11为crocin
‑
1、crocin
‑2’
、crocin
‑
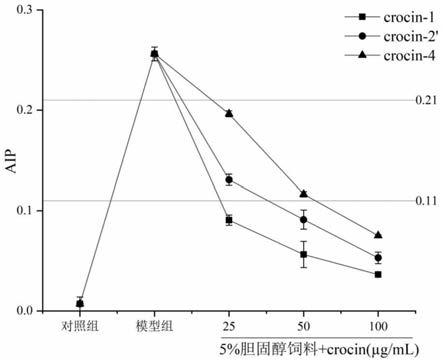
4对斑马鱼动脉粥样硬化指数的影响。
具体实施方式
[0034]
实施例1
[0035]
本实施例说明ox
‑
ldl作为诱导huvecs损伤剂其浓度的选择方法及mtt检测方法。
[0036]
将实验分为空白对照组及ox
‑
ldl给药组,将生长至对数生长期的huvec接种于96孔板中,每孔接种100μl的细胞悬液,每孔细胞个数为5*103‑
104个,边缘孔加pbs。放置于细胞培养箱中培养24h,至细胞完全贴壁生长。
[0037]
依照实验分组设计,每孔吸去原有培养基后添加含不同浓度ox
‑
ldl的培养基200μl,每组设置5个复孔。加药后继续培养,每隔24h取出一块板进行mtt检测:每孔加入5μg/ml的mtt溶液20μl,放置于细胞培养箱继续孵育,4h后吸去每孔培养液,加入150μl dmso后放置于水平低速摇床上震荡15min,使每孔中的有色物质充分地溶解,用酶标仪测定a
570
。
[0038]
由图1可知在ox
‑
ldl浓度为1
‑
10μg/ml时,对huvecs增殖呈促进作用,并未起到抑制细胞生长的作用;在ox
‑
ldl浓度范围50
‑
150μg/ml时,其对huvecs增殖呈抑制作用。综合考虑抑制效果和成本后,本实验选择100μg/ml的ox
‑
ldl作为细胞增殖抑制剂进行下一步实验。
[0039]
实施例2
[0040]
本实施例说明洛伐他汀、crocin
‑
4、crocin
‑
1、crocin
‑2’
对huvecs的处理方法。
[0041]
按照实验分组设计,吸去每孔培养基后加入含不同浓度药物的培养基,每组设置5个复孔,加药后继续培养12h后,再于除空白组外的孔中加入ox
‑
ldl至其浓度为100μg/ml,空白组中加等量的无菌pbs,继续培养24h后做mtt检测。
[0042]
首先,以洛伐他汀作为阳性对照,和藏红花酸糖苷
‑
4的给药浓度进行比较,初步筛选合适的用药浓度,由图2可知,洛伐他汀在给药浓度为50
‑
150μg/ml呈现对血管内皮细胞的保护作用,而藏红花酸糖苷
‑
4分别在给药浓度为1
‑
5μg/ml时,呈现较强的内皮细胞的保护作用,表明藏红花酸糖苷
‑
4在低浓度对血管内皮细胞保护作用更为显著。由于藏红花酸糖苷
‑
4与本实验欲探究的两种稀有藏红花酸糖苷的结构相似,并且在低浓度下即可显示显著性的人脐静脉内皮细胞保护作用,因此进一步探究稀有藏红花酸糖苷对细胞的作用,浓度范围初步设置在0.02
‑
6μg/ml之间。
[0043]
接着,探究不同浓度藏红花酸糖苷
‑
4、藏红花酸糖苷
‑
1(crocin
‑
1)及藏红花酸糖苷
‑2’
(crocin
‑2’
)对huvecs保护作用的影响,从图3可以看出,crocin
‑
1与crocin
‑2’
分别在0.02
‑
4μg/ml和0.02
‑
5μg/ml浓度范围内对细胞保护作用呈剂量依赖性,并且在0.02
‑
6μg/ml浓度范围内,crocin
‑2’
的细胞保护效果要比同浓度的crocin
‑
1与crocin
‑
4更为显著。
[0044]
实施例3
[0045]
本实施例说明elisa检测huvecs细胞内mek、erk水平的方法。
[0046]
设计实验分组:对照组、模型组、给药组。将生长至对数生长期的huvec接种于6孔板中,每孔接种2ml细胞悬液,每孔中细胞个数约为1*105个,培养24h至细胞完全贴壁生长。
按实验分组加入含不同浓度药物的培养液,培养12h后加入ox
‑
ldl至其浓度为100μg/ml,继续培养24h后收集细胞培养液。2500rpm/min离心15min后,收集离心上清。
[0047]
按试剂盒说明书检测每组细胞mek与erk的表达水平。由图4及图5可知,ox
‑
ldl诱导mek与erk水平显著上升,而将细胞先用不同浓度稀有藏红花酸糖苷处理后再用ox
‑
ldl诱导,细胞的erk及mek表达水平较模型组有所下降,并随藏红花酸糖苷给药浓度升高逐渐趋于空白对照组。由先前研究表明,ox
‑
ldl导致huvecs的增殖减少,而mek、erk的水平却呈升高趋势,说明ox
‑
ldl对huvecs的增殖抑制作用与crocin
‑
1与crocin
‑2’
对huvecs的保护作用可能与mek/erk信号通路的促增殖作用关系不大,与erk通路促炎症反应可能存在联系。
[0048]
实施例4
[0049]
本实施例说明rt
‑
pcr检测huvecs细胞内tnf
‑
α、il
‑
6水平的方法。
[0050]
设计实验分组:对照组、模型组、给药组。按试剂盒说明书提取细胞总rna,再反转录合成cdna,然后进行目的基因的rt
‑
pcr,选择β
‑
actin作为内参基因。通过2
‑
δδct
法,分析基因的表达量。由图6和图7可知,ox
‑
ldl处理后细胞tnf
‑
α与il
‑
6的表达显著上升,而先经过crocin
‑
1与crocin
‑2’
预处理的细胞其表达水平降低,并且随稀有藏红花酸糖苷给药浓度的升高,表达水平逐渐趋于对照组水平。因此,crocin
‑
1与crocin
‑2’
在一定的浓度范围内是通过降低细胞的炎症反应,从而起到对huvecs的保护作用。
[0051]
实施例5
[0052]
本实施例说明野生型斑马鱼成鱼及斑马鱼胚胎的饲养方法。
[0053]
斑马鱼成鱼饲养条件:于斑马鱼养殖系统中饲养,循环水温度为28
±
0.5℃,光照周期为14h(明):10h(暗),早晚各喂食一次热带鱼专用饲料。
[0054]
斑马鱼幼鱼饲养条件:90mm塑料培养皿中,每个培养皿50尾幼鱼,60ml培养水,水温28
±
0.5℃,光照周期14h(明):10h(暗),早晚各喂食一次斑马鱼幼鱼专用饲料。培养水直接从与斑马鱼养殖系统连接的ph及电导率调节仪直接接取,酸碱度范围为7.2
‑
7.6,电导率范围为500
‑
550。
[0055]
实施例6
[0056]
本实施例说明5%(w/w)胆固醇斑马鱼饲料的配制方法。
[0057]
将胆固醇按照5%(w/w)与斑马鱼饲料的比例称取,在通风橱中用少量乙醚溶解,搅拌至完全溶解后加入饲料,不断搅拌至乙醚挥发,使胆固醇均匀附着在饲料上,并在通风橱中晾干4h。
[0058]
实施例7
[0059]
本实施例说明斑马鱼胚胎的获得方法。
[0060]
在晚上9:00将斑马鱼成鱼放在交配盒中,雌鱼与雄鱼数量比为2:1,并将雄鱼与雌鱼用隔板隔开,避光过夜后于早上8:00拿出隔板,交配0.5
‑
1h,捞出成鱼后收集沉在盒底的受精卵,用放大镜观察受精卵,挑选其中健康饱满的半透明的卵,放于90mm装有培养水的塑料培养皿中,每天换水一次。
[0061]
实施例8
[0062]
本实施例说明实验组斑马鱼胚胎的饲喂方式。
[0063]
挑选健康的5dpf斑马鱼幼鱼进行分组实验。用培养液分别配制不同浓度的含药溶液,作为给药组的培养用水。按照实验设计如下分组:空白组、高胆固醇饲料组、给药组,每
组50尾幼鱼。按实验分组进行饲养,15dpf对各组斑马鱼进行检测。
[0064]
实施例9
[0065]
本实施例说明斑马鱼幼鱼体内tg、ldl
‑
c、hdl
‑
c的检测方法。
[0066]
每组取30尾幼鱼,加入500μl双蒸水后,用超声破碎仪进行超声破碎5min后于2000rpm/min离心10min,收集上清液,依照tg、ldl
‑
c、hdl
‑
c检测试剂盒说明书对每组斑马鱼的脂质水平分别进行检测。
[0067]
由图8
‑
图10可知,与模型组相比,给药组斑马鱼的tg、tc、ldl
‑
c水平随给药浓度的升高而下降,hdl
‑
c水平随给药浓度的升高而升高,说明两种稀有藏红花酸糖苷均能有效降低因高胆固醇饲料导致的脂质水平升高。
[0068]
根据动脉粥样硬化指数的相关研究标准,aip<0.11为低风险,0.11≤aip≤0.21为中风险,aip>0.21为高风险。由图11可知,通过饲喂高胆固醇饲料,斑马鱼的aip升高至高风险水平,而通过饲养用水进行给药后,斑马鱼的aip逐渐下降至低风险水平。因此可以发现,在一定浓度范围内,以crocin
‑
4作为对照,crocin
‑
1与crocin
‑2’
具有更好的作为降血脂药物及抗动脉粥样硬化药物的潜力;在所试条件下对照crocin
‑
4需在100μg/ml给药浓度下可将高脂斑马鱼动脉粥样硬化指标降为低风险,两种藏红花酸糖苷crocin
‑
1与crocin
‑2’
将高脂斑马鱼动脉粥样硬化指标降为低风险的给药浓度分别为25μg/ml和50μg/ml。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1