IL-17抗体的药物产品和稳定液体组合物的制作方法
il-17抗体的药物产品和稳定液体组合物
1.相关申请
2.本技术是发明名称为“il-17抗体的药物产品和稳定液体组合物”、申请日为2015年12月21日的中国发明专利申请201580076632.9的分案申请。
3.本技术要求2014年12月22日提交的美国临时专利申请第62/095210号的优先权,其通过引用全文纳入本文。
技术领域
4.本公开关于包含il-17抗体及其抗原结合片段(例如ain457(苏金单抗))的稳定液体药物组合物的药物产品,以及制造这些药物产品和液体药物组合物的工艺。
背景技术:
5.il-17a是新近定义的炎性t细胞子集th17细胞的中心淋巴因子,th17细胞在一些自身免疫和炎性过程中非常关键。期望用il-17a中和作用来治疗免疫介导疾病的潜在病理生理学,从而提供症状缓解。苏金单抗(ain457)是一种抑制il-17a活性的高亲和力的全人源单克隆抗人抗体,作为一种治疗各种自身免疫疾病患者的潜在治疗而出现,所述自身免疫疾病例如类风湿性关节炎、强直性脊柱炎、银屑病关节炎、糖尿病、哮喘、慢性斑块型银屑病和多发性硬化症。一些ii期和iii期研究已经显示,苏金单抗在治疗慢性斑块型银屑病实现pasi 75方面优于安慰剂(例如在研究cain457a2220中,在第12周实现pasi 75方面,苏金单抗3
×
150mg和3
×
75mg都优于安慰剂(分别为81.5%和57.1%,相对于9.1%)。苏金单抗目前被用于治疗慢性斑块型银屑病的全球iii期研究,同样显示优于安慰剂,且新近发现还优于依那西普。
6.国际专利申请pct/ep2011/069476提供了基于蔗糖的苏金单抗冻干组合物,其在临用前用1ml水复溶。但是pct/ep2011/069476没有公开具有长期稳定性的苏金单抗即用型药物产品或液体药物组合物。事实上,蛋白质在液体组合物中的边际稳定性经常妨碍室温或冷藏条件下的长期储存。另外,在溶液中可能发生各种物理和化学反应(聚集[共价和非共价]、脱酰胺化、氧化、剪切、异构化、变性),导致降解产物水平升高和/或生物活性损失。商业即用型液体抗体组合物应在运输和操作过程中提供足够的抗体物理和化学稳定性,以确保在将该分子施用给患者时符合剂量和产品安全性的要求。具体来说,可接受的液体抗体组合物必须加强稳定性并最大程度减少蛋白质降解尤其是蛋白质聚集,从而避免严重的免疫原反应。而且该组合物必须还具有皮下应用可接受的渗透压和ph值,并具有作为制备(配混、过滤、填充)先决条件的低粘性以及可注射性。平衡这么多要求很困难,使得生产商业可行的水性生物药物组合物成为一项技术挑战。
[0007]
尽管有以上概述的技术挑战,我们现已成功地开发出新颖且有益的本文所述il-17抗体和抗原结合片段(例如苏金单抗)的即用型药物产品和液体药物组合物。
技术实现要素:
[0008]
本公开提供了药物产品,包括容器(例如笔、注射器、小瓶、自我注射器)以及置于容器内的液体组合物,所述容器的顶部空间包含小于约12%的氧(例如小于约10%的氧、小于约8%的氧、小于约6%的氧等)。该液体组合物并非自冻干物复溶,而是一种即用型液体组合物,并大体包含至少一种公开的il-17抗体或其抗原结合片段(例如苏金单抗)、缓冲液、表面活性剂、甲硫氨酸和稳定剂,以及其亚组合。我们发现联合使用特定的稳定剂以及容器顶部空间中低氧含量,显著地助益于该液体药物产品的长期稳定性,并防止该组合物中包含的il-17抗体(例如苏金单抗)氧化。这些液体组合物具有极佳的性质,例如:
[0009]
在25℃储存13个月之后,通过sec测得团聚体形成≤3.5%(对于2.5mm甲硫氨酸),≤3.0%(对于5mm);且≤2.2%(对于含20mm甲硫氨酸的组合物);和
[0010]
在25℃储存13个月之后,通过rp-hplc测得(主峰之前变体之和)降解产物≤39.4%(对于2.5mm),≤37.8%(对于5.0mm),且≤34.5%(对于含20mm甲硫氨酸的组合物)。
[0011]
因此本公开提供药物产品,其包括具有顶部空间的容器和置于该容器内的ph为约5.2至约6.2的液体药物组合物,其中该顶部空间中的氧含量小于约12%,所述组合物包含约20mg/ml至约175mg/ml的苏金单抗和约2.5至约20mm l-甲硫氨酸,其中该液体药物组合物并非自冻干物复溶。
[0012]
本公开还提供药物产品,其包括具有顶部空间的容器和置于该容器内的液体药物组合物,其中该顶部空间中的氧含量小于约6%,该组合物包含约25mg/ml至约150mg/ml的本文所述il-17抗体(例如苏金单抗)、约10mm至约30mm ph 5.8的组氨酸、约200mm至约225mm海藻糖、约0.02%聚山梨醇酯80和约2.5mm至约20mm甲硫氨酸,其中该液体药物组合物并非自冻干物复溶。
[0013]
本公开还提供了一种减少苏金单抗氧化的方法,该方法包括:制备ph为约5.2至约6.2且包含约25mg/ml至约150mg/ml本文所述il-17抗体(例如苏金单抗)和约2.5mm至约20mm甲硫氨酸的液体组合物;将该液体组合物置于具有顶部空间的容器中;并将该顶部空间中的氧含量调节至小于或等于约12%。
[0014]
本公开还提供稳定的液体药物组合物,其包含约25mg/ml至约150mg/ml本文所述il-17抗体(例如苏金单抗)、约10mm至约30mm缓冲液(例如组氨酸)ph 5.8、约200mm至约225mm稳定剂(例如海藻糖)、约0.02%表面活性剂(例如聚山梨醇酯80)和约2.5mm至约20mm甲硫氨酸。
[0015]
本公开还关于这些药物产品和稳定的液体组合物用于治疗各种il-17介导疾病(例如自身免疫疾病,例如银屑病、强直性脊柱炎、银屑病关节炎和类风湿性关节炎)的应用,以及包含这些药物产品和稳定的液体组合物的试剂盒。
[0016]
其他组合物、产品、方法、方案、应用和试剂盒在以下说明书和所附权利要求书中提供。通过以下说明书和所附权利要求书,本文公开的其他特征、优点和方面对于本领域技术人员将是显而易见的。
附图说明
[0017]
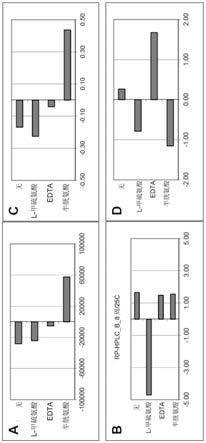
图1a-d显示不同抗氧化稳定剂对150mg/ml苏金单抗液体在注射器稳定性方面的影响:5℃保持8周之后通过光阻法测得的1μm不溶性(sub-visible)颗粒(颗粒/ml)的参数
估计(a)、25℃保持8周之后通过rp-hplc测得的主峰之前的物质(%)(b)、40℃保持8周之后的dp-sec(%)(c)、40℃保持8周之后的ap-sec(%)(d)。
[0018]
图2显示25℃储存时l-甲硫氨酸浓度对25mg/ml苏金单抗稳定性的影响:通过rp-hplc测得的主峰之前的物质(%)。灰色虚线:10mm l-甲硫氨酸/5%顶部空间氧含量数据的线性拟合;黑色虚线:0mm l-甲硫氨酸/5%顶部空间氧含量数据的线性拟合。
[0019]
图3显示25℃储存6个月时l-甲硫氨酸、海藻糖和聚山梨醇酯80对150mg/ml苏金单抗液体在注射器稳定性方面的影响:通过rp-hplc测得的主峰之前的物质(%)。
[0020]
图4a和b显示,在5mm和0mm l-甲硫氨酸存在下,在5℃储存时l-甲硫氨酸浓度对150mg/ml苏金单抗液体在注射器稳定性方面的影响ap-sec(%)(a)和通过rp-hplc测得的主峰之前的物质(%)(b)。
[0021]
图5显示在5℃保持30个月和在25℃保持13个月之后,l-甲硫氨酸浓度对150mg/ml苏金单抗液体在注射器稳定性方面的影响:ap-sec(%)(a)和通过rp-hplc测得的主峰之前的物质(%)(b)。
[0022]
图6a和b显示在40℃储存3个月之后,l-甲硫氨酸浓度对25mg/ml苏金单抗液体在小瓶(10%顶部空间氧含量)稳定性方面的影响:ap-sec(%)(a)和通过ce-sds测得的杂质之和(非还原性)(%)(b)。
[0023]
图7显示在25℃储存时顶部空间氧含量对注射器中的150mg/ml苏金单抗液体的影响:ap-sec(%)。
[0024]
图8a-d显示在25℃(a,b)和5℃(c,d)储存后,顶部空间氧含量和填充体积对注射器中的150mg/ml苏金单抗液体ap-sec(%)的影响。a和c的填充体积为0.5ml。b和d的填充体积为1.0ml。
[0025]
图9显示在5℃和25℃保持6个月之后,顶部空间氧含量和填充体积对150mg/ml苏金单抗液体在注射器稳定性方面的影响:通过rp-hplc测得的纯度。
[0026]
图10显示在25℃储存6个月之后,l-甲硫氨酸浓度和顶部空间氧含量对150mg/ml苏金单抗液体在注射器稳定性方面的影响(a):ap-sec(%)。
[0027]
图11显示氮气吹扫和l-甲硫氨酸浓度对150mg/ml苏金单抗液体在注射器稳定性方面的影响:通过rp-hplc测定主峰之前的物质(%)。
[0028]
图12a和b显示在40℃储存4周之后,ph对150mg/ml苏金单抗液体在注射器稳定性方面的影响:稳定性的分级估计/2(ph增量为0.3单位的影响),通过rp-hplc测得的主峰之前的物质(%变化)(a)和ap-sec(%变化)(b)。
[0029]
图13a-d显示在5℃储存之后,ph对150mg/ml苏金单抗液体在注射器稳定性方面的影响:浊度(ntu)(a)、通过sec测得的纯度(%)(b)、通过cex测得的酸性变体(%)(c)、ap-sec(%)(d)。
[0030]
图14显示在25℃储存8周之后,稳定剂对150mg/ml苏金单抗液体在注射器稳定性方面的影响:ap-sec的参数估计。
[0031]
图15显示摇动之后,表面活性剂对150mg/ml苏金单抗液体在注射器稳定性方面的影响:通过光阻法测得的≥1μm不溶性微粒的参数估计(颗粒/ml)。
[0032]
图16a-d显示缓冲剂类型对150mg/ml苏金单抗液体在注射器稳定性方面的影响:冻融应力之后的ap-sec(%)参数估计(a)、摇动应力之后的ap-sec(%)(b)、在25℃储存8周
之后通过rp-hplc测得的主峰之前的物质(%)(c)、摇动应力之后的dp-sec(%)(d)。
具体实施方式
[0033]
术语“包含”涵盖了“包括”以及“由
……
组成”的含义,例如“包含”x的组合物可仅由x组成,也可包括一些其他成分,例如x+y。
[0034]
关于数值x的术语“约”表示
±
10%,除非上下文中另外指明。
[0035]“每个月”表示大约每4周(例如每4周),其约为每28天(例如每28天)。
[0036]
本文所述的术语“抗体”是指包括整个抗体及其任意抗原结合片段或单链。天然产生的“抗体”是包含通过二硫键互相连接的至少两个重链(h)和两个轻链(l)的糖蛋白。各重链包含重链可变区(本文缩写为vh)和重链恒定区。重链恒定区包含三个域,ch1、ch2和ch3。各轻链包含轻链可变区(本文缩写为v
l
)和轻链恒定区。轻链恒定区包含一个域cl。vh和v
l
区可进一步细分:称为高变区或互补决定区(cdr)的高度易变区之间缀有被称为框架区(fr)的更保守区域。各vh和v
l
包含三个cdr和四个fr,按以下顺序从氨基端排列至羧基端:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区包含与抗原相互作用的结合域。抗体的恒定区可介导免疫球蛋白结合宿主组织或因子,包括免疫系统的各细胞(例如效应细胞)和经典补体系统的第一成分(c1q)。在所公开的方法、方案、试剂盒、工艺、应用和组合物的一些实施方式中,采用il-17抗体或il-17受体的抗体,优选il-17的抗体,例如苏金单抗。
[0037]
本文所用“分离的抗体”表示的抗体基本不含具有不同抗原特异性的其他抗体(例如,特异结合il-17的分离的抗体基本上不含特异结合il-17以外其他抗原的抗体)。本文使用术语“单克隆抗体”或“单克隆抗体组合物”表示单分子组合物的抗体分子制剂。本文使用的术语“人型抗体”意在包括具有其中框架和cdr区都源自人来源序列的可变区的抗体。“人型抗体”不一定由人、人体组织或人体细胞产生。本文公开的人型抗体可包含并非由人序列编码的氨基酸残基(例如通过如下引入的突变:通过在体外随机或定点突变形成、通过在抗体基因重组过程中在体内在接合处添加n-核苷酸或通过在体内体细胞突变)。在所公开的方法、方案、试剂盒、工艺、应用和组合物的一些实施方式中,il-17抗体是人型抗体、分离的抗体和/或单克隆抗体。
[0038]
本文所使用术语抗体的“抗原结合片段”表示保持特异结合抗原(例如il-17)的能力的抗体片段。已经显示抗体的抗原结合功能可通过全长抗体的片段进行。术语抗体的“抗原结合片段”所涵盖的结合片段的示例包括fab片段,一种由v
l
、vh、cl和ch1结构域组成的单价片段;f(ab)2片段,一种包含在铰链区通过二硫桥连接的两个fab片段的二价片段;fd片段,由vh和ch1结构域组成;fv片段,由抗体单臂的v
l
和vh结构域组成;dab片段(ward等,1989nature 341:544-546),由vh结构域组成;和分离的cdr。示例性的抗原结合部位包括苏金单抗的cdr,如seq id no:1-6和11-13(表1)中所示,优选重链cdr3。而且,虽然fv片段的两个结构域v
l
和vh由独立的基因进行编码,它们可通过合成接头采用重组方法连接,从而使得它们可作为单蛋白链制得,其中的v
l
和vh区配对形成单价分子(作为单链fv(scfv)已知;参见例如bird等,1988science 242:423-426;huston等,1988proc.natl.acad.sci.85:5879-5883)。这些单链抗体也涵盖在术语“抗体”内。单链抗体和抗原结合片段可采用本领域技术人员已知的常规技术获得。在所公开的方法、方案、试剂盒、工艺、应用和组合物的一些实施方式中,采用针对il-17(例如苏金单抗)或il-17受体抗体的单链抗体或抗原结合片
段。
[0039]
术语“药物产品”是指其中置有药物组合物的容器(例如笔、注射器、袋、泵等)。“容器”是指容纳液体药物组合物的任意方式,例如笔、注射器、小瓶、自我注射器、贴片等。各容器具有“顶部空间”,即容器内不含液体药物组合物的区域。这种顶部空间包含气体,例如氧和空气中常见的其他气体的混合物。顶部空间中的氧含量可进行调节,例如通过在顶部空间中引入惰性气体(例如氮、氩等)代替氧。这可主动地实现(例如通过吹扫),或者被动地实现(通过例如将容器放置在一系统中并除去氧(例如通过真空等))。吹扫(例如使用惰性气体、优选氮)可以发生在将组合物填充到容器中之前、在填充过程中或在放置塞子之前和放置塞子的过程中。本文使用术语“顶部空间中的氧含量”指给定容器的顶部空间中所发现的氧百分比。
[0040]“稳定的”组合物是其中的蛋白质在储存下基本保持其稳定性(例如物理、化学和/或生物活性)的组合物。本领域中有多种测定蛋白质稳定性的分析技术,并综述于《肽和蛋白质药物递送》(peptide and protein drug delivery),247-301,vincent lee编辑,marcel dekker,inc.,new york,n.y.,pubs.(1991)和jones,a.adv.drug delivery rev.10:29-90(1993)。可在选定温度下测试选定时间周期内的稳定性。“稳定的”液体抗体组合物是在冷藏温度(2-8℃)下保持至少6个月、12个月、优选2年、更优选3年,或在室温(23-27℃)下保持至少3个月、优选6个月、更优选1年,或在应力条件(~40℃)下保持至少1个月、优选3个月、更优选6个月后,没有观察到明显变化的液体抗体组合物。可使用各种稳定性标准,例如不超过10%、优选5%的抗体单体发生降解(例如通过sec纯度、rp-hplc纯度、cex纯度、ce-sds纯度(非还原性)等测定)。或者,若通过视觉分析或通过使用悬液计发现溶液保持清澈至略微乳白色,则可显示稳定性。或者,若在给定时间周期例如至少3个月、优选6个月、更优选1年之后,组合物的浓度、ph和渗透压的变化不超过
±
10%,则可显示稳定性。或者,若在给定时间周期例如至少3个月、优选6个月、更优选1年之后,效力(例如通过抑制或cex检测等之中的生物活性所测得)在对照的70-130%(例如至少70%,至少75%,至少76%,至少80%,至少90%,至少91%,至少95%)、优选80-120%之内,则可显示稳定性。或者,若在给定时间周期例如至少3个月、优选6个月、更优选1年之后,观察到抗体的剪切不超过10%、优选5%(例如通过dp-sec等测定),则可显示稳定性。或者,若在给定时间周期例如至少3个月、优选6个月、更优选1年之后,形成的聚集小于10%、优选小于5%(例如通过ap-sec等测定),则可显示稳定性。或者,若在25℃储存13个月之后,通过sec测得形成的聚集≤约3.5%、≤约3.0%或≤约2.2%,则可显示稳定性。或者,若在25℃储存13个月之后,形成的降解产物(通过rp-hplc测得(主峰之前的物质))≤约39.4%、≤约37.8%或≤约34.5%,则可显示稳定性。
[0041]
若通过颜色和/或透明度(浊度)的视觉检查,或通过紫外光散射、尺寸排除色谱(sec)和动态光散射(dls)测得,抗体的聚集、沉淀和/或变性没有显示明显增加,则该抗体在药物组合物中保持其物理稳定性。另外,蛋白质构象不应该显著改变,例如通过荧光光谱(确定蛋白质三级结构)或通过ftir光谱(确定蛋白质二级结构)评价。
[0042]
若抗体显示没有明显化学变化,则该抗体在药物组合物中保持其化学稳定性。化学稳定性可通过检测并量化该蛋白质的化学改变形式来评估。经常改变蛋白质化学结构的降解过程包括水解或剪切(通过例如尺寸排除色谱[sec]和sds-page的方法来评价)、氧化
(通过例如肽图联合质谱或maldi/tof/ms的方法来评价)、脱酰胺化(通过例如阳离子交换色谱(cex)、毛细管等电聚焦、肽图、异天冬氨酸测定的方法来评价)和异构化(通过测定异天冬氨酸含量、肽图等来评价)。
[0043]
若蛋白质/抗体在给定时间的生物活性在制备该药物组合物时表现出的生物活性的预定范围之内,则该抗体在药物组合物中保持其生物活性。可例如通过抗原结合elisa检测、效能检测(例如评价il-17抗体(例如苏金单抗)结合il-17并抑制il-6从软骨细胞释放的能力)或半胱胺-cex衍生化来确定抗体的生物活性。
[0044]
本文使用“rp-hplc纯度”表示rp-hplc中主峰的百分比,可用于评估苏金单抗的稳定性。使用rp-hplc根据疏水性分离苏金单抗及其变体。rp-hplc主峰之前的物质是在主峰之前洗出的峰的百分比之和,可包含该抗体的片段化、异构化和氧化的物质。
[0045]
本文使用“cex纯度”表示cex中主峰的百分比,可用于评估苏金单抗抗体的稳定性。使用cex通过测定酸性和碱性变体的百分比来评价苏金单抗的电荷异质性。
[0046]
本文使用“sec纯度”表示sec中单体的百分比,可用于评估苏金单抗的稳定性。sec被用于根据非变性条件下的尺寸将单体苏金单抗从聚集体和片段中分离。在主峰之前洗出的峰之和报告为聚集产物百分比(ap-sec),在主峰之后洗出的峰之和报告为降解产物百分比(dp-sec)。
[0047]
本文使用“ce-sds纯度”表示ce-sds中完整抗体的百分比,可用于评估苏金单抗的稳定性。使用ce-sds根据非还原性条件下的分子尺寸将副产物和降解产物从完整的苏金单抗中分离。与主峰分离的峰之和报告为杂质百分比。
[0048]
本文使用“液体药物组合物”表示并非自冻干物复溶的水性组合物,其包含至少一种il-17抗体或其抗原结合片段(例如苏金单抗)和至少一种其他赋形剂(例如缓冲液)。该液体药物组合物可包含其他赋形剂(稳定剂、表面活性剂)和其他活性成分。这种制剂也称为“即用型”制剂。
[0049]
本文使用术语“冻干物”表示大体上无水的干燥的(例如冷冻干燥的)药物组合物。抗体冻干技术已为本领域中所熟知,例如参见rey和may(2004)《药物和生物产品的冷冻干燥/冻干》(freeze-drying/lyophilization of pharmaceutical&biological products)isbn 0824748689。将冻干物复溶得到水性组合物——通常用于立即使用(例如在1-10天之内)——因为冻干物在复溶之后往往具有有限的保存期。
[0050]
术语“高浓度”是指组合物包含大于50mg/ml抗体或其抗原结合片段。在优选实施方式中,高浓度液体组合物包含≥约50mg/ml、≥约75mg/ml、≥约100mg/ml、≥约125mg/ml、≥约150mg/ml、≥约175mg/ml、≥约200mg/ml或≥约225mg/ml。
[0051]
术语“il-17”是指il-17a,之前称为ctla8,包括来自不同物种(例如人、小鼠和猴)的野生型il-17a、il-17a的多形变体和il-17a的功能等价物。根据本公开的il-17a的功能等价物优选与野生型il-17a(例如人il-17a)具有至少约65%、75%、85%、95%、96%、97%、98%或甚至99%的整体序列同一性,并基本保持诱导人皮肤成纤维细胞产生il-6的能力。
[0052]
术语“k
d”意在表示特定抗体-抗原相互作用的离解速率。本文使用术语“k
d”意在表示离解常数,其从kd相对于ka的比值获得(即kd/ka),并表示为摩尔浓度(m)。抗体的kd值可采用本领域沿用已久的方法确定。确定抗体kd的一种方法是通过使用表面等离子共振,或使
用生物传感器系统例如系统。在一些实施方式中,il-17抗体或其抗原结合片段与人il-17结合的kd约为100-250pm(通过测得)。
[0053]
术语“亲和力”是指在单个抗原位点的抗体和抗原之间的相互作用强度。在各抗原位点内,抗体“臂”的可变区通过弱非共价力与抗原在很多位点相互作用;相互作用越多,则亲和力越强。本领域中已知评价抗体对各物种il-17的结合亲和力的标准检测方法,包括例如elisa、蛋白质印记法和ria。还可通过本领域已知的标准检测方法来评估结合动力学(例如结合亲和力),例如通过分析。
[0054]
本文使用的术语“对象”和“患者”包括任何人或非人动物。术语“非人动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,例如非人灵长类、羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。
[0055]
通过根据本领域已知和如本文所述方法学确定的“抑制”一或多种这些il-17功能性质(例如,生物化学、免疫化学、细胞学、生理学或其他生物活性等)的抗体,应理解为与特定活性相对于无抗体时(或存在不相关特异性的对照抗体时)的统计学显著降低相关。抑制il-17活性的抗体会造成所测参数的统计学显著降低,例如降低至少约10%,至少50%、80%或90%,在所公开的方法、应用、工艺、试剂盒和组合物的一些实施方式中,所用il-17抗体可抑制超过95%、98%或99%的il-17功能活性。
[0056]
本文所用的“抑制il-6”表示il-17抗体(例如苏金单抗)降低来自软骨细胞的il-6产生的能力。il-17抗体或其抗原结合片段(例如苏金单抗)的生物活性可基于其抑制il-17诱导的永生化的人软骨细胞系例如c-20/a4释放il-6的能力来测定。简而言之,在检测的第一天,将c-20/a4细胞接种到96孔板中,使其贴附,然后在固定的次高浓度的il-17(例如在培养基中为约20-200ng/ml,例如约80ng/ml)和各浓度抗体(例如在检测板中为约0.01μg/ml-约4μg/ml,例如约0.5μg/ml-约2μg/ml)的存在下孵育过夜。还包含促进il-17诱导的il-6产生的tnfalfa(例如在培养基中为约0.01ng/ml-约1ng/ml,例如约0.5ng/ml),以增加该检测的动态范围。在第二天,通过elisa定量细胞上清液中的il-6浓度。细胞上清液中il-6的量与样品中存在的il-17抗体的活性成反比。通过将其抑制il-17依赖性il-6释放的能力与抗体参比标准的能力进行比较,对抗体测试样品的生物活性进行量化。基于蛋白质含量将样品和标准归一化。根据欧洲药典使用平行线测定来计算相对效力。最终结果表示为与参比标准相比较的样品相对效力(百分比)。
[0057]
除非另外指明,术语“衍生物”用于定义根据本公开的il-17抗体或其抗原结合片段(例如苏金单抗)、例如特定序列的(例如可变域)的氨基酸序列变体和共价修饰(例如聚乙二醇化、脱酰胺化、羟基化、磷酸化、甲基化等)。“功能衍生物”包括具有所公开il-17抗体或其抗原结合片段常见的定性生物活性的分子。功能衍生物包括如本文所公开的il-17抗体或其抗原结合片段的片段和肽类似物。片段包含位于根据本公开多肽(例如特定序列)的序列之内的区域。本文所公开的il-17抗体或其抗原结合片段的功能衍生物(例如苏金单抗的功能衍生物)优选包含与本文所公开il-17结合分子的vh和/或v
l
序列具有至少约65%、75%、85%、95%、96%、97%、98%、或甚至99%的整体序列同一性的vh和/或v
l
结构域(例如表1的vh和/或v
l
序列),并基本保持结合人il-17或例如抑制il-17诱导的人皮肤成纤维细胞的il-6产生的能力。
[0058]“基本同一”表示相关的氨基酸或核苷酸序列(例如vh或v
l
结构域)与特定参考序列
相同或具有非实质差异(例如通过保守氨基酸取代)。非实质差异包括较小的氨基酸变化,例如在指定区(例如vh或v
l
结构域)的5个氨基酸序列中的1或2个取代。在抗体的情况中,第二抗体具有相同的特异性,并具有至少50%的相同亲和力。与本文所公开的序列基本相同(例如至少约85%的序列同一性)的序列也属于本技术的一部分。在一些实施方式中,相对于所公开的序列,衍生il-17抗体(例如苏金单抗衍生物,例如苏金单抗生物类似抗体)的序列同一性可约为90%或大于90%,例如90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高。
[0059]
在本文中将关于天然多肽及其功能衍生物的“同一性”定义为在比对序列并(若需要)引入空位来实现最大的同一性百分比、且不考虑任意保守取代作为序列同一性部分之后,候选序列中与相应天然多肽的残基相同的氨基酸残基的百分比。n-或c-端的延伸和插入都不应理解为降低同一性。用于比对的方法和计算机程序是众所周知的。同一性百分比可通过标准比对算法确定,例如altshul等描述的基本局部比对检索工具(basic local alignment search tool)(blast)((1990)j.mol.biol.,215:403-410);needleman等的算法((1970)j.mol.biol.,48:444-453);或meyers等的算法((1988)comput.appl.biosci.,4:11-17)。一组参数可以是空位罚分为12、空位延伸罚分为4且移码空位罚分为5的blosum 62评分矩阵。两个氨基酸或核苷酸序列间的同一性百分比也可采用e.meyers和w.miller((1989)cabios,4:11-17)的算法确定,其已整合进align程序(2.0版)中,采用pam120权重残基表、空位长度罚分为12且空位罚分为4。
[0060]“氨基酸”是指所有天然产生的l-α-氨基酸(举例而言)且包括d-氨基酸。“氨基酸序列变体”是指与根据本公开的序列相比,在其氨基酸序列中具有一些差异的分子。根据本公开多肽的(例如指定序列的)氨基酸序列变体,仍具有结合人il-17、或例如抑制il-17诱导的人皮肤成纤维细胞产生il-6的能力。氨基酸序列变体包括取代变体(在根据本公开的多肽中有至少一个氨基酸残基被除去并在相同位置处插入不同氨基酸)、插入变体(在根据本公开的多肽中在特定位置处紧邻某一氨基酸插入一或多个氨基酸)和删除变体(在根据本公开的多肽中除去一或多个氨基酸)。
[0061]
术语“药学上可接受”表示不干扰活性成分的生物活性有效性的非毒性材料。
[0062]
使用与化合物例如il-17结合分子或另一种试剂相关的术语“施用”表示通过任何途径将该化合物递送给患者。
[0063]
本文使用的“治疗有效量”表示il-17抗体或其抗原结合片段例如苏金单抗的量,其以单或多剂施用于患者(例如人)能有效用于治疗、预防、防止发作、治愈、延迟、减轻严重性、改善疾病或复发疾病的至少一种症状或者延长患者生存超出无此治疗所预期。当用于单独应用的个体活性成分(例如il-17抗体,例如苏金单抗)时,该术语仅指该成分。当用于组合时,该术语指导致治疗效果的活性成分的总量,无论是否组合、序列或同时施用。
[0064]
术语“治疗”是指预防性治疗以及治愈或疾病改善性治疗,包括治疗存在感染疾病风险或疑似感染疾病以及已经得病或者被诊断出罹患疾病或医学症状的患者,还包括抑制临床复发。为了使一或多种病症或复发病症得以防止、治愈、延迟发作、减轻严重性或者改善,或者为了延长患者的预期生存超出无此治疗所预期,可将治疗施用于已经有医学症状或最终可能得病的患者。
[0065]
使用“施用手段”表示向患者全身性施用药物的任何可用器具,包括但不限于预填
充注射器、小瓶和注射器、注射笔、自我注射器、静脉滴注袋、泵、膜片泵等。患者可用这些器具自行施用药物(即独自施用药物)或者内科医师可用这些器具施用药物。通常,以“mg/kg”给出的剂量经由静脉途径施用,以“mg”给出的剂量经由肌内或皮下注射施用。在所公开的方法、试剂盒、方案和应用的一些实施方式中,经由静脉途径将il-17抗体或其抗原结合片段例如苏金单抗递送给患者。在所公开的方法、试剂盒、方案和应用的一些实施方式中,经由皮下途径将il-17抗体或其抗原结合片段例如苏金单抗递送给患者。
[0066]
il-17抗体及其抗原结合片段
[0067]
所公开的药物产品、组合物、液体组合物、方案、工艺、应用、方法和试剂盒包含或利用il-17抗体或其抗原结合片段。
[0068]
在一个实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含至少一个免疫球蛋白重链可变域(vh),其包含高变区cdr1、cdr2和cdr3,所述cdr1具有氨基酸序列seq id no:1,所述cdr2具有氨基酸序列seq id no:2,所述cdr3具有氨基酸序列seq id no:3。在一个实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含至少一个免疫球蛋白轻链可变域(v
l
),其包含高变区cdr1’、cdr2’和cdr3’,所述cdr1’具有氨基酸序列seq id no:4,所述cdr2’具有氨基酸序列seq id no:5,所述cdr3’具有氨基酸序列seq id no:6。在一个实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含至少一个免疫球蛋白重链可变域(vh),其包含高变区cdr1-x、cdr2-x和cdr3-x,所述cdr1-x具有氨基酸序列seq id no:11,所述cdr2-x具有氨基酸序列seq id no:12,所述cdr3-x具有氨基酸序列seq id no:13。
[0069]
在一个实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含至少一个免疫球蛋白vh结构域和至少一个免疫球蛋白v
l
结构域,其中:a)该免疫球蛋白vh结构域包含(例如依次是):i)高变区cdr1、cdr2和cdr3,所述cdr1具有氨基酸序列seq id no:1,所述cdr2具有氨基酸序列seq id no:2,所述cdr3具有氨基酸序列seq id no:3;或ii)高变区cdr1-x、cdr2-x和cdr3-x,所述cdr1-x具有氨基酸序列seq id no:11,所述cdr2-x具有氨基酸序列seq id no:12,所述cdr3-x具有氨基酸序列seq id no:13;和b)该免疫球蛋白vl结构域包含(例如依次是)高变区cdr1’、cdr2’和cdr3’,所述cdr1’具有氨基酸序列seq id no:4,所述cdr2’具有氨基酸序列seq id no:5,所述cdr3’具有氨基酸序列seq id no:6。
[0070]
在一个实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含:a)免疫球蛋白重链可变域(vh),其包含如seq id no:8所示的氨基酸序列;b)免疫球蛋白轻链可变域(v
l
),其包含如seq id no:10所示的氨基酸序列;c)免疫球蛋白vh结构域和免疫球蛋白v
l
结构域,其vh包含如seq id no:8所示的氨基酸序列,其v
l
包含如seq id no:10所示的氨基酸序列;d)免疫球蛋白vh结构域,其包含如seq id no:1、seq id no:2和seq id no:3所示的高变区;e)免疫球蛋白v
l
结构域,其包含如seq id no:4、seq id no:5和seq id no:6所示的高变区;f)免疫球蛋白vh结构域,其包含如seq id no:11、seq id no:12和seq id no:13所示的高变区;g)免疫球蛋白vh结构域和免疫球蛋白v
l
结构域,其vh包含如seq id no:1、seq id no:2和seq id no:3所示的高变区,其v
l
包含如seq id no:4、seq id no:5和seq id no:6所示的高变区;或h)免疫球蛋白vh结构域和免疫球蛋白v
l
结构域,其vh包含如seq id no:11、seq id no:12和seq id no:13所示的高变区,其v
l
包含如seq id no:4、seq id no:5和seq id no:6所示的高变区。
[0071]
为便于参考,基于kabat定义以及通过x射线分析测定并采用chothia及同事的方法,下表1中提供了苏金单抗单克隆抗体高变区的氨基酸序列。
[0072][0073]
表1:苏金单抗单克隆抗体高变区的氨基酸序列。
[0074]
在优选的实施方式中,恒定区也优选包含合适的人恒定区,例如如“免疫学感兴趣的蛋白质序列(sequences of proteins of immunological interest)”,kabat e.a.等,美国健康和人服务部(us department of health and human services),公众健康服务(public health service),国家健康研究院(national institute of health)中所述。编码苏金单抗的v
l
的dna如seq id no:9中所示。编码苏金单抗的vh的dna如seq id no:7中所示。
[0075]
在一些实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含seq id no:10的三个cdr。在其他实施方式中,il-17抗体包含seq id no:8的三个cdr。在其他实施方式中,il-17抗体包含seq id no:10的三个cdr和seq id no:8的三个cdr。按照chothia和kabat的定义,seq id no:8和seq id no:10的那些cdr可见于表1中。
[0076]
在一些实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含seq id no:14的轻链。在其他实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含seq id no:15的重链。在其他实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含seq id no:
14的轻链和seq id no:15的重链。在一些实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含seq id no:14的三个cdr。在其他实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含seq id no:15的三个cdr。在其他实施方式中,il-17抗体或其抗原结合片段例如苏金单抗包含seq id no:14的三个cdr和seq id no:15的三个cdr。按照chothia和kabat的定义,seq id no:15和seq id no:17的那些-cdr可见于表1中。
[0077]
高变区可与任意种类的框架区相连,尽管优选人源。合适的框架区如kabat e.a.等(同前)中所述。优选的重链框架是人重链框架,例如苏金单抗抗体的重链框架。其依次由例如fr1(seq id no:8的氨基酸1至30)、fr2(seq id no:8的氨基酸36至49)、fr3(seq id no:8的氨基酸67至98)和fr4(seq id no:8的氨基酸117至127)区组成。考虑到通过x射线分析确定的苏金单抗高变区,另一优选的重链框架依次由fr1-x(seq id no:8的氨基酸1至25)、fr2-x(seq id no:8的氨基酸36至49)、fr3-x(seq id no:8的氨基酸61至95)和fr4(seq id no:8的氨基酸119至127)区组成。在一种类似方式中,轻链框架依次由fr1’(seq id no:10的氨基酸1至23)、fr2’(seq id no:10的氨基酸36至50)、fr3’(seq id no:10的氨基酸58至89)和fr4’(seq id no:10的氨基酸99至109)区组成。
[0078]
在一个实施方式中,il-17抗体或其抗原结合片段例如苏金单抗选自人il-17抗体,其至少包含:a)免疫球蛋白重链或其片段,其包含可变域以及人重链的恒定部分或其片段,该可变域依次包含高变区cdr1、cdr2和cdr3;所述cdr1具有seq id no:1的氨基酸序列,所述cdr2具有seq id no:2的氨基酸序列,所述cdr3具有seq id no:3的氨基酸序列;和b)免疫球蛋白轻链或其片段,其包含可变域以及人轻链的恒定部分或其片段,该可变域依次包含高变区cdr1’、cdr2’和cdr3’,所述cdr1’具有seq id no:4的氨基酸序列,所述cdr2’具有seq id no:5的氨基酸序列,所述cdr3’具有seq id no:6的氨基酸序列。
[0079]
在一个实施方式中,il-17抗体或其抗原结合片段例如苏金单抗选自包含抗原结合位点的单链结合分子,所述抗原结合位点包含:a)依次包含高变区cdr1、cdr2和cdr3的第一结构域,所述cdr1具有seq id no:1的氨基酸序列,所述cdr2具有seq id no:2的氨基酸序列,所述cdr3具有seq id no:3的氨基酸序列;和b)依次包含高变区cdr1’、cdr2’和cdr3’的第二结构域,所述cdr1’具有seq id no:4的氨基酸序列,所述cdr2’具有seq id no:5的氨基酸序列,所述cdr3’具有seq id no:6的氨基酸序列;和c)连接第一结构域的n-端末端和第二结构域的c-端末端或连接第一结构域的c-端末端和第二结构域的n-端末端的肽接头。
[0080]
可选地,所公开方法中所用的il-17抗体或其抗原结合片段例如苏金单抗可包含如本文由序列所示分子的衍生物(例如苏金单抗的聚乙二醇化的形式)。或者,所公开方法中所用的il-17抗体或其抗原结合片段例如苏金单抗的vh或v
l
结构域可具有与本文中所示的vh或v
l
结构域(例如在seq id no:8和10中所示的那些)基本相同的vh或v
l
结构域。本文所公开的人il-17抗体可包含与如seq id no:15所示基本相同的重链和/或与如seq id no:14所示基本相同的轻链。本文公开的人il-17抗体可包含包含seq id no:15的重链和包含seq id no:14的轻链。
[0081]
本文所公开的人il-17抗体可包含:a)重链,其包含可变域和人重链的恒定部分,该可变域具有与seq id no:8中所示基本相同的氨基酸序列;和b)轻链,其包含可变域和人轻链的恒定部分,该可变域具有与seq id no:10中所示基本相同的氨基酸序列。或者,所公
开方法中所用的il-17抗体或其抗原结合片段例如苏金单抗可以是本文所示参考分子的氨基酸序列变体。在所有这些衍生物和变体的情况中,il-17抗体或其抗原结合片段例如苏金单抗能在约50nm或更小、约20nm或更小、约10nm或更小、约5nm或更小、约2nm或更小、或更优选约1nm或更小的所述分子浓度下抑制约1nm(=30ng/ml)人il-17的活性50%,所述抑制活性是在人皮肤成纤维细胞中通过人-il-17诱导的il-6产生而测定。
[0082]
对il-17结合至其受体的抑制可方便地在包括例如w0 2006/013107中所述的各种检测中进行测试。术语“达到相同程度”表示在本文提及的一种检测中,参比和衍生物分子在统计学基础上表现出基本上相同的il-17抑制活性(参见wo 2006/013107实施例1)。例如,对于人皮肤成纤维细胞中由人il-17诱导il-6产生的抑制,按wo 2006/013107实施例1中所述检测时,本文公开的il-17抗体或其抗原结合片段通常具有低于约10nm、更优选约9、8、7、6、5、4、3、2或约1nm的ic
50
,优选与相应参比分子的ic
50
基本相同。或者,所用检测可以是通过可溶性il-17受体(例如wo 2006/013107实施例1的人il-17r/fc结构)和本公开il-17抗体或其抗原结合片段来竞争性抑制il-17结合的检测。
[0083]
本公开还包括il-17抗体或其抗原结合片段例如苏金单抗,其中的vh或v
l
结构域的一或多个氨基酸残基(通常仅数个,例如1-10)相对于seq id no:8和seq id no:10所示的vh或v
l
结构域发生改变;例如通过突变,例如相应dna序列的定向诱变。本公开包括编码这些发生改变的il-17抗体的dna序列。
[0084]
本公开还包括对人il-17具有结合特异性的il-17抗体或其抗原结合片段例如苏金单抗,尤其是能抑制il-17结合至其受体的il-17抗体以及能以以下所述分子浓度抑制1nm(=30ng/ml)人il-17活性50%的il-17抗体:约50nm或更小、约20nm或更小、约10nm或更小、约5nm或更小、约2nm或更小、或更优选约1nm或更小(所述抑制活性通过在人皮肤成纤维细胞中由人-il-17诱导的il-6产生测定)。
[0085]
在一些实施方式中,il-17抗体例如苏金单抗结合至包含leu74、tyr85、his86、met87、asn88、val124、thr125、pro126、ile127、val128、his129的成熟人il-17表位。在一些实施方式中,il-17抗体例如苏金单抗结合至包含tyr43、tyr44、arg46、ala79、asp80的成熟人il-17表位。在一些实施方式中,il-17抗体例如苏金单抗结合至具有两条成熟人il-17链的il-17同型二聚体的表位,所述表位在一条链上包含leu74、tyr85、his86、met87、asn88、val124、thr125、pro126、ile127、val128、his129,并在另一条链上包含tyr43、tyr44、arg46、ala79、asp80。用于定义这些表位的残基编号方案是基于作为成熟蛋白质第一个氨基酸的残基(即缺少23氨基酸n-端信号肽并以甘氨酸开始的il-17a)。不成熟il-17a的序列在swiss-prot记录q16552中示出。在一些实施方式中,il-17抗体具有约100-200pm的kd,例如通过测定。在一些实施方式中,il-17抗体对于体外中和约0.67nm人il-17a生物活性的ic
50
约为0.4nm。在一些实施方式中,皮下(s.c.)施用il-17抗体的绝对生物利用度具有约60-约80%的范围,例如约76%。在一些实施方式中,il-17抗体例如苏金单抗,具有约4周的消除半衰期(例如约23至约35天、约23至约30天、例如约30天)。在一些实施方式中,il-17抗体例如苏金单抗具有约7-8天的t
max
。
[0086]
本公开的方法、应用、试剂盒等所用的特别优选的il-17抗体或其抗原结合片段例如苏金单抗是人型抗体,特别是如wo 2006/013107(us7807155,其通过引用全文纳入本文)的实施例1和2中所述的苏金单抗。苏金单抗是一种igg1/kappa同种型的重组高亲和力全人
源单克隆抗人白细胞介素-17a(il-17a、il-17)抗体,目前在临床试验中用于治疗免疫介导的炎性病症。苏金单抗(参见例如wo2006/013107和wo2007/117749)对于il-17具有非常高的亲和力,即,kd约为100-200pm(例如通过测定),且体外中和约0.67nm人il-17a生物活性的ic
50
约为0.4nm。因此,苏金单抗以约1:1的摩尔比抑制抗原。这种高结合亲和力使得苏金单抗抗体特别适合治疗应用。而且,已确定苏金单抗具有非常长的半衰期,即约4周,这允许施用间的周期延长,在治疗慢性终生病症例如银屑病时是一种优越的性质。
[0087]
包含il-17抗体或抗原结合片段的药物产品
[0088]
本公开宽泛地提供了包括容器和置于该容器内的液体组合物的药物产品,该容器的顶部空间中包含小于约12%的氧,该液体组合物包含上述il-17抗体或其抗原结合片段例如苏金单抗。
[0089]
容器
[0090]
本公开的药物产品采用初级包装即容器来储存、运输和保持所公开的液体组合物。药学上可接受的用作所公开药物产品一部分的容器包括注射器(例如可获自beckton dickinson、nuova ompi等)、带塞子的小瓶、药匣、自我注射器、膜片泵和注射笔。
[0091]
顶部空间氧
[0092]
我们发现,通过包含特定稳定剂(例如甲硫氨酸)并同时用惰性气体(例如氩、氦、氮)优选n2替换药物产品的顶部空间中的氧,能增强本公开液体组合物中il-17抗体或其抗原结合片段(例如苏金单抗)的稳定性。具体来说,我们发现相对于未吹扫产品,容器经过氧吹扫、即顶部空间中的氧小于约12%的药物产品具有提高的稳定性,例如通过sec和rp-hplc测定。
[0093]
使用吹扫(例如氮吹扫)来改变顶部空间中的氧含量可在填充阶段和/或压塞阶段(或两者)期间实现。可通过(例如使用针)主动引入惰性气体或在压塞期间实现吹扫(例如氮吹扫)。
[0094]
在一些实施方式中,顶部空间中的氧含量小于约12%(例如小于约10%、小于约8%、小于约6%等)。在一些实施方式中,顶部空间中的氧含量小于约6%。顶部空间中的氧含量可通过激光吸收光谱或荧光猝灭或气相色谱来监控。应理解,给定容器顶部空间中的氧含量可能随时间增大,例如因为漏气。因此,本文使用“顶部空间中的氧含量”表示产品封闭(例如压塞)之后即刻的容器顶部空间中的初始氧含量。
[0095]
液体组合物
[0096]
本公开的液体组合物包含如上所述的至少一种il-17抗体或其抗原结合片段(例如苏金单抗),以及至少一种其他赋形剂,例如缓冲剂、表面活性剂和稳定剂等。在一些实施方式中,液体组合物包含至少两种其他赋形剂,例如缓冲剂和稳定剂。在一些实施方式中,液体组合物包含缓冲液、至少一种稳定剂和表面活性剂。
[0097]
一般来说,药物组合物配制有与预期施用途径相容的赋形剂(例如,口服组合物通常包含惰性稀释剂或可食用载剂)。施用途径的示例包括胃肠外(例如静脉内)、皮内、皮下、经口(例如通过口或吸入)、透皮(局部)、透黏膜和直肠。本公开的液体抗体组合物适合于胃肠外施用例如静脉内、肌内、腹膜内或皮下注射;特别适合于皮下注射。
[0098]
在一些实施方式中,本公开的液体组合物在2-8℃储存6个月后保持至少约86%的rp-hplc纯度,在25℃/60%rh储存6个月后至少约76%的rp-hplc纯度(优选至少约76%),
和/或在30℃/75%rh储存6个月后至少约60%的rp-hplc纯度。在一些实施方式中,本公开的液体组合物在2-8℃储存24个月后保持至少约84%的rp-hplc纯度。
[0099]
在一些实施方式中,本公开的液体组合物在2-8℃储存6个月后保持至少约77%的cex纯度,在25℃/60%rh储存6个月后至少约62%的cex纯度,和/或在30℃/75%rh储存6个月后至少约50%的cex纯度。在一些实施方式中,本公开的液体组合物在2-8℃储存24个月后保持至少约73%的cex纯度。
[0100]
在一些实施方式中,本公开的液体组合物在2-8℃储存6个月后保持至少约98%的sec纯度,在25℃/60%rh储存6个月后至少约96%的sec纯度,和/或在30℃/75%rh储存6个月后至少约94%的sec纯度。在一些实施方式中,本公开的液体组合物在2-8℃储存24个月后保持至少约97%的sec纯度。
[0101]
在一些实施方式中,本公开的液体组合物在2-8℃储存6个月后保持至少约97%的ce-sds纯度(非还原性条件),在25℃/60%rh储存6个月后至少约95%的ce-sds纯度(非还原性条件),和/或在30℃/75%rh储存6个月后至少约94%(优选至少约92%)的ce-sds纯度(非还原性条件)。在一些实施方式中,本公开的液体组合物在2-8℃储存24个月后保持至少约97%的ce-sds纯度(非还原性条件)。
[0102]
在一些实施方式中,本文公开的液体组合物在2-8℃储存6个月后保持小于约0.57%的ce-sds杂质(还原性条件),在25℃/60%rh储存6个月后小于约1.1%的ce-sds杂质(还原性条件),和/或在30℃/75%rh储存6个月后小于约1.9%的ce-sds杂质(还原性条件)。在一些实施方式中,本公开的液体组合物在2-8℃储存24个月后保持小于约0.91%的ce-sds杂质(非还原性条件)。
[0103]
在一些实施方式中,本公开的液体组合物在2-8℃储存24个月后保持抑制c-20/a4软骨细胞il-6释放的至少约88%的相对生物活性,在25℃/60%rh储存6个月后抑制软骨细胞il-6释放的至少约94%的相对生物活性,和/或在30℃/75%rh储存6个月后抑制软骨细胞il-6释放的至少约85%的相对生物活性。
[0104]
抗体浓度
[0105]
本公开液体组合物中所用的il-17抗体或其抗原结合片段(例如苏金单抗)如上所述。一种优选的组合物包含苏金单抗。我们发现至少在约25mg/ml至约150mg/ml的范围内,抗体浓度不会显著影响组合物稳定性。因此在一些实施方式中,液体组合物中的抗体以至少25mg/ml的浓度存在(例如约25mg/ml至约150mg/ml)。在一些实施方式中,液体组合物中的抗体浓度为至少约25mg/ml、至少约50mg/ml、至少约75mg/ml、至少约100mg/ml或至少约150mg/ml的高浓度。在一些实施方式中,液体组合物中的抗体浓度为约25mg/ml-约150mg/ml的高浓度。在一个实施方式中,液体组合物中的苏金单抗浓度为约25mg/ml。在一个实施方式中,液体组合物中的苏金单抗浓度为约150mg/ml。
[0106]
缓冲液和ph
[0107]
用于本公开液体组合物的合适缓冲试剂包括但不限于葡糖酸盐缓冲液、组氨酸缓冲液、柠檬酸盐缓冲液、磷酸盐[例如钠或钾]缓冲液、琥珀酸盐[例如钠]缓冲液、乙酸盐缓冲液、tris缓冲液、甘氨酸、精氨酸及其组合。我们发现琥珀酸盐或乙酸盐缓冲液对苏金单抗液体组合物的稳定性没有有利影响。就sec、cex-酸性测得的降解产物和通过rp-hplc测得的聚集产物而言,柠檬酸盐缓冲液被评价为在组合物中是有益的。总体上,组氨酸缓冲液
在通过sec、cex酸性和rp-b测得的聚集和降解产物方面显示出优势。因此,对于所公开的稳定苏金单抗液体组合物而言,组氨酸缓冲液是优选的缓冲液。
[0108]
组氨酸缓冲液(例如浓度为约5mm至约50mm、例如约20mm至约50mm、约5mm、约10mm、约15mm、约20mm、约25mm、约30mm、约35mm、约40mm、约45mm、约50mm)是特别适用的。在一个实施方式中,稳定的液体组合物包含约20mm至约50mm组氨酸缓冲液。液体组合物的ph可在4.0-8.0范围内,其中在约5.5-约7.4范围内的ph是典型的,例如约5.2至约6.2、约5.2至约5.8、例如约5.2、约5.3、约5.4、约5.5、约5.6、约5.7、约5.8、约5.9、约6、约6.2、约6.4、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4。我们发现将ph从5.2升高到5.8观察到稳定性增大的趋势(sec-ap、dls、sec-dp、alp-dp、cex碱性、rp-hplc)。总体测试表明本公开液体组合物的理想组合物ph为5.8。因此在一个实施方式中,稳定的液体抗体组合物的ph为约5.8。
[0109]
表面活性剂
[0110]
适用于本公开液体组合物的表面活性剂包括但不限于非离子型表面活性剂、离子型表面活性剂、两性离子表面活性剂及其组合。用于本发明的典型表面活性剂包括但不限于山梨聚糖脂肪酸酯(例如山梨聚糖单辛酸酯、山梨聚糖单月桂酸酯、山梨聚糖单棕榈酸酯),山梨聚糖三油酸酯,甘油脂肪酸酯(例如甘油单辛酸酯、甘油单肉豆蔻酸酯、甘油单硬脂酸酯),聚甘油脂肪酸酯(例如十甘油基单硬脂酸酯、十甘油基二硬脂酸酯、十甘油基单亚油酸酯),聚氧乙烯山梨聚糖脂肪酸酯(例如聚氧乙烯山梨聚糖单月桂酸酯、聚氧乙烯山梨聚糖单油酸酯、聚氧乙烯山梨聚糖单硬脂酸酯、聚氧乙烯山梨聚糖单棕榈酸酯、聚氧乙烯山梨聚糖三油酸酯、聚氧乙烯山梨聚糖三硬脂酸酯),聚氧乙烯山梨醇脂肪酸酯(例如聚氧乙烯山梨醇四硬脂酸酯、聚氧乙烯山梨醇四油酸酯),聚氧乙烯甘油脂肪酸酯(例如聚氧乙烯甘油基单硬脂酸酯),聚乙烯乙二醇脂肪酸酯(例如聚乙烯乙二醇二硬脂酸酯),聚氧乙烯烷基醚(例如聚氧乙烯月桂基醚),聚氧乙烯聚氧丙烯烷基醚(例如聚氧乙烯聚氧丙烯乙二醇、聚氧乙烯聚氧丙烯丙基醚、聚氧乙烯聚氧丙烯鲸蜡基醚),聚氧乙烯烷基苯基醚(例如聚氧乙烯壬基苯基醚),聚氧乙烯氢化蓖麻油(例如聚氧乙烯蓖麻油、聚氧乙烯氢化蓖麻油),聚氧乙烯蜂蜡衍生物(例如聚氧乙烯山梨醇蜂蜡),聚氧乙烯羊毛脂衍生物(例如聚氧乙烯羊毛脂),和聚氧乙烯脂肪酸酰胺(例如聚氧乙烯硬脂酸酰胺);c10-c18烷基硫酸盐(例如鲸蜡基硫酸钠、月桂基硫酸钠、油烯基硫酸钠),具有平均添加2至4摩尔环氧乙烷单元的聚氧乙烯c10-c18烷基醚硫酸盐(例如聚氧乙烯月桂基硫酸钠),和c1-c18烷基磺基琥珀酸酯盐(例如月桂基磺基琥珀酸酯钠盐);和天然表面活性剂例如卵磷脂、甘油磷脂、鞘磷脂(例如神经鞘磷脂),和c12-c18脂肪酸的蔗糖酯。组合物可包含一或多种这些表面活性剂。优选的表面活性剂是泊洛沙姆(例如泊洛沙姆188)或聚氧乙烯山梨聚糖脂肪酸酯,例如聚山梨醇酯20、40、60或80。聚山梨醇酯80(tween80)(例如浓度为约0.01%-约0.1%(w/v)、例如约0.01%至约0.04%(w/v)、例如约0.01%、约0.02%、约0.04%、约0.06%、约0.08%、约0.1%)是特别合适的。在一个实施方式中,稳定的液体组合物包含约0.02%(w/v)聚山梨醇酯80。在一个实施方式中,稳定的液体组合物包含约0.02%(w/v)聚山梨醇酯20。
[0111]
我们发现在缺少表面活性剂的液体组合物中,浊度会显著增大,且可见颗粒数量会增大。但是与聚山梨醇酯20和80相比,除了alp-dp和rp增大以外,没有检测到泊洛沙姆188具有优势。在防止浊度增大、不溶性微粒和可见颗粒增多方面,聚山梨醇酯20和80显示
出可比的功效。因此,聚山梨醇酯20和80是优选的用于本公开的稳定液体组合物的表面活性剂。
[0112]
稳定剂
[0113]
稳定剂有助于防止药物组合物、尤其是液体药物组合物中的蛋白质氧化和聚集,这些药物组合物因水性溶液中的蛋白质容易氧化和/或聚集而具有较短货架保存期。可使用各种分析方法来评估给定组合物的稳定性,例如可使用rp-hplc来评估本公开液体组合物中的氧化产物(主峰之前)的含量,可使用sec评估本公开液体组合物中的聚集水平。
[0114]
适用于本公开液体组合物的稳定剂包括离子型和非离子型稳定剂(及其组合),例如糖、甘氨酸、氯化钠、精氨酸、edta、抗坏血酸钠、半胱氨酸、硫酸氢钠、柠檬酸钠、甲硫氨酸和苄醇。在一些实施方式中,液体药物组合物包含至少一种来自第1组的稳定剂(例如糖[例如海藻糖、甘露醇]、氨基酸[例如甘氨酸、精氨酸]和氯化钠)。在一些实施方式中,液体药物组合物包含至少一种来自第2组的稳定剂(edta、抗坏血酸钠、半胱氨酸、硫酸氢钠、柠檬酸钠、甲硫氨酸和苄醇)。第2组稳定剂倾向于具有抗氧化性质,可减少il-17抗体中的残基氧化。在优选的实施方式中,液体药物组合物包含两种稳定剂——一种来自第1组,一种来自第2组。
[0115]
对于第1组稳定剂,优选非离子型稳定剂。合适的非离子型稳定剂包括单糖、二糖和三糖,例如海藻糖、棉籽糖、麦芽糖、山梨醇或甘露醇。糖可以是糖醇或氨基糖。第1组稳定剂的浓度可为约175mm至约350mm、例如约200mm至约300mm、例如约250mm至约270mm、例如约180至约300mm、约200mm至约225mm、约175mm、约180mm、约185mm、约190mm、约195mm、约200mm、约225mm、约250mm、约270mm、275mm、约300mm。浓度为约200mm至约300mm(例如约250mm至约270mm)的甘露醇、浓度为约180mm至约300mm例如约200mm至约225mm的海藻糖、浓度为约130mm至约150mm的氯化钠、浓度为约160mm的精氨酸、浓度为约270mm的甘氨酸尤其有用。
[0116]
我们发现使用甘氨酸作为稳定剂(第1组)在sec-ap和dls方面略有优势,但是观察到几乎所有降解产物都增加。nacl作为稳定剂(第1组)导致通过sec和cex碱性变体测定的降解和聚集产物增加。几乎所有分析都验证海藻糖和甘露醇作为差不多的有益稳定剂发挥作用,但是甘露醇显示出略差的效果(sec-ap、dls),而且水溶性低于海藻糖。因此,由于其对降解产物的正向效果,海藻糖是优选的第1组稳定剂。在一个实施方式中,液体组合物包含约200mm至约225mm海藻糖。在一个实施方式中,液体组合物包含约200mm海藻糖。在一个实施方式中,液体组合物包含约225mm海藻糖。
[0117]
我们发现第2组稳定剂对苏金单抗液体组合物的稳定性产生显著影响。实验显示不使用第2组稳定剂不如包含第2组稳定剂的组合物(sec-ap、dls、浊度、rp-b)。edta四钠和半胱氨酸在各分析方法中都显示出聚集和降解产物增加。加入第2组稳定剂半胱氨酸时,在冻融应力之后得到浑浊的组合物,并在40℃储存4周之后沉淀。但是我们发现考虑分析结果,甲硫氨酸在所有组合物中都是有利的。因此,对于第2组稳定剂,优选还具有抗氧化性质的甲硫氨酸。第2组稳定剂(例如甲硫氨酸)的浓度可为至少约2.5mm、例如约2.5至约20mm、例如至少约2.5mm、至少约5mm、至少约10mm或至少约20mm(例如约2.5mm、约5mm、约10mm或约20mm)。在优选的实施方式中,液体药物组合物包含至少一种来自第1组的稳定剂和甲硫氨酸。在一些实施方式中,本公开液体组合物包含约5mm甲硫氨酸。
[0118]
其他赋形剂
[0119]
本公开的液体抗体组合物可包含其他赋形剂,例如其他缓冲剂、盐(例如氯化钠、琥珀酸钠、硫酸钠、氯化钾、氯化镁、硫酸镁和氯化钙)、其他稳定剂、张度调节剂(例如盐和氨基酸[例如脯氨酸、丙氨酸、l-精氨酸、天冬酰胺、l-天冬氨酸、甘氨酸、丝氨酸、赖氨酸和组氨酸])、甘油、白蛋白、醇、防腐剂、其他表面活性剂、抗氧化剂等。关于这些其他药物成分的详细讨论参见gennaro(2000)remington:the science and practice of pharmacy.第20版,isbn:0683306472。
[0120]
其他活性试剂
[0121]
il-17抗体或其抗原结合片段例如苏金单抗以外,本公开的药物产品和稳定液体组合物还可包含一或多种其他活性试剂(例如银屑病试剂、银屑病关节炎试剂、强直性脊柱炎试剂、类风湿性关节炎试剂)。药物组合物中可包含这些其他因子和/或试剂,从而与il-17抗体或其抗原结合片段例如苏金单抗产生协同效应,或者最大程度减小由il-17抗体或其抗原结合片段例如苏金单抗引起的副作用。
[0122]
可与本公开il-17抗体例如苏金单抗共同配制的银屑病试剂的示例包括环孢霉素、甲氨喋呤、吗替麦考酚酯、霉酚酸、柳氮磺吡啶、6-硫鸟嘌呤、富马酸酯(例如富马酸二甲酯和富马酸酯)、硫唑嘌呤、皮质类固醇、来氟米特、他克莫司、t-细胞阻断剂(例如(阿法赛特)和(依法珠单抗)、肿瘤坏死因子-α(tnf-α)阻断剂(例如(依那西普)、(阿达木单抗)、(英夫利昔单抗)和(戈利木单抗))和白细胞介素12/23阻断剂(例如(优特克单抗)、托法替尼和布雷奴单抗。
[0123]
可与本公开il-17抗体例如苏金单抗共同配制用于治疗银屑病的其他银屑病试剂包括阿普斯特、莫米松、伏环孢素、酮康唑、纽斯福特(neuroskin forte)、重组人白细胞介素-10、伏环孢素、mk-3222、托法替尼、vx-765、med-1545、氟非那嗪癸酸酯、扑热息痛、比莫西糖乳膏、多西环素、万古霉素、abgn168、维生素d3、ro5310074、氟达拉滨卡泊三醇和氢化可的松(leo 80190)、弗西特瑞亚(单价mf59-佐剂疫苗、tgaac94基因疗法载体、辣椒素、普赛克斯、abt-874(抗il-12)、idec-114、medi-522、le29102、bms 587101、cd 2027、crx-191、8-甲氧基补骨脂素或5-甲氧基补骨脂素、比西林l-a、ly2525623、incb018424、ly2439821、cep-701、cc-10004、赛妥珠单抗(czp)、gw786034(帕唑帕尼)、多西环素类姜黄素类c3复合物、nyc 0462、rg3421、hokt3γ1(ala-ala)、bt061、特立珠单抗、硫酸软骨素、cnto1275、il-12p40和il-23p40亚单元的单克隆抗体、bms-582949、mk0873、medi-507、m518101、abt-874、amg 827、an2728、amg714、amg 139、pth(1-34)、u0267 foam、cnto 1275、qrx-101、cnto1959、leo 22811、咪喹莫特、ctla4ig、巴氏杜氏藻、吡格列酮、吡美莫司、兰尼珠单抗、齐多夫定cdp870(赛妥珠单抗)、奥那西普(γ-htbp-1)、act-128800、4,4-二甲基-苯并异-2h-硒嗪、crx-191、crx-197、度骨化醇、las 41004、wbi-1001、他克莫司、rad001、雷帕霉素、罗格列酮、吡格列酮、abt-874、氨基蝶呤、an2728、cd2027、act-128800、糠酸莫米松、ct327、氯倍他索+lcd、btt1023、e6201、局部维生素b12、ip10.c8、bfh772、leo 22811、氟奋乃静、mm-093、clobex、sch 527123、cf101、srt2104、birt2584、cc10004、四硫钼酸盐、cp-690、550、u0267、asp015k、vb-201、阿曲汀a(也称为u0279)、rwj-445380、丙酸氯倍他索、a型肉毒
杆菌毒素、阿法赛特、厄洛替尼、bct194、罗氟司特、cnto 1275、乌倍他索、ilv-094、cta018乳膏、col-121、medi-507、aeb071。
[0124]
可与本公开il-17抗体例如苏金单抗共同配制的其他银屑病试剂包括il-6拮抗剂、cd20拮抗剂、ctla4拮抗剂、il-17拮抗剂、il-8拮抗剂、il-21拮抗剂、il-22拮抗剂、vgef拮抗剂、cxcl拮抗剂、mmp拮抗剂、防御素拮抗剂、il-1β拮抗剂和il-23拮抗剂(例如受体诱饵、拮抗抗体等)。可与苏金单抗共同配制的优选银屑病试剂是dmard(例如mtx和环孢霉素)、il-12/-23拮抗剂(例如优特克单抗),ctla-4拮抗剂(例如ctla4-ig)和tnf-α拮抗剂。
[0125]
宽泛地说,可与本公开il-17抗体例如苏金单抗共同配制的类风湿性关节炎试剂、银屑病关节炎试剂和强直性脊柱炎试剂可具体为免疫抑制剂、dmard、疼痛控制药、类固醇、非甾体抗炎药(nsaid)、细胞因子拮抗剂、骨合成代谢剂、骨抗再吸收剂,及其组合。代表性试剂包括环孢霉素、视黄醇、皮质类固醇、丙酸衍生物、乙酸衍生物、烯醇酸衍生物、灭酸衍生物、cox-2抑制剂、罗美昔布、布洛芬、胆碱水杨酸镁、非诺洛芬、双水杨酯、二氟苯水杨酸、托美汀、酮洛芬、氟比洛芬、奥沙普嗪、吲哚美辛、舒林酸、依托度酸、酮咯酸、萘丁美酮、萘普生、伐地考昔、艾托考昔、mk0966、罗非考昔、对乙酰氨基酚、塞来考昔、双氯芬酸、曲马多、吡罗昔康、美洛昔康、替诺昔康、哚昔康、氯诺昔康、伊索昔康、甲芬那酸、甲氯芬那酸、氯芬那酸、托芬那、伐地考昔、帕瑞昔布、依托度酸、吲哚美辛、阿司匹林、布洛芬、非罗考昔、甲氨蝶呤(mtx)、抗疟药(例如羟氯喹和氯喹)、柳氮磺吡啶、来氟米特、硫唑嘌呤、环孢霉素、氯金酸钠、米诺环素、环磷酰胺、d-青霉胺、米诺环素、金诺芬、他克莫司、硫代苯酸金钠、苯丁酸氮芥、tnfα拮抗剂(例如tnfα拮抗剂或tnfα受体拮抗剂)、例如阿达木单抗依那西普英夫利昔单抗(ta-650)、赛妥珠单抗(cdp870)、戈利木单抗cnto148)、阿那白滞素利妥昔单抗阿巴西普托珠单抗(roactemra/)、整合素拮抗剂((那他珠单抗))、il-1拮抗剂(acz885(ilaris))、阿那白滞素)、cd4拮抗剂、il-23拮抗剂、il-20拮抗剂、il-6拮抗剂、blys拮抗剂(例如阿塞西普,(贝利木单抗))、p38抑制剂、cd20拮抗剂(奥瑞珠单抗、奥法木单抗),干扰素γ拮抗剂(芳妥珠单抗)、泼尼松龙、泼尼松、地塞米松、考的索、可的松、氢化可的松、甲基泼尼松龙、倍他米松、氟羟泼尼松龙、倍氯米松、氟氢可的松、去氧皮质酮、醛固酮、sb-681323、rob 803、azd5672、ad 452、smp 114、hzt-501、cp-195、543、多西环素、万古霉素、crx-102、amg108、吡格列酮、sbi-087、scio-469、cura-100、oncoxin+viusid、twhf、pf-04171327、azd5672、甲氧沙林、arry-438162、维生素d-麦角钙化醇、米那普仑、紫杉醇、gw406381、罗格列酮、sc12267(4sc-101)、ly2439821、btt-1023、erb-041、erb-041、kb003、cf101、adl5859、mp-435、ilv-094、gsk706769、gw856553、ask8007、mor103、he3286、cp-690、550(托法替尼)、regn88(sar153191)、tru-015、bms-582949、sbi-087、ly2127399、e-551s-551、h-551、gsk3152314a、rwj-445380、他克莫司rad001、西罗莫司、雷帕霉素、福他替尼、芬太尼、xoma 052、cnto 136、jnj 38518168、伊马替尼、atn-103、isis 104838、叶酸、叶酸
盐、tnfαkinoid、mm-093、ii型胶原蛋白、vx-509、amg 827 70、马赛替尼(ab1010)、ly2127399、环孢霉素、sb-681323、mk0663、nnc 0151-0000-0000、atn-103、ccx 354-c、cam3001、lx3305、西曲瑞克、mdx-1342、tmi-005、mk0873、cdp870、曲尼司特、cf101、霉酚酸(及其酯)、vx-702、glpg0259、sb-681323、bg9924、art621、lx3305、t-614、福他替尼二钠(r935788)、cci-779、arry-371797、cdp6038、amg719、bms-582949、gw856553、罗格列酮、ch-4051、ce-224、535、gsk1827771、gw274150、bg9924、plx3397、tak-783、incb028050、ly2127399、ly3009104、r788、姜黄素(longvida
tm
)、瑞舒伐他汀、pro283698、amg 714、mtrx1011a、马拉维若、medi-522、mk0663、sta 5326甲磺酸盐、ce-224、535、amg108、bg00012(bg-12;biogen)、雷米普利、vx-702、crx-102、ly2189102、sbi-087、sb-681323、cdp870、米那普仑、pd 0360324、ph-797804、ak106-001616、pg-760564、pla-695、mk0812、ald518、考前列酮、促生长激素、tgaac94基因疗法载体、mk0359、gw856553、埃索美拉唑、依维莫司、曲妥珠单抗、骨合成代谢剂和骨抗再吸收剂(例如pth,二膦酸盐(例如唑来膦酸)、jak1和jak2抑制剂、泛jak抑制剂例如四环吡啶酮6(p6)、325、pf-956980、硬骨素蛋白拮抗剂(例如在wo09047356、wo2000/32773、wo2006102070、us20080227138、us20100028335、us 20030229041、wo2005003158、wo2009039175wo2009079471、wo03106657、wo2006119062、wo08115732、wo2005/014650、wo2005/003158、wo2006/119107、wo2008/061013、wo2008/133722、wo2008/115732、us7592429、us7879322、us7744874中公开的,它们的内容通过引用全文纳入本文[优选用于本公开方法、药物组合物、试剂盒和应用的抗壳硬蛋白抗体及其抗原结合部分参见wo09047356(等同于us7879322)、wo06119107(等同于us7872106和us7592429)和wo08115732(等同于us7744874)])、地诺单抗、il-6拮抗剂、cd20拮抗剂、ctla4拮抗剂、il-8拮抗剂、il-21拮抗剂、il-22拮抗剂、整合素拮抗剂((那他珠单抗))、vgef拮抗剂、cxcl拮抗剂、mmp拮抗剂、防御素拮抗剂、il-1拮抗剂(包括il-1β拮抗剂)和il-23拮抗剂(例如受体诱饵、拮抗抗体等)。可与本公开il-17抗体例如苏金单抗共同配制的优选类风湿性关节炎试剂是dmard(例如甲氨蝶呤)和tnfα拮抗剂。可与本公开il-17抗体例如苏金单抗共同配制的优选强直性脊柱炎试剂是nsaid、dmard(例如柳氮磺吡啶)和tnfα拮抗剂。可与本公开il-17抗体例如苏金单抗共同配制的优选银屑病关节炎试剂是dmards(例如环孢霉素)、ctla-4阻断剂(例如clta4-ig)、阿法塞特和tnfα拮抗剂。
[0126]
本领域技术人员能够了解以上试剂与本公开il-17抗体例如苏金单抗形成共组合物时的合适剂量。
[0127]
本文公开了稳定的液体药物组合物,其包含约20mg/ml至约175mg/ml(例如约25mg/ml至约150mg/ml)本公开il-17抗体或其抗原结合片段(例如苏金单抗)、约10mm至约30mm缓冲剂(例如组氨酸)ph 5.2-约6.0、约200mm至约225mm稳定剂(例如海藻糖)、约0.02%表面活性剂(例如聚山梨醇酯80)和约2.5mm至约20mm甲硫氨酸。
[0128]
在一些实施方式中,本公开药物的液体药物组合物中的甲硫氨酸浓度为约2.5mm、约5mm、约10mm或约20mm,优选约5mm。在一些实施方式中,液体药物组合物的ph为约5.8。在一些实施方式中,本公开组合物的苏金单抗浓度为约25mg/ml或约150mg/ml。在一些实施方式中,液体药物组合物包含选自组氨酸缓冲液、柠檬酸盐缓冲液、乙酸盐缓冲液和琥珀酸盐缓冲液的缓冲液。在一些实施方式中,液体药物组合物采用浓度为约20mm的组氨酸缓冲液。在一些实施方式中,液体药物组合物包含选自聚山梨醇酯和泊洛沙姆的表面活性剂。在一
些实施方式中,液体药物组合物还包含选自聚山梨醇酯80、聚山梨醇酯20和泊洛沙姆188的表面活性剂。在一些实施方式中,液体药物组合物包含浓度为约0.01%(w/v)至约0.04%(w/v)的聚山梨醇酯80,优选为约0.02%(w/v)。在一些实施方式中,液体药物组合物包含浓度为约0.02%(w/v)的聚山梨醇酯20。在一些实施方式中,液体药物组合物包含选自甘露醇、氯化钠、海藻糖、精氨酸hcl和甘氨酸的稳定剂。在一些实施方式中,液体药物组合物包含浓度为约180mm至约300mm的海藻糖,优选为约200mm或约225mm。
[0129]
本公开提供了药物产品,其包括:具有顶部空间的容器,其中该顶部空间中的氧含量小于约12%,以及置于所述容器内的ph为约5.2至约6.2的液体药物组合物,所述组合物包含:约20mg/ml至约175mg/ml(例如约25mg/ml至约150mg/ml)本公开il-17抗体或其抗原结合片段(例如苏金单抗);和约2.5至约20mm l-甲硫氨酸,其中该液体药物组合物并非自冻干物复溶。
[0130]
在一些实施方式中,本公开药品的液体药物组合物中甲硫氨酸浓度为约2.5mm、约5mm、约10mm或约20mm,优选约5mm。在一些实施方式中,本公开药物产品顶部空间中的氧含量小于约10%,例如小于约8%,优选小于约6%。在一些实施方式中,本公开药物产品的液体药物组合物的ph为约5.8。在一些实施方式中,本公开药物产品的苏金单抗浓度为约25mg/ml或约150mg/ml。在一些实施方式中,本公开药物产品的液体药物组合物还包含选自组氨酸缓冲液、柠檬酸盐缓冲液、乙酸盐缓冲液和琥珀酸盐缓冲液的缓冲液。在一些实施方式中,本公开药物产品的液体药物组合物采用浓度为约10mm至约30mm的缓冲液。在一些实施方式中,本公开药物产品的液体药物组合物采用浓度为约20mm的组氨酸缓冲液。在一些实施方式中,本公开药物产品的液体药物组合物还包含选自聚山梨醇酯和泊洛沙姆的表面活性剂。在一些实施方式中,本公开药物产品的液体药物组合物还包含选自聚山梨醇酯80、聚山梨醇酯20和泊洛沙姆188的表面活性剂。在一些实施方式中,本公开药物产品的液体药物组合物还包含浓度为约0.01%(w/v)至约0.04%(w/v)、优选为约0.02%(w/v)的聚山梨醇酯80。在一些实施方式中,本公开药物产品的液体药物组合物还包含浓度为约0.02%(w/v)的聚山梨醇酯20。在一些实施方式中,本公开药物产品的液体药物组合物还包含选自甘露醇、氯化钠、海藻糖、精氨酸hcl和甘氨酸的稳定剂。在一些实施方式中,本公开药物产品的液体药物组合物还包含浓度为约180mm至约300mm、优选为约200mm至约225mm的海藻糖。在一些实施方式中,本公开药物产品的容器是药匣、注射器、笔或小瓶。
[0131]
本公开提供了药物产品,其包括:具有顶部空间的容器,其中该顶部空间中的氧含量小于约6%;和置于所述容器内的液体药物组合物,所述组合物包含约20mg/ml至约175mg/ml(例如约25mg/ml至约150mg/ml)本公开il-17抗体或其抗原结合片段(例如苏金单抗)、约10mm至约30mm ph 5.8的组氨酸、约200mm至约225mm海藻糖、约0.02%聚山梨醇酯80和约2.5mm至约20mm甲硫氨酸,其中该液体药物组合物并非自冻干物复溶。
[0132]
在一些实施方式中,药物产品包含约25mg/ml苏金单抗和约225mm海藻糖。在一些实施方式中,药物产品包含约150mg/ml苏金单抗和约200mm海藻糖。在一些实施方式中,本公开药物产品的容器是药匣、注射器、笔或小瓶。
[0133]
在一些实施方式中,药物产品具有足够量的il-17拮抗剂以能够递送每单位剂量至少约75mg-约300mg的il-17拮抗剂(例如il-17抗体,例如苏金单抗)。在一些实施方式中,药物产品具有足够量的il-17拮抗剂(例如il-17抗体,例如苏金单抗)以能够递送每单位剂
量至少约10mg/kg。在一些实施方式中,将药物产品配制成能够静脉内递送每单位剂量约10mg/kg的il-17拮抗剂(例如il-17抗体,例如苏金单抗)的剂量。在一些实施方式中,将药物产品配制成能够皮下递送每单位剂量约75mg-约300mg的il-17拮抗剂(例如il-17抗体,例如苏金单抗)的剂量。
[0134]
制造液体组合物和药物产品的工艺
[0135]
本文还描述了制造本公开药物产品和液体组合物的工艺。这些工艺帮助减少本公开il-17抗体的氧化。简言之,液体组合物如下制备:将所需赋形剂(例如第1组稳定剂(例如海藻糖)、第2组稳定剂(甲硫氨酸)、表面活性剂(例如ps80)、缓冲液(例如组氨酸))与il-17抗体或其抗原阶段片段(例如苏金单抗)组合至所需浓度(例如约25至约150mg/ml苏金单抗、约20mm ph 5.8的组氨酸、约200mm至约225mm海藻糖、约0.02%聚山梨醇酯80和约2.5mm至约20mm甲硫氨酸)和ph(例如约ph 5.8)。然后将这种液体组合物置于所选容器中(例如小瓶、注射器、药匣[例如与自我注射器一起使用])。将顶部空间中的氧含量调节至所需水平(例如小于约12%、小于10%、小于约8%、小于约6%等),该调节可在用液体组合物填充容器之前、用液体组合物填充容器过程中、或在压塞/密封容器过程中进行。
[0136]
本公开提供了减少苏金单抗氧化的工艺,包括:制备ph为约5.2至约6.2并包含约20mg/ml至约175mg/ml(例如约25mg/ml至约150mg/ml)本公开il-17抗体或其抗原结合片段(例如苏金单抗)和约2.5mm至约20mm甲硫氨酸的液体组合物;将所述液体组合物置于具有顶部空间的容器中;将顶部空间中的氧含量调节至小于或等于约12%。
[0137]
在本公开工艺的一些实施方式中,调节步骤c)通过使用惰性气体吹扫顶部空间来进行。在本公开工艺的一些实施方式中,惰性气体是氮或氩。在本公开工艺的一些实施方式中,液体组合物中甲硫氨酸浓度为约2.5mm、约5mm、约10mm或约20mm,优选约5mm。在本公开工艺的一些实施方式中,将顶部空间中的氧含量调节至小于约10%,例如小于约8%,优选小于约6%。在本公开工艺的一些实施方式中,液体组合物的ph为约5.8。在本公开工艺的一些实施方式中,液体组合物中苏金单抗浓度为约25mg/ml或约150mg/ml。在本公开工艺的一些实施方式中,容器是药匣、注射器、笔或小瓶。
[0138]
使用药物产品和液体组合物的方法
[0139]
本公开药物产品和液体组合物将被用于治疗例如罹患自身免疫疾病(例如银屑病、类风湿性关节炎、强直性脊柱炎、银屑病关节炎等)的患者。当然,合适剂量将根据例如要使用的特定il-17抗体或其抗原结合片段例如苏金单抗、宿主、施用模式以及待治疗病症的性质和严重性来变化,并取决于患者经历的先前治疗的性质。最终,主治的健康护理提供者将决定其治疗的每个个体患者的il-17抗体量。在一些实施方式中,主治的健康护理提供者可施用低剂量的il-17抗体并观察患者响应。在其他实施方式中,施用于患者的il-17抗体初始剂量较高,然后逐渐向下滴定直至出现复发信号。可施用较大剂量的il-17抗体直至患者获得最佳治疗效果,一般不再增加剂量。
[0140]
通常从活性化合物(例如苏金单抗)第一剂量那天(称为“基线”)开始测量给药时间。但是不同的健康护理提供者使用不同的命名规则,如下
[0141]
表2中所示。
[0142]
周0/11/22/33/44/55/66/77/88/9等第1天0/17/814/1521/2228/2935/3642/4349/5056/57等
[0143]
表2-常规的给药方案命名规则。粗体项表示本文所用的命名规则。
[0144]
显然,零周可能被一些健康护理提供者称为第1周,而零天可能被一些健康护理提供者称为第一天。因此,不同的医师可以指定,例如在第3周期间/在第21天、在第3周期间/在第22天、在第4周期间/在第21天、在第4周期间/在第22天的剂量,都表示相同的给药安排。出于一贯性,在本文中将给药首周称为第0周,而将给药的首日称为第1天。但是本领域技术人员应理解,使用这种命名规则只是简单地为了保持一贯性,不应理解为限制性的,即周剂量是il-17抗体或其抗原结合片段例如苏金单抗的一周的剂量,不论医师是否将特定周称为“第1周”或“第2周”。作为采用本文指定规则的命名示例,可在第0周期间(例如在约第1天)、在第1周期间(例如在约第8天)、在第2周期间(例如在约第15天)、在第3周期间(例如在约第22天)和在第4周期间(例如在约第29天)提供每周施用的五个剂量苏金单抗。应理解,剂量不需在确切时间点提供,例如应大约在第29天的剂量可以在例如第24天至第34天、例如第30天提供,只要在合适的那周内提供。
[0145]
在一些实施方式中,本公开方法和应用采用持续1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或16周的初始(有时候称为“诱导”)方案。在一些实施方式中,初始方案在第0、1、2和3周期间使用剂量。在其他实施方式中,初始方案在第0、1、2、3、4、8和12周期间使用剂量。在一些实施方式中,初始方案包括施用若干(例如1、2、3、4、5、6、7,优选4或5)个剂量的约150mg-300mg、例如约四或五个剂量的150mg或300mg(优选五个剂量的约150mg-约300mg)的il-17抗体例如苏金单抗。在其他实施方式中,初始剂量每周、每两周、每隔一周或每月[每4周]递送,优选每周递送。在一些实施方式中,在第0、1、2和3周以初始剂量通过皮下注射施用150mg或300mg的il-17抗体例如苏金单抗。
[0146]
对于维持方案,可每个月(也称为“每月”剂量)(即每4周,即约每28天)、每两个月(即每8周,即约每56天)、或每三个月(即每12周,即约每84天)提供一个剂量。在一些实施方式中,维持方案在第12周后开始。在一些实施方式中,维持方案在第3周后开始。维持方案的第一个剂量通常在自诱导方案最终剂量起算的某个日期施用。因此举例来说,若诱导方案的最终剂量在第12周期间给出,则作为每月[每4周]维持方案一部分的第一个剂量将在第16周期间递送,作为每两个月维持方案一部分的第一个剂量将在第20周期间递送,作为每三个月维持方案一部分的第一个剂量将在第24周期间递送等。在一些实施方式中,维持方案包括每周、每两周、每月[每4周]、每隔一个月、每季度、每半年或每年施用一个剂量的il-17抗体或其抗原结合片段例如苏金单抗。在一些实施方式中,维持方案采用每月剂量(每4周)。在一些实施方式中,维持方案的第一个剂量在第4周期间或第16周期间递送。在一些实施方式中,维持方案包括施用一个剂量的约150mg-300mg(例如约150mg或约300mg)的il-17抗体或其抗原结合片段例如苏金单抗。
[0147]
在加载方案、诱导方案和/或维持方案期间,il-17抗体例如苏金单抗的递送可经由皮下途径例如递送约75mg-约300mg(例如约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg)的剂量,经由静脉内途径例如递送约1mg/kg-约50mg/kg(例如约1mg/kg、约3mg/kg、约10mg/kg、约30mg/kg、约40mg/kg、约50mg/kg等)的剂量,或任意其他施用途径(例如肌内,i.m.)。在优选的实施方式中,il-17抗体的剂量是皮下递送的。
[0148]
在优选的实施方式中,通过皮下注射在第0、1、2和3周以初始剂量、然后在第4周开
始以每月维持剂量向患者施用约150mg-约300mg(例如约150mg或约300mg)剂量的il-17抗体或其抗原结合片段例如苏金单抗。在此方案中,给药发生在第0、1、2、3、4、8、12、16、20周等各周。300mg剂量可以两次150mg皮下注射提供。
[0149]
本公开提供了治疗自身免疫疾病(例如银屑病、类风湿性关节炎、强直性脊柱炎、银屑病关节炎)的方法,包括向需要的患者通过皮下注射以第0、1、2和3周的初始剂量、以及随后在第4周开始的每月维持剂量施用约150mg-约300mg(例如约150mg或约300mg)剂量的il-17抗体或其抗原结合片段例如苏金单抗,其中该il-17抗体或其抗原结合片段例如苏金单抗作为药物组合物的一部分提供,该药物组合物包含以下组分:约20mg/ml至约175mg/ml(例如约25mg/ml至约150mg/ml)本公开il-17抗体或其抗原结合片段(例如苏金单抗)、ph为约5.2至约6.2的缓冲液和约2.5至约20mm的甲硫氨酸,其中该液体药物组合物并非自冻干物复溶。
[0150]
本公开提供了il-17抗体(例如苏金单抗)用于制备治疗患者自身免疫疾病(例如银屑病、类风湿性关节炎、强直性脊柱炎、银屑病关节炎)所用药物的应用,其中该药物经配制包括容器以及置于所述容器内的液体药物组合物,各容器具有氧含量小于约12%(例如小于约10%、小于约8%、小于约7%、小于约6%等)的顶部空间,所述组合物包含:约20mg/ml至约175mg/ml(例如约25mg/ml至约150mg/ml)本公开il-17抗体或其抗原结合片段(例如苏金单抗);ph为约5.2至约6.2的缓冲液;和约2.5至20mm的甲硫氨酸,其中该液体药物组合物并非自冻干物复溶。
[0151]
包含药物产品和液体组合物的试剂盒
[0152]
本公开还涵盖用于治疗各种自身免疫疾病(例如银屑病)的试剂盒。这些试剂盒大体包括至少一种本公开药物产品或液体组合物以及使用说明。该说明公开了将稳定的液体组合物提供给患者作为给药方案一部分的合适技术。这些试剂盒还可包含用于治疗自身免疫疾病例如银屑病的其他试剂(如上所述),用于与所含液体组合物联合(即同时或按顺序[之前或之后])递送。
[0153]
本公开提供了用于治疗罹患自身免疫疾病(例如银屑病)的患者的试剂盒,其包括:a)具有顶部空间的容器,其中该顶部空间中的氧含量小于约12%(例如小于约10%、小于约8%、小于约7%、小于约6%等),b)置于所述容器内的液体药物组合物,所述组合物包含:i)约20mg/ml至约175mg/ml(例如约25mg/ml至约150mg/ml)本公开il-17抗体或其抗原结合片段(例如苏金单抗);ii)ph为约5.2至约6.2的缓冲液;和iii)约2.5至20mm甲硫氨酸,其中该液体药物组合物并非自冻干物复溶;和c)用于向患者施用该液体药物组合物的说明。在一些实施方式中,该容器是笔、预充装注射器、自我注射器或小瓶。
[0154]
概述
[0155]
在本公开的一些实施方式中,il-17抗体或其抗原结合片段选自:a)il-17抗体,其结合包含leu74、tyr85、his86、met87、asn88、val124、thr125、pro126、ile127、val128、his129的il-17表位;b)il-17抗体,其结合包含tyr43、tyr44、arg46、ala79、asp80的il-17表位;c)il-17抗体,其结合具有两个成熟的il-17蛋白链的il-17同型二聚体的表位,所述表位在一条链上包含leu74、tyr85、his86、met87、asn88、val124、thr125、pro126、ile127、val128、his129且在另一条链上包含tyr43、tyr44、arg46、ala79、asp80;d)il-17抗体,其结合具有两条成熟il-17蛋白链的il-17同型二聚体的表位,所述表位在一条链上包含leu74、
tyr85、his86、met87、asn88、val124、thr125、pro126、ile127、val128、his129并在另一条链上包含tyr43、tyr44、arg46、ala79、asp80,其中该il-17结合分子具有(例如通过测得)约100-约200pm的kd,并且其中该il-17结合分子具有约23-约30天的体内半衰期;和e)包含选自下组抗体的il-17抗体:i)免疫球蛋白重链可变域(vh),包含如seq id no:8所示的氨基酸序列;ii)免疫球蛋白轻链可变域(v
l
),包含如seq id no:10所示的氨基酸序列;iii)包含如seq id no:8所示氨基酸序列的免疫球蛋白vh结构域和包含如seq id no:10所示氨基酸序列的免疫球蛋白v
l
结构域;iv)按顺序包含如seq id no:1、seq id no:2和seq id no:3所示高变区的免疫球蛋白vh结构域;v)按顺序包含如seq id no:4、seq id no:5和seq id no:6所示高变区的免疫球蛋白v
l
结构域;vi)按顺序包含如seq id no:11、seq id no:12和seq id no:13所示高变区的免疫球蛋白vh结构域;vii)按顺序包含如seq id no:1、seq id no:2和seq id no:3所示高变区的免疫球蛋白vh结构域和按顺序包含如seq id no:4、seq id no:5和seq id no:6所示高变区的免疫球蛋白v
l
结构域;和viii)按顺序包含如seq id no:11、seq id no:12和seq id no:13所示高变区的免疫球蛋白vh结构域和按顺序包含如seq id no:4、seq id no:5和seq id no:6所示高变区的免疫球蛋白v
l
结构域;ix)包含如seq id no:15(具有或没有c-端赖氨酸)所示氨基酸序列的免疫球蛋白重链;x)包含如seq id no:14所示氨基酸序列的免疫球蛋白轻链;xi)包含如seq id no:15(具有或没有c-端赖氨酸)所示氨基酸序列的免疫球蛋白重链和包含如seq id no:14所示氨基酸序列的免疫球蛋白轻链。在本公开方法的一些实施方式中,il-17抗体或其抗原结合片段是人型抗体,优选苏金单抗。
[0156]
本公开一或多个实施方式的细节伴随以上说明书中提出。虽然可使用与本文所述类似或相同的任何方法和材料来实施或测试本公开,但是以下描述优选的方法和材料。通过说明书和权利要求书,本文公开的其他特点、目的和优点将是显而易见的。在说明书和所附权利要求书中,单数形式包括复数指代物,除非上下文中清楚地另外指明。除非另有定义,本文使用的所有技术和科学术语都具有本公开所属领域普通技术人员通常所理解的相同含义。说明书中引用的所有专利和出版物都通过引用纳入本文。为更全面说明本公开的优选实施方式,呈现以下实施例。这些实施例决不应理解为限制所公开主题的范围,该范围由所附权利要求书限定。
[0157]
实施例
[0158]
应理解本文所述的实施例和实施方式仅是为了说明目的,本领域技术人员能由此想到的各种修饰和变化都包括在申请书的精神和范围以及权利要求书的范围之内。
[0159]
这些实施例描述了苏金单抗的稳定液体组合物的开发。数据显示组合物ph和第2组稳定剂的选择对液体组合物的稳定性有很大影响。数据还显示顶部空间的氧含量对液体组合物的稳定性的影响。抗体浓度、表面活性剂选择、第1组稳定剂的选择以及缓冲体系的选择对稳定性的影响较小。因此,当考虑对稳定性具有较大影响的变量时,所公开的药物产品包括具有顶部空间的容器(例如pfs或小瓶),其中该顶部空间中的氧含量小于约12%,以及置于所述容器内的液体药物组合物,所述组合物的ph为约5.2至约6.2并包含浓度为约20mg/ml至175mg/ml的苏金单抗和约2.5至约20mm l-甲硫氨酸。当既考虑对稳定性具有大影响又考虑对稳定具有小影响的变量时,所公开的药物产品包括具有顶部空间的容器(例如pfs或小瓶),其中该顶部空间中的氧含量小于约12%,以及置于所述容器内的液体药物
组合物,所述组合物的ph为约5.2至约6.2,并且包含苏金单抗、缓冲液、表面活性剂、稳定剂和约2.5至约20mm l-甲硫氨酸。
[0160]
根据下述数据,优选的液体组合物包含约25mg/ml-约165mg/ml苏金单抗、约185mm-约225mm海藻糖、约0.01%-约0.03%聚山梨醇酯80、约2.5mm-约20mm l-甲硫氨酸和约ph为约5.8的10-30mm组氨酸缓冲液(例如约20mm组氨酸缓冲液)。
[0161]
一种优选的液体组合物i包含约150mg/ml苏金单抗、约200mm海藻糖、约0.02%聚山梨醇酯80、约5mm l-甲硫氨酸和约20mm ph为约5.8组氨酸缓冲液。一种优选的药物产品i包含置于预充装注射器(pfs)中的上述液体组合物i。
[0162]
另一种优选的液体组合物ii包含约25mg/ml苏金单抗、约225mm海藻糖、约0.02%聚山梨醇酯80、约5mm l-甲硫氨酸和约20mm ph为约5.8组氨酸缓冲液。一种优选的药物产品ii包含置于小瓶中的上述液体组合物ii。
[0163][0164]
表3:实施例中使用的缩写
[0165][0166]
表4:实施例中使用的分析
[0167]
1.1部分i-详细分析对苏金单抗液态稳定性产生较大影响的变量(顶部空间氧、ph和l-甲硫氨酸)
[0168]
1.1.1实施例1:l-甲硫氨酸
[0169]
使用一大组分析技术表征了若干抗氧化稳定剂对苏金单抗稳定性的影响。
[0170]
在早期研究中,对一定范围的抗氧化稳定剂进行了评价,包括edta四钠、抗坏血酸钠、半胱氨酸、硫酸氢钠和柠檬酸钠。虽然这些稳定剂中没有一种稳定剂充分地稳定了该分子,但是与不含抗氧化稳定剂的组合物相比,还是在sec测得的聚集产物上观察到edta四钠和柠檬酸钠产生少量的稳定影响(数据未显示)。
[0171]
在进一步研究中,使用150mg/ml的苏金单抗浓度采用doe方法,评价了10mm浓度的稳定剂半胱氨酸、edta四钠和l-甲硫氨酸并与无稳定剂的情况比较。将组合物填充到pfs中并以长期(5℃)、加速(25℃)和应力(40℃)条件进行2个月的稳定性研究,并就物理稳定性(ap-sec、dls、浊度、通过光阻法测得的可见颗粒和不溶性微粒)、化学稳定性(cex纯度、rp-hplc纯度、颜色)和生物活性指示子(cys-cex活性、游离sh基团)进行评价。另外,向填充在2ml小瓶中的组合物施加了冻融(-20℃至室温的5个循环)和摇动应力(150rpm保持一周)。
[0172]
发现l-甲硫氨酸是用于苏金单抗的最好的第2组稳定剂。这可通过cex纯度和rp-hplc纯度测得的较高纯度水平、较低的浊度水平和可见颗粒计数来证明。与没有稳定剂的
组合物相比,l-甲硫氨酸存在时显示出明显更好的稳定性。在25℃和40℃加速条件下进行8周稳定性测试之后,具有l-甲硫氨酸的组合物具有较低水平的ap-sec、更一致的dls数据、较低的浊度以及较少量的通过rp-hplc测得的主峰之前物质。edta由于ap-sec、dls、通过cex测得的碱性变体、以及通过rp-hplc测得的主峰之前物质增加而不利。各种分析方法都显示半胱氨酸会导致几乎所有的聚集和降解产物都增加。
[0173]
图1列出在不同条件下储存之后的选定性质属性。只有l-甲硫氨酸观察到对苏金单抗具有一致的稳定效果。特别在通过rp-hplc(图1b)测得的主峰之前物质和ap-sec(图1d)观察到稳定效果。还在浊度和通过dlc测得的流体动力学半径方面观察到进一步的效果。在后续研究中评价了不同l-甲硫氨酸浓度对苏金单抗性质属性的影响。
[0174]
图2显示在25℃储存期间,苏金单抗浓度为25mg/ml、海藻糖浓度为225mm、聚山梨醇酯80浓度为0.02%、ph 5.8组氨酸缓冲液时在有和没有l-甲硫氨酸情况下通过rp-hplc测得的主峰之前物质的变化。将组合物填充到2ml小瓶中并在应力条件下储存长达3个月。黑色虚线代表由包含0mm l-甲硫氨酸的组合物获得值的线性拟合,灰色虚线代表由包含10mm l-甲硫氨酸的组合物获得值的线性拟合。显然,在包含l-甲硫氨酸的情况中观察到降解动力学减小。
[0175]
对于包含150mg/ml苏金单抗的组合物还观察到浓度依赖性影响。对于海藻糖浓度在200mm和300mm之间、聚山梨醇酯80浓度在0.01%和0.04%之间以及l-甲硫氨酸浓度在0mm至10mm的组合物进行了研究。将组合物填充到1ml pfs中并在长期、加速和应力条件下储存长达三个月。监控苏金单抗的物理(ap-sec、dls、通过光阻法测得的不溶性颗粒以及可见颗粒、浊度)和化学(cex纯度、rp-hplc纯度、颜色)稳定性以及生物活性。
[0176]
图3显示在25℃储存6个月之后通过rp-hplc测得的主峰之前的物质。虽然海藻糖和聚山梨醇酯80对降解的影响可以忽略,但是在l-甲硫氨酸存在下观察到明显减小的降解水平。与有和没有l-甲硫氨酸时的苏金单抗稳定性相比,这种影响更为显著,而且也观察到在2.5-10mm l-甲硫氨酸范围中的浓度依赖性。
[0177]
在长期储存(长达30个月)之后,在填充到1ml pfs的组合物中观察到相同的l-甲硫氨酸稳定效果,所述组合物包含在ph 5.8组氨酸缓冲液中的150mg/ml苏金单抗、200mm海藻糖、0.02%聚山梨醇酯80。图4显示在5℃储存长达30个月期间的ap-sec(a)和通过rp-hplc测得的主峰之前物质(b)。黑色虚线代表由包含5ml l-甲硫氨酸的组合物获得值的线性拟合,灰色虚线代表由包含0mm l-甲硫氨酸的组合物获得值的线性拟合。显然,在l-甲硫氨酸存在时观察到减小的降解动力学。
[0178]
在评价l-甲硫氨酸浓度(0-20mm)对苏金单抗稳定性(150mg/ml,海藻糖200mm,聚山梨醇酯80 0.02%,ph 5.8组氨酸缓冲液)影响的研究中进一步验证了浓度依赖性。将不同的组合物填充到pfs中并在长期和加速条件下储存13个月和30个月(仅5℃)。通过在之前筛选中已观察到指示稳定性的一组选定的分析技术(rp-hplc纯度、sec纯度、浊度)来评估苏金单抗稳定性。无法从浊度测量得出清楚的趋势结论。但是,ap-sec和通过rp-hplc测得的主峰之前物质清楚显示出对l-甲硫氨酸浓度的依赖性。该影响在实时储存条件下较小,但是在25℃下观察到明显差异(图5)。
[0179]
在25℃储存13个月之后,没有l-甲硫氨酸的组合物中通过sec测得的聚集物水平从t0时<1%的起始水平增加到4.5%。通过在组合物中加入l-甲硫氨酸,团聚体形成的增
加对于2.5mm l-甲硫氨酸降至3.5%,对于5mm降至3.0%,对于20mm降至2.2%。在5℃时,无l-甲硫氨酸的组合物和包含20mm l-甲硫氨酸的组合物之间的差别仅为0.3%。对于含0mm l-甲硫氨酸的样品,在25℃储存13个月期间,通过rp-hplc测得的主峰之前物质从9.1%增加至42.7%。该rp-hplc主峰之前物质的增加对于包含2.5mm l-甲硫氨酸的样品降至39.4%,对于5.0mm降至37.8%,对于20mm降至34.5%。总的来说,在l-甲硫氨酸的存在下,在pfs中在5℃和25℃储存期间,观察到ap-sec和rp-hplc主峰之前物质的水平降低。在25℃储存之后观察到的差异更为明显,但是在5℃储存之后观察到的差异也是可检测的。
[0180]
与没有l-甲硫氨酸的组合物相比,在2.5mm l-甲硫氨酸水平的降解速率就有明显减小。这也在0、2.5和5.0mm l-甲硫氨酸存在下比较苏金单抗稳定性的进一步研究中也得到验证。在预期储存条件下储存24个月之后,在rp-hplc纯度、sec纯度以及浊度方面,没有在包含2.5mm和5.0mm l-甲硫氨酸的组合物之间观察到差异。
[0181]
向小瓶中的液体抗体组合物加入l-甲硫氨酸还使ap-sec和ce-sds杂质(非还原性)减小(图6)。有趣的是,对于小瓶中有25mg/ml苏金单抗的液体抗体组合物观察到减小的l-甲硫氨酸浓度依赖性(图6),表明较低浓度的l-甲硫氨酸就足以保持具有较低抗体浓度的组合物中的抗体完整性和稳定性。
[0182]
根据来自以上实验的组合数据,对于苏金单抗的液体组合物,理想的甲硫氨酸浓度为至少2.5mm(优选约5mm),且优于其他的第2组稳定剂。
[0183]
1.1.2实施例2:顶部空间氧含量
[0184]
1.1.2.1初级包装-pfs:
[0185]
在150mg/ml苏金单抗浓度和在具有200mm海藻糖、5mm l-甲硫氨酸、0.02%聚山梨醇酯80的ph 5.8组氨酸缓冲液的组合物中评价顶部空间氧含量对苏金单抗稳定性的影响。将组合物填充到来自各pfs供应商的1ml pfs中。测得的顶部空间氧含量分别为13%和15%之间(0.5ml填充体积)或3-4%之间(0.5ml填充体积)/7-8%之间(1.0ml填充体积)。将样品在长期、加速和应力条件下储存长达六个月。将选定的组合物在长期条件下储存长达24个月。通过以下监控苏金单抗稳定性:sec纯度、rp-hplc纯度、cex纯度、ce-sds纯度(非还原性)、浊度、颜色、游离sh基团、生物活性、通过光阻法测得的不溶性微粒和可见颗粒。
[0186]
在长期、加速和应力条件通过rp-hplc主峰之前物质和ap-sec观察顶部空间氧含量的影响。图7显示在25℃储存长达9个月期间的ap-sec。显然顶部空间氧含量在13-15%之间的pfs显示在25℃条件下聚集增多。但是在2-8℃储存条件下,几乎没有与顶部空间氧含量相关的聚集水平绝对差异(6个月数据)(数据未显示)。
[0187]
在5℃储存12个月期间、在加速条件下(25℃)储存6个月期间以及在应力条件下(40℃)储存3个月期间,进一步评价6%至21%范围内不同的顶部空间氧含量水平(即无吹扫)对苏金单抗性质属性(浊度、sec纯度、rp-hplc纯度、ce-sds纯度(非还原性)、游离sh基团、生物活性、通过光阻法测定的不溶性微粒、可见颗粒、颜色)的影响。在150mg/ml苏金单抗且包含200mm海藻糖、5ml的l-甲硫氨酸、0.02%聚山梨醇酯80的ph 5.8组氨酸缓冲液的组合物中进行研究。将样品填充到pfs中并用经检定的氧混合物吹扫以获得目标顶部空间氧含量。
[0188]
经过储存时间在浊度方面没有观察到变化;没有观察到顶部空间氧含量对通过光阻法测得的不溶性微粒、颜色和游离sh基团的明显影响,而且不同顶部空间氧含量样品之
间的差异在方法的分散性之内。在5℃或25℃的储存期间,甲硫氨酸浓度没有发生相关变化,且不考虑顶部空间氧含量,在5℃保持12个月之后观察到为4.9mm(初始值为4.9-5.0mm)。
[0189]
不同于显示顶部空间氧含量对sec聚集产物产生相对较大影响的前期发现,在这个实验中,在预期储存条件下(5℃)储存长达12个月期间仅观察到较小的变化,甚至在未吹扫的参照样品中也是如此。在具有不同的顶部空间氧含量的样品之间,对于所测试的不同稳定性点(在2-8℃储存长达12个月以及在25℃储存长达6个月),没有观察到在纯度和sec聚集物方面存在相关的差异(图8)。相反,我们的确注意到随着顶部空间氧含量增大,rp-hplc主要纯度增加。在5℃(储存12个月之后)(数据未显示)和25℃(储存6个月之后)观察到这个现象(图9)。没有新峰出现。
[0190]
1.1.2.2初级包装-小瓶:
[0191]
将组合物填充到2ml小瓶中并在冷冻条件下储存12个月以及在加速和应力条件下储存长达3个月。表5-7总结了在有和没有5mm l-甲硫氨酸存在下,在5℃、25℃和40℃下储存的ph 5.8组氨酸缓冲液中的苏金单抗浓度为25mg/ml、海藻糖浓度为225mm、聚山梨醇酯80浓度为0.02%的组合物通过rp-hplc测得的主峰之前物质的变化和sec-ap。
[0192][0193]
表5:小瓶中在5℃储存6和12个月之后的25mg/ml苏金单抗液体的rp-hplc和sec结果。组合物含25mg/ml苏金单抗、225mm海藻糖、5mm l-甲硫氨酸、0.02%ps80。
[0194][0195]
表6:小瓶中在25℃和40℃储存3个月之后的25mg/ml苏金单抗液体的rp-hplc和sec结果。组合物含25mg/ml苏金单抗、225mm海藻糖、5mm l-甲硫氨酸、0.02%ps80。
[0196][0197]
表7:在小瓶中在5℃储存6和12个月之后的25mg/ml苏金单抗液体的rp-hplc和sec结果。组合物含25mg/ml苏金单抗、225mm海藻糖、0mm l-甲硫氨酸、0.02%ps80。
[0198][0199][0200]
表8:在小瓶中在25℃和40℃储存3个月之后的25mg/ml苏金单抗液体的rp-hplc和sec结果。组合物含25mg/ml苏金单抗、225mm海藻糖、0mm l-甲硫氨酸、0.02%ps80。
[0201]
顶部空间的氧含量对小瓶中的25mg/ml苏金单抗液体稳定性的影响可通过rp-hplc测定主峰之前的物质看出:在5℃保持12个月之后(顶部空间氧含量为5%时为4.5%相比顶部空间氧含量为20%时为7.1%,参见表5)、在25℃保持3个月之后(顶部空间氧含量为5%时为17.9%相比顶部空间氧含量为20%时为20.6%,参见表6)、以及在40℃保持3个月之后(顶部空间氧含量为5%时为40.6%相比顶部空间氧含量为20%时为46.2%,参见表6)。在40℃保持3个月之后,ap-sec也推出相同的趋势(顶部空间氧含量为5%时为1.8%相比顶部空间氧含量为20%时为2.5%,参见表6)。而且,当与较低的顶部空间氧含量联用时,l-甲硫氨酸的浓度具有进一步的影响。例如,对顶部空间的氧含量为5%并在5℃储存12个月之后的组合物的rp-hplc主峰之前物质进行比较,不含l-甲硫氨酸的组合物为6.1%(表7),而含5mm l-甲硫氨酸的组合物为4.5%(表5)。对于rp-hplc主峰之前物质可见同样的差异:在25℃保持3个月之后(5%-20%氧:没有l-甲硫氨酸时为20.9-25.5%(表8),相比含5mm l-甲硫氨酸时为17.9-25.5%(表6))以及在40℃保持3个月之后(5%-20%氧:没有l-甲硫氨酸时为44.6-50.9%(表8)相比含5mm l-甲硫氨酸时为40.6-46.2%(表6))。
[0202]
根据以上实验,进行氮吹扫以降低顶部空间氧含量至小于约12%被认为对于加强pfs和小瓶中的液体组合物的稳定性(通过rp-hplc主峰之前物质进行评估)是有益的。
[0203]
1.1.3实施例3:l-甲硫氨酸浓度和顶部空间氧含量之间的相互作用
[0204]
进一步研究评价了l-甲硫氨酸浓度和顶部空间氧含量之间的相互作用。制备包含2.5-7.5mm范围内的l-甲硫氨酸并且顶部空间氧含量在3和9%之间的组合物。将组合物填充到pfs中并在长期和加速条件下储存6个月。在3和6个月储存之后监控相关的苏金单抗性质属性(sec纯度、rp-hplc纯度、cex纯度、游离sh基团、生物活性、通过光阻法测得的不溶性微粒和可见颗粒、溶液的浊度和颜色)。图10显示在25℃储存6个月之后的ap-sec纯度,其作为l-甲硫氨酸和顶部空间氧含量的应变量。采用ap-sec纯度进行分析时,在所测试的范围中没有观察到相互作用。
[0205]
在另一项研究中,在150mg/ml苏金单抗浓度评价顶部空间氧含量降低和l-甲硫氨酸浓度的影响。组合物包含270mm甘露醇、0.04%聚山梨醇酯80以及从0.15%至2%范围内的不同l-甲硫氨酸浓度。将组合物填充到2ml玻璃小瓶中,用氮吹扫或不吹扫并以长期、加速和应力条件储存长达6个月。
[0206]
图11显示包含0.15%(10mm)、1%(67mm)或2%(134mm)l-甲硫氨酸并具有氮气或
空气顶部空间的组合物在储存长达36个月之后的rp-hplc主峰之前物质。如之前观察到的,包含较多量l-甲硫氨酸的组合物的rp-hplc主峰之前物质处于较低水平。同样组合物的顶部空间被氮吹扫的情形中,显示出较低水平的rp-hplc主峰之前物质。
[0207]
根据来自使用小瓶和pfs作为初级包装的不同实验的组合数据,对于苏金单抗的液体组合物,理想情况是顶部空间氧含量小于约12%并且l-甲硫氨酸浓度为至少约2.5mm。
[0208]
1.1.4实施例4:ph
[0209]
开始以ph为4.0和7.5之间范围内含90mm氯化钠的100mm柠檬酸/磷酸钠缓冲液中10mg/ml的浓度评价ph对苏金单抗稳定性的影响。将样品在5℃和40℃储存3周。平行监控在从≤-60℃到室温的五轮冻融循环之后的苏金单抗稳定性。
[0210]
苏金单抗的最佳ph根据所分析的降解路径而变化。通过sec纯度、sds-page纯度(还原性)和lls平均分子量确定的聚集和蛋白质水解在ph 5.7至6.2时为最小,而对于cex纯度最佳的ph为5.3。活性苏金单抗在每个轻链上包含一个游离半胱氨酸残基,因此预计2摩尔硫醇基团/摩尔苏金单抗。由于游离sh基团水平降低与苏金单抗生物活性损失相关,所以使用基于ellman试剂的方法来量化游离sh基团。只在ph 4.3下才观察到略微降低的1.94摩尔/摩尔值。通过sec纯度和lls平均分子量监控的苏金单抗的冻融耐受性在ph 5.3至5.7时最大。为了进一步配制苏金单抗选择ph 5.8。
[0211]
在pfs中用doe方法进行ph对苏金单抗稳定性影响的进一步研究。在150mg/ml的苏金单抗浓度评价5.2-5.8范围内的ph影响。将组合物以长期(5℃)、加速(25℃)和应力(40℃)条件进行2个月稳定性研究,并就物理稳定性(ap-sec、dls、浊度、通过光阻法测得的可见颗粒和不溶性微粒)、化学稳定性(cex纯度、rp-hplc纯度、颜色)和生物活性指示子(cys-cex活性、游离sh基团)进行评价。另外,对填充于2ml小瓶中的组合物施加冻融(-20℃至室温的5个循环)和摇动应力(150rpm保持一周)。发现研究范围内的ph值会显著影响苏金单抗稳定性(ap-sec、dp-sec、dls、cex碱性变体、rp-hplc纯度)。来自之前研究的关于ph 5.8为理想值(ap-sec、dp-sec和rp-hplc主峰之前物质)的结果得到了证实(图12)。
[0212]
在含150mg/ml浓度苏金单抗、海藻糖200mm、2.5-7.5mm范围内的l-甲硫氨酸且顶部空间氧含量在3和9%之间的组合物中进一步评价ph的影响。组氨酸缓冲液的ph在5.4和6.2之间变化。将组合物填充到pfs中并以长期和加速条件储存6个月。在储存3和6个月之后监控相关的苏金单抗性质属性(sec纯度、rp-hplc纯度、cex纯度、游离sh基团、生物活性、通过光阻法测得的不溶性微粒、可见颗粒、溶液的浊度和颜色)。图13显示在5℃储存之后ph对苏金单抗性质属性的影响。在较高ph值下观察到浊度、ap-sec和cex酸性变体增加以及sec纯度降低,进一步证实了初始筛选中观察到的情况。
[0213]
根据来自各种实验的组合数据,对于苏金单抗液体组合物,理想的ph范围是从约5.2至约6.2。
[0214]
1.2部分2-详细分析对苏金单抗液态稳定性具有较小影响的赋形剂(稳定剂、表面活性剂和缓冲液)
[0215]
1.2.1实施例5:对稳定性几乎没有影响的稳定剂的选择
[0216]
为液体剂型进行的初步组合物开发致力于评价不同稳定剂在长期储存条件下以及加速和应力条件下储存期间对苏金单抗可溶性和不溶性团聚体形成(ap-sec、sds-page纯度、光散射技术)、化学稳定性(rp-hplc纯度、cex纯度、颜色)和生物活性(cys-cex活性、
游离sh基团、生物活性)的影响。
[0217]
将稳定剂分成三个不同的组:第i组包括非离子型(甘露醇、海藻糖二水合物)和离子型(氯化钠和精氨酸盐酸盐)稳定剂。所有第i组稳定剂相比没有稳定剂都提供了益处。但是通过较低的聚集物水平和较高的cys-cex活性观察到,非离子型稳定剂(海藻糖和甘露醇)能更好地稳定分子。
[0218]
根据来自初始组合物开发研究的结论,在pfs中使用doe方法进行进一步研究。评价了第i组稳定剂(甘氨酸、甘露醇、海藻糖二水合物、氯化钠)的效果。将组合物填充到预充装注射器中并在长期、加速和应力条件进行2个月稳定性研究,就物理稳定性(ap-sec、dls、浊度、通过光阻法测得的可见颗粒和不溶性微粒)、化学稳定性(cex纯度、rp-hplc纯度、颜色)和生物活性指示子(cys-cex活性、游离sh基团)进行评价。另外,向填充到2ml小瓶中的组合物施加冻融(-20℃至室温的5个循环)和摇动应力(150rpm保持一周)。关于第i组稳定剂,证实了之前筛选观察到的情况:1)所有第i组稳定剂相比没有稳定剂都提供了益处;和2)发现对于苏金单抗蛋白质而言非离子型稳定剂是更好的稳定剂(图14)。这在sec纯度、rp-hplc纯度和dls多分散性方面尤为显著。比较不同的非离子型稳定剂,没有观察到相关的效果。
[0219]
其次我们确定了第i组稳定剂的理想浓度(海藻糖二水合物200-300mm)。将样品填充到pfs中并以长期、加速和应力条件储存长达三个月。监控苏金单抗的物理(ap-sec、dls、通过光阻法测得的不溶性微粒、可见颗粒、浊度)和化学(cex纯度、rp-hplc纯度、颜色)稳定性以及生物活性。用变化的海藻糖浓度并没有观察到苏金单抗的性质属性发生相关的变化(图3)。
[0220]
1.2.2实施例6:对稳定性几乎没有影响的表面活性剂的选择
[0221]
150mg/ml液体组合物的初始组合物开发致力于评价不同赋形剂(例如稳定剂和表面活性剂)在长期储存条件以及加速和应力条件下储存期间对苏金单抗可溶性和不溶性团聚体形成(ap-sec、sds-page纯度、光散射技术)、化学稳定性(rp-hplc纯度、cex纯度、颜色)和生物活性(cys-cex活性、游离sh基团、生物活性)方面的影响。将赋形剂分成三个不同的组:第iii组包括表面活性剂聚山梨醇酯20和80。与没有表面活性剂的情况相比,静态储存期间在浓度为0.04%的聚山梨醇酯20和80之间没有观察到差异。
[0222]
根据初始组合物开发研究的结论,在pfs中使用doe方法进行进一步研究。评价了表面活性剂(聚山梨醇酯20、聚山梨醇酯80、泊洛沙姆188、无表面活性剂)的影响。将组合物填充到pfs中并在长期、加速和应力条件进行2个月稳定性研究,评价物理稳定性(ap-sec、dls、浊度、通过光阻法测得的可见颗粒和不溶性微粒)、化学稳定性(cex纯度、rp-hplc纯度、颜色)和生物活性指示子(cys-cex活性、游离sh基团)。另外,对填充在2ml小瓶中的组合物施加冻融(-20℃至室温的5个循环)和摇动应力(150rpm保持一周)。通过较低的浊度水平以及通过光阻法计数测得的可见颗粒和不溶性微粒,观察到存在表面活性剂是有利的。但是,表面活性剂种类仅有弱影响(图15)。
[0223]
我们接下来确定了第iii组表面活性剂的理想浓度(聚山梨醇酯800.01-0.04(w/v)%)。将样品填充到pfs中并在长期、加速和应力条件储存长达三个月。监控苏金单抗的物理(ap-sec、dls、通过光阻法测定的不溶性微粒、可见颗粒、浊度)和化学(cex纯度、rp-hplc纯度、颜色)稳定性以及生物活性。在静态储存(图3)期间以及以150rpm摇动1周之后,没有
观察到聚山梨醇酯80浓度对苏金单抗性质属性产生明显影响。在表面活性剂浓度较高时,dls多分散性和通过光阻法测得的不溶性微粒略微增加;因此确定聚山梨醇酯80的浓度为0.02%,从而保持最低评价浓度的安全边界。
[0224]
1.2.3实施例5:对稳定性几乎没有影响的缓冲液的选择
[0225]
在pfs中使用doe方法评价缓冲液种类(柠檬酸盐、组氨酸、琥珀酸盐、乙酸盐)的影响。将组合物填充到pfs中并在长期、加速和应力条件进行2个月稳定性研究,评价物理稳定性(ap-sec、dls、浊度、通过光阻法测得的可见颗粒和不溶性微粒)、化学稳定性(cex纯度、rp-hplc纯度、颜色)和生物活性指示子(cys-cex活性、游离sh基团)。另外,对填充在2ml小瓶中的组合物施加冻融(-20℃至室温的5个循环)和摇动应力(150rpm保持一周)。没有观察到缓冲液种类的相关影响。图16显示选择的性质属性。
[0226]
1.2.4实施例6:测试范围内的抗体浓度对稳定性几乎没有影响
[0227]
在124.5-175.5mg/ml范围内评价苏金单抗浓度对液体组合物性质属性的影响。组合物还包含在ph 5.8组氨酸缓冲液中的200mm海藻糖、5mm l-甲硫氨酸和0.02%聚山梨醇酯。将组合物填充到pfs中并以长期和加速条件储存6个月。在3和6个月储存之后监控相关的苏金单抗性质属性(sec纯度、rp-hplc纯度;cex纯度、游离sh基团、生物活性、通过光阻法测得的不溶性微粒、可见颗粒、溶液的浊度和颜色)。在25mg/ml至150mg/ml范围内没有观察到苏金单抗浓度对液体组合物性质属性产生相关的影响(数据未显示)。
[0228]
1.3部分3-优选的最终市售组合物的性质
[0229]
优选的苏金单抗药物产品包括在pfs中提供的液体组合物,该组合物包含ph 5.8的20mm组氨酸缓冲液中的150mg/ml苏金单抗、200mm海藻糖、0.02%聚山梨醇酯80和5mm l-甲硫氨酸。在初始填充和完成时,pfs中的顶部空间氧含量小于12%。这些药物产品具有优越的保存期和整体稳定性。
[0230]
对pfs中的各批次苏金单抗药物产品(150mg/ml苏金单抗、200mm海藻糖二水合物、20mm l-组氨酸/l组氨酸盐酸盐一水合物、5mm l-甲硫氨酸、0.02%聚山梨醇酯80(%w/v)、ph 5.8)进行稳定性测试。在以下的表9-11中示出在长期储存条件(2-8℃)下储存长达24个月之后、在加速储存条件(25℃)下储存长达6个月之后以及在温度应力条件(30℃)下储存长达6个月之后的测试结果。根据呈现的稳定性数据、预充装注射器(pfs)中150mg/1ml液体的苏金单抗的长达24个月的实时数据以及在开发过程中产生的长达36个月的稳定性数据(批量注射器),对于pfs商用产品中150mg/1ml液体的苏金单抗,当以5℃
±
3℃的长期条件、避光并防止冷冻进行储存时,建议保存期为24个月。
[0231]
表9sec、cex和rp-hplc纯度。*此较高值与正好在主峰之前出现的小峰有关。由于这个新峰独立于主峰进行积分,所以主峰之前的变体之和变得更高。
[0232][0233]
表10ce-sds纯度(非还原性)和sds-page杂质(还原性)。
[0234][0235]
表11效力和量。
*
样品在取出日之后》30天进行测试,此偏差对效力检测结果没有影响。
[0236][0237]
本技术还涉及以下的技术方案。
[0238]
项目1.一种药物产品,其包括:
[0239]
a.具有顶部空间的容器,其中所述顶部空间中的氧含量小于约12%,和
[0240]
b.置于所述容器内的ph为约5.2至约6.2的液体药物组合物,所述组合物包含:
[0241]
i.约20mg/ml至约175mg/ml的苏金单抗;和
[0242]
ii.约2.5至约20mm l-甲硫氨酸,
[0243]
其中所述液体药物组合物并非自冻干物复溶。
[0244]
项目2.如项目1所述的药物产品,其特征在于,所述甲硫氨酸的浓度为约2.5mm、约5mm、约10mm或约20mm。
[0245]
项目3.如项目2所述的药物产品,其特征在于,所述甲硫氨酸的浓度为约5mm。
[0246]
项目4.如前述任一项项目所述的药物产品,其特征在于,所述顶部空间中的氧含量小于约10%。
[0247]
项目5.如前述任一项项目所述的药物产品,其特征在于,所述顶部空间中的氧含量小于约8%。
[0248]
项目6.如前述任一项项目所述的药物产品,其特征在于,所述顶部空间中的氧含量小于约6%。
[0249]
项目7.如前述任一项项目所述的药物产品,其特征在于,所述液体药物组合物的ph为约5.8。
[0250]
项目8.如前述任一项项目所述的药物产品,其特征在于,所述苏金单抗的浓度为约25mg/ml或约150mg/ml。
[0251]
项目9.如前述任一项项目所述的药物产品,其特征在于,所述液体药物组合物进一步包含选自组氨酸缓冲液、柠檬酸盐缓冲液、乙酸盐缓冲液和琥珀酸盐缓冲液的缓冲液。
[0252]
项目10.如项目9所述的药物产品,其特征在于,所述缓冲液的浓度为约10mm至约30mm。
[0253]
项目11.如项目10所述的药物产品,其特征在于,所述缓冲液是浓度为约20mm的组氨酸缓冲液。
[0254]
项目12.如前述任一项项目所述的药物产品,其特征在于,所述液体药物组合物进一步包含选自聚山梨醇酯和泊洛沙姆的表面活性剂。
[0255]
项目13.如前述任一项项目所述的药物产品,其特征在于,所述表面活性剂是聚山梨醇酯80、聚山梨醇酯20或泊洛沙姆188。
[0256]
项目14.如项目13所述的药物产品,其特征在于,所述表面活性剂是浓度为约0.01%(w/v)至约0.04%(w/v)的聚山梨醇酯80。
[0257]
项目15.如项目14所述的药物产品,其特征在于,所述聚山梨醇酯80的浓度为约0.02%(w/v)。
[0258]
项目16.如项目13所述的药物产品,其特征在于,所述表面活性剂是浓度为约0.02%(w/v)的聚山梨醇酯20。
[0259]
项目17.如前述任一项项目所述的药物产品,其特征在于,所述液体药物组合物进一步包含选自甘露醇、氯化钠、海藻糖、精氨酸hcl和甘氨酸的稳定剂。
[0260]
项目18.如项目17所述的药物产品,其特征在于,所述稳定剂是浓度为约180mm至约300mm的海藻糖。
[0261]
项目19.如项目18所述的药物产品,其特征在于,所述海藻糖的浓度为约200mm或约225mm。
[0262]
项目20.如前述任一项项目所述的药物产品,其特征在于,所述容器是药匣、注射器、笔或小瓶。
[0263]
项目21.一种药物产品,其包括
[0264]
a.具有顶部空间的容器,其中所述顶部空间中的氧含量小于约6%;和
[0265]
b.置于所述容器内的液体药物组合物,所述组合物包含约25mg/ml至约150mg/ml苏金单抗、约10mm至约30mm ph 5.8的组氨酸、约200mm至约225mm海藻糖、约0.02%聚山梨醇酯80和约2.5mm至约20mm甲硫氨酸,其中所述液体药物组合物并非自冻干物复溶。
[0266]
项目22.如项目21所述的药物产品,其特征在于,包含约25mg/ml苏金单抗和约225mm海藻糖。
[0267]
项目23.如项目21所述的药物产品,其特征在于,包含约150mg/ml苏金单抗和约200mm海藻糖。
[0268]
项目24.如前述任一项项目所述的药物产品,其特征在于,所述液体组合物:
[0269]
a.在2-8℃储存6个月后保持至少约86%的rp-hplc纯度,在25℃/60%rh储存6个月后保持至少约76%的rp-hplc纯度,和/或在30℃/75%rh储存6个月后保持至少约60%的rp-hplc纯度;
[0270]
b.在2-8℃储存6个月后保持至少约77%的cex纯度,在25℃/60%rh储存6个月后保持至少约62%的cex纯度,和/或在30℃/75%rh储存6个月后保持至少约50%的cex纯度;
[0271]
c.所述液体组合物在2-8℃储存6个月后保持至少约98%的sec纯度,在25℃/60%rh储存6个月后至少约96%的sec纯度,和/或在30℃/75%rh储存6个月后至少约94%的sec纯度;
[0272]
d.在2-8℃储存6个月后保持至少约97%的ce-sds纯度(非还原性条件),在25℃/
60%rh储存6个月后保持至少约95%的ce-sds纯度(非还原性条件),和/或在30℃/75%rh储存6个月后保持至少约94%(优选至少约92%)的ce-sds纯度(非还原性条件);
[0273]
e.在2-8℃储存6个月后保持小于约0.57%的ce-sds杂质(还原性条件),在25℃/60%rh储存6个月后保持小于约1.1%的ce-sds杂质(还原性条件),和/或在30℃/75%rh储存保持小于约1.9%的ce-sds杂质(还原性条件);和/或
[0274]
f.在2-8℃储存24个月后保持至少约88%的抑制il-6从c-20/a4软骨细胞释放的相对生物活性,在25℃/60%rh储存6个月后保持至少约94%的抑制il-6从软骨细胞释放的相对生物活性,和/或在30℃/75%rh储存6个月后保持至少约85%的抑制il-6从软骨细胞释放的相对生物活性。
[0275]
项目25.如前述任一项项目所述的药物产品,其特征在于,所述液体组合物:
[0276]
a.在2-8℃储存24个月后保持至少约84%的rp-hplc纯度;
[0277]
b.在2-8℃储存24个月后保持至少约73%的cex纯度;
[0278]
c.在2-8℃储存24个月后保持至少约97%的sec纯度;
[0279]
d.在2-8℃储存24个月后保持至少约97%的ce-sds纯度(非还原性条件);和/或
[0280]
e.在2-8℃储存24个月后保持小于约0.91%的ce-sds杂质(非还原性条件)。
[0281]
项目26.一种减少苏金单抗氧化的方法,其包括:
[0282]
a.制备液体组合物,其ph为约5.2至约6.2并包含:
[0283]
i.约25mg/ml至约150mg/ml苏金单抗;和
[0284]
ii.约2.5mm至约20mm甲硫氨酸;
[0285]
b.将所述液体组合物置于具有顶部空间的容器内;和
[0286]
c.将所述顶部空间中的氧含量调节至小于或等于约12%。
[0287]
项目27.如项目26所述的方法,其特征在于,通过用惰性气体吹扫顶部空间来进行调节步骤c)。
[0288]
项目28.如项目27所述的方法,其特征在于,所述惰性气体是氮或氩。
[0289]
项目29.如项目26所述的方法,其特征在于,所述甲硫氨酸的浓度为约2.5mm、约5mm、约10mm或约20mm。
[0290]
项目30.如项目29所述的方法,其特征在于,所述甲硫氨酸的浓度为约5mm。
[0291]
项目31.如项目26所述的方法,其特征在于,所述顶部空间中的氧含量被调节至小于约10%。
[0292]
项目32.如项目26所述的方法,其特征在于,所述顶部空间中的氧含量被调节至小于约8%。
[0293]
项目33.如项目26所述的方法,其特征在于,所述顶部空间中的氧含量被调节至小于约6%。
[0294]
项目34.如项目26所述的方法,其特征在于,所述液体组合物的ph为约5.8。
[0295]
项目35.如项目26所述的方法,其特征在于,所述苏金单抗浓度为约25mg/ml或约150mg/ml。
[0296]
项目36.一种液体药物组合物,其包含约25mg/ml至约150mg/ml苏金单抗、约10mm至约30mm ph 5.8的组氨酸、约200mm至约225mm海藻糖、约0.02%聚山梨醇酯80和约2.5mm至约20mm甲硫氨酸,其中所述液体药物组合物并非自冻干物复溶。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1