用于治疗或改善炎症疾病的包含含龙眼肉组合生药组合物的口服用药物组合物及其用途的制作方法
1.本发明涉及用于治疗或预防炎症疾病的包含含有龙眼肉(longanae arillus)的组合生药组合物的口服用药物组合物及其用途。
背景技术:
2.通常,炎症为在组织或细胞的相关组织或细胞受到稍微的引起有机变化的任意侵入时发生的有关浮肿、疼痛等相关的人体的正常反应。近来查明,多种细胞因子与炎症疾病相关。
3.因此,正在开发有效抑制通过中性粒细胞等炎症细胞分泌引起的炎症、过敏反应或哮喘等的与激活诱发半胱氨酸、白三烯的生物合成的细胞相关的白细胞介素4(il-4)、白细胞介素5(il-5)、白细胞介素(il-13)以及免疫球蛋白e等多种细胞因子的生成的有效药物。
4.已知炎症阶段因肿瘤坏死因子α(tnf-α)、白细胞介素1β(il-1β)、白细胞介素6(il-6)等促炎性细胞因子和基质金属蛋白酶(mmp)(血小板源生长因子(pdgf)、血管内皮生长因子(vegf)及胰岛素样生长因子(igf)等基质金属蛋白酶)持续进行,与之相反,生长因子的表达减少(trengove nj,bielefeldt-ohmann h,stacey mc(2001)mitogenic activity and cytokine levels in non-healing and healing chronic leg ulcers.wound repair and regeneration.8:13-25.;armstrong dg,jude eb(2002)the role of matrix metalloproteinases in wound healing.journal of the american podiatric medical association.92:12-18.)。
5.基质金属蛋白酶通过基质金属蛋白酶抑制因子(timp)来控制,其分解细胞外基质而使再上皮化(re-epithelialization)成为可能(martins vl,caley m,o'toole ea(2013)matrix metalloproteinases and epidermal wound repair.cell and tissue research.351:255-268)。
6.尤其,在基质金属蛋白酶中,有关基质金属蛋白酶9(mmp-9)的研究最为集中,已知其给慢性伤口带来最为不利的影响(jones ji,nguyen tt,peng z,chang m(2019)targeting mmp-9in diabetic foot ulcers.pharmaceuticals.12:79.;reiss mj,han yp,garcia e,goldberg m,yu h,garner wl(2010)matrix metalloproteinase-9delays wound healing in a murine wound model.surgery.147:295-302.)。
7.因此,在治疗并改善炎症疾病方面,至今仍需要从天然资源中开发比现有使用的药物副作用少且更为有效的药物及化妆品。
8.龙眼肉(longanae arillus)为属于无患子科(sapindaceae)的龙眼(dimocarpus longan或euphoria longan)或同种的种皮,据报告,含有葡萄糖、果糖、蛋白质等,具有心脏保护、促进食欲等下效果(chung b.s et al,dohaehyangyakdaesajeon,youngrimsa,2nd ed.p197-198,1998)。
9.细叶藁本(ligusticum tenuissimum kitagawa)属于伞形科(umbelliferae),为中国藁本(ligusticum sinense oliv)、辽藁本(ligusticum jeholense nakai et kitagawa)或同种的根茎或根部,据报告,藁本(ligustici tenuissimi rhizoma)含有蛇床肽内酯(cnidilide)、3-丁基苯酞(phthalide),具有抗病毒效果等(chung b.s et al,dohae-hyangyakdaesajeon,youngrimsa,2nd ed.p428-429,1998)。
10.属于远志科(polygalaceae)的远志(polygala tenuifolia willd)或同种的根部远志(polygalae radix)含有多种皂苷,据报告,具有祛痰作用、抗菌作用等(chung b.s et al,dohaehyangyakdaesajeon,youngrimsa,2nd ed.p798-799,1998)。
11.但是,在本技术中引用的作为参考的上述文献中,没有公开任何关于对炎症疾病显出强力治疗效果的局部应用龙眼肉、藁本及远志的组合生药提取物的有关预防或改善活性的报告。
技术实现要素:
12.技术问题
13.为了调查龙眼肉、藁本及远志的组合生药组合物的抗炎效果,本发明人集中进行了多种实验,包括:与炎症相关的细胞因子(酸性核糖体磷蛋白亚基(rplpo)、胸腺基质淋巴细胞生成素(tslp)、粒细胞-巨噬细胞集落刺激因子(gm-csf)以及白细胞介素1β(il-1β))的表达抑制试验(实验例1);有关ht-29及thp-1细胞的细胞存活试验(体外,实验例2);thp-1细胞中的抗炎活性(体外,实验例3);自噬活性抑制效果(体外,实验例4)等体外实验;以及利用关节炎-诱导的大鼠动物模型的关节炎抑制效果(生物体内,实验例5)等生物体内实验。通过这些调查的结果,本发明人确认到本发明的组合生药组合物强力抑制并改善炎症疾病,从而最终完成本发明。
14.技术方案
15.为了解决背景技术中的问题,本发明的技术方案为开发用于治疗及预防炎症疾病或关节炎疾病的新型生药剂型。
16.因此,本发明的目的在于,提供用于治疗及改善炎症疾病的包含龙眼肉、藁本及远志的组合生药提取物作为有效成分的口服用药物组合物。
17.本技术中定义的术语“组合生药提取物”是指如下组合生药提取物,即,(a)以龙眼肉、藁本及远志的干燥重量(w/w)为基准,龙眼肉、藁本及远志的组合生药提取物的混合比为0.01-100∶0.01-100∶0.01-100重量份(w/w),优选地,混合比为0.1-50∶0.1-50∶0.1-50重量份(w/w),更优选地,混合比为0.1-10∶0.1-10∶0.1-10重量份(w/w),尤其优选地,混合比为1-5∶1-5∶1-5重量份(w/w),最优选地,混合比为1-3∶1-3∶1-3重量份(w/w);或者(b)以龙眼肉、藁本及远志的干燥重量(w/w)为基准,龙眼肉、藁本及远志的各提取物的组合物的混合比为0.01-100∶0.01-100∶0.01-100重量份(w/w),优选地,混合比为0.1-50∶0.1-50∶0.1-50重量份(w/w),更优选地,混合比为0.1-10∶0.1-10∶0.1-10重量份(w/w),尤其优选地,混合比为1-5∶1-5∶1-5重量份(w/w),最优选地,混合比为1-3∶1-3∶1-3重量份(w/w)。
18.本技术中公开的术语“提取物”包括可以通过选自水、例如甲醇、乙醇、丙醇、丁醇等c
1-c4的低级醇、丙酮、乙酸乙酯、三氯甲烷、己烷、丁二醇、丙二醇或甘油中的一种以上的溶剂提取的提取物,优选地,包括可以通过选自由水、甲醇、乙醇中的一种以上的溶剂提取
的提取物,更优选地,包括可以通过选自水或10%-90%(v/v)的乙醇水溶液中的一种以上的溶剂提取的提取物,最优选地,包括可以通过选自水或20%-80%(v/v)乙醇水溶液的一种以上的溶剂提取的提取物。
19.本技术中公开的术语“炎症疾病”包括选自由皮炎、特应性皮炎、结膜炎、牙周炎、鼻炎、中耳炎、咽喉痛、扁桃体炎、肺炎、胃溃疡、胃炎、克罗恩病、大肠炎、痔疮、痛风、风湿热、狼疮、纤维肌痛、肌腱炎、腱鞘炎、腹膜炎、肌炎、肝炎、膀胱炎、肾炎、干燥综合征、由慢性炎症及急性炎症诱发的瘙痒症组成的组中的疾病。
20.本技术中公开的“抗炎”是指抑制各种炎症的所有机制,但不限定于此。
21.本技术中公开的术语“抗风湿”是指抑制各种风湿的所有机制,但不限定于此。
22.炎症为身体组织对病原体、损伤的细胞或刺激物质等有害刺激的复杂的生物学反应中的一部分,将发热、疼痛、发红、浮肿等非特异性的反应成为“炎症反应”。
23.炎症分为如下种类:(a)急性炎症,为身体对有害刺激的初期反应,通过血浆及白细胞(尤其是粒细胞)从血液中向受损组织的移动增加来实现,然后通过一系列的生物化学现象的传播以及局部血管系统、免疫系统及与损伤组织内的多种细胞相关的炎症反应的成熟来实现;(b)慢性炎症,为长期炎症,其特征在于,引起存在于炎症部位的细胞类型,例如单核细胞的渐进性变化,在炎症过程中同时发生组织的破坏和治愈。
24.通常,受损细胞的巨噬细胞释放多种细胞因子来激活t淋巴细胞,作为淋巴细胞的肥大细胞释放多种组氨引起内部屏障反应来诱导被感染细胞的炎症。因此,细胞因子的表达水平可以用作炎症反应被激活(其他方式,抗炎活性)的指标。本技术中公开的“抗炎活性”是指对皮肤炎症的抑制活性。
25.细胞因子是指通过趋化因子、干扰素、白细胞介素、淋巴因子及巨噬细胞、b淋巴细胞、t淋巴细胞以及肥大细胞等免疫细胞以及包括内皮细胞在内的广义的细胞生成的肿瘤坏死因子、通过成纤维细胞以及通过例如病毒等的病原体的入侵而诱发的免疫学进行来释放的包括多种基质细胞在内的所有免疫学物质。
26.通常,细胞因子虽然只在感染初期释放,但在免疫系统非正常地被激活的情况下,会持续释放。当细胞因子以高水平持续释放一周以上的时间时,本发明人称之为“细胞因子风暴(storm)”,这是如下的生理反应,即,先天免疫体系无法调节成为细胞因子的促炎性信号传递分子而引起过度的释放,免疫细胞极度丰富地聚集于感染的部位而使炎症恶化,舒缓血管引起血管外出血,严重的甚至会引起死亡。本技术中公开的术语“细胞因子表达的抑制活性”可以解释为预防、治疗或改善细胞因子风暴。
27.本技术中公开的术语“细胞因子”是指与特应性皮炎等皮炎相关的多种细胞因子,具体地,包括选自由胸腺基质淋巴细胞生成素、例如粒细胞-巨噬细胞集落刺激因子、巨噬细胞集落刺激因子(m-csf)、粒细胞集落刺激因子(g-csf)等集落刺激因子(csf)、例如白细胞介素-1(il-1)、il-4、il-10、il-12、il-13、il-31、il-33等白细胞介素、肿瘤坏死因子α(tnf-α)、干扰素γ(ifnγ)等组成的组中的细胞因子,但不限定于此。
28.本发明的提取物可以通过如下优选的实施方式来制备。
29.在本发明的情况下,上述提取物可以通过如下方式制备。
30.本技术中定义的术语“龙眼肉、藁本及远志的组合生药提取物”可以通过如下步骤制备:步骤1,将龙眼肉、藁本及远志切片及清洗来用作基础提取物质;步骤2,以龙眼肉、藁
本及远志的干燥重量(w/w)为基准,以0.01-100∶0.01-100∶0.01-100重量份(w/w)的混合比,优选地,以0.1-50∶0.1-50∶0.1-50重量份(w/w)的混合比,更优选地,以0.1-10∶0.1-10∶0.1-10重量份(w/w)的混合比,尤其优选地,以1-5∶1-5∶1-5重量份(w/w)的混合比,最优选地,以1-3∶1-3∶1-3重量份(w/w)范围的混合比一起混合龙眼肉、藁本及远志来获得混合物质;步骤3,将选自水、例如甲醇、乙醇、丙醇、丁醇等c
1-c4的低级醇、丙酮、乙酸乙酯、三氯甲烷、己烷、丁二醇、丙二醇或甘油组成的组中的提取溶剂,优选地,将选自由水、甲醇、乙醇组成的组中的提取溶剂,更优选地,选自水或10%-90%(v/v)的乙醇水溶液组成的组中的提取溶剂,最优选地,将选自水或20%-80%(v/v)乙醇水溶液组成的组中的提取溶剂,以1倍-20倍的体积(v/w)加入于混合物质,优选地,以4倍-8倍的体积(v/w)加入于混合物质;步骤4,通过在50℃至120℃的温度范围,优选地在约80℃至100℃的温度范围中进行1小时至24小时,优选地,进行2小时至12小时的热水提取、冷水提取、回流提取或超声波提取,优选地,通过热水提取的提取方法来提取各溶液;步骤5,重复上述提取过程,通过过滤、冷冻干燥或自然风干燥或热风干燥来干燥各过滤液,优选地,通过冷冻干燥各过滤液来收集龙眼肉、藁本及远志的组合生药提取物。
31.本发明的还有一目的在于,提供如前所述的制备本发明的龙眼肉、藁本及远志的组合生药提取物的方法。
32.本发明的另一目的在于,提供用于治疗及改善炎症疾病的包含通过上述方法制备的龙眼肉、藁本及远志的组合生药提取物作为有效成分的口服用药物组合物。
33.根据本发明的再一实施方式,提供治疗或改善哺乳动物的炎症疾病的方法,包括向哺乳动物口服给药有效量的龙眼肉、藁本及远志的组合生药提取物及其药学上可接受的载体的步骤。
34.并且,根据本发明的还有一实施方式,提供将龙眼肉、藁本及远志的组合生药提取物作为有效成分来制备为用于治疗或改善包括人类在内的哺乳动物的炎症疾病的口服制剂的用途。
35.本发明的又一目的在于,提供用于预防及治疗炎症疾病的包含通过上述方法获得的上述生药组合物作为有效成分的药物组合物或保健功能食品。
36.本发明人通过与炎症相关的细胞因子(酸性核糖体磷蛋白亚基、胸腺基质淋巴细胞生成素、粒细胞-巨噬细胞集落刺激因子以及白细胞介素1β)的表达抑制试验(实验例1)、有关ht-29及thp-1细胞的细胞存活试验(体外,实验例2)、thp-1细胞中的抗炎活性(体外,实验例3)、自噬活性抑制效果(体外,实验例4)等体外实验以及利用关节炎-诱导的大鼠动物模型的关节炎抑制效果(生物体内,实验例5)等生物体内实验验证本发明的复合组合物具有强力的抗炎/抗风湿效果,因此,确认到本发明的组合提取物以口服用药物组合的形式非常有用地用在炎症疾病及关节炎疾病的改善或治疗中。
37.用于治疗上述目标疾病的药物组合物,以组合物的总重量为基准,可以包含约0.01重量百分比至99重量百分比的本发明的生药组合物。
38.但是,上述组合物的量及各成分可以根据患者的状态、患者的疾病进程、疾病的种类等的不同而不同。
39.本发明的组合物还可以根据所使用的方法包含通常的载体、佐剂或稀释剂。
40.本发明的组合物可以配制为如下形式:粉末、颗粒、片剂、胶囊剂、悬浮液、乳剂、糖
浆、气雾剂等口服给药形式;局部制剂;或者注射溶液。本发明的生药组合物可以提供为包含药学上可接受的载体、佐剂或稀释剂,包含例如乳糖、蔗糖、葡萄糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、硬脂酸镁及矿物油的药物组合物。剂型还可以包含填充剂、增量剂、结合剂、湿润剂、崩解剂、表面活性剂、稀释剂等赋形剂。固体口服给药形式包括片剂、丸剂、烷基、颗粒剂、胶囊剂等,固体口服给药形式通过向生药组合物中加入淀粉、碳酸钙、蔗糖、乳糖或明胶等至少一种赋形剂来制备。可以使用硬脂酸镁或滑石粉等润滑剂。水性口服给药形式包括悬浮液、口服溶液、乳液、糖浆,水性口服给药形式不仅可以包含湿润剂、甜味剂、香味剂、防腐剂,还可以包含水、液体石蜡等多种赋形剂。胃肠外给药形式包括灭菌的水溶液、非水性溶剂、悬浮液、乳液、冷冻干燥制剂、栓剂等。载体的适当的例包括丙二醇、聚乙二醇、橄榄油之类的植物油、油酸乙酯之类的可注射酯类。栓剂的基剂可以包括witepsol、聚乙二醇(macrogol)、吐温61(tween 61)、可可脂、肉实树酯(laurin)、甘油明胶等,但不限定于此。
41.本发明组合物的优选剂量根据对象的状态及体重、疾病的严重程度、药物形式、给药途径及期间的不同而不同,可以通过相关从业者适当地选择。但为了获得优选的效果,建议以0.01mg/kg至10g/kg范围的量给药本发明的组合物,优选地,以1mg/kg至1g/kg(重量/天)范围的量给药本发明的组合物。能够以一天的剂量或一天多次的剂量给药。
42.本发明的药物组合物可以通过多种途径向哺乳动物(大鼠、小鼠、家畜或人类)等对象动物给药。可以考虑所有的给药方式,例如,可以通过口服、直肠或静脉内注射来给药。
43.根据本发明的一实施方式,本发明提供用于预防或改善炎症疾病的包含龙眼肉、藁本及远志的组合生药组合物作为有效成分的保健功能食品。
44.本技术中公开的术语“保健功能食品”,根据韩国保健功能食品法第6727条的规定,是为了预防或改善人类或哺乳动物的目标疾病而向普通食品中加入本发明的提取物来强化物理功能或生理功能等功能的功能食品。
45.用于预防或改善上述目标疾病的保健功能食品组合物,以组合物的总重量为基准,可以包含0.01重量百分比至95重量百分比的本发明的生药组合物,优选地,可以包含1重量百分比至80重量百分比的本发明的生药组合物。
46.并且,在制备用于预防或改善炎症疾病的各种保健功能食品及保健辅助食品时,可以将本发明的提取物用作主要成分、添加剂或者保存剂。
47.本发明的保健功能食品可以制备并提供为散剂、颗粒剂、片剂、胶囊剂、丸剂、悬浮剂、乳剂、糖浆等药学上可接受的给药形式,或者制备及提供为茶包、浸提茶、保健饮料形式等的保健功能食品形式。
48.本发明的又一目的在于,提供用于预防或改善炎症疾病的包含龙眼肉、藁本及远志的组合生药组合物作为有效成分或主要成分的保健辅助食品。
49.上述提及的术语“作为主要成分”是指以组合物的总重量为基准,上述保健辅助食品包含30重量百分比至90重量百分比的本发明的提取物,优选地,包含50重量百分比至99重量百分比的本发明的提取物,更优选地,包含70重量百分比至99重量百分比的本发明的提取物。
50.在本发明的组合生药组合物用作保健功能饮料组合物的成分时,保健功能饮料组
合物可以与通常的饮料组合物一样不受限制地包含香味剂或天然碳水化合物等其他成分。天然碳水化合物的例包括:葡萄糖、果糖等单糖类;麦芽糖、蔗糖等双糖类;糊精、环糊精等多糖类;以及木糖醇、山梨糖醇、赤藓糖醇等糖醇。保健功能饮料组合物中可以添加天然香料(索马甜、甜叶菊提取物(莱鲍迪甙a、甘草酸等))以及合成香料(糖精、阿巴斯甜等)。通常,每100ml本组合物包含约1g至20g范围的天然碳水化合物,优选地,包含约5g至12g范围的天然碳水化合物。
51.在将本发明的组合生药组合物用作保健食品的添加物时,可以直接添加组合生药组合物,或者根据通常的工序与其他食品成分一同使用。为了预防或改善目标疾病,食品的例包括肉类制品、香肠、面包、巧克力、糖果、小食品、薄饼、饼干、披萨、拉面、面类制品、口香糖、冰淇淋等乳制品、汤类、饮料(beverage)、茶、饮剂(drink)、酒类、微生物复合物等,但不限定于此。
52.除上述组合物以外的其他成分为各种营养素、维生素、矿物质或电解质、合成香料、着色剂及奶酪的情况改良剂、巧克力等、果胶酸及其盐、海藻酸及其盐、有机酸、保护性胶体增稠剂、ph调节剂、稳定剂、保存剂、甘油、酒精、碳酸饮料使用的碳酸化剂等。除上述成分以外,其他成分还可以为制备天然果汁的果汁、果汁饮料及蔬菜饮料,可以单独使用这些成分或组合来使用。成分的比例不是很重要,但通常为每100重量百分比的组合物包含约0重量百分比至20重量百分比。
53.并且,上述提取物可以为预防或改善目标障碍而加入食品或饮料中。作为保健功能食品或保健辅助食品,在视频或饮料中,相对于保健功能食品组合物用食品组合物的总重量,上述提取物的含量可以为0.01重量百分比至15重量百分比的范围。而且,每100ml保健饮料组合物可以包含0.02g至5g的本发明的提取物,优选地,可以包含0.3g至1g的本发明的组合物。
54.有益效果
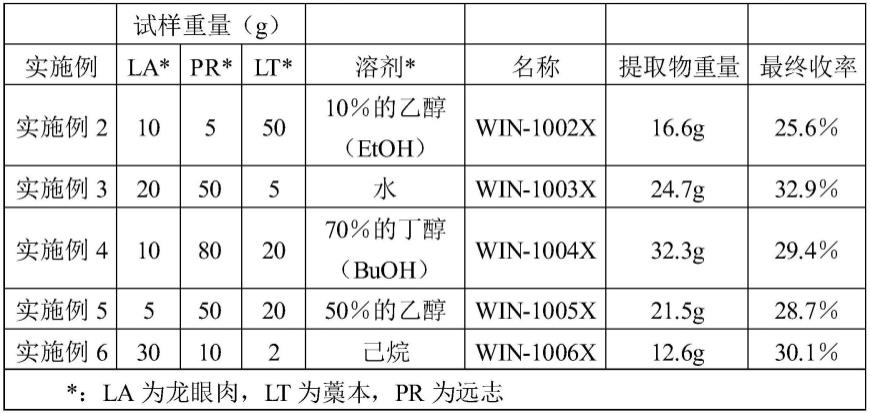
55.在本发明中,如上所述,本发明人通过与炎症相关的细胞因子(酸性核糖体磷蛋白亚基、胸腺基质淋巴细胞生成素、粒细胞-巨噬细胞集落刺激因子以及白细胞介素1β)的表达抑制试验(实验例1)、有关ht-29及thp-1细胞的细胞存活试验(体外,实验例2)、thp-1细胞中的抗炎活性(体外,实验例3)、自噬活性抑制效果(体外,实验例4)等体外实验以及利用关节炎-诱导的大鼠动物模型的关节炎抑制效果(生物体内,实验例5)等生物体内实验验证本发明的复合组合物具有强力的抗炎/抗风湿效果,因此,确认到本发明的组合提取物以口服用药物组合的形式非常有用地用在炎症疾病及关节炎疾病的改善或治疗中。
具体实施方式
56.本发明所属技术领域的普通技术人员应该明白的是,在不脱离本发明的精神或范围的情况下,本发明的组合物、用途及配制可以进行多种变更及变形。
57.通过下述实施例更为具体地说明本发明。但是,无论在任何方面都不应理解为本发明限定于这些实施例。
58.实施例
59.在不限制本发明的范围的情况下,下述实施例及实验例用于追加例示本发明。
60.实施例1.制备本发明的组合提取物(1)
61.细细切割20g的干燥龙眼肉(buyoung yakup co.ltd.公司)、20g的干燥藁本(buyoung yakup co.ltd.公司)以及20g的干燥远志(buyoung yakup co.ltd.公司)后,与6倍体积(v/w)的20%的乙醇水溶液混合,在90
±
5℃的温度下回流提取该混合物3天。通过过滤纸(孔隙大小:小于10μm)过滤提取物去除残余物后,使用4倍体积(v/w)的20%的乙醇水溶液再提取剩余的残余物两次后,通过过滤纸(孔隙大小:小于10μm)过滤提取物。
62.将收集的提取物混合在一起后在真空下进行浓缩(16白利糖度-21白利糖度)来获得浓缩的提取物。通过冷冻干燥过程干燥浓缩的提取物后,通过粉碎(小于50目)获得20.5g的本发明的组合提取物(1)(以下表示为“win-1001x”)(干燥粉末,收率33.4%)。
63.实施例2至实施例6.制备本发明的组合提取物(2)至本发明的组合提取物(6)
64.除使用不同混合比和不同溶剂以外,以与实施例1相同的过程来获得龙眼肉(la)、藁本(lt)及远志(pr)的多种本发明的组合提取物,即,本发明的组合提取物(2)至本发明的组合提取物(6),在下述实验中使用他们作为试验试样。
65.表1各种组合提取物
[0066][0067]
实验例1.对细胞因子表达的抑制效果(体外).
[0068]
为了确定本发明提取物的抗炎活性,根据文献记载的过程进行利用hacat细胞的下述细胞因子表达抑制试验(jeong et al.,2019,j.invest.dermatol.,may;139(5):pp1098-1109)。
[0069]
在包含10%的胎牛血清、100单位/ml的青霉素、100μg/ml的链霉素(d6429,sigma-aldrich co.ltd公司)的杜氏改良伊戈尔培养基(dmem)中接种hacat细胞(人类上皮角质细胞,300493,cls公司)后,在保持最佳湿度(85%-95%)及5%的co2大气气氛的条件下在恒温箱(hera cell 150i,thermo fisher scientific co.ltd.公司)中进行培养。
[0070]
为了进行基因表达试验,将培养的细胞移到12个孔中后,使用50ng/ml的肿瘤坏死因子α(rc214-12,biobasic co.ltd公司)处理1小时来诱导炎症反应。将地塞米松(200nm,阳性对照组,“dex”,d4902,sigma-aldrich co.ltd.公司)及蒸馏水(阴性对照组,“diw”)用作比较对照组。
[0071]
诱导炎症1小时后,使用相同的培养基处理1μg/ml的实施例中制备的本发明的提取物后培养1小时。培养后,从细胞中提取核糖核酸(rna)(fatrr-001,favorgen公司)后,使用互补脱氧核糖核酸(cdna)合成试剂盒(rro36a,takara公司)从核糖核酸合成互补脱氧核
糖核酸。使用合成的互补脱氧核糖核酸与sybrgreen试剂盒(rt500m,enzynomics公司)进行聚合反应后,如表2所示,利用与皮肤炎症有关的多种细胞因子的相关引物(rplpo、tslp、gm-csf以及il-1β)进行实时聚合酶链式反应(pcr)。
[0072]
表2实时聚合酶链式反应(rt-pcr)方法中使用的引物
[0073][0074]
实时聚合酶链式反应的定量结果如表3所示,通过表3可知,与处理蒸馏水(diw)的阴性对照组相比,处理本发明的提取物的试验试样组迅速抑制了与炎症相关的多种细胞因子的表达水平,确认到试验试样对与炎症相关的多种细胞因子的表达的抑制活性与处理地塞米松(dex)的阳性对照组相同。
[0075]
因此,确认实施例1至实施例6中制备的各种本发明的组合提取物对炎症具有强力的抑制效果。
[0076]
表3细胞因子表达抑制效果
[0077]
[0078][0079]
实验例2.有关ht-29及thp-1细胞的细胞存活试验(体外).
[0080]
为了确认本发明提取物对ht-29细胞及thp-1细胞的细胞毒性,根据本发明所属技术领域中现有公知的过程进行使用ht-29细胞及thp-1细胞的下述细胞存活试验。
[0081]
2-1.过程
[0082]
将ht-29细胞(人结肠上皮细胞,韩国细胞株银行,韩国细胞株研究财团,首尔市钟路区大学路101,03080,韩国)接种于含有10%的胎牛血清和1%的青霉素/链霉素溶液的杜氏改良伊戈尔培养基(dmem)中,将thp-1细胞(人单核细胞,韩国细胞株银行,韩国细胞株研究财团,首尔市钟路区大学路101,03080,韩国)接种于含有10%的胎牛血清和1%的青霉素/链霉素溶液的rpmi培养基中进行培养。
[0083]
分别使用25μg/ml、50μg/ml、100μg/ml、250μg/ml、500μg/ml及1000μg/ml的试验试样处理ht-29细胞及thp-1细胞。培养24小时后,加入cck-8(细胞计数试剂盒-8,dojindo molecular technologies,inc.公司),在450nm的波长中测量吸光度(光密度)来测量细胞存活率。
[0084]
2-2.试验结果
[0085]
通过表4可知,在ht-29细胞中处理本发明提取物(25μg/ml-1000μg/ml)的试验试样组显出与只处理培养基的阴性对照组相似的细胞存活率,确认到在thp-1细胞中处理500μg/ml及1000μg/ml浓度的本发明的试验试样时分别显出90.5%及26.5%的细胞存活率,与阴性对照组稍有差异,将小于500μg/ml的试验试样用于下述试验。
[0086]
表4细胞存活率试验结果
[0087][0088]
实验例3.在thp-1细胞中的抗炎活性(体外)
[0089]
为了确定本发明提取物的抗炎活性,根据本发明所属技术领域中现有公知的过程进行利用thp-1细胞的下述促炎性细胞因子水平的抑制试验。
[0090]
3-1.测量白细胞介素1β的数值
[0091]
3-1-1.试验过程
[0092]
分别向人单核细胞株(thp-1细胞,韩国细胞株银行,韩国细胞株研究财团,首尔市钟路区101,03080,韩国)加入10μg/ml、20μg/ml、50μg/ml、100μg/ml及500μg/ml的脂多糖(lps)来准备炎症模型。
[0093]
处理脂多糖24小时后,测量采取的细胞上层液中炎症细胞因子白细胞介素1β的数值。
[0094]
并且,在thp-1细胞中分别处理10μg/ml、25μg/ml、50μg/ml以及100μg/ml的试验试样4小时后,向其处理脂多糖来确认试验试样的抗炎效果。
[0095]
处理脂多糖24小时后,使用酶联免疫吸附测定(elisa)读取器(il-1β/il-1f2 duo set elisa,r&d systems)测量促炎性细胞因子白细胞介素1β的数值。
[0096]
3-1-2.试验结果
[0097]
通过表5可知,可以确认实施例中制备的试验试样迅速减少随着脂多糖的剂量的增加而增加的白细胞介素1β的数值。
[0098]
因此,确认实施例中制备的本发明的组合物提取物对炎症具有强力的抑制效果。
[0099]
表5白细胞介素1β抑制效果(促炎性细胞因子)
[0100][0101]
3-2.测量白细胞介素10(il-10)的数值
[0102]
3-2-1.试验过程
[0103]
分别向人单核细胞株(thp-1细胞,韩国细胞株银行,韩国细胞株研究财团,首尔市钟路区101,03080,韩国)加入10μg/ml、20μg/ml、50μg/ml、100μg/ml及500μg/ml的脂多糖来准备炎症模型。
[0104]
处理脂多糖24小时后,测量采取的细胞上清液中的炎症细胞因子白细胞介素10的数值。
[0105]
并且,在thp-1细胞中分别处理10μg/ml、25μg/ml、50μg/ml以及100μg/ml的试验试样4小时后,向其处理脂多糖来确认试验试样的抗炎效果。
[0106]
处理脂多糖24小时后,使用酶联免疫吸附测定读取器(il-10,duo set elisa,r&d systems)测量促炎性细胞因子白细胞介素10的数值。
[0107]
3-2-2.试验结果
[0108]
通过表6可知,可以确认实施例中制备的试验试样迅速减少随着脂多糖的剂量的增加而增加的白细胞介素10的数值。
[0109]
因此,确认实施例中制备的本发明的组合物提取物对炎症具有强力的抑制效果。
[0110]
表6白细胞介素10抑制效果(促炎性细胞因子)
[0111][0112]
实验例4.自噬活性抑制效果(体外)
[0113]
为了检测本发明提取物在免疫细胞中给炎症因子的表达带来的效果,根据本发明
所属技术领域中现有公知的过程进行利用thp-1细胞的下述试验。
[0114]
4-1.试验过程
[0115]
为了确认抗炎活性与自噬途径的相互关系,分别向人单核细胞株(thp-1细胞,韩国细胞株银行,韩国细胞株研究财团,首尔市钟路区101,03080,韩国)加入10μg/ml、20μg/ml、50μg/ml、100μg/ml及500μg/ml的脂多糖来准备炎症模型。
[0116]
分别处理10μg/ml、25μg/ml、50μg/ml及100μg/ml的试验试样后,加入20μg/ml及100μg/ml的脂多糖,分别使用抗-beclin 1抗体(abcam公司)及lc3b-抗体(cell signaling公司)通过免疫印迹试验确认beclin 1和lc3b(自噬标记物)的表达。
[0117]
使用chemidoc tmmpimagingsystem(biorad)扫描上述生成的感光膜来定量beclin 1及lc3b的表达水平。
[0118]
4-2.试验结果
[0119]
通过表7可知,确认到处理试验试样和100μg/ml脂多糖的试验组对lc3b-1和beclin1的表达表现出剂量依赖性的增加效果。
[0120]
表7 belin 1及lc3b表达效果
[0121][0122][0123]
实验例5.关节炎抑制效果(生物体内)
[0124]
为了确认本发明提取物的关节炎抑制效果,根据本发明所属技术领域中现有公知的过程进行利用关节炎-诱导大鼠动物模型的动物模型实验。
[0125]
5-1.试验过程
[0126]
为了评估试验试样对钠碘乙酸(mia)诱导的骨关节炎大鼠模型的功效,在位于韩国首尔st.首尔圣母医院天主教大学的“关节免疫疾病t2b中心(院长朴成焕)”中进行如下试验。
[0127]
5-1-1.试验方案
[0128]
5-1-1-1.动物模型试验过程
[0129]
(1)试验动物:在保持12小时间隔的昼夜(08:00~20:00)明暗期、温度21
±
2℃、相对湿度50
±
20%的情况下,在控制的很好的饲育室中,在聚砜饲养笼(每笼2只-3只)中饲育大鼠(雄性wistar大鼠,中央研究所动物,首尔,韩国,7周龄-8周龄,200g-250g)来使用周围环境。
[0130]
试验方法:在实验当天(第0天),将3mg/kg的钠碘乙酸(mia,i2512,sigma公司,普
尔(poole),英国(uk))溶于注射生理盐水来使浓度达到60mg/ml。分组后,将实验动物放入麻醉室,使用乙醚进行麻醉。为了诱导骨关节炎,使用1cc的注射器(26.5gage)通过髌韧带向右侧膝关节注射50μl的钠碘乙酸(3mg/身体)。
[0131]
(2)试验试样:实施例中制备的本发明的提取物
[0132]
(3)阳性对照组:(韩林制药,首尔,韩国)
[0133]
(4)治疗途径:诱发骨关节炎后第3天口服给药(1天1次)
[0134]
(5)试验组的设定:参照表8
[0135]
5-1-1-2.给药途径及试验期间
[0136]
(1)给药途径
[0137]
使用钠碘乙酸诱导骨关节炎后,使用溶剂(生理盐水)根据处方的剂量使试验试样均质化,以1天1次的方式口服给药1ml的试验试样来制备试验试样处理组(g2、g3)。
[0138]
阴性对照组(g1)只处理溶剂,根据试验物质给药,根据试验日程口服给药一天一次。
[0139]
阳性对照组(g4)根据剂量在溶剂中均质化来一天一次口服给药。
[0140]
(2)试验期间
[0141]
以每组6只的方式将24只大鼠分为4组,在规定的时间口服给与试验试样和阳性对照组物质。
[0142]
表8试验组的设定
[0143][0144]
5-2.评估内容
[0145]
5-2-1.测量疼痛阈值
[0146]
5-2-1-1.测量疼痛阈值的方法
[0147]
根据用于测量疼痛阈值的von freestyle评估方法,使用在规定期间逐渐增加施加在雄性wistar大鼠足部的力的装置动态足底麻醉机(ugo basile公司,37400,科梅里奥(comerio),意大利(italy))来测量疼痛阈值(痛觉耐受潜伏期,阈值)((kwon jy et al.,sci rep.2018sep 14;8(1):13832)。
[0148]
在测量之前,将动物放入具有铁网长凳的亚克力箱中适应5分钟。
[0149]
利用金属丝在个动物的右侧后足中央在10秒钟内缓慢施加0g~50g的力,测量动物出现撤足行为时的重量来测量疼痛阈值。
[0150]
为了防止组织损伤,将中断阈值(cut-off threshold)设定为50g,将时间设定在通过钠碘乙酸治疗诱发骨关节炎的前一天,计算出正常对照组(g1)、试验试样(g2、g3)及阳
性对照组(g4)的基准线值,在基准线(第3天)获得相同的值。
[0151]
在处理试验试样之前(第3天)测量相同的值,向大鼠的关节腔给药试验试样,一周一次在特定的时间测量值。
[0152]
疼痛阈值的试验结果根据如下条件计算:(a)撤足的潜伏期(秒钟);以及(b)撤足的阈值(g)。
[0153]
5-2-1-2.疼痛阈值测量试验结果
[0154]
疼痛检测的试验结果,确认到与处理溶剂的阴性对照组相比,处理100mg/kg及150mg/kg的试验试样的试验试样组示出剂量依赖的疼痛抑制效果(表9-表10)
[0155]
表9各组根据经过时间的疼痛抑制效果(撤足潜伏期,秒钟)
[0156][0157]
表10各组根据强制体重(撤足阈值,g)的疼痛抑制效果
[0158]
[0159][0160]
5-2-2.有关测量体重负荷的试验
[0161]
5-2-2-1.测量体重负荷
[0162]
为了测量正常后腿(足)与诱导关节炎的后腿(右)之间的体重变化(或者体重分布),根据文献(kwon jy et al.,sci rep.2018sep 14;8(1):13832)记载的方法利用试验装置(600型,iitc公司,美国(usa)测量两条后腿的负荷。
[0163]
由于荷重可根据动物的足的位置的不同而不同,因此将试验动物正确设置在支架上,以双足对称的方式固定。由特定人员进行固定以最大限度地减少可能的误差。
[0164]
当在支架上正确设置动物时,启动机器测量各组的体重负荷,每次测量持续5秒,共测量2次。
[0165]
将各测试结果的平均值以各足的体重负荷(g)的方式数字化。
[0166]
在钠碘乙酸治疗之前获得基准值(第0天)后,在特定时间,每周测量2次正常对照组(g1)、试验试样(g2,g3)及阳性对照组(g4)体重负荷来在测量试验试样3天确定体重负荷(第3天)。
[0167]
根据下述数学式1将测量体重负荷的试验结果变化为重量负荷率。
[0168]
数学式1
[0169]
重量比(%)={右后腿重量/(右后腿重量+左后腿重量)}
×
100
[0170]
5-2-2-2.体重负荷试验结果
[0171]
通过表11可知,确认到与阴性对照组相比,试验试样组强力地提高双腿的平均能力。
[0172]
表11对体重负荷的效果
[0173][0174]
5-2-3.骨损伤抑制试验(组织学分析,微型电子计算机断层扫描(ct))
[0175]
为了确定本发明提取物的骨损伤抑制效果,根据文献记载的公知的方法进行组织学分析(kwon jy et al.,sci.rep.2018sep 14;8(1):13832)。
[0176]
5-2-3-1.抑制由骨关节炎引起的骨损伤抑制效果(组织学分析,微型电子计算机断层扫描)
[0177]
为了确认本发明提取物对由骨关节炎引起的骨损伤的抑制效果,向安乐死的大鼠(雄性wistar大鼠)的右侧膝关节给药钠碘乙酸和试验试样后使用福尔马林溶液固定。
[0178]
利用x射线光源(70kv,142ua,ai0.5mm过滤器,旋转阶段0.6
°
)和动物扫描仪(skyscan1272体外微型电子计算机断层扫描,bruker微型电子计算机断层扫描,比利时)测量由3只大鼠组成的组中的膝关节的股骨部分周围的骨损伤程度,以像素解析度15μm的方式进行包括断层形成(nrecon)、断层旋转(data viewer)、数据分析(ctan)、立体渲染(ctvox)及表面渲染(ctan+ctvol)在内的微型电子计算机断层扫描拍摄。
[0179]
5-2-3-2.组织学分析试验结果(微型电子计算机断层扫描)
[0180]
通过表12可知,通过微型电子计算机断层扫描拍摄的试验结果确认到,与阴性对照组(溶剂组)相比,使用100mg/kg及150mg/kg的试验试样处理的试验试样组显出骨损伤抑制效果。
[0181]
表12
[0182][0183]
5-2-4.骨损伤抑制试验(组织病理学分析)
[0184]
为了确定本发明提取物的骨损伤抑制效果,根据文献中公知的方法进行下述组织病理学分析(kwon jy et al.,sci rep.2018sep.14;8(1):13832)。
[0185]
5-2-3-1.抑制由骨关节炎引起的骨损伤抑制效果(组织病理学分析)
[0186]
为了确认本发明提取物对由骨关节炎引起的骨损伤的抑制效果,向安乐死的大鼠(雄性wistar大鼠)的右侧膝关节给药钠碘乙酸和试验试样后,将大鼠的右侧膝关节切片并使用番红o(safranin o)进行染色。
[0187]
拍摄膝关节的股骨部分(
×
200倍)来进行组织病理学分析。根据整体mankin分数(bulstra sk et al.,1989,clin orthop relat res:294-302.)及oarsi分数(pritzker k.p.h.et al.,2006,osteoarthritis cartilage 14)等公知的方法计算机评估试验结果。
[0188]
5-2-3-2.组织病理学分析试验结果
[0189]
通过表13(整体mankin分数方法)及表14(oarsi分数)可知,通过组织病理学分析结果确认到,与阴性对照组(溶剂组)相比,使用100mg/kg及150mg/kg的试验试样处理的试验试样组对骨损伤显出强力的抑制效果。
[0190]
表13骨损伤抑制效果(整体mankin分数方法)
[0191][0192]
表14骨损伤抑制效果(oarsi分数方法)
[0193][0194]
统计分析
[0195]
所有数据以平均值和标准差(平均值
±
sd)的方式示出,在graphpad prism 5.0版本(美国)分析程序中使用二元(two-way)anova、一元(one-way)anova通过统计学显著性检验来判断为具有显著性(p《0.05)。
[0196]
本发明的方法
[0197]
以下,说明赋形剂的配制及种类,但本发明不限定于此。代表性的制备例如下。
[0198]
制备注射液
[0199]
win-1001x提取物:100mg
[0200]
焦亚硫酸钠:3.0mg
[0201]
对羟基苯甲酸甲酯:0.8mg
[0202]
对羟基苯甲酸丙酯:0.1mg
[0203]
注射用蒸馏水:适量
[0204]
溶解有效成分后并将ph调节为7.5后,将所有成分装入2ml的安碚瓶后根据现有的注射剂制备方法灭菌来制备注射剂。
[0205]
制备散剂
[0206]
win-1002x提取物:500mg
[0207]
玉米淀粉:100mg
[0208]
乳糖:100mg
[0209]
滑石粉:10mg
[0210]
将上述成分混合后装入密封的袋中来制备散剂制剂。
[0211]
制备片剂
[0212]
win-1003x提取物:200mg
[0213]
玉米淀粉:100mg
[0214]
乳糖:100mg
[0215]
硬脂酸镁:适量
[0216]
将上述成分混合后片剂化来制备片剂制剂。
[0217]
制备胶囊
[0218]
win-1004x提取物:100mg
[0219]
玉米淀粉:50mg
[0220]
乳糖:50mg
[0221]
滑石粉:2mg
[0222]
硬脂酸镁:适量
[0223]
将上述成分混合后通过通常的制备明胶胶囊的方法填充明胶胶囊来制备胶囊制剂。
[0224]
制备液体
[0225]
win-1005x提取物:1000mg
[0226]
糖:20g
[0227]
多糖类:20g
[0228]
柠檬香料:20g
[0229]
溶解有效成分后装入1000ml的安碚瓶中通过现有的液体制备方法灭菌来制备粗液。
[0230]
制备保健食品
[0231]
win-1001x提取物:1000mg
[0232]
维生素混合物:适量
[0233]
乙酸维生素a:70g
[0234]
维生素e:1.0mg
[0235]
维生素b
10
:13mg
[0236]
维生素b2:0.15mg
[0237]
维生素b6:0.5mg
[0238]
维生素b1:20.2g
[0239]
维生素c:10mg
[0240]
生物素:10g
[0241]
烟酰胺:1.7mg
[0242]
叶酸:50g
[0243]
泛酸钙:0.5mg
[0244]
矿物质混合物:适量
[0245]
硫酸亚铁:1.75mg
[0246]
氧化锌:0.82mg
[0247]
碳酸镁:25.3mg
[0248]
磷酸钾:15mg
[0249]
磷酸钙:55mg
[0250]
柠檬酸钾:90mg
[0251]
碳酸钙:100mg
[0252]
氯化镁:24.8mg
[0253]
上述提及的微生物和矿物质混合物可以通过多种方法而多种多样。但这样的变形不应视为脱离本发明的精神及范围。
[0254]
准备保健饮料
[0255]
win-1002x提取物:1000mg
[0256]
柠檬酸:1000mg
[0257]
低聚糖:100g
[0258]
杏浓度:2g
[0259]
牛磺酸:1g
[0260]
蒸馏水:900ml
[0261]
溶解有效成分并混合,在85℃的温度下搅拌1小时后,过滤后将所有成分装入1000ml的安碚瓶中通过现有的保健饮料制备方法灭菌来制备保健饮料制剂。
[0262]
因此,显而易见的是,说明的本发明可以变形为多种方式。这些变形不能视为脱离本发明的精神及范围,对于本发明所属技术领域的普通人员来说显而易见的是,所有变形都包括在随附的发明要求保护范围内。
[0263]
产业上的可应用性
[0264]
如在本发明中说明的,本发明提供包含龙眼肉、藁本及远志的组合生药组合物的口服用药物组合物,本发明人通过与炎症相关的细胞因子(酸性核糖体磷蛋白亚基、胸腺基质淋巴细胞生成素、粒细胞-巨噬细胞集落刺激因子以及白细胞介素1β)的表达抑制试验(实验例1)、有关ht-29及thp-1细胞的细胞存活试验(体外,实验例2)、thp-1细胞中的抗炎活性(体外,实验例3)、自噬活性抑制效果(体外,实验例4)等体外实验以及利用关节炎-诱导的大鼠动物模型的关节炎抑制效果(生物体内,实验例5)等生物体内实验炎症本发明的组合组合物具有强力的抗炎/抗风湿效果,因此,确认到本发明的组合提取物以口服用药物组合的形式非常有用地用在炎症疾病及关节炎疾病的改善或治疗中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1